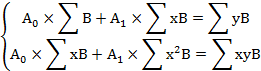Приказ
Федерального агентства по рыболовству от 4 августа 2009 г. № 695
"Об утверждении Методических указаний по разработке нормативов качества
воды водных объектов рыбохозяйственного значения, в том числе нормативов
предельно допустимых концентраций вредных веществ в водах водных объектов
рыбохозяйственного значения"
В соответствии с постановлением Правительства Российской Федерации от 28 июня 2008 г. № 484 "О порядке разработки и утверждения нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения" (Собрание законодательства Российской Федерации, 2008, № 27, ст. 3286) приказываю:
1. Утвердить по согласованию с Министерством природных ресурсов и экологии Российской Федерации прилагаемые Методические указания по разработке нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения.
2. Управлению науки и образования (В.А. Беляев) совместно с Управлением правового обеспечения (Е.С. Кац) направить настоящий приказ на государственную регистрацию в Минюст России в десятидневный срок со дня его подписания.
3. Контроль за выполнением настоящего приказа возложить на заместителя руководителя Росрыболовства В.В. Рисованого.
|
Руководитель |
А.А. Крайний |
Зарегистрировано в Минюсте РФ 3 сентября 2009 г.
Регистрационный № 14702
Приложение
Методические указания
по разработке нормативов качества воды водных объектов
рыбохозяйственного значения, в том числе нормативов предельно
допустимых концентраций вредных веществ в водах водных
объектов рыбохозяйственного значения
(утв.
приказом Федерального агентства по рыболовству
от 4 августа 2009 г. № 695)
1. Назначение и область применения
1.1. Методические указания по разработке нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ (далее - ПДК веществ) в водах водных объектов рыбохозяйственного значения предназначены для научно-исследовательских и иных организаций, выполняющих работы по разработке нормативов качества воды и ПДК веществ.
1.2. Нормативы качества воды водных объектов рыбохозяйственного значения характеризуют пригодность ее для обитания водных биологических ресурсов (далее - водные биоресурсы) и обеспечивают безопасность продукции из них.
1.3. Показатели состава и свойств естественного природного состояния воды поверхностных водных объектов определяются физическими, химическими, биологическими и иными показателями, соответствующими природным условиям, не затронутым антропогенным воздействием.
1.4. Утратил силу. Изм. от 22.12.2016 г.
1.5. Методические указания по разработке ПДК веществ в водах водных объектов рыбохозяйственного значения предназначены для разработки нормативов, при которых сохраняется биологическое разнообразие и среда обитания водных биоресурсов, обеспечивается добыча (вылов) водных биоресурсов.
1.6. Методические указания по разработке ПДК веществ устанавливают требования к проведению научно-исследовательских работ по определению и обоснованию указанных нормативов в воде водных объектов рыбохозяйственного значения, в том числе в морях или их отдельных частях.
1.7. ПДК веществ устанавливаются по результатам (приложения 1 - 4 к настоящим Методическим указаниям) токсикологических исследований вещества на тест-объектах разных трофических звеньев водного объекта (микроорганизмы, фито-, зоопланктон, фитобентос, зообентос, рыбы на разных стадиях развития); оценки влияния веществ на санитарные показатели водной среды; определения стабильности вещества в воде; способности его к накоплению в гидробионтах; исследования генотоксичности; обобщения полученных данных; определения наиболее слабого звена, для которого максимальная недействующая концентрация вещества оказалась наименьшей (приложение 5 к данным Методическим указаниям). Наиболее слабое звено называют также лимитирующим звеном, максимальная недействующая концентрация которого определяет ПДК вещества. Исследуемый показатель (численность, биомасса, физиологический или гематологический показатель и проч.), для которого определена максимальная недействующая концентрация, называется лимитирующим показателем.
1.8. Методические указания разработаны в соответствии с Федеральным законом от 20 декабря 2004 г. № 166-ФЗ "О рыболовстве и сохранении водных биологических ресурсов"; статьями 20, 21 Федерального закона от 10 января 2002 г. № 7-ФЗ "Об охране окружающей среды" (Собрание законодательства Российской Федерации, 2002, № 2, ст. 133; 2004, № 35, ст. 3607; 2005, № 1, ст. 25; № 19, ст. 1752; 2006, № 1, ст. 10; № 52, ст. 5498; 2007, № 7, ст. 834; № 27, ст. 3213).
2. Общие положения разработки нормативов вещества
2.1. Предельно допустимая концентрация (ПДК) вещества в воде характеризует его максимально допустимую концентрацию (или его метаболитов) в воде, при которой в водном объекте не возникают последствия, снижающие его рыбохозяйственную ценность (в ближайшее время и в перспективе) или затрудняющие его рыбохозяйственное использование при постоянстве этой концентрации в воде водного объекта.
2.2. Ориентировочно безопасный уровень воздействия (ОБУВ) вещества, который оценивается на основе экспресс-экспериментальных и расчетных методов токсичности, характеризует полученное значение до установления ПДК вещества в воде водного объекта рыбохозяйственного значения, как временный норматив, применяемый не более двух лет.
2.3. При установлении ПДК или ОБУВ вещества по критерию действия вещества на показатели водной среды или на показатели жизнедеятельности различных трофических уровней водных организмов устанавливается лимитирующий показатель вредности (ЛПВ) вещества.
Если вещество оказывает прямое токсическое действие на водные организмы, тогда ЛПВ характеризуется как токсикологический и обозначается "токс".
При нарушении экологических условий при попадании вещества в воду водного объекта рыбохозяйственного значения: изменение трофности водных объектов; гидрохимических показателей (содержание в воде кислорода, азота, фосфора, изменение рН), нарушение самоочищения воды (биохимическое потребление кислорода (БПК5), численность сапрофитной микрофлоры рыб), - ЛПВ характеризуется как санитарный и обозначается "сан".
При действии вещества как на водные организмы, так и на санитарные показатели водного объекта ЛПВ характеризуется как санитарно-токсикологический и обозначается "сан-токс".
Если вещество при попадании в воду образовывает пленку или пену на поверхности воды, появляются посторонние привкусы и запах воды, наблюдается выпадение осадка, появление опалесценции, мутности и взвешенных веществ, тогда ЛПВ характеризуется как органолептический и обозначается "орг". При этом указывается расшифровка характера изменения органолептических свойств воды (зап. - запах; мутн. - мутность; окр. - окраска; пен. - пена; пл. - пленка; привк. - привкус; оп. - опалесценция и т.д.).
При ухудшении органолептических показателей качества рыбы (появление неприятных и посторонних привкусов и запахов) ЛПВ характеризуется как рыбохозяйственный, обозначается "рыб-хоз".
2.4. Для каждого вещества может быть установлена только одна величина норматива (за исключением случаев, предусмотренных условиями нормирования вещества с учетом природных особенностей водных объектов - регионального норматива данного вещества). При утверждении уточненного норматива прежний норматив, установленный ранее для этого вещества, отменяется.
2.5. Если исследуемое вещество является структурным аналогом другого вещества, для которого норматив утвержден ранее (т.е. имеет идентичную химическую структуру, но иное товарное название), допускается токсикологическое исследование вещества-аналога лишь по лимитирующим звеньям без выполнения исследований по полной схеме. При совпадении результатов токсикологических исследований с ранее установленным нормативом исследуемое вещество включается в Перечень нормативов в качестве синонима к веществу с ранее установленным нормативом. Если токсичность исследуемого вещества оказывается иной, то необходимы его подробный химический анализ и разработка норматива по полной схеме (постановление Правительства Российской Федерации от 12 ноября 1992 г. № 869 "О государственной регистрации потенциально опасных химических и биологических веществ" (Собрание актов Президента и Правительства Российской Федерации, 1992, № 20, ст. 1669); Инструкция Минприроды России от 25 мая 1993 г. № 37-2-7/435, Госкомсанэпиднадзора от 25 мая 1993 г. № 01-19/22-22 "О порядке государственной регистрации потенциально опасных химических и биологических веществ" (зарегистрирована в Минюсте России 18 июня 1993 г., регистрационный № 279).
2.6. При разработке нормативов как для индивидуальных веществ, так и для смесей, используются одинаковые методические приемы.
2.7. Под индивидуальным веществом понимается вещество, полученное в результате конкретного химического процесса. Индивидуальное вещество может содержать примеси побочных продуктов химической реакции и продуктов его трансформации за счет биологических и физико-химических факторов окружающей среды.
2.8. Совокупность индивидуальных веществ, смешанных до поступления в окружающую среду, характеризует полученную совокупность веществ как смесевое вещество или смесь.
2.9. При разработке ПДК смесевого вещества состав исследуемого препарата должен быть полностью расшифрован заказчиком. В то же время условия конфиденциальности должны быть обеспечены исполнителем работ на время проведения исследований.
2.10. К образцам веществ, представляемых на токсикологические исследования, должны прилагаться официальные документы, характеризующие их строение, химический состав и подтверждающие соответствие образцов заявленным к исследованию веществам.
2.11. Если исследуемое вещество не растворяется в воде или растворимость его незначительна, изучение влияния этого вещества на тест-объекты проводится при внесении в воду навесок вещества для создания различных его концентраций (п. 2 приложения 1 к настоящим Методическим указаниям).
2.12. При отсутствии информации в литературных источниках (справочная литература, статьи, паспорт вещества, информационная карта Российского регистра потенциально опасного химического и биологического вещества) по срокам 50 % и 95 % распада нормируемого вещества в водной среде проводят оценку стабильности вещества химико-аналитическим или биологическим методом исследования. Далее классифицируют вещество по степени его стабильности в водной среде (п. 3 приложения 1 к настоящим Методическим указаниям) и определяют частоту смены опытных растворов в хронических экспериментах.
Стабильность не исследуется для веществ, у которых гибель 50 % организмов концентрация средняя летальная (ЛК50) за 96 ч отмечается при 1000 и более мг/л (природные минералы типа графита, силикатного стекла, природной глины и т.д.).
2.13. Оценка мутагенного и канцерогенного действия веществ проводится в том случае, если имеются научные сведения или есть подозрение на образование метаболитов, обладающих генотоксичностью.
2.14. Нормативы ПДК разрабатываются для веществ, используемых в производственной и иной деятельности, связанной с неизбежным сбросом или риском их поступления в водную среду (при транспортировке, погрузочно-разгрузочных операциях и т.д.), при применении на территории водосборной площади. Разработка нормативов осуществляется по запросу заказчиков.
Не требуется разработка ПДК вещества для химически инертных и биологически неактивных веществ (природные минералы типа графита, силикатного стекла и др.), используемых промышленностью, если данные вещества не содержат токсичных примесей, растворимых в воде.
К биологически неактивным веществам относятся те вещества, у которых величина ЛК50 за 96 ч составляет 1000 и более мг/л. Исследования проводят сами разработчики на стандартных зоопланктонных организмах, если нет информации в литературных источниках.
Содержание водорастворимых примесей в веществах оценивается в химической лаборатории, аккредитованной в области аналитического контроля.
2.15. Уровень физиологической активности лабораторных культур и выборок тестобъектов периодически контролируется по эффекту на них эталонного (стандартного) токсиканта, для чего определяется ЛК50 (ЭК50) - концентрация 50 % гибели или изменение какого-либо параметра жизнедеятельности организма для этого токсиканта за 24 - 96 ч. В качестве эталонного токсиканта рекомендуется бихромат калия. Если реакция тест-объекта не соответствует определенному диапазону полулетальных концентраций, тогда с данным тест-объектом эксперименты не проводят.
2.16. При наличии утвержденной величины ПДК вещества для пресноводных водных объектов возможно (при разработке ПДК этого вещества для морских водных объектов) использование морских тест-объектов для полученных лимитирующих экологических звеньев.
Для веществ, на которые разработаны нормативы ПДК или ОБУВ, должны быть разработаны и аттестованы методики количественного химического анализа (КХА) этих веществ в воде, сведения об аттестованных методиках (методах) измерений передаются в Федеральный информационный фонд по обеспечению единства измерений проводящими аттестацию юридическими лицами и индивидуальными предпринимателями (статья 5 Федерального закона от 26 июня 2008 г. № 102-ФЗ "Об обеспечении единства измерений" (Собрание законодательства Российской Федерации, 2008, № 26, ст. 3021).
3. Общие условия разработки ПДК веществ различного назначения
3.1. Методика определения ПДК вещества предусматривает проведение хронических токсикологических исследований на организмах - представителях основных экологических групп водного сообщества. В процессе экспериментальных оценок токсичности в обязательном порядке должны быть проведены исследования хотя бы на одном представителе каждой из экологических групп.
3.2. Для каждого тест-организма установлен круг тест-параметров (или тест-функций), которые являются основными и контролируются в обязательном порядке. Иные тестпараметры являются вспомогательными и могут быть использованы для уточнения пределов действующих концентраций или для установления особенностей действия исследуемого вещества.
3.3. При выборе концентраций для исследования каждого вещества следует исходить из правил:
а) для острых и предварительных исследований выбираются 5 - 6 концентраций, различающихся между собой в 10 раз;
б) при проведении острых опытов определяется ЛК50 для рыб за 96 ч, для одноклеточных водорослей - за 72 ч, для зоопланктона - за 48 ч. Результаты заносятся в аннотационную карту;
в) для более точного определения пороговой концентрации в хронических опытах концентрации могут различаться в 2 - 5 раз.
3.4. При разработке ПДК для веществ, которые характерны для природных вод (в том числе в геохимических провинциях с пониженным или повышенным их содержанием), необходимо определять концентрацию веществ в воде, которая используется для ведения культур и для опытов. В этом случае норматив определяется (рассчитывается) с учетом природного фонового содержания этого вещества в воде.
При определении нормативов для других веществ достаточно убедиться в том, что они отсутствуют в воде, используемой в лабораторной практике.
3.5. Основные правила анализа полученных данных, с целью выведения предельно допустимой концентрации вещества:
а) результаты, полученные при действии исследуемого вещества (опыт), сопоставляются с результатами наблюдений при отсутствии данного вещества в среде (контроль). Особенности вариантов опыта и контроля указаны при описании конкретных методов;
б) в эксперименте концентрации считаются действующими, если вызывают не только токсический, но и эвтрофирующий эффект (увеличение численности, биомассы организмов или других регистрируемых параметров);
в) достоверность отличия данных в опыте от данных в контроле оценивается статистическими методами (приложение 4 к данным Методическим указаниям);
г) на основании статистической обработки данных устанавливаются максимальные допустимые концентрации для каждого тест-параметра используемого тест-организма, а также для тест-организма в целом;
д) максимальная недействующая концентрация для наиболее чувствительного тест-объекта принимается как ПДК исследуемого вещества. Звено, к которому относится данный тест-объект, определяется как лимитирующее при разработке ПДК вещества.
3.6. В связи с высокой токсичностью органических пестицидов при разработке для них ПДК обязательными являются исследования на рыбах материальной и функциональной кумуляции вещества (накопления вещества в органах и тканях и накопление токсического эффекта организмом).
Для расчета максимально недействующей концентрации исследуемого вещества используется пороговая концентрация (Кlim) - минимальная концентрация вещества, вызывающая достоверные изменения в организме, с учетом суммы коэффициентов запаса по стабильности вещества (Кс) в воде, по степени накопления в организмах (КзН), по степени накопления токсического эффекта (КзКУМ):
ПДК = Кlim/(Кс + КзН + КзКУМ).
Для пестицидов, обладающих малой или умеренной стабильностью, ПДК определяется по максимальной недействующей концентрации для лимитирующего звена.
3.7. При исследовании вещества оценивается характер загрязнения водной среды в опыте: опалесценция, пленка, изменение цвета раствора, истинность или коллоидность раствора, для мелкодисперсных взвесей - скорость оседания частиц, органолептическое определение запаха и вкуса (привкуса) воды и пр.
3.8. При величине ПДК вещества 0,00001 мг/л и менее или при лимитирующем показателе "генотоксичность" вещество не рекомендуется для внедрения в производство и в практику.
3.9. Все результаты специализированных научно-исследовательских работ по разработке нормативов обобщаются в Аннотационной карте (приложение 5 к данным Методическим указаниям).
4. Общие условия разработки ОБУВ веществ различного назначения
4.1. Временные нормативы разрабатываются для веществ различного назначения.
4.2. ОБУВ химических и биологических веществ для пресноводных водных объектов и морей, включая внутренние морские воды Российской Федерации, устанавливается в краткосрочных экспериментах сроком не менее 7 суток в соответствии с п. 8 приложения 2 и п. 9 приложения 3 к настоящим Методическим указаниям.
При определении ОБУВ пестицидов используется расчетный метод оценки (п. 8.1 приложения 2).
4.3. Если исследуемое вещество или его химические аналоги по литературным источникам (справочная литература, статьи, паспорт вещества, информационная карта государственной регистрации потенциально опасного химического и биологического вещества) или по показаниям, выявленным в процессе исследований, обладают потенциальной мутагенной активностью, необходимо проведение оценки такой активности.
4.4. В случае, если мутагенное действие оказывается лимитирующим показателем при разработке ОБУВ вещества, данный норматив не утверждается, проводится разработка ПДК вещества в полном объеме в соответствии с настоящими Методическими указаниями.
4.5. Рекомендуемые величины ОБУВ веществ после их утверждения в установленном порядке используются на протяжении срока их действия, после чего исключаются из действующих списков нормативов качества воды.
5. Требования к разработке ПДК и ОБУВ биологических препаратов
5.1. Нормативы для бактериальных и других биологических препаратов разрабатываются в соответствии с общими требованиями настоящих Методических указаний по методикам (п. 4.2 приложения 1; приложение 2; приложение 3 к данным Методическим указаниям) с частичными модификациями (указанными ниже в пп. 5.2. - 5.9).
5.2. При исследовании воздействия биологического препарата на гидрохимический режим не являются обязательными определение , оценка стабильности токсичности препарата, но должна контролироваться концентрация кислорода в среде.
5.3. Должны быть проведены исследования динамики прироста исследуемого штамма в чистой воде (отстоянной водопроводной), в воде водного объекта с природной сапрофитной микрофлорой, и выявлены антагонистические отношения между исследуемым штаммом и природной сапрофитной микрофлорой.
5.4. Если в состав препарата входят два или несколько бактериальных штаммов, исследуется динамика прироста каждого штамма в отдельности.
5.5. При исследованиях штаммов, предназначенных для разложения других веществ, проводится также оценка токсичности продуктов разложения.
5.6. Оценка мутагенного действия биологических препаратов должна проводиться всегда, поскольку модифицированные штаммы бактерий сами способны вызвать мутации.
5.7. Исследования с бактериальными препаратами, предназначенными для деструкции нефти и других субстанций, проводят одновременно в двух вариантах - для оценки биологического действия бактериального препарата в отдельности и в сочетании его с веществом, подвергающимся деструкции.
5.8. Нормативы на биологические препараты приводятся в двойном виде - в мг/л и в виде титра клеток на 1 мл (кл/мл). Если препарат представляет собой смесь штаммов, то указывается общий титр клеток с указанием процентного соотношения штаммов в препарате.
5.9. ОБУВ вещества на биологические препараты определяют по сокращенной схеме: исследуют влияние препарата на органолептические показатели воды, на кислородный режим, динамику сапрофитной микрофлоры, динамику прироста численности исследуемого штамма; оценивают вещество в хронических исследованиях на зоопланктоне и на ранних стадиях онтогенеза рыб (икра, личинки), а также на тест-объектах (из числа включенных в настоящие Методические указания), близких по систематическому положению к организмам, против которых направлены препараты.
6. Требования к разработке ПДК и ОБУВ для смесей постоянного состава
6.1. Под смесями постоянного состава (например, пестициды, некоторые красители, компоненты буровых растворов и проч.) подразумеваются рецептуры (препараты), полученные в результате намеренного смешивания двух или более индивидуальных веществ (п. 2.8 раздела 2 "Общие положения разработки нормативов вещества"), имеющих (наряду с индивидуальными веществами) соответствующие номера ГОСТа или ТУ, которые определяют свойства этих смесевых веществ (количество и качество примесей). Такие смесевые вещества (препараты) могут иметь свое фирменное (или товарное) название.
6.2. При определении норматива на смесь постоянного состава эта смесь исследуется как единое вещество в соответствии с общими правилами. При этом устанавливается суммарная величина норматива с указанием лимитирующего признака вредности и класса опасности.
6.3. Величина норматива смеси используется для экспертной оценки экологического риска поступления такого вещества в водные объекты, а также для различных технологических расчетов сброса смеси в водные объекты и при оценке ущерба водным биоресурсам.
6.4. Все индивидуальные вещества, входящие в состав смеси, с точки зрения влияния на водную биоту рассматриваются как потенциально опасные или токсичные. На каждый компонент смеси также должна быть установлена величина норматива.
6.5. Нормативы для смеси рассматриваются только в том случае, если установлены нормативы для ее отдельных компонентов. Не нормируются только те компоненты, для которых доказано отсутствие биологической активности на основании представляемых в отчете литературных или собственных экспериментальных данных (например, по оценке величины ЛК50, п. 4 приложения 2, п. 5.1 приложения 3).
Если хотя бы для одного биологически активного компонента смеси в качестве норматива определен ОБУВ, для всей смеси в качестве норматива может быть установлен только ОБУВ.
6.6. ПДК смеси может определяться по сокращенной схеме:
а) если все компоненты смеси изучены и их нормативы установлены по одному и тому же лимитирующему признаку вредности, а наиболее чувствительное звено совпадает для всех компонентов, достаточно оценить эффект смеси на это звено и убедиться в отсутствии действия большего, чем аддитивное;
б) если лимитирующие признаки вредности и лимитирующие звенья для компонентов смеси различаются, необходимо исследовать влияние смеси на те показатели, которые были определяющими при обосновании ПДК для каждого из компонентов.
6.7. На смесевое вещество устанавливается ПДК, при которой не превышаются нормативы ни на один из его компонентов.
Если какой-либо компонент в составе смеси превышает свой норматив при попадании этой смеси в воду, экспериментально установленная величина норматива на смесь корректируется так, чтобы этот компонент в составе смеси не превышал свой норматив.
Пример: В состав некоторой смеси входит компонент: "а", составляющий 10 %; "b", составляющий 1 % от общей массы смеси, и наполнитель, составляющий 89 %. Ранее установленные ПДК для этих компонентов равны, соответственно, 0,01; 0,0001 и 0,25 мг/л. Результаты исследований выявляют в качестве допустимой для всей смеси концентрацию 0,1 мг/л. При такой концентрации смеси в среде концентрация компонента "а" составит 10 % от 0,1 мг/л, т.е. 0,01 мг/л (нет превышения ПДК), компонента "b" - 1 % от 0,1 мг/л, т.е. 0,001 мг/л (ПДК для этого компонента превышено в 10 раз), а наполнителя - 89 % от 0,1 мг/л, т.е. 0,089 мг/л (превышения ПДК нет). Следовательно, для соблюдения нормативов отдельных компонентов смеси ПДК для всей смеси необходимо уменьшить в 10 раз, чтобы не превышался норматив для компонента "b". Поэтому ПДК для смеси не должна превышать 0,01 мг/л.
6.8. Аналитический контроль за содержанием смеси в водной среде ведется по индикаторному компоненту или компонентам смеси. Выбор индикаторного компонента проводится на основе следующих принципов: выявление наиболее токсичного и опасного компонента; выбор наиболее стабильного компонента; определение относительной массы (процентного содержания) компонентов смеси; наличие метода определения вещества в воде или его обязательная разработка.
7. Разработка нормативов ПДК веществ с учетом природных особенностей водных объектов
7.1. С целью сохранения сформировавшихся под влиянием природных факторов состава воды водных объектов разрабатываются региональные нормативы:
а) для химических элементов, встречающихся в природных водах отдельных геохимических провинций в относительно повышенных или пониженных концентрациях;
б) для техногенных аналогов природных веществ, сброс которых требует учета типа принимающего водного объекта и особенностей водосборной территории. К ним относятся вещества, способные повышать сапробность и эвтрофность вод (легко утилизируемые органические соединения и соединения биогенных элементов), изменять солевой режим (минерализацию) и рН природных вод, изменять концентрацию взвешенных (минеральных) веществ природного происхождения, а также соединения и комплексы гуминовых кислот.
7.2. Территории, для которых предполагается разработка нормативов с учетом природных особенностей водных объектов (геохимические провинции, районы с водными объектами определенной трофности, жесткости воды и т.д.), должны быть охарактеризованы:
а) по содержанию нормируемого ингредиента в поверхностных водах с целью доказательства повышенного или пониженного его содержания по сравнению со средним его уровнем для поверхностных вод;
б) по интегральным показателям качества воды на водосборе, в том числе по содержанию основных компонентов воды и физико-химическим факторам (водные объекты определенной жесткости, трофности и т.д.).
7.2.1. Критерием аномальности естественного уровня (кларка) содержания нормируемого вещества может служить достоверное отличие его (при уровне Р < 0,5) от среднего содержания в поверхностных водах в меженный период года 95 % обеспеченности.
7.2.2. Границы территории, для которой предлагается величина норматива, должны быть определены возможно более точно.
7.3. Нормативы определяются с использованием тест-объектов, предусмотренных настоящими Методическими указаниями, культивируемых на местной воде (водные растения, зоопланктонные организмы, бентосные организмы, аквариумные виды рыб).
7.4. В случае необходимости в общий список тест-объектов могут быть добавлены чувствительные местные виды. Обоснованность данных, полученных на эндемичных видах для определения величины норматива в целом, рассматривается и подтверждается при рекомендации норматива к утверждению.
7.5. При антропогенном загрязнении вод территории (с учетом природных особенностей водных объектов) можно использовать токсикологические данные, полученные на воде и тест-объектах для водного объекта-аналога из незагрязненного района.
7.6. Если на вещество существует утвержденный общероссийский норматив, то региональный норматив может быть установлен по сокращенной схеме. Для этого на местной воде должны быть проведены исследования на тест-объектах, оказавшихся лимитирующими при установлении общероссийского норматива (с учетом требований пп. 7.3 - 7.5).
7.7. Величины нормативов ПДК веществ или ОБУВ веществ с учетом природных особенностей водных объектов, указываются всегда в абсолютном значении, а не в допустимом превышении концентрации над фоновым уровнем.
Приложение 1
к Методическим указаниям по
разработке нормативов
качества воды водных объектов
рыбохозяйственного значения, в
том числе нормативов
предельно допустимых
концентраций вредных веществ
в водах водных объектов
рыбохозяйственного значения
Общие требования к разработке ПДК веществ в водах водных объектов рыбохозяйственного значения
1. Оценка класса опасности вещества
1.1. В основу классификации опасности вещества положены показатели, характеризующие различную степень опасности для водных биоресурсов химических соединений, загрязняющих воду водных объектов рыбохозяйственного значения, в зависимости от токсичности, степени накопления в организмах, способности вызывать отдаленные эффекты, лимитирующего показателя вредности.
1.2. Класс опасности вещества учитывает:
а) степень опасности вещества в связи с его появлением в водных экосистемах;
б) приоритет при контроле загрязнения среды;
в) обоснование рекомендаций о замене хозяйственного использования высоко опасных веществ на менее опасные.
1.3. Выявляются четыре класса опасности веществ, загрязняющих воду водных объектов рыбохозяйственного значения и токсичных для водных биоресурсов. При отнесении вещества к определенному классу опасности учитывается токсичность вещества по величине его ПДК, стабильность этого вещества в водном объекте и его кумулятивные свойства. Отнесение проводится по любому из указанных признаков, одному или нескольким.
1-й класс - чрезвычайно опасные вещества, лимитируемые по токсикологическому и рыбохозяйственному ЛПВ. Степень вредного воздействия на водные биоресурсы очень высокая.
Выделяется по следующим признакам:
а) ПДК вещества ниже 0,00001 мг/л;
б) материальная кумуляция высокая или сверхвысокая (коэффициент накопления КН больше 200);
в) стабильность вещества или токсичных продуктов его распада превышает 180 суток при 20 °С (τ95).
К данному классу относятся вещества исключительно антропогенного происхождения (ксенобиотики, не имеющие аналогов в природе).
2-й класс - высоко опасные вещества, лимитируемые по токсикологическому и рыбохозяйственному ЛПВ. Степень вредного воздействия на водные биоресурсы высокая.
Выделяется по следующим признакам:
а) ПДК вещества от 0,0001 до 0,00001 мг/л (вещества, для которых принимается значение ПДК - "отсутствие", относятся ко второму классу);
б) материальная кумуляция умеренная (КН от 51 до 200). В отдельных случаях слабовыраженная (КН 1,1 - 50);
в) стабильность вещества или токсичных продуктов его распада - 60 - 180 суток при 20 °С (τ95). Для северных районов, где преобладают низкие температуры воды, эти вещества лимитируются по классу 1.
К данному классу относятся вещества исключительно антропогенного происхождения (ксенобиотики, не имеющие аналогов в природе).
3-й класс - опасные вещества, лимитируемые в основном по токсикологическому, иногда по рыбохозяйственному (в том числе и органолептическому) ЛПВ. Степень вредного воздействия на водные биоресурсы средняя.
Выделяется по следующим признакам:
а) ПДК вещества от 0,01 до 0,0001 мг/л;
б) материальная кумуляция слабовыраженная (КН 1,1 - 50). Вещества не вызывают видимых патологических явлений и легко выводятся из организма;
в) стабильность вещества или токсичных продуктов его распада менее 60 суток при 20 °С (τ95).
К данному классу относятся как ксенобиотики, так и вещества природного происхождения (например, сероводород, сульфиды и др.).
4-й класс - умеренно опасные вещества, лимитируемые по любому ЛПВ. Степень вредного воздействия на водные биоресурсы низкая.
Выделяются по следующим признакам:
а) ПДК вещества выше 0,01 мг/л;
б) не обладают кумулятивными свойствами;
в) стабильность меньше 10 суток при 20 °С (τ95).
К данному классу относятся частично ксенобиотики (обычно биологически относительно инертные), но в значительной степени - вещества природного происхождения.
В 4-м классе выделяются вещества (4-й класс "экологический" - 4э), действие которых проявляется в изменении экологических условий в водном объекте. Это вещества, входящие в состав органики сапробного типа, компоненты минерализации природных вод, биогенные вещества и др.
1.4 Если из трех показателей, характеризующих класс опасности вещества (ПДК, стабильность, степень кумуляции), два последних являются более жесткими величинами при температуре 20 ± 5 °С, чем указано для класса опасности вещества в соответствии со значением его ПДК, тогда класс опасности данного вещества ужесточается на единицу.
1.5 В связи с тем что Россия расположена в различных климатических зонах, учитывается температурный фактор прогрева водных объектов в течение года, и при необходимости класс опасности при высокой среднегодовой температуре воды (20 °С) можно снижать, а при более низкой температуре воды (10 °С и ниже) повышать, так как в этом случае деградация вещества соответственно увеличивается или замедляется в 3 - 10 раз.
2. Требования к приготовлению растворов исследуемых веществ при разработке ПДК
2.1 Все вещества (индивидуальные и смесевые) независимо от их растворимости в воде (полной, частичной или отсутствие таковой) должны исследоваться по единой схеме.
2.2 Исходные (маточные) растворы высокой концентрации готовят на дистиллированной воде при установлении норматива вещества для пресноводных водных объектов.
2.3 Исследуемые концентрации веществ (растворимых в воде) готовят из исходного раствора на той воде, которая используется для содержания тест-объекта.
Для стабильных веществ возможно приготовление исходных растворов высокой концентрации с последующим приготовлением рабочих растворов на протяжении срока, за который в исходном растворе концентрация вещества практически не меняется.
Для нестабильных веществ, когда концентрация их быстро изменяется в растворе, исходные растворы готовят регулярно к каждой очередной замене растворов в экспериментальных сосудах.
2.4 Нерастворимые в воде вещества (минеральные и органические порошки; маслянистые вещества; масла, жиры и их формы; смолистые, вязкие и клейкие органические вещества), как правило, являются высокостабильными.
Подход к созданию опытных концентраций должен быть всегда индивидуальным в отношении каждого из вышеуказанных веществ - в зависимости от его формы, химической природы и физико-химических свойств.
2.5 При исследовании нерастворимых в воде веществ важнейшими показателями будут органолептические - образование на поверхности воды мелких масляных шариков, пленки, снижение прозрачности и др., а также гидрохимические и микробиологические показатели (сапрофитная микрофлора, БПК5).
2.6 Маслянистые вещества. Исходный раствор готовится в момент постановки опыта. Навеска таких веществ помещается в определенное количество воды и размешивается на магнитной мешалке при 1000 об/мин не менее 1 - 2 ч. Образуется раствор определенной мутности. Полученную мелкодисперсную водно-маслянную эмульсию используют для приготовления опытных концентраций заданного диапазона. При этом каждую опытную емкость перемешивают в течение 1 минуты для образования гомогенной среды, затем вносят тест-объекты.
2.7 Смолистые, вязкие и клейкие вещества. Исходный раствор вещества готовят аналогично тому, как указано в п. 2.6 настоящих Методических указаний. Навеска вещества должна постепенно, путем подогрева или без него, механическим путем дробиться и растираться до образования максимально однородной массы с водой. Ультразвуковые мешалки полностью гомогенизируют вещество в воде. Полученный исходный раствор используют для приготовления опытных концентраций как указано в п. 2.6 настоящих Методических указаний.
2.8 Твердые вещества (порошки, гранулы и т.п.), не смешиваемые с водой (всплываемые на поверхность или осаждающиеся на дно).
Навеску вещества необходимо тщательно растереть в ступке с небольшим количеством воды до образования однородной гомогенной массы. Продолжая растирание, в ступку постепенно добавлять все большее количество воды. Полученную водную суспензию вещества переливают из ступки в мерную колбу, ступку несколько раз ополаскивают чистой водой и переливают в ту же мерную колбу. Затем в мерную колбу доливают чистую воду до метки, закрывают пробкой, встряхивают. Полученную суспензию используют для приготовления опытных концентраций заданного диапазона. При этом в толще воды опытного сосуда большая часть препарата равномерно распределяется. Часть вещества оседает на дно или всплывает на поверхность. Периодически растворы перемешивают, встряхивая опытный сосуд.
2.9 Газообразные вещества (на примере метана, опыт в закрытых сосудах). Исходный раствор газа для проведения опытов с фитопланктоном готовят на дистиллированной воде, далее разбавляют его до нужной концентрации культуральной средой. Для проведения опытов на других трофических звеньях исходный раствор газа готовят на контрольной воде (отстойной водопроводной, аквариумной; природной или искусственной морской), разбавляя далее этой же водой до нужной концентрации.
Для приготовления исходных растворов газа используют пластиковые бутыли емкостью 5 л, заливая их соответствующей контрольной или дистиллированной водой. Бутыль закрывают пробкой с двумя отверстиями, в которые вставлены трубки длиной почти до дна сосуда. Трубки имеют зажимы. Газ с помощью редуктора из газового баллона подается в сосуд через одну из трубок. При этом 1/3 воды вытесняется из бутыли через вторую трубку, над водой оказывается только данный газ. Растворение газа в воде происходит при барбатации и встряхивании бутыли. Аналитическое определение концентрации исходного раствора газа проводят газохроматографическим методом.
2.10. Искусственную морскую воду (соленость 34) готовят внесением соответствующих солей в дистиллированную воду, аэрируют ее 10 - 12 ч, отстаивают 2 недели ("старение воды"). Используют искусственную морскую воду при токсикологических исследованиях только после ее "старения". До нужной солености ее разбавляют дистиллированной водой.
рН морской природной или искусственной воды имеет щелочную реакцию, характеризуется величинами в границах 7,8 - 9.
3. Определение требований к оценке стабильности вещества и стабильности его токсичности в водной среде
3.1. Химико-аналитическое исследование
3.1.1. Время, в течение которого вещество разрушается или улетучивается из раствора, характеризует его стабильность (устойчивость). На основании аналитических определений вычисляют время убывания концентрации вещества в растворе на 95 %. Химико-аналитические определения проводят в лабораториях, аккредитованных Федеральным агентством по техническому регулированию и метрологии (статья 5, Федерального закона от 26 июня 2008 № 102-ФЗ "Об обеспечении единства измерений" (Собрание законодательства Российской Федерации, 2008, № 26, ст. 3021).
Метод химического анализа вещества в воде предоставляется заказчиком разработки норматива ПДК вещества.
До начала проведения исследований проводят подготовку необходимого оборудования, приборов, посуды и реактивов согласно методу анализа.
Для исследований используют 8 стеклянных емкостей объемом не менее 20 дм3. Число емкостей соответствует определенному дню исследований.
Емкости наполняют отстоянной природной профильтрованной водой пресноводного водного объекта (природной или искусственной морской водой соленостью 20 - 34). В воде, заливаемой в емкости для приготовления растворов исследуемого вещества, определяют его фоновое содержание.
Для создания в емкостях исходной исследуемой концентрации вещества хорошо растворимого в воде, соответствующие его навески вносят непосредственно в подготовленные емкости с водой и тщательно перемешивают. При наличии фонового содержания исследуемого вещества в воде, в опытном растворе учитывается суммарная концентрация вещества при внесении в воду. При выборе концентраций для оценки стабильности меньшая из них должна быть как минимум на 2 порядка выше чувствительности метода.
Для исследования веществ не растворимых или мало растворимых в воде используют емкости объемом менее 20 дм3 (малые емкости) с целью проведения полной экстракции вещества в сосуде (учитывая осаждение вещества на стенках сосуда).
Число емкостей соответствует определенному дню исследований.
Опыты проводят в емкостях с открытой поверхностью, при температуре 20 ± 2 °С и при естественном освещении. Исследованию подвергаются в двух повторностях три концентрации вещества, меньшая из которых на порядок выше чувствительности метода.
Перед каждым отбором проб для анализа, воду в емкостях тщательно перемешивают. Отбор проб и анализ их проводят после приготовления раствора (исходная концентрация - 0 сутки), затем на 1, 3, 5, 7, 10, 15, 20 и 30 сутки от начала эксперимента. Усредненные результаты анализа по повторностям за каждые сутки исследования вносят в таблицу 3.1.1, где представлены данные для одной концентрации.
Таблица 3.1.1
Динамика распада вещества в воде в течение 30 суток, мг/л
|
Исходная концентрация, мг/л |
Экспозиция раствора вещества, сутки |
|||||||
|
1 |
3 |
5 |
7 |
10 |
15 |
20 |
30 |
|
|
Концентрация вещества в растворе, мг/л |
||||||||
|
10 |
10 |
10 |
9 |
8 |
7 |
6 |
5 |
4 |
3.1.2. Расчет стабильности проводят методом регрессии с учетом того, что убывание концентрации вещества в растворах обычно имеет экспоненциальный характер и описывается уравнением:
lgC = lgC0 - t/τ,
где С - концентрация вещества в момент определения (мг/л);
С0 - исходная концентрация (мг/л);
t - время (сутки);
τ - константа скорости убывания вещества в растворе (сутки).
Принимаем lgC = y; lgC0 = а ; t = х; -1/τ = b , получаем уравнение у = а + х - b;
"а" и "b" вычисляем методом наименьших квадратов по уравнениям:
![]()
![]()
где n - число определений во времени.
На основании расчетов определяют время 95 %-го распада вещества в воде. По времени 95 %-го распада вещества в водной среде классифицируют его стабильность и определяют коэффициент запаса (Таблица 3.1.2).
Этот же показатель может быть определен и графически. С этой целью строят график убывания концентрации вещества. На осях откладывают время и логарифм концентрации. Из точки на прямой, соответствующей логарифму 5 % вещества от исходного уровня, опускают перпендикуляр. Точка пересечения его с осью времени и определит срок разрушения 95 % вещества.
3.1.3. По степени стабильности в водной среде препарат относят к одной из шести групп, каждой из которых соответствует определенный коэффициент запаса (Кс), приведенный в таблице 3.1.2.
Классификация* веществ по их стабильности в водной среде (τ = 95 %)
|
Группы |
Стабильность |
Время 95 %-го распада, сутки |
Коэффициент запаса (Кc) |
|
1 |
Малая |
до 10 |
1,0 |
|
2 |
Умеренная |
11 - 60 |
2,5 |
|
3 |
Средняя |
61 - 90 |
7,5 |
|
4 |
Высокая |
91 - 180 |
13,5 |
|
5 |
Очень высокая |
181 - 365 |
27,0 |
|
6 |
Сверхвысокая |
более года |
- |
Примечание: * Методические указания по гигиенической оценке новых пестицидов. Киев: ВНИИГИНТОКС, 1969 г.)
3.1.4. Стабильность вещества учитывают: при определении класса опасности вещества (п. 1, Приложения 1 к настоящим Методическим указаниям), коэффициента запаса Кс - при вынесении решения о величине ПДК для пестицидов.
3.2. Токсикологическое исследование
3.2.1 Необходимость исследования стабильности токсичности обусловлена тем, что химико-аналитические определения не позволяют оценить остаточную суммарную токсичность вещества и продуктов его превращения. Оценку остаточной токсичности проводят методами биотестирования. В качестве тест-объекта рекомендуется использовать организмы зоопланктона (например, одновозрастные дафнии - для пресноводных водных объектов). Возможно использование в качестве тест-объекта других представителей трофической цепи, например, рыб (личинки, мальки, сеголетки).
3.2.2 Исследованию подвергается одна концентрация вещества - ЛК50 за 24 ч, которая устанавливается для организма в соответствии с общими требованиями для опытов на острую токсичность вещества (п. 4.1.4 Приложения 2 к настоящим Методическим указаниям).
3.2.3 Раствор вещества данной концентрации (ЛК50 за 24 ч) вносят в восемь емкостей. Каждая емкость соответствует постановке эксперимента в определенный день исследований.
3.2.4 На исходные (0) сутки, далее на 3, на 5, на 7, на 10, на 15, на 20 и на 30 сутки от начала эксперимента в соответствующие емкости вносят по одинаковому количеству тест-объектов (не менее 10 экземпляров). Перед каждым внесением тест-объектов в емкость с раствором, емкость тщательно перемешивают. Через 24 ч после внесения организмов в емкость, учитывают число погибших и удаляют их из емкости.
Опыты проводят в 3-кратной повторности. Каждому опыту соответствует контроль.
3.2.5 Полученные экспериментальные данные по соответствующим суткам исследования усредняют по повторностям и рассчитанные проценты погибших экземпляров тест-объекта вносят в таблицу 3.2.1, где представлены данные по динамике гибели тест-организмов за 30 суток в растворе вещества с ЛК50 за 24 ч, равной 10 мг/л.
Гибель тест-организмов (%) при убывании исходной концентрации вещества (ЛК50) по суткам экспозиции (среднее 3-х повторностей)
|
Концентрация, ЛК50 за 24 часа 10 мг/л |
Сутки исследований |
|||||||
|
0 |
3 |
5 |
7 |
10 |
15 |
20 |
30 |
|
|
Гибель тест-объекта, % |
||||||||
|
50 |
46,6 |
40 |
30 |
16,6 |
3,3 |
0 |
0 |
|
|
Концентрация вещества в соответствии с ее убыванием по суткам, мг/л |
||||||||
|
10 |
9,3 |
8,0 |
6,0 |
3,3 |
0,66 |
0 |
0 |
|
3.2.6 На основании полученных данных по гибели тест-организмов в соответствующей емкости, методом пропорции определяется концентрация вещества для каждой величины процента погибших тест-объектов в эксперименте:
так, 50,0 % погибших организмов соответствуют 10,0 мг/л;
46,6 % - 9,3 мг/л;
40,0 % - 8,0 мг/л;
30,0 % - 6,0 мг/л;
16,6 % - 3,3 мг/л;
3,3 % - 0,66 мг/л.
Полученные значения убывающих концентраций вещества (мг/л) по суткам экспозиции также заносят в таблицу 3.2.1.
В случае распада вещества на 20 и на 30 сутки, количество определений во времени (n) увеличивается с 6 до 7 - 8.
3.2.7 Далее расчет периода 95 % распада вещества в воде определяют в соответствии с п. 3.1.2:
lgC = lgC0 - t/τ,
где
С - концентрация вещества в момент определения (мг/л);
C0 - исходная концентрация (мг/л);
t - время (сутки);
τ - константа скорости убывания вещества в растворе (сут.).
Принимаем lgC = y; lgC0 = а; t = х; -1/τ = b, получают решаемое регрессионное уравнение: у = а + х - b.
Коэффициенты уравнения регрессии "а" и "b" вычисляют методом наименьших квадратов по уравнениям:
получают решаемое
![]()
![]()
где
n - число определении во времени.
3.2.8. Соответствующие данные (расчетные концентрации вещества из таблицы 3.2.1) вносят в таблицу 3.2.2. и далее проводят преобразование экспериментальных результатов для дальнейшего расчета по формулам п. 3.2.7.
Таблица 3.2.2
Данные для расчета распада вещества на 95 %
|
Число определений во времени N |
Сутки исследований t = x |
Концентрация вещества, С мг/л |
Логарифм концентрации, lgC = у |
xlgC (ху) |
x2 |
|
1 |
0 |
10,0 |
1,0000 |
0 |
0 |
|
2 |
3 |
9,3 |
0,9685 |
2,9055 |
9 |
|
3 |
5 |
8,0 |
0,9031 |
4,5155 |
25 |
|
4 |
7 |
6,0 |
0,7782 |
5,4474 |
49 |
|
5 |
10 |
3,3 |
0,5185 |
5,180 |
100 |
|
6 |
15 |
0,66 |
-0,1805 |
-2,7075 |
225 |
|
Значения сумм вышеуказанных показателей (∑), вносимых в формулы расчета показателей а и b |
|||||
|
N |
∑(х) |
|
∑(у) |
∑(ху) |
∑x2 |
|
6 |
40 |
|
4,9878 |
16,3459 |
408 |
3.2.9. Определяют 5 % концентрацию вещества от исходной концентрации (10 мг/л) при его распаде на 95 %.
В рассматриваемом примере концентрация вещества 0,5 мг/л является 5 %-й концентрацией от исходной (10 мг/л) при распаде вещества на 95 %.
Определяют lg0,5 = у (y = lgC = lg0,5 = -0,301).
3.2.10. Определяют по данным табл. 3.2.2. значения коэффициентов регрессии а и b (п. 3.2.7.):
а = 1,6288; b = -0,1196.
Подставляют полученные значения в решаемое регрессионное уравнение (п. 3.2.7): у = а + хb, откуда следует: х = (у - а)/b, где х - время распада вещества на 95 %;
х = (-0,301 - 1,6288) / -0,1196 = 16,1.
При округлении полученного значения х до целого числа, записывают время распада вещества на 95 % за 16 суток.
3.2.11. При наличии данных по химической стабильности вещества в растворе и данных по стабильности токсичности вещества может быть проведено сравнение полученных величин и сделан вывод о токсичности продуктов распада вещества.
4. Оценка влияния вещества на показатели водной среды
Влияние вещества на показатели водной среды характеризуется по органолептическим (запах, цвет, прозрачность, мутность взвесь, осадок), гидрохимическим (кислород, рН, нитриты, нитраты, аммоний) показателям, а также по показателям, характеризующим самоочищение воды (БПК5, численность сапрофитных микроорганизмов).
4.1. Оценка влияния вещества на органолептические показатели воды
Органолептические показатели воды при различных концентрациях вещества характеризуют по изменению запаха и цвета, вязкости, опалесценции. А также по изменению прозрачности, мутности, взвеси, образованию осадка в воде - указанные показатели определяют с помощью цилиндра высотой 40 см, емкостью 1 л, на белом основании с темными полосами, нанесенными крестообразно. Определение производят в хорошо освещенных помещениях, но не на прямом солнечном свету.
Запах воды при различных концентрациях вещества определяют при комнатной температуре непосредственно из колбы с притертой пробкой. Для этого открывают пробку и слегка втягивают носом воздух из колбы у самого ее горлышка и оценивают наличие запаха.
При этом отмечают интенсивность запаха по пятибальной шкале (Таблица 4.1.1).
Характер запаха определяют описательно: хлорный, землистый, болотный, хлорфенольный, запах нефти и нефтепродуктов, навозный, гнилостный и т.д.
Таблица 4.1.1
Шкала определения запаха по его интенсивности
|
Балл |
Интенсивность |
Оценка |
|
0 |
Нет |
Запах не ощущается |
|
1 |
Очень слабый |
Запах, обнаруживаемый большинством наблюдателей |
|
2 |
Слабый |
Запах, обнаруживаемый всеми наблюдателями |
|
3 |
Заметный |
Запах легко ощущаемый |
|
4 |
Отчетливый |
Запах четко ощущаемый |
|
5 |
Очень сильный |
Запах сильный и резкий |
Цвет среды с разными концентрациями вещества сравнивают с цветом контрольной среды, отмечая его интенсивность в каждой концентрации и отмечая концентрацию, при которой цвет среды не отличается от контроля.
Прозрачность. Границей изменения прозрачности считают глубину в сантиметрах, при которой исчезает четкая видимость линий на диске основания цилиндра.
Мутность воды характеризуют описательно: слабая опалесценция, опалесценция, сильная опалесценция, слабая мутность, заметная мутность, сильная мутность.
Осадок характеризуется по его величине - ничтожный, незначительный, заметный, большой. В случае большого осадка указывается толщина слоя осадка в отношении общего объема воды. При качественной характеристике указывают свойства осадка: кристаллический, аморфный, хлопьевидный, илистый, песчаный и т.п., отмечается также цвет осадка - бесцветный, серый, бурый и т.п.
В качестве примера приводится табличная запись отмечаемых изменений органолептических показателей воды при различных концентрациях вещества (карбоксиметилированный крахмал, таблица 4.1.1.а).
Таблица 4.1.1.а
Влияние карбоксиметилированного крахмала на органолептические показатели водной среды
|
Концентрация, мг/л |
Органолептические показатели |
||||
|
Запах |
Цвет |
Прозрачность |
Мутность |
Осадок |
|
|
Вода |
|||||
|
контроль |
естественный |
естественный |
40 см |
отсутствует |
отсутствует |
|
Карбоксиметилированный крахмал (Floplex С115) |
|||||
|
2,0 |
отсутствие |
без изменения |
40 см |
отсутствует |
отсутствует |
|
10,0 |
отсутствие |
- " - |
40 см |
отсутствует |
отсутствует |
|
25,0 |
отсутствие |
- " - |
39 см |
малая суспензия |
отсутствует |
|
50,0 |
отсутствие |
- " - |
39 см |
малая суспензия |
отсутствует |
|
250,0 |
отсутствие |
- " - |
35 см |
средняя суспензия |
видимый |
|
1250,0 |
отсутствие |
- " - |
30 см |
густая суспензия |
выраженный |
4.2. Оценка влияния вещества на процессы самоочищения
4.2.1 Вводные замечания
Нарушение жизнедеятельности бактериального населения под действием химических веществ может привести к изменению качества водной среды и, в конечном итоге, к деградации экосистемы водного объекта. В связи с этим, при установлении ПДК вещества следует определять его влияние на разные группы бактерий-минерализаторов. Для экспериментального исследования предлагается следующая цепочка объектов:
а) сапрофиты, растущие на мясопептонном агаре (МПА) разведенном в 10 раз (МПА:10);
б) нитрификаторы 1-й фазы;
в) нитрификаторы 2-й фазы.
4.2.2 Характеристика тест-объекта
Наибольшей физиологической активностью обладают сапрофиты, первыми начинающие процесс минерализации, разлагая азотсодержащую органику до аммонийного азота. Их сменяют нитрификаторы 1-й фазы, окисляющие аммонийный азот до нитритов, а затем - нитрификаторы 2-й фазы, окисляющие нитриты до нитратов.
Для регистрации состояния бактерий в экспериментах предлагается следующий набор основных показателей:
а) Численность сапрофитов. Если исследуемое вещество легко усваивается бактериями, их численность значительно возрастает, превышая численность в контроле, а если токсично - количество микроорганизмов снижается.
б) Дыхание бактерий. Определяется по БПК5. Этот показатель характеризует физиологическую активность бактерий и не всегда коррелирует с численностью бактерий (в связи с тем, что токсическое действие некоторых ксенобиотиков выражается в увеличении численности бактерий на фоне снижения их физиологической активности).
в) Концентрация растворенного кислорода. Показатель аэробного состояния среды.
г) Аммонийный азот. Продукт метаболизма сапрофитов-аммонификаторов.
д) Азот нитритов. Продукт метаболизма нитрификаторов 1-й фазы.
е) Азот нитратов. Продукт метаболизма нитрификаторов 2-й фазы.
ж) рН среды. Показатель активной реакции среды.
Длительность наблюдения обусловлена сроком полной минерализации азотсодержащей органики в нормальных условиях до стабильной формы азота в виде нитратов. Момент окончания опыта определяют выходом концентрации нитратов в контрольном экспериментальном сосуде на стационарный уровень (плато), что происходит на 25 - 30-е сутки.
4.2.3. Проведение исследований
4.2.3.1. Необходимое оборудование:
термостат-стерилизатор;
термостат с водяной рубашкой для поддержания температуры 20 °С;
автоклав;
фотоэлектроколориметр или спектрофотометр;
потенциометр;
мерные колбы на 50, 100, 200, 250, 500 и 1000 см3;
стеклянные кристаллизаторы на 5 дм3;
кислородные склянки вместимостью около 200 м3;
чашки Петри;
пробирки, бюретки.
4.2.3.2. Предварительный опыт проводят с пятью или шестью концентрациями исследуемого вещества, различающимися на порядок. Исследование проводят в стеклянных кристаллизаторах, наполовину заполненных природной водой из чистого водного объекта, профильтрованной через мельничное сито № 76. Во все сосуды вносят пептон из расчета 3 мг/дм3, который обеспечивает БПК5, не превышающее 5 мгО2/дм3, и соответствующее количество исследуемого вещества. В контрольный сосуд исследуемое вещество не вносят.
В предварительном опыте контролируется только один показатель - численность сапрофитов, растущих на МПА:10. Посевы проводят в трехкратной повторности глубинным методом. Чашки Петри с посевами инкубируют при температуре 20 ± 2 °С в течение двух суток, после чего просчитывают количество выросших колоний. Отбор проб для посевов проводят ежедневно в течение 4 - 5 суток. На основании полученных результатов планируют основной опыт.
При работе с искусственной морской водой - в подготовленную искусственную морскую воду (п. 2.10 Приложения 1) вносят предварительно выращенную на МПА морскую естественную микрофлору из природной морской воды или морского аквариума (из расчета 1 тыс. кл/мл). Выдерживают при комнатной температуре в течение недели (время адаптации) - для размножения бактерий и стабилизации гидрохимических параметров. После этого проводят токсикологический эксперимент.
4.2.3.3. Основной опыт ставят при тех же условиях, что и предварительный опыт. Оценивают действие вещества в пяти концентрациях, из которых максимальной служит та наименьшая концентрация, которая в предварительном опыте снижала численность сапрофитов по сравнению с контролем более чем на 25 %. Другие концентрации различаются не более, чем в 5 раз. Опыт проводят в трех повторностях.
4.2.4. Учет и анализ результатов
В ходе длительного опыта учитывают следующие показатели:
рН - в исходные, на 10, 20 и 30 сутки;
растворенный кислород - в исходные, на 3, 5, 7, 10 и 15 сутки;
численность сапрофитов, растущих на МПА:10, - в исходные, на 1, 3, 5 и 7 сутки;
БПК5 - в исходные, на 1, 3, 5 и 7 сутки;
азот аммонийный - в исходные, на 1, 3, 5, 7, 10 и 15 сутки;
азот нитритов - на 5, 7, 8, 9, 10, 12 и 15 сутки;
азот нитратов - на 7, 9, 10, 12, 15, 20, 25 и 30 сутки.
Химические определения проводят по общепринятым методикам.
Результаты перечисленных определений обрабатывают статистически и оценивают достоверность отклонения опытных величин от контрольных. Допустимыми концентрациями считаются такие, которые не вызывают достоверного отклонения исследуемых показателей от контрольных.
Приложение 2
к Методическим указаниям по
разработке нормативов
качества воды водных объектов
рыбохозяйственного значения, в
том числе нормативов
предельно допустимых
концентраций вредных веществ
в водах водных объектов
рыбохозяйственного значения
1. Установление максимальной допустимой концентрации вещества для одноклеточных водорослей
Планктонные одноклеточные водоросли (фитопланктон), как и высшие водные растения, представляют в водных экосистемах группу организмов-продуцентов.
Из двух видов рекомендуемых одноклеточных водорослей (п. 2, Приложения 2) для исследований может быть выбран один, в зависимости от возможностей и традиций лаборатории. Другие виды водорослей могут быть использованы только в дополнение к обязательным видам.
Для экспериментов используют культуру водорослей в экспоненциальной фазе роста. Большое значение имеет физиологическое состояние культуры, проверяемое по эталонному (стандартному) веществу.
Оценка влияния вещества на одноклеточные водоросли оценивается по показателям
изменения численности клеток водорослей (снижение или увеличение) в опытной среде по сравнению с контролем;
Достоверное снижение численности клеток водорослей в растворе вещества является показателем токсического действия раствора вещества.
Критерием эвтрофирующего эффекта вещества является достоверное увеличение численности клеток водорослей в различных концентрациях вещества. Лимитирующий показатель вредности в данном случае - санитарный.
Наряду с изучением динамики численности водорослей, к регистрируемым показателям в опыте следует относить изменение рН; визуальные наблюдения за состоянием культуры водорослей: изменения в окраске, форме клеток и состоянии суспензии (взвешенное, опускание на дно, всплывание к поверхности, гомогенность или агрегация) по сравнению с контролем.
В качестве экспресс-метода оценки токсичности (эвтрофирования) химического вещества можно использовать приборный метод быстрой или замедленной флуоресценции водорослей (Минрыбхоз СССР введены в действие методические разработки ВНИРО от 18 декабря 1987 г. № 291-ц "Методические рекомендации по экспрессному биотестированию природных и сточных вод с использованием замедленной флуоресценции одноклеточных водорослей". М.: ВНИРО, 1987) Показания изменения флуоресценции водорослей в растворах вещества по отношению к контролю следует относить к основным показателям, характеризующим процессы жизнедеятельности одноклеточных водорослей. Показания быстрой и замедленной флуоресценции относятся только к живым клеткам, отражают интенсивность процесса фотосинтеза водорослей, по калибровочной кривой позволяют определить количество живых клеток в эксперименте.
Кратковременная оценка токсичности раствора вещества - до 24 - 96 ч - позволяет определить наличие острого токсического действия вещества на одноклеточные водоросли, а длительное исследование - до 14 суток - его хроническое токсическое действие.
К дополнительным показателям при исследовании следует относить: оценку биомассы водорослей (полученную расчетным методом), оценку скорости и темпа деления клеток (расчет генераций), содержание фотосинтезирующих пигментов (хлорофилла и каротиноидов), соотношение живых и мертвых клеток водорослей (используя люминисцентный микроскоп или различные витальные красители - цитохимический метод).
1.2. Характеристика тест-объекта
В качестве основных стандартных тест-объектов используются лабораторные альгологически чистые монокультуры одноклеточных зеленых водорослей сценедесмус и хлорелла, относящиеся к родам сценедесмус (Scenedesmus quadricauda (Turp.) Breb., S. acuminatus (Lagerh.) Chod) и хлорелла (Chlorella vulgaris Beyer, Chl. pyrenoidosa Chik). Чаще других в лабораторной практике используют виды S. quadricauda и Chl. vulgaris (сценедесмус квадрикауда и хлорелла вульгарис).
Сценедесмус широко распространен в водных объектах России и имеет относительно крупные удлиненно-овальные клетки с закругленными концами. Размер клеток 7 - 43×2,5 - 16 мкм. Клетки неподвижные, собранные в виде плоских пластинок (ценобии) по 2-, 4-, реже 8, 16 клеток. Размножение автоспорами. Автоспоры в материнской оболочке располагаются пучком, после освобождения разворачиваются в виде пластинки. В условиях культуры вместо ценобиев образуются отдельные клетки.
Хлорелла распространена в водных объектах южных широт (диаметр клеток 4,2 - 10,5 мкм). Клетки одиночные, шаровидные, с тонкой оболочкой, без слизи. Хроматофор чашевидный, с пиреноидом. Размножение автоспорами, образующимися по 4 - 8, реже 16 и освобождающимися через разрыв материнской оболочки. Диаметр клеток 4,2 - 10,5 мкм.
После пересева культур на новую среду экспоненциальная фаза роста наступает на 4 сутки.
Численность клеток за 3 суток увеличивается не менее чем в 3 раза.
1.3. Условия лабораторного содержания одноклеточных водорослей
Используется обычное лабораторное оборудование, приборы, посуда и реактивы, в том числе:
фильтровальная установка любого типа;
фильтры мембранные (размер пор 3,5 мкм, 0,45 мкм);
пипетки автоматические дозаторы объемом 0,1, 0,2 см3;
камера счетная Горяева или Фукс-Розенталя;
предметные и покровные стекла;
климатостат (люминостат) любого типа, оснащенный лампами дневного света 3000 - 6000 лк, обеспечивающий поддержание температуры (20 ± 2) °С;
спиртовка;
рН-метр;
оксиметр любого типа с погрешностью измерения не более 0,5 мг/дм3;
микроскоп биологический, обеспечивающий увеличение в 100 - 200 раз;
стаканы стеклянные лабораторные объемом 100, 500, 1000 см3;
колбы конические емкостью 50, 100, 250 , 1000 см3;
эталонное (стандартное) химическое вещество: калий двухромовокислый (бихромат калия) или стандарт-титр калия двухромовокислого для проверки физиологической чувствительности культуры водорослей;
культуры зеленых одноклеточных водорослей Scenedesmus quadricauda (Turp.) Breb. и Chlorella vulgaris Beyer.
Культивируют водоросли (Таблица 1.3.1.) на среде Прата или на среде Успенского № 1 (Утверждено Минприродой России от 27 апреля 2001 г. "Руководство по определению методов биотестирования токсичности вод, донных отложений, загрязняющих веществ и буровых растворов". М.: РЭФИА, НИА-Природа, 2002)
|
Компоненты среды |
Концентрация в среде для культивирования, г/дм3 |
Концентрация исходных растворов для приготовления среды, г/100 см3 |
||
|
Прата |
Успенского № 1 |
Прата |
Успенского № 1 |
|
|
KNO3 |
0,1 |
0,025 |
10,0 |
2,5 |
|
MgSO4×7H2O |
0,01 |
0,025 |
1,0 |
2,5 |
|
Ca(NO3)2×4H2O |
- |
0,144 |
- |
14,4 |
|
K2HPO4×3H2O |
0,01 |
- |
1,0 |
- |
|
KH2PO4×3Н2O |
- |
0,025 |
- |
2,5 |
|
K2CO3 |
- |
0,0345 |
- |
3,45 |
|
FeCl3×6H2O |
0,001 |
- |
0,1 |
|
Питательные среды Прата и Успенского для культивирования водорослей готовят на дистиллированной воде. Чтобы избежать образования осадка в питательной среде, каждый ее компонент предварительно готовят отдельно в 100 см3 дистиллированной воды (исходный раствор). Исходные растворы хранят в холодильнике при температуре от +2 °С до +4 °С в течение месяца, в случае помутнения производят их замену.
Из исходных растворов каждого вещества (кроме солей железа) по 1 см3 добавляют в колбу объемом 1 дм3, наполовину наполненную дистиллированной водой (добавление в последовательности расположения веществ в таблице 1.3.1). Доливают колбу дистиллированной водой до объема 1 дм3, перемешивают, после чего питательную среду стерилизуют в автоклаве (30 мин при 1 атм.) или кипячением на водяной бане в течение 30 мин. После охлаждения стерилизованной среды в нее добавляют соль железа в количестве 1 см3 на 1 дм3 среды (для среды Прата 1 %-ный раствор FeCl3·6Н2О; для среды Успенского 1 % растворы одного из солей железа FeCl3, Fe2(SO4)3, Fe(NH3)(SO4)2 или цитрат железа).
Приготовленную среду хранят до использования в темном месте при комнатной температуре.
Культивируют водоросли в люминостате в конических колбах объемом 250 - 300 см3 закрытых фольгой или ватно-марлевым тампоном. Освещенность 3000 - 6000 люкс. Соблюдается световой суточный ритм. Культуру водорослей периодически перемешивают, встряхивая 1 - 2 раза в сутки. Температура при культивировании водорослей 20 ± 2 °С.
Повышение температуры до 25 °С и выше усиливает токсическое действие, а понижение ее до 12 - 15 °С задерживает проявление эффекта и снижает действие вещества.
Водоросли рекомендуется один раз в десять дней пересевать. Для этого в чистую простерилизованную колбу объемом 250 см3 со свежей средой (100 - 150 мл) над пламенем спиртовки приливают примерно 15 - 20 см3 верхнего росткового слоя из колбы ранее культивируемых водорослей. При этом получают начальную плотность клеток в колбе для культивирования, примерно 300 тыс. кл/см3. Колбу закрывают ватно-марлевым тампоном или фольгой, перемешивают, записывают на колбе название культуры, дату посева и ставят в люминостат. В течение дня содержимое колбы перемешивают 1 - 2 раза.
Опыты проводят при оптимальной температуре и освещении (п. 1.3. Приложения 2). Используют водоросли в экспоненциальной фазе роста, что соответствует трехсуточной культуре водорослей после пересева. Плотность культуры в колбе в это время достигает примерно 5 млн. кл/см3.
В опыте используют начальную плотность клеток 25 тыс. кл/см3. Для этого нужная плотность клеток в опыте достигается расчетом, исходя из объема тестируемой (контрольной, опытной) воды (например, 100 мл) и численности клеток в культуре в экспоненциальной фазе роста (примерно, млн. кл/см3). В указанном случае в опытную и контрольную воду добавляется по 0,5 см3 трехсуточной культуры водорослей.
Периодически (не реже 1 раза в месяц) необходимо проводить контроль физиологической чувствительности водорослей. Для этого используют стандартное (эталонное) вещество - двухромовокислый калий K2Cr2О7 марки химически чистый ("хч") или стандарт-титр калия двухромовокислого.
Готовят маточный раствор двухромокислого калия концентрацией 1 г/дм3. Далее методом разбавления - серию растворов с концентрациями 0,12; 0,25; 0,5; 1,0; 2,0; 3,0 мг/л. Исследование проводят в течение 48 ч в трех повторностях. По результатам опыта рассчитывают среднюю концентрацию K2Cr2О7, вызывающую уменьшение численности клеток на 50 % за 48 ч (ЛК50 за 48 ч). Если полученное значение ЛК50 находится в интервале 1,3 - 2,5 мг/л, то культура водорослей может быть использована для экспериментов.
Если полученные значения ЛК50 не попадают в указанный интервал, то эксперименты с водорослями не проводят, выясняют причину (условия культивирования, состав культуральной среды и проч.). Иногда культуру водорослей заменяют и проводят эксперименты заново.
При постановке острых и хронических экспериментов в контрольные и опытные колбы емкостью 250 мл наливают по 100 мл (в колбы емкостью 100 мл - по 50 мл) контрольной среды или исследуемой концентрации вещества. Контролем служит культуральная среда, на которой культивируются водоросли (среда Прата или среда Успенского № 1). Концентрации веществ также готовят на соответствующей среде.
В опытные и контрольные колбы пипеткой добавляют по 0,5 см3 (0,25 см3) культуры водорослей в экспоненциальной фазе роста.
Колбы закрывают ватно-марлевыми пробками или фольгой, их содержимое тщательно перемешивают и в каждой колбе определяют исходную численность клеток, которая должна составлять 25 тыс. кл/см3. Колбы помещают в люминостат.
В эксперименте должно быть исследовано не менее 5 концентраций вещества. Повторность трехкратная.
Эксперименты на водорослях проводятся в 2 этапа: предварительный и основной (окончательный).
В предварительном остром эксперименте находят интервал токсичных концентраций. Опыты проводят в широком диапазоне концентраций вещества, которые отличаются в геометрической прогрессии (коэффициент 10). Например, 0,01; 0,1; 1,0; 10,0 мг/л и т.д. Исследуют не менее пяти концентраций в двух повторностях. По результатам эксперимента определяется диапазон концентраций для основного острого и хронического эксперимента.
В основном остром и хроническом эксперименте шаг между концентрациями изменяется в 2 - 5 раз. Исследуют не менее пяти концентраций в трех повторностях.
Подсчет клеток водорослей проводят в остром опыте ежедневно, в хроническом на 1, 2, 3, 4, 7, 10, 14 сутки.
На 14 сутки от начала эксперимента опыт прекращают и устанавливают, оказывают ли исследуемые концентрации вещества хроническое токсическое или эвтрофирующее действие на водоросли.
1.5. Учет и анализ результатов
Основным критерием токсичности действия веществ на тест-объект следует считать изменение численности клеток водорослей, последовательность прохождения ими всех стадий развития и их способности к размножению.
Для подсчета численности клеток используют счетную камеру Горяева или счетную камеру Фукса-Розенталя.
При работе с камерой Горяева - камеру и покровное стекло обезжиривают (промывают спиртом). Затем из колбы наносят пипеткой по капле суспензии водорослей на верхнюю и нижнюю сетки счетной камеры, накрывают камеру покровным стеклом, которое притирают по бокам до появления колец интерференции. Через 1 - 2 мин начинают подсчет водорослей в 5-и больших квадратах камеры, расположенных по диагонали сетки счетной камеры, или в 25 больших квадратах всей камеры при малой плотности водорослей. Под микроскопом просчет из каждой контрольной и опытной колбы проводят не менее трех раз.
По окончании эксперимента рассчитывают численность клеток водорослей в остром и хроническом опытах по сравнению с контролем (в том числе и в процентах).
Рассчитывают численности клеток на 1 см3 среды следующим образом: количество клеток в 25 больших квадратах камеры Горяева умножают на 104, получая количество клеток в 1 см3 суспензии.
Учет численности клеток можно также проводить в камере Фукса-Розенталя объемом 3,2 мл. При высокой численности клеток просчитывают по диагонали 16 квадратов, при малой - считают по всему полю камеры. Количество клеток также выражают в 1 см3. Расчет клеток производят по формуле:
![]()
где М - количество клеток в 1 см3;
m - количество просчитанных клеток (сумма);
n - количество просчитанных маленьких квадратов камеры;
V - объем части камеры, имеющей площадь маленького квадрата.
Результаты исследования учитывают, если численность клеток водорослей в контроле увеличивается за 96 ч не менее чем в 3 раза. При изменении численности клеток в контроле менее чем в 3 раза, результаты опыта считаются недействительными.
Используя приемы статистической обработки, устанавливают достоверность различия (снижение или увеличение) численности клеток между и опытом и контролем.
Численность живых и мертвых клеток определяют с помощью люминесцентной микроскопии. Ранжируя клетки по интенсивности свечения, можно установить время воздействия вещества на водоросли, степень и скорость отмирания.
На практике в основном различают три цвета - жизнеспособные клетки светятся ярким пурпурно-красным светом, отмирающие - различными оттенками тускло-красного или оранжево-красного тона, мертвые - желтовато-салатным. При подсчете клеток водорослей учитываются все три группы - живые, мертвые и отмирающие клетки. В стадии интенсивного роста клеток водорослей в культуре наблюдается минимальное присутствие мертвых клеток.
Помимо люминесцентной микроскопии разделение живых и мертвых клеток может проводиться путем микроскопии в видимой области, с использованием специальных красителей.
Активная реакция среды - изменение рН среды служит интегральным косвенным показателем состояния культуры. Чем выше жизнеспособность водорослей, тем значительнее изменяется на свету реакция среды (подщелачивание) в результате фотосинтетической ассимиляции углекислоты. Измерение рН среды осуществляется с помощью рН-метра, что является обязательным в начале и конце опыта, при хроническом эксперименте - в дни учета биологических показателей.
2. Установление максимальной допустимой концентрации вещества для высших водных растений
Высшие водные (сосудистые) растения являются важным компонентом сообщества организмов-продуцентов водных объектов. Иногда такие растения называют макрофитами из-за их относительно крупных размеров.
Высшие пресноводные растения образуют основную фитомассу водных объектов, являются основным звеном, создающим первичное органическое вещество и выделяющим кислород, служат основным субстратом для размножения водных животных и местом их укрытия от опасности. Важную роль играет это звено в самоочищении водных объектов.
В схеме определения ПДК вещества это звено представлено (на выбор) двумя видами - укореняющейся Elodea canadensis Rich, (элодея), у которой основная часть стебля взвешена в толще воды, и плавающей Lemna minor L. (ряска), у которой в толще воды располагаются только корешки, а основное растение стелется по поверхности.
2.1. Элодея
2.1.1. Характеристика тест-объекта
Элодея (Elodea canadensis Rich.) - представитель погруженных растений, широко распространенный в пресноводных водных объектах умеренной зоны.
Размножается вегетативным путем за счет образования густо облиственных боковых отростков, побегов из подземных частей (корневищ) или из нижних частей летних побегов. Теневынослива. Температурная граница выживаемости лежит в пределах от +5 °С до 41,5 °С.
Для культивирования растения отбирают из естественной популяции условно чистого водного объекта в конце мая - начале июня, когда появляется много молодых, наиболее жизнеспособных растений.
У элодеи отбирают зеленые верхушечные побеги длиной 8 - 10 см без боковых отростков и корней, не имеющие видимых повреждений.
Отобранные растения транспортируют в сосудах с водой, взятой из того же водного объекта.
2.1.2. Условия лабораторного содержания
В лаборатории элодею размещают в большие широкие, но не глубокие емкости (10 - 15 дм3). Растения проходят акклимацию при комнатной температуре в течение 7 - 10 дней, достаточной освещенности (лучше - в люминостатной установке) и при смене воды каждые 2 - 3 суток.
Для работы с растениями необходимо следующее оснащение:
люминостатная установка;
круглые аквариумы на 10 - 15 л;
кристаллизаторы объемом 1 л;
стаканы объемом 0,5 л;
люксметр;
термометр;
линейка;
глазной пинцет, лезвие;
воронка, набор пипеток, стеклянная палочка;
планктонный газ № 68, фильтровальная бумага.
Для проведения экспериментов и культивирования растений используют отстоянную водопроводную воду или воду из незагрязняемого водного объекта. Природную воду процеживают через воронку диаметром 150 мм с планктонной сеткой (газ № 68) для удаления взвеси и мелких организмов, заливают в аквариум с постоянной продувкой воздуха.
Для исследований воду используют через 4 - 5 дней.
Сосуды располагают у окон на дневном рассеянном свету (с южной стороны) или в люминостате при освещенности 1,5 - 2 лк на протяжении 10 - 12 ч и при температуре 22 - 25 °С. Для измерения температуры раствора рядом ставят стакан с водой и термометром.
В воду добавляют среду Успенского № 1 (разведение 1:10), которая способствует быстрому образованию боковых отростков и увеличению биомассы растения и дает возможность круглогодичного содержания растений, пригодных для экспериментов.
Предварительно приготовленные основные растворы держат в холодильнике, затем из них вносят по 0,5 см3 на 1 дм3 дистиллированной воды; рН после стерилизации раствора (равномерным кипячением в течение 0,5 ч) составляет 7,0 - 7,3.
2.1.2.1. Проведение исследований
Для экспериментов используют верхнюю часть побега элодеи длиной 4 см без боковых отростков и корней и по 5 экземпляров помещают в кристаллизаторы с растворами исследуемого вещества и с водой без токсиканта объемом по 1 дм3. Для каждой концентрации и для контроля используют по три таких сосуда. Сосуды размещают в люминостате или у окон на дневном рассеянном свету с досвечиванием лампами дневного света при температуре 17 - 22 °С и освещенности до 2 лк.
До проведения хронического эксперимента следует в предварительном 10-дневном опыте установить диапазон действующих концентраций вещества. Из раствора, вызывающего гибель половины особей (ЛК50) за 10 суток, для проведения хронического опыта готовят не менее 3 - 6 разведений, различающихся между собой на порядок.
Опыты, продолжительностью не менее 30 суток, наиболее удобно проводить в летний период. Смену всех растворов и воды в контроле проводят (в зависимости от стабильности вещества) через 2 - 5 суток.
Состояние выборок учитывают каждые 5 суток.
2.1.2.2. Учет и анализ результатов
Оценку токсичности веществ для элодеи осуществляют по следующим параметрам:
а) состояние растений (изменение окраски, потеря тургора, повреждение точек роста и др.);
б) выживаемость и прирост основного побега;
в) число боковых отростков и их длина;
г) число корней и длина.
Прирост основного побега элодеи определяют, вычитая исходные 4 см. Суммарный прирост растения составляется из суммы прироста основного побега и длины боковых отростков. Прирост выражают в сантиметрах, число боковых отростков и корней - в штуках (экз.).
У элодеи в лабораторных условиях боковые отростки и корни появляются, как правило, на 10 - 20 сутки. Отмечают время их появления. Прирост, число и длину боковых отростков и корней рассчитывают на одно растение.
2.1.3. Ряска малая
2.1.3.1. Характеристика тест-объекта
Ряска малая (Lemna minor L.) - представитель группы растений с плавающими листьями. Тенелюбива, устойчива к низким температурам. Ее распространение ограничено участками водных объектов с рН от 6,2 до 7,5.
Для культивирования растения отбирают из естественной популяции водного объекта в конце мая - начале июня, когда много молодых, наиболее жизнеспособных растений. При отборе ряски выбирают растения с зелеными лопастями и с корнями, не имеющими видимых повреждений.
Отобранные растения транспортируют в сосудах с водой, взятой из того же водного объекта.
2.1.3.2. Условия лабораторного содержания
В лаборатории ряску помещают в кристаллизаторы объемом 1 дм3 с речной или отстоянной водопроводной водой. В течение 7 - 10 дней растения проходят акклимацию при комнатной температуре и при достаточной освещенности (лучше в люминостатной установке), со сменой воды каждые 2 - 3 суток для удаления продуктов метаболизма.
Для работы с растениями необходимо следующее оснащение:
люминостатная установка;
круглые аквариумы на 10 - 15 дм3;
кристаллизаторы объемом 1 дм3;
стаканы объемом 0,5 дм3;
люксметр;
термометр;
линейка;
глазной пинцет, лезвие;
воронка, набор пипеток, стеклянная палочка;
планктонный газ № 68, фильтровальная бумага.
Для проведения экспериментов и культивирования растений используют отстоянную водопроводную воду или воду из незагрязненного водного объекта. Природную воду процеживают через воронку диаметром 150 мм с планктонной сеткой (газ № 68) для удаления взвеси и мелких организмов, заливают в аквариум с постоянной аэрацией воды.
Для исследований воду используют через 4 - 5 дней.
Ряску в количестве 5 растений, имеющих одну сформировавшуюся и одну развивающуюся лопасть и корень с неповрежденным корневым чехликом, и примерно одинаковой длины, помещают в стаканы объемом 0,5 дм3 и размещают в люминостате при температуре 22 - 25 °С и освещенностью 5 лк. Для измерения температуры раствора рядом ставят стакан с водой и термометром.
Для круглогодичного культивирования ряски в целях получения достаточного количества материала рекомендуют выращивать их на среде Гапоненко-Стажецкого при круглосуточном освещении 7 - 8 лк и температуре +25 °С.
Состав среды Гапоненко-Стажецкого:
KNO3 - 0,4 г/л,
KН2РО4 - 0,2 г/л,
MgSO4·7Н2О - 0,3 г/л,
СаСl2·6Н2О - 0,6 г/л,
MnCl2·4Н2О - 0,3 г/л,
Н3ВО3 - 0,5 мг/л,
цитрат железа - 5 мг/л.
Среду автоклавируют при 1,5 атм в течение 20 минут, цитрат железа вносят после стерилизации.
2.1.3.3. Проведение исследований
До постановки хронического эксперимента следует провести предварительный 10-дневный опыт для установления диапазона действующих концентраций вещества. Для каждой концентрации и контрольной выборки отводят по 3 стакана.
Для проведения хронического опыта из концентрации, вызывающей за 10 суток гибель 50 % особей, готовят не менее 3 - 6 разведений, отличающихся на порядок.
Хронические опыты продолжительностью не менее 30 суток наиболее удобно проводить в летний период. Растения по 5 экземпляров рассаживают в стаканы (объем 0,5 дм3), которые размещают в люминостате или на рассеянном свету при температуре 22 - 25 °С и освещенности 3 - 4 лк.
Смену опытных растворов проводят (в зависимости от стабильности вещества) через 2 - 5 суток, одновременно меняя воду и в контроле.
2.1.3.4. Учет и анализ результатов
Состояние растений учитывают каждые 5 суток по выживаемости и изменению ряда биологических показателей.
Отмечают общее состояние растений: изменение окраски, размер лопастей, состояние корней), число растений, лопастей и корней в штуках. Общее число лопастей составляет суммарный прирост ряски.
Измерения длины проводят с помощью линейки.
Все результаты измерений пересчитывают на одно растение.
Учитывают сроки образования новых лопастей и корней, а также новых растений, которые приходятся примерно на 10 - 20-е сутки.
3. Установление максимальной допустимой концентрации вещества для простейших
3.1. Введение
Простейшие, в частности инфузории, составляют до 70 % численности гетеротрофного микропланктона в водных объектах. Многочисленность данной группы организмов, экологическая значимость ее в процессах самоочищения, в продукционных процессах, трофических связях, значение ее как составной части естественной кормовой базы зоопланктона и молоди рыб вызывают необходимость исследовать данную группу в токсикологическом плане. Наблюдения показали, что простейшие в силу своих физиологических особенностей проявляют большую чувствительность к изменению факторов внешней среды. Их короткий цикл развития дает возможность проследить действие отдельных веществ на ряде поколений. Данные организмы (особенно ресничные инфузории) достаточно легко культивировать. Все это делает простейших удобным тест-объектом для токсикологических опытов.
3.2. Характеристика тест-объекта
В токсикологических исследованиях в качестве тест-объектов используется парамеция (Paramecium caudatum Ehrenberg) - свободноживущая широко распространенная ресничная инфузория, предпочитающая альфа-мезосапробные условия. Температурный оптимум лежит в пределах 24 - 28 °С, предпочитает рН, близкую к нейтральной (6,5 - 7,5). Основными регистрируемыми показателями являются выживаемость и скорость размножения.
Выбор парамеции в качестве тест-объекта обусловлен следующими критериями. Благодаря сочетанию в парамеции признаков клетки и организма на ней можно изучить как клеточные, так и организменные формы реакции на токсическое воздействие. Возможность культивирования в широком диапазоне температур позволяет использовать их для экспериментальных работ в любое время года.
Короткий жизненный цикл, быстрота размножения позволяют проследить реакцию на интоксикацию в относительно короткий срок в длинном ряду поколений. Используя принцип клонирования, можно получить большое количество генетически однородного материала.
3.3. Условия лабораторного содержания
Парамеций выделяют из природных водных объектов или берут чистые культуры из коллекций. Из природных водных объектов банкой на 1 дм3 у самого берега зачерпывают воду с илом. В тот же день под бинокуляром просматривают пробу.
Обнаруженных парамеций последовательно переносят в микроаквариумы сначала со смесью: природная среда и культуральная среда в соотношении 2:1, затем увеличивают содержание культуральной среды в микроаквариумах через каждый час и, наконец, помещают в чистую культуральную среду.
Монокультуру простейших культивируют при комнатной температуре 20 ± 2 °С на среде Лозина-Лозинского в чашках Петри при естественном освещении, предохраняя от воздействия прямых солнечных лучей или в люминостате.
Используется лабораторное оборудование, приборы, посуда и реактивы, в том числе:
реактивы для приготовления среды Лозина-Лозинского;
вода дистиллированная;
бумага фильтровальная;
колбы на 1000 см3;
градуированные мерные пипетки на 10, 5, 1, 0,1 см3;
пипетки для пересадки простейших (Пастеровские пипетки с укороченным концом);
мерные колбы на 100 см3;
мерные пробирки на 10 см3;
чашки Петри;
микроаквариумы (блок камер из оргстекла);
бинокуляр МБС-9 или МБС-10;
рН-метр;
двухромовокислый калий K2Cr2О7 марки "хч" или стандарт-титр калия двухромокислого;
культура простейших (Paramecium caudatum Ehrenberg 1838);
сухие пекарские дрожжи;
Состав минеральной среды Лозина-Лозинского для культивирования P. caudatum:
в 1 дм3 дистиллированной воды растворяют:
NaCl - 0,1 г;
KCl - 0,01 г;
СаСl2 - 0,01 г;
MgCl2 - 0,01 г;
NaHCO3 - 0,02 г.
В качестве корма используют хорошо высушенные и измельченные пекарские дрожжи, которые легко хранить в закрытой посуде. Вносят их в чашки Петри в очень небольшом количестве на кончике скальпеля, или делают суспензию дрожжей и стерильной пипеткой производят подкормку парамеций из расчета 2 - 3 капли на чашку Петри. Можно в качестве корма использовать (на чашку Петри) частицу дробленного зерна риса.
Два раза в неделю рекомендуется просматривать состояние культуры в чашках Петри. Через две недели культуру пересаживают, т.е. 100 - 300 особей пипеткой переносят в чашку Петри с чистой средой, куда добавляют один из названных видов корма.
Не реже 1 раза в месяц проводят оценку физиологической чувствительности организмов. Для этого используют эталонное (стандартное) вещество - двухромовокислый калий K2Cr2О7 марки "хч" или стандарт-титр калия двухромокислого. Готовят маточный раствор двухромокислого калия концентрацией 1 г/дм3. Далее методом разбавления готовят серию растворов с концентрациями 100,0; 150,0; 200,0; 250,0 и 300,0 мг/дм3. Исследование проводят в течение 24 ч. По результатам эксперимента рассчитывают летальную концентрацию K2Cr2О7, вызывающую гибель простейших на 50 % (ЛК50 за 24 ч). Если полученные значения ЛК50 находятся в интервале 170 - 220,0 мг/дм3, то культура может быть использована для проведения экспериментов.
Если полученные значения ЛК50 не попадают в интервал 170 - 220 мг/дм3 эксперименты с простейшими не проводят, выясняют причину этого, эксперимент повторяют.
3.4. Проведение исследований
Перед постановкой опытов культуру простейших необходимо вывести в экспоненциальную фазу развития, что достигается пересевом культуры за трое суток до постановки опытов в чашку Петри с добавлением корма.
Эксперименты можно проводить как в чашках Петри объемом 25 см3, так и в камерах с рабочим объемом 4 см3. Плотность посадки в чашках Петри (с рабочим объемом 10 мл) 10 организмов, в камерах с рабочим объемом 4 мл - 5 организмов. Повторность -двух или трехкратная.
Для предварительных и окончательных экспериментов удобно использовать камеры из органического стекла с рабочим объемом 4 см3. Блок камер состоит из двух склеенных между собой пластин размером 20 - 21×7 - 8 см. В верхней пластине толщиной около 1 см просверливают отверстия диаметром 3 см. Нижняя пластина толщиной около 0,5 см служит дном. В блоке 12 камер (лунок), которые расположены в два ряда по шесть в каждом. В каждую лунку вносят по 5 парамеций. Пять рядов используют для различных концентраций вещества, а шестой - для контроля. Повторность при этом двухкратная (два ряда лунок в блоке). Сверху микроаквариум закрывают стеклянной пластинкой соответствующего размера, что препятствует испарению раствора.
В качестве показателей токсического действия целесообразно использовать выживаемость и темп деления простейших.
В первом случае в камерах из органического стекла (объем 4 см3) определяют концентрации вещества, вызывающие гибель (LC16, LC50, LC100) или любое повреждающее действие (ЕC16, ЕC50, ЕC100) подопытных организмов за определенный срок. Длительность опыта определяется токсичностью среды и составляет обычно от нескольких часов до 5 суток. Контролем служит культуральная среда. Наблюдения проводят под бинокуляром каждые сутки.
Эксперименты на простейших проводят в два этапа (предварительный и окончательный). В предварительном эксперименте находят интервал токсических концентраций. Опыты ставят в широком диапазоне концентраций вещества, причем предыдущую концентрацию последовательно увеличивают в 10 раз (0,1; 1,0; 10,0 и т.д.). В окончательном эксперименте, установив диапазон действия вещества, разбивают найденный интервал на пять равных концентраций и устанавливают ЛК50.
Темп деления простейших определяют в микроаквариумах (планшет с ячейками (лунки диаметром 1 см, глубина 0,5 см). Планшет с микроаквариумами представляет собой стеклянный или изготовленный из оргстекла квадратный или прямоугольный брусок толщиной 1 см с пятью рядами полированных лунок. В каждом ряду, соответственно, 5 или 10 лунок. Микроаквариумы накрывают стеклянной пластинкой, предохраняя испарение среды из лунок.
Лунки в каждом ряду (5 - 10 лунок) заполняются раствором вещества определенной концентрации. В каждую лунку микроаквариума помещают по одному организму. Ежесуточно в течение нескольких суток (3 - 5 суток) подсчитывают количество организмов в каждой лунке каждого ряда, оставляя, после подсчета организмов, в лунке исходное количество организмов (1 экземпляр), удаляя лишние организмы. Или можно по одному организму переносить в соответствующую лунку с теми же концентрациями вещества аналогичного планшета с микроаквариумами.
3.5. Учет и анализ результатов
В качестве показателя действия токсикантов на тест-объект используют показатель выживаемости инфузорий за определенный срок наблюдения или нарушение темпа деления клеток инфузорий, которое выражается в изменении прироста численности клеток в проценте от контроля. Прирост численности организмов оценивают по формуле:
N = Nt - N0,
где Nt - численность организмов в конце опыта (или последующие сутки подсчета), a N0 - численность организмов в начале опыта (или предыдущие сутки подсчета). Результаты обрабатывают методами статистики.
4. Установление максимальной допустимой концентрации вещества для зоопланктонных ракообразных
Ракообразные включены в схему по определению ПДК вещества в качестве типичного представителя звена зоопланктона и важнейшего кормового объекта.
Метод с использованием ветвистоусых ракообразных в качестве тест-объектов является одним из наиболее широко применяемых в практике водной токсикологии у нас в стране и за рубежом. Наиболее часто используются виды дафний, цериодафний, моин (Daphnia magna, D. longispina, D. carinata, Ceriodaphnia affinis, Moina macrocopa).
По экологическим и токсикологическим характеристикам дафния карината (D. carinata) близка к дафнии магна (D. magna), но легче переходит от партеногенетического типа размножения к бисексуальному и обратно. Этот вид может быть рекомендован для использования в южных районах страны с высокой среднегодовой температурой, так как имеет довольно высокий температурный оптимум - 28 - 31 °С. Вид дафния лонгиспина (D. longispina) к ксенобиотикам имеет приблизительно такую же токсикорезистентность, как и предыдущие виды, но менее вынослив к осолонению водных объектов и загрязнению гуминовыми кислотами. Кроме того, D. longispina - олигосапробный вид, тогда как D. magna и D. carinata - типичные бетамезосапробы. Не рекомендуется для экспериментов вид D. pulex из-за его полиморфности и вариабельности токсикорезистентности.
В настоящее время наиболее часто используются D. magna - стандартный биотест для токсикологических исследований в ряде стран, а также С. affinis, цикл развития которой в два раза короче, чем у дафний. Метод с использованием цериодафний при строгом соблюдении условий опыта вдвое короче, чем с использованием дафний. Эксперименты с более мелкой цериодафнией компактны - требуются меньшие объемы растворов и посуды. Однако на более крупных дафниях удобнее производить измерения, вести наблюдения за показателями размножения (четче выявляются патологические отклонения - абортирование яиц, эмбрионов, уродства).
В связи с большей требовательностью цериодафний к кислородному режиму среды, они более чувствительны к органическому загрязнению и веществам, снижающим концентрацию растворенного кислорода в воде. По отношению к действию тяжелых металлов видовая чувствительность различна: в одних случаях более устойчивы цериодафнии, в других - дафнии.
Оценку токсичности на ветвистоусых ракообразных разных видов можно проводить по единой методике, изменяя процедуру постановки опытов с учетом индивидуальных биологических характеристик вида - разной продолжительности цикла развития, размеров, оптимальных условий содержания.
В данном руководстве приводятся две методики определения хронической токсичности вещества на ракообразных:
1. Длительный опыт на серии трех поколений - D. magna или С. affinis. Проведение исследований на серии генераций предпочтительно тогда, когда есть основания полагать, что отрицательное действие веществ может накапливаться в поколениях.
2. Длительный опыт на модельных популяциях дафний - D. magna, D. longispina или D. carinata. Проведение исследований по этой схеме предпочтительно тогда, когда возможно отрицательное действие веществ на бисексуальный тип размножения, связанный с образованием самцов и латентных яиц. Кроме того, данный прием обеспечивает прямую оценку влияния вещества на продуктивные свойства дафний. В отдельных случаях выявлено, что при бисексуальном размножении дафний латентные яйца оказываются дефектными или вообще не развиваются. Дафния откладывает пустой эфиппиум.
Для работы с ракообразными необходимы оборудование и материалы:
микроскоп биологический, обеспечивающий увеличение в 100 - 200 раз;
бинокуляр МБС;
рН-метр;
оксиметр;
микрокомпрессоры;
аквариумы для хранения чистой воды (от 50 до 200 л);
камера Горяева;
стаканы химические (на 0,05; 0,1; 0,3 л; 0,5 л);
пробирки;
колбы мерные (на 0,1 - 2 л);
цилиндры мерные (на 0,5 - 2 л);
колбы конические (на 0,2 - 0,5 л);
кристаллизаторы (на 0,5 - 1,0 л);
пипетки мерные (на 0,1 - 10 мл);
кюветы для выращивания водорослей;
шелковые мельничные сита, аквариумные сачки реактивы, входящие в состав сред для выращивания водорослей.
4.1. Дафния магна
4.1.1. Введение
Предлагаемая методика с использованием дафний вошла в состав ряда методических указаний и рекомендаций по установлению токсичности сточных и природных вод (РД 118-02-90 утвержден Госкомприроды СССР от 06 августа 1990 г. № 37 "Методическое руководство по биотестированию воды"; Утверждено Минприродой России от 27 апреля 2001 г. "Руководство по определению методов биотестирования токсичности вод, донных отложений, загрязняющих веществ и буровых растворов". М.: РЭФИА, НИА-Природа, 2002).
4.1.2. Характеристика тест-объекта
Рачки вида Daphnia magna Straus (класс Crustacea, отряд Cladocera) обитают в стоячих и слабопроточных водных объектах, особенно часто - во временных лужах, и распространены повсеместно на территории России.
Этот вид является типичным бетамезосапробом, перенося осолонение до 6. Оптимальное содержание кислорода для дафнии составляет 7 - 8 мг/л, однако рачок способен переносить снижение концентрации О2 до 2 мг/л.
Оптимальные значения активной реакции среды рН составляют 7,0 - 8,0, однако временные изменения рН в пределах 5,8 - 9,0 не подавляют существенным образом жизнедеятельность дафнии.
При культивировании и проведении токсикологических опытов необходимо поддерживать непрерывное партеногенетическое размножение рачков, учитывая особенности биологического цикла развития рачков.
Длительное культивирование дафний в лабораторных условиях позволяет установить пределы изменчивости основных биологических показателей рачков в зависимости от сезона. В оптимальных условиях содержания выживаемость дафний не зависит от времени года, оставаясь на уровне 80 - 100 % к концу опытов. Средние значения плодовитости за 30 суток опытов (за это время получают 7 - 8 пометов) составляют от 60 до 170 экземпляров молоди на одну самку. Могут наблюдаться повторяющиеся снижения плодовитости рачков в зимний (ноябрь - январь) и летний (июнь - июль) периоды. Длительность культивирования рачков в лаборатории в оптимальных условиях даже в течение 10 лет не влияет на результаты опытов.
4.1.3. Условия лабораторного содержания
Работу с дафниями необходимо проводить в помещении, где не используются химические летучие вещества. Недопустима также обработка помещения хлор- и фосфорорганическими пестицидами для борьбы с насекомыми и грызунами.
Дафний отлавливают в природном водном объекте (или получают культуру в одной из специализированных лабораторий). Для постепенной адаптации дафний рекомендуется смешивать 1 часть воды из природного водного объекта или воды, в которой рачки предварительно культивировались, с тремя частями лабораторной воды. Культуральная среда обновляется полностью или частично 1 раз в неделю.
Стабильные условия культивирования обеспечиваются в специально устроенном шкафу-термолюменостате. Он представляет собой застекленный бокс с раздвижными стеклами и рядом полок для сосудов. Хорошо предусмотреть ряд секций для раздельного содержания маточных культур дафний и постановки хронических экспериментов. В шкафу монтируются лампы дневного света, обеспечивающие освещенность около 400 - 600 люкс в течение 10 - 12 ч в сутки. В шкаф может быть встроен обогреватель с контактным термометром, обеспечивающим температуру 20 ± 2 °С.
Для культивирования дафний используют отстоянную водопроводную воду или воду из незагрязняемых водных объектов. Отбор воды из природных водных объектов лучше производить в ясную погоду, желательно после ряда дней без дождя. Неблагоприятное действие на рачков может оказать вода, взятая в паводковый период. Природную воду необходимо процеживать через сито (№ 68-72) во избежание попадания простейших и коловраток, которые могут паразитировать на рачках. Водопроводной водой можно пользоваться после предварительного удаления из нее остаточного хлора путем длительного продувания воздуха с помощью микрокомпрессора (около 14 дней). На дно аквариума насыпают хорошо промытый песок, сажают 5 - 10 растений.
Основные гидрохимические показатели воды, используемой для культивирования дафний, должны находиться в следующих пределах:
а) содержание кислорода 7 - 8 мгО2/л;
б) рН - 7,0 - 8,2;
в) окисляемость по Кубелю 4,2 - 5,8 мгО2/л;
г) общая жесткость 3,0 - 6,5 мг·экв/л (20 ± 5 мг СаСО3);
д) соотношение Ca/Mg 4:1;
е) NH3+, NO2- - отсутствие, следы. В почти всех остальных случаях без знаков препинания!
В качестве основного корма для дафний могут быть использованы зеленые протококковые водоросли и в качестве дополнительного - пекарские дрожжи только для маточных культур. Дрожжами дафний можно подкармливать 1 - 2 раза в неделю из расчета 3 мл 1 %-й суспензии на 1 дм3 среды. Взвесь дрожжей хранится в холодильнике не более трех дней.
Состав сред для культивирования кормовых водорослей представлен в таблице 4.1.1.
Быстрый рост накопительной культуры водорослей хлореллы (Chlorella vulgaris) создается при соблюдении следующих условий: питательная среда с добавлением микроэлементов (Тамия), круглосуточное освещение лампами дневного света (2 - 4 тыс. лк) и интенсивное продувание атмосферного воздуха (аэрация) с помощью микрокомпрессоров. При выращивании водорослей на средах Успенского и Прата (с меньшим количеством солей) аэрация не требуется, но рост водорослей идет значительно медленнее.
Питательные среды для водорослей готовят на дистиллированной воде (п. 2.2, Приложения 1 настоящих Методических указаний). Растворы солей железа и микроэлементов можно добавлять во все среды независимо от того, указано это в прописи среды или нет.
Исходная концентрация водорослей должна быть около 2 млн. кл./дм3. Через 7 - 10 дней роста в оптимальных условиях культура достигает максимальной плотности.
Для кормления водоросли отделяют от питательной среды путем центрифугирования или отстаивания в холодильнике в течение 3 - 5 дней. Осадок разбавляется дистиллированной водой и хранится в холодильнике не более трех недель.
Состав сред для культивирования кормовых водорослей
|
Соли |
Содержание солей в средах, г/дм3 |
||
|
Тамия |
Успенского |
Прата |
|
|
KNО3 |
5,00 |
0,025 |
0,1 |
|
MgSО4×7H2О |
2,50 |
0,025 |
0,01 |
|
K2НРО4×3Н2О |
- |
- |
0,01 |
|
KН2РО4×3Н2О |
1,25 |
0,025 |
- |
|
KСО3 или (К2СО3) |
- |
0,0345 |
- |
|
FeSО4×7H2О |
0,003 |
- |
- |
|
FeCl3×6H2О |
- |
- |
0,001 |
|
Ca(NO3)2×4H2О |
- |
0,144 |
- |
|
Микроэлементы* |
по 1 см3 растворов № 1 и № 2 |
|
|
Примечание: раствор микроэлементов № 1: Н3ВО3 - 2,86 г/дм3; MNCl2·4Н2О - 1,81 г/дм3; ZnSO4·7Н2О - 0,222 г/дм3. Раствор микроэлементов № 2: МоО3 - 17,64 мг/дм3; NH4VO3 - 22,96 мг/дм3.
Число клеток в суспензии хлореллы просчитывают в камере Горяева (или любой другой камере для счета водорослей). Кормление дафний проводится 1 раз в день, концентрация корма в сосуде с дафниями 350 - 700 тыс. кл/мл.
Для культивирования рачков удобны небольшие стеклянные кристаллизаторы объемом 1 - 3 дм3, плотность посадки 20 - 25 особей на 1 дм3. Появившуюся молодь в необходимом количестве отсаживают в следующие сосуды от поколения к поколению. Когда вновь народившиеся рачки начинают размножаться, материнские особи удаляют. Каждое поколение маркируют и ставят дату рождения. Одновременно в лаборатории содержат культуры двух поколений дафний.
4.1.4. Проведение исследований на сериях генераций
Требования к тест-объекту. Для токсикологических исследований используют дафний, начиная с третьего поколения, полученного в лаборатории. Перед проведением эксперимента оценивают устойчивость рачков к бихромату калия. По величинам ЛК50 за 24 ч определяют соответствие культуры стандарту. Эта концентрация для дафний в возрасте 18 ± 6 ч должна находиться в пределах 0,9 - 2,0 мг/л.
4.1.4.1. Оценка острой токсичности. Основная цель острых (краткосрочных) опытов на дафниях - установить концентрации исследуемого вещества, которые в водных объектах могут вызвать массовую гибель наиболее продуктивной части зоопланктона -фильтраторов. Кроме того, устанавливается концентрация, начиная с которой следует проводить хронические (длительные) эксперименты.
Острые опыты по оценке токсичности состоят из двух экспериментов - предварительного и основного.
Предварительный эксперимент проводят с набором 3 - 5 концентраций вещества, различающихся в 10 раз. Обычно это 0,001; 0,01; 0,1; 1,0; 10,0 и 100,0 мг/дм3 вещества. Длительность такого опыта 24 - 48 ч, он позволяет установить порядок остролетальных концентраций веществ.
Основной острый опыт проводится на основании результатов предварительного варианта с набором около 5 концентраций. Выбирают такой диапазон концентраций вещества, которые вызывают иммобилизацию или гибель 10 - 90 % рачков. Продолжительность основного острого опыта 48 ч.
В экспериментальные стеклянные стаканы заливают возрастающие объемы исследуемых растворов в количестве по 100 см3 и помещают по 10 односуточных дафний. Повторность опытов в предварительном эксперименте составляет 2 - 3, а в окончательном - не менее трех.
Условия проведения опытов: температура 20 ± 2 °С, световой день - 10 - 12 ч, вода по своим свойствам должна соответствовать требованиям, перечисленным выше (п. 4.1.3 Приложения 2). В ходе острых опытов рачков не кормят. При работе со стабильными веществами замену растворов не проводят. В случае, когда исследуется быстро распадающееся вещество, исследования проводят с ежедневной заменой растворов.
4.1.4.2. Учет и анализ результатов в острых опытах. В опытах длительностью до четырех суток основным показателем токсичности среды является выживаемость дафний. Наблюдения за выживаемостью дафний проводят непрерывно в течение первого часа воздействия, затем ежечасно в первый день наблюдений и 2 - 3 раза в день - в последующие сроки.
Время гибели рачков отмечают по наступлению неподвижности (иммобилизации), при которой дафнии лежат на дне стакана, плавательные движения отсутствуют и не возобновляются при покачивании стакана. Данные по выживаемости рачков записывают в таблицу по форме 1.
Форма 1
|
Учет выживаемости дафний в растворах токсиканта А и Б
|
||||||||||||||||||||||||||||||||||||||||||||||||
В качестве дополнительных показателей в остром опыте можно учитывать: изменение окраски тела, кишечника, жирового тела, гонад, изменение наполнения кишечника, а также поведенческие реакции по балльной системе.
Изменения перечисленных показателей нередко предшествуют гибели организмов, что позволяет использовать их для ранней диагностики.
По результатам острых опытов определяют концентрацию
вещества, вызывающую гибель 50 % подопытных организмов за 48 ч экспозиции (![]() ). Наиболее простым и часто применяемым
для определения ЛК50 является графический метод. В системе координат
по оси ординат откладывают величину выживаемости (гибели) дафний в процентах за
заданный срок опытов, а по оси абсцисс - логарифм концентрации. Точка
пересечения горизонтальной прямой, соответствующей 50 % выживаемости рачков, с
экспериментальной линией определит искомую концентрацию ЛК50.
). Наиболее простым и часто применяемым
для определения ЛК50 является графический метод. В системе координат
по оси ординат откладывают величину выживаемости (гибели) дафний в процентах за
заданный срок опытов, а по оси абсцисс - логарифм концентрации. Точка
пересечения горизонтальной прямой, соответствующей 50 % выживаемости рачков, с
экспериментальной линией определит искомую концентрацию ЛК50.
Графически может быть определено также для каждой концентрации вещества медианное время выживания (ЛК50), то есть время выживания 50 % организмов при данной концентрации.
Более точное определение ЛК50 может проводиться с использованием пробит-анализа (п. 4, Приложения 4).
Результаты опытов дают возможность оценить также наличие острой токсичности по концентрациям, вызывающим достоверное снижение выживаемости рачков по сравнению с контрольными и определить максимальную концентрацию, при которой острая токсичность не проявляется.
Достоверность получаемых результатов можно считать надежной, если удовлетворены следующие условия:
а) гибель контрольных дафний не превышает 10 %;
б) ЛК50 бихромата калия за 24 ч для дафний в возрасте 18 ± 6 ч находятся в диапазоне 0,9 - 2,0 мг/л;
в) содержание растворенного кислорода, определенное в конце опыта, составляет не ниже 2,0 мгО2/л.
4.1.4.3. Оценка токсичности в хроническом эксперименте. Хронические (длительные) опыты с дафниями служат для глубокого, более детального исследования токсичности химических соединений.
Для хронических опытов подбирают 3 - 4 концентрации вещества, составляющие 0,1 - 0,0001 от ЛК50 за 48 ч.
В каждой серии эксперимента (контрольной или опытной) используют не менее 20 рачков, а опыты ставят не менее чем в трех повторностях (приемлемы 4 повторности по 5 дафний или 3 повторности по 7 дафний). В опытные стаканы заливают растворы, исходя из соотношения 50 см3 на 1 дафнию. Возраст рачков 18 ± 6 ч.
Общие условия (температура, освещенность) проведения хронических опытов те же, что и в острых опытах. Рачков ежедневно кормят хлореллой в концентрации 350 - 700 тыс. кл/см3. Частота замены растворов определяется свойством веществ, но не реже двух раз в неделю. При смене растворов сохраняют соотношение 50 см3 на 1 дафнию, если рачки погибают, количество исследуемого раствора пропорционально уменьшают.
Продолжительность опытов с каждой генерацией определяется временем появления четырех пометов у контрольных дафний, что составляет обычно около 20 суток, а общая продолжительность опытов - 40 - 45 суток.
При проведении опытов на поколениях придерживаются следующей схемы: молодь из первого помета, появившуюся от исходных особей, отсаживают в таком же количестве в растворы вещества с концентрациями, при которых проводились исследования с исходными особями, и ведут такие же наблюдения до получения трех поколений (Таблица 4.1.2.).
Таблица 4.1.2
Схема опытов на серии генераций дафний
|
Оцениваемое поколение |
Учитываемые пометы |
Сумма молоди |
|
Исходное Fисх |
F1исх, F2исх, F3исх, F4исх |
∑F1-4исх |
|
Первое F1 |
F11, F21, F31, F41 |
∑F1-41 |
|
Второе F2 |
F12, F22, F32, F42 |
∑F1-42 |
|
Третье F3 |
F13, F23, F33, F43 |
∑F1-43 |
Примечание: F - поколения; верхний индекс - пометы каждого поколения; нижний индекс - оцениваемое поколение.
4.1.4.4. Учет и анализ результатов в хроническом опыте. Основными показателями токсического действия являются выживаемость, рост, плодовитость и качество потомства. При наблюдении за размножением рачков учитывают время наступления половозрелости в днях, регистрируемое по моменту откладки яиц в выводковую камеру, время рождения первого помета, количество народившейся молоди в каждом помете. Необходимо учитывать также патологические отклонения: количественный учет абортивных яиц и эмбрионов, мертворожденной и уродливой молоди. В случае появления уродливой молоди, ее отсаживают в небольшие сосуды с соответствующими концентрациями исследуемого соединения и наблюдают за ее выживаемостью минимум трое суток.
Наблюдения за выживаемостью и показателями размножения дафний ведут ежедневно, подсчет, анализ и удаление молоди удобно проводить во время смены растворов. Получаемые в ходе опытов результаты регистрируют в таблице согласно форме 2.
Общее количество народившейся жизнеспособной молоди от одной самки отражает величину реальной (фактической) плодовитости дафний.
Форма 2
|
Изменение биологических показателей у дафний исходного (1-го, 2-го, 3-го) поколения при действии исследуемого вещества
|
||||||||||||||||||||||||||||
Эта величина, в конечном итоге, определяет сохранность вида и имеет решающую роль при оценке токсичности.
Суммарное количество образованных яйцеклеток в организме дафний (патология и фактическая плодовитость) составляет потенциальную плодовитость дафний.
В редких случаях химические вещества могут влиять на темп роста рачков, снижая или увеличивая скорость роста на разных этапах жизни. Из каждой концентрации следует проводить измерение по 10 - 15 рачков после рождения (односуточных), после наступления половозрелости в течение суток и перед окончанием опыта. Измеряют длину рачков от переднего края головы до основания шипа.
По окончании опытов для каждого поколения подсчитывают средние значения выживаемости, плодовитости в пересчете на одну самку за 4 помета, количество патологических отклонений в процентах от реальной плодовитости, от размеров в разные сроки. Результаты опытов в растворах вещества сравнивают с контролем (водная среда без исследуемого вещества), достоверность отклонений результатов опыта от контроля определяют обычными методами вариационной статистики. Достоверность получаемых результатов в хроническом опыте можно считать надежной, если соблюдены следующие условия:
а) гибель контрольных дафний на конец опыта не превышает 10 %;
б) 4 помета у контрольных рачков получены за срок не более 20 ± 2 суток;
в) количество молоди на 1 самку за 4 помета в контроле - не менее 35 штук;
г) время наступления половозрелости у контрольных рачков - не позднее 9 суток;
д) ЛК50 бихромата калия за 24 ч для дафний из контрольных растворов находятся в диапазоне 0,9 - 2,0 мг/л.
На основании результатов исследований с дафниями в остром и хроническом опыте делают вывод об уровне токсичности исследуемых веществ.
Определение концентраций, не обладающих хроническим токсическим действием, базируется на оценке трех показателей: выживаемости, плодовитости и размеров дафний. Критерием токсичности в опытах на поколениях рачков служит также наличие статистически достоверного различия трех показателей в опыте и в контроле.
При оценке влияния вещества на размножение особое внимание следует уделить эффекту стимуляции, когда количество молоди в опыте превышает количество в контроле. Опыты на серии трех поколений позволяют установить, насколько устойчив этот эффект в поколениях. Если численность молоди в опыте превышает численность в контроле не более чем на 50 - 70 % и не сопровождается патологическими отклонениями в размножении, то стимуляция, как правило, в поколениях не закреплена. Стимулирующий эффект, превышающий 100 %, всегда связан с патологическими отклонениями и в ряду поколений приводит к снижению плодовитости.
Число патологических отклонений при развитии у рачков из контрольных серий (чаще всего - абортивные яйца), не должно превышать 10 % от величины реальной плодовитости на данный период времени. Появление абортивных яиц может быть связано с ухудшением некоторых условий культивирования: недостатком корма, освещенности, колебанием температуры и качеством воды.
Патологические отклонения, проявляющиеся при исследованиях токсичности вещества, могут указывать на характер действия испытываемого соединения:
а) если у рачков замедлены процессы созревания, снижена численность пометов и количество образованных яйцеклеток, то вещество обладает гонадотропным действием;
б) если у дафний опытной серии величина потенциальной плодовитости равна или превышает контроль, а реальная плодовитость значительно снижена за счет абортивных яиц, эмбрионов и мертворожденной уродливой молоди, то вещество обладает эмбриотропным действием;
в) если у дафний отмечено появление уродливой молоди, которая выживает в исследуемых растворах 3 и более суток, то предполагается наличие мутагенности и необходимо проведение специальных уточняющих экспериментов.
При установлении недействующих концентраций вещества на дафниях лимитирующими показателями, как правило, являются выживаемость и плодовитость. Направленное действие вещества только на размеры дафний наблюдается реже. Химические соединения могут тормозить рост на разных жизненных этапах:
а) если молодь рождается такая же, как в контрольных растворах, но к периоду наступления половозрелости размеры рачков уменьшены, то вещество тормозит рост дафний в ювенильный период;
б) если размеры дафнии достоверно уменьшены к концу опытов, то вещество подавляло рост дафний в период размножения;
в) если новорожденная молодь в 2 раза мельче, чем молодь контрольных рачков, то результаты указывают на наличие мутагенного эффекта.
4.1.5. Проведение исследований на модельных популяциях
4.1.5.1. Постановка исследований. Опыты по этой схеме проводятся в химических стаканах или аквариумах с объемом среды 1 дм3. Остальные приемы сходны с описанными в предыдущей методике. Выметанную молодь после подсчета не удаляют (как в случае постановки опыта на серии генераций), а возвращают в экспериментальный стакан.
В стаканы вносится одинаковое количество одновозрастных рачков (по 8, 9 или 10 организмов). Подсчет удобно производить по трем возрастным группам дафний: молодь до начала созревания гонад (м1), молодь с гонадами, начавшими созревать (м2), и взрослые. Поскольку переход между группами регистрируется нечетко, удобно использовать вторичный половой признак - у м1 первый абдоминальный отросток неразвит или имеет малые размеры и расположен перпендикулярно спине абдомена, у м2 он начинает загибаться вперед.
Полный анализ с использованием шкал можно производить не на всех рачках, а отобрав по 15 экземпляров м1, м2 и взрослых, остальные подсчитывают только для учета соотношения их численности. Затем дафний взвешивают. Для этого следует сделать сито из планктонного газа и капроновой жилки (0,4 - 0,6 мм), используя в качестве шаблона дно химической пробирки соответствующей кривизны и сваривая все части с помощью нагретого железного предмета, например, пинцета с тонкими кончиками и т.п. Для взвешивания рачков из стакана для просмотра пипеткой переносят на сито. В сито для просмотра, помещенное в чашку Петри (где и удобно проводить просмотр), наливают немного воды из стакана, в котором они находились. Сито для взвешивания обсушивают на фильтровальной бумаге. Взвешивание производится на торсионных или аналогичных им других весах, после чего дафний немедленно переносят в новую экспериментальную среду. Взвешивают всех дафний из данной концентрации с точностью ±1,5 мг, поэтому вес более 10 рачков достаточно репрезентативен.
Опыт длится до начала снижения биомассы после достижения ее максимальной величины в контроле и при низких концентрациях вещества (подострый опыт) или до второго или третьего пика биомассы (хронический опыт).
4.1.5.2. Учет и анализ результатов. В течение первых двух часов наблюдение проводится регулярно: сначала каждую минуту, затем - через 5, далее - через 10 минут. Позже можно ограничиться просмотром через полчаса до конца первого рабочего дня. Со следующего дня просмотр проводится ежедневно.
Через сутки, через двое, на 5-е и 10-е сутки проводится полный анализ с просмотром под бинокуляром и описанием состояния каждой особи. Если имеются данные, что возможна задержка роста дафний, они должны регулярно измеряться под бинокуляром.
Дафнии подразделяются на следующие возрастные группы:
♀м1 - молодые самки до начала созревания гонад (первый абдоминальный отросток не начал отгибаться вперед);
♀м2 - молодые самки с начавшими развиваться гонадами (первый абдоминальный отросток начал отгибаться вперед);
♀ял. - взрослые яловые самки, у которых в выводковой камере (в марсупии) должны быть, но отсутствуют зародыши или на спине нет эфиппиума;
♀мя - взрослые самки с яйцами или зародышами в выводковой камере;
♀яМs - самки с яйцами и зародышами разного возраста и размера (нарушение развития части яиц);
♀э - самки с эфиппиумом на спине и латентными яйцами в гонадах;
♂м1 - молодые самцы до начала развития вторичных признаков, у них, в отличие от самок того же возраста, несколько «бульдожий» вид и вздутые антеннулы;
♂м2 - молодые самцы с началом роста антеннул (они вытянуты, но не развиты полностью) и с образованием расширения на нижней щели раковины;
♂ - взрослые самцы с полностью развитыми антеннулами, с опушенным расширением в середине брюшной щели раковины и длинным жгутом на первых абдоминальных ножках.
Если под влиянием нервно-паралитического яда у дафний происходит судорожное сокращение продольных мышц абдомена, особенно когда это сопровождается опорожнением кишечника и выбрасыванием из выводковой камеры яиц или зародышей, ставят букву «Т» (тетанус). Обязательно отмечают случаи побеления (коагуляции белков), в первую очередь жаберных отростков абдоминальных ножек.
Такие отметки делают при беглом просмотре дафний. При тщательном обследовании под бинокуляром регистрируется численность (2 раза в неделю в момент замены растворов):
а) молоди м1 и м2 (отдельно ♀м1; ♀м2; ♂м1; ♂м2)
б) взрослых самцов (♂);
в) самок с партеногенетическими яйцами (♀я);
г) «яловых» самок (явно половозрелых, но с пустовыводной камерой, если гонады не набиты партеногенетическими яйцами) (♀ял.);
д) самок с эфиппиумами (♀э).
Кроме того, учитываются случаи уродливого развития яиц в выводковой камере, сброшенные недоразвитые яйца и зародыши, сброшенные эфиппиумы (если в них нет латентных яиц) и суммарный вес живых дафний.
Один-два раза в течение эксперимента, лучше всего на 10 - 15-е сутки (фаза логарифмического роста) и при достижении биомассы насыщения (на 25 - 28-е сутки) целесообразно в качестве дополнительных показателей провести полный биологический анализ дафний с регистрацией по 15 особей ♀м1, ♀м2 и взрослых.
Отдельно должны учитываться все уродливые особи. Желательно пересадить их в чистую воду и проследить за их дальнейшей судьбой и за их потомством.
Как правило, наиболее чувствительным показателем является биомасса дафний в момент достижения максимальных значений в контроле и при минимальных концентрациях вещества в опыте. Если обнаруживаются нарушения в развитии партеногенетических или латентных яиц, ПДК вещества должна устанавливаться по этому показателю.
Об упитанности дафний и накоплении гемоглобина при снижении в воде содержания растворенного кислорода можно судить по цвету тела и количеству капель жира. Иногда у дафний появляется зеленовато-голубоватая окраска, особенно яиц и зародышей в выводковой сумке, расположенной между створками раковины на спинной стороне и абдоменом рачка. Обычно этот цвет приписывают каротиноидам, накапливаемым в заметных количествах.
Ниже приведены некоторые формы записи и интерпретации результатов опытов с дафниями (Таблицы 4.1.2 - 4.1.6 и Формы 3 - 5).
При внесении в таблицу в числителе записывают состояние яиц в гонадах, а в знаменателе - состояние яиц, зародышей в выводковой камере или в эфиппиуме на ней. Выделяют следующие градации степени повреждающего действия:
E1 - реакции дафний, не связанные с их повреждением;
Е2 - легкие повреждения, не связанные с опасностью для существования особи;
Е3 - повреждения средней тяжести;
Е4 - тяжелые повреждения;
Е5 - гибель рачков и предшествующие ей симптомы (иммобилизация, тетанические сокращения туловища, параличи и т.п.).
Шкала для оценки степени наполнения кишечника дафний
|
Содержимое кишечника |
Балл |
|
Отсутствует |
к1 |
|
Заполняет меньше половины кишечника, часто не прилегает к его стенкам |
к2 |
|
Заполняет от 1/2 до 3/4 кишечника, рыхло |
к3 |
|
Заполняет больше 3/4 кишечника, но местами отстает от стенок или прозрачно в средней части кишечника |
к4 |
|
Заполняет весь кишечник; если просвечивает, то только в его передней части |
к5 |
|
Заполняет весь кишечник, но прозрачным еле видным содержимым |
к2а |
|
Заполняет весь кишечник, окрашено, но сильно просвечивает |
к3а |
Примечание: баллы к2а и к3а свидетельствуют о нарушении пищеварения, к1 и к2 - о голодании дафний, к3 - о плохом питании.
Таблица 4.1.3
Сокращенная запись окраски содержимого кишечника
|
Окраска содержимого |
Оливковая |
Зеленая |
Охристая ("песчаная") |
Коричневая |
Серая |
Черная |
|
Обозначение |
О |
З |
Ох |
К |
С |
Ч |
Примечание: заполненность кишечника и окраску его содержимого удобно учитывать отдельно для передней (до перегиба при переходе из головного отдела в абдомен) и задней части.
Таблица 4.1.4
Шкала градаций окраски тела дафний
|
Характеристика окраски тела дафний |
Оценочный балл |
|
Бесцветное, "стеклянное" |
1 |
|
Желтоватое (полостная жидкость не видна, но ощущается плазма клеток) |
2 |
|
Плазма клеток и кровь (полостная жидкость) имеют диффузнорозовое окрашивание: |
|
|
бледное |
3 |
|
умеренное |
4 |
|
яркое |
5 |
|
Мутно-желтое |
2м |
|
Мутно-розовое |
3м - 5м |
Примечание: балл 1м не приводится, поскольку он плохо выявляется визуально. Мутность (в первую очередь дыхательных отростков ног и туловища) обычно свидетельствует о коагуляции плазмы клеток.
Таблица 4.1.5
Шкала развития партеногенетических и латентных яиц в гонадах дафний
|
Состояние гонады и проходящие в ней процессы |
Оценочный балл |
|
Развитие партеногенетических яиц |
|
|
В зоне роста визуально не обнаруживается очередная партия яиц. Иногда здесь слабо видны прозрачные клетки эпителия зоны роста, но они расположены беспорядочно |
1 |
|
В зоне роста расположены тетрады прозрачных яйцеклеток, содержащие капли жира (малый трофоплазматический рост) |
2 |
|
Яйцеклетки становятся дымчатыми, промежутки между ними просвечивают (большой рост, накопление желтка) |
3 |
|
Яйцеклетки темные, малопрозрачные в проходящем свете, промежутки между ними не видны (накопление желтка закончено, яйца готовы к поступлению в выводную камеру |
4 |
|
Развитие латентных яиц |
|
|
На границе зоны роста и зачатковой зоны гонады (над пятой парой брюшных ножек лежит группа клеток с более резкими границами, последняя тетрада преобразуется в латентную яйцеклетку с первичными питающими клетками) |
1л |
|
В группе клеток с более темными оболочками снизу прилегает темная треугольная полоска латентной яйцеклетки (начало накопления желтка) |
2л |
|
Первичные питающие клетки дымчатые, под ними - темная треугольная полоска латентной яйцеклетки (идет накопление желтка) |
3л |
|
Латентное яйцо сформировано, часто с небольшой перетяжкой посередине. Питающих клеток не видно |
4л |
|
Патология |
|
|
Края клетки мутные, частицы желтка в клетках эпителия зоны роста. Идет резорбция яиц. Обычно заметно на стадиях 3 и 3л |
Р |
Шкала развития партеногенетических яиц в выводковой камере и эфиппиума. Норма и патология
|
Показатель состояния и происходящие процессы |
Оценочный балл |
|
Выводная камера пуста. |
|
|
а) у впервые созревающих самок |
0 |
|
б) у повторно созревающих |
04 |
|
Развитие партеногенетических яиц (норма) |
|
|
Яйца темные, непрозрачные, в начале стадии вытянутые, в конце ее округлые. Окончание образования направительных телец, слияние ядра одного из них с ядром яйцеклетки, образование первой яйцевой оболочки |
1 |
|
Яйца становятся крупнее с более светлым периферическим слоем и грануляцией в середине яйца. Дробление, гаструляция |
2 |
|
Стадия несформированного эмбриона. Начало становления зачатков (выступов) плавательных антенн, конец его, сформирование парного глаза |
3 |
|
Стадия сформированного эмбриона. Начало стадии - слияние парного глаза и появление в нем черного пигмента, конец ее - полное сформирование молодой дафнии, которая начинает двигаться, сердце ее пульсирует. Каудальная игла иногда подогнута в момент вымета, иногда выпрямлена |
4 |
|
Нарушение партеногенетического развития (патология) |
|
|
Яйца мутные, непрозрачные, часто - набухшие. Их гибель и дегенерация |
Д |
|
Яйца теряют форму, разлагаются и в виде пенистой массы вытекают через заднюю щель выводковой камеры самки |
S |
|
Яйца развиваются, но не происходит яйцевой линьки (во время развития эмбрионов в норме наблюдается одна яйцевая и две эмбриональные линьки), поэтому зародыш развивается уродливо "в яйце". При сформированном глазе и уже пульсирующем сердце не видно никаких выступающих органов |
мS |
|
Выживаемость дафний в растворах вещества
|
||||||||||||||||||||||||||||||||||||
Форма 4
|
Изменение биологических показателей у дафний под влиянием вещества
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Изменения биологических показателей у дафний в опытах на культурах
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4.2. Цериодафния
4.2.1. Характеристика тест-объекта
Цериодафнии - рачки вида Ceriodaphnia affinis Lilljeborg (класс. Crustacea, отряд Cladocera, семейство Daphnidae) обитают в пресноводных водных объектах Европы, Северной Африки, Азии, Северной Америки. Этот вид относится к олиго- и бетамезосапробам и населяет водные объекты с замедленным течением - неглубокие озера, реки, водохранилища. Сведения о морфологии и физиологии рачков опубликованы ранее (РД 118-02-90 утвержден Госкомприроды СССР от 06 августа 1990 г. № 37 "Методическое руководство по биотестированию воды". М.: 1991; Утверждено Минприродой России от 27 апреля 2001 г. "Руководство по определению методов биотестирования токсичности вод, донных отложений, загрязняющих веществ и буровых растворов". М.: РЭФИА, НИА-Природа, 2002).
Цериодафния имеет более мелкие размеры, чем дафнии, половозрелые самки 1,5 мм, самцы - 0,8 мм, что позволяет в опытах манипулировать с меньшими объемами воды и более компактными емкостями. Биологический цикл развития от рождения до половозрелости у цериодафнии вдвое короче, чем у дафний, при оптимальных условиях развития. Так, при температуре 25 °С созревание наступает на 2 - 3-й сутки от рождения, время первого помета - на 3 - 4-е сутки, а за срок 7 - 8 суток у рачков получают 3 помета.
При температуре 18 °С сроки получения трех пометов у рачков могут растянуться до 28 суток. Численность молоди у рачков в первом помете невелика - по 2 - 6 особей, а начиная со второго помета - от 6 до 20 особей на самку. Этот вид цериодафний моно-или дицикличен. Максимум полового периода размножения приходится на август -сентябрь, самки образуют эфиппиум с одним яйцом. В лабораторных условиях самцы появляются при недостаточном освещении, снижении температуры, концентрации растворенного кислорода, голодании.
Цериодафния более чувствительна к кислородному фактору, чем дафния. Нормальное развитие цериодафний протекает при концентрации растворенного в воде кислорода не ниже 5 мгО2/л. Вследствие этого цериодафнии более чувствительны к органическому загрязнению и веществам, снижающим концентрацию растворенного кислорода в среде.
4.2.2. Условия лабораторного содержания
Требования к помещению, где содержат цериодафний, такие же, как и с дафниями. Не допустима обработка помещения химическими веществами с целью уничтожения насекомых и грызунов.
Для культивирования цериодафний используют дехлорированную, отстоянную воду, которая должна удовлетворять следующим требованиям:
а) рН 7,0 - 8,2;
б) общая жесткость - 1,3 - 2,0 мг·экв/л;
в) содержание растворенного кислорода - 7,0 - 8,0 мгО2/л.
В качестве корма для цериодафний используют хлореллу - зеленые протококковые водоросли (Chlorella vulgaris) и пекарские дрожжи. Процедура выращивания водорослей приведена в разделе с дафниями (п. 4 Приложения 2).
Для культивирования цериодафний удобны небольшие кристаллизаторы или стаканы емкостью 0,5 - 1 дм3, плотность посадки рачков - из расчета не менее 20 см3 объема среды на одну особь. С целью адаптации рачков к условиям новой лаборатории, их помещают в смешанную воду: 1 часть среды, в которой рачки жили ранее, и 3 части лабораторной воды. Кормление проводят ежедневно, водоросли вносят в концентрации 250 - 500 тыс. кл/см3; дрожжи дают не чаще одного раза в неделю, желательно перед сменой раствора в концентрации 1 - 2 см3 1 % раствора на 1 дм3. Культуральная среда обновляется полностью один раз в неделю.
Культуру цериодафний выращивают в климатостате, люминостате или боксе при оптимальных условиях содержания: температура 25 ± 1 °С, освещенность - 400 - 600 лк, продолжительность светового дня - 10 - 12 ч.
При культивировании цериодафний удобно одновременно содержать рачков двух поколений - материнские размножающиеся особи и подрастающую молодь. Продолжительность использования маточных культур ограничивают 15 - 20 сутками. Отмечается каждое родившееся в лаборатории поколение и ставится дата рождения.
Для токсикологических исследований используют цериодафний, начиная с третьего поколения. Рачков в возрасте 4 ± 2 ч исследуют на устойчивость к стандартному токсиканту - бихромату калия в остром опыте, величина ЛК50 бихромата калия за 24 ч находится в интервале 1,0 - 2,2 мг/дм3.
В дальнейшем эксперименты с бихроматом калия ставят одновременно с постановкой основного острого опыта с каждым веществом.
4.2.3. Проведение исследований
4.2.3.1. Острый опыт. Предварительный острый опыт проводят с набором 3 - 5 концентраций веществ, различающихся в 10 раз: 100,0 - 0,001 мг/дм3. Длительность этого опыта 24 ч, он устанавливает порядок остролетальных концентраций веществ.
Основной острый опыт проводится исходя из результатов предварительного варианта с набором около 5 концентраций вещества. Выбирают диапазон концентраций вещества, которые вызывают иммобилизацию или гибель рачков в интервале 10 - 90 %. Обычно эти концентрации отличаются от минимальной летальной в 2 раза. Продолжительность основного острого опыта - 48 ч.
4.2.3.2. Проведение эксперимента. В экспериментальные стеклянные стаканы емкостью 50 см3 или пробирки наливают по 20 см3 испытуемых растворов и сажают по 4 рачка в возрасте 6 ± 2 часа. При постановке острых опытов используют на каждую концентрацию не менее 20 рачков, распределяя их не менее чем на 4 повторности.
Условия проведения опытов: температура 24 ± 1 °С, световой день - 10 - 12 ч, разбавляющая контрольная вода должна отвечать всем требованиям, перечисленным выше. В ходе острых опытов рачков не кормят. Смену растворов проводят ежедневно.
В остром опыте показателем токсичности среды является выживаемость цериодафний. Наблюдения за выживаемостью ведут в том же режиме, что и в опытах с дафниями и полученные данные записывают в таблицу (п. 4.1.5 Приложения 2 к настоящим Методическим указаниям). По результатам острых опытов рассчитывают величины ЛК50 за 48 ч, определяют действующие концентрации вещества по наличию статистически достоверного снижения величины выживаемости цериодафний в опыте по сравнению с контролем.
Достоверность получаемых результатов можно считать надежной, если удовлетворены следующие условия:
а) гибель контрольных цериодафний не превышает 10 %;
б) ЛК50 бихромата калия за 24 ч для цериодафний в возрасте 6 ± 2 ч находится в интервале 1,0 - 2,2 мг/дм3;
в) содержание растворенного О2 в исследуемых растворах, определенное в конце опыта, не ниже 5,0 мгО2/дм3.
4.2.3.3 Хронический опыт. Хронические опыты на серии трех поколений с цериодафниями, так же как и с дафниями, служат для оценки действия малых концентраций токсиканта на выживаемость, плодовитость и качество потомства в поколениях.
Для хронических опытов подбирают 3 - 4 концентрации вещества, составляющие 0,5 - 0,001 от ЛК50 за 24 ч.
4.2.3.4. Проведение эксперимента. В опытные стаканы заливают по 40 см3 испытуемых растворов и контрольной воды и помещают в них по 4 экземпляра одновозрастных цериодафний возрастом 6 ± 2 часа, повторность пятикратная. Рачков ежедневно кормят зелеными водорослями в концентрации 250 - 500 тыс. кл/см3. Смену растворов проводят через сутки до начала размножения рачков и ежедневно в последующем. При смене растворов сохраняют соотношение 10 см3 на 1 исходную цериодафнию, если рачки погибают количество раствора пропорционально уменьшают.
Продолжительность опытов с каждым поколением цериодафний определяется временем появления четырех пометов у контрольных рачков, что составляет около 10 суток, а общая продолжительность опытов на трех генерациях - от 20 до 25 суток.
Схема постановки опытов на поколениях цериодафний аналогична постановке опытов с дафниями.
В хроническом опыте ведут учет выживаемости и размножения цериодафний. При наблюдении за размножением учитывают время наступления половозрелости и первого помета, количество молоди в пометах и количество патологических отклонений (абортивные яйца и эмбрионы, уродливая и мертворожденная молодь).
Наблюдения в опытах ведут ежедневно, регистрируемые результаты заносят в таблицу по форме 1 и 2 (п. 4.1.4 Приложения 2).
По окончании опытов с каждым поколением цериодафний подсчитывают среднее значение по суткам выживаемости, плодовитости в пересчете на одну самку за 4 помета, процент патологических отклонений от величины реальной плодовитости. Результаты опытов сравнивают с контролем, достоверность отклонений определяется обычными методами вариационной статистики.
Достоверность получаемых результатов в хроническом опыте можно считать надежной, если соблюдены следующие условия:
а) гибель в контроле на конец опыта не превышает 10 %;
б) 4 помета в контроле получены за срок около 10 суток;
в) количество молоди на 1 самку за 4 помета в контроле не менее 20 штук;
г) время наступления половозрелости у цериодафний в контроле не превышает 5 суток;
д) ЛК50 бихромата калия за 24 ч для цериодафний из контрольных растворов находятся в интервале 1,0 - 2,2 мг/л.
5. Установление максимальной допустимой концентрации вещества для бентосных организмов
5.1. Прудовик обыкновенный
5.1.1 Характеристика тест-объекта
Брюхоногие моллюски играют важную роль в круговороте органического вещества в водных экосистемах. Прудовик болотный (обыкновенный, большой) Limnea stagnalis является представителем эпибентоса. Широко распространен в прибрежной зоне стоячих или медленно текущих водных объектов.
Прудовиков отлавливают в летние месяцы на мелководьях эвтрофных водных объектов в зарослях высшей водной растительности.
5.1.2 Условия лабораторного содержания
Для содержания моллюсков и для проведения исследований необходимо следующее оборудование:
микроскоп биологический, обеспечивающий увеличение в 100 - 200 раз;
бинокулярная лупа;
весы аналитические с разновесами;
весы технические;
термостат на 150 °С;
муфельная печь на 450 °С; кристаллизаторы на 2 л;
стаканы химические на 100 - 500 мл;
колбы мерные на 0,2 - 1 л;
цилиндры мерные на 50 - 1000 мл;
пипетки химические на 1 - 10 мл;
чашки Петри;
респирометры (банки по 0,5 л со стеклянными крышками);
склянки с притертыми пробками на 0,5 - 1 л для растворов;
сифоны с зажимами Мора;
пикнометры;
тигли;
ножницы, пинцеты, часовые стекла;
реактивы для определения кислорода методом Винклера.
Для исследований отбирают половозрелых моллюсков, активно передвигающихся и потребляющих корм. Кормят листьями одуванчика, капусты, салата, рдестом блестящим. Корм моллюскам дают в изобилии, что положительно сказывается на их росте и продуктивности. В каждый кристаллизатор помещают по 3 - 5 особей. После отбора проводят адаптацию к условиям лабораторного содержания в течение двух недель.
5.1.3 Проведение исследований
Для каждого опыта выбирают особей одного размера, веса и цвета раковины.
Острый опыт предназначен для определения диапазона концентраций хронического опыта. Проводится при 5 - 6 концентрациях в трех повторностях каждая. Концентрации различаются между собой на порядок. Продолжительность исследования - 3 - 5 суток. Моллюсков в опыте не кормят. В каждый кристаллизатор на 1,5 - 2,5 дм3 раствора помещают 3 - 5 моллюсков.
Учитывают влияние исследуемого вещества на выживаемость и поведение моллюсков.
Хронический опыт продолжается 45 - 60 суток. Исходной концентрацией для длительных исследований служит наибольшая безвредная концентрация, определенная в остром опыте. Число повторностей и плотность посадки такие же, как и в остром опыте. В течение опыта моллюсков подкармливают.
Состояние выборок учитывают ежедневно.
Для оценки влияния вещества на процессы размножения в аквариумы помещают по 2 - 3 взрослых прудовика. Ежедневно учитывают появление кладок, начало выклева и время появления молоди, которая содержится в аквариуме. Через 3 - 4 месяца всю молодь изымают из аквариумов и промеряют под микроскопом с помощью окуляр микрометра по высоте и ширине раковины. Мелкие особи держатся у уреза воды, быстро обсыхают и могут быть утеряны при подсчете численности. Необходимо регистрировать и погибших моллюсков, учитывая пустые раковины.
5.1.4 Учет и анализ результатов
В первые 8 ч ежечасно, а в последующие 3-е суток 2 - 3 раза в день, учитывают состояние моллюсков в опытных и контрольных сосудах. Регистрируют количество живых особей и их поведение (степень и характер передвижения, выдвижение ноги и ее реакцию на раздражение), интенсивность потребления корма, выделение слизи, определяемое по помутнению опытного раствора. В дальнейшем учет проводят один раз в сутки.
Особи, которые не реагируют на механическое раздражение и тело которых легко высвобождается из раковины, считаются погибшими.
Размножение и плодовитость оценивают по времени появления первых кладок, их числу и количеству яиц в каждой кладке. Потенциальную плодовитость определяют по числу яиц в кладках, полученных от каждого моллюска за период опыта, а реальную - по количеству выклюнувшейся молоди в абсолютных величинах и процентах к исходному числу яиц в кладках. Помимо этого можно контролировать процесс эмбриогенеза (время начала и конца прохождения каждой стадии, состояние эмбрионов) вплоть до выклева молоди. Особенности роста оценивают, определяя высоту и ширину раковины, отношение высоты к ширине. Водно-солевой обмен моллюсков оценивают, определяя сырую массу тела и раковины, массу полостной жидкости и воды в теле, сухой остаток и количество золы в мягких тканях. По разнице сухого остатка и сырой массы тела судят об изменении степени обводненности, а по количеству зольных элементов в теле и массе раковины - об изменении минерального обмена.
Высоту и ширину раковины измеряют штангенциркулем. За ее высоту принимают расстояние от вершины раковины до наиболее выступающего края устья, а за ширину - диаметр раковины в наиболее широкой части.
Для определения общей массы прудовика обыкновенного его обсушивают фильтровальной бумагой и, не надавливая на ногу (для сохранения в раковине полостной жидкости), переносят на технические весы и взвешивают.
При определении массы тела и раковины ножницами разрезают раковину по швам витков, освобождают тело, обсушивают на фильтровальной бумаге и взвешивают на аналитических весах (с точностью до 0,001 грамма). Тела особей каждой размерной группы фиксируют в бюксах в 96 % этаноле. Осколки раковины взвешивают. Вычитая из общей массы массу тела и раковины, определяют количество полостной жидкости.
Для определения сухого остатка тела вес зафиксированных в спирте моллюсков доводят до постоянной величины при температуре 103 - 105 °С. Количество сухого остатка рассчитывают на единицу сырой массы. По разности сырой и сухой массы определяют количество воды в теле прудовика и судят о степени обводненности или обезвоживания тела под воздействием химического вещества.
Сухой остаток тела прудовика (весь или его часть) переносят в тигли и сжигают в муфельной печи при температуре 450 °С. Рассчитывают количество золы на единицу массы сухого остатка тела. По количеству золы судят об изменении минерального обмена.
Количество органического вещества рассчитывают по разности массы сухого остатка и золы. Эта величина, при сравнении с контрольными величинами, указывает на степень энергетических затрат организма при токсическом воздействии.
Для определения суточного рациона моллюсков находят разность между начальным количеством корма и его остатком. Задаваемую порцию корма взвешивают, а остаток изымают, обсушивают и вновь взвешивают. Для каждой размерной группы вычисляют кормовой коэффициент по формуле:
К = Р/ΔР,
где Р - масса съеденного корма (г),
ΔР - прирост массы моллюска (г).
Этот показатель позволяет судить об эффективности потребленного корма моллюсками при токсическом воздействии в опыте по сравнению с контролем.
Изучение энергетического обмена у прудовиков заключается в определении интенсивности потребления кислорода с применением метода Винклера (или с использованием чувствительного оксиметра).
Для этого в респирометры (банки на 0,5 дм3 с плотными крышками) заливают воду, помещают прудовиков, у которых предварительно определены масса и объем тела (по 3 особи), и закрывают крышками так, чтобы в банках не оставалось воздушных пузырьков. Банки с водой, но без моллюсков являются контрольными. Банки при стабильной температуре выдерживают 2 ч, после чего из них отбирают пробы воды в калиброванные пикнометры, в которых измеряют количество растворенного кислорода. Количество кислорода, потребленное прудовиками (в мг кислорода на 1 дм3 за 1 ч), определяют по формуле:
Ммг/дм3 ч = (m0·m)·(V1 - V2)/Р·t,
где m0 - содержание кислорода, растворенного в воде респирометра без прудовиков, мгО2 на 1 см3;
m1 - содержание кислорода в воде респирометра с прудовиками;
V1 - объем респирометра в см3;
V2 - общий объем тел моллюсков в мл;
Р - общая масса тел прудовиков в мг;
t - продолжительность экспозиции в часах.
При наличии оксиметра контроль содержания кислорода в воде можно производить непосредственно в респирометрах, не отбирая проб.
Полученные результаты по динамике роста молоди прудовика заносят в нижеследующую табличную форму 6.
Форма 6
|
Результаты учета динамики роста молоди прудовиков
|
||||||||||||||||||||||||||||||||||||||||||||||
По окончании экспериментов с прудовиком и обобщении полученных данных допустимыми следует считать такие концентрации вещества, которые:
а) не вызывают статистически достоверного отклонения выживаемости взрослых моллюсков и молоди от выживаемости в контроле в срок до 60 суток;
б) не вызывают достоверного угнетения размножения моллюсков за срок наблюдения;
в) не снижают интенсивность потребления кислорода более чем на 15 % по сравнению с контролем; (то, что отмечено выше красным шрифтом)
г) изменяют водно-солевой обмен по сравнению с контролем не более чем на 10 %.
5.2. Хирономиды
5.2.1 Характеристика тест-объекта
Из пресноводных бентосных организмов инфауны (зарывающихся в грунт) для проведения токсикологических опытов используются хирономиды. Хирономус дорзалис (Chironomus dorsalis Meig.) относится к широко распространенному семейству хирономид, личинки темно-красного цвета обитают в иле стоячих водных объектов, где строят в грунте трубчатые домики. Окукливание наступает чаще всего на 12 - 13-е сутки. Перед окукливанием личинки перестают питаться, теряют активность. Стадия куколки длится 2 - 3 суток. В конце этой стадии куколки из олигофотных становятся полифотными, покидают грунт и всплывают к поверхности воды, где происходит вылупление комаров из кукольной шкурки через ее разрыв на дорсальной стороне груди. Общая продолжительность жизни комаров 3 - 5 суток. В течение этого времени ни самцы, ни самки не питаются. После выклева из яиц личинки покидают кладку и плавают в воде, через несколько дней они оседают на грунт, переходя к донному образу жизни. Их дальнейшие рост и развитие определяются в основном условиями питания, дыхания, качеством грунта, температурным режимом, плотностью популяции и некоторыми другими факторами.
5.2.2 Условия лабораторного содержания
Хирономиды легко поддаются культивированию в искусственных условиях, и их личинки служат важным кормовым объектом.
При содержании мотыля в искусственных условиях создание и поддержание маточного роя комаров нужной численности осуществляется по той же методике, что и выращивание личинок. Разница состоит лишь в том, что их не отбирают на опыт, а дают им возможность закончить метаморфоз.
Устройство для выведения хирономид (хирономидник) представляет собой деревянный каркас, обтянутый марлей. Комната, где расположен хирономидник, должна быть достаточно светлой, высота хирономидника должна быть не менее 2,5 - 3 м. Поскольку взрослые комары не питаются, содержание маточного роя заключается в контроле за водным режимом в кюветах, в кормлении растущих личинок и в соблюдении чистоты воздуха (недопустимо наличие дыма, запаха нефтепродуктов, красок и т.п.).
Яйца, откладываемые комарами, собирают, и 20 - 30 % их идет на воспроизводство маточного роя, остальная часть используется в качестве посадочного материала для токсикологических опытов. Яйцекладки можно вносить сразу на поверхность ила, однако лучшие результаты получают, используя их предварительное выдерживание в чистой воде до массового выклева личинок. Для постановки опытов выклюнувшуюся молодь выращивают в выростных кюветах до размеров 3 - 4 мм. В качестве корма используют сухие белковые дрожжи.
Для культивирования удобнее использовать фотографические кюветы высотой 2,5 - 3 см со сторонами размером 13×16 см. Кюветы размещают в несколько ярусов на деревянном или металлическом стеллаже в хирономиднике. Просвет между стенками кювет, расположенных на стеллаже по вертикали одна над другой, составляет 10 - 15 см, число ярусов - 7 - 15 см в зависимости от высоты хирономидника.
Наиболее целесообразно выращивание личинок на "тонком" речном иле, накапливающемся на участках с затишным течением. Желательно, чтобы слой ила был толщиной 12 - 15 мм. Хороший результат дает уменьшение водного слоя вплоть до его полного исчезновения. Лучше выращивать личинок во влажном грунте, периодически обрызгиваемом водой во избежание подсыхания. При поддержании комнатной температуры культивирование мотыля может идти круглогодично.
Личинок выращивают в кюветах, заполненных наполовину сметанообразной массой смеси ила с водой. Качество прудового или речного ила может быть улучшено его прогреванием до температуры 50 - 60 °С, обуславливающим уничтожение организмов, которые могут оказаться хищными по отношению к разводимым личинкам (личинки жуков, стрекоз, другие виды хирономид).
После отстаивания грунтовой массы, налитой в кюветы (4 - 5 ч), вносят кладки, предварительно выдержанные в чистой воде до выхода первых личинок из слизи. На 1 м поверхности вносится примерно 100 - 150 кладок. Яйцекладки нужно распределять равномерно во избежание их заглубления в грунт. При температуре 18 - 20 °С сухие белковые дрожжи в виде порошка двукратно распыляют по поверхности грунта из расчета 30 - 40 г/м. При температуре выше 18 - 20 °С единовременное внесение большого количества корма может привести к интенсивному развитию гнилостных процессов с выделением метана и сероводорода. В связи с этим лучше вносить корм каждые 3 - 4 суток, причем вносимую порцию необходимо увеличивать соответственно росту личинок. Последнюю порцию корма вносят за 2 - 3 суток до отбора личинок.
Для получения яиц в маточном помещении устанавливают стеклянные кюветы или кристаллизаторы высотой 5 - 10 см и площадью 400 - 1600 см2 и наливают в них чистую воду толщиной слоя 2 - 3 см. Ежедневно (лучше в середине дня, чтобы не мешать роению) выбирают яйцекладки пинцетом выше уреза воды, где они прикрепляются. Затем кристаллизаторы ополаскивают для удаления обрывков кладок и заполняют чистой водой. Один-два раза в месяц кюветы и кристаллизаторы рекомендуется протирать спиртом.
5.2.3 Проведение исследований
Эксперименты на хирономидах можно проводить в трех вариантах:
а) в чашках Петри или Коха с регулярной заменой среды;
б) в циркуляционных устройствах;
в) в проточных установках.
В опытах с осуществлением проточности установка представляет собой два расположенных один над другим сосуда, между которыми находятся чашка Петри с подопытными организмами (10 экземпляров в чашке).
Соответствующие концентрации токсичного вещества, введенные в верхний сосуд, по каплям проходят через чашки, стекая в нижний сосуд. Таким образом обеспечиваются проточность и аэрация.
Выбор концентраций определяется токсичностью того или иного вещества. Опытные растворы готовят на дехлорированной воде и меняют раз в двое суток. Нестойкие токсичные вещества необходимо менять каждый день. Объем 2 дм3 в проточной установке обеспечивает подачу опытной жидкости в течение 10 - 12 ч, после чего ее снова переливают в верхние сосуды. Температуру измеряют три раза в день.
Растертые в порошок и просеянные через сито № 27 белковые дрожжи замачивают в воде до получения густой массы, затем вносят в опытную чашку стеклянной палочкой. Масса, опущенная на конце стеклянной палочки, располагается под водой в опытной чашке в форме кружков диаметром 6 - 8 мм. Десяти маленьким личинкам в начале опыта хватает 3 - 4 кружков. По мере роста личинок количество корма, вносимого в опытные чашки, увеличивают.
С начала окукливания кормление сводится к минимуму, а к моменту вылета имаго совсем прекращается. Дрожжи используются хирономидами и как строительный материал для домиков. Разведенные дрожжи на протяжении всего опыта хранят в холодном месте.
Острые опыты проводят без добавления грунта в течение 10 - 15 суток. Длительность хронических опытов от III стадии личинки (длиной 3 - 4 мм) до вылета имаго составляет около 30 суток.
Вначале отбирают одну из кладок хирономид (в ней до 200 яиц) в кристаллизатор с водой. После вылупления личинок их подращивают на иле до определенного размера (3 - 4 мм) и затем сифоном со стеклянной трубочкой осторожно отбирают по 10 экземпляров на опытную чашку. В течение двух суток они обживают опытные площади (чашки), строят домики из дрожжей, вносимых заранее. Слабых особей заменяют новыми из той же одновозрастной популяции. К концу вторых суток личинки подрастают до 3-й стадии (4 - 5 мм). Перед опытом воду из опытной чашки отсасывают сифоном вместе с остатками корма и заменяют раствором определенной концентрации. Опытную жидкость следует менять по возможности быстро, чтобы куколки и личинки не обсыхали. После очистки опытную чашку наполняют на 2/3 жидкостью и только затем вносят корм. Каждая концентрация испытывается в трех повторностях.
5.2.4 Учет и анализ результатов
При проведении токсикологических опытов регистрируются следующие показатели:
основные:
а) выживаемость личинок;
б) сроки их окукливания;
в) сроки и процент вылетевших комаров;
г) процент уродливых особей.
дополнительные:
а) окраска личинок;
б) их поведенческие реакции;
в) вес;
г) активность имаго.
Среди погибших имаго встречаются насекомые, которые не смогли высвободиться из экзувия или при выходе из него повредили конечности или крылья. Часто встречаются имаго с уродствами, обусловленными действием токсических веществ, в частности кровоизлиянием в области брюшка, крыльев или общим кровоизлиянием. Такие экземпляры с трудом высвобождаются из экзувия. При выходе они еще больше раздуваются, происходит выпячивание отдельных участков тела между хитиновыми пластинками в области брюшка с последующим их разрывом.
У некоторых особей под действием токсичных веществ кишечник выпадает наружу. Вес личинок регистрируется на 7-е и 10-е сутки опыта.
Наблюдения за организмами ведутся ежедневно. Дрожжевые домики вскоре становятся непроницаемыми, и наблюдения ведутся в основном за пораженными особями, которые обычно остаются в домиках. Особое внимание обращают на форму домиков, поведение организмов, окраску тела, стадию, готовность к линьке и окукливанию, наполнение кишечника. Погибших особей измеряют и рассматривают под бинокуляром.
Размеры живых зрелых куколок и имаго в опыте и контроле можно оценивать визуально. Здоровые особи, как правило, не покидают домиков даже на небольшой срок. Сравнивают линейные размеры погибших особей с их первоначальной длиной и имеющимися в литературе нормативами роста для хирономид.
Для оценки острого летального действия можно использовать два способа:
а) определение концентраций, вызывающих гибель за определенный срок 50 % особей, взятых в опыт;
б) определение медианного летального времени для ряда концентраций, а по форме кривой - границы между остролетальными и хронически летальными концентрациями.
В течение длительных опытов учитывают и основные, и дополнительные показатели, указанные выше. Выживаемость всех стадий выражают в процентах с поправкой по Абботу. Личинок взвешивают на торзионных весах на 7-е и 10-е сутки опыта. Удельный прирост биомассы определяют по формуле:
Р = [(Ркон - Рнач) / Рнач]·100,
где: Рнач и Ркон - вес в начале и в конце опыта соответственно.
Личинок после взвешивания в опыте не используют из-за травмирования, а эксперименты продолжаются с особями двух других линий той же популяции.
Регистрируют сроки вылета насекомых (в сутках) и проводят статистическую обработку данных.
По окончании опыта все полученные данные сводят в таблицу согласно форме 7.
Форма 7
|
Оценка токсического действия вещества на хирономид (среднее 00 из трех повторностей)
Примечание: С - концентрация вещества |
|||||||||||||||||||||||||||||||||||||||||||||||||||
6. Установление максимальной допустимой концентрации вещества для рыб
Рыбы (наряду с водными млекопитающими) находятся в области конечного звена трофической цепи водных экосистем и включают две трофические группы - мирных и хищных видов рыб, из которых хищники занимают высшее звено по сравнению с мирными.
Определение ПДК веществ на ранних стадиях эмбриогенеза и на взрослых рыбах важно с двух точек зрения - установления опасности вещества для существования популяции рыб в водном объекте и угрозы здоровью человека при употреблении их в пищу.
Эти особенности рыб учитываются при выборе тест-объектов, установлении параметров и критериев токсичности, кумулятивных свойств, патологических изменений и отдаленных последствий действия исследуемых веществ.
Для определения наиболее чувствительных (уязвимых) звеньев среди разных групп рыб, параметры токсичности следует определять на наиболее чувствительных к веществу видах и возрастных группах, кумулятивные эффекты и поиск наиболее чувствительных физиолого-биохимических показателей - на средне- и малочувствительных.
Выделяют три группы рыб, обладающих разной чувствительностью по отношению к большому числу токсических веществ.
а) высокочувствительные - все виды лососевых, а также голец, судак, плотва, пескарь, верховка;
б) среднечувствительные - голавль (возраст 1+), гольян, лещ, окунь, красноперка;
в) малочувствительные - голавль (возраст 2+ и старше), карп, карась.
Целесообразно использовать виды рыб, широко распространенные в местных водных объектах и хорошо переносящие содержание в лабораторных условиях.
6.1. Эмбрионы и личинки рыб
6.1.1. Вводные замечания
Контролируются эмбриональное развитие рыб в исследуемой воде, выклев свободных эмбрионов (предличинок) и выживаемость предличинок после выклева. Из литературных источников и из опыта нормирования известно, что эмбрионы рыб и предличинки более чувствительны к токсическому воздействию по сравнению со взрослыми особями.
В настоящих Методических указаниях описан порядок работы с аквариумной рыбкой данио рерио, но наряду с этим видом могут быть использованы вьюн, осетр, форель и др.
6.1.2. Характеристика тест-объекта
В качестве тест-объекта для определения ПДК вещества по эмбриональному развитию удобно использовать икромечущую аквариумную рыбу данио Brachydanio rerio (Hamilton-Buchanan), поскольку материал для исследования можно получать в течение всего года, независимо от периодичности работы рыбоводных заводов. В природе данио обитает в медленно текущих водных объектах Юго-Восточной Азии. Длина взрослых рыб до 4,5 см. Тело цилиндрической формы, серебристое с 7 - 9 темно-синими горизонтальными полосами. Полосы идут к хвостовому и анальному плавникам. Спина окрашена в оливково-зеленый цвет.
6.1.3. Условия лабораторного содержания
Для содержания рыб-производителей могут быть использованы аквариумы объемом от 25 дм3, заполненные отстоянной водопроводной водой с температурой 22 °С. Для кормления может быть использован сухой корм, но при подготовке к нересту необходимы живые корма (дафния, циклоп, мотыль, отмытый трубочник).
Для получения икры самок и самцов отделяют друг от друга и кормят живым кормом. Плотность посадки рыб в этот период не отличается от обычного содержания. В конце второй недели самцы приобретают густой золотистый блеск, а брюшко самок значительно увеличивается в объеме за счет икры. Наиболее подготовленных к нересту рыб отлавливают и помещают в нерестовый аквариум.
Нерестовый аквариум наполняют свежей отстоянной водой с жесткостью не более 4,0 мг экв/л, с температурой около 27 °С и рН 6,8 - 6,9. В аквариум должна быть помещена сетка с ячеями 3 мм, которая служит для предохранения от поедания икры и личинок рыб взрослыми рыбами. Отложенная оплодотворенная икра опускается на дно, проходит сквозь сетку и становится недоступной для рыб. При размещении сетки следят, чтобы над сеткой осталось не менее одного литра воды для плавания производителей.
В нерестовый аквариум утром помещают самок и кормят сухим кормом, а вечером в этот же аквариум помещают по 2 - 3 самца на каждую самку, еще раз кормят всех рыб, а затем выключают свет. Стимулом к нересту служит утреннее включение света.
Обычно выклев у данио завершается через 48 ч после нереста, а еще через 48 ч предличинки начинают переходить на активное питание и становятся личинками. Переход предличинок на активное питание завершает данный этап исследований.
6.1.4. Проведение исследований
Для определения ПДК вещества на эмбрионах и личинках рыб ведут наблюдение за эмбриональным развитием данио и выклевом предличинок в контроле и исследуемых концентрациях веществ. После нереста взрослых рыб отсаживают, а оплодотворенные икринки помещают в чашки Петри. В каждую чашку с отстоянной водой (контроль) и с исследуемыми растворами помещают по 10 икринок. Концентрации исследуемого вещества готовят с шагом либо на порядок, либо в арифметической прогрессии, ориентируясь на максимальные допустимые концентрации вещества, полученные в опытах на других организмах. Исследование каждой концентрации проводится в трехкратной повторности.
Выклюнувшиеся предличинки помещаются по 10 штук в контрольную и тестируемую воду. Наблюдение ведется, как и в первом случае, в чашках Петри, которые должны находиться в термостатируемых условиях. Длительность эксперимента определяется переходом личинок на активное питание.
6.1.5. Учет и анализ результатов
Основными показателями токсичности вещества являются выживаемость эмбрионов и личинок, морфометрические параметры, тератологический анализ. В качестве дополнительных показателей эмбриотоксикологической оценки влияния исследуемых, веществ могут служить биохимические исследования (например, липидный и белковый обмен у эмбрионов и предличинок рыб).
В опытах через каждые 6 ч учитывают состояние тест-объекта и ход выклева. Учитывается оплодотворение икры, а также гибель и морфологические изменения у эмбрионов в процентах по отношению к контролю.
Процент оплодотворения выявляется уже через сутки после нереста. Неоплодотворенные икринки белеют и легко отличаются от нормально развивающихся, которые остаются прозрачными.
Становятся белыми также и погибшие эмбрионы вследствие коагулирования белка. Гибель эмбрионов бывает наибольшей в начале и в конце эмбрионального периода. Выклев - наиболее чувствительный и важный этап, завершающий эмбриональное развитие у рыб. Эмбрионы, достигшие стадии выклева, в результате действия токсичного агента часто оказываются неспособными выйти из оболочек и погибают. Важным показателем является распределение выклева на весь период эмбрионального развития. Если под влиянием токсикантов нарушается эмбриональное развитие, то максимум выклева смещается по сравнению с контролем или растягивается во времени.
Морфометрические исследования лучше всего проводить на выклюнувшихся предличинках. У эмбрионов вредные воздействия веществ могут вызывать морфологические изменения, которые, служат в качестве интегрального показателя эффекта действия вещества. Появление уродств свидетельствует о тератогенном действии. Уродливые эмбрионы, погибшие во время эмбрионального развития, включаются в число погибшей икры, а средний процент уродств подсчитывается после выклева и прохождения стадий предличинки.
Личинки, которые способны нормально плавать и переходят на активное питание, считаются выжившими. Нормальными считаются особи, не имеющие морфологических отклонений и не отличающиеся размерами от контрольных.
В качестве максимальной допустимой концентрации вещества для ранних стадий онтогенеза рыб принимается максимальная концентрация, не вызывающая статистически достоверного повышения смертности эмбрионов и личинок, увеличения числа особей с дефектами развития или отставания личинок в размерах и темпах развития.
6.2. Мальки и взрослые рыбы
6.2.1. Характеристика тест-объекта
В экспериментах используются мальки, сеголетки, годовики отдельных видов рыб с разной чувствительностью (п. 6 Приложения 2 к настоящим Методическим указаниям). При отсутствии достаточного количества промысловых рыб и условий их содержания, целесообразно проводить опыты на "сорных" рыбах с высокой и средней чувствительностью к токсическим веществам, например верховках и пескарях, а также использовать аквариумных рыбок, например данио. Выбор других рыб в качестве тесторганизмов должен быть обоснован литературными и экспериментальными данными.
6.2.2. Условия лабораторного содержания
Для исследований подбирают некрупных одноразмерных рыб в хорошем физиологическом состоянии из водных объектов Рыб транспортируют на специально оборудованном транспорте с регулируемой подачей кислорода. При длительных перевозках необходим постоянный контроль за кислородным режимом и температурой воды, так как при резких перепадах гидрохимических показателей возможна значительная гибель перевозимой рыбы. При кратковременных перевозках можно использовать молочные бидоны или полиэтиленовые мешки, не допуская травмирования рыбы и резкого снижения содержания кислорода в воде.
В аквариальных условиях привезенную рыбу рассаживают в специально оборудованные проточные лотки, ванны или бассейны. Вода в данных емкостях должна быть одинаковой температуры с температурой воды в перевозимых емкостях.
При содержании рыб необходимо поддерживать оптимальный водообмен в емкостях из расчета 1 - 1,5 м3 воды в сутки на 1 кг лососевых рыб и 0,5 - 1 м3 на 1 кг карповых рыб. Если нет условий для осуществления постоянного протока воды, необходимо проводить смену ее в емкостях с рыбой, исходя из содержания кислорода в воде. Для лососевых рыб содержание растворенного кислорода в воде должно быть не ниже 9,5 - 10,5 мг/дм3, а для карповых - не менее 6 - 8 мг/дм3.
После помещения рыб в емкости, в течение 10 дней (при постепенной адаптации рыб к аквариальным условиям) проводят контроль за температурой и кислородом в емкостях, проводя измерения два раза в день. Для обогащения воды кислородом рекомендуется применять принудительную аэрацию, а для повышения до необходимого уровня температуры - аквариумные водонагреватели с датчиками.
Для кормления рыб используют пастообразные, гранулированные или живые корма из расчета от 0,8 до 5 % к весу тела рыб. Емкости, используемые для содержания рыб, необходимо ежедневно очищать от скапливающихся остатков корма и фекальных масс. Помещение аквариальной должно быть оборудовано стеллажами с аквариумами или ваннами.
Из другого оборудования необходимо иметь:
холодильные установки для хранения корма и реактивов;
весы аналитические с разновесами;
весы аптекарские (чашечные и ручные);
микроскоп биологический, обеспечивающий увеличение в 100 - 200 раз;
лупу;
электромешалку;
вентиляторы;
ведра эмалированные;
бидоны;
тазы и кюветы разных размеров;
фотоаппарат;
сачки разноячейные;
покрытия из мелкоячейной сети, газа или дели для емкостей с рыбой;
микрокомпрессоры;
аквариумные водонагреватели с датчиками;
скальпели, пинцеты, ножницы, шприцы на 1 - 20 мл, инъекционные иглы;
секундомер, линейки;
набор инструментов и реактивов для исследования крови;
стеклянную посуду емкостью от 0,1 до 3 л, мерные пипетки, глазные пипетки, бюретки, мерные стаканы, колбы, чашки Петри, стеклянные трубки и палочки;
резиновые шланги разного диаметра и длины, резиновые груши;
полиэтиленовую пленку, клеенку, марлю, халаты, резиновые фартуки, сапоги и перчатки;
карандаши по стеклу, лейкопластырь, фиксирующие и дезинфицирующие жидкости;
журналы для записей и прочие необходимые материалы и инструменты.
6.2.3. Проведение исследований
Перед началом экспериментов рыб помещают в аквариумы или другие экспериментальные емкости на 7 - 10 суток с целью адаптации к новым условиям. Опыты проводят на двух-трех видах рыб из различных семейств (желательно хищных и мирных) и выявляют рыб с высокой чувствительностью к токсиканту путем определения ЛК0, ЛК50 и ЛК100 в острых опытах длительностью 96 ч. Хронические опыты начинают с концентрации, равной 1/2 ЛК50 за 96 ч, и создают токсикологический ряд из 5 - 10 убывающих концентраций вещества с множителем 1/2. Длительность хронических опытов составляет 1 - 3 месяца. В зависимости от стабильности исследуемого вещества в воде.
Эксперименты проводят в стеклянных аквариумах или пластмассовых ваннах емкостью 20 - 40 дм3 в двукратной повторности с использованием 6 - 10 особей в каждой концентрации вещества. Два аквариума служат контролем.
Норма посадки молоди, сеголеток и годовиков лососевых и сиговых рыб в экспериментальные емкости для проведения опытов должна быть не более 1 г ихтиомассы на 1 дм3 воды в сутки. Для рыб возрастом более года, а также для карповых рыб, эта величина составляет не более 3 г на 1 дм3 воды в сутки.
Взвешивание рыб производят перед началом опытов, затем через каждые 10 - 15 суток до их окончания. Для этого на весы ставят сосуд емкостью 2 - 2,5 дм3, в который наливают 0,5 - 1 дм3 воды и уравновешивают его с помощью гирь или другого сосуда с водой. Затем отловленных сачком рыб быстро помещают в сосуд с водой для взвешивания, предварительно осушив низ сачка от избытка влаги марлей. Мальков взвешивают с помощью химических стаканов на аптекарских или других более точных весах.
Для опытов используется незагрязненная вода из природных водных объектов или водопроводная дехлорированная вода, отстоянная в течение трех суток. Ежедневно измеряется температура воды, и один раз в 10 суток проводятся гидрохимические исследования за содержанием растворенного в воде кислорода и рН.
В зависимости от стабильности исследуемого вещества смену воды в опытных емкостях проводят один раз в 1 - 3-е суток, спустя 1,5 - 2 ч после кормления рыб. При этом недопустимо травмирование рыб. Аэрация воды возможна лишь в тех случаях, когда состав и концентрация исследуемого вещества не изменяются. Толщина слоя воды в аквариуме для сеголеток и годовиков должна быть не менее 20 см, для более крупных рыб ее следует увеличивать.
В аквариумах должна постоянно поддерживаться оптимальная для исследуемого вида температура воды.
При кормлении необходимо учитывать видовые и возрастные особенности питания рыб. Используют рыбные комбикорма, говяжью и свиную селезенку в смеси с комбикормами, а также живые корма - дафнии, хирономиды, гаммарусы и др.
Схема и динамика проведения опытов, учет регистрируемых показателей ведется в лабораторном журнале.
Опыты по определению параметров острой и хронической токсичности веществ, по установлению коэффициентов кумуляции ставят на мальках или сеголетках. После этого ставят острые и хронические опыты на сеголетках или двухлетках для определения их токсичности по физиолого-биохимическим показателям, используя среднесмертельные, максимально переносимые и более низкие концентрации для установления пороговых.
6.2.4. Учет и анализ результатов
6.2.4.1. Выживаемость рыб определяется путем систематического учета живых и погибших рыб на протяжении всего опыта (в острых опытах через 24, 48 и 96 ч, в хронических - через 5, 10 и далее через каждые 10 суток опыта). Полученные данные обобщают и выражают в абсолютных и процентных величинах. Устанавливают границы выживания рыб в зависимости от концентрации вещества и времени его воздействия на организм. Находят переносимую концентрацию вещества, которая не вызывает гибели рыб.
6.2.4.2. Прирост или снижение ихтиомассы устанавливают на основе данных периодического взвешивания рыб в хроническом опыте (каждые 10 суток). Этот показатель выражают в процентах от начальной массы или индивидуально.
6.2.4.3. Клиническую картину (симптомы отравления) оценивают по изменению поведения рыб в водной среде и реакции на внешние раздражители путем периодического осмотра их в опыте. Изменение поведения и местонахождения рыб в воде может свидетельствовать о поражении многих систем организма.
С повышением токсичности вещества чаще наблюдается тенденция к подъему рыб в поверхностные слои при наличии возбуждения или общего угнетения, дискоординации движений, расстройств дыхания и других патологических признаков. Незадолго до гибели большая часть рыб опускается на дно.
При отравлениях реакции рыб на внешние раздражители могут усиливаться, ослабевать или полностью исчезать. В качестве раздражителей при проведении токсикологических исследований можно использовать стук по стенкам аквариума, включение и выключение света, всплеск воды в аквариуме, прикосновение сачком или стеклянной палочкой к телу рыб, искусственно создаваемый ток жидкости путем слива или слабого вращения воды при помощи лопаточки и другие приспособления.
Несмотря на некоторые различия в развитии процесса отравления рыб ядами, как правило, наблюдают следующие стадии интоксикации - начало беспокойства (учащение дыхательного ритма, беспокойное дыхание, отставление плавников), первые признаки расстройства чувствительности (судорожное дыхание, поднятие лучей плавников, неполное закрытие рта), усиление раздражимости (стремительное плавание или неподвижность, сильная реакция на внешние раздражители или полное ее отсутствие), первое расстройство координации движений (кратковременное опрокидывание на бок или на спину, кружение вокруг продольной оси тела, толчкообразные движения), полная потеря равновесия (стабильное изменение положения тела, плавание на боку, вверх брюшком по кругу и штопорообразно, дрожание мышц и плавников, судороги тела), агония (опускание на дно аквариума, удушье, паралич). Все эти признаки регистрируют через 24, 48 и 96 ч в острых опытах и через 5, 10 и далее через каждые 10 суток в хронических опытах. Выявляют концентрацию вещества, при которой не проявляются внешние признаки интоксикации.
На основании сачковой пробы оценивают резервную силу, организма рыб по времени трепетания на сачке. Отловленных взрослых рыб из растворов с разными концентрациями вещества помещают на плоскодонный сачок и регистрируют время прекращения трепетания, оценивают характер и силу движений. Полученные данные сравнивают с результатами, полученными на рыбах из контрольных аквариумов, а в естественных условиях - из незагрязненных водных объектов или контрольных участков. При острых, подострых и хронических токсикозах всегда отмечается резкое сокращение времени трепетания рыб. Полученные результаты сводят в таблицы, подвергают статистической обработке и по графической зависимости времени трепетания от концентрации вещества устанавливают пороговую и недействующую концентрации.
6.2.4.4. Характер питания зависит от вида рыб и от особенности поедания корма. Хищные рыбы (радужная форель, лосось и др.) активно набрасываются на корм, стараясь поймать его на лету у поверхности воды. Мирные рыбы (карп, сазан) корм берут спокойно, заглатывая его в толще воды или собирая на дне аквариума. При отравлениях эти реакции угнетаются или полностью подавляются. При явных признаках интоксикации рыбы полностью отказываются от корма. В конце экспериментов устанавливается концентрация раствора, при которой не происходит нарушения рефлекса питания.
6.2.4.5. Характер и частота дыхания. Наблюдения ведутся через 24, 48 и 96 ч в острых опытах и через 5, 10 и далее через каждые 10 суток в хронических опытах путем оценки силы, частоты и ритма дыхательных движений жаберных крышек с помощью секундомера по отношению к контролю в течение 1 - 10 минут. Нормальное дыхание у рыб характеризуется спокойными, ритмичными, умеренной силы (амплитуда) и частоты колебательными движениями жаберных крышек. Норма устанавливается в каждом конкретном случае на здоровых рыбах. При отравлениях можно наблюдать различные расстройства дыхания, в том числе резкое учащение колебательных движений жаберных крышек, беспорядочное дрожание жабр с последующей остановкой дыхания, периодическое прекращение и возобновление учащенных или замедленных дыхательных движений с увеличенной или уменьшенной амплитудой колебательных движений жаберных крышек.
6.2.4.6. Внешний вид (состояние кожных покровов, плавников, органов зрения). Хорошее состояние рыб характеризуется энергичностью, округлостью спины, упругостью мышц, полным упругим животом с наличием полостного жира во внутренних органах при нормальном состоянии печени. Истощенные рыбы характеризуются как вялые, пассивные, с опавшей и заостренной спиной, запавшими глазами, подтянутым животом, мягкой мускулатурой, истонченной брюшной стенкой и отсутствием полостного жира на внутренних органах. Состояние отдельных органов и систем организма оценивают в конце опыта и у погибших рыб в течение эксперимента общими методами исследования (вскрытие, осмотр, определение запаха, измерение, фотографирование и зарисовки). Используют также разнообразные специальные методы исследования (микроскопия, электрокардиография, рентгенография, запись дыхания и др.). При отравлениях могут быть обнаружены самые разнообразные изменения в органах и тканях рыб, которые в совокупности характеризуют особенности течения того или иного токсикологического процесса.
На коже часто обнаруживают изменения слизистого покрова, покраснения (гиперемия), кровоизлияния, новообразования (опухоли), рубцы, эрозии, язвы, ерошение и выпадение чешуи, появление налетов и выделение слизи. Аналогичные изменения возникают на плавниках, которые иногда деформируются и разрушаются вплоть до оголения лучей. Мускулатура рыб при отравлениях может стать дряблой, водянистой, тургор ослабляется, при надавливании пальцем обнаруживается медленно выправляющаяся вмятина. Нередко наблюдаются парезы, параличи, уплотнение или расслабление отдельных групп мышц головы, туловища и хвостового стебля с соответствующими искривлениями тела. Глаза больных рыб застланы пеленой, тусклые, помутневшие, с бледным рисунком. Иногда обнаруживаются пучеглазие, кровенаполнение сосудов, кровоизлияние в переднюю, заднюю камеры и ткани глаз.
6.2.4.7. Состояние жаберного аппарата. Осмотр производится при жизни и после гибели рыб под водой и в воздушной среде. Рыб отлавливают, заворачивают в марлевую салфетку, отводят пальцем жаберную крышку в сторону и осматривают жабры визуально или с помощью лупы. Осмотр жабр под водой производится путем погружения рыбы на глубину 3 - 5 см, при этом многие патологические изменения гораздо лучше заметны, чем при осмотре в воздушной среде. В норме жабры полнокровные, ярко-красного цвета, чистые, жаберные лепестки ровные, лежат параллельно, соприкасаясь друг с другом, свободный край их образует ровный полукруг относительно жаберной дужки. При отравлениях рыб жабры приобретают различные оттенки - темно-вишневый, красный, бледно-красный, бледный желтовато-розовый, темно-бурый, сероватый и др. Жаберные лепестки набухают и лежат беспорядочно.
6.2.4.8. Патологоанатомическое вскрытие рыб проводится при гибели и обязательно после окончания опыта. Перед вскрытием рыб измеряют, взвешивают, фотографируют, изготавливают препараты. После вскрытия определяют цвет, запах, консистенцию, местоположение, деформацию, кровенаполнение, дегенерацию органов и тканей, а также наличие или отсутствие жировых отложений (по балльной системе). Отбирают материал для гистологических исследований при ЛК50, ЛК40 и предполагаемой пороговой концентрации.
6.2.4.9. Гистологические и гистохимические свидетельства поражения органов и тканей рыб могут наблюдаться и в отсутствие клинических симптомов интоксикации. Для исследований берут только свежий материал - от живых или находящихся в состоянии агонии рыб, либо от только что погибших особей. В хронических опытах фиксацию органов подопытных рыб следует производить в конце опытов. Для изучения воздействия токсических веществ гистологическому и гистохимическому исследованию подвергают жабры, печень, почки, желудочно-кишечный тракт, половые продукты, селезенку, поджелудочную и щитовидную железы, головной мозг, сердце, мышцы туловища, кожные покровы. Для сравнения обязательно фиксируют и исследуют органы и ткани контрольных рыб. После вскрытия рыбы материал немедленно фиксируется во избежание обезвоживания и деформации поверхностных слоев клеток. Толщина кусочков органов для фиксации должна быть не более 1 см, чтобы фиксирующая жидкость легко и быстро проникала в ткань. Сроки фиксации для разных фиксаторов различны, как правило, они тем короче, чем выше температура фиксатора. При использовании большинства фиксаторов наилучшие результаты дает длительная фиксация (3 - 5 минут) при температуре от 1 до 18 °С. Объем фиксирующей жидкости должен в 15 - 20 раз превышать объем фиксируемых кусочков. Мелкие органы фиксируются целиком, из крупных вырезают пластинки с таким расчетом, чтобы на гистологических препаратах были как нормальные, так и изменившиеся части органа. Во избежание разрушения внутренние органы рыхлой консистенции, особенно мелких рыб, фиксируют вместе с близлежащими тканями. Хорошими фиксаторами служат жидкость Буэна, 5 - 10 %-й нейтральный формалин, смесь спирта, формалина и уксусной кислоты, жидкость Карнуа. При оценке изменений описывают общую микроскопическую картину и данные гистохимических исследований (на гликоген, жир и др.). Морфологические изменения у рыб при воздействии токсических веществ не всегда являются строго специфическими для каждого яда, чаще всего по ним можно определить, к какой группе относится ядовитое вещество. Гистохимические реакции и электрономикроскопические исследования более чувствительны и позволяют точнее определить пороговую концентрацию.
6.2.4.10. Гематологические и биохимические показатели широко используются в ихтиопатологии, ветеринарии, медицине, в токсикогигиенических исследованиях. Они углубляют представление о динамике интоксикации организма гораздо раньше, чем появляются внешние признаки отравления рыб. Определяют следующие показатели: количество эритроцитов и лейкоцитов, эритроцитарные картины и морфология форменных элементов крови, размеры клеток крови, общий белок, активность пероксидазы (каталазы) или холинэстеразы.
Для взятия крови рыбу завертывают в марлевую салфетку. Место, откуда предполагают взятие крови, освобождают от слизи и избытка влаги ватно-марлевым тампоном. Пробы крови получают из жаберной вены путем введения тонко оттянутой пастеровской пипетки в жаберный сосуд нижней трети жаберной дужки, а также из сердца с помощью полой иглы или пастеровской пипетки. Место укола в сердце лежит в середине линии, соединяющей основание правого и левого грудных плавников. Иглу вводят в сердце под углом 45° относительно фронтальной плоскости тела рыб. Кровь можно также отобрать из хвостовой артерии после отрезания хвоста или с помощью полой иглы или пастеровской пипетки, погружая их на медиальной линии позади анального плавника под углом 45° до упора в позвоночник рыбы. Взятая кровь быстро свертывается, поэтому необходимо в возможно более короткий срок (40 - 50 секунд) взять максимальное количество проб на определение различных гематологических и биохимических показателей.
В качестве антикоагулянта применяют гепарин или лимоннокислый натрий в виде порошка или 3,8 % раствора, которым ополаскивают пробирки, или добавляют 1/4 часть раствора к объему крови. Для определения общего белка антикоагулянт не добавляют, а оставляют пробирки с кровью в теплом месте для отделения плазмы и получения сыворотки.
Отбор проб крови и анализ проводят в следующей последовательности:
а) берут кровь от рыб;
б) приготавливают мазок крови;
в) заряжают меланжер для количественного подсчета форменных элементов крови или отбирают пробы крови в пробирку с раствором хлористого натрия для определения количества эритроцитов фотоколориметрическим методом на эритрогемометре;
г) заряжают гемометр Сали для определения содержания гемоглобина крови или отбирают пробы крови для определения этого показателя на эритрогемометре;
д) определяют содержание гемоглобина в крови по методу Сали или на эритрогемометре;
е) подсчитывают число эритроцитов и лейкоцитов в камере Горяева или на эритрогемометре;
ж) фиксируют и окрашивают взятые мазки крови;
з) подсчитывают количество лейкоцитов и определяют эритроцитарные картины; -определяют общий белок сыворотки крови методом Лоури;
и) исследуют пероксидазную активность по методу Попова и Нейковска.
Приемы и методы гематологических анализов описаны в соответствующих руководствах (Кудрявцев А.А., Кудрявцев Л.А., Привольнов Т.И. Гематология животных и рыб. М.: Колос, 1969; Балаховский С.Д., Балаховский И.С. Методы химического анализа крови. М.: Медгиз, 1953).
Полученные результаты сводят в таблицы, подвергают статистической обработке и в соответствии с изменениями исследуемых показателей от концентраций вещества устанавливают пороговую и недействующую концентрации (ЛК16 и ЛК0) в хроническом эксперименте.
6.2.4.11. Органолептические свойства и вкусовые качества бульона и мяса рыб. После вскрытия и обследования по показателям, приведенным выше, рыб обмывают чистой питьевой водой, помещают в стаканы или колбы, заливают чистой питьевой водой в соотношении 5 частей воды на 1 часть рыбы и без добавления соли варят в течение 5 - 10 мин на слабом огне. После охлаждения до комнатной температуры у сваренных контрольных и опытных рыб вырезают кусочки спинных мышц весом 0,2 - 0,5 г (в зависимости от веса рыбы). Кусочки мяса помещают в рыбный бульон, разлитый по нумерованным чашкам Петри. Порядок нумерации чашек Петри с контрольными и подопытными рыбами оглашается дегустаторам только после окончания дегустации. Для проведения дегустации приглашается 3 - 5 человек. Испытатели отмечают цвет бульона, присутствие или отсутствие постороннего запаха, а затем цвет и присутствие или отсутствие постороннего запаха мяса рыб.
После этого определяют вкусовые качества мяса рыб и наличие постороннего привкуса. В норме вкус мяса рыб сладковатый. После дегустации образец продукта выбрасывают в банку, полость рта ополаскивают питьевой водой. Результаты дегустации испытатель вносит, не оглашая, в таблицу по форме 8.
Форма 8
|
Запись результатов органолептических исследований
|
|||||||||||||||||||||||
Обобщая дегустационные таблицы, испытатель делает заключение о наибольшей концентрации вещества, которая, по данным большинства дегустаторов, не вызывает изменений органолептических свойств бульона и мяса, вкусовых качеств мяса рыб.
6.2.4.12. Кумулятивные свойства (материальная и функциональная кумуляции) химических веществ на рыбах определяются по нижеописанной схеме в соответствии с Методическими указаниями по разработке предельно допустимых концентраций пестицидов в воде рыбохозяйственных водоемов. (Минрыбхоз СССР введены в действие от 19 января 1979 г. № 08-3/178 "Методическими указаниями по разработке предельно допустимых концентраций пестицидов в воде рыбохозяйственных водоемов". Ростов-на-Дону, 1979)
а. Оценка накопления вещества в рыбах (материальная кумуляция вещества) проводится минимум при двух концентрациях. Опыты ставят по методике проведения хронического эксперимента длительностью не менее 30 суток (или используют для анализа рыб из проводимого хронического эксперимента). В течение этого периода через каждые 5 суток (5, 10, 20, 25, 30-е) отбирают особей для оценки содержания вещества в органах и тканях опытных и контрольных рыб, которые до окончания эксперимента можно хранить в холодильнике. Из 6 отобранных проб эффект накопления можно предварительно оценить в пробе, отобранной на 30-е сутки. Если при этом концентрация вещества в рыбе превышает концентрацию в исследуемой воде, проводится анализ всех проб, если не превышает - аналитическое исследование остальных проб можно не проводить.
Для количественной оценки материальной кумуляции используют коэффициент накопления (Кн), который представляет собой отношение максимального содержания вещества в организме рыб (мг/кг) к его концентрации в воде (мг/л).
В зависимости от величины коэффициента материального накопления (Кн) вещество по классификации К.К. Врочинского (Таблица 6.2.1.) относят к соответствующей группе с коэффициентом запаса (Кзн).
Таблица 6.2.1
Классификация веществ по степени накопления их в организмах
|
Группа |
Степень накопления вещества |
Коэффициент накопления (Кн) |
Коэффициент запаса (Кзн) |
|
1 |
Слабая |
50 |
1 |
|
2 |
Умеренная |
51 - 200 |
2 |
|
3 |
Высокая |
201 - 1000 |
4 |
|
4 |
Сверхвысокая |
> 1000 |
16 |
б. Оценка функциональной кумуляции вещества проводится для характеристики возможного перехода материальной кумуляции вещества в токсический эффект в хроническом эксперименте (накопление токсического эффекта при воздействии вещества на организм).
Для оценки функциональной кумуляции вещества, после расчета параметров острой и хронической токсичности по каждому биологическому объекту (икра, личинки, молодь, взрослые рыбы), рассчитывают характеристику опасности развивающегося токсического эффекта по отношению вероятностных смертельных концентраций. Наиболее полно отмечаемое явление характеризуется фактором угла наклона "доза - эффект" (S):
![]()
Оценка кумулятивного действия вещества проводится по коэффициенту функциональной кумуляции (Ккум), который определяется отношением острой среднелетальной концентрации, умноженной на фактор утла "доза - эффект", к хронической среднелетальной концентрации, умноженной на свой фактор:
![]()
Таблица 6.2.2
Оценка веществ по коэффициенту функциональной кумуляции (Ккум)
|
Степень кумуляции |
Коэффициент
кумуляции |
Коэффициент запаса (Кзкум) |
|
Слабая |
1 - 50 |
1 |
|
Умеренная |
51 - 200 |
5 |
|
Выраженная |
201 - 1000 |
10 |
|
Высокая |
1000 |
20 |
В зависимости от величины коэффициента функциональной кумуляции вещество относят к одной из четырех групп (Таблица 6.2.2), каждой из которых соответствует определенный коэффициент запаса (Кзкум).
Кумулятивные коэффициенты запаса по степени накопления вещества в организмах (Кзн) и по степени накопления токсического эффекта (Кзкум) используются при расчете ПДК для пестицидов (п. 3.1.4 Приложения 1 к настоящим Методическим указаниям). Коэффициент материальной кумуляции (Кн) используется при установлении класса опасности вещества (п. 1.1 Приложения 1 к настоящим Методическим указаниям).
6.2.4.13. Токсикологическая оценка исследованного вещества. При токсикологической оценке вещества в качестве обязательных используются наиболее общие показатели и признаки отравления рыб. По ним устанавливают максимальные допустимые концентрации испытуемого вещества, то есть концентрации, которые в хроническом опыте не вызывают никаких отклонений исследуемых показателей от контроля. Максимальные допустимые концентрации, установленные по каждому обязательному показателю, вносят в сводную таблицу по форме 9.
Форма 9
|
Сводная таблица допустимых концентраций для рыб
|
В качестве максимальной допустимой концентрации вещества для взрослых рыб принимается наименьшая концентрация из допустимых, установленных по каждому обязательному показателю.
7. Оценка генотоксичности вещества
7.1. Вводные замечания
Генотоксичность вещества исследуется на генном, хромосомном или геномном уровне. По этим данным устанавливается его максимальная допустимая концентрация для рыбохозяйственных водных объектов по показателю "генотоксичность".
Для выявления мутаций на генном уровне рекомендуется тест Эймса.
Для выявления хромосомных аберраций в хроническом опыте проводят следующие исследования генетического аппарата на клетках различных тканей рыб:
а) учет частоты хромосомных аберраций и нарушений митотического аппарата деления клеток эпителия хрусталика на стадии анафазы и телофазы;
б) учет частоты хромосомных аберраций на стадии метафазы на жаберном эпителии;
в) учет частоты образования микроядер (микроядерный тест) в эритроцитах.
Оценка генотоксичности вещества по нарушению дифференциальной активности генов может проводиться на политенных хромосомах из слюнных желез хирономид.
В обязательную программу генетических исследований должно входить изучение генных мутаций и хромосомных аберраций одним из методов. Вы их выделили жирным шрифтом. При подозрении, что вещество воздействует на митотическую активность клеток и обладает канцерогенностью, необходимо провести дополнительно исследования по выявлению воздействия вещества на дифференциальную активность генов.
Исследуемые концентрации вещества в эксперименте должны укладываться в диапазон от пороговой концентрации (или ниже) до концентрации выше значения ПДК вещества в 5 раз.
7.2. Учет генных мутаций (тест Эймса)
7.2.1. Характеристика тест-объекта
Наиболее удобными, быстрыми и экономичными способами выявления мутагенной активности являются методы с использованием бактерий. Широкое применение находит тест-система с использованием бактерии сальмонелла тифимуриум (Salmonella typhimurium) (Таблица 7.2.1). Эти методы основаны на аналогичности генетических механизмов повреждения и репарации ДНК у клеток низших и высших организмов.
Таблица 7.2.1
Штаммы S. typhimurium, используемые для выявления мутагенной активности соединений
|
Штаммы |
Основная мутация в опероне |
Дополнительные мутации |
Наличие фактора |
Выявленный тип мутагенного эффекта |
|
ТА 1950 ТА 1535 |
his G 46 |
+ urvB |
- |
R-BPS |
|
ТА 100 |
his G 46 |
rfa urvB |
- |
R-BPS |
|
|
his G 46 |
rfa urvB |
pKM-101 |
R-BPS |
|
ТА 1534 ТА 1538 |
his D 3052 |
+ urvB |
- |
R-FS |
|
ТА 98 |
his D 3052 |
rfa urvB |
- |
R-FS |
|
|
his D 3052 |
rfa urvB |
pKM-101 |
R-FS |
|
ТА 97 |
his D 6610 |
rfa urvB |
pKM-101 |
R-FS |
|
ТА 102 |
his G 428 |
rfa + (PAO 1) |
pKM-101 |
R-BPS |
|
А 1537 |
his С 3076 |
rfa urvB |
- |
RPS |
Примечание: "+" - обозначение генов дикого типа; rfa - нарушение липополисахаридной капсулы; urvB - нарушение системы эксцизионной реакции; RPS - сдвиг рамки считывания; R-BPS - замена пар оснований.
Сущность использования системы "бактерии-микросомы" заключается в определении способности вещества или его метаболитов индуцировать генные мутации у подопытных штаммов. Если исследуемое вещество (или его метаболиты) обладают мутагенной активностью, то увеличивается количество колоний - ревертантов на чашку Петри в опыте по сравнению с контролем. Под влиянием мутагенных веществ у микроорганизмов - ревертантов происходят обратные мутации, и они приобретают способность жить на среде, лишенной гистидина или другой аминокислоты, по которой отобран тот или другой штамм.
Для выявления промутагенов производят микросомальную активацию, после которой промутагены проявляют мутагенные свойства. Методы приготовления микросомальных ферментов из гепатопан-креаса карпа или других рыб приводятся ниже.
При определении мутагенной активности веществ, нормируемых для воды рыбохозяйственных водных объектов, целесообразно использовать микросомы именно из тканей рыб, а не теплокровных животных, так как экстраполяция результатов, полученных с применением микросом печени теплокровных животных, не всегда оправдана при установлении ПДК веществ вследствие неадекватности протекания метаболических процессов у различных видов животных.
7.2.2. Проведение исследований
7.2.2.1. Оборудование:
бактерицидные облучатели;
центрифуги;
автоклавы;
термостаты;
размельчитель тканей;
водяные термостатирующие бани;
счетчик колоний;
весы;
сушильный шкаф;
дистиллятор.
Реактивы:
K2НРО4, лимоннокислый натрий, NADP (Rianal);
KН2РО4, MgCI2, биотин;
KCl, MgSO4, L-гистидин;
(NH4)2SO4, БСА, нитрозогуанидин;
Na2НРО4, глюкозо-6-фосфат, ДМСО.
|
Мутагены: |
Промутагены: |
|
бенз/а/пирен, |
2-ацетиламинофлуоредин, |
|
9-аминоакридин, |
2-аминофлуорен. |
|
Циклофосфамид; |
|
7.2.2.2. Приготовление минимальной среды (МС). МС готовят следующим образом. К 300 мл расплавленного агара (компонент 2) добавляют 100 мл солевого раствора (компонент 1), 10 мл 20 %-ного раствора глюкозы и 2,0 мл раствора MgSO4:
1. Компонент 1 (солевой раствор):
лимоннокислый натрий - 2,0 г,
K3РО4×3Н2О - 42,0 г,
KН2РО4 - 18,0 г,
(NH4)2SO4 - 4,0 г,
Н2О (дист.) - 1,0 дм3.
2. Компонент 2 (водный агар):
агар - 20,0 г; Н2О - 1,0 л.
3. 20 %-ный раствор глюкозы.
4. 1 %-ный раствор MgO×7Н2O.
5. Агар для верхнего слоя:
NaCl - 6,0 г,
Агар - 7,0 г,
Н2O - 10 дм3.
Компоненты 1, 2, 4 и 5 автоклавируют при 0,8 атм 30 мин. Затем на каждые 80 мл агара добавляют 10 мл L-гистидина (0,5 мм) и биотина (0,25 мМ) в виде стерильных растворов. В качестве полноценной среды (ПС) может использоваться любая среда для энтеробактерий (МПБ и МПА, или АП и АПА). Она стерилизуются в автоклаве при 0,5 атм 30 мин (после стерилизации рН = 7,0).
7.2.2.3. Проверка генетических маркеров. Получают отдельные клоны соответствующих штаммов. Готовят три варианта селективных сред:
а) МС с добавкой L-гистидина;
б) МС с добавкой биотина;
в) МС с добавкой L-гистидина и биотина.
Растворы аминокислоты и биотина вносят в МС из расчета 50 мкг/мл и 1 мкг/мл соответственно. Отбирают по 25 отдельных колоний и пересеивают на селективные среды, чашки Петри инкубируют при 37 °С двое суток. По характеру роста колоний делают вывод о способности того или иного штамма расти на среде, лишенной гистидина.
7.2.2.4. Хранение индикаторных штаммов. Суспензии штаммов рекомендуется хранить в диметилсульфоксиде (ДМСО) или глицерине при замораживании (-70 °С), а также в слое 0,6 % МПА под стерильным вазелиновым маслом. Периодически при пересевах штаммы проверяют на соответствие генотипу.
7.2.2.5. Приготовление фракций. Фракцию микросомных ферментов получают по следующей схеме:
1. Индуцируют синтез микросомальных ферментов в гепатопанкреасе карпа и белого толстолобика ежедневными внутрибрюшинными инъекциями метилхоланна из расчета 80 мг/кг веса в течение трех дней.
2. Извлекают из животных гепатопанкреас, взвешивают, промывают стерильным раствором 0,15М KCl, измельчают и гомогенизируют в трехкратном объеме 0,15М KCl. Среда гомогенизации гепатопанкреаса рыб дополнительно содержит 0,6 % Na-фосфатный буфер с рН 7,4. Все операции проводят на льду.
3. Гомогенат центрифугируют 15 мин при 9000 об/мин и аликвот ("фракция Sg") разливают в пластмассовые емкости объемом 3 - 6 мл.
Фракцию хранят до момента использования не более двух недель (при температуре - 80 °С).
7.2.2.6. Приготовление микросомальной активирующей системы. Фракцию Sg размораживают при комнатной температуре и ставят на лед. В эксперименте используют микросомальную активирующую среду, в 1,0 мл которой содержится фракция Sg, 5 мМ глюкозо-6-фосфат, 4 мМ NAPR, 33 мМ KCl, 8 мМ MgCl в 0,1М К-фосфатном буфере в рН 7,4.
Приготовление исследуемых веществ: Готовят стандартные растворы в дистиллированной воде или в растворе ДМСО (0,1; 1,0; 10,0; 100,0; 1000,0 мкг на чашку Петри).
7.2.2.7. Приготовление бактериальной суспензии. В экспериментах используют чистую культуру. Для этого культуру штамма с косяка пересевают в 10 мл АП и инкубируют без аэрации 18 ч при 37 °С. Затем 19 мл АПБ необходимо засеять 1 мл культуры и инкубировать ее при 37 °С на качалке в течение 2 - 3 ч до плотности 5×108 кл/мл. Культуру центрифугируют 15 мин при 5000 об/мин. Осадок ресуспендируют в стерильном физиологическом растворе с таким расчетом, чтобы получить суспензию плотностью 2×109 кл/мл.
7.2.3. Проведение исследований
Чашки Петри заливают минимальной средой и выдерживают при комнатной температуре 1 ч. Полужидкий полуобогащенный агар расплавляют и помещают в термостатируемую водяную баню (46 °С) на 20 мин. В каждую пробирку добавляют по 0,1 мл культуры тест-штамма, 0,2 мл раствора исследуемого вещества определенной концентрации и 0,5 мл микросомальной реактивирующей системы. Полученную смесь сразу же перемешивают и выливают на поверхность чашки. Верхний агар должен покрыть поверхность нижнего минимального агара тонким слоем. Вся процедура в целом занимает не более 20 секунд. Затем дают агару застыть и инкубируют при 37 °С двое суток. Через два дня отмечают колонии гистидиновых ревертантов. Чтобы выяснить, нуждается ли исследуемое вещество в предварительной активации, имеет смысл проводить исследования как в присутствии, так и в отсутствии микросомальной активирующей системы, содержащей фракцию Sg.
Помимо опытных чашек должны быть и контрольные, содержащие:
а) только культуру бактерий и растворитель;
б) культуру бактерий, растворитель и микросомальную активирующую систему, содержащую фракцию Sg;
в) культуру бактерий с добавлением мутагенов и промутагенов, указанных выше (п. 7.2.2.1, Реактивы):
для штамма ТА 100 - цилофосфамида - 500 мкг на чашку;
для штамма ТА 98 - бенз-а-пирена - 10 мкг, 9-аминоакридина - 10 мкг на чашку.
В качестве промутагенов для штаммов ТА 98 и ТА 100 используются 2-ацетиламинофлуоредин и 2-аминофлуорен соответственно.
Степень мутагенного эффекта определяют по кратности превышения числа колоний реверантов при данной дозе над таковым в контроле. При сравнении числа колонии на опытных и контрольных чашках могут быть получены следующие результаты, представленные в таблице 7.2.2.
Таблица 7.2.2
Учет мутагенности
|
Отношение числа колоний в опыте и в контроле |
Характеристика мутагенности |
Обозначение |
|
Менее 2,5 |
Отсутствие мутагенности |
- |
|
Менее 10 |
Слабая мутагенность |
+ |
|
10 - 100 |
Средняя мутагенность |
++ |
|
100 и более |
Сильная мутагенность |
+++ |
Методы статистической обработки полученных результатов приведены в приложении 4 данных Методических указаний.
7.3. Выявление хромосомных мутаций
7.3.1 Определение хромосомных аберраций в эпителии хрусталика глаза рыб
7.3.1.1. Характеристика тест-объекта. Исследования проводятся на видах рыб, у которых нет резкого падения митотической активности в осенне-зимний период. Для исследований подходят сеголетки и годовики обыкновенного окуня и радужной форели. Можно использовать другие виды рыб, не прекращающие активно питаться в естественных водных объектах зимой. Для морских рыб получены первые результаты исследований на покатниках семги, а также на морской камбале.
7.3.1.2. Лабораторное оборудование и материалы:
микроскоп биологический, обеспечивающий увеличение в 100 - 200 раз;
микроскальпель;
препаровальная игла с трехгранным сечением;
препаровальная игла с тонким изогнутым концом типа "кочерги";
обычная препаровальная игла;
пинцет с тонкоотточенными и изогнутыми концами;
глазные ножницы;
гистологическая проводка от дистиллированной воды до ксилола, с присутствием дополнительных стаканчиков с 30 % и 50 % этиловым спиртом;
банка с притертой пробкой для фиксации препаратов глаз;
обезвоженный медный купорос;
этиловый спирт;
ледяная уксусная кислота;
краситель - гемалаун Майера либо другой краситель (для ядер и хромосом, в зависимости от поставленной задачи).
7.3.1.3. Проведение исследований
а) Без предварительной травматизации хрусталика глаза. Рыбы выдерживаются в исследуемых концентрациях токсиканта. Возможно проведение подострых и хронических опытов. После экспозиции в растворах вещества рыб забивают декапитацией. У них извлекают глаза, которые помещают в фиксатор из смеси абсолютного этанола и ледяной уксусной кислоты в соотношении 3:1. Глаза могут помещаться в марлевый мешочек с этикеткой на дно банки с фиксатором. Банку на 1/4 заполняют обезвоженным медным купоросом. Продолжительность фиксации 24 ч. После фиксации глаза рыб обрабатываются поочередно.
Глаза из фиксатора перемещают в дистиллированную воду на 20 минут. По мере обводнения они опускаются на дно стакана с водой. После положенного срока поочередно каждый глаз помещают на ладонь вниз роговицей и вверх отверстием зрительного нерва. Глазными ножницами срезают дно глаза так, чтобы в образовавшееся отверстие мог пройти хрусталик. Хрусталик при этом становится видимым, но повернут к препаратору задним полюсом. В задний полюс вводят иглу с трехгранным сечением до упора в ядро хрусталика. Хрусталик изымается из глаза.
Дальнейшие операции сводятся к снятию передней капсулы хрусталика с эпителием и к получению плоскостного препарата из снятой с хрусталика полусферы. Сразу же после изъятия хрусталика из глаза трехгранной иглой, которая не дает возможности ему вращаться по оси, хрусталик перемещают в каплю дистиллированной воды. В этой капле микроскальпелем по экватору хрусталика делают надрез, и переднюю капсулу с эпителием помещают с волоконной частью глазной линзы в воду. Наряду с капсулой на предметном стекле в капле воды могут оказаться фрагменты волокон хрусталика, частицы сетчатки и радужной оболочки.
Необходимо подготовить другое предметное стекло с каплей воды, в которую микропинцетом или обычной препаровальной иглой переносят капсулу хрусталика с эпителием.
Далее микроскальпелем наносятся насечки от периферии к центру полусферы капсулы хрусталика. Обычно бывает достаточно 5 - 6 глубоких насечек, чтобы полусферическую переднюю капсулу хрусталика можно было бы уложить в одной плоскости на предметном стекле. Отдельные части капсулы расправляют препаровальной иглой и "микрокочергой". Одновременно удаляют оставшиеся на эпителии волокна хрусталика. После первого расправления вода частично отсасывается фильтровальной бумагой.
Отдельные лепестки капсулы после насечек должны подворачиваться внутрь. Это гарантирует то, что эпителий хрусталика оказывается между стеклом и капсулой. В этом случае плоскостной препарат приклеивается к предметному стеклу при частичном подсушивании.
Дальнейшие операции сводятся к подсушиванию фильтровальной бумагой плоскостного препарата эпителия хрусталика и к частичному выправлению капсулы, она присушивается к стеклу, но не доводится до полного высыхания. Побелевшую, но еще влажную капсулу закрывают каплей красителя (при использовании красителя гемалаун Майера процесс окрашивания длится 5 - 8 мин). При окраске гемалаун Майера препарат помещают в водопроводную воду, отмывают от красителя и проявляют там до подсинения.
После окраски препарата на предметном стекле его проводят через спирты, доводят до ксилола и заключают в канадский бальзам или в другую синтетическую среду.
Подсчет хромосомных аберраций проводят по методике, описанной на стадиях анателофазы в клетках эпителия как для всего хрусталика, так и для отдельных зон цитодифференцировки эпителия: центральной, герминативной и предэкваториальной. Высокая митотическая активность в герминативной и предэкваториальной зонах позволяет более полно выявить хромосомные мутации по сравнению с исследованием на других тканях.
б) Исследование с предварительной травматизацией хрусталика. Рыбы после экспозиции в растворах токсикантов за двое суток до приготовления препаратов эпителия хрусталика подвергаются травматизации уколом. Укол наносят тонкой энтомологической иглой в передний полюс хрусталика на 1/5 его диаметра. В первые сутки травматизацией гасятся спонтанные митозы в эпителии хрусталика, а затем появляются синхронизированные посттравматические митозы, полоса которых повторяет конфигурацию травмы. Таким образом, хромосомные аберрации на стадии ана-телофазы подсчитываются в посттравматических, синхронизированных митозах. Приемы подготовки препаратов эпителия хрусталика не отличаются от вышеописанных.
7.3.2 Определение частоты хромосомных аберраций в клетках жаберного эпителия рыб
Исследования проводят с аквариумной рыбой нотобранхиус (Nothobranchius rachovi) Метод позволяет учитывать частоту структурных нарушений хромосом на стадии метафазы и предполагает более полную оценку аберраций в качественном и количественном отношениях.
7.3.2.1. Характеристика тест-объекта. Нотобранхиус (Nothobranchius rachovi) имеет размер 3 - 4 см, имеет сравнительно небольшое количество хромосом (16), у которой в тканях отмечается высокая митотическая активность. Рыба легко воспроизводится и достаточно неприхотлива при содержании.
7.3.2.2. Лабораторное оборудование и материалы:
холодильник для хранения фиксированного материала;
микроскоп биологический, обеспечивающий увеличение в 100 - 200 раз с фотонасадкой;
мерная посуда для приготовления растворов;
флаконы (по 10 мл) для хранения фиксированного материала;
вегетационные сосуды для рыб;
предметные стекла;
препаровальные иглы;
пинцеты;
скальпель;
шприцы и иглы для инъекций;
краситель Гимза;
фиксатор (спирт/96 %-ная ледяная уксусная кислота 3:1);
колхицин (0,4 %);
гипотонический раствор KCl (0,4 %);
уксусная кислота (60 %).
7.3.2.3. Проведение исследований
Для учета средней частоты структурных перестроек хромосом используются клетки жаберного эпителия, богатые митозами.
Рыбе инъецируют внутримышечно 0,4 % раствор колхицина и, умертвив ее через 5 - 6 часов, отделяют жабры, которые выдерживают в течение 20 минут в 0,4 % растворе KCl, фиксируют в этанол-уксусной смеси (3:1) и мацерируют ткань в 60 %-ной уксусной кислоте. Клеточную суспензию наносят на предметные стекла, высушивают, окрашивают раствором Гимза.
Для анализа выбираются метафазные пластинки с явно выраженными хромосомами, располагающимися в одной плоскости без наложений.
Для каждой рыбы анализируют до 40 метафаз. Независимо от числа аберраций в одной клетке, они засчитываются как одно нарушение.
Учитывают следующие виды нарушений:
а) структурные хромосомные аномалии, включающие хромосомные и хроматидные разрывы, фрагменты, дицентрики, кольцевые хромосомы, ацентрические фрагменты;
б) анеуплоидные клетки;
в) полиплоидные клетки.
Подсчитывают на одну особь количество нормальных метафаз и клеток с аберрациями хромосом, рассчитывают процент нарушений (N) по следующей формуле:
![]()
Вычисляют среднее арифметическое из N для каждой группы рыб.
7.4. Учет частоты образования микроядер в эритроцитах рыб
Метод позволяет учитывать в цитоплазме эритроцитов рыб частоту образования микроядер, которые представляют собой фрагменты ядерного материала, элимининирующиеся из ядра клетки при аберрациях митотических хромосом.
7.4.1. Проведение исследований
7.4.1.1. Оборудование и материалы:
микроскоп биологический, обеспечивающий увеличение в 100 - 200 раз с фотокамерой;
мерная посуда для приготовления растворов;
предметные стекла;
вегетационные сосуды для рыб;
краситель Гимза;
этиловый спирт (96 %) для фиксации.
7.4.1.2. Подготовка мазков крови
Для приготовления мазков кровь берут из хвостовой вены. Мазки фиксируют в чистом этаноле, высушивают, окрашивают 10 %-ным раствором красителя Гимза и просматривают под микроскопом.
7.4.1.3. Учет и анализ результатов
Анализу подлежат мазки, где клетки располагаются равномерно, образуя монослой без наложений и повреждений цитоплазмы. Учитываются только целые эритроциты.
Для определения частоты встречаемости клеток с одним или двумя микроядрами анализируют 1000 эритроцитов на особь на 1 предметное стекло. Перед подсчетом стекла можно шифровать.
7.5. Микроядерный тест на эпителии гуппи
7.5.1. Характеристика тест-объекта
С целью выявления тест-реакции на индукцию микроядер можно использовать покровный эпителий гуппи.
Применение метода обосновано тем, что во время деления клеток ацентрические фрагменты хромосом и отставшие хромосомы не входят в дочерние ядра, а формируют в цитоплазме одно и реже два ДНК-содержащих образования, получивших название микроядра. Микроядра представляют собой округлые образования в цитоплазме, имеющие темную окраску, сходную с окраской ядер исследуемых клеток. Размеры микроядер изменяются от 1/5 до 1/20 размера ядра.
7.5.2. Оборудование и материалы
аквариумы емкостью 5 л;
микрокомпрессоры;
микроскоп биологический, обеспечивающий увеличение в 100 - 200 раз;
чашки Петри;
покровные и предметные стекла, пипетки объемом 1 - 5 мл;
препаровальные иглы;
микроскальпели;
глазные пинцеты;
счетчик для подсчета форменных элементов крови.
7.5.3. Проведение исследований
Для выявления микроядер используют те же методики, что и для выявления хромосомных аберраций (п. 7.3.1 Раздела 7). В препаратах определяют количество клеток с микроядрами на 1 тыс. подсчитанных клеток и выражают их число в процентах. При этом учитывают на временно окрашенных препаратах появление микроядер в клетках эпителия в опыте и контроле.
7.5.4. Учет и анализ результатов
Критерием генотоксичности вещества является статистически достоверное увеличение числа клеток, содержащих микроядра в опытных препаратах по сравнению с контролем.
7.6. Определение генотоксичности вещества по действию на дифференциальную активность генов
7.6.1. Характеристика тест-объекта
Исследования проводятся на политенных хромосомах в слюнных железах предкуколки хирономид. В качестве тест-объекта рекомендуется лабораторная культура хирономид - хирономус тами и хирономус плумозус (Chironomus thummi и Ch. Plumosus). При исследовании вещества в соленой воде в качестве тест-объекта рекомендуется лабораторная культура хирономид (Chironomus sp.) из азовских лиманов, адаптированная к солености 20. В результате проведения работы выявляется действие веществ на структуру интерфазных хромосом и на дифференциальную активность проявления пуффинга в процессе метаморфоза личинки в куколку.
7.6.2. Оборудование и материалы
микроскоп биологический, обеспечивающий увеличение в 100 - 200 раз;
тонкий пинцет;
препаровальные иглы;
предметные и покровные стекла;
кисточка;
фильтровальная бумага;
краситель ацетоарсеин (0,5 % арсеина в 45 %-ной уксусной кислоте);
среда для заливки (краситель, разведенный в соотношении 1:3 45 %-ной уксусной кислотой).
7.6.3. Проведение исследований
Определение генотоксичности химических соединений и их действия на дифференциальную активность генов проводят на предкуколке, развитие которой наблюдается с 36-го по 38-й день при температуре 20 - 25 °С. Стадия предкуколки характеризуется набуханием грудных сегментов, укорочением и заострением тела и уменьшением ложных ножек. Метаморфоз проходит в 6-й, 7-й, 8-й и 9-й фазах развития. Изменение цвета тела с красного на темно-серый указывает на окончание метаморфоза.
Для синхронизации развития и отбора хирономид в эксперименте заранее следят за степенью потемнения головы на первой фазе четвертого возраста, перед тем как личинка перейдет в фазу предкуколки. Отбирают личинок, у которых красный цвет головы меняется на темно-коричневый, и затем ждут момента набухания грудных сегментов и укорачивания тела. Препараты политенных хромосом из слюнных желез получают следующим образом. Личинку помещают на фильтровальную бумагу для обсушивания, затем переносят на предметное стекло, тонко отточенным пинцетом берут за мандибулы и тянут, отрывая голову. Вместе с головой из тела вытягивается кишечник, по бокам которого видны слюнные железы, прикрепленные к голове протоками. Препаровальными иглами слюнные железы отделяют от остальных тканей и окрашивают их в течение 10 - 15 мин ацетоорсеином. После окрашивания слюнные железы изымают из красителя и помещают на чистое предметное стекло. На покровное стекло наносится капля среды для заливки. Покровное стекло переворачивают так, чтобы капля покрыла слюнные железы. На покровное стекло помещают кусочек фильтровальной бумаги и большим пальцем, без сдвигов в стороны, клетки слюнных желез раздавливают. Среда для заливки, выступившая из-под покровного стекла, впитывается в фильтровальную бумагу. Затем бумагу удаляют, а края покровного стекла смазывают бесцветным лаком. Благодаря лаку, препарат предохраняют от высыхания.
7.6.4. Учет и анализ результатов
Генотоксичность вещества оценивается по нарушению структуры политенных хромосом (возможны разрывы, распад концов и дезинтеграция) и по нарушению пуфинга во время метаморфоза. Отмечается следующее образование пуфов в норме. На первой хромосоме пуф Gih-к увеличивается в размерах на 7-й и 8-й фазах развития. На второй хромосоме 2Азв постепенно сужается, а пуф 2Азе увеличивается на каждой последующей фазе. На 8-й фазе появляются 2 пуфа 2Д2де и пуф 2Г2. На третьей хромосоме на 6-й и 7-й фазах имеется пуф 3Дih, а после 7-й фазы появляется пуф 3Дif, который отмечается до конца метаморфоза. На четвертой хромосоме видны тельца Бальбиани, которые резко увеличиваются на 8-й фазе. Помимо этого на 6-й фазе появляется быстро исчезающий пуф 4Дс.
При действии некоторых токсикантов у личинок насекомых, имеющих политенные хромосомы, может возникнуть до 22 новых пуфов.
8. Определение требований к оценке временных нормативов вещества для пресноводных водных объектов
8.1. Расчетный метод оценки ОБУВ органических пестицидов
Для вычисления величин ОБУВ пестицидов органического состава необходимо обычным порядком (п. 7 Приложения 2 к настоящим Методическим указаниям) установить следующие величины:
X1 - коэффициент распределения "октанол-вода" - Кow;
Х2 - для дафний - ЛК50 за 48 ч (мг/л);
Х3 - для взрослых или годовиков рыб - ЛК50 за 96 ч (мг/л);
Х4 - для личинок рыб - ЛК50 за 48 ч (мг/л).
Полученные величины вставляются в следующее обобщающее уравнение:
lgOBYB = А + b1·lgX1 + b2·lgX2 + b3·lgX3 + b4·lgX4.
Коэффициенты A, b1, b2, b3 и b4 выбираются из таблицы 8.1.1 в соответствие с имеющимся максимальным набором известных исходных показателей (предикторов). Если какие-либо предикторы неизвестны, то из общего уравнения исключают соответствующие члены.
Для пестицидов, обладающих высокой токсичностью, имеющих ЛК50 менее 0,1 мг/л, рекомендуется вычислять уравнение и с другой подборкой коэффициентов (Таблица 8.1.2).
Из двух вариантов следует выбрать меньшее количественное значение ОБУВ вещества.
8.1.1. Примеры расчета ОБУВ
1. Пример расчета ОБУВ среднетоксичного пестицида (ридомила):
а) полный набор
lg Кow = 1,65(f1)ПДК = 0,01 мг/л,
ЛК50 для дафний = 0,6(Х2),
ЛК50 для рыб = 91,8(Х3),
ЛК50 для личинок = 34,3(Х4);
проводим логарифмирование:
f2 = lgX2 = -0,22,
f3 = lgX3 = 1,96,
f4 = lgX4 = 1,54;
находим по таблице 8.1.1 для набора Х1Х2Х3Х4:
А = -3,35; b1 = - 0,11; b2 = 0,10; b3 = 0,43; b4 = 0,31;
подставляем в уравнение:
lgY = - 3,35 + (-0,11)·1,65 + 0,10·(-0,22) + 0,43·1,96 +
0,31·1,54 =
= -3,35 – 0,18 – 0,02 + 0,84 + 0,48 = -2,23
Y = 10-2,23 = 0,006 ОБУВ = 0,006 мг/л;
Коэффициенты формулы для расчета ОБУВ при разных вариантах исходной информации (общий случай)
|
Набор установленных предикторов |
Коэффициенты |
||||
|
A |
b1 |
b2 |
b3 |
b4 |
|
|
X1 |
-2,05 |
-0,42 |
- |
- |
- |
|
X2 |
-3,23 |
- |
0,89 |
- |
- |
|
Х3 |
-3,90 |
- |
- |
0,91 |
- |
|
Х4 |
-3,55 |
- |
- |
- |
0,90 |
|
X1X2 |
-2,62 |
-0,22 |
0,57 |
- |
- |
|
Х1Х3 |
-3,42 |
-0,12 |
- |
0,74 |
- |
|
X1X4 |
-2,87 |
-0,19 |
- |
- |
0,69 |
|
Х2Х3 |
-3,76 |
- |
0,32 |
0,68 |
- |
|
Х2Х4 |
-3,48 |
- |
0,37 |
- |
0,62 |
|
Х3Х4 |
-3,82 |
- |
- |
0,63 |
0,32 |
|
Х1Х2Х3 |
-3,50 |
-0,08 |
0,18 |
0,66 |
- |
|
X1X2X4 |
-2,95 |
-0,16 |
0.12 |
- |
0,63 |
|
X1X3X4 |
-3,29 |
-0,13 |
- |
0,44 |
0,35 |
|
Х2Х3Х4 |
-3,72 |
- |
0,27 |
0,54 |
0,19 |
|
X1Х2Х3Х4 |
-3,35 |
-0,11 |
0,10 |
0,43 |
0,31 |
Коэффициенты формулы для расчета ОБУВ при разных вариантах исходной информации (для высокотоксичных препаратов, ПК50 < 0,1 мг/л)
|
Набор установленных предикторов |
Коэффициенты |
||||
|
A |
b1 |
b2 |
b3 |
b4 |
|
|
X1 |
-2,05 |
-0,42 |
- |
- |
- |
|
X2 |
-3,13 |
- |
0,96 |
- |
- |
|
Х3 |
-4,28 |
- |
- |
0,73 |
- |
|
Х4 |
-2,97 |
- |
- |
- |
1,21 |
|
X1X2 |
-2,61 |
-0,30 |
0,29 |
- |
- |
|
Х1Х3 |
-2,86 |
-0,28 |
- |
0,57 |
- |
|
X1X4 |
-2,23 |
-0,27 |
- |
- |
0,82 |
|
Х2Х3 |
-3,22 |
- |
0,56 |
0,78 |
|
|
Х2Х4 |
-2,17 |
- |
0,68 |
- |
1,13 |
|
Х3Х4 |
-3,32 |
- |
- |
0,25 |
0,99 |
|
Х1Х2Х3 |
-2,13 |
-0,24 |
0,16 |
- |
0,85 |
|
X1X3X4 |
-2,50 |
-0,24 |
- |
0,28 |
0,61 |
|
Х2Х3Х4 |
-2,44 |
- |
0,51 |
0,33 |
0,91 |
б) пусть неизвестны lgКow и ЛК50 для личинок. Тогда используем набор Х2Х3:
А = -3,76; b2 = 0,32; b3 = 0,68, который подставляем в уравнение:
lgY = -3,76 + 0,32·(-0,22) + 0,68·1,96 = -3,76 - 0,07 + 1,33 = -2,5
Y = 10-2,5 = 0,003 ОБУВ = 0,003 мг/л.
2. Пример расчета ОБУВ высокотоксичного пестицида (карате):
а) по таблице 8.1.2:
пусть неизвестен lgКow. Тогда используем набор Х2Х3Х4:
ЛК50 для дафний = 0,00059(Х2), ПДК - 0,00000002 мг/л,
ЛК50 для рыб = 0,005(Х3),
ЛК50 для личинок = 0,0034(Х4);
проводим логарифмирование:
f2 = lgX2 = -3,23,
f3 = lgX2 = -2,3,
f4 = lgX4 = -2,47.
находим по таблице 8.1.1 для набора Х2Х3Х4:
А = -3,72; b2 = 0,27; b3 = 0,54; b4 = 0,19
подставляем в уравнение
lgY = -3,72 + 0,27·(-3,23) + 0,54·(-2,3) + 0,19·(-2,47) = -3,72 - 0,87 - 1,24 - 1,47 = -6,3
Y = 10-6,3 = 0,0000005 ОБУВ = 0,0000005 мг/л;
б) по таблице 8.1.2:
пусть неизвестен lgКow. Тогда используем набор Х2Х3Х4:
ЛК50 для дафний = 0,00059(Х2), ПДК - 0,00000002 мг/л,
ЛК50 для рыб = 0,005(Х3),
ЛК50 для личинок = 0,0034(Х4);
проводим логарифмирование:
f2 = lgX2 = -3,23,
f3 = lgX2 = -2,3,
f4 = lgX4 = -2,47.
находим по таблице 8.1.2 для набора Х2Х3Х4:
А = -2,44; b2 = 0,51; b3 = 0,33; b4 = 0,91
подставляем в уравнение
lgY = -2,44 + 0,51·(-3,23) + 0,33·(-2,3) + 0,91·(-2,47) = -2,44 - 1,65 - 0,76 - 2,25 = -7,1
Y = 10-7,1 = 0,00000008 ОБУВ = 0,00000008 мг/л.
По таблице 8.1.1 получено меньшее значение, его и выбираем в качестве ОБУВ пестицида карате.
8.2. Определение требований по оценке ОБУВ веществ, помимо органических пестицидов
Помимо ОБУВ органических пестицидов, в пресноводных водных объектах устанавливаются в краткосрочных исследованиях исходные данные для оценки ОБУВ веществ:
а) ядохимикатов сельскохозяйственного и промышленного назначения неорганического состава;
б) соединений и их смесей, используемых в газо-, нефте-, горнодобывающих, перерабатывающих и других отраслях промышленности;
в) химических средств обработки воды;
г) веществ, планируемых к широкому использованию в строительстве и транспорте.
8.2.1. Исследования на водорослях
Целесообразно проведение 7-суточных исследований действия вещества на рост культуры водорослей (п. 1.4 Приложения 1 к настоящим Методическим указаниям). В качестве альтернативы возможно полное проведение хронического эксперимента с одноклеточными водорослями в течение 14 суток.
В конце опытов оценивается статистическая достоверность отклонений опытных данных от контрольных.
Условия культивирования водорослей и постановки токсикологических исследований с ними приведены в п.п. 1.3 и 1.4 Приложения 2 к настоящим Методическим указаниям.
8.2.2. Исследование на зоопланктонных организмах
Исследования проводятся на односуточных дафниях около 20 суток, что определяется временем появления трех пометов у контрольных дафний, или на односуточных цериодафниях в течение 7 - 8 суток, когда у рачков появляется 3-й помет.
Постановка токсикологических исследований изложена в п.п. 4.1.4 и 4.2.3 Приложения 2 к настоящим Методическим указаниям.
8.2.3 Исследования на эмбрионах и личинках рыб
8.2.3.1. Проведение исследований
Условия содержания рыб, получения икринок и проведения исследований на них приведены в п. 6 Приложения 2 настоящих Методических указаний.
8.2.3.2. Анализ результатов исследований
В качестве максимальной допустимой концентрации вещества для рыб принимается максимальная концентрация, не вызывающая статистически достоверного повышения смертности эмбрионов и личинок.
8.2.4 Исследования изменений санитарных показателей водной среды
8.2.4.1. Проведение исследований
Исследуемое вещество оценивают по изменению показателя БПК5, характеризующего процессы самоочищения водной среды.
Исследования проводятся при 20 °С в стеклянных сосудах объемом 5 дм3, заполняемых природной морской водой, профильтрованной через мельничный газ № 76 и насыщенной кислородом.
В сосуды вносится исследуемое вещество в 5 - 7 концентрациях, различающихся на порядок. Один из сосудов остается чистым и используется в качестве контроля. В исходные сутки, а также через 5 суток в пикнометры отбираются пробы воды (по 2 пикнометра на каждую пробу), которые выдерживаются в термостате при 20 °С в течение 5 суток.
Через 5 суток после экспозиции в каждом из пикнометров в воде определяют содержание кислорода по Винклеру или с применением специально приспособленных оксиметров.
Расчет величины БПК5 производится следующим образом:
БПК5 = [О2]исх - [О2]t,
где: [О2]исх - исходная концентрация кислорода в воде,
[О2]t - концентрация кислорода в пробах на 5 сутки наблюдения.
Результаты используются для составления таблицы или графиков зависимости БПК5 от времени и концентрации исследуемого вещества.
8.2.4.2. Анализ результатов исследования
Оценка эффекта химического вещества производится по сравнению величин БПК5 в опыте и в контроле:
![]()
где: БПК5(оп) и БПК5(контр), соответственно, в опыте и в контроле на один и тот же срок.
Безвредной для процесса самоочищения следует считать такую концентрацию, при которой показатель БПК5 отклоняется от соответствующих значений в контроле не более чем на 20 % (т.е. N < 20 %).
Для вычисления концентрации, вызывающей 20 % отклонение, путем интерполяции может быть использовано следующее уравнение:
![]()
где: С - концентрация вещества, вызывающая отклонение значений БПК5 от аналогичных значений в контроле на 20 %;
C1 и C2 - концентрации вещества, вызвавшие отклонения БПК5 менее и более чем на 20 % соответственно;
N1 и N2 - величины этих отклонений.
Определение величины временного норматива
Из концентраций, выведенных в процессе исследований в качестве максимальных допустимых для каждого из объектов исследования, выбирается наименьшая, которая и рассматривается в качестве временного норматива вещества - ориентировочного безопасного уровня воздействия (ОБУВ вещества).
Приложение 3
к Методическим указаниям по
разработке нормативов
качества воды водных объектов
рыбохозяйственного значения, в
том числе нормативов
предельно допустимых
концентраций вредных веществ
в водах водных объектов
рыбохозяйственного значения
1. Установление максимальной допустимой концентрации вещества для одноклеточных водорослей
1.1. Введение
Оценка влияния веществ на одноклеточные водоросли осуществляется по нижеследующим показателям:
а) изменение численности клеток водорослей при воздействии веществ, содержащихся в тестируемой воде, по сравнению с контролем;
б) характер изменения численности клеток: их увеличение или снижение, отражающее интенсивность деления клеток водорослей по отношению к контролю.
Критерием токсичности раствора вещества является достоверное снижение численности клеток водорослей ("выживаемость") в растворе по сравнению с контролем.
Критерием эвтрофирующего эффекта вещества является достоверное увеличение численности клеток водорослей в различных концентрациях вещества. Лимитирующий показатель вредности вещества в данном случае - экологический. Наряду с изучением динамики численности водорослей, к регистрируемым показателям в опыте следует относить изменение рН; визуальные наблюдения за состоянием культуры водорослей: изменения в окраске, форме клеток и состоянии суспензии (взвешенное, опускание на дно, всплывание к поверхности, гомогенность или агрегация) по сравнению с контролем.
В качестве экспресс-метода оценки токсичности вещества можно использовать приборный метод быстрой или замедленной флуоресценции водорослей (Минрыбхоз СССР введены в действие методические разработки ВНИРО от 18 декабря 1987 г. № 291-ц "Методические рекомендации по экспрессному биотестированию природных и сточных вод с использованием замедленной флуоресценции одноклеточных водорослей". М: ВНИРО, 1987). Показания изменения флуоресценции водорослей в растворах вещества по отношению к контролю следует относить к основным показателям, характеризующим процессы жизнедеятельности одноклеточных водорослей. Показания быстрой и замедленной флуоресценции относятся только к живым клеткам, отражают интенсивность процесса фотосинтеза водорослей, по калибровочной кривой позволяют определить количество живых клеток в эксперименте.
Кратковременная оценка токсичности раствора вещества - до 24 - 96 ч - позволяет определить наличие острого токсического действия вещества на одноклеточные водоросли, а длительное исследование - до 14 - 21 суток - его хроническое токсическое действие.
К дополнительным показателям при исследовании следует относить: оценку биомассы водорослей (полученную расчетным методом), оценку скорости и темпа деления клеток (расчет генераций), содержание фотосинтезирующих пигментов (хлорофилла и каротиноидов), соотношение живых и мертвых клеток водорослей (используя люминисцентный микроскоп или различные витальные красители - цитохимический метод).
1.2. Характеристика тест-объектов
В качестве основного стандартного тест-объекта рекомендуется использовать лабораторную монокультуру одноклеточных золотистых водорослей феодактилум трикорнутум (Phaeodactylum tricornutum). Вид представлен клетками овальнотреугольной формы с шипиками на концах. Клетки неподвижны, длина 13 - 16 мкм. Размножение вегетативное, путем простого деления клеток надвое. Численность клеток увеличивается за трое суток не менее чем в 3 раза. После пересева культуры на новую среду, экспоненциальная фаза роста наступает на 4 сутки. Данный вид водорослей используется в международном стандарте оценки качества воды (ИСО 10253:2006 Качество воды. Тест по угнетению роста морских водорослей Skeletonema costatum и Phaeodactylum tricornutum).
В исключительных случаях или в качестве дополнительной культуры возможно использовать другой вид водорослей из перидиниевых - экзувиелла кордата (Exuviella cordata) или пророцентрум миканс (Prorocentrum micans), с указанием срока выхода культуры в экспоненциальную фазу роста в культуре, темпа деления клеток и диапазона чувствительности водорослей к стандартному (эталонному) веществу бихромату калия (п. 1.4 Приложения 2 настоящих Методических указаний).
1.3. Условия лабораторного содержания одноклеточных водорослей
Используется обычное лабораторное оборудование, приборы, посуда и реактивы, в том числе:
климатостат (люминостат) любого типа, оснащенный лампами дневного света 3000 - 6000 лк, обеспечивающий поддержание температуры (20 ± 2) °С;
прибор для определения солености воды;
рН-метр;
оксиметр любого типа с погрешностью измерения не более 0,5 мг/дм3;
спиртовка;
микроскоп биологический обеспечивающий увеличение в 100 - 200 раз;
камера счетная Нажотта (или камера Горяева);
предметные и покровные стекла;
фильтровальная установка любого типа;
фильтры мембранные (размер пор 3,5 мкм; 0,45 мкм);
пипетки автоматические-дозаторы на 0,1 - 0,23;
готовая искусственная морская соль;
двухромовокислый калий K2Cr2О7 марки "хч" или стандарт-титр калия двухромовокислого;
стаканы стеклянные лабораторные вместимостью 100, 500, 1000 см3;
колбы конические на 100, 150, 250, 500, 1000 см3;
культура морских одноклеточных водорослей Phaeodactylum tricrnutum Bohlin;
Выращивают водоросли (Таблица 1.3.1) на среде Гольдберга.
Таблица 1.3.1
Состав питательной среды Гольдберга
|
№ исходного раствора |
Реактив |
Навеска реактива г/100 см3 дистиллированной воды |
Количество (см3) каждого исходного раствора на 1 дм3 морской природной воды |
|
1 |
KNO3 |
10,1 |
2 |
|
2 |
NaH2PO4 |
1,421 |
0,5 |
|
3 |
MnCl2×4H2O |
0,01979 |
1 |
|
CoCl2×6H2O |
0,02379 |
|
|
|
4 |
FeCl3×6H2O |
0,02703 |
1 |
Питательную среду для культивирования готовят на искусственной морской воде или на морской природной воде (черноморской, беломорской, балтийской, каспийской и т.д.), которую предварительно отбирают в незагрязненном районе. Морскую воду фильтруют через мембранный фильтр (размер пор 3,5 мкм). Дважды стерилизуют, нагревая до температуры 75 - 80 °С и охлаждая до комнатной температуры. В подготовленную таким образом морскую воду добавляют растворы № 1, № 2 и № 3 (см. таблицу 1.3.1). Затем среду стерилизуют третий раз, охлаждают и добавляют раствор № 4.
Приготовленную вышеописанным способом среду хранят в темном месте при комнатной температуре. Исходные растворы для приготовления среды хранят в холодильнике, в случае помутнения производят их замену.
Культивируют водоросли в конических колбах объемом 250 - 300 мл закрытых фольгой или ватно-марлевой пробкой в люминостате или климатостате, избегая попадания прямых солнечных лучей. Освещенность 3000 - 6000 люкс. Лампы дневного света размещают на расстоянии 30 - 40 см от поверхности культуры. Соблюдается световой, суточный ритм. Температура при культивировании водорослей 20 ± 2 °С. Культуру водорослей периодически перемешивают, встряхивая 1 - 2 раза в сутки.
Водоросли рекомендуется один раз в десять дней пересевать. Для этого в чистую простерилизованную колбу объемом 250 см3 со свежей средой (100 - 150 мл) над пламенем спиртовки приливают примерно 15 - 20 см3 верхнего росткового слоя из колбы ранее культивируемых водорослей. При этом получают начальную плотность клеток в колбе для культивирования, примерно 300 тыс. кл/см3. Колбу закрывают ватно-марлевыми пробками или фольгой, перемешивают, записывают на колбе название культуры, дату посева и ставят в люминостат.
В течение дня содержимое колбы следует перемешивать 1 - 2 раза.
1.4. Проведение исследований
Опыты проводят при оптимальной температуре и освещении, как и культивирование водорослей (п. 1.3 Приложения 3). Используют водоросли в экспоненциальной фазе роста, что соответствует трехсуточной культуре водорослей после пересева. Плотность культуры в колбе в это время достигает примерно 5 млн. кл/мл.
В опыте используют начальную плотность клеток 25 тыс. кл/см3. Для этого нужная плотность клеток в опыте достигается расчетом, исходя из объема исследуемой концентрации вещества (например, 100 см3) и численности клеток в культуре в экспоненциальной фазе роста (5 млн. кл/см3). В указанном случае в опытную и контрольную среду добавляется по 0,5 см3 трехсуточной культуры водорослей.
Периодически (не реже 1 раза в месяц) необходимо проводить контроль физиологической чувствительности водорослей. Для этого используют эталонное химическое вещество - двухромовокислый калий K2Cr2О7 марки "хч" или стандарт-титр калия двухромокислого. Готовят маточный раствор двухромовокислого калия концентрацией 1 г/м3. Далее методом разбавления готовят серию растворов с концентрациями 1,0; 2,5; 5,0; 7,5 и 10,0 мг/дм3. Исследование проводят в течение 96 ч. На основании полученных результатов рассчитывают среднюю концентрацию K2Cr2О7, вызывающую уменьшение численности клеток на 50 % за 96 ч (ЛК50 за 96 ч). Если полученное значение ЛК50 находится в интервале 5,8 - 10,0 мг/дм3, то культура водорослей может быть использована для экспериментов.
Если полученные значения ЛК50 не попадают в интервал 5,8 - 10,0 мг/дм3, то эксперименты с водорослями не проводят, выясняют причину (условия культивирования, состав культуральной среды и прочее). Иногда культуру водорослей заменяют и проводят эксперименты заново.
При постановке острых и хронических экспериментов в контрольные и опытные колбы емкостью 250 см3 наливают по 100 см3 (в колбы емкостью 100 см3 наливают по 50 см3) контрольной среды и исследуемые концентрации вещества. Контролем служит среда Гольдберга. Исследуемые концентрации веществ также готовят на среде Гольдберга.
Затем в опытные и контрольные колбы пипеткой добавляют по 0,5 см3 (0,25 см3) культуры водорослей в экспоненциальной фазе роста.
Колбы закрывают ватно-марлевыми пробками или фольгой, их содержимое тщательно перемешивают и в каждой колбе определяют исходную численность клеток, которая должна составлять 25 тыс. кл/мл. Колбы помещают в люминостат (или в климатостат) и экспонируют в течение трех суток (острый) или четырнадцати суток (хронический) эксперимент.
В эксперименте должно быть исследовано не менее 5 концентраций вещества. Повторность трехкратная.
Эксперименты на водорослях проводятся в 2 этапа: предварительный и основной (окончательный).
В предварительном остром эксперименте находят интервал токсичных концентраций. Опыты проводят в широком диапазоне концентраций вещества, которые отличаются в геометрической прогрессии (коэффициент 10). Например, 0,01; 0,1; 1,0; 10,0 мг/л и т.д. Исследуют не менее пяти концентраций в двух повторностях. По результатам эксперимента определяется диапазон концентраций для основного острого и хронического эксперимента.
В основном остром и хроническом эксперименте шаг между концентрациями различается в 2 - 5 раз. Исследуют не менее пяти концентраций в трех повторностях.
Подсчет клеток водорослей проводят в остром опыте ежедневно, в хроническом на 1, 2, 3, 4, 7, 10, 14 сутки.
На 14 сутки от начала эксперимента опыт прекращают и устанавливают, оказывают ли исследуемые концентрации вещества хроническое токсическое (или эвтрофирующее) действие на водоросли.
1.5. Учет и анализ результатов
Для подсчета численности клеток под микроскопом используют счетную камеру Нажотта объемом 0,01 см3 (или камеру Горяева).
Подсчет клеток в камере Нажотта осуществляют следующим образом. Камеру Нажотта и покровное стекло толщиной 0,2 - 0,4 мм промывают дистиллированной водой и вытирают насухо. Из каждой контрольной или опытной колбы каплю суспензии водорослей наносят на середину камеры, покровное стекло плотно прижимают к поверхности камеры (в камере не должно быть пузырьков воздуха), дают отстояться 1 - 2 минуты, после чего начинают подсчет в пяти правых верхних и пяти правых нижних вертикальных счетных полосах. Затем выводят среднее количество клеток в одной полосе. При большом разбросе клеток в полосах просчитывают 10 верхних и 10 нижних полос. Полученное среднее число клеток в одной полосе умножают на коэффициент 1600 и величину разведения (например, при разведении культуры в 10 раз среднее число клеток в одной полосе умножают на 10), определяя численность клеток в 1 см3.
При работе с камерой Горяева суспензию водорослей наносят по капле на нижнюю и верхнюю сетки счетной камеры. Затем камеру накрывают покровным стеклом, которое притирают по бокам до появления колец интерференции. Через 1 - 2 мин начинают подсчет водорослей в 25 больших квадратах всей камеры. Рассчитывают численность клеток на 1 см3 среды следующим образом: количество клеток в 25 больших квадратах камеры Горяева умножают на 104 и получают количество клеток в 1 см3 суспензии.
Из каждой опытной и контрольной колбы просчитывают не менее двух камер.
Подсчет подвижных клеток водорослей (например, эксувиеллы) проводят после фиксации их формалином.
Для этого в мерную пробирку на 10 см3 помещают 1 см3 суспензии водорослей из опытных или контрольных колб. Приливают туда 9 мл питательной среды Гольдберга, перемешивают, добавляют 0,1 см3 4 %-го раствора формалина, еще раз перемешивают. Затем из пробирки помещают каплю суспензии водорослей в камеру Нажотта для подсчета клеток.
По окончании эксперимента на водорослях проводят обработку полученных результатов острого и хронического опыта. Рассчитывают среднюю численность клеток водорослей в опыте и контроле (в млн. кл/см3 и в процентах).
Результаты исследования учитываются, если численность клеток водорослей в контроле увеличивается за 96 часов не менее чем в 3 раза.
При изменении численности клеток в контроле менее чем в 3 раза, результаты опыта считаются недействительными.
Достоверность различия между численностью клеток в контроле и опыте устанавливают, используя приемы статистической обработки (Приложение 4 данных Методических указаний).
Достоверность снижения (или увеличения) численности клеток в опыте по сравнению с контролем свидетельствует о наличии острого или хронического токсического (эвтрофирующего) действия исследованных концентраций вещества на водоросли.
2. Установление максимальной допустимой концентрации вещества для макрофитов и высших водных растений
В прибрежных участках морей макрофиты (бурые и красные высшие водоросли), а также высшие водные растения, создают широкий плотный пояс фитомассы, обеспечивающий первичное органическое вещество и выделяющий кислород, служат местом укрытия от опасности водных организмов, а в некоторых случаях субстратом для нереста рыб. Важную роль играет это звено в самоочищении водных объектов.
При оценке значения норматива (ПДК вещества) наиболее удобно использовать в экспериментах некоторые виды макрофитов (бурые водоросли) и погруженные высшие водные растения семейства зостеровых.
В лабораторных условиях указанные водоросли и высшие водные растения не культивируются.
2.1. Характеристика тест-объекта
2.1.1. Высшие водные растения
Зостера морская (Zostera marina L.) - растение многолетнее, имеет ползучее корневище, укореняющееся на узлах и переходящее в вертикальный побег. В каждом узле с двух сторон по 8 - 10 тонких, нежных корней. Стебель ветвистый, длиной 60 - 150 см, ветви укороченные. Листья плоские, линейные, длиной в среднем 50, нередко 100 см и более, шириной 3 - 9 мм. Верхушка листа округлая. Соцветие многоцветковое, длиной до 8 см, на цветоносных ветвях.
Распространена в умеренных и теплых водах Северного полушария у берегов Европы, в Тихом океане от Желтого до Берингова моря и до Калифорнийского залива, также встречается в Карском и Чукотском морях.
2.1.2. Макрофиты
В Дальневосточных морях удобны для экспериментов в лабораторных условиях некоторые виды макрофитов, относящиеся к красным высшим водорослям.
а) Семейство Phyllophoraceae - Филлофоровые
Вид Ahnfeltia tobuchiensis (Kanno et Matsubara) - Анфельция тобучинская
Слоевище темно-фиолетовое, упругое, прочное, нитевидное, неправильно дихотомически разветвленное, длиной 7 - 10 см, толщиной 0,3 - 0,45 мм. Органы прикрепления отсутствуют. Образует неприкрепленные пласты на мягком илистом или песчаном грунте.
б) семейство Gigartinactae - Гигартиновые
вид Chondrus pinnulatus (Harv.) - Хондрус перистый
Слоевище глубокого фиолетово-карминного цвета, светлеющее до розовато-фиолетового и зеленовато-желтого, хрящевое, плоское, разветвленное, длиной 10 - 15 см, шириной 2 - 4 мм. Прикрепляется дисковидной подошвой. Ветви кверху клиновидно расширенные или линейные, ответвляются на некотором расстоянии от подошвы; на вершине пальчато или вильчато разветвленные, снабжены короткими, плоскими, перисто расположенными боковыми веточками.
2.2. Проведение исследований
Растения и макрофиты собирают в условно чистом прибрежном районе и предварительно акклиматизируют к лабораторным условиям в течение недели. Для опыта отбирают одинаковые экземпляры однолетних растений зостеры (1 - 2 листа, стебель, корень) или одинакового размера участки таллома макрофитов.
Зостеру (макрофиты) по 4 экземпляра помещают в контрольные и опытные кристаллизаторы емкостью 0,5 дм3 и выдерживают 30 суток при постоянном искусственном освещении, температуре 15 - 17 °С.
С учетом стабильности вещества производят смену растворов в емкостях.
Действие растворов вещества на растения и макрофиты оценивают по следующим показателям: общее состояние (ежедневно - изменение окраски, наличие тургора), выживаемость (на 7, 14, 21, 30 сутки), прирост биомассы (на 10, 20, 30 сутки - в пересчете на одно растение или макрофит), число корней и листьев (макрофиты) в пересчете на одно растение (на 10, 20, 30 сутки).
2.3. Учет и анализ результатов
Все результаты опытов обрабатываются статистически (п. 3 Приложения 4 настоящих Методических указаний).
3. Установление максимальной допустимой концентрации вещества для простейших
3.1. Введение
Простейшие, в частности инфузории, составляют до 70 % численности гетеротрофного микропланктона в водных объектах. Многочисленность данной группы организмов, экологическая значимость ее в процессах самоочищения, в продукционных процессах, трофических связях, значение ее как составной части естественной кормовой базы зоопланктона и молоди рыб вызывают необходимость исследовать данную группу в токсикологическом плане. Наблюдения показали, что простейшие в силу своих физиологических особенностей проявляют большую чувствительность к изменению факторов внешней среды. Их короткий цикл развития дает возможность проследить действие отдельных токсикантов на ряде поколений. Данные организмы (особенно ресничные инфузории) достаточно легко культивировать. Все это делает простейших удобным тест-объектом для токсикологических опытов.
3.2. Характеристика тест-объекта
В качестве тест-объектов в токсикологических исследованиях используются брюхоресничные инфузории: стилонихия, эуплотус, керонопсис (Stylonichia mytilus; Euplotes harpac, E. trisulkatus, E. sp.; Urostula marina; Keronopsis multistilata).
Стилонихия (Stylonichia mytilus) - солоноватоводная инфузория (размер до 300 мкм), в лабораторных условиях адаптируется к солености до 25. Обитает в водных объектах с большим содержанием органических веществ, отмирающих растений, ила и т.п. Всеядна, в число ее пищевых объектов входят бактерии, жгутиконосцы, одноклеточные водоросли, детрит. Стилонихия, подобно другим инфузориям, размножается половым и бесполым путем. В процессе бесполого размножения (амитоз) при делении вегетативного ядра (макронуклеуса) происходит постепенное нарушение его генетической структуры, что, в свою очередь, выражается в депрессии и старении клона. При половом процессе в результате слияния микронуклеусов двух конъюгирующих особей развивается новый макронуклеус, что восстанавливает нормальную генетическую структуру последнего и, соответственно, нормализует физиологические функции организма.
Эуплотус (Euplotes harpac), размер до 450 мкм - самая крупная инфузория из рода Euplotes. Инфузории этого рода имеют бесцветное и прозрачное щитовидное тело с очень сильно развитым перистомом, 10 лобно-брюшных циррий, 5 поперечных, 4 умеренно развитых хвостовых циррий играют роль рулей. Инфузории весьма распространены в иле, среди растительности. Помимо Е. harpac используются Е. trisulkatus.
Уростула (Urostula marina), размер до 200 мкм, имеет гибкое, малосократимое, яйцевидное тело, ширина которого составляет 1/3 длины. Рот с двумя ундулирующими мембранами, вентральные ряды из низких циррий, краевые ряды выражены слабо, поперечный ряд выражен очень ясно. Обитает среди растений, в незагрязненных водных объектах; прожорливая всеядная форма.
Керонопсис (Keronopsis multistilata), размер до 450 мкм - бентическая инфузория, населяет толщу прибрежного морского песка. Форма длинной ленты, ширина составляет 1/7 длины тела. Ресничный аппарат, позволяющий протискиваться между песчинками, хорошо развит.
Как видно, используемые в качестве тест-организмов инфузории, занимают определенную нишу в водном объекте. Они являются или планктонобентосными формами, или полностью бентическими формами, что позволяет исследовать как растворимую фракцию веществ, так и малорастворимую.
3.3. Условия лабораторного содержания
Монокультуру простейших культивируют при комнатной температуре 20 ± 2 °С на искусственной морской среде в чашках Петри при естественном освещении, предохраняя от воздействия прямых солнечных лучей, или в люминостате.
Используется обычное лабораторное оборудование, приборы, посуда и реактивы, в том числе:
реактивы для приготовления искусственной морской среды;
вода дистиллированная;
бумага фильтровальная;
колбы на 1000 см3;
градуированные мерные пипетки на 10, 5, 1, 0,1 см3;
пипетки для пересадки простейших (Пастеровские пипетки с укороченным концом);
мерные колбы на 100 см3;
мерные пробирки на 10 см3;
чашки Петри;
микроаквариумы (блок камер из оргстекла);
бинокуляр МБС-9 или МБС-10;
оксиметр;
рефрактометр для измерения солености воды;
рН-метр;
двухромовокислый калий K2Cr2О7 марки "хч" или стандарт-титр калия двухромокислого;
культура простейших;
сухие пекарские дрожжи.
Среда для культивирования - традиционно используемая для простейших.
Для приготовления искусственной морской среды делают запас морской воды соленостью 70 следующего состава (в граммах на 1 дм3): NaCl - 55,30; MgSO4×2Н2О - 13,84; MgCl2×6Н2О - 11,02; СаCl2×6Н2О - 2,9; KCl - 1,3; NaHCO3 - 0,5; NaNO3 - 0,2; NaBr - 0,2; NaHPO4 - 0,1; KJ - 0,01; SrCl2 - 0,03.
Все компоненты растворяют отдельно, через одни сутки сливают вместе и общий объем доводят дистиллированной водой до 1 дм3. При хранении морской воды в растворе может выпасть очень незначительный осадок солей, отфильтровывать который не рекомендуется.
Для разведения искусственной морской воды соленостью 70 до нужной солености пользуются формулой Хлебович (1974):
Х = (1000с) / а,
где X - количество морской воды, необходимое для получения искомой солености в 1000 мл дистиллированной воды;
а - соленость исходной воды (70);
с - соленость искомой воды.
Можно использовать для приготовления искусственной морской воды готовую профессиональную морскую соль.
В качестве корма используют хорошо высушенные и измельченные пекарские дрожжи, которые легко хранить в закрытой посуде. Вносят их в чашки Петри в очень небольшом количестве на кончике скальпеля.
Два раза в неделю рекомендуется просматривать состояние культуры в чашках Петри. Через две недели культуру пересевают, т.е. 100 - 300 особей пипеткой переносят в чашку Петри с чистой средой, куда добавляют корм.
Периодически (не реже 1 раза в месяц) проводят оценку физиологической чувствительности организмов. Для этого используют эталонный токсикант - двухромовокислый калий K2Cr2О7 марки "хч" или стандарт-титр калия двухромокислого. Готовят маточный раствор двухромокислого калия концентрацией 1 г/дм3. Далее методом разбавления готовят серию растворов с концентрациями 100,0; 150,0; 200,0; 250,0 и 300,0 мг/дм3. Исследование проводят в течение 24 ч. По результатам эксперимента рассчитывают летальную концентрацию K2Cr2О7, вызывающую гибель простейших на 50 % (ЛК50 за 24 ч). Если полученные значения ЛК50 находятся в интервале 180 - 230,0 мг/дм3, то культура может быть использована для проведения экспериментов.
Если полученные значения ЛК50 не попадают в интервал 180 - 230,0 мг/дм3, эксперименты с простейшими не проводят, выясняют причину, эксперимент повторяют.
Для получения из природных проб морской воды монокультуры простейших, растущих в лабораторных условиях на искусственной морской среде той же солености, используют соответствующие методические разработки (Методические указания по морским токсикологическим биотестам. М.: ВНИРО, 1978; Методические рекомендации по биотестированию природных, сточных вод и отдельных загрязняющих веществ. М.: ВНИРО, 1982).
3.4. Проведение исследований
Перед постановкой опытов культуру простейших необходимо вывести в экспоненциальную фазу развития, что достигается пересевом культуры за трое суток до постановки опытов в чашку Петри с добавлением корма.
Эксперименты можно проводить как в чашках Петри объемом 25 см3, так и в камерах с рабочим объемом 4 см3. Плотность посадки в чашках Петри (с рабочим объемом 10 мл) 10 организмов, в камерах с рабочим объемом 4 мл - 5 организмов. Повторность двукратная или трехкратная.
Для предварительных и окончательных экспериментов удобно использовать камеры из оргстекла с рабочим объемом 4 см3. Блок камер состоит из двух склеенных между собой пластин размером 20 - 21×7 - 8 см. В верхней пластине толщиной около 1 см просверливают отверстия диаметром 3 см. Нижняя пластина толщиной около 0,5 см служит дном. В блоке 12 камер (лунок), которые расположены в два ряда по шесть в каждом. В каждую лунку вносят по 5 инфузорий. Пять рядов используют для различных концентраций вещества, а шестой - для контроля. Повторность при этом двукратная (два ряда лунок в блоке). Сверху микроаквариум закрывают стеклянной пластинкой соответствующего размера, что препятствует испарению раствора.
В качестве показателей токсического действия целесообразно использовать выживаемость и темп деления простейших.
В первом случае в камерах из оргстекла (объем 4 см3) определяют концентрации вещества, вызывающие гибель (LC16, LC50, LC100) или любое повреждающее действие (EC16, EC50, ЕС100) подопытных организмов за определенный срок. Длительность опыта определяется токсичностью среды и составляет обычно от нескольких часов до 5 суток. Контролем служит культуральная среда. Наблюдения проводят под бинокуляром каждые сутки.
Эксперименты на простейших проводят в два этапа (предварительный и окончательный). В предварительном эксперименте находят интервал токсических концентраций. Опыты ставят в широком диапазоне концентраций токсиканта, причем предыдущую концентрацию последовательно увеличивают в 10 раз (0,1; 1,0; 10,0 и т.д.). В окончательном эксперименте, установив диапазон действия токсиканта, разбивают найденный интервал на пять равных концентраций и устанавливают ЛК50.
Темп деления простейших, определяют в микроаквариумах (планшет с ячейками (лунки диаметром 1 см, глубина 0,5 см). Планшет с микроаквариумами представляет собой стеклянный или изготовленный из оргстекла квадратный или прямоугольный брусок толщиной 1 см с пятью рядами полированных лунок. В каждом ряду, соответственно, 5 или 10 лунок. Микроаквариумы накрывают стеклянной пластинкой во избежание испарения среды из лунок.
Лунки в каждом ряду (5 - 10 лунок) заполняются раствором вещества определенной концентрации. В каждую лунку микроаквариума помещают по одному организму. Ежесуточно в течение нескольких суток (3 - 5 суток) подсчитывают количество организмов в каждой лунке каждого ряда, оставляя, после подсчета организмов, в лунке исходное количество организмов (1 экземпляр), удаляя лишние организмы. Или можно по одному организму переносить в соответствующую лунку с теми же концентрациями вещества аналогичного планшета с микроаквариумами.
3.5. Учет и анализ результатов
В качестве показателя действия токсикантов на тест-объект используют показатель выживаемости инфузорий за определенный срок наблюдения или нарушение темпа деления клеток инфузорий, которое выражается в изменении прироста численности клеток в процентах от контроля. Прирост численности организмов оценивают по формуле:
N = Nt - N0,
где Nt - численность организмов в конце опыта (или последующие сутки подсчета), а N0 - численность организмов в начале опыта (или предыдущие сутки подсчета). Результаты обрабатывают методами статистики.
4. Установление максимальной допустимой концентрации вещества для коловраток
4.1. Введение
Коловратки представляют существенную часть планктона морей, включая внутренние морские воды Российской Федерации и являются наиболее распространенным кормом в естественных условиях для личинок многих видов морских рыб и некоторых беспозвоночных. Коловратки эффективно очищают загрязненные воды от бактериальной флоры. Питаются бактериями и одноклеточными водорослями.
Для целей токсикологического эксперимента наиболее пригодна коловратка брасионус пликатилис пликатилис (Brachionus plicatilis plicatilis - Методические рекомендации по биотестированию природных, сточных вод и отдельных загрязняющих веществ. М.: ВНИРО, 1982). Коловратка легко культивируется в лабораторных условиях при солености воды 17 - 25. Имеет короткий жизненный цикл, дает ряд поколений в течение нескольких дней.
4.2. Характеристика тест-объекта
Коловратка В. plicatilis plicatilis встречается в морях и внутренних морских водах Российской Федерации. Вид эвригалинен и эвритермен. Сравнительно большой размер (около 600 мкм) значительно облегчает проведение токсикологических экспериментов.
По систематическому положению коловратки относятся к низшим червям. Тело коловратки состоит из головы, туловища (покрытого мягким панцирем) и ноги. На переднем конце головы расположен коловращательный аппарат с ресничками, который служит для плавания и захвата пищи. Колебанием ресничек пищевые частицы (микроорганизмы, простейшие, детрит, различные виды одноклеточных водорослей) могут привлекаться или отталкиваться (при избытке или несоответствии пищи).
В. plicatilis plicatilis при культивировании в качестве корма предпочитает более мелкие округлые водорослевые клетки. Обладает способностью регулировать число заглатываемых клеток с помощью фильтрующего аппарата. Размеры пищевых частиц не превышают 12 - 15 мкм.
Размножается коловратка как партеногенетически, так и половым путем. Жизненный цикл В. plicatilis plicatilis состоит из трех периодов: однополого размножения, двуполого размножения и стадии покоя. Эти периоды могут протекать параллельно в одной культуре.
Период однополого размножения начинается вылуплением амиктических (партеногенетических) самок из покоящихся яиц. Амиктические самки не способны к оплодотворению, они производят и вынашивают амиктические яйца, из которых вылупляются либо амиктические самки, либо (в зависимости от условий) миктические самки, способные как к однополому, так и к двуполому размножению. Миктические самки вынашивают миктические яйца, из которых развиваются самцы. В случае оплодотворения, миктическая самка откладывает покоящиеся яйца, из которых после латентного периода снова вылупляются амиктические самки.
Амиктические самки с партеногенетическими яйцами составляют основу здоровой быстро размножающейся популяции коловраток. Плодовитость В. plicatilis plicatilis от 1 до 8 яиц на самку.
После выклева коловратка достигает половозрелости через 20 - 30 ч при температуре 20 - 25 °С, через 16 - 20 ч - при 26 - 28 °С. В это время у нее появляется первое яйцо. Первый вымет молоди коловратки могут дать на 2 - 3 сутки, но массовый вымет наступает на 3 - 4 сутки. Плодовитость самки зависит от ее физиологического состояния и продолжительности жизни, которая колеблется от нескольких дней до 1,5 - 2 недель. За свою жизнь самка откладывает несколько десятков яиц. Длительность сенильного (постпродуктивного) периода самки 2 - 4 суток.
Амиктические и миктические самки, присутствующие в культуре, внешне отличаются по наличию определенного типа яиц.
Амиктические (партеногенетические) яйца, из которых развиваются партеногенетические самки, крупные 115 - 170 мкм, тонкостенные, с полупрозрачным содержимым, в количестве 1 - 3 у одной самки на разных стадиях эмбриогенеза, редко до 7 - 8 штук.
Миктические покоящиеся (оплодотворенные) яйца в количестве не более 3 у одной самки также крупные, размером 115 - 170 мкм, толстостенные, непрозрачные, с темнокоричневым содержимым, прилегающим к оболочке, или с оранжевым содержимым, отстоящим от оболочки на одном из полюсов. Покоящиеся яйца способны переносить различные неблагоприятные условия в водном объекте. Эти яйца морфологически и физиологически разнокачественны, что обуславливает порционность выхода из них коловраток.
Миктические яйца, из которых развиваются самцы, мелкие - размером 80 - 110 мкм, в количестве от 1 до 12 у одной самки, с полупрозрачным содержимым. Продолжительность жизни самцов 3 - 4 суток.
При культивировании следует избегать условий, при которых появляются миктические самки, поскольку их покоящиеся яйца имеют латентный период. Молодь из покоящихся (латентных) яиц может выклевываться через несколько недель, месяцев или даже лет. Появление покоящихся яиц в культуре обусловлено резким изменением одного или нескольких внешних факторов (повышением или понижением температуры, ухудшением кормового режима, изменением солености и др.).
Переход к двуполому размножению является признаком неблагополучия в культуре, при этом доля миктических самок превышает 10 %.
При смешанном размножении в популяции коловраток имеются самцы и самки всех категорий: ювенильные, амиктические, миктические оплодотворенные с покоящимися яйцами и неоплодотворенные, а так же сенильные самки. Наличие разных стадий жизненного цикла и их численное соотношение характеризуют состояние культуры коловраток.
4.3. Условия лабораторного содержания
При культивировании коловраток необходимо поддерживать на одном уровне температуру, освещенность, соленость, концентрацию корма и режим кормления во избежание перехода от партеногенетического размножения коловраток к половому.
Культивирование проводят при температуре от 20 °С до 25 °С, как при естественном, так и при искусственном освещении (не менее 500 - 3000 лк) в люминостате, с естественной сменой дня и ночи.
Культивируют коловраток в колбочках объемом 50 - 100 см3. Число колбочек с маточной культурой коловраток должно быть в количестве 2 - 3 штуки. Средой для культивирования является природная или искусственная морская вода (п. 2 Приложения 1).
Кормом являются морские микроводоросли монохризис или изохризис (Monochrysis (Pavlova) lutheri; Isochrysis galbana).
Корм вносят через 2 - 3 суток из расчета 0,5 см3 водорослей (при плотности клеток культуры водорослей 15·104/см3) на 10 мл культуры коловраток при плотности коловраток 5 - 10 экз/см3.
От концентрации корма зависят многие продукционные показатели культуры коловраток. Если концентрация корма выступает лимитирующим фактором, то сокращается общая продолжительность жизни организмов, их плодовитость, скорость рождаемости.
Избыточное количество корма настолько быстро проходит через пищеварительный аппарат коловраток, что не усваивается и наступает парадоксальная ситуация - избыток корма приводит к голоданию коловраток и снижению продукционных показателей, а кроме того, загрязняет выростные емкости.
Показателем высокого качества маточной культуры является почти полное отсутствие самок с миктическими яйцами, самок с покоящимися яйцами и самцов. В культуре должны преобладать амиктические самки с 1 - 3 и более яйцами.
Маточную культуру коловраток можно создавать из яиц коловраток (по аналогии с артемиями).
В том случае, когда маточную культуру начинают создавать от нескольких десятков амиктических самок, культивирование начинают в микроаквариумах.
В каждую лунку сажают по одной амиктической самке. Молодь из лунок, появляющуюся в течение трех-четырех дней, переносят в колбочки объемом 50 - 150 см3 с морской водой, постепенно увеличивая маточное стадо коловраток до 5 - 10 экз/мл.
При достижении плотности организмов в культуре 100 - 200 экз/см3, среду обновляют: сливают половину культуры из колбочки и добавляют свежую среду (искусственную или природную морскую воду).
Для маточной культуры коловраток желательно иметь хотя бы 1 бюкс объемом не более 50 см3, поскольку в бюксе с широким горлом очень удобно вести контроль за популяционной структурой коловраток. Бюкс можно поставить под бинокуляр и просмотреть всю культуру сразу.
Для культивирования коловраток и проведения токсикологических экспериментов необходимы лабораторное оборудование и реактивы:
весы аналитические;
бинокуляр МБС-9 или МБС-10;
рН-метр;
прибор для измерения солености воды;
микрокомпрессоры;
реактивы для приготовления искусственной морской среды (п. 2, Приложения 1 настоящих Методических указаний);
бумага фильтровальная;
вода дистиллированная;
мерные колбы на 1000, 100, 50 см3;
бюксы с широким горлом на 50 см3;
градуированные мерные пипетки на 10, 5, 1, 0,1 мл;
пипетки для пересадки коловраток (пастеровские пипетки с укороченным концом);
микроаквариумы;
культура коловраток Brachionus plicatilis plicatilis;
морские микроводоросли для корма Monochrysis (Pavlova) lutheri или Isochrysis galbana.
4.4. Проведение исследований
Токсикологические исследования проводят только на одновозрастной культуре коловраток.
Для получения большого количества одновозрастной культуры отбирают 50 активных самок с яйцами и помещают по одной в микроаквариумы объемом 0,5 см3 каждый (планшет с ячейками). Появившуюся молодь переносят в новые микроаквариумы, заполненные морской водой и кормом. Третий помет коловраток, как правило, является наиболее плодовитым, поэтому, при необходимости использования в эксперименте большого количества организмов, удобнее работать с одновозрастной молодью третьего помета.
Возможно так же получение односуточной культуры для проведения эксперимента путем замачивания яиц коловраток в морской воде. При этом происходит синхронизированный выклев молоди коловраток, что очень важно при постановке опыта.
Односуточная молодь становиться половозрелой через 1 - 2 суток (появляется первое яйцо) и дает массовый вымет молоди через 3 - 4 суток.
Периодически, не реже 1 раза в месяц при культивировании коловраток, а также непосредственно перед постановкой эксперимента, необходимо проводить контроль чувствительности культуры коловраток к эталонному веществу - двухромовокислому калию K2Cr2О7 марки "хч" или стандарт-титру калия двухромокислого. Для этого готовят маточный раствор двухромовокислого калия концентрацией 1 г/дм3. Далее методом разбавления - серию концентраций 150,0; 180,0; 210,0; 240,0 и 300,0 мг/дм3, с которыми проводится исследование. По данному эталонному веществу LC50 за 24 ч для коловраток находится в диапазоне 180 - 240 мг/л (соленость 20).
Если полученное значение ЛК50 не попало в указанный диапазон концентраций, то эксперименты с данной культурой коловраток не проводят.
Исследование токсического действия веществ на тест-организмы проводят в острых и хронических экспериментах.
4.4.1. Острое токсическое действие вещества исследуют в течение 24 ч. По результатам эксперимента оценивают выживаемость коловраток за 24 ч и определяют ЛК вещества.
Предварительный эксперимент проводят с 4 - 5 концентрациями вещества, различающимися в 10 раз; например:, 0,001; 0,01; 0,1; 1; 10 мг/дм3 и т.д. Этот опыт позволяет установить границы остролетальных концентраций вещества.
Основной эксперимент проводят по результатам предварительного. Выбирают диапазон концентраций вещества, которые вызывают гибель меньше 50 % и больше 50 % коловраток в предварительном эксперименте. Шаг между концентрациями различается в 2 - 5 раз.
В экспериментальные микроаквариумы объемом по 0,5 мл помещают растворы исследуемых концентраций вещества. В каждый микроаквариум рассаживают по одному экземпляру коловраток возрастом 1 сутки, начиная с контроля и далее от наименьшей концентрации по возрастанию. В контроле и в эксперименте (в каждой концентрации) используют по 20 коловраток.
Условия проведения опытов такие же, как и при культивировании данного объекта. В ходе острых опытов коловраток не кормят.
4.4.2. Хроническое токсическое действие вещества исследуют около 2 недель (11 - 14 дней).
Исследование проводят на 3-х поколениях коловраток. По результатам исследования оценивают (по сравнению с контролем):
а) выживаемость коловраток в разных концентрациях вещества в исходном, в 1-ом, 2-ом и 3-ем поколениях;
б) наступление половозрелости в каждом из трех поколений;
в) плодовитость коловраток в каждом поколении и общую плодовитость.
Половозрелость коловраток отмечают с момента появления первого яйца. Плодовитость коловраток - количество молоди, появившейся в каждом поколении. Общая плодовитость коловраток в каждом поколении определяется как сумма всей молоди за 4 вымета.
Для хронических опытов берут не менее 4 - 5 концентраций вещества, в установленном диапазоне по ЛК50 за 24 часа.
В контроле и опыте (в каждой концентрации) используют не менее 20 коловраток, помещая в каждую лунку микроаквариума по одному экземпляру возрастом 6 ± 2 ч.
Коловраток во время проведения эксперимента кормят водорослями раз в 2 - 3 суток. Концентрация клеток водорослей та же, что и при культивировании коловраток. Предварительно культуру водорослей концентрируют центрифугированием. Концентрированный корм добавляют в каждую лунку на кончике пастеровской пипетки.
При проведении опытов на поколениях коловраток (Таблица 4.4.1) придерживаются схемы, аналогично проведению опытов с дафниями.
Таблица 4.4.1
Схема опытов на серии поколений коловраток
|
Оцениваемое поколение |
Учитываемые пометы |
Сумма молоди |
|
Исходное Хисх |
Х0исх, Х1исх, Х2исх, Х3исх, Х4исх |
∑Х1-4исх |
|
Первое Х1 |
Х01, Х11, Х21, Х31, Х41 |
∑Х1-41 |
|
Второе Х2 |
Х02, Х12, Х22, Х32, Х42 |
∑Х1-42 |
|
Третье Х3 |
Х03, Х13, Х23, Х33, Х43 |
∑Х1-43 |
Примечание. X - поколения; верхний индекс - пометы каждого поколения; нижний индекс оцениваемое поколение
Подготовленную для эксперимента культуру коловраток (исходную молодь) рассаживают в микроаквариумы по 1 экземпляру. После того, как исходные особи дали первый помет (1-е поколение - Х1исх), эту молодь отсаживают (Х01 - "исходная" молодь первого поколения) в том же количестве в другие лунки-микроаквариумы, соответствующие тем же концентрациям вещества и т.д.
За исходными особями ведут наблюдение до получения 4-х пометов в 3-ем опытном и контрольном поколениях. Наблюдения, которые ведутся за исходными особями, повторяют с 1-м, 2-м и 3-м поколениями.
4.5. Учет и анализ результатов
Для определения наличия действия концентрации исследуемого раствора вещества на коловратках отмечают изменение выживаемости, плодовитости, время наступления половозрелости тест-организмов в тестируемом растворе по сравнению с контролем.
Статистически достоверное отклонение от контроля исследуемых показателей в различных концентрациях вещества свидетельствует о наличии действия определенной концентрации вещества на коловраток.
5. Установление максимальной допустимой концентрации вещества для зоопланктонных ракообразных
Из представителей зоопланктонных ракообразных в морских токсикологических исследованиях используют жаброногого рачка артемию салину (Artemia salina). Помимо жаброногого рачка часто используют культивируемые в лабораторных условиях различные виды мизид в возрасте 3 - 5 суток. В опыт берут организмы на самых чувствительных стадиях развития (после выклева, при переходе на активное питание, линьке и т.п.).
Из природных вод к лабораторным условиям адаптируют крупные организмы доминирующих видов зоопланктонных ракообразных, таких как калянус, идэя, калянипеда (Calanus finmarchicus, Idyaea furcata - северные моря России; Calanipeda aquaedulcis - Каспийское море); ракообразных семейства мизид и чилимов (дальневосточные моря).
5.1.1. Характеристика тест-объекта
Жаброногий рачок - артемия салина (Artemia salina L.) удобен в качестве тест-объекта, что определяется его эвригалинностью, доступностью в любое время года исходного материала (яиц), возможностью длительного хранения яиц (в течение нескольких лет), легкостью содержания и культивирования в воде разной солености. Адаптация при этом не требуется.
При благоприятных условиях выклев науплиев артемий из яиц происходит за 1 - 2 суток (при 25 °С - в течение 24 часов; при 20 °С в течение 48 ч). В течение первых дней жизни науплии не потребляют оформленной пищи, находятся на эндогенном питании. На 4-е сутки науплии переходят на активное питание оформленной пищей. В зависимости от температурных условий артемии достигают половозрелого состояния в течение 3 - 4 недель после вылупления из яиц.
В связи с различной устойчивостью артемий к токсикантам на разных стадиях развития, в токсикологических экспериментах ставят опыты с развивающимися яйцами, науплиальными стадиями артемий и взрослыми особями, используя каждую стадию как отдельный тест-объект.
Из всех стадий развития артемий, наиболее чувствительным тест-объектом, являются науплии в возрасте 1 суток (переход ортонауплиуса в метанауплис). Данная стадия используется как тест-объект в экспериментах при разработке ПДК вещества.
5.1.2. Условия лабораторного содержания
Используется обычное лабораторное оборудование, приборы, посуда и реактивы, в том числе:
микрокомпрессоры;
микроскоп биологический, обеспечивающий увеличение в 100 - 200 раз;
оксиметр;
рН-метр;
прибор для определения солености воды;
мембранные фильтры (размер пор 0,45 мкм и 3 - 5 мкм);
дистиллированная вода;
стеклянные бутыли на 20 л - 2 штуки;
стаканы лабораторные на 50, 100, 300, 500, 1000 см3;
чашки Петри;
градуированные пипетки на 10, 5, 1, 0,1 мл;
пипетки Пастера стеклянные, вместимостью 2 см3 с укороченным и оплавленным концом для пересадки рачков;
реактивы марки "хч" а также морская соль;
двухромовокислый калий K2Cr2О7 марки "хч" или стандарт-титр калия двухромокислого;
сухие яйца Artemia salina L. (хранятся в холодильной камере).
Исследование с артемиями (Artemia salina L.) проводят при искусственном или естественном освещении, температуре 20 ± 2 °С, от выклева из яйца (односуточные науплии) до половозрелого состояния (21 сутки) на природной морской воде или на искусственной морской воде определенной солености.
При проведении экспериментов с артемиями на искусственной морской воде, последняя служит контролем в экспериментах.
В связи с эндогенным питанием науплиусы артемий не нуждаются в подкормке в течение четырех суток после выклева. В дальнейшем в качестве корма для них используют культуры одноклеточных перидиниевых водорослей из родов Phaeodactylum и Exuviella, или желто-зеленых жгутиковых водорослей Nephrochloris salina, выращиваемых на среде Гольдберга.
Плотность клеток водорослей в среде с рачками при их кормлении - 100 тыс. кл/см3 (слегка зеленоватый или бежевый цвет среды). Подкармливают рачков через 2 суток.
При достаточном внесении корма рачки распределяются равномерно по всей толще воды и активно движутся. При недостатке корма артемии задерживаются у стенок и дна аквариума, взмучивая осадок, при излишке корма собираются у поверхности воды, при этом движение становится замедленным.
В опыт необходимо брать яйца артемий с высоким процентом выклева (60 - 100 %).
Чтобы получить исходный материал для исследования, 1 - 3 г сухих яиц помещают в химический стакан объемом 500 мл и заливают водопроводной водой, заранее отстоянной и аэрируемой в течение суток. Через 30 мин, не взбалтывая содержимого стакана, сливают слой воды над осевшими яйцами, удаляя таким образом пустые оболочки яиц и погибшие яйца. Процедуру очистки повторяют несколько раз.
Отмытые яйца вновь заливают пресной водой, подводят аэрацию и выдерживают в таком состоянии в течение суток. Через сутки пресную воду сливают и яйца несколько раз промывают фильтрованной и проаэрированной морской водой нужной солености с рН 7,8 - 8,2.
Промытые яйца для выклева помещают в плоский кристаллизатор, наполненный морской водой нужной солености. Содержимое кристаллизатора взбалтывают, при этом яйца располагаются по дну монослоем. Через 18 - 24 часа в кристаллизаторе вылупляются первые личинки. Для дружного выклева необходима аэрация и освещенность не менее 1500 - 2500 лк/м2.
Для получения синхронизированного материала первых выклюнувшихся науплиусов Artemia salina L. тщательно отбирают пипеткой Пастера и переносят в стакан (объемом 150 см3) с морской водой. Через час в кристаллизаторе накапливаются новые науплиусы. Отбирают и переносят науплиусов в тот же стакан с морской водой по мере их выклева - 2 - 3 раза в течение трех часов, концентрируя организмы возле одной из стенок направленным источником света (новорожденные науплиусы имеют положительный фототаксис). Далее односуточные науплиусы Artemia salina L. используют в эксперименте.
Один раз в месяц (или при использовании новой партии яиц) проводят проверку выклюнувшихся науплиусов на пригодность к токсикологическому анализу, то есть проверяют их физиологическую чувствительность. Для этого определяют значение LC50 (72 ч) эталонного химического вещества двухромовокислого калия для науплиусов.
Если значение LC50 для организмов находится в диапазоне 6,5 - 8,0 мг/дм3 эталонного вещества, науплиусы пригодны для проведения эксперимента. В случае не попадания LC50 в указанный диапазон концентраций, проверяют соблюдение процедуры выполнения определений, условия подготовки организмов к токсикологическому анализу и, при необходимости, используют новую партию яиц.
5.1.3. Проведение исследований
Исследования на артемиях проводят в 2 этапа (предварительный и основной).
В предварительном кратковременном исследовании (оценка острого токсического действия вещества в течение 96 часов) по 20 экземпляров науплиусов рассаживают по чашкам Петри в контрольную и опытную среды (40 мл). Число повторностей равно трем. Показания снимают ежедневно (в 1, 2, 3 и 4 сутки), удаляя погибших рачков.
Исследуют, как правило, 5 концентраций вещества. При этом следует стремиться к тому, чтобы по крайней мере две из концентраций вызывали бы эффект менее и более 50 %.
При длительном исследовании (оценка хронического токсического действия вещества в течение 21 суток) эксперименты проводят в стаканах емкостью 300 - 500 см3, число повторностей равно трем. Плотность посадки из расчета 1 экземпляр на 25 см3 среды (количество рачков в контрольных и опытных емкостях каждой концентрации - по 10 экземпляров).
После 4-х суток эксперимента, науплиусов кормят водорослями каждые двое суток. Показания снимают по возможности ежедневно (удаляя погибших рачков). Через 21 сутки исследование заканчивается.
5.1.4. Учет и анализ результатов
Для определения наличия токсического действия растворов вещества на артемий, рассчитывают снижение (в процентах) выживаемости тест-организмов в опыте по сравнению с контролем. Используют статистическую обработку результатов эксперимента (Приложение 4 данных Методических указаний).
5.2. Мизиды
5.2.1. Характеристика тест-объекта
Мизиды являются существенным компонентом пищи многих видов рыб и обладают высокими продукционными способностями. Многочисленны в прибрежной зоне морей, удобны в качестве тест-объекта. Легко культивируются в лабораторных условиях и широко используются в токсикологических исследованиях.
В настоящее время культура морских мизид в России отсутствует, поэтому исследования предлагается проводить с природными организмами мизид. Аналогично проводятся исследования с другими природными зоопланктонными ракообразными.
В прибрежной зоне дальневосточных морей многочисленна мизида удивительная (Neomysis mirabilis), которую удобно использовать в качестве тест-объекта. Она распространена в северной части Тихого океана от Сангарского пролива до Командорских островов и Аляски. Обитает на глубинах от 1 до 50 м. Легко адаптируется к лабораторным условиям и широко используется в токсикологических исследованиях, так как обладает низкой резистентностью к воздействию многих химических веществ.
5.2.2. Условия лабораторного содержания
Мизиды легко отлавливаются в прибрежной зоне и содержатся в адаптационных аквариумах в лабораторных условиях в течение 48 ч до начала эксперимента. Травмированные организмы за это время погибают, а остальные акклиматизируются к лабораторным условиям (освещению, температуре, солености воды). По возможности эксперименты проводят с мизидами на ранних стадиях развития.
Для получения молоди, самки мизид с марсупиальными сумками, содержащими эмбрионов на последних стадиях развития, помещаются в специальные емкости. Выметанная молодь (возрастом 3 - 5 суток) отбирается для экспериментов. Адаптированных к лабораторным условиям мизид длиной 9 - 12 мм, возрастом 2 месяца и старше также отбирают для экспериментов.
Обязательно проведение оценки физиологической активности взятых для эксперимента организмов по эталонному веществу, с записью в отчете полученной величины ЛК50.
5.2.3. Проведение исследований
В остром опыте в каждый стакан помещают по 5 экземпляров мизид на 0,5 дм3 раствора. Выметанную молодь для острых опытов рассаживают по 6 экземпляров в 0,2 дм3 раствора. Для анализа токсичности раствора необходимо проверить, как минимум, 5 концентраций в 3 - 5 повторностях. При этом следует стремиться к тому, чтобы по крайней мере по одной концентрации вызывали эффект менее 50 % и более 50 %. Параллельно ставится контрольный опыт также в 3 - 5 повторностях с организмами из той же партии. В течение 96 ч острого эксперимента мизид не кормят.
По результатам 96 часового эксперимента рассчитывают токсикологические параметры острого опыта (ЛК0, ЛК50, ЛК100).
Длительность хронического эксперимента до 30 суток. В опыт отбираются 3 - 5 суточные экземпляры мизид, выметанных в лаборатории - по 10 экземпляров на 0,5 л раствора. Кормить мизид в первые две недели необходимо 2 раза в сутки измельченным природным планктоном, а в последующем - живыми науплиями артемий.
Смена раствора в эксперименте осуществляется 1 раз в 3 дня, учитывая плотность посадки, а также - с учетом стабильности исследуемого вещества.
В первую неделю подсчет выживших рачков проводят ежесуточно, а в последующем - каждые 1 - 2 дня. В конце эксперимента мизид измеряют.
5.2.4. Учет и анализ результатов
Тест-функцией состояния организмов служит их выживаемость, регистрируется также процент уродливых особей. Отмечается изменение внешнего вида, поведенческие реакции, вес и размер особей.
Критерием для определения гибели служит отсутствие реакции на стеклянную палочку. Вследствие того, что мертвые рачки могут разлагаться или быть съеденными в промежутках между подсчетами, следует учитывать только живых организмов (при каннибализме мизид рассаживают по одному). Погибшие мизиды удаляются при каждом наблюдении.
Если смертность в контрольной группе превышает 10 %, все данные признаются недействительными и эксперимент повторяется заново.
По окончании опытов с помощью пробит-анализа проводят расчеты параметров токсичности - ЛК0, ЛК5, ЛК50, ЛК95, ЛК100.
При смертности тест-объектов в контроле, превышающей 5 %, вводится поправка Аббота (п. 1.3 Приложения 4). Достоверность различий с контролем оценивается при 5 % уровне значимости.
6. Установление максимальной допустимой концентрации вещества для бентосных организмов
При оценке токсического действия вещества на бентосные организмы наиболее часто используют следующие организмы: двустворчатые моллюски семейства митилид - мидия мускулистая и др. (северные, дальневосточные моря, Черное море), абра, кардиум, дидакна (Каспийское море); брюхоногие моллюски - литорина (северные моря, Черное море); ракообразные - бокоплавы (практически повсеместно); морские ежи - взрослые особи (северные моря), икра ежей (северные, дальневосточные моря).
6.1. Мидии
6.1.1. Характеристика тест-объекта
Мидия - широко распространенный вид двустворчатых моллюсков, образует две экологические морфы: скаловую и иловую. Скаловая мидия обитает в прибрежной зоне на каменистых субстратах в горизонте от сублиторали до глубин 20 - 25 м, образуя в верхнем 10-метровом слое сплошные поселения. Иловая морфа образует банки в открытом море на глубинах 35 - 75 м.
По показателю выживаемости мидия обладает высокой токсикорезистентностью ко многим типам загрязнения. Наряду с этим, пороговая чувствительность по некоторым показателям физиологической активности этого моллюска находится на уровне ПДК вещества для водных объектов рыбохозяйственного значения. Широкая распространенность и низкая смертность при изменении абиотических факторов позволяют легко добывать экспериментальный материал и содержать мидий в лабораторных условиях. В то же время повышенная чувствительность физиологических функций к действию токсикантов позволяет с большой точностью определять пригодность водной среды для жизнедеятельности моллюсков.
Для регистрации показателей токсичности используют следующие тест-функции: интенсивность потребления кислорода, биссусный тест, трофическая активность, степень агрегированности и скорость собирания в друзы.
Для проведения исследований наиболее пригодны молодые неполовозрелые мидии размером не более 30 мм, находящиеся в фазе активного роста. На этой стадии онтогенеза мидии обладают наибольшей двигательной, дыхательной и трофической активностью и меньше подвержены индивидуальным различиям, связанным с развитием гаметогенетического цикла.
Мидии легко культивируются в лабораторных условиях, что позволяет всегда иметь в лаборатории необходимое количество экспериментального материала, однако в лабораторных условиях не всегда удается создать наиболее оптимальные условия для обитания моллюсков. В связи с этим данный биотест ориентирован на применение в условиях морских лабораторий и полевых экспедиций, использующих живой материал непосредственно из моря.
На Черном море мидия размножается практически круглый год с ярко выраженными пиками в феврале-марте, апреле-мае и августе-сентябре. В планктоне личинки находятся от 8 до 14 суток в зависимости от температуры воды, затем оседают на различные субстраты. Молодь мидий размером 20 - 30 мм можно найти в водоеме практически круглый год.
6.1.2. Условия лабораторного содержания
При исследовании на мидиях используют следующее оборудование:
респирометры;
термооксиметры модели UT-800, либо анализаторы параметров водной среды марки HORIBA, модель U-7;
счетная камера Нажотта;
микроскоп биологический, обеспечивающий увеличение в 100 - 200 раз;
прибор для определения оптической плотности воды.
6.1.3. Отбор мидий для опыта
Друзы моллюсков, доставленные из моря, разбирают на отдельные особи, отделяют от обрастаний и детрита и тщательно промывают чистой морской водой. Отделять мидии друг от друга следует осторожно, во избежание повреждения биссусных желез и травмирования моллюсков. Срезают мидий с друзы маленькими ножницами, обрезая биссусные нити у основания раковины. Для отбора мидий в эксперимент и первичной оценки физиологического состояния анализируемой популяции, очищенных мидий помещают в аквариум с проточной водой на 15 - 25 минут и наблюдают за их двигательной активностью. Здоровые мидии размером 15 - 25 мм начинают шевелиться и пытаются перемещаться по дну аквариума с помощью ноги уже через 2 - 3 минуты после помещения в воду. По количеству двигающихся особей можно предварительно судить о состоянии популяции. В норме примерно 95 % всех отобранных мидий проявляют двигательную активность в первые 5 минут.
6.1.4. Проведение исследований
При постановке опыта у каждой группы испытуемых моллюсков одновременно регистрируется несколько параметров физиологической активности. Для этого в качестве рабочей камеры рекомендуется использовать герметичные респирометры объемом 2 - 3 дм3 с большой площадью дна, на который размещаются датчики постоянной регистрации содержания кислорода, магнитная мешалка, пробоотборник проб воды для определения концентрации корма при выяснении трофической активности тестобъектов. В полевых условиях магнитная мешалка может быть заменена на электромотор (питаемый от аккумулятора или батареи и снабженный крыльчаткой), помещенный в воду. Если по схеме эксперимента дыхательная активность не измеряется, то перемешивание воды может осуществляться с помощью барбатации.
Число организмов в эксперименте 50 - 100 экземпляров. Количество параллельных серий 2 - 3.
Для определения влияния того или иного токсиканта на физиологическую активность мидий в респирометры наливают морскую воду, содержащую определенное количество испытуемого вещества. Выбор рабочих концентраций осуществляется по стандартной схеме токсикологического биотестирования, включая предварительный и окончательный этап эксперимента. Если необходимо провести оценку физиологического состояния мидий, взятых из определенного района побережья, то респирометры заливают природной морской водой, взятой из того же места, что и испытуемые мидии. Как в первом, так и во втором случае, воду перед заливкой в респирометры аэрируют не менее 30 мин для полного насыщения кислородом. После заливки респирометров водой и их герметизации, включают магнитную мешалку. Измерения производят через 15 минут. Регистрируются следующие параметры:
а) концентрация кислорода в воде;
б) температура воды;
в) количество мидий, собравшихся в друзы (друзой считается группа соприкасающихся мидий, состоящая из трех или более экземпляров);
г) прикрепленность ко дну аквариума (определяют длинным проволочным щупом, пропускаемым через отверстие в крышке респирометра, которое после определения закрывают пробкой).
Длительность эксперимента определяется скоростью потребления кислорода. Опыт прекращается, когда концентрация кислорода в воде снижается по сравнению с исходной на 30 %. Если дыхание происходит очень слабо, то длительность эксперимента следует ограничить до 4 - 5 часов, так как дальнейшая экспозиция может быть сильно замаскирована разложением детрита, выделяемого мидиями.
Для проведения экспериментов, в схему которых включено измерение трофической активности мидий, предварительно готовят кормовую смесь. Обычно это суспензия микроводорослей различных видов, либо гомогенат талломов макрофитов. Опыты по определению трофической активности мидий ведутся без измерения потребления кислорода. Аэратор, работающий на малом режиме, остается в аквариуме на все время эксперимента, так как снижение концентрации кислорода в воде блокирует трофику мидий.
Определенное количество микроводорослей либо определенную навеску гомогената, помещают в рабочий аквариум с равномерно размещенными мидиями и тщательно перемешивают с помощью аэратора.
Аликвоты для измерения концентрации пищи в среде отбирают через каждые 5 мин. Все остальные параметры снимают через каждые 15 мин. Аликвоты либо фиксируют для дальнейшего просчета клеток под микроскопом (в случае кормления водорослями), либо помещают в счетную камеру прибора для измерения оптической плотности (в случае кормления гомогенатом). Исходная концентрация корма зависит от разрешающей способности применяемой аппаратуры.
6.1.5. Учет и анализ результатов
На основании экспериментальных данных по стандартным статистическим и биометрическим методикам обрабатывают полученные показатели физиологического состояния мидий. Определяют:
а) интенсивность дыхания - потребление кислорода в единицу времени на единицу биомассы и на одну особь; 2) степень агрегированности - отношение числа особей в друзах к общему числу особей в опыте выражают в процентах;
б) скорость прикрепления к субстрату - время, за которое 50 % особей прикрепились ко дну рабочего аквариума;
в) трофическую активность - количество корма, потребленного одной особью за единицу времени.
Сравнивая показатели, полученные у мидий, взятых в качестве контроля, с показателями, полученными у мидий, подвергшихся действию химического вещества, можно оценить степень нарушения физиологического состояния мидий и сделать заключение о токсичности растворов вещества.
6.2. Литорина
Литорин собирают на литорали. Моллюсков одного размера помещают в стеклянные аквариумы емкостью 5 дм3 по 20 - 25 штук в каждый. Смену растворов в опытных аквариумах проводят не реже двух раз в неделю. Температура воды в опыте для северных регионов составляет 4,5 - 12,0 °С, соленость 34,5 - 35. Кормом для моллюсков служат фукусы.
Взрослых моллюсков и их отложенные кладки инкубируют в соответствующих концентрациях растворов вещества при температуре 11 °С. После вылупления первых моллюсков (науплиальные планктонные стадии) через 60 суток фиксированные кладки анализируют. Критерием токсичности концентраций вещества служило отклонение в эмбриональном развитии моллюсков (смертность, процент вылупления), выживаемость и интенсивность дыхания взрослых литорин.
Для определения интенсивности дыхания (потребление кислорода) используют непроточные респирометры объемом 0,5 дм3, в которые помещают по одному помеченному организму. Интенсивность дыхания определяют по Винклеру.
6.3. Бентосные ракообразные - амфиподы (Gammarus finmarchicus, Niphargoides maeoticus) и др.
Амфипод (бокоплавов) собирают в прибрежной зоне на литорали и акклиматизируют к лабораторным условиям 7 суток при температуре близкой к среде их обитания.
Влияние различных концентраций химических веществ на амфипод исследуют в условиях острого и хронического экспериментов при оптимальных температурных условиях (соответствующих температурному режиму морей северных и южных регионов страны). Длительность экспериментов составляет 4 и 30 суток, соответственно. Опыты ставят не менее чем в трех повторностях. Подопытных рачков содержат в аквариумах объемом от 0,3 до 2,0 дм3 или кристаллизационных чашках. В качестве корма используют бурые водоросли (фукус) и кусочки рыбы. О токсичности различных концентраций вещества судят по выживаемости взрослых особей и молоди, поведенческим реакциям и по нарушению рефлекса питания. В последнем случае применяют сообщающиеся двухкамерные аквариумы, заполненные раствором исследуемого вещества. В эксперименте используют голодных амфипод, взятых из чистой морской воды (контроль), а также после предварительного 5-суточного экспонирования их в различных концентрациях вещества. Амфипод сажают в один отсек, в другой отсек помещают пищевой раздражитель. Затем регистрируют двигательную активность рачков в течение 10 минут, определяя предпочтение пребывания в каждой из двух зон, направление движений, время нахождения корма.
6.4. Морские ежи
Исследуется выживаемость взрослых морских ежей, а также морских ежей на ранних этапах онтогенеза, являющихся компонентом планктонного сообщества (меропланктон).
Эксперименты по выживаемости взрослых ежей проводятся аналогично вышеописанным экспериментам (п. 6.3 Приложения 3) с бентосными ракообразными и моллюсками.
Ниже приводятся приемы исследования на ранних этапах развития (эмбрионы и личинки) морских ежей.
6.4.1. Характеристика тест-объекта
В 70 - 90-е годы исследователями разных стран разработана методология биотестирования с использованием гамет, зародышей и личинок морских ежей - "Sea Urchin Test System". Наиболее широкое применение получил метод, основанный на анализе эмбрионального и раннего личиночного развития морских ежей - "Sea Urchin Embryo Test" (Kobayashi N., 1984. Marine ecotoxicological testing with Echinoderms //Personne G., Jaspers E., Clans C. (eds.) Ecotoxicological Testing for the Marine Environment. Belgium, Breden: State Univ. Ghent & fast Mar. Sci. Res. V. 1, p. 341 - 405). Его основные преимущества: возможность получения большого количества гамет и синхронно развивающихся зародышей; простота инкубации зародышей и личинок на ранних этапах развития в контролируемых условиях; легкость прижизненных наблюдений и анализа фиксированного материала, поскольку нормальный эмбриогенез морского ежа и отклонения от нормы (аномалии развития) детально описаны; возможность использования разных видов морских ежей, так как чувствительность их половых клеток и зародышей к химическим веществам практически одинакова.
Для получения половых клеток можно использовать морских ежей любого из видов, обитающих в морях России. Это в основном - шаровидные морские ежи стронгилоцентротусы (Strongylocentrotus droebachiensis, S. Nudus, S. intermedius), дисковидные морские ежи (Echinaracknius parma, Scaphechinus mirabilis) и ловениды (Echinocardium cordatum).
Морских ежей отлавливают в сезон их размножения, так как только зрелые гонады содержат достаточное количество качественных половых клеток. Для стимуляции нереста применяют инъекцию в превисцеральную полость тела (через перистомальную мембрану) 0,5 см3 0,5 М раствора KCl (на дистиллированной воде). Ежей укладывают аборальной стороной вниз на плоскую поверхность. После начала выделения половых клеток (яйцеклетки имеют желто-оранжевый цвет, сперма - белый) самцов сразу отделяют от самок Самку следует быстро обмыть сначала пресной водой (чтобы уничтожить случайно попавшие сперматозоиды), затем морской и поместить на высокий узкий стакан объемом 100 - 200 мл, заполненный фильтрованной морской водой таким образом, чтобы аборальный полюс ежей был погружен в воду. Сразу после этого из гонопоров начинают вытекать струйками зрелые яйца, довольно быстро оседающие на дно стаканов. Основная масса яиц вытекает в воду за 15 - 30 минут. Воду из стаканов сливают, заменяют свежей и дают яйцам снова осесть; эту процедуру повторяют 2 - 3 раза. Рекомендуется также профильтровать суспензию яйцеклеток через мельничный газ (размер ячеи 100×100 мкм) для освобождения клеток от студенистой оболочки и очистки суспензии от механических примесей. Полученные отмытые яйца желательно сразу же использовать для опыта. В случае необходимости их можно хранить в холодильнике без перемешивания в течение нескольких часов. Партия яйцеклеток не должна содержать недозрелых (ооциты, определяемые по наличию крупного пузырькового ядра) или перезрелых (разрушающихся) клеток.
Сперму следует извлекать из семенников вскрытых самцов и хранить в "сухом" виде в холодильнике или на льду в течение 6 - 12 часов. Перед использованием ее следует разбавить морской водой и таким образом активировать.
6.4.2. Проведение исследований
Предварительно необходимо проверить способность гамет к оплодотворению. Каплю суспензии яйцеклеток помещают на предметное стекло и вносят разбавленную морской водой сперму. Половые клетки считаются качественными, если в течение 3 мин после осеменения оболочка оплодотворения (отслаивающаяся в результате кортикальной реакции желточная оболочка яйцеклетки) появляется не менее чем у 95 % яйцеклеток.
Посуда должна быть стеклянная или нетоксичная пластиковая, однократного использования. Стеклянную посуду следует мыть питьевой содой, без применения мыла и детергентов. Объем инкубационной среды зависит от задач эксперимента, может составлять от 0,3 мл до единиц, десятков и сотен миллилитров.
Яйцеклетки должны быть распределены по дну инкубационной емкости монослоем. Оптимальная концентрация яйцеклеток в среде при проведении экспериментов в течение 48 - 96 часов (время, достаточное до достижения стадии плутеуса у большинства видов морских ежей) не должна превышать 300 кл/см3. Концентрацию яйцеклеток в среде подсчитывают в 3 - 5 аликвотах по 0,01 см3, взятых из взвешенной суспензии яиц, определяют среднее значение и рассчитывают концентрацию в 1 см3.
В пределах одного эксперимента следует использовать один образец спермы с наиболее подвижными и жизнестойкими сперматозоидами. Необходимо соблюдать определенный порядок внесения гамет в инкубационную среду. Рекомендуется первоначально вносить в инкубационную среду яйцеклетки, а затем - сперматозоиды. В этом случае нет необходимости определять концентрацию сперматозоидов, достаточно лишь соблюдать рекомендации по конечному разведению спермы для того, чтобы избежать полиспермии. Величины конечного разведения спермы в инкубационной среде - от 1:60000 до 1:100000.
Для того чтобы правильно идентифицировать стадии развития зародышей и личинок, определять время их прохождения и отличать нормальных зародышей и личинок от аномалий развития, предварительно следует составить таблицу нормального развития используемого в работе вида морского ежа.
Для различных видов стронгилоцентротусов (Strongylocentrotus droebachiensis, S. Nudus и S. Intermedium) можно использовать уже имеющиеся в литературных источниках таблицы. Все опыты должны проводиться при одинаковой температуре, находящейся в пределах оптимального для каждого вида диапазона, и в оптимальных диапазонах солености (обычно 28 - 32) и рН (обычно 7,8 - 8,2).
На определенных этапах развития (обычно это оплодотворение, первое деление дробления, средняя бластула, поздняя гаструла и плутеус) часть зародышей и личинок (не менее 100 экземпляров на каждой стадии) отбирают из инкубационной среды и фиксируют слабым раствором (конечная концентрация 0,02 - 0,05 %) формальдегида или глутаральдегида на морской воде. При использовании иммунологических планшетов фиксацию следует производить прямо в ячейках. Следует иметь в виду, что наличие фиксатора в близлежащих ячейках оказывает отрицательное влияние на личинок, поэтому фиксацию нужно проводить на каком-нибудь одном (конечном) этапе развития (например, гаструлы или плутеуса). На стадиях оплодотворения, первого деления и средней бластулы зародыши, находящиеся в оболочке оплодотворения, неподвижно лежат на дне, что позволяет вести прижизненное наблюдение и осуществлять необходимые подсчеты с использованием инвертированного микроскопа.
Описание этапов развития морского ежа и типичные аномалии эмбрионального развития приведены в таблицах 6.4.1.а, 6.4.1.б.
6.4.3. Учет и анализ результатов
Для получения достоверных результатов опыты с каждым тестируемым образцом вещества в определенной концентрации следует проводить не менее чем в двух повторностях и не менее чем в двух параллелях в пределах каждой повторности.
Подсчитывают долю (в процентах) нормальных и аномальных зародышей и личинок из расчета на 100 экземпляров на каждом этапе развития. Определяют среднее значение, его ошибку (или стандартное отклонение). Определяют достоверность различий между контрольными и экспериментальными данными по критерию Стьюдента. Для определения полулетальной концентрации токсиканта (ЛК50) можно использовать пробит-анализ.
Описание этапов индивидуального развития Strongylocentrotus intermedius
|
Этап |
Основные признаки этапа развития |
Время наступления осеменения при t 20 °С |
|
Оплодотворение |
Оплодотворенное яйцо; сформированная оболочка оплодотворения |
30 секунд |
|
Первое деление дробления |
Дробление полное, радиальное, равномерное |
1 час 07 минут |
|
Средняя бластула (до вылупления) |
Зародыши подвижны и сохраняют сферическую форму; толщина стенок бластоцеля везде одинакова (диаметр бластоцеля около 0,8 мкм) |
9 часов 30 минут |
|
Поздняя гаструла (плавающая личинка) |
Завершение формирования первичной кишки, возникновение орального контакта и связанное с этим появление первых признаков двусторонней симметрии |
20 часов 25 минут |
|
Плутеус |
Сформировалась первая и вторая пары рук. Отделы пищеварительного тракта морфологически полностью выражены |
30 часов |
Типичные аномалии эмбрионального развития морских ежей
|
Этап развития |
Аномалии развития |
|
Образование оболочки оплодотворения |
Несколько полюсов отхождения; деформация перивителлинового пространства |
|
Первое деление дробления |
Полиспермия, которая проявляется в многополюсных митозах, аномальном преждевременном дроблении, неправильной ориентации бластомеров |
|
Бластула |
Остановка развития, зародыши во многих случаях долго сохраняют оболочки оплодотворения; |
|
Дезагрегация бластомеров вскоре после вылупления |
|
|
Гаструла |
Торможение образования первичной кишки; |
|
Первичная кишка неправильной формы; |
|
|
Мезенхимная бластула (клетки первичной мезенхимы заполняют бластоцель); |
|
|
Экстрогаструляция (выпячивание кишки наружу) |
|
|
Плутеус |
Нарушение формирования личиночного скелета; уменьшение размеров по сравнению с нормальными; изменение пропорций тела; деформация кишечника |
7. Установление максимальной допустимой концентрации вещества для рыб
7.1. Вводные замечания
При оценке действия веществ на ихтиофауну эксперименты проводят на икре, личинках, мальках, сеголетках (годовиках) или взрослых половозрелых рыбах.
Однако, в отличие от пресноводных рыб, в настоящее время отсутствуют культивируемые морские рыбы, удобные для проведения опытов на всех этапах раннего онтогенеза (от эмбрионов до сеголетков). На рыбоводных заводах икра проходных и полупроходных рыб, их личинки, мальки и более старшая молодь до определенного времени развиваются в пресной воде.
В настоящее время икру, развивающуюся в морской среде, рекомендуется получать во время нереста рыб непосредственно в водоеме или в лабораторных условиях. Оплодотворение икры в лаборатории производят сухим или мокрым способом в зависимости от вида рыб и конкретных условий проведения экспериментов. Получение морской молоди и взрослых рыб, особенно их транспортировка и содержание в искусственных условиях весьма затруднительны и требуют дополнительных исследований по доработке соответствующих методик.
Наиболее удобным и весьма чувствительным тест-объектом является хорошо изученная в токсикологическом плане культивируемая в искусственных условиях морская культура - гуппи. Исследования на ее особях в возрасте 1 - 2 суток в остром эксперименте (96 ч) условно можно рассматривать как ответную реакцию личинок рыб на токсическое воздействие. Высокая чувствительность гуппи сохраняется на протяжении первых 4 суток, затем их чувствительность к химическим веществам несколько снижается, но остается на уровне для достоверных отклонений. Кроме того, эксперименты проведенные на половозрелых особях морской лабораторной культуры гуппи позволяют не только всесторонне оценить на достоверно однородном материале воздействие химических веществ на старшие возрастные группы рыб, но и использовать более широкий, чем при работе с природными (дикими) популяциями, спектр исследуемых параметров, в частности, показатели реальной плодовитости и жизнестойкости выметанной молоди, характеризующие основополагающий и наиболее чувствительный репродуктивный период.
В настоящее время при токсикологических исследованиях на рыбах рекомендуются следующие тест-объекты: морская лабораторная культура гуппи; рыбы из природного водоема, например, смарида - Черноморский регион; сельдь, навага (икра, личинки), треска (молодь), морская камбала (икра, половозрелые рыбы), семга (смолты) - Северный регион; кутум (икра), бычок кругляк (2 - 3 года), вобла (2 - 3 года) - Каспийский регион; анчоус, минтай, камбаловые (личинки); кета, горбуша (молодь); камбала, красноперка (половозрелые рыбы) - Дальневосточный регион.
При кратковременном исследовании (острые опыты до 96 ч) определяется острое токсическое действие тестируемых растворов веществ на рыб по показателю "выживаемость". Показатель токсичности вещества - снижение выживаемости рыб на 50 % за период от 24 до 96 ч.
При длительном исследовании (хронические опыты до 30 суток) - устанавливается достоверное по сравнению с контролем изменение поведенческих реакций, снижение выживаемости, изменение гематологических, патоморфологических и других показателей жизнедеятельности организмов.
7.2. Гуппи
7.2.1. Характеристика тест-объекта
Гуппи (Poecilia reticulata Peters) - широко распространенная аквариумная живородящая рыбка. В природе встречается в соленых и пресных водах. Выдерживает значительные колебания солености.
Данный тест-объект широко применяется в международных и национальных стандартах при токсикологических исследованиях морей и внутренних морских вод.
Гуппи - мелкие рыбы с ярко выраженным половым деморфизмом. Самцы (3 - 4 см) обычно мельче самок и окрашены в более яркие цвета. В их окраске преобладают серовато-коричниевые тона с очень яркими красными, голубыми, зелеными и черными вкраплениями и точками. Самки достигают 6 см в длину, обычно желтовато-зеленые.
Гуппи выдерживают многократное близкородственное скрещивание, что облегчает получение чистых линий.
Для исследований используют гуппи, адаптированных к различной солености. Изменение солености от 0 до 20 гуппи переносят без адаптации. Постепенная адаптация к океанической солености до 35 занимает около двух недель.
7.2.2. Условия лабораторного содержания
Для содержания (культивирования) гуппи используют термостатированные аквариумы, обеспечивающие плотность посадки тест-объектов из расчета для молоди 1 экземпляр на 1 - 2 дм3, и для половозрелых рыб - 1 экземпляр на 5 дм3 воды. Аквариум размещают в помещении, не содержащем токсических паров или газов, заполняют отстоянной и проаэрированной в течение 7 суток морской водой необходимой солености. Искусственная морская вода для содержания гуппи должна отвечать следующим требованиям: рН 7,8 - 8,2, температура 25 - 27 °С. Воду в аквариуме аэрируют с помощью микрокомпрессоров. Каждые три дня часть воды (1/4 - 1/5 часть) заменяют свежей. Поддерживают первоначальный объем воды в аквариумах, доливая дистиллированную воду вместо испарившейся и контролируя соленость с помощью солемера. Ил со дна аквариума убирают регулярно при помощи сифона.
Кроме рыб в аквариум помещают зеленую водоросль энтероморфу, которая при хорошем освещении хорошо развивается и служит для гуппи укрытием и кормом.
Кормят гуппи 1 - 2 раза в сутки, производителей чаще, сухим (дафнии, циклопы) или живым кормом (мотыль, трубочник, дафнии, циклопы). Корм вносят в таком количестве, чтобы рыбы съедали его без остатка за 3 - 5 минут, так как излишки приводят к ухудшению качества воды в аквариуме. Особенно осторожно следует кормить рыб живыми дафниями и циклопами, которые в морской воде быстро погибают и могут служить источником сильного загрязнения.
Для получения молоди отбирают производителей в возрасте от 1 - 2 лет (продолжительность жизни гуппи в аквариумных условиях 3 - 3,5 года).
Самку готовят к вымету, помещая в отдельную термостатированную нерестовую емкость объемом не менее 4 дм3, заполненную водопроводной водой температурой 25 °С и большим количеством мелколистных растений. Готовность самки к вымету мальков определяют по наличию хорошо заметного темного пятна перед анальным плавником. При этом форма брюшка приближается к прямоугольной, и оно становится намного шире спины. Вымет происходит в искусственную или природную морскую воду (самок перед выметом переводят в аквариумы с морской водой).
После окончания вымета самок изолируют, так как они поедают потомство.
Мальки рождаются сформированными. Лучшим кормом для них является "пыль", состоящая из инфузорий, коловраток, молоди ветвистоусых рачков и науплиусов веслоногих рачков. При отсутствии "пыли" молодь гуппи кормят перетертыми сухими дафниями или любым другим измельченным сухим кормом. На 100 мальков вносят не более 1 г корма. По мере роста в рацион рыб вводят измельченный трубочник, мотыль, коретку и другой живой корм. Однодневных и двухнедельных мальков кормят до 5 раз в сутки, более взрослых 2 - 3 раза. Вносимые порции корма должны быть небольшими и поедаться рыбами в течение 3 - 5 минут.
Мальков сортируют по размерам и постепенно переводят из нерестовых аквариумов в вырастные (вначале объемом 50 дм3, а затем - 200 дм3). Мальки становятся половозрелыми в 4 - 6 месяцев.
Гуппи размножаются и растут при солености воды от 0 до 20 без адаптации при их пересаживании. Для тестирования химических веществ в среде с соленостью выше 20 получают исходный материал (мальков) в пресной воде (или в воде с соленостью до 20) с последующей адаптацией к более высокой солености.
7.2.3. Проведение исследований с гуппи возрастом 1 сутки
В опыте используют гуппи возрастом 1 сутки. Исследования проводят при освещении рассеянным светом, с естественной сменой дня и ночи, концентрацией кислорода в воде не менее 4 мг/дм3 и температурой воды 25 ± 2 °С. Гибель рыбы в контроле не должна превышать 10 %. Диапазон ответной реакции гуппи возрастом 1 - 2 суток (ЛК50 за 96 часов) на эталонное вещество K2Cr2O7 находится в интервале 45 - 60 мг/л.
В аквариум наливают по 10 дм3 контрольной или тестируемой воды. Повторность трехкратная. В каждый аквариум помещают по 10 рыб. Воду в контрольных и опытных аквариумах аэрируют с помощью микрокомпрессоров. Ежесуточно в каждом аквариуме подсчитывают количество выживших рыб и удаляют погибших. Погибшими считают рыб, не подающих признаков движения или дыхания в течение 5 минут после прикосновения к ним стеклянной палочкой.
Для определения наличия острого токсического действия раствора вещества опыт проводят в течение 96 ч. Для определения наличия хронического токсического действия раствора вещества - опыт проводят в течение 30 суток.
При кратковременном исследовании рыб не кормят.
При длительном исследовании смену воды в контрольных и опытных аквариумах проводят через 2 суток (или в соответствии со стабильностью тестируемого вещества в воде), один-два раза в сутки рыб кормят.
7.2.4. Определение влияния веществ на реальную плодовитость гуппи
При необходимости, для изучения влияния тестируемого вещества на реальную плодовитость гуппи, предварительно проводится подготовка тест-объекта.
Полученных от производителей мальков в течение 1 месяца выращивают в просторном аквариуме (на 1 малька - 1 дм3 воды). С появлением первых признаков половых различий, самцов отделяют от самок и продолжают выращивать в отдельных аквариумах. При температуре 25 - 27 °С через 6 месяцев все рыбы становятся половозрелыми. С этого момента их можно использовать в опыте.
За три дня до начала постановки опытов самцов и самок помещают в общий аквариум для спаривания. Соотношение самцов и самок 2:1. Однажды оплодотворенная самка может приносить приплод несколько раз.
Опыт длится до 30 суток. За это время при температуре 25 - 27 °С все самки рожают мальков.
Опыт проводят в трех повторностях. В каждый аквариум помещают по шесть самок. В процессе эксперимента рыб кормят живым кормом. В аквариумах устанавливаются садки с крупными ячейками, чтобы исключить поедание самками новорожденной молоди.
Показателем токсичности тестируемого раствора вещества служат выживаемость самок, реальная плодовитость (количество жизнеспособной молоди), количество мертворожденной молоди по сравнению с контролем.
Жизнеспособную молодь желательно проверить по показателю ЛК50 для K2Cr2O7.
7.3. Эмбрионы и личинки
7.3.1. Икра и личинки беломорских рыб
В качестве тест-объекта используется икра и выклюнувшиеся личинки (апрель) беломорской сельди или (январь) наваги.
Продолжительность эксперимента 33 суток для сельди и 74 суток для наваги (от оплодотворения до перехода личинок на экзогенное питание).
Основными критериями оценки токсичности препарата служат: процент оплодотворения икры, выживаемость икры и личинок, скорость эмбриогенеза от этапа дробления до этапа вылупления, динамика выклева, аномалии в развитии.
Оплодотворение икры проводят "мокрым" способом в чистой морской среде и в заранее приготовленных исследуемых растворах. Субстратом для икринок беломорской сельди служат предметные стекла, помещаемые в чашки Петри. После набухания икры с предметных стекол под бинокуляром с помощью глазного скальпеля удаляют комки и слипшиеся икринки, оставляя на стекле до 30 - 50 икринок. Икра наваги неклейкая и легко раскладывается по чашкам Петри. Процент оплодотворения икры рыб составляет 98 - 99 %. Во всех вариантах опыта и в контроле используется икра от одной самки (соотношение самок и самцов при оплодотворении 1:2).
Эксперименты ставят в чашках Петри со сменой растворов один раз в неделю (или в соответствии со стабильностью исследуемых препаратов). Величина выборки в каждом варианте составляет суммарно по трем повторностям от 120 до 160 икринок.
В качестве фоновой среды в опыте и в контроле используют природную морскую воду, привезенную с места оплодотворения икры. Для наваги соленость воды должна быть не ниже 20.
Температурный режим обеспечивается с помощью термостатирующих лотков. В эмбриональный период температура поддерживается на уровне 3 - 4 °С для сельди, 1,5 °С для наваги. С начала выклева личинок сельди, в соответствии с биологией тестобъекта, температура постепенно поднимается до 11 °С.
Проводится статистическая обработка полученного материала. Достоверность различий средних данных в опыте от контроля оценивается по критерию Стьюдента для уровня значимости 95 % (Р ≥ 0,05). Рассчитываются параметры токсичности.
7.3.2. Исследования на икре и личинках дальневосточных рыб
В водном объекте отлавливают планктонную икру массовых морских видов рыб (анчоус, камбала, минтай) и переносят в лабораторные условия. Инкубацию икры проводят в лабораторных условиях, при этом предличинки сразу попадают в искусственно созданные условия обитания, что исключает необходимость периода адаптации. В эксперименте сравнивают выживаемость предличинок в тестируемых растворах вещества и контроле. Длительность экспериментов с предличинками разных рыб от 96 ч до 10 суток (время рассасывания желточного мешка).
7.3.2.1. Анчоус японский (Engraulis japonicus)
Икра у японского анчоуса пелагическая, свободно плавающая, эллиптическая, с большим диаметром - около 1,25 мм и малым диаметром - около 0,9 мм. Оболочка тонкая, прозрачная. Размеры икринок отрицательно коррелируют с температурой воды, при которой идет нерест, - чем выше температура, тем меньше размер икры.
Продолжительность развития эмбрионов (до выклева) при средней температуре 18 °С составляет 48 ч. При температуре 14 °С развитие эбрионов происходит до 103 ч, при 26 °С - до 23 ч (Камия Н. Пелагическая икра и личинки рыб в заливе Татеяма. Научные доклады (известия) Тихоокеанского хозяйственного института. Т. 11, 1916 г.).
Форма предличинок каплевидная, по мере рассасывания желточного мешка их тело приобретает нитевидную форму. Как у всех сельдеобразных, личинки анчоуса почти прозрачные, пигментация в виде меланофоров располагается на брюшной стороне тела и сохраняется вплоть до фазы оформившегося малька. В заливе Петра Великого длина тела для только что выклюнувшихся личинок составляет 2,4 мм до конца уростиля. Для личинок в возрасте 4 - 5 дней (период рассасывания желточного мешка) - 2,8 - 3,8 мм.
7.3.2.2. Желтоперая камбала (Limanda aspera).
Икра пелагическая, свободно плавающая. Диаметр икринок варьирует от 0,72 до 0,98 мм.
Развитие эмбриона в зависимости от температуры продолжается 4 - 6 дней. Предличинки практически прозрачные, каплевидные из-за сильного смещения к голове желточного мешка. Личинки становятся мальками на 10-й день после выклева.
7.3.2.3. Длиннорылая камбала (Limanda punctatissima punctatissima).
Икра пелагическая, свободноплавающая.
Оплодотворенные икринки совершенно прозрачные и с трудом различимы в воде. Диаметр оплодотворенных и разбухших в воде икринок колеблется от 0,71 до 0,85 мм, составляя в среднем 0,74 - 0,80 мм. Это самые мелкие из всех встречающихся одновременно с ними видов икринок. На первых стадиях развития трудно отделить икринки длиннорылой камбалы от близких к ним по размерам икринок желтоперой камбалы. С конца же II стадии разделение икринок этих двух видов не представляет труда по пигменту в виде рассеянных точек, распространенных почти по всему телу эмбриона, кроме хвостовой части. Глаза в течение всего эмбрионального развития остаются непигментированными (Перцева-Остроумова Т.А. Размножение и развитие дальневосточных камбал. М.: АН СССР, 1961).
Выклюнувшиеся предличинки прозрачны и очень малы. Это самые мелкие предличинки из всех видов дальневосточных камбал. В среднем длина живых предличинок равна 2,32 мм и колеблется от 2,21 до 2,50 мм. На хвостовом стебле у предличинок этого вида ярко выражен поясок из черных и желтых пигментных клеток, что хорошо отличает их от предличинок близкородственных видов. На четвертые сутки предличинки почти полностью утрачивают желточный мешок, их длина в это время составляет в среднем 3,2 мм.
7.3.2.4. Минтай (Theragra chalcogramma).
Икринки минтая пелагические, имеют шаровидную форму, совершенно прозрачны. Они держатся в самом верхнем слое воды. Диаметр в среднем равен 1,4 - 1,7 мм. Оболочка икринок тонкая, но очень плотная. При температуре воды ниже -1 °С развитие эмбриона приостанавливается, но он не погибает даже при вмерзании икринки в лед. Верхний температурный предел жизнеспособности икры минтая экспериментально определен в 15 °С. Вывод о более высокой выживаемости икры минтая при низких положительных температурах (в пределах Японии 2 - 4 °С) подтвержден и другими исследователями. Экспериментально показан также низкий выклев при температуре -1 и 13 °С. На континентальном шельфе нерест минтая протекает в придонных слоях в темное время суток. Икра после вымета всплывает в верхние слои моря, где происходит ее развитие. По мере развития она постепенно опускается в более низкие горизонты. За 10 - 30 ч до вылупления личинок, икра опять поднимается в средние слои. Продолжительность эмбрионального развития минтая составляет 93 градусо·дня (Горбунова Н.Н. Икра минтая и ее развитие. Владивосток: Известия ТИНРО. т. 34, 1951).
Только что вылупившиеся личинки снабжены большим желточным мешком, длина их составляет 3 - 4,6 мм, в среднем около 4 мм.
7.3.1 Условия лабораторного содержания дальневосточных предличинок рыб. Проведение исследований
Икра анчоуса и камбал на I - XI стадиях отлавливается днем из поверхностного слоя с помощью нестандартного орудия лова, изготовленного по типу сети Маручи-Ами с диаметром входного отверстия 1,3 м. Доинкубирование икры осуществляют при температуре 14 - 21 °С.
Работы с икрой и предличинками необходимо проводить в хорошо освещенных аквариальных помещениях, где не используются летучие химические вещества. Стабильные температурные условия обеспечивают с помощью термостатируемых аквариумов. Вылупившихся предличинок рассаживают пипеткой в экспериментальные емкости по 5 экземпляров на 100 см3 отстоянной и отфильтрованной через тройной слой газа № 61 морской воды с соленостью 33.
В эксперименте оценивается выживаемость личинок, которая является интегральной характеристикой резистентности организмов. Смертность в различных сериях острых экспериментов подсчитывают через 12 ч в течение всего опыта.
Опыты на предличинках анчоуса и камбал проводят в стеклянных стаканах с объемом растворов 100 см3. В каждый сосуд помещают по 5 особей. Для снижения гибели в контроле и улучшения воспроизводимости результатов, предличинок рассаживают через 12 ч после их выклева (возраст 14 - 22 ч). Незначительные изменения температуры воды в опыте и контроле соответствуют природному ходу температур. Освещенность повторяет естественные суточные циклы. Продолжительность экспозиции в экспериментах на предличинках анчоуса и камбал составляет 96 часов. За это время при температуре 18 °С происходит рассасывание желточного мешка.
При необходимости проводят предварительные эксперименты, на их основании устанавливают диапазон токсичных концентраций для основного опыта, состоящий из четырех-пяти концентраций вещества. При этом следует стремиться к тому, чтобы, по крайней мере, по одной концентрации вызывали эффект менее 50 % и более 50 %.
Опыты проводятся в трех повторностях. Параллельно ставится тройной контроль, с соблюдением тех же условий, что и в опыте: организмы берутся из той же партии, вода та же, но без внесения исследуемого вещества. В течение 96 ч эксперимента среду содержания не заменяют, предличинок не кормят.
При проведении токсикологических опытов регистрируют следующие показатели по сравнению с контролем:
а) основные: выживаемость, процент уродливых особей;
б) дополнительные: внешний вид, поведенческие реакции (снижение двигательной активности, оседание на дно).
По окончании опытов проводят подсчет погибших особей с учетом "поправки Аббота" (п. 1.3 Приложения 4 настоящих Методических указаний) и расчет параметров токсичности - ЛК0, ЛК16, ЛК50, ЛК84, ЛК100.
Показателем токсичности является достоверное снижение выживаемости и наличия уродливых особей. Опыт считается достоверным, если гибель в контроле не превышает 10 %.
7.4. Мальки и взрослые рыбы
Для исследований используют рыб морских видов, легко адаптирующихся к аквариальным условиям. Например, молодь кеты, горбуши; сеголеток и рыб более старших возрастных групп - красноперки, камбалы, наваги, сельди.
Для этого отлавливают молодь или взрослых особей из водного объекта. Рыб транспортируют на специально оборудованном транспорте с регулируемой подачей кислорода. При длительных перевозках необходим постоянный контроль за кислородным режимом и температурой воды, так как при резких перепадах данных показателей возможен значительный отход (гибель) перевозимой рыбы. При кратковременных перевозках можно использовать молочные бидоны или полиэтиленовые мешки, не допуская травмирования и резкого снижения содержания кислорода в воде.
7.4.1. Условия лабораторного содержания рыб из природного водного объекта
В аквариальных условиях привезенную рыбу помещают в приготовленную заранее отстоянную профильтрованную природную морскую воду (рН 7,8 - 8,5), при постоянном контроле растворенного в воде кислорода (от 8,5 до 9,5 мг/л), поддерживаемого за счет аэрации.
Емкости, в которых содержится рыба, должны быть оборудованы биофильтрами, а вода в них должна периодически обновляться за счет частичной замены не реже одного раза в 10 суток и полной замены не реже одного раза в месяц.
Срок адаптации рыб к условиям аквариальной не менее 10 суток.
Плотность посадки не должна превышать 1 г ихтиомассы мальков и 2 г взрослых рыб на 1 дм3 воды.
Для кормления рыб используют специальные пастообразные, гранулированные или живые корма, которые задают по мере его съедания, но не реже двух раз в сутки для мальков (утром и вечером) и один раз для рыб более старшего возраста.
Для проведения исследований необходимы следующее оборудование, приборы и материалы:
стеллажи;
емкости на 10, 20, 40, 60, 100, 200, 500, 1000 и 2000 л;
холодильные установки для хранения корма и реактивов;
весы аналитические с разновесами; весы аптекарские (чашечные и ручные);
микроскоп биологический, обеспечивающий увеличение в 100 - 200 раз;
электромешалка;
вентиляторы или кондиционер;
ведра эмалированные;
бидоны, ведра эмалированные, тазы и кюветы разных размеров;
фотоаппарат:
сачки разноячейные;
материал из мелкоячейной сети, газа или дели для емкостей с рыбой;
микрокомпрессоры;
аквариумные водонагреватели с датчиками;
скальпели, пинцеты, ножницы, шприцы на 1 - 20 мл, препаровальные иглы;
секундомер;
линейки;
набор приборов, инструментов и реактивов для исследования крови;
гистологических и биохимических исследований;
стеклянная посуда емкостью от 0,1 до 3 л, мерные пипетки, глазные пипетки, бюретки, мерные стаканы, колбы, чашки Петри, стеклянные трубки и палочки;
резиновые шланги разного диаметра и длины, резиновые груши;
полиэтиленовая пленка, клеенка, марля, халаты, резиновые фартуки, сапоги и перчатки;
карандаши по стеклу, лейкопластырь, фиксирующие и дезинфицирующие жидкости.
7.4.2. Проведение исследований
Для исследований отбирают одноразмерные экземпляры рыб в хорошем физиологическом состоянии.
Перед началом экспериментов рыб помещают в аквариумы или другие экспериментальные емкости на 7 - 10 суток с целью адаптации к новым условиям. В острых опытах длительностью 96 ч проводят определения ЛК0, ЛК50 и ЛК100. Хронические опыты начинают с концентрации, равной 1/2 ЛК9650, и создают токсикологический ряд из 5 - 10 убывающих концентраций вещества с множителем 1/2. Длительность хронических опытов составляет 1 - 3 месяца в зависимости от стабильности исследуемого вещества в воде.
Эксперименты проводят в стеклянных аквариумах или пластмассовых ваннах емкостью 20 - 40 дм3 в двукратной повторности с использованием 5 - 10 особей в каждой концентрации вещества. Два аквариума служат контролем.
Норма посадки мальков, сеголетков и годовиков лососевых и сиговых рыб в экспериментальные емкости для проведения опытов должна быть не более 1 г ихтиомассы на 1 л воды в сутки. Для рыб возрастом более года эта величина составляет не более 3 г на 1 дм3 воды в сутки.
Взвешивание рыб производят перед началом опыта, затем через каждые 10 - 15 суток до его окончания. Для этого на весы ставят сосуд емкостью 2 - 2,5 дм3, в который наливают 0,5 - 1 дм3 воды, и уравновешивают его с помощью гирь или другого сосуда с водой. Затем отловленных сачком рыб быстро помещают в сосуд с водой для взвешивания, предварительно осушив низ сачка от избытка влаги марлей. Мальков взвешивают с помощью химических стаканов на аптекарских или других более точных весах.
В экспериментальных емкостях ежедневно измеряют температуру воды и один раз в 10 суток проводят определение содержания растворенного в воде кислорода и рН.
В зависимости от стабильности исследуемого вещества смену воды в опытных емкостях проводят один раз в 1 - 3 суток, спустя 1,5 - 2 ч после кормления рыб. При этом недопустимо травмирование рыб. Аэрация воды возможна лишь в тех случаях, когда состав и концентрация исследуемого вещества не изменяются. Толщина слоя воды в аквариуме для сеголетков и годовиков должна быть не менее 20 см, для более крупных рыб ее следует увеличивать.
Схема и динамика проведения опытов, учет регистрируемых показателей отражаются в лабораторном журнале.
Опыты по определению параметров острой и хронической токсичности веществ, установления коэффициентов кумуляции проводят на мальках или сеголетках. Ставят также острые и хронические опыты на сеголетках или двухлетках для определения их токсичности по физиолого-гистологическим, гематологическим показателям, используя среднелетальные, максимально переносимые и более низкие концентрации для установления пороговых.
7.4.3. Учет и анализ результатов приводят в п. 6.2.4 Приложения 2
8. Оценка генотоксичности вещества проводится в соответствии с п. 7 (п. 7.1; п. 7.2; п. 7.3 (пп. 7.3.1); п. 7.4; п. 7.6) Приложения 2 настоящих Методических указаний)
9.1. Исследование на водорослях
Рекомендуется проведение семисуточных исследований действия вещества на рост культуры водорослей (п. 1.4 Приложения 3 настоящих Методических указаний, а также требования проведения хронического эксперимента (Утверждено Минприродой России от 27 апреля 2001 г. "Руководство по определению методом биотестирования токсичности вод, донных отложений, загрязняющих веществ и буровых растворов". М.: РЭФИА, НИА-Природа, 2002). В качестве альтернативы возможно полное проведение хронического эксперимента с одноклеточными водорослями в течение 14 - 21 суток.
В конце опытов оценивается статистическая достоверность отклонений опытных данных от контрольных.
Условия культивирования водорослей и постановки токсикологических исследований с ними приведены в п. 1 Приложения 3 данных Методических указаний.
9.2. Исследование на зоопланктонных организмах
Исследования проводятся на односуточных артемиях в течение 7 суток (не полный хронический эксперимент). После семи суточного опыта, как правило, не наблюдается резкого увеличения гибели артемий в эксперименте длительностью 21 суток. В качестве альтернативы возможно полное проведение хронического эксперимента в течение 21 суток.
Постановка токсикологических исследований изложена в п. 5 Приложения 3 данных Методических указаний.
9.3. Исследование на рыбах
Условия получения, содержания икринок и проведения исследований на них при инкубации до 30 - 45 суток в настоящее время не дают возможности проводить краткосрочные эксперименты с икрой морских рыб.
В то же время, достаточно большое количество токсикологических исследований показывает чувствительность морской культуры гуппи (односуточные организмы) на уровне или на порядок выше ответной реакции эмбрионального развития морских рыб на загрязняющее вещество. Это позволяет рекомендовать острые опыты (96 ч) с использованием в качестве тест-объекта односуточных гуппи. Условия проведения экспериментов в п. 7. Приложения 3 данных Методических указаний.
Анализ результатов исследований показал, что в качестве максимально допустимой концентрации для рыб принимается максимальная концентрация, не вызывающая статистически достоверного повышения смертности мальков гуппи.
9.4. Исследования изменений показателей водной среды
Санитарно-экологические последствия присутствия в воде исследуемого вещества оцениваются по его влиянию на БПК5 воды.
Исследования проводятся при 20 °С в стеклянных сосудах объемом 5 дм3, заполняемых природной морской водой, профильтрованной через мельничный газ № 76 и насыщенной кислородом.
В сосуды вносится исследуемое вещество в 5 - 7 концентрациях, различающихся на порядок. Один из сосудов остается чистым и используется в качестве контроля. В исходные сутки, а также через 5 суток в пикнометры отбираются пробы воды (по 2 пикнометра на каждую пробу), которые выдерживаются в термостате при 20 °С в течение 5 суток.
Через 5 суток после экспозиции в каждом из пикнометров в воде определяют содержание кислорода по Винклеру или с применением специально приспособленных оксиметров.
Расчет величины БПК5 производится следующим образом:
БПК5 = [О2]исх - [О2]t,
где: [О2]исх - исходная концентрация кислорода в воде,
[О2]t - концентрация кислорода в пробах на соответствующий срок наблюдения.
Результаты используются для составления таблицы или графиков зависимости БПК5 от времени и концентрации исследуемого вещества.
Анализ результатов исследования проводится по оценке действия вещества на величину БПК5 в опыте и в контроле:
![]()
где: БПК5(оп) и БПК5(контр), соответственно, в опыте и в контроле на один и тот же срок.
Безвредной для процесса самоочищения следует считать такую концентрацию, при которой показатель БПК5 отклоняется от соответствующих значений в контроле не более чем на 20 % (т.е. N < 20 %).
Для вычисления концентрации, вызывающей 20 % отклонение, путем интерполяции может быть использовано следующее уравнение:
![]()
где: С - концентрация вещества, вызывающая отклонение значений БПК5 от аналогичных значений в контроле на 20 %;
С1 и С2 - концентрации вещества, вызвавшие отклонения БПК5 менее и более чем на 20 % соответственно;
N1 и N2 - величины этих отклонений.
9.5. Определение величины временного норматива
Из концентраций, выведенных в процессе исследований в качестве максимальных допустимых для каждого из объектов исследования, выбирается наименьшая, которая рассматривается в качестве временного расчетного норматива - ориентировочного безопасного уровня воздействия (ОБУВ) вещества.
Приложение 4
к Методическим указаниям по
разработке нормативов
качества воды водных объектов
рыбохозяйственного значения, в
том числе нормативов
предельно допустимых
концентраций вредных веществ
в водах водных объектов
рыбохозяйственного значения
1. Общие положения
1.1. Статистическая обработка результатов токсикологических исследований проводится с целью:
определения достоверных усредненных данных, характеризующих биологическую эффективность отдельных концентраций вещества и вещества в целом;
оценки достоверности различия средних количественных значений тест-функций в разных вариантах исследований (опыт и контроль).
1.2. Биологическая эффективность отдельных концентраций выражается либо через количественное значение тест-функции при этой концентрации в конце срока наблюдения (по отношению к значению в контрольной серии, выраженное в процентах), либо в виде срока достижения определенной величины тест-функции объекта при действии этой концентрации.
1.3. В тех случаях, когда в контрольной выборке также наблюдаются регистрируемые изменения (например, гибель тест-объектов), то к данным опытов вводят "поправку Аббота", определяемую следующим путем:
![]()
где: N%peз - уточненная величина эффекта вещества;
N%oп - число погибших особей в опыте;
N%контр - число погибших особей в контроле.
1.4. Характеристикой токсичности вещества служит величина концентрации, вызывающая определенный эффект на тест-объект (ЭК25, ЭК50 или ЭК100), или не производящая достоверного эффекта за время токсикологических исследований.
1.5. Задачей вычислений при определении ПДК служит установление максимальных концентраций, не оказывающих устойчивого эффекта ни на один из тест-параметров, учитываемых в исследованиях. Недействующей концентрацией исследуемого вещества признается такая концентрация, которая не вызьшает достоверное отклонение величины тест-функции от ее величины в контрольной серии за срок исследований. Тест-функция не должна достоверно отличаться от значений в контроле.
1.6. При определениях ориентировочно безопасного уровня воздействия вещества (ОБУВ вещества) устанавливаются концентрации, способные производить эффект на тест-параметры, не превышающие величину, оговоренную в настоящих Методических рекомендациях по соответствующему тест-объекту.
1.7. Дополнительную информацию о возможностях и приемах статистической обработки данных можно найти в соответствующих руководствах.
2. Первичная обработка данных
2.1. Для всех повторностей в контроле и в каждой из концентраций на конкретный срок вычисляется среднее арифметическое значение тест-функции X по формуле:
![]()
где: х - частные значения тест-параметра в каждой из повторностей (в контрольном варианте или в каждой из концентраций);
n - количество значений (повторностей) в серии.
2.2. В случае существенных отклонений одной из дат в серии от средней арифметической целесообразно оценить, не выпадает ли она, в силу каких-то побочных причин, из общей закономерности. Для этого может быть проведено вычисление по следующим формулам:
если сомнительная дата оказалась наименьшей по значению -
![]()
где v - коэффициент оценки принадлежности;
x1 - сомнительная дата (наименьшая);
х2 - дата, следующая по величине;
хn-1 - дата, предшествующая наибольшей в серии;
если сомнительная дата оказалась наибольшей по значению -
![]()
где хn - сомнительная дата (наибольшая);
хn-1 - дата, предшествующая по величине;
х2 - дата, следующая за наименьшей в серии.
Полученный коэффициент v сопоставляется с приведенными в таблице величинами для уровня значимости Р = 0,05 и для разного числа повторностей n (Таблица 3.1):
Таблица 3.1
Значение коэффициента v от числа повторностей n
|
n- |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
v- |
0,96 |
0,81 |
0,69 |
0,61 |
0,55 |
0,51 |
0,48 |
0,45 |
0,43 |
|
|
|||||||||
|
n- |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
v- |
0,41 |
0,40 |
0,38 |
0,37 |
0,36 |
0,35 |
0,34 |
0,33 |
|
Если вычисленная величина v равна табличному или превышает его, то оцениваемая дата может быть исключена из выборки данных. Новое среднее арифметическое значение и все последующие вычисления производятся без этой даты.
2.3. Вычисляется среднее квадратическое отклонение значений тест-функции от среднего (σ) для контроля и для каждой из концентраций:
![]()
2.4. Рассчитывается ошибка среднего арифметического значения тест-функции (S) в контроле и в каждой из концентраций:
![]()
3. Вычисления достоверности различий при определении ПДК вещества
3.1. Вычисления достоверности различия по критерию tst (Стьюдента)
Вычисляется критерий достоверности различия средних значений тест-функции в контроле и в каждой из концентраций (td):
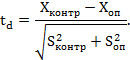
Вычисленные величины критерия td сопоставляются с табличными значениями (критерий Стьюдента), приведенными в таблице 3.1.1. Эти значения (tst) соответствуют уровню значимости Р = 0,05 и числу степеней свободы (k = noп + nконтр - 2) до 30.
Таблица 3.1.1
Значения критерия Стюдента
|
k- |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
tst- |
12,7 |
4,3 |
3,18 |
2,78 |
2,57 |
2,45 |
2,37 |
2,31 |
2,26 |
2,23 |
|
|
||||||||||
|
k- |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
tst- |
2,2 |
2,18 |
2,16 |
2,15 |
2,13 |
2,12 |
2,11 |
2,10 |
2,09 |
2,09 |
|
|
||||||||||
|
k- |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
tst- |
2,08 |
2,07 |
2,07 |
2,06 |
2,06 |
2,06 |
2,05 |
2,05 |
2,05 |
2,04 |
Различие между средними значениями тест-параметра в опыте и в контроле считается достоверным, если рассчитанная величина td, при соответствующей величине k, равна табличной или превышает ее (td ≥ tst).
3.2. Вычисления достоверности различия по критерию F (Фишера)
Для каждой пары сравниваемых средних величин (опыт и контроль) вычисляется величина отношения соответствующих дисперсий (квадратов средних квадратических отклонений):
![]()
Всегда берется отношение большей дисперсии к меньшей, поэтому величина Fэксп не может быть меньше единицы.
Полученная величина критерия Fэксп сопоставляется с табличными значениями (Fст) для уровня значимости Р = 0,05 при соответствующем числе степеней свободы k1 и k2 (Таблица 3.2.1).
Если Fэксп больше Fст при соответствующем значении степеней свободы, то различие между сравниваемыми вариантами (между опытом и контролем) достоверны.
Таблица 3.2.1
Значения критерия Фишера
|
k2 - число степеней свободы для меньшей дисперсии |
k1 - число степеней свободы для большей дисперсии |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
1 |
161 |
200 |
216 |
225 |
230 |
234 |
237 |
239 |
241 |
242 |
|
2 |
18,5 |
19,0 |
19,3 |
19,3 |
19,4 |
19,4 |
19,4 |
19,4 |
19,4 |
19,4 |
|
3 |
10,1 |
9,6 |
9,3 |
9,1 |
9,0 |
8,9 |
8,9 |
8,8 |
8,8 |
8,8 |
|
4 |
7,7 |
6,9 |
6,6 |
6,4 |
6,3 |
6,2 |
6,1 |
6,0 |
6,0 |
6,0 |
|
5 |
6,6 |
5,8 |
5,4 |
5,2 |
5,1 |
5,0 |
4,9 |
4,8 |
4,8 |
4,7 |
|
6 |
6,0 |
5,1 |
4,8 |
4,5 |
4,4 |
4,3 |
4,2 |
4,2 |
4,1 |
4,1 |
|
7 |
5,6 |
4,7 |
4,4 |
4,1 |
4,0 |
3,9 |
3,8 |
3,7 |
3,7 |
3,6 |
|
8 |
5,3 |
4,5 |
4,1 |
3,8 |
3,7 |
3,6 |
3,5 |
3,4 |
3,4 |
3,3 |
|
9 |
5,1 |
4,3 |
3,9 |
3,6 |
3,5 |
3,4 |
3,3 |
3,2 |
3,2 |
3,1 |
|
10 |
5,0 |
4,1 |
3,7 |
3,5 |
3,3 |
3,2 |
3,1 |
3,1 |
3,0 |
3,0 |
4. Использование пробит-анализа для определения ЛК50
При определении концентраций, способных вызывать гибель 50 % особей в выборке (например, при определении ОБУВ вещества), проводят такое преобразование значений концентрации и эффекта гибели организмов, при котором зависимость эффекта от концентрации превращается из сигмоиды в прямую линию. Такое преобразование позволяет по данным, полученным только для 2 - 3 концентраций, определить вероятный эффект для всего диапазона концентраций от максимально недействующей до минимально абсолютно летальной.
Для этого на графике значения процентных концентраций вещества переводятся в логарифмическую форму, а полученный эффект - из процентов гибели организмов в соответствующие им значения условных единиц - пробитов. Значения пробитов, приводятся в таблице 4.1.
Таблица 4.1
Значение процента гибели организмов в опыте соответствующему условному числу единиц - пробитов
|
Гибель, % |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
- |
2,67 |
2,95 |
3,12 |
3,25 |
3,35 |
3,45 |
3,52 |
3,59 |
3,66 |
|
10 |
3,72 |
3,77 |
3,82 |
3,83 |
3,92 |
3,96 |
4,01 |
4,05 |
4,08 |
4,12 |
|
20 |
4,16 |
4,19 |
4,23 |
4,26 |
4,29 |
4,33 |
4,36 |
4,39 |
4,42 |
4,45 |
|
30 |
4,48 |
4,50 |
4,53 |
4,56 |
4,59 |
4,61 |
4,64 |
4,67 |
4,69 |
4,72 |
|
40 |
4,75 |
4,77 |
4,80 |
4,82 |
4,85 |
4,87 |
4,90 |
4,92 |
4,95 |
4,97 |
|
50 |
5,00 |
5,03 |
5,05 |
5,08 |
5,10 |
5,13 |
5,15 |
5,18 |
5,20 |
5,23 |
|
60 |
5,25 |
5,28 |
5,31 |
5,33 |
5,36 |
5,39 |
5,41 |
5,44 |
5,47 |
5,50 |
|
70 |
5,52 |
5,55 |
5,58 |
5,61 |
5,64 |
5,67 |
5,71 |
5,74 |
5,77 |
5,81 |
|
80 |
5,84 |
5,88 |
5,92 |
5,95 |
5,99 |
6,04 |
6,08 |
6,13 |
6,18 |
6,23 |
|
90 |
6,28 |
6,34 |
6,41 |
6,48 |
6,55 |
6,64 |
6,75 |
6,89 |
7,05 |
7,33 |
На графике, отражающем связь эффекта (в пробитах) с концентрацией (в логарифмах), определяют точку, соответствующую пробиту 5 (50 % гибели), и опускают из нее перпендикуляр на ось концентраций. Основание этого перпендикуляра придется на концентрацию, соответствующую ЛК50.
Помимо графического может быть использован расчетный способ определения полуэффективной концентрации. Он основан на прямолинейной взаимосвязи между концентрацией и эффектом, выраженным в пробитах.
Для этого вводятся дополнительные обозначения:
х - порядковый номер данной концентрации в шкале исследованных концентраций;
у - гибель тест-организмов, выраженная в пробитах;
В - весовой коэффициент пробита, определяемый по таблице 4.2:
Таблица 4.2
Весовые коэффициенты значений пробитов
|
Пробит |
0,0 |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
0,6 |
0,7 |
0,8 |
0,9 |
|
3 |
1,0 |
1,2 |
1,4 |
1,6 |
1,8 |
2,0 |
2,3 |
2,6 |
2,9 |
3,2 |
|
4 |
3,5 |
3,7 |
3,9 |
4,1 |
4,3 |
4,5 |
4,6 |
4,7 |
4,8 |
4,9 |
|
5 |
5,0 |
4,9 |
4,8 |
4,7 |
4,6 |
4,5 |
4,3 |
4,1 |
3,9 |
3,7 |
|
6 |
3,5 |
3,2 |
2,9 |
2,6 |
2,3 |
2,0 |
1,8 |
1,6 |
1,4 |
1,2 |
Зависимость между концентрацией и эффектом, выраженным в пробитах, описывается следующим уравнением: у = A0 + A1х.
Для вычисления коэффициентов А0 и А1 может быть использован калькулятор с программой определения коэффициентов прямолинейной регрессии или производятся следующие операции ("методом наименьших квадратов"):
По данным, полученным в исследованиях, составляется таблица по соответствующей форме (Таблица 4.3):
Таблица 4.3
Исходные данные для вычисления компонентов системы уравнений при вычислении ЛК50 "методом наименьших квадратов"
|
Концентрация, мг/л |
х |
у |
В |
ХВ |
х2В |
уВ |
хуВ |
|
|
|||||||
|
|
|
|
∑В |
∑хВ |
∑х2В |
∑уВ |
∑хуВ |
Данные из таблицы используются для решения следующей системы уравнений:
|
|
(1) |
|
|
(2) |
|
|
(3) |
Из уравнения (3) вычисляем А1 и подставляем его в уравнение (2) для вычисления А0.
Подставив оба коэффициента и величину "у", равную 5 (пробит 50 %) в уравнение (1), можно вычислить искомую величину концентрации ЛК50.
Приложение 5
к Методическим указаниям по
разработке нормативов
качества воды водных объектов
рыбохозяйственного значения, в
том числе нормативов
предельно допустимых
концентраций вредных веществ
в водах водных объектов
рыбохозяйственного значения
Нормируемое вещество
1. Организация-разработчик (адрес почтовый, телеграфный, тел./факс), Рецензент.
2. Организация-заказчик.
3. Название отчета.
4. Название нормируемого вещества (товарное; химическое, указать № CAS; синонимы); его состав для смесевых препаратов (указать действующее вещество).
Область применения исследуемого вещества.
5. Эмпирическая и структурная формула.
6. Основные физико-химические показатели: молекулярная масса (М.М.); температура плавления (Тплав °С); агрегатное состояние; растворимость в воде (мг/л); плотность (г/см3) и т.п.
7. Стабильность в водной среде. Порог влияния на показатели водной среды.
8. Наличие метода химического анализа вещества в воде, включение в государственный реестр.
9. Трофический статус водного объекта, из которого берется вода для опытов (продуктивность, содержание общего хлорофилла в цифровом выражении и проч.).
10. Природное фоновое содержание в водном объекте вещества, на которое разрабатывается предельно допустимая концентрация ПДК вещества или ориентировочно безопасный уровень ОБУВ вещества.
11. Качество фоновой среды (воды), используемой при проведении токсикологических исследований: минерализация, жесткость, рН, окисляемость, содержание биогенов и т.п. Гидрохимический класс и группа вод по классификации О.А. Алекина.
12. Характер загрязнения водной среды в опыте: опалесценция, пленка, изменение цвета раствора, истинность или коллоидность раствора, для мелкодисперсных взвесей - скорость оседания частиц и т.д.
13. Результаты исследований в таблице:
|
Охраняемое звено |
Тест-организм |
Определяемый показатель* |
Время экспозиции, сут. |
Пороговая концентрация, мг/л |
Недействующая концентрация, мг/л |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Примечание: * в том числе ЛК50 (ЭК50) за 24 - 96 ч.
14. Пороговая концентрация по органолептическому признаку вредности.
15. Изменение органолептических свойств мяса рыбы и бульона, а также другая специфика (например, изменение цвета организмов, оболочки икры некоторыми красителями).
16. Наличие специфических эффектов (тератогенез, мутагенез, эмбриотоксичность, гонадотоксичность) с указанием объекта и концентрации.
17. Результаты теста на гено-, цитотоксичность.
18. Класс опасности.
19. Лимитирующий показатель вредности.
20. Рекомендуемая ПДК вещества в мг/л или ОБУВ вещества в мг/л.
Подпись руководителя работ
Дата заполнения
Приложение 6. Утратило силу. Изм. от 22.12.2016 г.
СОДЕРЖАНИЕ