Государственное санитарно-эпидемиологическое
нормирование
Российской Федерации
1.3. ЭПИДЕМИОЛОГИЯ
Организация работы лабораторий,
использующих методы амплификации
нуклеиновых кислот при работе
с материалом, содержащим
микроорганизмы
I - IV групп патогенности
Методические указания
МУ 1.3.2569-09
Москва 2010
1. Разработаны Федеральным государственным учреждением науки «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора (В.И. Покровский, Г.А. Шипулин, И.Н. Манзенюк); Федеральным государственным учреждением здравоохранения «Российский научно-исследовательский противочумный институт «Микроб» Роспотребнадзора (В.В. Кутырев, И.Н. Шарова, Н.А. Осина, В.Е. Куклев, С.А. Щербакова); Федеральным государственным учреждением здравоохранения «Ставропольский научно-исследовательский противочумный институт» Роспотребнадзора (А.Н. Куличенко); Федеральным государственным учреждением науки «Государственный научно-исследовательский институт стандартизации и контроля медицинских и биологических препаратов им. Л.А. Тарасевича» Роспотребнадзора (Г.М. Игнатьев); Государственным научным центром вирусологии и биотехнологии «Вектор» Роспотребнадзора (И.Г. Дроздов, А.Н. Сергеев, А.Н. Шиков, А.О. Семенцова, И.Н. Бабкина, В.А. Терновой, А.П. Агафонов); Федеральным государственным учреждением здравоохранения «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора (А.И. Верещагин, М.В. Зароченцев, Т.В. Воронцова, Э.Ф. Опочинский).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 03 декабря 2009 г. № 3).
3. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 22 декабря 2009 г.
4. Введены в действие с 5 апреля 2010 г.
5. Введены взамен:
- МУ 1.3.1794-03 «Организация работы при исследованиях методом ПЦР материала, инфицированного микроорганизмами I - II групп патогенности» (Минздрав России, Москва, 2003);
- МУ 1.3.1888-04 «Организация работы при исследованиях методом ПЦР материала, инфицированного патогенными биологическими агентами III - IV групп патогенности» (Минздрав России, Москва, 2004);
- МУ 3.5.5.1034-01 «Обеззараживание исследуемого материала, инфицированного бактериями I - IV групп патогенности, при работе методом ПЦР» (Минздрав России, Москва, 2001).
СОДЕРЖАНИЕ
|
|
УТВЕРЖДАЮ Руководитель
Федеральной службы Г.Г. Онищенко 22 декабря 2009 г. Дата введения: 5 апреля 2010 г. |
1.3. ЭПИДЕМИОЛОГИЯ
Организация работы лабораторий, использующих
методы амплификации нуклеиновых кислот при работе
с материалом, содержащим микроорганизмы I - IV групп
патогенности
Методические указания
МУ 1.3.2569-09
1. Область применения
1.1. Методические указания предназначены для специалистов лабораторий, выполняющих работы с использованием методов амплификации нуклеиновых кислот (МАНК) при исследовании материала, содержащего (подозрительного на содержание) микроорганизмы I - IV групп патогенности.
1.2. Юридические лица, независимо от организационно-правовых форм и форм собственности и индивидуальные предприниматели, осуществляющие деятельность, связанную с использованием возбудителей инфекционных заболеваний, должны иметь на нее лицензию. Деятельность каждого структурного подразделения (микробиологической лаборатории, цеха, производственного участка и т.п.), связанная с использованием ПБА I - IV групп, должна осуществляться на основании санитарно-эпидемиологического заключения (СП 1.3.1285-03; СП 1.3.2322-08)*.
________________
* Зарегистрированы Минюстом России 15 мая 2003 г. номер 4545; 21 февраля 2008 г. номер 11197.
1.3. Методические указания определяют принципы организации лаборатории и этапы проведения анализа с использованием МАНК: взятие проб, первичная обработка, хранение, условия перевозки, обеззараживание материала, выделение нуклеиновых кислот, проведение обратной транскрипции и (или) амплификации, секвенирование продуктов амплификации, учет и регистрация результатов исследования биологического материала, пищевых продуктов, материала из объектов окружающей среды.
1.4. Методические указания регламентируют деятельность персонала лабораторий при выполнении исследований с помощью МАНК, проводимых с использованием зарегистрированных в установленном порядке наборов реагентов и оборудования.
2. Нормативные ссылки
2.1. СП 1.3.1285-03 «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)». Минздрав России, 2003.
2.2. СП 1.3.2322-08 «Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней». Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2008.
2.3. СП 1.2.1318-03 «Порядок выдачи санитарно-эпидемиологического заключения о возможности проведения работ с возбудителями инфекционных заболеваний человека I - IV групп патогенности (опасности), генно-инженерно-модифицированными микроорганизмами, ядами биологического происхождения и гельминтами». Минздрав России, 2003.
2.4. СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности». Госкомсанэпиднадзор России, 1995.
2.5. СанПиН 2.1.7.728-99 «Правила сбора, хранения и удаления отходов лечебно-профилактических учреждений». Минздрав России, 1999.
2.6. МУ № 01-19/123-17 «Методические указания по детекции патогенной микрофлоры в клиническом материале, пищевых продуктах, объектах внешней среды и генетической идентификации клеток с помощью полимеразной цепной реакции» от 18.10.96. Госкомсанэпиднадзор России, 1996.
2.7. Р 3.5.1904-04 «Использование ультрафиолетового бактерицидного излучения для обеззараживания воздуха в помещениях». М., 2005.
3. Общие положения
3.1. Процесс амплификации основан на многократном увеличении числа копий фрагмента нуклеиновых кислот (ДНК/(кДНК)/РНК) или усилении сигнала в условиях in vitro, что позволяет обнаружить специфичный участок генома возбудителя с целью его идентификации.
3.2. Методы амплификации нуклеиновых кислот: полимеразная цепная реакция (ПЦР), лигазная цепная реакция (ЛЦР), амплификация с удалением (вытеснением) цепи (SDA), транскрипционно-опосредованная амплификация (ТМА), реакция амплификации на основе нуклеотид-ной последовательности нуклеиновых кислот (NASBA), реакция изотермальной транскрипционной амплификации (TAS), самоподдерживающаяся реакция репликации последовательностей (SSSR или 3SR), амплификация с использованием QB-репликазы, амплификации по типу катящегося кольца (RCA) и т.д.
3.3. Методы амплификации сигнала: сигнальная амплификация или метод «разветвленной» ДНК (bDNA assay), прямой гибридизационный анализ на основе РНК/ДНК-зондов и т.д.
3.4. Разновидности полимеразной цепной реакции: с «горячим» стартом (hot-start PCR), мультиплексная (мультипраймерная), гнездовая («вложенная», nested PCR), «инвертированная», ассиметричная, метод молекулярных колоний, длинных фрагментов (Long-range PCR), с быстрой амплификацией концов кДНК (RACE-PCR), универсальная (broad-range PCR), с обратной транскрипцией (ОТ-ПЦР, RT-PCR), иммуно-ПЦР (immuno-PCR-IPCR), в режиме «реального времени» (Real-Time PCR), анализ «по конечной точке» (End-point PCR) и т.д.
3.5. Форматы амплификации нуклеиновых кислот в режиме «реального времени»:
• с применением интеркалирующих флуоресцентных красителей;
• использование меченых флуоресцентными красителями олиго-нуклеотидных зондов, комплементарных участку ампликона (гибридизационно-флуоресцентная детекция), работающих по принципу: гидролиза зондов (линейно разрушаемые зонды (TaqMan), зондов с инвертированным концевым повтором (молекулярные «маячки», molecular beacons), праймер - зондов («скорпионы», Scorpions), гибридизации зондов (с резонансным переносом энергии (FRET-технология), «амплифлюр» (Amplifluor) - технологии и т.д.
3.6. Методы исследования, использующие продукты амплификации нуклеиновых кислот: секвенирование, ДНК-чипы, рестрикционный анализ.
3.7. Методы детекции продуктов амплификации нуклеиновых кислот:
• электрофоретический (в агарозном или полиакриламидном геле);
• гибридизационно-ферментный;
• гибридизационно-флуоресцентный (детекция продукта в режиме «реального времени» или регистрация продукта после окончания реакции амплификации («анализ по конечной точке»),
3.8. Форматы исследования: качественный, количественный.
3.9. Основные характеристики наборов реагентов, используемых для проведения амплификации нуклеиновых кислот микроорганизмов I - IV групп патогенности: аналитическая чувствительность, аналитическая специфичность, диагностическая чувствительность, диагностическая специфичность, воспроизводимость.
3.10. Методы амплификации нуклеиновых кислот микроорганизмов I - IV групп патогенности используют:
• как метод экспресс-диагностики при исследовании биологического материала, взятого от человека, с целью выявления ДНК (РНК) микроорганизмов I - IV групп патогенности и их количественной оценки;
• как метод специфической индикации патогенных биологических агентов в объектах окружающей среды и пищевых продуктах;
• как ускоренный предварительный тест при выполнении культурального и биологического методов исследования и для идентификации культур;
• для определения эпидемиологической значимости изолятов на основании выявления генетических маркеров вирулентности и патогенности, антибиотикоустойчивости;
• для таксономической характеристики штаммов на основании выявления специфических видовых, родовых и других маркеров;
• для генотипирования штаммов с целью определения их происхождения;
• для прогнозирования течения инфекционного заболевания и оценки эффективности проводимой терапии.
3.11. По результатам анализа выдают ответ о наличии (качественный или количественный анализ) в пробе специфических фрагментов ДНК или РНК, имеющих гомологию с определенным участком генома возбудителя инфекционного заболевания, а также о наличии в исследуемом материале генетических маркеров или генетически модифицированных ДНК.
4. Требования к организации работ
4.1. Исследование материала, содержащего (подозрительного на содержание) микроорганизмы I - IV групп патогенности, методами амплификации нуклеиновых кислот (сигнала) связано с необходимостью одновременного обеспечения и соблюдения персоналом правил биологической безопасности и требований к организации и проведению данных работ с целью предотвращения контаминации нуклеиновыми кислотами и (или) ампликонами исследуемых проб помещений и оборудования.
4.2. Данные исследования проводят в организациях, имеющих лицензию на деятельность, связанную с возбудителями инфекционных заболеваний человека, в лабораториях, имеющих санитарно-эпидемиологическое заключение о возможности проведения данных работ, выданных в установленном порядке.
4.3. Противоэпидемический режим работы лаборатории должен быть обеспечен в соответствии с СП 1.3.1285-03 и (или) СП 1.3.2322-08, регламентирующими работу с микроорганизмами I - II и III - IV групп патогенности соответственно.
4.4. Допускается проведение исследований биологического материала (без предварительного накопления возбудителя) на наличие ДНК (РНК) возбудителей бруцеллеза, парентеральных вирусных гепатитов, ВИЧ-инфекции в лаборатории, имеющей санитарно-эпидемиологическое заключение о возможности проведения работ с возбудителями III - IV групп патогенности (с указанием конкретных видов микроорганизмов), выданное в установленном порядке.
4.4.1. В лаборатории, имеющей санитарно-эпидемиологическое заключение о возможности проведения работ с возбудителями III - IV групп патогенности, допускается исследование биологического материала, подозрительного на инфицирование микроорганизмами II группы патогенности только в тех случаях, для которых разработаны и утверждены нормативные документы, регламентирующие порядок проведения таких исследований в условиях данной лаборатории.
5. Требования к помещениям и оборудованию лаборатории, выполняющей молекулярно-биологические диагностические исследования
5.1. При строительстве новых или реконструкции имеющихся помещений лабораторию размещают в отдельно стоящем здании (изолированной части здания, этажа) с соблюдением требований СП 1.3.1285-03 и (или) СП 1.3.2322-08.
5.2. При отсутствии возможности размещения помещений лаборатории в виде отдельного блока допускается проведение исследований поступающего материала на базе действующей лаборатории (микробиологической, вирусологической, иммунологической и т.д.) при условии организации в ней самостоятельных или выделенных в составе других функциональных помещений рабочих зон, соответствующих этапам проведения анализа, поточности движения персонала и материалов.
5.3. Помещения лаборатории должны быть боксированными (боксы с предбоксами), соответствующим образом промаркированы (нумерация или название рабочих зон) и оборудованы приточно-вытяжной вентиляцией, водопроводом, канализацией, электричеством и отоплением, средствами пожаротушения, естественным и искусственным освещением и быть непроницаемыми для грызунов и насекомых.
5.4. Внутреннюю отделку помещений осуществляют кафелем (пол, стены) или краской (стены, потолок), устойчивой к действию моющих и дезинфицирующих средств, поверхности стен, пола и потолка в лабораторных помещениях должны быть гладкими, без щелей, легко обрабатываемыми.
5.5. В помещениях рабочих зон должны быть установлены бактерицидные лампы. Расчет режима работы бактерицидных ламп проводят в соответствии с Р 3.5.1904-04 «Использование ультрафиолетового бактерицидного излучения для обеззараживания воздуха в помещениях».
5.6. Окна должны быть плотно закрыты, возможно использование светозащитных пленок из материала, устойчивого к действию используемых дезинфицирующих средств. Использование жалюзи (из-за адсорбции ими пыли) запрещено.
5.7. Архитектурно-планировочные решения и размещение оборудования должны обеспечивать поточность движения исследуемого материала.
5.8. Лаборатория в соответствии с этапами проведения анализа должна включать следующий набор последовательно расположенных самостоятельных рабочих зон (помещений) или отдельно выделенных рабочих зон в составе других функциональных помещений, количество которых определяется используемыми МАНК (прилож. 1):
• приема, регистрации, разбора и первичной обработки материала (рабочая зона 1);
• выделения нуклеиновых кислот (рабочая зона 2);
• проведения реакции амплификации и учета ее результатов при использовании гибридизационно-флуоресцентного метода детекции (рабочая зона 3);
• учета результатов реакции амплификации нуклеиновых кислот методом электрофореза и (или) гибридизационно-ферментным методом детекции (рабочая зона 4 - 1);
• учета результатов (детекции) продуктов амплификации нуклеиновых кислот методом секвенирования и (или) на ДНК-чипах (рабочая зона 4 - 2).
5.8.1. В состав лаборатории могут быть включены вспомогательные помещения (комнаты персонала, кабинет заведующего лабораторией, раздевалки для сотрудников, комната приема пищи, туалет, подсобные (складские) помещения), которые должны быть вынесены за пределы рабочей зоны.
5.8.2. Вспомогательные помещения должны располагаться отдельно от рабочих зон (помещений) в соответствии с действующими санитарными правилами, регламентирующими обеспечение безопасности работ с микроорганизмами I - IV групп патогенности.
5.8.3. Необходимо предусмотреть наличие автоклавной комнаты для обеззараживания исследуемого материала, которая может быть общей с другими подразделениями учреждения при условии соблюдения требований биологической безопасности.
5.9. В рабочей зоне 1 осуществляют прием материала, его маркировку, регистрацию в специальном журнале, первичную подготовку (концентрирование материала путем центрифугирования, фильтрации, иммуносорбции, суспендирование, перевод сухих и плотных материалов в жидкую фазу и т.д.), объединение или разделение проб на аликвоты, обеззараживание и хранение проб, обеззараживание остатков исследуемого материала.
5.9.1. Допускается проведение в рабочей зоне 1 приема, регистрации, разбора и первичной обработки материала, исследуемого другими методами диагностики (бактериологическими, вирусологическими, иммунологическими и т.д.).
5.9.2. При работе с микроорганизмами I - II групп патогенности допускается размещение рабочей зоны 1 в помещениях блока для работы с инфицированными животными.
5.10. В рабочей зоне 2 проводят выделение и очистку нуклеиновых кислот микроорганизмов из проб, подготовленных в рабочей зоне 1.
5.11. В рабочей зоне 3 осуществляют приготовление реакционных смесей, проведение обратной транскрипции, амплификации нуклеиновых кислот и учет результатов амплификации при использовании гибридизационно-флуоресцентного метода детекции.
5.11.1. Приготовление реакционных смесей для проведения обратной транскрипции и амплификации нуклеиновых кислот осуществляют до доставки в рабочую зону 3 проб, подготовленных в рабочей зоне 2.
5.11.2. Рекомендуется разделить рабочую зону 3 на две подзоны (3а и 3б) и разместить их в отдельных помещениях. В подзоне 3а осуществляют приготовление реакционных смесей и проведение обратной транскрипции. В подзоне 3б проводят амплификацию нуклеиновых кислот и учет результатов амплификации при использовании гибридизационно-флуоресцентного метода детекции.
5.11.3. При необходимости возможно совмещение рабочей зоны 2 и рабочей зоны 3 в одном помещении при наличии в нем отдельных боксов биологической безопасности II или III классов для каждой из рабочих зон.
5.12. Рабочие зоны 4 - 1 и 4 - 2 располагают изолированно от рабочих зон 1 - 3 для предотвращения их контаминации продуктами амплификации через воздушный поток.
5.12.1. Рабочая зона 4 - 1 предназначена для учета результатов продуктов амплификации нуклеиновых кислот методом электрофореза и (или) гибридизационно-ферментным методом детекции, а также очистки продуктов амплификации для секвенирования.
5.12.2. Рабочая зона 4 - 2 предназначена для учета результатов (детекции) продуктов амплификации нуклеиновых кислот методом секвенирования и (или) на ДНК-чипах.
5.12.3. При использовании различных методов учета результатов (детекции) продуктов амплификации нуклеиновых кислот (электрофорез, гибридизационно-ферментативный анализ, секвенирование и ДНК-чипы) в рабочих зонах 4 - 1 и 4 - 2 выделяют отдельные рабочие подзоны или отдельные боксированные помещения (отдельные изолированные помещения) для каждого типа детекции. Объединение рабочих зон 4 - 1 и 4 - 2 запрещено.
5.13. Помещения лаборатории оборудуют приточно-вытяжной вентиляцией в соответствии с СП 1.3.1285-03 и (или) СП 1.3.2322-08.
5.13.1. В рабочей зоне 3 объем приточного воздуха должен соответствовать объему на вытяжке.
5.13.2. В рабочих зонах 1 и 2 вытяжка должна преобладать над притоком.
5.13.3. Рабочие зоны 4 - 1 и 4 - 2 рекомендуется оборудовать автономной системой приточно-вытяжной вентиляции. Вытяжка должна преобладать над притоком.
5.13.4. При разделении зоны 3 на подзоны 3а и 3б, приточно-вытяжная вентиляция в них должна быть выполнена в соответствии с п. 5.13.1. для подзоны 3а и п. 5.13.2. для подзоны 3б.
5.13.5. В условиях жаркого климата разрешается установка кондиционеров в помещениях рабочих зон лаборатории при условии их выключения на время проведения работ с использованием МАНК с последующей дезинфекционной обработкой рабочего места.
5.14. Каждая самостоятельная рабочая зона должна быть оснащена минимальным набором соответствующего лабораторного оборудования в зависимости от их функционального назначения и риска контаминации (прилож. 3), необходимым комплектом мебели, пластиковой и стеклянной посуды, расходных материалов, защитной одежды и уборочного инвентаря, используемых только в данном помещении.
5.14.1. Необходимый комплект лабораторного оборудования определяют с учетом используемых МАНК.
5.14.2. Лабораторная мебель, оборудование и принадлежности каждой рабочей зоны должны иметь маркировку указанной зоны (помещения), их применение в других рабочих зонах (помещениях) или для других видов исследований не допускается.
5.14.3. Лабораторная мебель, поверхность используемого оборудования должны быть устойчивы к действию моющих и дезинфицирующих средств, ультрафиолетового излучения, поверхность столов не должна иметь трещин и швов.
5.15. Оборудование и измерительные приборы, используемые в работе лаборатории, должны быть зарегистрированы в установленном порядке и исправны, иметь технический паспорт и рабочую инструкцию по эксплуатации, соответствовать нормам безопасности и электромагнитной совместимости. Не реже 1 раза в год измерительные приборы должны подвергаться метрологическому контролю (поверке).
5.16. Лаборатория должна быть обеспечена аптечкой стандартной комплектации для оказания первой медицинской помощи при авариях в соответствии с действующими санитарными правилами, регламентирующими безопасность работ с микроорганизмами I - IV групп патогенности.
6. Требования к проведению работ
6.1. Не допускается проведение работ, связанных с использованием методов амплификации нуклеиновых кислот в помещениях, где осуществляются культуральные работы по накоплению биомассы биологических агентов I - IV групп патогенности и генно-инженерные работы, в т.ч. получение (клонирование) и выделение рекомбинантных генетических конструкций.
6.2. Исследование материала, содержащего (подозрительного на содержание) микроорганизмы I - IV групп патогенности, МАНК осуществляют специалисты с высшим или средним медицинским или биологическим (ветеринарным) образованием, прошедшие подготовку на лицензированных курсах первичной специализации по работе с микроорганизмами I - II групп патогенности (опасности) (только при работе с данными микроорганизмами) или с микроорганизмами III - IV групп патогенности, получившие дополнительное специальное образование на курсах повышения квалификации по молекулярно-биологическим методам диагностики.
6.3. Допуск персонала к работе в лаборатории осуществляется в порядке, регламентированном действующими санитарными правилами проведения работ с микроорганизмами I - IV групп патогенности.
6.4. Выполнение работ в рабочих зонах 4 - 1 и 4 - 2 должно осуществляться отдельным персоналом, не задействованным на других этапах проведения анализа.
6.5. При проведении исследований с использованием МАНК неукоснительно соблюдают этапы проведения последовательной обработки материала и проб.
6.5.1. Весь поступающий материал направляют в рабочую зону 1 для приема, регистрации, разбора, первичной обработки и обеззараживания материала.
6.5.2. В рабочую зону 2 материал подлежит передаче только после обеззараживания (прилож. 5) в маркированных одноразовых микроцентрифужных пробирках объемом 1,5 - 2,0 мл с закрытой крышкой.
6.5.3. После окончания работы в рабочей зоне 2 пробирки передают в рабочую зону 3, где предварительно проведена работа по подготовке реакционных смесей для проведения реакции амплификации.
6.5.4. После окончания работы в рабочей зоне 3, если для учета результатов используется метод электрофореза и (или) гибридизационно-ферментативный метод детекции, пробирки переносят в рабочую зону 4 - 1 для проведения анализа.
6.5.5. В случае применения для регистрации результатов реакции амплификации секвенирования работы по очистке ампликонов осуществляют в рабочей зоне 4 - 1 с последующим переносом пробирок в рабочую зону 4 - 2 для завершения анализа.
6.5.6. Если учет реакции амплификации осуществляют с использованием ДНК-чипов, пробирки из рабочей зоны 3 для проведения анализа переносят в рабочую зону 4 - 2.
6.6. При проведении исследований с использованием методов амплификации нуклеиновых кислот неукоснительно соблюдают следующие правила работы:
6.6.1. Обеспечение поточности движения исследуемого материала, проб нуклеиновых кислот, продуктов амплификации.
6.6.2. Забор материала, его предварительную обработку, хранение, перевозку (прилож. 2) и передачу на исследование в рабочую зону 1 осуществляют согласно инструктивно-методическим документам, регламентирующим выполнение исследований для каждого вида возбудителя инфекций, инструкциям к наборам реагентов и в соответствии с СП 1.3.1285-03 и СП 1.3.2322-08.
6.6.3. Передачу исследуемого материала в рабочую зону 1 и проб при смежном расположении помещений рабочих зон 1, 2, 3 (3а и 3б) желательно осуществлять через шлюзовые передаточные окна, а в рабочие зоны 4 - 1 и 4 - 2 - через передаточные окна.
6.6.4. Перенос проб из одной рабочей зоны в другую, а также их хранение в данных помещениях рекомендуется осуществлять в плотно закрывающихся металлических (с возможностью опломбирования) или пластмассовых контейнерах (штативах) с их последующей обработкой регламентируемыми дезинфицирующими средствами после каждого использования.
6.6.5. При исследовании материала, подозрительного на зараженность микроорганизмами I - IV групп патогенности, все манипуляции в рабочих зонах 1 и 2, включая манипуляции, сопровождающиеся риском образования аэрозоля (встряхивание, центрифугирование и т.д.) при обработке материала и выделении нуклеиновых кислот, выполняют в боксах биологической безопасности II или III класса (прилож. 4).
6.6.6. По окончании работы все объекты, инфицированные (подозрительные на инфицирование) микроорганизмами I - IV групп патогенности, помещают на хранение в холодильное (морозильное) оборудование (бытовые и промышленные холодильники (морозильники) и шкафы, холодильные камеры) на время проведения исследований. Рабочее место и рабочие поверхности оборудования подвергают дезинфекции.
6.6.7. Работы в Рабочих зонах 3, 4 - 1 и 4 - 2 выполняют в боксах биологической безопасности II (I) класса защиты или ПЦР-боксе (прилож. 4). При работе с материалом, содержащим микроорганизмы III - IV групп патогенности, этапы анализа, выполняемые в рабочих зонах 4 - 1 и 4 - 2, проводят на лабораторных столах.
6.6.8. Каждая манипуляция после ее завершения обязательно должна сопровождаться сменой наконечников для автоматических пипеток.
6.6.9. Расходуемые материалы (наконечники, пробирки и т.д.), наборы реагентов должны строго соответствовать используемому оборудованию (автоматическим пипеткам, термоциклерам и т.д.).
6.6.10. Рекомендуется использование источников бесперебойного питания при подключении амплификационного оборудования.
6.6.11. Условия хранения наборов реагентов (комплектов реагентов), образцов проб должны соответствовать инструкциям по применению. Образцы проб, содержащих нуклеиновые кислоты и (или) ампликоны хранят отдельно от реагентов в разных холодильниках. Не допускается использование несертифицированных наборов, реагентов с истекшим сроком годности, хранившихся в условиях нарушения температурного режима.
6.6.12. Холодильное оборудование должно быть оснащено средствами ручного или автоматического температурного контроля и регистрации, свидетельствующими о реальном режиме хранения наборов реагентов и исследуемых проб.
7. Требования к защитной одежде
7.1. При работе с микроорганизмами I - IV групп патогенности выбор типа защитного костюма (рабочей одежды и средств индивидуальной защиты) проводится в строгом соответствии с СП 1.3.1285-03 и (или) СП 1.3.2322-08 и определяется видом возбудителя, рабочей зоной, оснащением ее боксами биологической безопасности (прилож. 4).
7.2. Каждая рабочая зона (помещение) обеспечивается необходимым количеством комплектов спецодежды (комбинезон или пижама, медицинский халат, шапочка, одноразовые латексные (резиновые) перчатки и сменная обувь). При работе в помещении детекции продуктов амплификации следует надевать одноразовые бахилы. Использование одежды из другой зоны запрещено. Рекомендуется использование одноразовой одежды.
7.3. Надевание и снятие защитной одежды производят в предбоксах. В каждом из них должен быть отдельный комплект защитной одежды и обуви. Наиболее загрязненной продуктами амплификации считается защитная одежда рабочих зон 4 - 1 и 4 - 2, особенно латексные (резиновые) перчатки, которые снимают в первую очередь.
8. Требования к обработке помещений и обеззараживанию материала
8.1. Обработку помещений проводят в соответствии с требованиями СП 1.3.1285-03 и СП 1.3.2322-08.
8.2. Ежедневно в конце рабочего дня проводят текущую влажную уборку полов разрешенными к применению дезинфицирующими средствами.
8.3. Рабочие зоны (помещения) лаборатории должны подвергаться ежедневному обеззараживанию ультрафиолетовым излучением в соответствии с Р 3.5.1904-04 «Использование ультрафиолетового бактерицидного излучения для обеззараживания воздуха в помещениях» (М., 2005).
8.4. Каждая рабочая зона (помещения) лаборатории должна быть обеспечена промаркированным набором уборочного инвентаря, не допускается использование индивидуального уборочного инвентаря для уборки других помещений лаборатории.
8.5. Перед началом работы рабочую поверхность столов (биологических боксов) и оборудования обрабатывают 70 %-м этиловым спиртом.
8.6. При использовании кондиционеров ежемесячно проводят очистку и обработку радиаторной решетки кондиционера и накопителя конденсата 0,2 %-м раствором ДП-2Т с заменой фильтров.
8.7. Не менее чем один раз в год осуществляют обработку автоматических дозаторов. Дозаторы разбирают, обрабатывают моющим раствором для удаления жирового загрязнения, после чего остатки моющего средства удаляются ветошью, смоченной водой. Затем проводят обработку 1 N соляной кислотой; время экспозиции - 1 ч. Остатки раствора тщательно удаляют ветошью, смоченной водой, и проводят обеззараживание влажных поверхностей ультрафиолетовым излучением в течение 1 ч. По окончании обработки дозаторы собирают и проводят калибровку в соответствии с прилагаемой инструкцией по пользованию дозаторами. Автоклавируемые дозаторы обеззараживают паром под давлением 1,7 атм. при температуре 120 ± 1 °С в течение 20 мин.
8.8. Остатки материала, инфицированного (подозрительного на инфицирование) микроорганизмами I - IV групп патогенности, использованную посуду после дезинфекции регламентируемыми дезинфицирующими препаратами (если необходимо) собирают в закрывающиеся емкости (контейнеры) и передают на автоклавирование. Не допускается слив необеззараженных жидкостей в канализационную сеть. Порядок и режимы обеззараживания исследуемого материала, инактивации пробирок с ампликонами, использованных реагентов и рабочей одежды представлены в прилож. 5 и 6.
8.9. При возникновении контаминации в помещениях лаборатории, использующей МАНК, немедленно останавливают работы и проводят мероприятия по ликвидации контаминации (прилож. 7).
8.9.1. При случайном открытии пробирок с продуктами амплификации (рабочая зона 3) необходимо остановить работу, надеть перчатки (при их отсутствии), закрыть пробирки, заменить перчатки, провести мероприятия по ликвидации возможной контаминации (прилож. 7).
8.10. В лаборатории проводят внутрилабораторный контроль качества дезинфекции и проведенной деконтаминации ампликонов путем исследования смывов с рабочих поверхностей оборудования и поверхностей помещений.
9. Контроль качества проводимых исследований
9.1. В лаборатории, использующей МАНК в диагностических целях, проводят внутрилабораторный контроль качества проводимых исследований с периодичностью, зависящей от объема выполняемой работы и определяемой руководителем лаборатории, но не реже одного раза в квартал.
9.2. В установленном порядке лаборатория должна принимать участие в мероприятиях (программах) по внешней оценке качества лабораторных исследований (ФСВОК и т.д.) по конкретным нозологическим формам не реже 1 раза в год.
9.3. Внутрилабораторный и внешний контроль качества лабораторных исследований осуществляют путем анализа шифрованных аттестованных контрольных панелей, содержащих «положительные» и «отрицательные» пробы.
9.4. При проведении внутрилабораторного контроля качества лабораторных исследований могут использоваться аттестованные на наличие аналита (его количества) панели производителей коммерческих наборов или внутрилабораторные аттестованные образцы, содержащие и не содержащие нуклеиновые кислоты конкретных возбудителей в различной концентрации, стабильные в условиях хранения.
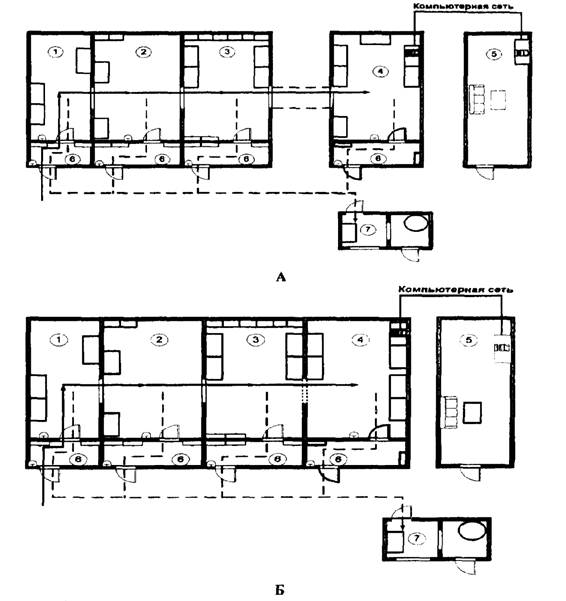
Приложение 1
Рис. 1. Рекомендуемые схемы размещения помещений
(рабочих зон)
лаборатории, использующей МАНК с электрофоретической и (или)
гибридизационно-ферментативной детекцией продуктов амплификации (А и Б)
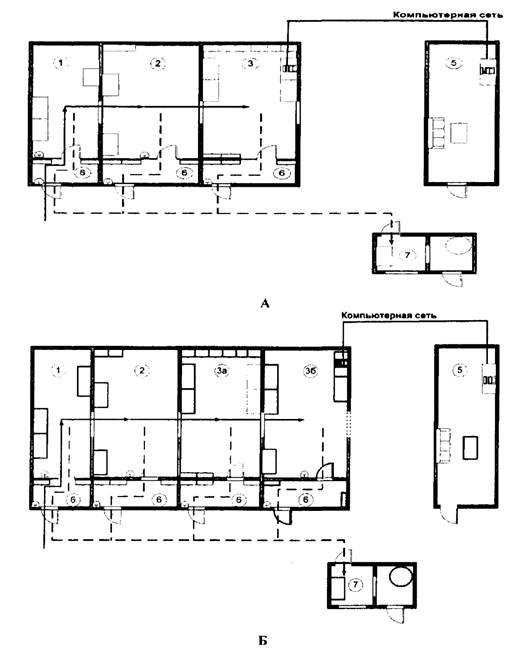
Рис. 2. Рекомендуемые схемы размещения помещений
(рабочих зон)
лаборатории, использующей МАНК с гибридизационно-флуоресцентным
методом детекции продуктов амплификации (А и Б)
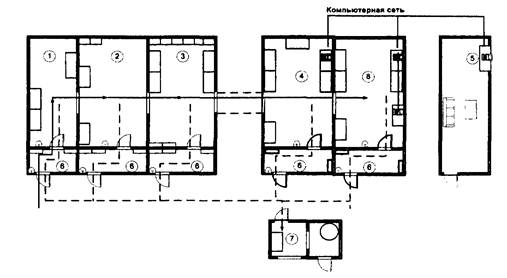
Рис. 3. Рекомендуемая схема размещения помещений
(рабочих зон) лаборатории,
использующей МАНК с комплексной детекцией продуктов амплификации
(электрофоретической, гибридизационно-ферментативной (ГИФА),
гибридизационно-флуоресцентной), а также их последующего секвенирования
или проведения анализа на ДНК-чипах
Обозначения:
1) рабочая зона - 1;
2) рабочая зона - 2;
3) рабочая зона - 3 (подзоны 3а и 3б);
4) рабочая зона 4 - 1;
5) вспомогательное помещение (комната анализа результатов);
6) предбокс;
7) вспомогательное помещение (комната обеззараживания материала с автоклавом);
8) рабочая зона 4 - 2.
Приложение 2
Забор, предварительная обработка, хранение и перевозка материала на исследование
1. Забор материала, его предварительная обработка, хранение и перевозка, передача исследуемого материала в другие организации осуществляется согласно инструктивно-методическим документам, регламентирующим выполнение исследований для каждого вида возбудителя инфекций, инструкциям к наборам реагентов и в соответствии с СП 1.2.036-95, СП 1.3.1285-03 и СП 1.3.2322-08.
2. С целью предотвращения разрушения нуклеиновых кислот рекомендуется использование следующих транспортных сред в зависимости от вида исследуемого материала:
• № 1, содержащая: NaCl 137 мМ, КСl 2,7 мМ, NaH2PО4 10 мМ, К2НРО4 2 мМ, сыворотка крупного рогатого скота 20 %;
• № 2, содержащая: сахароза 0,218 М, КН2РО4 0,0038 М, К2НРО4 0,0072 М, БСА 1 %;
• ESP, содержащая: саркозил 1 %; ЭДТА 0,05 М; свободная от нуклеаз проназа Е 1 мг/мл;
• специальные транспортные среды, разработанные и рекомендованные производителями наборов реагентов.
При необходимости длительного хранения и перевозки в отсутствии низкотемпературных холодильников рекомендуется использовать транспортную среду ESP. Исследуемый материал может храниться в среде ESP при температуре (25 ± 5) °С в темном месте в течение 10 дней.
3. Перевозку матер и гит (предварительно обработанных проб) для исследования, а также его хранение осуществляют в соответствии с СП 1.2.036-95 в закрывающихся (с возможностью опломбирования) металлических или пластмассовых контейнерах, на дне которых размещают адсорбирующий материал (марлевая салфетка, ткань, вата и пр.), смоченный раствором дезинфицирующего средства. Контейнер помещают в сумку-холодильник или во внешний термоконтейнер с хладагентами. При соблюдении противоэпидемического режима возможна перевозка материала для исследования в металлическом термосе со льдом.
4. Перевозку и хранение материала рекомендуется осуществлять в условиях «холодовой цепи» с обеспечением необходимого контроля установленного температурного режима при помощи термоиндикаторов.
4.1. В зависимости от используемой транспортной среды, вида исследуемого материала и температурного режима сроки перевозки и хранения материала могут варьировать в широком диапазоне.
Забор материала на исследование от человека, животных, насекомых и объектов окружающей среды
1. Требования к забору биологического материала.
1.1. Кровь (плазма), сыворотка крови.
Пробы крови (плазмы) используют при проведении качественных и количественных исследований, пробы сыворотки крови используют только при проведении качественных исследований с помощью МАНК.
Взятие материала
Для получения плазмы забор крови производят натощак или через 3 ч после приема пищи из локтевой вены одноразовой иглой (диаметр 0,8 - 1,1 мм) в специальную вакуумную систему типа «Vacuett» (сиреневые крышки - 6 % ЭДТА) или одноразовым шприцем в пластиковые пробирки с цитратом натрия (3,8 %-й раствор цитрата Na в соотношении 1:9). Пробирку закрывают крышкой и аккуратно переворачивают несколько раз вверх дном, чтобы кровь в пробирке тщательно перемешалась с антикоагулянтом (в противном случае кровь свернется, и выделение ДНК/РНК станет невозможным). Гепарин в качестве антикоагулянта использовать нельзя!
Для получения сыворотки забор крови проводят натощак из локтевой вены одноразовой иглой (диаметр 0,8 - 1,1 мм) в одноразовые пробирки без антикоагулянта.
Предварительная обработка проб
Плазму крови получают центрифугированием пробирок с цельной кровью при 800 - 1600 g в течение 20 мин при комнатной температуре. Затем отбирают плазму в количестве не менее 1 мл отдельными наконечниками с фильтром (пастеровскими пипетками) в стерильные пробирки объемом 1,5 или 2,0 мл.
Для получения сыворотки пробирки с кровью отстаивают при комнатной температуре в течение 30 мин до полного образования сгустка или помещают в термостат при 37 °С на 15 мин. Затем центрифугируют при 800 - 1600 g в течение 10 мин при комнатной температуре. Сыворотку переносят отдельными наконечниками с фильтром (пастеровскими пипетками) в стерильные пробирки объемом 1,5 или 2,0 мл. Сыворотка не должна быть гемолизированной.
Клетки крови (лейкоцитарную фракцию цельной крови, лейкоцитарную пленку) для выявления лейкотропных вирусов и т.д. следует отбирать после центрифугирования цельной крови и удаления плазмы. Используя наконечник с фильтром аккуратно собрать лейкоцитарную массу с поверхности осадка клеток в объеме 0,2 мл и перенести в стерильную пробирку объемом 1,5 - 2,0 мл.
Условия хранения и перевозки материала и предварительно обработанных проб
Образцы цельной крови:
• при температуре от 2 до 8 °С - в течение 6 ч с момента взятия материала для количественного определения нуклеиновых кислот; в течение 12 ч - для качественного определения нуклеиновых кислот;
• при температуре от 2 до 8 °С - в течение 1 сут. для качественного и количественного определения ДНК (РНК) инфекционных агентов.
Недопустимо замораживание образцов цельной крови!
Образцы плазмы и сыворотки:
• при температуре от 2 до 8 °С - в течение 5 сут.;
• при температуре -20 °С - в течение года;
• при температуре -70 °С - длительно.
Допускается только однократное замораживание-оттаивание материала, поэтому образцы плазмы или сыворотки для длительного хранения желательно разлить небольшими (0,1 - 0,2 мл) порциями в отдельные стерильные пробирки объемом 1,5 или 2,0 мл.
1.2. Соскобное отделяемое слизистых оболочек урогенитального тракта (цервикального канала, влагалища, уретры), прямой кишки, отделяемое эрозивно-язвенных элементов.
Взятие материала
Забор материала осуществляют с помощью специальных стерильных одноразовых инструментов - урогенитальных зондов, цитощеток или тампонов в зависимости от источника клинического материала согласно установленной процедуре. После взятия клинического материала погрузить рабочую часть зонда в транспортную среду производителя наборов реагентов. Если инструкция к набору реагентов предусматривает - оставить рабочую часть зонда в пробирке с транспортной средой, отломив ее в области насечки. В случае отсутствия насечки или если оставление зонда не предусмотрено инструкцией, погрузить рабочую часть зонда в среду и, прижав ее к внутренней стенке пробирки, вращать зонд 5 - 10 с, после чего зонд удалить, а пробирку плотно закрыть. Перед проведением процедуры экстракции нуклеиновых кислот осадить капли материала со стенок пробирки и внутренней части крышки центрифугированием (1500 - 3000 об./мин в течение 5 с), после чего аккуратно перемешать содержимое пробирки на вортексе, избегая разбрызгивания и попадания материала на внутреннюю часть крышки.
Предварительная обработка проб
Не требуется.
Условия хранения и перевозки материала
Определяются инструкцией к транспортной среде и набору реагентов для выделения и очистки ДНК (РНК). Длительное хранение клинического материала осуществляют в замороженном виде при -70 °С.
1.3. Моча.
Взятие материала
Для анализа отбирают первую порцию утренней мочи в количестве не меньше 20 - 30 мл в специальный сухой стерильный флакон на 50 мл.
Предварительная обработка проб
Взбалтывают флакон с мочой. Переносят 1 мл мочи, используя наконечник с фильтром, в стерильные одноразовые пробирки объемом 1,5 мл. Центрифугируют 5 мин при 10000 g, при наличии большого количества солей ресуспендируют только верхний слой осадка солей в объеме 1 мл и затем снова концентрируют. Используя вакуумный отсасыватель с колбой-ловушкой, полностью удаляют супернатант, не захватывая осадок. К осадку добавляют транспортную среду до конечного объема 0,2 мл, тщательно перемешивают содержимое на вортексе.
Условия хранения и перевозки материала и предварительно обработанных проб
Нативные и предварительно обработанные образцы мочи:
• при температуре от 2 до 8 °С - в течение 1 сут.;
• при температуре -20 °С - в течение 1 недели;
• при температуре -70 °С - длительно.
Допускается лишь однократное замораживание-оттаивание материала.
1.4. Фекалии.
Взятие материала
Используют пробы фекалий массой (объемом) примерно 1 - 3 г (1 - 3 мл). Исследование мазков неинформативно из-за низкого содержания в них возбудителей. Пробу в количестве 1 г (примерно) отдельным наконечником с фильтром или одноразовыми лопатками переносят в специальный стерильный флакон.
Предварительная обработка проб
При исследовании нативных фекалий без предшествующего замораживания готовят фекальную суспензию (при водянистой консистенции фекалий суспензию не готовят).
Приготовление фекальной суспензии
В соответствующее пробам количество микроцентрифужных пробирок (объемом 1,5 мл) вносят 0,8 мл фосфатного буфера (или стерильного изотонического раствора натрия хлорида). В каждую пробирку отдельным наконечником с фильтром (или одноразовыми лопатками) вносят 0,1 г (0,1 мл) фекалий и тщательно ресуспендируют на вортексе до образования гомогенной суспензии.
При невозможности исследования материала в течение суток и/или необходимости длительного хранения к 10 - 20 %-й суспензии фекалий в фосфатном буфере (или стерильном изотоническом растворе натрия хлорида) добавляют глицерин в конечной концентрации 10 - 15 %. Подготовленные таким образом пробы замораживают только после тщательной гомогенизации и экспозиции с глицерином в течение 30 - 40 мин.
Приготовление бактериальной фракции фекалий для выявления бактериальных агентов
Для приготовления бактериальной фракции фекалий используют фекалии водянистой консистенции, свежеприготовленную суспензию фекалий или суспензию, подвергавшуюся замораживанию с глицерином. Пробирки с суспензией (водянистыми фекалиями) центрифугируют при 7000 - 12000 g в течение 5 мин. Отдельным наконечником с фильтром из каждой пробирки отбирают бактериальную фракцию в объеме 0,05 мл (верхняя бело-желтая часть образовавшегося осадка). При отсутствии осадка или бело-желтого пограничного слоя между осадком и супернатантом отбирают 0,1 мл со дна пробирки или с границы осадка или супернатанта соответственно. Отобранную часть пробы, содержащую высокую концентрацию бактерий, переносят в новую микроцентрифужную пробирку объемом 1,5 мл, содержащую 0,8 мл фосфатного буфера (или стерильного изотонического раствора натрия хлорида). Проводят тщательное ресуспендирование осадка на вортексе с последующим центрифугированием при 7000 - 12000 g в течение 15 мин.
Супернатант удаляют, а осадок ресуспендируют на вортексе в 0,3 мл фосфатного буфера (стерильного изотонического раствора натрия хлорида).
Приготовление осветленного экстракта фекалий для выявления вирусных агентов
Для приготовления осветленного экстракта фекалий используют фекалии водянистой консистенции, свежеприготовленную суспензию фекалий или суспензию, подвергавшуюся замораживанию с глицерином. Взвесь фекалий интенсивно гомогенизируют на вортексе. Осветляют полученную суспензию путем центрифугирования при 10000 g в течение 5 мин. Супернатант (0,1 мл) смешивают с отрицательным контрольным образцом (50 %-я сыворотка крови крупного рогатого скота, разведенная фосфатно-солевым буфером, состав которого указан выше) (0,1 мл) в соотношении 1:1 и используют непосредственно для выделения ДНК или РНК. При необходимости хранения супернатант отбирают в отдельную одноразовую пробирку.
Условия хранения и перевозки материала и предварительно обработанных проб
Образцы нативных фекалий:
• при комнатной температуре - в течение 6 ч;
• при температуре от 2 до 8 °С - в течение 3 сут.
Фекальная суспензия с глицерином, бактериальная фракция и осветленный фекальный экстракт:
• при температуре -20 °С - в течение 1 недели;
• при температуре -70 °С - длительно.
1.5. Спинномозговая жидкость (ликвор).
Взятие материала
Спинномозговую жидкость в количестве не менее 1 мл собирают, используя одноразовые иглы, в одноразовые пластиковые пробирки объемом 1,5 или 2,0 мл.
Предварительная обработка проб
Не требуется.
Условия хранения и перевозки материала:
• при температуре от 2 до 8 °С - в течение 1 сут.;
• при температуре -20 °С - в течение 1 недели;
• при температуре -70 °С - длительно.
Допускается лишь однократное замораживание-оттаивание материала.
1.6. Биопсийный и аутопсийный материал.
Взятие материала
Материал забирают из зоны предполагаемого местонахождения возбудителя инфекции, из поврежденной ткани или из пограничного с поврежденным местом участка. Кусочки ткани диаметром не более 5 мм помещают в одноразовые стерильные пробирки объемом 2 мл, содержащие соответствующую транспортную среду. Пробирку плотно закрывают. Макроаутоптат помещают в контейнер с физиологическим раствором или транспортной средой № 2.
Предварительная обработка проб
Микробиоптаты (пунктаты) или микроаутоптаты печени, селезенки, предстательной железы, желудочно-кишечного тракта, шейки матки и т.д., помещенные в микропробирки с закручивающимися крышками или в пробирки объемом 1,5 мл с защелкой, содержащие 0,1 мл транспортной среды, предобработки не требуют. Далее выделение нуклеиновых кислот проводят в соответствии с инструкцией к набору реагентов.
Макробиоптаты или макроаутоптаты. При выявлении вирусных агентов кусочки ткани массой 0,1 - 1 г помещают в охлажденную фарфоровую ступку и добавляют охлажденный изотонической раствор хлорида натрия объемом 0,5 - 1 мл. Измельчают стерильными ножницами с последующим растиранием пестиком. Через ватный тампон отбирают надосадочную жидкость (0,1 - 0,2 мл) стерильным наконечником с фильтром в стерильные микропробирки.
При выявлении бактериальных агентов процесс подготовки макробиоптатов (макроаутоптатов) аналогичен, только ступку и изотонический раствор не охлаждают.
По другому способу биоптат непосредственно перед выделением нуклеиновых кислот помещают в жидкий азот, затем аккуратно измельчают его пестиком в предварительно охлажденной жидким азотом фарфоровой ступке. Взвешивают 100 мг кусочков ткани и растирают их в ступке в жидком азоте до порошка. Затем для выделения РНК порошок переносят в гомогенизатор и следуют инструкции по выделению РНК. Для выделения ДНК к полученному порошку добавляют равный объем стерильного физиологического раствора (0,1 мл), тщательно перемешивают и отбирают необходимый объем материала согласно инструкции для выделения ДНК.
Фарфоровая посуда, а также гомогенизаторы должны быть предварительно обработаны хромпиком и простерилизованы. При гомогенизации нескольких образцов необходимо после каждой пробы протирать поверхность стола 0,2 %-м раствором ДП-2Т, затем водой и 70 %-м этиловым спиртом и менять перед обработкой следующей пробы перчатки.
Условия хранения и перевозки материала
Образцы биопсийного и аутопсийного материала, предназначенного для выделения ДНК или РНК:
• при комнатной температуре - в течение 6 ч;
• при температуре от 2 до 8 °С - в течение 3 сут.;
• при температуре -20 °С - в течение 1 недели;
• при температуре -70 °С - длительно.
1.7. Мокрота.
Взятие материала
Взятие материала осуществляют в количестве не менее 1,0 мл в одноразовые градуированные стерильные флаконы с широким горлом и завинчивающимися крышками объемом не менее 50 мл.
Предварительная обработка проб
Перед выделением нуклеиновых кислот необходимо провести разжижение мокроты, используя раствор «Муколизин» (Na2HPО4 77,4 мМ, NaH2PО4 22,6 мМ, бета-МЭ 99,4 мМ, 5 %-й азид натрия в конечной концентрации 0,05 %). В емкость с мокротой добавляют «Муколизин» в соотношении 5:1 (5 частей «Муколизина» к 1 части мокроты), ориентируясь по градуировке емкости, и стерильные стеклянные бусы. В процессе разжижения мокроты (20 - 30 мин) емкость периодически встряхивают. Затем автоматической пипеткой, используя наконечник с фильтром, отбирают 1,0 мл разжиженной мокроты, помещают в пробирку с завинчивающейся крышкой или в микроцентрифужную пробирку с защелкой на 1,5 мл и центрифугируют при 5000 - 7000 g в течение 10 мин. Удалить 0,8 мл надосадочной жидкости, осадок клеток перемешать с 0,2 мл оставшейся жидкости.
Допускается выделение ДНК/РНК из 0,1 мл разжиженной мокроты без стадии центрифугирования.
Условия хранения и перевозки материала и предварительно обработанных проб:
• при комнатной температуре - в течение 6 ч;
• при температуре от 2 до 8 °С - в течение 3 сут.;
• при температуре -20 °С - в течение 1 недели;
• при температуре -70 °С - длительно.
Допускается лишь однократное замораживание-оттаивание материала.
1.8. Бронхо-альвеолярный лаваж или промывные воды бронхов.
Взятие материала
Взятие материала осуществляют в одноразовые, плотно завинчивающиеся пробирки объемом 50 мл.
Предварительная обработка проб
Промывные воды бронхов или бронхо-альвеолярный лаваж перемешивают переворачиванием пробирки. Автоматической пипеткой, используя наконечник с фильтром, отбирают 1,0 мл клинического материала, помещают в пробирку с завинчивающейся крышкой или пробирку с защелкой на 1,5 мл и центрифугируют при 7000 g в течение 10 мин. Удалить 0,9 мл надосадочной жидкости, осадок клеток перемешать с 0,1 мл оставшейся жидкости.
Условия хранения и перевозки материала и предварительно обработанных проб:
• при температуре от 2 до 8 °С - в течение 1 сут.;
• при температуре -20 °С - в течение 1 недели;
• при температуре -70 °С - длительно.
Допускается лишь однократное замораживание-оттаивание материала.
1.9. Мазки из полости носа.
Взятие материала
Мазки (слизь) берут сухими стерильными ватными тампонами на пластиковой основе. Тампон вводят легким движением по наружной стенке носа на глубину 2 - 3 см до нижней раковины. Затем тампон слегка опускают книзу, вводят в нижний носовой ход под нижнюю носовую раковину, делают вращательное движение и удаляют вдоль наружной стенки носа. После взятия материала тампон (рабочую часть зонда с ватным тампоном) помещают в стерильную одноразовую пробирку с защелкивающейся крышкой, содержащую соответствующую транспортную среду (например, № 2) и аккуратно обламывают пластиковый стержень на расстоянии не более 0,5 см от рабочей части, оставляя рабочую часть зонда с материалом в транспортной среде. Пробирку плотно закрывают крышкой.
Предварительная обработка проб
Не требуется.
Условия хранения и перевозки материала:
• при комнатной температуре - в течение 6 ч;
• при температуре от 2 до 8 °С - в течение 3 сут.;
• при температуре -20 °С - в течение 1 месяца;
• при температуре -70 °С - длительно.
Допускается только однократное замораживание-оттаивание материала.
1.10. Мазки из ротоглотки.
Взятие материала
Мазки берут сухими стерильными ватными тампонами на пластиковой основе вращательными движениями с поверхности миндалин, небных дужек и задней стенки ротоглотки. После взятия материала тампон (рабочую часть зонда с ватным тампоном) помещают в стерильную одноразовую пробирку со специальной транспортной средой (например, № 2) и аккуратно обламывают пластиковый стержень на расстоянии не более 0,5 см от рабочей части, оставляя рабочую часть зонда с материалом в транспортной среде. Пробирку плотно закрывают крышкой.
Предварительная обработка проб
Не требуется.
Условия хранения материала:
• при комнатной температуре - в течение 6 ч;
• при температуре от 2 до 8 °С - в течение 3 сут.;
• при температуре -20 °С - в течение 1 месяца;
• при температуре -70 °С - длительно.
Допускается лишь однократное замораживание-оттаивание материала.
1.11. Смывы из полости носа.
Взятие материала
Взятие материала проводят в положении больного сидя с отклоненной назад головой путем введения с помощью одноразового шприца (зонда) теплого стерильного изотонического раствора натрия хлорида (3 - 5 мл) поочередно в каждый из носовых ходов. Промывную жидкость собирают через стерильную воронку в одну стерильную пробирку.
Не допускается повторное использование воронки без предварительного обеззараживания паром под давлением.
Предварительная обработка проб
Не требуется.
Условия хранения материала:
• при температуре от 2 до 8 °С - в течение 6 ч;
• при температуре -20 °С - в течение 1 недели;
• при температуре -70 °С - длительно.
Допускается лишь однократное замораживание-оттаивание материала.
1.12. Смывы из ротоглотки.
Взятие материала
Перед взятием смывов из ротоглотки проводят предварительное полоскание полости рта водой. После этого проводят тщательное полоскание ротоглотки (в течение 10 - 15 с) 25 - 40 мл изотонического раствора натрия хлорида. Жидкость собирают через стерильную воронку в стерильный флакон на 50 мл.
Предварительная обработка проб
Не требуется.
Условия хранения материала:
• при комнатной температуре - в течение 6 ч;
• при температуре от 2 до 8 °С - в течение 3 сут.;
• при температуре -20 °С - в течение 1 недели;
• при температуре -70 °С - длительно.
Допускается лишь однократное замораживание-оттаивание материала.
1.13. Пунктат бубона.
Взятие материала
Взятие материала производят стерильным шприцем. Если бубон имеет сохранившуюся кожу (не вскрывшийся бубон), то ее протирают предварительно спиртом. Пункцию бубона производят как в его центре, так и на периферии. Из вскрывшегося бубона материал забирают в местах с сохраненной тканью, а также берут отделяемое бубона. Исследуемый материал в количестве 0,1 - 0,3 мл помещают в пробирку с транспортной средой № 2 или ESP (п. 2).
Предварительная обработка проб
Не требуется.
Условия хранения и перевозки материала:
• при температуре от 2 до 8 °С - в течение 1 сут.;
• при температуре -20 °С - в течение 1 месяца;
• при температуре -70 °С - длительно.
Допускается лишь однократное замораживание-оттаивание материала.
1.14. Везикулы, пустулы.
Взятие материала
Перед взятием материала кожные элементы очищают ватным тампоном, смоченным эфиром или спиртом, затем прокалывают их у основания стерильной иглой или тонким капилляром пастеровской пипетки. Для ускорения поступления материала элемент сверху надавливают пинцетом. Корку или верхнюю часть везикул отделяют от кожи иглой, скальпелем. Исследуемый материал помещают в пробирку с транспортной средой № 2 или ESP (п. 2) или другой транспортной средой, рекомендованной производителем.
Предварительная обработка материала, условия хранения и перевозка
В соответствии с п. 1.12.
1.15. Клещи, комары и эктопаразиты (вши и блохи).
Взятие материала
После взятия и доставки материала в лабораторию (комары, клещи, блохи и вши) его обрабатывают эфиром до обездвижения, нанося каплю эфира на ватно-марлевую пробку. После определения вида и пола материал может быть объединен в пулы в зависимости от вида, пола, места и даты сбора и помещен в сухие чистые пробирки объемом 1,5 мл.
Группировку проб осуществляют в соответствии с МУ 3.1.1027-01 «Сбор, учет и подготовка к лабораторному исследованию кровососущих членистоногих - переносчиков возбудителей природно-очаговых инфекций». При исследовании на чуму в одну пробу включают по 20 - 30 (не более 50) блох или мелких клещей, вшей. Иксодовых клещей при исследовании на чуму и другие природно-очаговые инфекции исследуют отдельно по фазам развития и в одну пробу берут пивших самок не более трех, голодных - до 30; нимф пивших - до 15, голодных - до 50; личинок пивших - до 30. При исследовании на туляремию в одну пробу объединяют до 50 имаго иксодовых клещей, 50 - 100 нимф и 100 - 200 личинок. Блох, гамазовых клещей, вшей исследуют до 100 особей в пробе. Из кровососущих двукрылых группируют пробы, включая в одну до 100 комаров, до 250 мошек и 20 - 25 слепней. При исследовании на арбовирусные инфекции комаров объединяют в пулы по 50 - 100 экземпляров. При необходимости проводят исследования отдельных особей.
Предварительная обработка проб:
• клещей помещают в микроцентрифужные пробирки объемом 1,5 мл, куда вносят 1 мл 96 %-го этанола, встряхивают на вортексе и центрифугируют в течение 3 - 5 с при 2000 g для удаления капель с крышки пробирки;
• с помощью вакуумного отсасывателя отдельными наконечниками для каждой пробы удаляют спирт из пробирки;
• вносят в пробирку 1 мл 0,15 М раствора хлорида натрия, встряхивают пробирку и осаждают капли с крышки пробирки на микроцентрифуге в течение 3 - 5 с при 2000 g;
• с помощью вакуумного отсасывателя отдельными наконечниками для каждой пробы удаляют раствор хлорида натрия из пробирки;
• переносят клещей в стерильную фарфоровую чашку, добавляют 0,7 - 1,0 мл 0,15 М раствора хлорида натрия и гомогенизируют пробу;
• наконечником с фильтром переносят пробу в микроцентрифужную пробирку объемом 1,5 мл и центрифугируют при 1200 g в течение 2 мин для осветления пробы.
РНК и ДНК выделяют из 0,1 мл надосадочной жидкости.
При выделении РНК и ДНК из комаров, блох и вшей используют данную методику обработки проб, за исключением этапов отмывки в 96 %-м этаноле и 0,15 М растворе хлорида натрия. Насекомых сразу гомогенизируют в стерильной ступке в 0,15 М растворе хлорида натрия.
Условия хранения материала и предварительно обработанных проб
Материал после разбора и формирования проб:
• при температуре -20 °С - в течение 1 месяца;
• при температуре -70 °С или в сосуде Дьюара с жидким азотом - длительно.
Обработанный материал (после гомогенизации и осветления) хранится длительно при температуре минус 70 °С или в сосуде Дьюара с жидким азотом.
Допускается только однократное замораживание-оттаивание материала.
2. Требования к забору материала из объектов окружающей среды.
Взятие материала
Пробы отбирают с соблюдением правил асептики в стерильные широкогорлые банки с помощью стерильной ложки, пинцета или ножа. Края банок обжигают над пламенем спиртовки. После закладки проб банки закрывают стерильной бумагой и перевязывают.
Предварительная обработка проб
Твердые пищевые продукты в количестве 1 - 10 г помещают в стерильную ступку, добавляют 0,9 %-й раствор натрия хлорида в соотношении 1:10 и растирают до гомогенного состояния. Отстаивают и через ватный тампон отбирают надосадочную жидкость, из которой проводят выделение ДНК. Жидкие пищевые продукты в объеме 0,2 мл переносят в микроцентрифужную пробирку объемом 1,5 или 2,0 мл для выделения ДНК.
Условия хранения и перевозки материала:
• при температуре от 2 до 8 °С - в течение 1 сут.;
• при температуре -20 °С - в течение 1 месяца;
• при температуре -70 °С - длительно.
Допускается лишь однократное замораживание-оттаивание материала.
2.2. Почва, трава, фураж, подстилка.
Взятие материала
Пробы почвы с мест вероятного обсеменения патогенными микроорганизмами (мест вынужденного убоя скота, стоянок и водопоя животных) берут в количестве 20 - 30 г на глубине до 15 см, на территории скотомогильников - на глубине до 2 м с помощью почвенных буров. При этом верхний слой почвы (2 - 3 см) снимают.
Пробы фуража берут из поверхностного слоя - не менее 400 г на 4 м2 поверхности при незатаренном типе хранения. Из брикетированного корма срезают верхний слой брикета. Отбор проб проводят сухим стерильным пробным щупом. Пробы грубых кормов (сено, солома) берут из разных мест скирды при помощи ножниц и пинцета из расчета одна проба (40 г) на 4 м2 площади скирды. Отобранные навески сена и соломы измельчают при помощи ножниц и пинцета на листе бумаги, затем помещают в банки. Зеленую массу, срезанную ножницами, помещают пинцетом в пробирку или в банку.
Предварительная обработка проб
К исследуемому материалу добавляют 0,9 %-й раствор натрия хлорида 1:10, тщательно перемешивают в течение 15 мин, отстаивают в течение 10 мин для оседания крупных частиц. Надосадочную жидкость дробно центрифугируют: первоначально в течение 2 - 3 мин при 2000 g, затем супернатант центрифугируют в течение 15 мин при 10000 g. Осадок ресуспендируют в 0,2 - 0,5 мл дистиллированной воды.
Условия хранения и перевозки
В соответствии с п. 2.1.
2.3. Вода, стоки, смывы.
Взятие материала
Водопроводную воду и воду из поверхностных водоемов для исследования берут в количестве 1 л на одну пробу в двух объемах по 500 мл в стерильную посуду с непромокаемой пробкой. Из водопроводных кранов отбор проб воды производят после предварительного обжигания их спиртовым факелом и спуска воды в течение 10 мин при полном открытии крана.
Хозяйственно-бытовые сточные воды отбирают для исследования двумя способами: в объеме 1 л в двух емкостях по 500 мл или тампонами, приготовленными из марлевых салфеток размером 10×15 см в 10 - 15 слоев. Последние закрепляют у места забора воды, через 1 сут. помещают в стерильную банку, содержащую физиологический раствор.
Смывы с поверхностей берут стерильными ватными тампонами или марлевыми салфетками. Перед взятием смывов тампоны или салфетки смачивают стерильным физиологическим раствором. После взятия смыва тампон (салфетку) погружают в емкость с физиологическим раствором.
Предварительная обработка проб
При выявлении бактериальных агентов и возбудителей микозов подготовку проб осуществляют методом дробного центрифугирования или вакуумной фильтрации на фильтры с размерами пор 0,45 и 0,65, 0,8, 1,2 мкм соответственно. При выявлении вирусных агентов для подготовки проб используют только вакуумную фильтрацию на фильтры с размером пор 0,2 мкм.
Дробное центрифугирование
Из отобранных образцов переносят по 125 мл в 4 центрифужных стакана объемом 250 мл с завинчивающимися крышками (или по 80 мл в 6 центрифужных пробирок, или по 50 мл в 10 центрифужных пробирок) и центрифугируют в течение 15 мин при 10000 g. После этого осадок в каждом стакане (пробирке) ресуспендируют в 0,2 мл 0,9 %-го раствора натрия хлорида. Полученные суспензии переносят в микроцентрифужную пробирку объемом 1,5 или 2,0 мл и центрифугируют при 10000 g в течение 1 мин. Надосадочную жидкость отбирают наконечником с фильтром в микропробирку объемом 1,5 мл. Для выделения ДНК используют 0,1 - 0,2 мл надосадочной фракции.
Возможно центрифугирование одной пробы в одном центрифужном стакане (пробирке). Для этого в центрифужный стакан (пробирку) переносят пробу в объеме 50 - 125 мл и центрифугируют в течение 15 мин при 10000 g, надосадочную жидкость удаляют и в стакан (пробирку) снова добавляют соответствующий объем исследуемой пробы. Аналогичным образом центрифугируют весь объем исследуемой пробы. После последнего центрифугирования осадок ресуспендируют в 1 мл 0,9 %-го раствора натрия хлорида и центрифугируют при 10000 g в течение 1 мин. Надосадочную жидкость отбирают наконечником с фильтром в микропробирку объемом 1,5 мл. Для выделения ДНК используют 0,1 - 0,2 мл надосадочной фракции.
Вакуумная фильтрация
Для исследования используют стерильные фильтры с соответствующими размерами пор. В случае сильной загрязненности исходного образца воды механическими или масляными примесями, определяемыми визуально, его предварительно фильтруют на стеклянной воронке через стерильный ватно-марлевый или бумажный фильтр. Подготовленную таким образом воду пропускают через мембранный фильтр. После окончания фильтрации мембранные фильтры переносят обожженным анатомическим пинцетом в стерильный флакон (чашку Петри) или стерильный пластиковый пакет типа «Вихрь» объемом 100 мл, содержащие 10 мл 0,9 %-го раствора натрия хлорида. Воду после фильтрации обеззараживают добавлением сухой хлорной извести из расчета 200 г на 1 л. Для сорбции бактерий и вирусов с фильтра флакон встряхивают в течение 10 мин с помощью шейкера, фильтр внутри пакета типа «Вихрь» растирают вручную в течение 1 мин, фильтр, помещенный в чашку Петри, разрезают на мелкие куски ножницами, инкубируют при покачивании в течение 10 мин. Далее смыв с поверхности фильтра переносят в стерильную пробирку. Для исследования методом ПЦР отбирают 1 мл в микроцентрифужные пробирки объемом 1,5 мл и центрифугируют при 10000 g в течение 10 мин. При выявлении бактериальных агентов оставляют 0,1 мл надосадочной жидкости, в которой ресуспендируют осадок. Из полученной суспензии проводят выделение ДНК. При выявлении вирусных агентов для выделения нуклеиновых кислот используют 0,1 - 0,2 мл надосадочной жидкости.
Условия хранения и перевозки
В соответствии с п. 2.1.
Приложение 3
Рабочая зона 1
1. Бокс биологической безопасности III класса защиты или бокс биологической безопасности II класса защиты.
2. Центрифуга для пробирок объемом 5 - 100 мл до 3 тыс. об./мин.
3. Микроцентрифуга/вортекс.
4. Настольная центрифуга для микропробирок типа «Эппендорф» объемом 1,5 - 2 мл до 10000 g.
5. Твердотельный термостат для пробирок объемом 1,5 мл с диапазоном рабочих температур 25 - 100 °С.
6. Термостатируемый шейкер для пробирок.
7. Установка для фильтрования воды с набором фильтров.
8. Отдельный набор автоматических пипеток переменного объема.
9. Одноразовые полипропиленовые завинчивающиеся или плотно закрывающиеся микропробирки на 1,5 или 2,0 мл.
10. Одноразовые наконечники для пипеток переменного объема с фильтром до 200 и до 1000 мкл.
11. Штативы для наконечников, микропробирок объемом 1,5 мл.
12. Комбинированный холодильник с камерами, поддерживающими температуру от 2 до 8 °С и не выше -16 °С (для хранения исследуемого материала). Возможно отдельное использование холодильника с камерой, поддерживающей температуру от 2 до 8 °С, и морозильника с камерой, поддерживающей температуру не выше -16 °С.
13. Морозильная камера на -70 °С (при необходимости, в случае длительного хранения материала).
14. Емкость с регламентируемым дезинфицирующим раствором.
15. Емкость с 70 %-м этиловым спиртом.
Рабочая зона 2
1. Бокс биологической безопасности II или III класса биологической защиты.
2. Микроцентрифуга/вортекс.
3. Настольная центрифуга для микропробирок типа «Эппендорф» объемом 1,5 - 2 мл до 10000 g.
4. Твердотельный термостат для пробирок объемом 1,5 мл с диапазоном рабочих температур 25 - 100 °С.
5. Вакуумный отсасыватель медицинский с колбой-ловушкой.
6. Отдельный набор автоматических пипеток переменного объема.
7. Одноразовые полипропиленовые завинчивающиеся или плотно закрывающиеся пробирки объемом 1,5 или 2,0 мл.
8. Одноразовые наконечники для пипеток переменного объема с фильтром до 200 и до 1000 мкл.
9. Одноразовые наконечники для пипеток переменного объема до 200 мкл.
10. Штативы для наконечников, микропробирок на 1,5 мл.
11. Холодильник с камерами, поддерживающими температуру от 2 до 8 °С и не выше -16 °С (для хранения наборов, предназначенных для выделения нуклеиновых кислот). Возможно отдельное использование холодильника с камерой, поддерживающей температуру от 2 до 8 °С, и морозильника с камерой, поддерживающей температуру не выше -16 °С.
12. Холодильник с камерой, поддерживающей температуру от 2 до 8 °С (для хранения препаратов нуклеиновых кислот). Не допускается хранение препаратов нуклеиновых кислот в одном холодильнике с компонентами набора для выделения нуклеиновых кислот;
13. Емкость с дезинфицирующим раствором.
14. При исследовании материала, подозрительного на зараженность возбудителями III - IV групп патогенности, не образующими спор, допускается использование автоматизированного оборудования для выделения нуклеиновых кислот.
Рабочая зона 3
1. Бокс биологической безопасности II и III класса защиты или настольный бокс с бактерицидной лампой (ПЦР-бокс; УФ-бокс).
2. Программируемые термоциклеры (персональные, многомодульные, с функцией амплификации в режиме «реального времени») и автоматизированные станции.
2.1. Выбор термоциклера или автоматизированной станции определяется методами амплификации нуклеиновых кислот и коммерческими наборами реагентов, используемыми в лаборатории, характером выполняемых задач и финансовыми возможностями.
3. Флуориметр (флуоресцентный детектор), только при использовании учета продуктов амплификации гибридизационно-флюоресцентным методом детекции по конечной точке.
4. Микроцентрифуга/вортекс.
5. Отдельный набор автоматических пипеток переменного объема.
6. Одноразовые полипропиленовые пробирки для амплификации объемом 0,5 (0,2) мл.
7. Одноразовые наконечники для пипеток переменного объема с фильтром до 10, 100 и 200 мкл, свободные от РНКаз.
8. Штативы для наконечников, микропробирок на 0,5 (0,2) мл.
9. Холодильник с камерами, поддерживающими температуру от 2 до 8 °С и от -18 до -25 °С (для хранения наборов, предназначенных для проведения обратной транскрипции и амплификации нуклеиновых кислот). Возможно отдельное использование холодильника с камерой, поддерживающей температуру от 2 до 8 °С, и морозильника с камерой, поддерживающей температуру от -18 до -25 °С.
10. Емкость для сброса отработанных расходных материалов.
11. С целью автоматизации процедуры приготовления реакционных смесей для амплификации допускается использование автоматизированного оборудования для раскапывания реагентов.
Рабочая зона 4 - 1
Для электрофоретического анализа продуктов амплификации и их очистки для секвенирования*.
1. Камера для горизонтального электрофореза.
2. Источник постоянного тока с напряжением 150 - 460 В.
3. Ультрафиолетовый трансиллюминатор с кабинетом для просмотра гелей.
4. Видеосистема с цифровой видеокамерой для регистрации результатов.
5. Компьютер (должен быть связан через компьютерную сеть с компьютером, располагающимся в чистой зоне и предназначенным для анализа результатов электрофореза).
6. Аквадистиллятор.
7. Микроволновая печь или другой нагревательный прибор для плавления агарозы.
8. Колба коническая из термостойкого стекла для плавления агарозы объемом 250 мл.
9. Мерные цилиндры объемом 100 и 1000 мл.
10. Столик и набор гребенок для приготовления геля.
11. Штатив для микропробирок на 0,5 мл.
12. Отдельная автоматическая пипетка переменного объема до 100 мкл.
13. Одноразовые наконечники для пипеток переменного объема до 200 мкл в штативе.
14. Холодильник с камерой, поддерживающей температуру от 2 до 8 °С (для хранения наборов электрофоретической детекции).
15. Емкость с дезинфицирующим раствором для сброса отработанных расходных материалов.
16. Пластиковая емкость объемом 5 л для дезактивации буфера и гелей, содержащих бромид этидия.
* Дополнительное оборудование и расходные материалы, требуемые для осуществления очистки продуктов амплификации (секвенирование):
• стерильный ламинарный шкаф;
• твердотельный термостат для пробирок типа «Эппендорф» на 25 - 100 °С;
• микроцентрифуга от 10000 до 12000 g для микроцентрифужных пробирок объемом 1,5 или 2,0 мл;
• микроцентрифуга/вортекс;
• вакуумный отсасыватель медицинский с колбой-ловушкой для удаления надосадочной жидкости;
• отдельный набор автоматических пипеток переменного объема;
• одноразовые полипропиленовые завинчивающиеся или плотно закрывающиеся микропробирки объемом 1,5 или 2,0 мл;
• штативы для микропробирок объемом 1,5 или 2,0 мл и наконечников;
• одноразовые наконечники для пипеток переменного объема в штативах до 200 и до 1000 мкл;
• одноразовые наконечники для пипеток переменного объема с фильтром до 200 и до 1000 мкл;
• холодильник от 2 до 8 °С с морозильной камерой не выше -16 °С.
Для гибридизационно-ферментной детекции продуктов амплификации.
1. Термостат планшетный, поддерживающий температуру 37 °С (термошейкер).
2. Вошер (не обязательно).
3. Планшетный спектрофотометр.
4. Компьютер (должен быть связан через компьютерную сеть с компьютером, располагающимся в чистой зоне и предназначенным для анализа результатов гибридизации).
5. Восьмиканальная пипетка до 200 мкл.
6. Отдельный набор одноканальных автоматических пипеток переменного объема.
7. Одноразовые наконечники для пипеток переменного объема.
8. Мерный цилиндр объемом 1 л.
9. Комбинированный холодильник с камерами, поддерживающими температуру от 2 до 8 °С (для хранения наборов ГиФА) и не выше -16 °С (для хранения ампликонов).
10. Емкость для сброса отработанных расходных материалов.
Рабочая зона 4 - 2
Для секвенирования продуктов амплификации.
Перечень оборудования, необходимого для проведения секвенирования продуктов амплификации, определяется в соответствии с инструкциями по эксплуатации производителей автоматических секвенаторов.
Пример:
1. Автоматический секвенатор.
2. Компьютер (должен быть связан через компьютерную сеть с компьютером, располагающимся в чистой зоне и предназначенным для анализа результатов секвенирования).
3. Источник постоянного тока с напряжением 150 - 460 В.
4. Вортекс.
5. Флуориметр или спектрофотометр.
6. Термостат для пробирок типа «Эппендорф» на 25 - 100 °С.
7. Холодильник с камерой, поддерживающей температуру от 2 до 8 °С.
8. Центрифуга.
9. Отдельный набор одноканальных автоматических пипеток переменного объема.
10. Одноразовые наконечники для пипеток переменного объема.
11. Штативы для наконечников, микропробирок на 0,5 (0,2) мл.
12. Емкость для сброса отработанных расходных материалов.
Для гибридизации и анализа продуктов амплификации с помощью ДНК-чипов.
Перечень оборудования, необходимого для проведения детекции продуктов амплификации с помощью ДНК-чипов, определяется в соответствии с инструкциями по применению к данным наборам реагентов.
Пример:
1. Термостат планшетный, поддерживающий температуру 37 - 60 °С.
2. Термостат для пробирок на 200, 500 мкл, поддерживающий температуру 24 - 99 °С.
3. Вошер-инкубатор специализированный для биочипов.
4. Мультиканальный флуоресцентный сканер для биочипов в комплекте с управляющим компьютером (должен быть связан через компьютерную сеть с компьютером, располагающимся в чистой зоне и предназначенным для анализа результатов анализа).
5. Центрифуга низкоскоростная (до 1200 g) для больших пробирок (50 мл).
6. Холодильник с камерами, поддерживающими температуру от 2 до 8 °С и от -18 °С.
7. Отдельный набор одноканальных автоматических пипеток переменного объема.
8. Восьмиканальная пипетка до 200 мкл.
9. Одноразовые наконечники для пипеток переменного объема.
10. Штативы для наконечников, микропробирок на 0,5 (0,2) мл.
11. Емкость для сброса отработанных материалов.
Приложение 4
|
Рабочие зоны (помещения) |
Вирусы I группы |
Вирусы II группы |
Чума, сап, мелиоидоз |
Глубокие микозы |
Бруцеллез, туляремия, сибирская язва, холера |
Риккетсиозы |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
I. Блок для работы с инфицированными животными |
||||||
|
Рабочая зона 1 Прием, разбор, первичная обработка клинического материала от больных с неясной этиологией (не исключая наличия вирусов 1 группы) |
Максимально изолированные лаборатории (ИСИЗ1)) или боксы биологической безопасности (БББ) III класса + защитная одежда IV типа + РП2) |
|||||
|
II. Боксированные помещения лаборатории |
||||||
|
Рабочая зона 1 |
ИСИЗ или БББ III класса + IV тип + РП |
бокс биологической безопасности II класса |
||||
|
IV тип + РП + респиратор |
IV тип + РП + респиратор |
IV тип + РП + респиратор |
IV тип + РП |
IV тип + РП + респиратор |
||
|
бокс биологической безопасности III класса |
||||||
|
IV тип + РП |
IV тип + РП |
IV тип + РП |
IV тип + РП |
IV тип + РП |
||
|
Рабочая зона 2 |
ИСИЗ или БББ III класса + IV тип + РП |
бокс биологической безопасности II класса |
||||
|
IV тип + РП + респиратор |
IV тип + РП + респиратор |
IV тип + РП + респиратор |
IV тип + РП |
IV тип + РП + респиратор |
||
|
бокс биологической безопасности III класса |
||||||
|
IV тип + РП |
IV тип + РП |
IV тип + РП |
IV тип + РП |
IV тип + РП |
||
|
Рабочая зона 33) |
IV тип + РП + респиратор |
бокс биологической безопасности II класса |
||||
|
IV тип + РП + респиратор |
IV тип + РП + респиратор |
IV тип + РП + респиратор |
IV тип + РП |
IV тип + РП |
||
|
Рабочая зона 4 - 1 и Рабочая зона 4 - 2 |
IV тип + РП + респиратор |
бокс биологической безопасности II класса (I класса) или ПЦР-бокс |
||||
|
IV тип + РП |
IV тип + РП |
IV тип + РП |
IV тип + РП |
IV тип + РП |
||
|
Примечания: 1) ИСИЗ - изолирующие средства индивидуальной зашиты (пневмокостюмы или их аналоги). 2) РП - резиновые или латексные перчатки. 3) В случае исследования материала, подозрительного на зараженность РНК-вирусами I - II групп патогенности, этап проведения реакции обратной транскрипции РНК проводится с использованием ИСИЗ или БББ III класса + IV тип + РП в соответствии с требованиями СП 1.3.1285-03. |
||||||
Приложение 5
1. Исследуемый материал может быть представлен чистыми культурами микроорганизмов, биологическим или секционным материалом от человека и животных, насекомыми, пищевыми продуктами, смывами с поверхностей, фильтратами почвы и т.д. (прилож. 2).
2. Обработка исследуемого материала, инфицированного бактериями I - IV групп патогенности и возбудителями глубоких микозов.
2.1. Обработка исследуемого материала, инфицированного (подозрительного на инфицирование) микроорганизмами I - II групп патогенности (бактериями, не образующими споры, хламидиями, риккетсиями и возбудителями глубоких микозов), проводится следующим способом:
• к исследуемому образцу добавляют мертиолят натрия до конечной концентрации 1:10000 (0,01 %) и прогревают его при 56 °С в течение 30 мин. Затем 100 мкл образца переносят в микроцентрифужные пробирки объемом 1,5 мл, добавляют лизирующий раствор, приготовленный на основе 6 М гуанидинизотиоцианата в объеме, указанном в инструкции по применению к набору реагентов, и инкубируют 15 мин при 65 °С. После выполнения данных процедур материал считается обеззараженным.
2.2. Обработка исследуемого материала, инфицированного (подозрительного на инфицирование) микроорганизмами III - IV групп патогенности (вирусами, хламидиями, риккетсиями и бактериями, не образующими споры) проводится одним из следующих способов:
2.2.1. Способ 1. Прогревание исследуемого образца при 100 °С в течение 30 мин.
2.2.2. Способ 2. К 100 мкл исследуемого образца добавляют лизирующий раствор, приготовленный на основе 6 М гуанидинизотиоцианата в объеме, указанном в инструкции по применению к набору реагентов (тест-системе) с последующей его инкубацией в течение 15 мин при 65 °С.
После выполнения процедуры, указанной в п.п. 2.2.1 или 2.2.2, материал считается обеззараженным.
2.3. Обработка исследуемого материала, инфицированного (подозрительного на инфицирование) бактериями II - IV групп патогенности, образующими споры, проводится следующим способом:
• исследуемый материал в количестве 0,1 мл засевают в пробирки с 0,9 мл бульона Хоттингера, рН 7,2 и инкубируют с аэрацией при 37 °С в течение 2,5 ч. Добавляют пенициллин до конечной концентрации 1000 ед./мл и инкубируют при 37 °С в течение 15 мин. После инкубации с пенициллином исследуемый материал прогревают на водяной бане в течение 10 мин при температуре 100 °С. Затем 100 мкл обработанного образца переносят в пробирки объемом 1,5 мл и добавляют лизирующий раствор, приготовленный на основе 6 М гуанидинтиоизоцианата в объеме, указанном в инструкции по применению к набору реагентов, и инкубируют 15 мин при 65 °С. После выполнения данных процедур материал считается обеззараженным.
3. Обработка исследуемого материала, инфицированного вирусами I - II групп патогенности.
3.1. Обработка исследуемого материала, инфицированного вирусом натуральной оспы, проводится следующим способом:
• материал (100 мкл) помещают в пробирку объемом 1,5 мл, добавляют 400 мкл лизирующего буферного раствора, содержащего 100 мМ Трис-HCl (рН 8), 100 мМ ЭДТА, 100 мМ NaCl, 1 % SDS и инкубируют 10 мин при температуре 65 °С. Добавляют 50 мкл раствора протеиназы К (10 мг/мл), перемешивают и инкубируют в течение 1ч при 56 °С. Центрифугируют в течение 5 мин при 14000 об./мин для осаждения нерастворенных частиц. Супернатант переносят в стерильные пробирки объемом 1,5 мл, добавляют равный объем смеси фенол/хлороформ (рН 8,0) и тщательно перемешивают. Затем центрифугируют в течение 5 мин при 10000 g. Переносят верхнюю водную фазу, содержащую раствор фенола и ДНК, в новую пробирку, добавляют 1/10 по объему 3 М ацетата натрия (рН 5,5), 30 - 40 мкг РНК-носителя (1 мкл раствора РНК-носителя с концентрацией 30 - 40 мкг/мкл) и равный объем изопропанола. Затем центрифугируют в течение 15 мин при 10000 g при 4 °С. Полученный осадок промывают добавлением 1 мл 70 %-го этанола и центрифугированием в течение 5 мин при 14000 об./мин при 4 °С.
После выполнения данных процедур материал считается обеззараженным.
3.2. Обработка исследуемого материала, инфицированного вирусами I - II групп патогенности (кроме вируса оспы), содержащего инфекционную (позитивную) РНК, проводится следующим способом:
• материал (100 мкл) помещают в пробирку объемом 1,5 мл, добавляют 500 мкл лизирующего буфера на основе 6 М гуанидинизотиоцианата и фенола (1:1) и инкубируют 20 мин при температуре 65 °С. Затем выделяют РНК, используя метод нуклеосорбции на силикагеле, начиная с этапа добавления сорбента, либо метод осаждения РНК этанолом в присутствии 0,3 М ацетата натрия. Обратную транскрипцию выполняют в соответствии с инструкцией по применению к набору реагентов. Затем в образцы с кДНК добавляют РНКазу А до конечной концентрации 25 мкг/мл. После выполнения данных процедур материал считается обеззараженным.
3.3. Обработка исследуемого материала, инфицированного (подозрительного на инфицирование) вирусами I - II групп патогенности, содержащих неинфекционную (негативную) РНК или ДНК, проводится следующим образом:
• материал (100 мкл) помещают в пробирку объемом 1,5 мл, добавляют 500 мкл лизирующего буфера на основе 6 М гуанидинизотиоцианата и фенола (1:1) и инкубируют 20 мин при температуре 65 °С. После выполнения данных процедур материал считается обеззараженным.
3.4. Обработка исследуемого материала, подозрительного на инфицирование высокопатогенным неизвестным возбудителем, проводится в соответствии с п.п. 2.3 и (или) 3.1. Работа с таким материалом на всех этапах исследования осуществляется с применением специальных средств индивидуальной защиты согласно прилож. 4.
4. В Рабочие зоны 2, 3, 4 - 1 и 4 - 2 передаются только обработанные пробы, не содержащие инфекционный материал.
5. Обеззараживание остатков исследуемого материала в рабочей зоне 1 осуществляют в соответствии с СП 1.3.1285-03 и СП 1.3.2322-08.
Приложение 6
1. Дезинфицирующие растворы, после обработки ими исследуемого материала и истечения времени их экспозиции, сливают в канализацию, открытую емкость с обработанным материалом помещают в плотный термостойкий пакет (контейнер) для последующего автоклавирования под давлением 2,0 кГс/см2 (0,2 МПа) при температуре 132 ± 2 °С в течение 60 мин.
1.1. После автоклавирования пакет с инактивированным материалом выносят в контейнер для мусора с последующим вывозом на полигон бытовых отходов или на сжигание в специальных печах.
2. Обеззараживание пробирок с ампликонами, расходного материала, перчаток в рабочей зоне 3 (помещении).
2.1. Использованные пробирки с ампликонами (исключая пробирки с ампликонами, передаваемые для анализа в рабочие зоны 4 - 1 и 4 - 2), наконечники, перчатки, ветошь для обработки поверхностей в боксе биологической защиты или ПЦР-боксе собирают в пластиковые закрывающиеся емкости, выносят в рабочую зону 4 - 1 с целью последующей инактивации.
При ее отсутствии отходы переносят в специально-предназначенное вспомогательное помещение, где проводят их инактивацию.
2.2. Утилизацию остатков растворов, содержащих гуанидинизотиоцианат, осуществляют путем их двадцатикратного разбавления водой с последующим сливом жидкости в канализацию.
3. В рабочих зонах 4 - 1 и 4 - 2 или при их отсутствии во вспомогательном помещении использованные наконечники, пробирки с ампликонами (не открывать), перчатки, ветошь после окончания работы помещают в плотный термостойкий пакет (контейнер) для последующего автоклавирования в соответствии с п. 1.
4. Дезактивацию буферов и гелей, содержащих бромид этидия, осуществляют следующими способами.
4.1. Первый способ - отработанные гели и буфер из камеры помещают в пластиковую емкость на 5 л с плотно завинчивающейся крышкой. Добавляют 1 объем 0,5 М раствора калия перманганата и затем 1 объем 2,5 М соляной кислоты. Аккуратно перемешивают и оставляют при комнатной температуре на 4 - 6 ч. Добавляют 1 объем 2,5 М натрия гидроксида, аккуратно перемешивают. Сбрасывают нейтрализованные реактивы в канализацию.
Необходимые реагенты для обработки 1 л буфера и гелей: 0,5 М перманганат калия - 1 л; 2,5 М соляная кислота - 1 л; 2,5 М NaOH - 1 л.
4.2. Второй способ - обработку растворов (буферов), содержащих этидиум бромид, осуществляют путем добавления к ним деконтаминирующего раствора до его конечной концентрации 25 % (например, 25 мл деконтаминирующего раствора добавить к 75 мл раствора, содержащего этидиум бромид), аккуратно перемешивают и оставляют при комнатной температуре в течение 20 ч. Раствор нейтрализуют (рН между 5 - 9) натрием бикарбонатом. Нейтрализованные растворы сливают в канализацию.
Обработку твердых материалов, содержащих этидиум бромид (наконечники и гели), осуществляют путем помещения их в пластмассовую емкость, содержащую деконтаминирукмций раствор. Далее процедуру выполняют как при деконтаминации растворов (буферов), содержащих этидиум бромид.
Приготовление деконтаминирующего раствора: добавить 20 мл 50 %-й гипофосфорной кислоты к раствору, содержащему 4,2 г натрия нитрита в 300 мл дистиллированной воды, аккуратно перемешать. Раствор используют в день приготовления.
4.3. Третий способ - заполнить колонку активированным углем и пропускать через нее отработанный буфер небольшими порциями. Дезактивированный раствор можно сливать в канализацию. Г ели дезактивировать первым способом.
Необходимые реагенты: стеклянная колонка емкостью на 1 - 2 л; активированный уголь.
5. Обработка рабочей одежды.
5.1. При работе с микроорганизмами I - IV групп патогенности обработку рабочей одежды осуществляют в соответствии с СП 1.3.1285-03 и (или) СП 1.3.2322-08.
5.2. Рабочую одежду сотрудников лаборатории маркируют индивидуально и в соответствии с зональным распределением, ее смену проводят не реже одного раза в неделю. В зоне детекции результатов желательно использовать одноразовую рабочую одежду.
5.3. Стирку рабочей одежды сотрудников проводят в прачечной организации. Не допускается одновременно производить стирку рабочей одежды разных рабочих зон. Обработку рабочей одежды из зоны учета результатов (детекции) продуктов амплификации нуклеиновых кислот проводят отдельно от одежды из других зон.
5.4. Сдачу «грязной» и выдачу «чистой» рабочей одежды производят с соблюдением поточности и разделяют во времени.
Приложение 7
Действия при контаминации лаборатории, использующей МАНК, нуклеиновыми кислотами и ампликонами
1. Сотрудников, проводящих мероприятия по деконтаминации, обеспечивают отдельными халатами (желательно одноразовыми), шапочками, одноразовыми бахилами и перчатками, одноразовой ветошью, емкостями для приготовления необходимых количеств моющих и дезинфицирующих растворов.
2. Каждую зону лаборатории обрабатывают сотрудники, работающие в ней.
3. Для обработки каждой зоны используют отдельный набор уборочного инвентаря, подвергаемый после уборки обработке регламентируемыми дезинфицирующими средствами.
4. Каждую зону лаборатории разбивают на участки уборки, например:
• участок 1 - бокс биологической безопасности и оборудование внутри него;
• участок 2 - внешние поверхности бокса биологической безопасности;
• участок 3 - шкафы для расходного материала;
• участок 4 - холодильники для хранения реактивов, образцов проб;
• участок 5 - оборудование, которое используют в работе, но стоит оно вне бокса биологической безопасности;
• участок 6 - поверхности помещения (стены, окна, батареи, потолок, двери и т.д.);
• участок 7 - пол.
5. Обработку проводят от участка к участку последовательно. Каждый участок обрабатывают отдельной ветошью. Перед обработкой готовят моющие и дезинфицирующие растворы.
6. Поверхности каждого участка вначале обрабатывают моющим раствором для удаления жировых загрязнений, после чего остатки моющего средства удаляются ветошью, смоченной водой.
7. Затем на поверхность наносят на 30 мин 0,2 %-й раствор ДП-2Т или аналогичные ему растворы, разрешенные к применению для этих целей в установленном порядке. Остатки дезинфицирующего средства тщательно удаляют ветошью, смоченной водой.
8. После завершения указанной обработки проводят обеззараживание влажных поверхностей ультрафиолетовым излучением в течение 45 мин.
9. Мероприятия, описанные в п.п. 7 и 8, повторяют еще раз.
10. По завершении деконтаминации берут повторные смывы, которые исследуют на наличие нуклеиновых кислот и (или) ампликонов возбудителей инфекционных заболеваний, диагностика которых наиболее часто осуществляется в данной лаборатории, с учетом длины специфических фрагментов амплификации нуклеиновых кислот возбудителей, указанных в инструкциях по применению к набору реагентов.
11. Для проведения смывов используют отдельные стерильные зонды с ватным тампоном, которые смачивают в 0,9 %-м растворе натрия хлорида или ТЕ-буфере (10 мМ Трис, 1 мМ ЭДТА) и вращательными движениями протирают рабочие поверхности оборудования, мебели, дверных ручек, косяков, телефонов и т. п. в течение 10 - 15 с, особое внимание уделяя помещениям совместного посещения работников зоны детекции продуктов амплификации и других сотрудников лаборатории (столовая, санузел и т.п.). После взятия смыва зонд помещают в микропробирки объемом 1,5 мл с 300 - 400 мкл ТЕ-буфера или 0,9 %-м раствором натрия хлорида, вращают в течение 10 - 15 с, избегая разбрызгивания раствора, и, отжав избыток жидкости о стенки пробирки, удаляют. Полученные суспензии перемешивают на вортексе в течение 1 мин. Для постановки реакции амплификации используют необходимый объем жидкости в соответствии с инструкцией по применению к набору реагентов. После получения результатов смывов оформляется протокол.
12. В случае получения в образцах смывов положительных результатов амплификации обработку повторяют.
13. Загрязненный расходный материал (пробирки, наконечники, реактивы и т.п.) и контаминированный рабочий исследуемый материал (кроме исходного материала) обеззараживают через автоклавирование в соответствии с п. 1. прилож. 6.
14. Случаи контаминации регистрируют в специальном журнале с указанием мероприятий по ее устранению и результатов внутрилабораторного контроля.
15. Проведение работ, связанных с амплификацией нуклеиновых кислот, до завершения деконтаминационных мероприятий в лаборатории не допускается.
Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности