Федеральная служба по надзору в сфере защиты прав
потребителей
и благополучия человека
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение остаточных
количеств химических веществ
в объектах окружающей среды, атмосферном
воздухе, воздухе рабочей зоны
и сельскохозяйственной продукции
Сборник
методических указаний
МУК
4.1.1960, 4.1.1961, 4.1.1963
- 4.1.1980-05
1. Разработаны Московской сельскохозяйственной академией им. К.А. Тимирязева, Учебно-научным консультационным центром «Токсикология пестицидов и агрохимикатов» (Калинин В.А., Калинина Т.С., Рыбакова О.И., Калинин А.В.).
2. Рекомендованы к утверждению Комиссией по санитарно-гигиеническому нормированию Минздрава России (протокол № 1 от 31 марта 2005 г.).
3. Утверждены Главным государственным санитарным врачом Российской Федерации, руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 21 апреля 2005 г.
4. Введены в действие с 1 июля 2005 г.
5. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель
Федеральной службы ______________________ Г.Г. Онищенко 21 апреля 2005 г. Дата введения: 1 июля 2005 г. |
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение остаточных
количеств глифосата в зерне
и масле сои, семенах и масле подсолнечника методом
высокоэффективной жидкостной хроматографии
Методические указания
МУК 4.1.1978-05
1. Вводная часть
Действующее вещество: глифосат
(ИСО) N-(фосфонометил)-глицин (ИЮПАК)
Структурная формула:
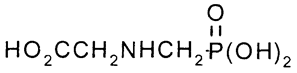
Эмпирическая формула: C3H8PNO5.
Молекулярная масса: 169,1.
Белый порошок без запаха.
Температура плавления: 189,5 ± 0,5 °С.
Давление паров при 25 °С: 1,31 × 10-2 мПа.
Коэффициент распределения н-октанол/вода: Kow logP < -3,2 (pH 2 - 5, 20 °С).
Хорошо растворим в воде (11,6 г/л) и практически нерастворим в органических растворителях (ацетон, этанол, ксилол).
Вещество стабильно при нормальных условиях хранения, не гидролизуется в водных растворах при рН 3 - 9.
Краткая токсикологическая характеристика
Острая пероральная токсичность (LD50) для крыс и мышей составляет соответственно 5600 и 11300 мг/кг. Острая дермальная токсичность (LD50) для крыс - 5000 мг/кг; острая ингаляционная токсичность (LC50) для крыс - > 4,98 мг/л воздуха (4 ч). LD50 для рыб > 1000 мг/л, LC50 для дафний - 780 мг/л, LC50 для водорослей - 1,2 - 42 мг/л (7 дней).
Глифосат малотоксичен для человека, животных, пчел и птиц, не обладает побочными токсическими эффектами.
Гигиенические нормативы
МДУ в семенах подсолнечника - 0,3 мг/кг, подсолнечном масле - 0,1 мг/кг. ВМДУ в зерне сои - 0,15 мг/кг, соевом масле - 0,05 мг/кг.
Область применения препарата
Глифосат - системный гербицид сплошного действия из группы ингибиторов биосинтеза ароматических аминокислот, обладает способностью вызывать десикацию ряда культур, таких как подсолнечник, гречиха, соя и др.
2. Методика определения остаточных количеств глифосата в зерне и масле сои, семенах и масле подсолнечника методом высокоэффективной жидкостной хроматографии
2.1. Основные положения
2.1.1. Принцип метода
Методика основана на определении глифосата с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) в обращено-фазовом режиме с флуоресцентным детектором после предварительного извлечения вещества из растительного материала подкисленной водой, очистки экстрактов в системе несмешивающихся растворителей и на ионообменных смолах Дауэкс 1×8 и Дауэкс 50W × 2, дериватизации глифосата с помощью 9-флуоренилметилхлорформиата в щелочной среде.
Количественное определение глифосата проводится методом абсолютной калибровки.
2.1.2. Избирательность метода
В предлагаемых условиях метод специфичен в присутствии пестицидов, применяемых в интенсивной технологии выращивания сои и подсолнечника.
2.1.3. Метрологическая характеристика метода
Таблица
Метрологические параметры метода
|
Анализируемый объект |
Метрологические параметры, Р = 0,95, n = 20 |
|||||
|
предел обнаружения, мг/кг |
диапазон определяемых концентраций, мг/кг |
среднее значение определения, % |
стандартное отклонение S, % |
относительное отклонение, % |
доверительный интервал среднего, % |
|
|
Зерно сои |
0,15 |
0,15 - 1,5 |
79,7 |
3,5 |
1,6 |
± 3,3 |
|
Масло сои |
0,05 |
0,05 - 0,5 |
80,0 |
3,9 |
1,7 |
± 3,6 |
|
Семена подсолнечника |
0,15 |
0,15 - 1,5 |
80,4 |
4,4 |
2,0 |
± 4,1 |
|
Масло подсолнечника |
0,10 |
0,10 - 1,0 |
80,1 |
3,9 |
1,7 |
± 3,6 |
2.2. Реактивы, растворы, материалы
|
Глифосат с содержанием д.в. 99,8 %, хч (Monsanto, США) |
|
|
Ацетон, хч |
|
|
Ацетонитрил, ч |
ТУ-6-09-3534-82 |
|
Вода дистиллированная, деионизованная |
ГОСТ 7602-72 |
|
Кислота ортофосфорная, 85,6 %, хч |
|
|
Кислота соляная, 37 %, хч |
|
|
Кислота серная, хч |
|
|
Железо серно-кислое, хч |
|
|
Кальция хлорид, хч |
ГОСТ 4161-77 |
|
Калия перманганат, хч |
|
|
Калий углекислый, хч |
|
|
Калий фосфорно-кислый однозамещенный, хч |
|
|
Натрия гидроксид, хч |
|
|
Натрий тетраборнокислый, хч |
|
|
Фосфора пентоксид, ч |
МРТУ 6-09-5759-69 |
|
Хлороформ, хч |
ТУ-6-09-4263-76 |
|
Эфир диэтиловый, хч |
|
|
9-флуоренилметилхлорформиат (Sigma - Aldrich, Германия) |
|
|
Анионообменная смола Дауэкс 1×8 (100 - 200 меш)/Cl- - форма/(Serva, Германия) |
|
|
Катионообменная смола Дауэкс 50W × 2 (100 - 200 меш)/Н+ - форма/(Serva, Германия) |
|
|
Стекловата |
|
|
Фильтры бумажные, красная лента |
ТУ 6-09-1706-72 |
2.3. Приборы, аппаратура, посуда
|
Хроматограф жидкостный с флуоресцентным детектором |
|
|
Колонка хроматографическая, стальная для ВЭЖХ (4×150 мм), неподвижная фаза Диасфер 110-NH2, 5 мкм |
|
|
Колонка хроматографическая, стальная для ВЭЖХ (4×150 мм), неподвижная фаза Диасорб 130-NH2, 7 мкм |
|
|
Весы аналитические типа ВЛР-200 |
|
|
Иономер универсальный ЭВ-74 (РФ) |
|
|
Аппарат для встряхивания АВУ-1 |
ТУ 64-1-1081-73 |
|
Ванна ультразвуковая |
|
|
Испаритель ротационный, тип ИР-1М |
ТУ 25-11-917-76 |
|
Мельница электрическая лабораторная |
ТУ 46-22-236-79 |
|
Вакуумный водоструйный насос |
ГОСТ 10696-75 |
|
Прибор для перегонки при атмосферном давлении |
|
|
Центрифуга Т-23 (Janetzki, Чехия) или аналогичная |
|
|
Колонка хроматографическая, стеклянная (10×250 мм) |
|
|
Колонка хроматографическая, стеклянная (18×250 мм) |
|
|
Колба Бунзена |
ГОСТ 6514-75 |
|
Воронка Бюхнера |
ГОСТ 0147-73 |
|
Воронки делительные, вместимостью 100 и 250 мл |
|
|
Воронки стеклянные |
ГОСТ 8613-75 |
|
Колбы конические плоскодонные, вместимостью 100, 250 и 500 мл |
ГОСТ 10394-72 |
|
Колбы мерные, вместимостью 50, 100 и 1000 мл |
|
|
Колбы круглодонные, вместимостью 100 и 200 мл со шлифом ККШ-250-29/32 |
ГОСТ 10394-72 |
|
Микрошприц емкостью 100 мкл |
|
|
Микрошприц емкостью 1000 мкл |
|
|
Пипетки мерные, вместимостью 0,1; 1, 2, 5 мл |
|
|
Пробирки градуированные с притертыми пробками, вместимостью 5 мл |
ГОСТ 10515-75 |
|
Цилиндры мерные, вместимостью 50 и 100 мл |
2.4. Отбор проб
Отбор проб производится в соответствии с "Унифицированными правилами отбора проб сельскохозяйственной продукции, продуктов питания и объектов окружающей среды для определения микроколичеств пестицидов" (№ 2051-79 от 21.08.79).
Отобранные пробы зерна и семян высушивают до стандартной влажности и хранят в стеклянной или полиэтиленовой таре в холодильнике при температуре 4 °С не более трех месяцев. Масло хранят в холодильнике.
Перед анализом зерно и семена размалывают на мельнице
2.5. Подготовка к определению
2.5.1. Подготовка и очистка реактивов и растворителей
Органические растворители перед началом работы очищают, сушат и перегоняют в соответствии с типовыми методиками.
Ацетонитрил сушат над пентоксидом фосфора и перегоняют; отогнанный растворитель повторно перегоняют над углекислым калием.
Ацетон перегоняют над перманганатом калия и поташом (на 1 л ацетона 10 г KMnO4 и 2 г K2CO3).
Хлороформ встряхивают с концентрированной серной кислотой, промывают водой, сушат над пентоксидом фосфора и перегоняют.
Диэтиловый эфир встряхивают со свежеприготовленным раствором железного купороса (30 г сульфата железа, 655 мл воды с добавлением 1,5 мл концентрированной серной кислоты), затем диэтиловый эфир последовательно промывают 0,5 %-м раствором перманганата калия, 5 %-м раствором гидроксида натрия и водой, после чего сушат над хлористым кальцием и перегоняют.
2.5.2. Приготовление 0,5 н раствора соляной кислоты
В мерную колбу вместимостью 1 л, содержащую 200 - 300 мл деионизованной воды, вносят 41 мл концентрированной НСl, перемешивают, доводят до метки деионизованной водой и перемешивают.
Растворы соляной кислоты других концентраций готовят из 0,5 н раствора НСl соответствующим разбавлением дистиллированной деионизованной водой.
2.5.3. Приготовление 1 М раствора гидроксида натрия
40 г NaOH переносят в мерную колбу емкостью 1 л, добавляют 500 - 600 мл дистиллированной деионизованной воды, перемешивают до полного растворения осадка, охлаждают раствор до комнатной температуры, доводят водой до метки и перемешивают.
2.5.4.
Приготовление 0,1 н раствора калия фосфорно-кислого
однозамещенного (рН 4,5)
13,56 г KH2PO4 переносят в мерную колбу емкостью 1 л, добавляют 500 - 600 мл дистиллированной деионизованной воды, растворяют осадок, доводят водой до метки и перемешивают. Кислотность раствора контролируют с помощью иономера. При необходимости доводят рН раствора до 4,5 с помощью 1 М H3PO4 или 1 M NaOH.
2.5.5. Приготовление 0,025 М раствора
тетраборно-кислого натрия (рН 9,0)
950 мг Na2B4O7×10H2O помещают в мерную колбу емкостью 100 мл, добавляют 50 - 60 мл дистиллированной деионизованной воды, растворяют вещество, доводят водой до метки и перемешивают. Щелочность раствора контролируют с помощью иономера. При необходимости доводят рН раствора до 9,0 с помощью 0,5 н НСl или 1 М NaOH.
2.5.6. Приготовление 0,001 М
раствора
9-флуоренилметилхлорформиата
31,8 мг 9-флуоренилметилхлорформиата помещают в мерную колбу емкостью 100 мл, добавляют 50 - 60 мл ацетона, растворяют вещество, доводят ацетоном до метки и перемешивают.
2.5.7. Подготовка подвижной фазы для ВЭЖХ
Для колонки Диасорб-130-Амин: отмеряют 300 мл ацетонитрила, переносят в колбу емкостью 1000 мл, добавляют 700 мл 0,1 М раствора KH2PO4 (п. 2.5.4), перемешивают, фильтруют и дегазируют в ультразвуковой ванне в течение 2 мин.
Для колонки Диасфер-110-Амин: отмеряют 500 мл ацетонитрила, переносят в колбу емкостью 1000 мл, добавляют 500 мл 0,1 М раствора KH2PO4 (п. 2.5.4), перемешивают, фильтруют и дегазируют в ультразвуковой ванне в течение 2 мин.
2.5.8. Кондиционирование колонки
Промывают колонку для ВЭЖХ 20 мл смеси ацетонитрил-вода (1:1, по объему), а затем подвижной фазой для ВЭЖХ (п. 2.5.7) в течение 30 мин при скорости подачи растворителя 0,9 мл/мин. Включают детектор и дожидаются стабилизации базовой линии (5 - 15 мин).
2.5.9. Приготовление стандартных растворов глифосата
Основной стандартный раствор глифосата с содержанием 100 мкг/мл готовят растворением 100 мг вещества в дистиллированной деионизованной воде в мерной колбе емкостью 1000 мл. Раствор хранят в холодильнике не более одного месяца.
Рабочие стандартные растворы с концентрациями 10, 20, 50 и 100 нг/мл готовят из основного стандартного раствора глифосата соответствующим последовательным разбавлением деионизованной водой. Рабочие растворы хранят в холодильнике не более недели.
2.5.10. Построение калибровочного графика
Для построения калибровочного графика в градуированные пробирки емкостью 5 мл вносят по 1,5 мл рабочих стандартных растворов глифосата с концентрациями 10,0; 20,0; 50,0 и 100 нг/мл и упаривают их досуха на роторном испарителе. Сухой остаток растворяют в 1,5 мл 0,025 М раствора тетрабората натрия. К полученному раствору прибавляют 1,5 мл 0,001 М ацетонового раствора 9-флуоренилметилхлорформиата, реакционную смесь перемешивают, выдерживают 20 мин при комнатной температуре и затем трижды обрабатывают 2 мл порциями диэтилового эфира для удаления избытка флуорогенного реактива. К водному остатку добавляют воды до объема 2,5 мл. Переносят 0,5 мл водного раствора в мерную пробирку емкостью 5 мл, добавляют 4,5 мл подвижной фазы для ВЭЖХ (п. 2.5.7) и перемешивают.
В инжектор хроматографа вводят по 50 мкл полученных растворов флуорогенного производного глифосата и анализируют по п. 2.7. Осуществляют не менее 5 параллельных измерений и находят среднее значение высоты хроматографического пика для каждой концентрации. Строят калибровочный график зависимости высоты хроматографического пика в мм от концентрации вещества в растворе в нг/мл.
2.5.11.
Приготовление растворов глифосата для фортификации
образцов зерна, семян и масла
Для фортификации образцов зерна сои и семян подсолнечника используют водный раствор глифосата с концентрацией 10 нг/мкл, приготовленный из основного стандартного раствора (2.5.9) разбавлением его деионизованной дистиллированной водой. В образцы муки (10 г) вносят с помощью микрошприца 150, 300, 750 или 1 500 мкл раствора глифосата с концентрацией 10 нг/мкл, что соответствует концентрации 0,15; 0,30; 0,75 или 1,5 мг/кг.
Для фортификации образцов масла сои и подсолнечника используют водно-ацетоновый раствор глифосата с концентрацией 10 нг/мкл (раствор А), приготовленный смешиванием 2 мл водного раствора с концентрацией 50 нг/мкл и 8 мл ацетона, и водно-ацетоновый раствор глифосата с концентрацией 100 нг/мкл (раствор Б), приготовленный смешиванием 2 мл водного раствора глифосата с концентрацией 500 нг/мкл и 8 мл ацетона.
К 5 г масла сои с помощью микрошприца добавляют 25, 50 или 125 мкл раствора А или 25 мкл раствора Б и тщательно перемешивают в течение 5 мин. В полученных образцах концентрация глифосата составляет 0,05; 0,10; 0,25 или 0,50 мг/кг.
К 5 г масла подсолнечника с помощью микрошприца добавляют 50 и 100 мкл раствора А или 25 и 50 мкл раствора Б и тщательно перемешивают в течение 5 мин. В полученных образцах концентрация глифосата составляет 0,1; 0,2; 0,5 и 1,0 мг/кг.
2.5.12. Подготовка анионообменной смолы и колонки
Заливают 100 г анионообменной смолы Дауэкс 1×8 (Clˉ - форма) 1 л 0,5 н раствора HCl и перемешивают суспензию в течение 2 мин. После 30-минутного стояния декантируют надосадочную жидкость, оставшуюся суспензию смолы фильтруют на воронке Бюхнера через бумажный фильтр. Смолу на фильтре промывают деионизованной водой до тех пор, пока рН фильтрата не достигнет рН деонизованной воды.
В нижнюю часть стеклянной колонки длиной 25 см и внутренним диаметром 10 мм вставляют тампон из стекловаты, медленно выливают в колонку (при открытом кране) суспензию 10 г подготовленного анионита Дауэкс 1×8 (Clˉ - форма) в 50 мл деионизованной воды. Дают растворителю стечь до верхнего края сорбента и вводят в колонку 1 мл водного раствора глифосата с концентрацией 20 мкг/мл. Колонку последовательно промывают 20 мл деионизованной воды, 200 мл 0,5 н HCl и 250 мл деионизованной воды со скоростью 5 мл/мин, после чего она готова к работе.
2.5.13. Подготовка катионообменной смолы и колонки
Заливают 100 г катионообменной смолы Дауэкс 50W × 2 (Н+ - форма) 1 л 0,25 н раствора HCl и перемешивают суспензию в течение 2 мин. После 30-минутного стояния декантируют надосадочную жидкость, оставшуюся суспензию смолы фильтруют на воронке Бюхнера через бумажный фильтр. Смолу на фильтре промывают деионизованной водой до тех пор, пока рН фильтрата не достигнет рН деонизованной воды.
В нижнюю часть стеклянной колонки длиной 25 см и внутренним диаметром 18 мм вставляют тампон из стекловаты, медленно выливают в колонку (при открытом кране) суспензию 15 г подготовленного катионита Дауэкс 50W × 2 (Н+ - форма) в 50 мл деионизованной воды и дают растворителю стечь до верхнего края сорбента. Затем колонку последовательно промывают 200 мл 0,25 н HCl, 200 мл деионизованной воды и 50 мл 0,03 н HCl со скоростью 5 мл/мин, после чего она готова к работе.
2.5.14.
Проверка хроматографического поведения глифосата
на колонке с Дауэкс 1×8
В подготовленную по п. 2.5.12 колонку с Дауэксом 1×8 вводят 5 мл водного раствора глифосата с концентрацией 0,4 мкг/мл, подщелоченного 1М NaOH до рН 11,0. Колонку промывают 200 мл деионизованной воды со скоростью 5 мл/мин и элюат отбрасывают. Затем через колонку последовательно пропускают 50 мл 0,01 н НСl и 60 мл 0,03 н НСl со скоростью 2 мл/мин и собирают 10 мл фракции. Фракции упаривают досуха на роторном испарителе при температуре 40 °С и эту операцию повторяют трижды с последовательно вносимыми 5 мл порциями деионизованной воды для удаления следов кислоты. Остаток растворяют в 1,5 мл 0,025 М тетрабората натрия, подвергают дериватизации по п. 2.6.3 и анализируют на содержание глифосата по п. 2.7.
Фракции, содержащие глифосат, объединяют и вновь анализируют по п. 2.7. Рассчитывают содержание вещества в элюате, определяют полноту смывания с колонки и необходимый для очистки объем элюента.
2.6. Описание определения
2.6.1. Экстракция и очистка глифосата
2.6.1.1. Зерно сои и семена подсолнечника. Навеску (10 г) муки сои или подсолнечника помещают в коническую колбу емкостью 250 мл, приливают 125 мл 0,1 н HCl HCl и перемешивают в течение 30 мин на аппарате для встряхивания. Суспензию центрифугируют 10 мин при 5000 g. Остатки ткани повторно обрабатывают 50 мл 0,1 н HCl и полученный экстракт объединяют с первым. Из супернатанта отбирают аликвоту раствора, эквивалентную 5 г ткани, и переносят в делительную воронку вместимостью 250 мл. Добавляют 30 мл хлороформа и содержимое энергично встряхивают в течение 1 мин. После разделения слоев хлороформную фракцию отбрасывают. При анализе семян сои проводят повторную обработку водной фазы хлороформом (30 мл). Водную фазу подщелачивают 1 М NaOH до рН 11,0 и центрифугируют 5 мин при 5000 g. Супернатант декантируют в цилиндр емкостью 100 мл и доводят деионизованной водой до объема 100 мл.
2.6.1.2. Масло. Навеску (5 г) масла помещают в делительную воронку емкостью 100 мл, приливают 50 мл 0,1 н HCl и энергично встряхивают в течение 1 - 2 мин. Нижний водный слой собирают, а масло повторно обрабатывают 30 мл 0,1 н HCl. Объединенные водные экстракты переносят в делительную воронку емкостью 250 мл, добавляют 50 мл хлороформа и энергично встряхивают в течение 1 мин. После разделения слоев нижнюю хлороформную фракцию отбрасывают, а водную фазу подщелачивают 1 М NaOH до рН 11,0 и центрифугируют 5 мин при 5000 g. Супернатант декантируют в цилиндр емкостью 100 мл и доводят деионизованной водой до объема 100 мл. Дальнейшую очистку проводят по п. 2.6.2.
2.6.2. Очистка на ионообменных колонках
Для очистки на ионообменных колонках и дальнейшего анализа используют 12-мл аликвоты экстрактов зерна, семян и масла (п.п. 2.6.1.1, 2.6.1.2), соответствующие 0,6 г матрицы. Отобранные аликвоты пропускают через подготовленную по п. 2.5.12 колонку с Дауэкс 1×8 со скоростью 2 мл/мин. Колонку последовательно промывают 200 мл воды и 50 мл 0,01 н НСl со скоростью 5 мл/мин, которые отбрасывают. Глифосат элюируют 60 мл 0,03 н НСl со скоростью 2 мл/мин.
Собранный элюат пропускают через подготовленную по п. 2.5.13 колонку с Дауэкс 50W × 2 со скоростью 2 мл/мин. Отбрасывают первые 5 мл элюата и собирают в грушевидную колбу остальной элюат. Колонку промывают 10 мл 0,03 н НСl и элюат объединяют с ранее полученным. Объединенный элюат упаривают досуха на роторном испарителе при температуре 40 °С, и эту операцию повторяют трижды с последовательно вносимыми 5 мл порциями деионизованной воды для удаления следов кислоты.
2.6.3. Дериватизация
Остаток в колбе, полученный при упаривании очищенных по п. 2.6.2 экстрактов зерна и семян, растворяют в 9 мл, соевого масла в 3 мл и подсолнечного масла в 6 мл 0,025 М раствора тетрабората натрия (п. 2.5.5). 1,5 мл аликвоты раствора переносят в градуированную пробирку емкостью 5 мл с притертой пробкой, прибавляют 1,5 мл 0,001 М ацетонового раствора 9-флуоренилметилхлорформиата (п. 2.5.6) и содержимое хорошо перемешивают. Реакционную смесь выдерживают 20 мин при комнатной температуре, а затем трижды обрабатывают 2 мл порциями диэтилового эфира для удаления избытка флуорогенного реактива. К водному остатку добавляют деионизованной воды до объема 2,5 мл. 0,5 мл водного раствора переносят в мерную пробирку емкостью 5 мл, прибавляют 4,5 мл подвижной фазы для ВЭЖХ (п. 2.5.7), перемешивают и содержание глифосата определяют по п. 2.7.
2.7. Условия хроматографирования
2.7.1. Жидкостный хроматограф фирмы Altex, мод. 322 (США) с флуоресцентным детектором фирмы Shimadzu, мод. RF-530 (Япония).
Хроматографическая колонка стальная, 4×150 мм, заполненная Диасфер-110-Амин (5 мкм).
Подвижная фаза: ацетонитрил - 0,1 М раствор KH2PO4, рН 4,5 (50:50, по объему).
Скорость потока элюента: 0,9 мл/мин.
Температура колонки: комнатная.
Длина волны: λmax возбуждения 270 нм; λmax эмиссии 313 нм.
Чувствительность детектора: 4.
Объем вводимой пробы: 50 мкл.
Время удерживания глифосата: около 9 мин.
Линейный диапазон детектирования: 0,03 - 1,5 нг.
2.7.2. Жидкостный хроматограф фирмы Altex, мод. 322 (США) с флуоресцентным детектором фирмы Shimadzu, мод. RF-530 (Япония).
Хроматографическая колонка стальная, 4×150 мм, заполненная Диасорб-130 Амин (7 мкм).
Подвижная фаза: ацетонитрил-0,1 М раствор KH2PO4, рН 4,5 (30:70, по объему).
Скорость потока элюента: 0,9 мл/мин.
Температура колонки: комнатная.
Длина волны: λmax возбуждения 270 нм; λmax эмиссии 313 нм.
Чувствительность детектора: 4.
Объем вводимой пробы: 50 мкл.
Время удерживания глифосата: около 9 мин.
Линейный диапазон детектирования: 0,03 - 1,5 нг.
Каждую анализируемую пробу вводят 3 раза и вычисляют среднюю высоту пика.
Образцы, дающие пики большие, чем стандартный раствор с концентрацией 100 нг/мл, разбавляют подвижной фазой для ВЭЖХ.
2.8. Обработка результатов анализа
Содержание глифосата рассчитывают методом абсолютной калибровки по формуле:
|
|
Х - содержание глифосата, мг/кг;
H1 - высота пика образца, мм;
H0 - высота пика стандарта, мм;
А - концентрация стандартного раствора глифосата, мкг/мл;
m - масса анализируемой части образца, г (для зерна сои и семян подсолнечника - 0,1 г, для масла подсолнечника - 0,15 г, для масла сои - 0,3 г).
3. Требования техники безопасности
Необходимо соблюдать общепринятые правила безопасности при работе с органическими растворителями, токсичными веществами, электронагревательными приборами.
4. Контроль погрешности измерений
Оперативный контроль погрешности и воспроизводимости измерений осуществляется в соответствии с рекомендациями МИ 2335-95. ГСИ. Внутренний контроль качества результатов количественного химического анализа.
5. Разработчики
Назарова Т.А., Микитюк О.Д., Макеев А.М.
ВНИИ фитопатологии, 143050 Московская обл., п/о Большие Вяземы, тел. 592-92-20.