МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
|
УСТАНОВКИ ДИСТИЛЛЯЦИОННЫЕ ОПРЕСНИТЕЛЬНЫЕ СТАЦИОНАРНЫЕ |
ГОСТ |
|
Методы химического анализа промывных растворов при очистке оборудования |
|
|
Stationary distillation desalting units. |
Постановлением Государственного комитета СССР по стандартам от 15 ноября 1985 г. № 3612 дата введения установлена
01.01.87
Настоящий стандарт устанавливает методы химического анализа промывных растворов на все контролируемые компоненты.
Подготовка аппаратуры, реактивов, растворов и общие требования к отбору проб и проведению анализа - по ГОСТ 26449.0-85.
Содержание
1. ТИТРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ СОЛЯНОЙ КИСЛОТЫ
1.1. Сущность метода
Соляную кислоту титруют раствором гидроокиси натрия с индикатором - метиловым красным. Влияние железа и меди устраняют добавлением раствора трилона Б.
Метод применяют при определении массовой концентрации соляной кислоты от 20 мг/дм3 и более.
Нижний предел обнаружения составляет 12 мг/дм3.
1.2. Аппаратура, реактивы и растворы
Колбы конические вместимостью 250 см3.
Колбы мерные вместимостью 1000 см3.
Пипетки с делениями вместимостью 2 и 5 см3. Бюретка вместимостью 25 см3.
Мензурка вместимостью 100 см3.
Натрия гидроокись, стандарт-титр.
Натрия
гидроокись, раствор с молярной концентрацией эквивалента ![]() 0,1 моль/дм3;
готовят из стандарт-титра.
0,1 моль/дм3;
готовят из стандарт-титра.
Трилон Б, раствор с массовой концентрацией 50 г/дм3.
Кальций хлористый, раствор с массовой концентрацией 100 г/дм3.
Метиловый красный, индикатор; готовят по ГОСТ 4919.1-77.
1.3. Проведение анализа
В коническую колбу помещают 5 см3 раствора трилона Б, 2 см3 раствора хлористого кальция, 3-5 капель метилового красного и 80-90 см3 дистиллированной воды. Раствор нейтрализуют, добавляя из бюретки раствор гидроокиси натрия до перехода окраски из красной в желтую. В нейтрализованный раствор вводят объем исследуемого раствора, содержащий 2-80 мг соляной кислоты, и титруют раствором гидроокиси натрия до перехода окраски из красной в желтую.
1.4. Обработка результатов
1.4.1. Массовую концентрацию соляной кислоты X, мг/дм3, вычисляют по формуле:
![]()
где V1 - объем раствора гидроокиси натрия, израсходованный на титрование, см3;
0,00365 - масса соляной кислоты, эквивалентная массе гидроокиси натрия в 1 см3 раствора с молярной концентрацией эквивалента 0,1 моль/дм3, г;
V - объем исследуемого раствора, взятый для анализа, см3.
1.4.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 1.
|
Массовая концентрация соляной кислоты, мг/дм3 |
Допускаемое расхождение |
Массовая концентрация соляной кислоты, мг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
||
|
12 |
9,2 |
74 |
120 |
10,8 |
9 |
|
20 |
9,4 |
47 |
160 |
11,2 |
7 |
|
30 |
9,6 |
32 |
240 |
14,4 |
6 |
|
40 |
10,0 |
25 |
320 |
16,0 |
5 |
|
60 |
10,2 |
17 |
480 |
17,2 |
4 |
|
80 |
10,4 |
13 |
640 и более |
- |
3 |
Примечание к табл. 1-5. При необходимости разбавления исследуемого раствора значения массовой концентрации определяемых компонентов следует делить на кратность разбавления.
Допускаемые расхождения в относительных единицах должны соответствовать массовой концентрации разбавленного раствора.
2. ТИТРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ СОЛЯНОЙ КИСЛОТЫ И ЖЕЛЕЗА
2.1. Сущность метода
Соляную кислоту титруют раствором гидроокиси натрия в присутствии сульфосалициловой кислоты, после чего к раствору добавляют соляную кислоту и титруют железо (III) раствором трилона Б.
Метод применяют при определении массовой концентрации соляной кислоты от 8 мг/дм3 и более, железа (III) - от 4 мг/дм3 и более.
Нижний предел обнаружения составляет соответственно 4 и 1 мг/дм3.
2.2. Аппаратура, реактивы и растворы
Плитка электрическая.
Бюретка вместимостью 25 см3.
Колбы конические вместимостью 250 см3.
Мензурка вместимостью 50 см3.
Колбы мерные вместимостью 1000 см3.
Пипетки с делениями вместимостью 5 и 10 см3.
Трилон Б, стандарт-титр.
Трилон Б,
раствор с молярной концентрацией эквивалента ![]() 0,05 моль/дм3;
готовят из стандарт-титра.
0,05 моль/дм3;
готовят из стандарт-титра.
Натрия гидоокись, стандарт-титр.
Натрия гидроокись, раствор с молярной концентрацией эквивалента 0,3 моль/дм3; готовят из стандарт-титра.
Кислота сульфосалициловая, раствор с массовой концентрацией 100 г/дм3 нейтрализованный раствором гидроокиси натрия до рН 7.
Аммоний надсернокислый, раствор с массовой концентрацией 50 г/дм3.
Кислота соляная, разбавленная 1:10.
2.3. Проведение анализа
Объем исследуемого раствора, содержащий 1,5-60,0 мг соляной кислоты и 1-40 мг железа, помещают в коническую колбу, добавляют 50-60 см3 дистиллированной воды, 5 см3 раствора сульфосалициловой кислоты и титруют раствором гидроокиси натрия до перехода окраски раствора из красно-фиолетовой в желтую. К раствору добавляют соляную кислоту до восстановления красно-фиолетовой окраски 0,5-1,0 см3 раствора надсернокислого аммония, нагревают до температуры 60-70 °С и титруют раствором трилона Б до перехода окраски раствора в зеленовато-желтую.
2.4. Обработка результатов
2.4.1. Массовую концентрацию железа Х1, мг/дм3, вычисляют по формуле:
![]()
где V1 - объем раствора трилона Б, израсходованный на титрование, см3;
0,0014 - масса железа, эквивалентная массе трилона Б в 1 см3 раствора с молярной концентрацией эквивалента 0,05 моль/дм3, г;
V - объем исследуемого раствора, взятый для анализа, см3.
2.4.2. Массовую концентрацию соляной кислоты Х2, мг/дм3, вычисляют по формуле:
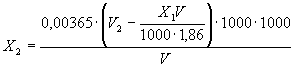
V2 - объем раствора гидроокиси натрия, израсходованный на титрование, см3;
0,00365 - масса соляной кислоты, эквивалентная массе гидроокиси натрия в 1 см3 раствора с молярной концентрацией эквивалента 0,1 моль/дм3, г;
1,86 - масса железа, эквивалентная массе гидроокиси натрия в 1 см3 раствора с молярной концентрацией эквивалента 0,1 моль/дм3 (для реакции гидроокиси натрия с железосульфосалицилатным комплексом), мг.
2.4.3. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 2 и 3.
Таблица 2
|
Массовая концентрация железа, мг/дм3 |
Допускаемое расхождение |
|
|
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
|
|
1 |
0,7 |
74 |
|
2 |
0,8 |
40 |
|
4 |
0,8 |
20 |
|
6 |
0,8 |
14 |
|
8 |
0,9 |
11 |
|
10 |
0,9 |
9 |
|
15 |
0,9 |
6 |
|
20 |
1,0 |
5 |
|
30 |
1,2 |
4 |
|
40 |
1,6 |
4 |
|
60 |
1,8 |
3 |
|
80 |
2,4 |
3 |
|
100 |
3,0 |
3 |
|
150 и более |
- |
2 |
|
Массовая концентрация кислоты, мг/дм3 |
Допускаемое расхождение |
|
|
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
|
|
4 |
3,0 |
75 |
|
6 |
3,0 |
50 |
|
8 |
3,0 |
37 |
|
10 |
2,9 |
29 |
|
15 |
3,2 |
21 |
|
20 |
3,2 |
16 |
|
30 |
3,6 |
12 |
|
40 |
3,6 |
9 |
|
80 |
4,0 |
5 |
|
160 |
4,8 |
4 |
|
320 |
9,6 |
3 |
|
640 и более |
|
2 |
3. ФОТОКОЛОРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ЖЕЛЕЗА С ИСПОЛЬЗОВАНИЕМ СУЛЬФОСАЛИЦИЛОВОЙ КИСЛОТЫ - ПО ГОСТ 26449.0-85, РАЗД. 16
4. МЕТОДЫ ОПРЕДЕЛЕНИЯ МЕДИ
4.1. Экстракционно-фотоколориметрический метод - по ГОСТ 26449.0-85, разд. 19.
4.2. Потенциометрический метод
4.2.1. Сущность метода
Медь в исследуемом растворе определяют по изменению электродвижущей силы (ЭДС) цепи, состоящей из медьселективного электрода, электрода сравнения, измерительной ячейки с исследуемым раствором и рН-метра или иономера. Влияние солей (в основном солей кальция) учитывают построением градуировочного графика на фоне имитирующего раствора. Проверку градуировочного графика проводят не реже одного раза в смену перед проведением анализа.
Метод применяют при определении массовой концентрации меди от 100 мкг/дм3 и более.
Нижний предел обнаружения составляет 64 мкг/дм3.
Применение метода ограничено диапазоном 4-6 рН исследуемого раствора и присутствием в исследуемом растворе избытка железа по отношению к массовой концентрации меди не более чем 50:1.
4.2.2. Аппаратура, реактивы и растворы
рН-метр лабораторный или иономер с основной погрешностью измерения не более 2,5 мВ для шкалы делений до 5 рН.
Электрод измерительный медьселективный с электрическим сопротивлением 5·10-2-7·10-2 мОм; в диапазоне молярных концентраций меди С от 10-6 до 10-2 моль/дм3 крутизна электродной характеристики (28±3) мВ/рС. Перед измерением электрод выдерживают в течение 24 ч в растворе сернокислой меди с молярной концентрацией 1·10-3моль/дм3.
Электрод сравнения хлорсеребряный насыщенный по ГОСТ 17792-72.
Термокомпенсатор автоматический с тепловой инерционностью не более 3 мин.
Весы аналитические.
Колбы мерные вместимостью 100 и 1000 см3.
Пипетки с делениями вместимостью 1 и 10 см3.
Натрия гидроокись, раствор с массовой концентрацией 40 г/дм3.
Кислота серная, разбавленная 1:20.
Метиловый красный, индикатор; готовят по ГОСТ 4919.1-77.
Основной стандартный раствор, 1 см3 раствора содержит 1 мг меди; готовят по ГОСТ 4212-76.
Рабочий стандартный раствор, 1 см3 раствора содержит 10 мкг меди; готовят разведением основного стандартного раствора.
Имитирующий раствор; раствор хлористого кальция с массовой концентрацией 16,5 г/дм3.
4.2.3. Проведение анализа
В мерную колбу вместимостью 100 см3 помещают объем исследуемого раствора, содержащий 10-80 мкг меди, добавляют 20-30 см3 дистиллированной воды, нейтрализуют раствором гидроокиси натрия в присутствии метилового красного до перехода окраски из красной в желтую, доводят объем раствора до метки дистиллированной водой и перемешивают. Раствор помещают в измерительную ячейку, погружают электроды, термокомпенсатор и через 2-3 мин измеряют значение ЭДС по шкале иономера.
Массовую концентрацию меди находят по градуировочному графику.
4.2.4. Построение градуировочного графика
В мерные колбы вместимостью по 100 см3 помещают 1, 2, 3, 4, 5, 6, 7, 8 см3 рабочего стандартного раствора, добавляют имитирующий раствор в объеме, равном объему исследуемого раствора, взятому для определения меди по п. 4.2.3, и доводят объемы растворов до метки дистиллированной водой. Массовая концентрация меди б растворах составляет соответственно 100, 200, 300, 400, 500, 600, 700, 800 мкг/дм3. Растворы в порядке возрастания массовой концентрации меди помещают в измерительную ячейку, погружают электроды, термокомпенсатор и через 2-3 мин измеряют значения ЭДС по шкале иономера.
По найденным значениям ЭДС и соответствующим им значениям массовой концентрации мели строят градуировочный график.
4.2.5. Обработка результатов
4.2.5.1. Массовую концентрацию меди X, мкг/дм3, вычисляют по формуле:
![]()
где V - объем исследуемого раствора, взятый для анализа, см3;
m - массовая концентрация меди, найденная по градуировочному графику, мкг/дм3;
V1 - объем раствора в мерной колбе, см3.
4.2.5.2. Относительные допускаемые расхождения результатов двух параллельных определение не должны превышать 9,0 % для мономеров с основной погрешностью ±2,5 мВ.
5. КОМПЛЕКСОНОМЕТРИЧЕСКИИ МЕТОД ОПРЕДЕЛЕНИЯ КАЛЬЦИЯ ПРИ ОТСУТСТВИИ ФОСФАТОВ
5.1. Сущность метода - по ГОСТ 26449.1-85, разд. 11.
5.2. Аппаратура, реактивы и растворы - по ГОСТ 26449.1-85, разд. 11.
5.3. Проведение анализа
Объем исследуемого раствора, содержащий 2-20 мг кальция, помещают в коническую колбу, нейтрализуют раствором гидроокиси натрия до рН 7, добавляют 90-100 см3 дистиллированной воды и далее анализ проводят, как указано в ГОСТ 26449.1-85, разд. 11.
5.4. Обработка результатов - по ГОСТ 26449.1-85, разд. 11.
6. КОМПЛЕКСОНОМЕТРИЧЕСКИИ МЕТОД ОПРЕДЕЛЕНИЯ МАГНИЯ В ПРИСУТСТВИИ КАЛЬЦИЯ
6.1. Сущность метода - по ГОСТ 26449.1-85, разд. 12.
6.2. Аппаратура, реактивы и растворы - по ГОСТ 26449.1-85, разд. 10.
6.3. Проведение анализа
Исследуемый раствор в объеме, равном объему для определения кальция по п. 5.3, помещают в коническую колбу, нейтрализуют раствором аммиака до рН 7, добавляют 90-100 см3 дистиллированной воды. Далее анализ проводят, как указано в ГОСТ 26449.1-85, разд. 10.
6.4. Обработка результатов - по ГОСТ 26449.1-85, разд. 12.
7. КОМПЛЕКСОНОМЕТРИЧЕСКИИ МЕТОД ОПРЕДЕЛЕНИЯ ОБЩЕЙ ЖЕСТКОСТИ
7.1. Сущность метода
В присутствии фосфатов определяют сумму молярных концентраций эквивалентов кальция и магния (общую жесткость) и далее поступают, как указано в ГОСТ 26449.1-85, разд. 10.
7.2. Аппаратура, реактивы и растворы - по ГОСТ 26449.1-85, разд. 10.
7.3. Проведение анализа - по ГОСТ 26449.1-85, разд. 10.
7.4. Обработка результатов - по ГОСТ 26449.1-85, разд. 10.
8. ФОТОКОЛОРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ФОСФОРА С ИСПОЛЬЗОВАНИЕМ ВОССТАНОВИТЕЛЯ - ТИОМОЧЕВИНЫ
8.1. Сущность метода - по ГОСТ 26449.4-85, разд. 10.
Метод применяют при определении массовой концентрации фосфора от 200 мкг/дм3 и более
Нижний предел обнаружения составляет 100 мкг/дм3.
8.2. Аппаратура, реактивы и растворы - по ГОСТ 26449.4-85, разд. 10.
8.3. Проведение анализа
Объем исследуемого раствора, содержащий 20-100 мкг фосфора, помещают в мерную колбу вместимостью 100 см3 и далее анализ проводят, как указано в ГОСТ 26449.4-85, разд. 10.
8.4. Построение градуировочного графика - по ГОСТ 26449.4-85, разд. 10.
8.5. Обработка результатов
8.5.1. Массовую концентрацию фосфора X, мкг/дм3 вычисляют по формуле:
![]()
где m - масса фосфора в пробе, найденная по градуировочному графику, мкг;
V - объем исследуемого раствора, взятый для анализа, см3.
8.5.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 4.
Таблица 4
|
Массовая концентрация фосфора, мкг/дм3 |
Допускаемое расхождение |
Массовая концентрация фосфора, мкг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мкг/дм3 |
в относительных единицах, % |
||
|
100 |
80 |
80 |
600 |
110 |
19 |
|
150 |
80 |
55 |
700 |
120 |
18 |
|
200 |
80 |
40 |
800 |
130 |
17 |
|
300 |
90 |
30 |
1000 |
140 |
14 |
|
400 |
100 |
25 |
1500 |
120 |
11 |
|
500 |
110 |
21 |
2000 и более |
|
10 |
9. ТИТРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ УРОТРОПИНА
9.1. Сущность метода
Уротропин разлагается в кислой среде с образованием формальдегида. При реакции формальдегида с солянокислым гидроксиламином выделяется соляная кислота, которую титруют раствором гидроокиси натрия.
Метод применяют при определении массовой концентрации уротропина от 26 мг/дм3 и более.
Нижний предел обнаружения составляет 13 мг/дм3.
9.2. Аппаратура, реактивы и растворы
Баня водяная.
Колба коническая вместимостью 250 см3 со шлифом.
Холодильник со шлифом.
Колбы мерные вместимостью 1000 см3.
Бюретка вместимостью 25 см3.
Пипетки с делениями вместимостью 5 и 10 см3.
Мензурка вместимостью 50 см3.
Натрия гидроокись, стандарт-титр.
Натрия
гидроокись, раствор с молярной концентрацией эквивалента ![]() 0,1 моль/дм3;
готовят из стандарт-титра.
0,1 моль/дм3;
готовят из стандарт-титра.
Гидроксиламин солянокислый, раствор с массовой концентрацией 100 г/дм3.
Кислота соляная, разбавленная 1:1.
Кислота серная, разбавленная 1:1.
Индикатор смешанный; готовят следующим образом: 0,1 г метилового оранжевого растворяют в 50 см3 дистиллированной воды и 0,25 г индигокармина - в 50 см3 дистиллированной воды. Растворы смешивают и хранят в посуде из темного стекла.
9.3. Проведение анализа
Объем исследуемого раствора, содержащий 2,5-10,0 мг уротропина, помещают в колбу со шлифом, добавляют 5 см3 соляной кислоты. Колбу соединяют с холодильником и нагревают на водяной бане в течение 4 ч. Раствор охлаждают до температуры 20-25 ºС, добавляют 40-50 см3 дистиллированной воды, 3-4 капли смешанного индикатора, нейтрализуют раствором гидроокиси натрия до перехода окраски раствора из фиолетовой в сине-зеленую, после чего добавляют 5 см3 раствора солянокислого гидроксиламина и выдерживают в течение 30 мин. Затем титруют раствором гидроокиси натрия до перехода окраски из фиолетовой в сине-зеленую. Одновременно через нее стадии анализа проводят раствор, содержащий 100 см3 дистиллированной воды и реактивы.
9.4. Обработка результатов
9.4.1. Массовую концентрацию уротропина X, мг/дм3, вычисляют по формуле:
![]()
где V1 - объем раствора гидроокиси натрия, израсходованный на титрование исследуемого раствора, см3;
V2 - объем раствора гидроокиси натрия, израсходованный на титрование дистиллированной воды, см3;
0,0023 - масса уротропина, эквивалентная массе гидроокиси натрия в 1 см3 раствора с молярной концентрацией эквивалента 0,1 моль/дм3; г;
V - объем исследуемого раствора, взятый для анализа, см3.
9.4.2. Допускаемые расхождения результатов двух параллельных определений не должны превышать значений, приведенных в табл. 5.
|
Массовая концентрация уротропина, мг/дм3 |
Допускаемое расхождение |
Массовая концентрация уротропина, мг/дм3 |
Допускаемое расхождение |
||
|
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
в абсолютных единицах, мг/дм3 |
в относительных единицах, % |
||
|
13 |
9,6 |
74 |
91 |
11,0 |
12 |
|
26 |
9,8 |
38 |
130 |
12,0 |
9 |
|
39 |
9,8 |
25 |
260 |
13,0 |
5 |
|
52 |
10,4 |
20 |
390 |
19,0 |
5 |
|
65 |
10,4 |
16 |
520 |
21,0 |
4 |