МИНИСТЕРСТВО ПРИРОДНЫХ РЕСУРСОВ
РОССИЙСКОЙ ФЕДЕРАЦИИ
Утверждаю
Первый заместитель Министра
природных ресурсов
Российской Федерации
Н.Н. Михеев
27 апреля 2001 г.
РУКОВОДСТВО
по определению методом биотестирования токсичности вод, донных отложений, загрязняющих веществ и буровых растворов
РЭФИА, НИА-Природа
Москва-2002
Настоящее «Руководство по определению методом биотестирования токсичности вод, донных отложений, загрязняющих веществ и буровых растворов» содержит ранее и вновь разработанные методики биотестирования для определения токсичности сточных и природных пресных и морских вод, донных отложений, отработанных буровых растворов и загрязняющих веществ с использованием в качестве тест-объектов бактерий, водорослей, простейших, ракообразных и рыб.
Метод биотестирования наряду с физико-химическими методами применяется при установлении нормативных требований к качеству вод и предназначен для использования Министерством природных ресурсов Российской Федерации, его территориальными органами и подведомственными организациями, а также научно-исследовательскими, проектными и производственными организациями, имеющими разрешение на проведение работ по биотестированию в соответствии с установленными требованиями.
ПРЕДИСЛОВИЕ
Настоящее «Руководство по определению методом биотестирования токсичности вод, донных отложений, загрязняющих веществ и буровых растворов» содержит ранее и вновь разработанные методики биотестирования для определения токсичности сточных и природных (пресных и морских) вод, донных отложений, отработанных буровых растворов, сбрасываемых в море, и загрязняющих веществ.
Метод биотестирования наряду с физико-химическими методами применяется при установлении нормативных требований к качеству вод, при проведении экологического контроля за соблюдением нормативов допустимых сбросов химических веществ в водные объекты, нормативов допустимых воздействий хозяйственной и иной деятельности на водные объекты, осуществлении государственного экологического мониторинга за состоянием водных объектов в районах расположения источников антропогенного воздействия, проведении оценки изменения состояния водных экосистем, биоценозов.
Исследования в области разработки и использования метода биотестирования в водоохранной практике проводились во многих научно-исследовательских и учебных институтах. В 1980г. была признана необходимость применения биотестирования как показателя оперативной интегральной диагностики качества вод. В 1981-1986 гг. методики биотестирования были апробированы и рекомендованы для определения токсичности сточных и природных вод. По итогам апробации Всесоюзным научно-исследовательским институтом по охране вод (ВНИИВО) - головным институтом по разработке и использованию методов определения токсичности вод в 1990 г. было подготовлено и утверждено Государственным комитетом СССР по охране природы «Методическое руководство по биотестированию воды» (РД 118-02-90). В этот документ вошли методики с использованием тест-объектов - представителей основных трофических звеньев водной экосистемы: водорослей, ракообразных и рыб. Позднее, для целей государственного экологического контроля Минприроды России, а затем Госкомэкологией России были подготовлены и утверждены методики для определения токсичности воды с использованием в качестве тест-объектов инфузорий и ракообразных (ПНД Ф Т* 14.1:2:3:4.2-98; ПНД Ф Т 14.1:2:3:4.3-99; ПНД Ф Т 14.1:2:3:4.4-99), и для определения токсичности вод, почв и донных отложений - методика биотестирования по ферментативной активности бактерий (ПНД Ф Т 14.1:2:3:4.1-96, 16.2:2:3:1.2.-96).
____________
* Примечание: ПНД Ф Т - федеральный природоохранный нормативный документ, регламентирующий токсикологические методы контроля.
Настоящее руководство содержит впервые разработанные методики определения токсичности донных отложений, морских вод, буровых растворов, сбрасываемых в морскую воду.
Методики прошли экспертизу в Уральском научно-исследовательском институте метрологии Госстандарта России, на основании которой дано заключение о соответствии установленных для них метрологических характеристик требованиям, предъявляемым к методикам выполнения измерений (письмо УНИИМ Госстандарта России от 30.09.99 № 224-10.0/2385).
В Руководстве учтены требования европейских стандартов и документов международных организаций (разделы «Общие положения», «Нормативные ссылки», «Приложение В»).
Для определения токсичности природных пресных вод и донных отложений сточных вод, отработанных буровых растворов и загрязняющих веществ рекомендуется применять «Методику биотестирования по снижению уровня биолюминесценции бактерий Photobacterium phosphoreum (Cohn) Ford»; «Методику биотестирования по снижению прироста количества инфузорий Tetrahymena pyriformis (Ehrenberg) Schewiakoft»; «Методику биотестирования по угнетению роста пресноводных водорослей Scenedesmus quadricauda (Тurp) Breb»; «Методику биотестирования по гибели ракообразных Daphnia magna Straus»; «Методику биотестирования по гибели ракообразных Ceriodaphnia affinis Lilljeborg»; «Методику биотестирования по выживаемости и плодовитости ракообразных Ceriodaphnia affinis Lilljeborg»; «Методику биотестирования по гибели рыб Poecillia reticulata Peters».
Для определения токсичности морских вод и донных отложений, сточных вод разной степени солености и отработанных буровых растворов, сбрасываемых в морские воды, рекомендуется использовать «Методику биотестирования по угнетению роста одноклеточных морских водорослей Phaeodactylum tricornutum Bohlin»; «Методику биотестирования по гибели ракообразных Artemia salina L.»; «Методику биотестирования по гибели рыб Poecillia reticulata Peters»; «Методику биотестирования по снижению уровня биолюминесценции бактерий Photobacterium phosphoreum (Cohn) Ford».
Руководство было рассмотрено и рекомендовано к утверждению Научно-техническим советом Министерства природных ресурсов Российской Федерации (протокол от 17.07.2000 г. № 17 совместного заседания Секции водного хозяйства и Подсекции нормативов в области использования и охраны водных объектов под председательством Первого заместителя Министра природных Российской Федерации Н.Н. Михеева).
Авторами методик являются специалисты ведущих научных учреждений как бывшего Советского Союза, так и России: Всесоюзного научно-исследовательского института по охране вод (ныне Украинский научно-исследовательский институт экологических проблем Минэкоресурсов Украины), Московского государственного университета им. М.В. Ломоносова, Гидрохимического института Росгидромета, Всероссийского научно-исследовательского института рыбного хозяйства и океанографии Госкомрыболовства России, Государственного научно-исследовательского института озерного и речного рыбного хозяйства Росрыбхоза России, Федерального государственного унитарного предприятия комлексного научно-исследовательского и конструкторно-технологического института водоснабжения, канализации, гидротехнических сооружений и инженерной гидрогеологии Госстроя России, Института биологии внутренних вод РАН, бывшего Главного управления аналитического контроля при Минприроды России (ныне ФГУ «Центр экологического контроля и анализа МПР России), Института экологической токсикологии МПР России, Института гидробиологии АН СССР (ныне НАН Украины), Института биологии южных морей АН СССР (ныне НАН Украины), ГУ НИИ экологии человека и гигиены окружающей среды им. А.Н. Сысина РАМН; Красноярского государственного университета и др. Список авторов методик приведен в «Приложении Д» настоящего документа.
СОДЕРЖАНИЕ
1. ОБЛАСТЬ ПРИМЕНЕНИЯ
1.1. Метод биотестирования по определению токсичности сточных и природных пресных и морских вод, донных отложений, отработанных буровых растворов загрязняющих веществ применяются наряду с физико-химическими методами при установлении нормативных требований к качеству вод, проведении экологического контроля за соблюдением нормативов допустимых сбросов химических веществ в водные объекты и нормативов допустимых воздействий хозяйственной и иной деятельности на водные объекты; осуществлении государственного экологического мониторинга водных объектов прежде всего, в районах расположения источников антропогенного воздействия; проведении оценки сосотояния водных экосистем.
1.2. Методики предназначены для использования Министерством природных ресурсов Российской Федерации, его территориальными органами и подведомственными организациями, научно-исследовательскими, проектными и производственными организациями, имеющими разрешение на проведение работ по биотестированию в соответствии с установленными требованиями.
2. НОРМАТИВНЫЕ ССЫЛКИ
- Водный кодекс Российской Федерации от 16 ноября 1995г. № 167-ФЗ
- ГОСТ 12.0.004-79 ССБТ. Организация обучения работающих безопасности труда. Общие положения
- ГОСТ 12.1.004-85 ССБТ. Пожарная безопасность. Общие требования
- ГОСТ 12.1.019-79 ССБТ. Электробезопасность. Общие требования и номенклатура видов защиты
- ГОСТ 12.4.009-83 ССБТ. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
- ГОСТ 12.4.021-75 ССБТ. Системы вентиляционные. Общие требования
- ГОСТ 17.1.1.02-77 Охрана природы. Гидросфера. Классификация водных объектов
- ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
- ГОСТ 112-78Е Термометры метеорологические стеклянные. Технические условия
- ГОСТ 171-81 Дрожжи хлебопекарные прессованные. Технические условия
- ГОСТ 245-76 Натрий фосфорнокислый однозамещенный 2-водный. Технические условия
- ГОСТ 612-75 Марганец (II) хлористый 4-водный. Технические условия
- ГОСТ 1770-74Е Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Технические условия
- ГОСТ 2493-75 Калий фосфорнокислый двузамещенный 3-водный. Технические условия
- ГОСТ 2874-82 Вода питьевая. Гигиенические требования и контроль за качеством
- ГОСТ 4147-74 Железо (III) хлорид 6-водный. Технические условия
- ГОСТ 4159-79 Йод. Технические условия
- ГОСТ 4166-76 Натрий сернокислый. Технические условия
- ГОСТ 4201-79 Натрий углекислый кислый. Технические условия
- ГОСТ 4209-77 Магний хлористый 6-водный. Технические условия
- ГОСТ 4217-77 Калий азотнокислый. Технические условия
- ГОСТ 4220-75 Калий двухромовокислый. Технические условия
- ГОСТ 4233-77 Натрий хлористый. Технические условия
- ГОСТ 4234-77 Калий хлористый. Технические условия
- ГОСТ 4523-77 Магний сернокислый 7-водный. Технические условия
- ГОСТ 4525-77 Кобальт хлористый 6-водный. Технические условия
- ГОСТ 6038-79 D-Глюкоза, безводная. Технические условия
- ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
- ГОСТ 6709-72 Вода дистиллированная. Технические условия
- ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
- ГОСТ 9656-75 Кислота борная. Технические условия
- ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
- ГОСТ 13805-76 Пептон сухой для бактериологических целей
- ГОСТ 14919-83Е Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
- ГОСТ 22649-83 Стерилизатор воздушный медицинский
- ГОСТ 24104-88Е Весы лабораторные общего назначения и образцовые. Общие технические условия
- ГОСТ 25336-82Е Посуда и оборудование стеклянное. Типы, основные параметры и размеры
- ГОСТ 27065-86 (СТ СЭВ 5184-85) Качество вод. Термины и определения
- ГОСТ 29227-91 Посуда лабораторная стеклянная. Пипетки градуированные. Ч. 1. Общие требования
- ГОСТ Р 51000.1-95 Система аккредитации органов по сертификации, испытательных и измерительных лабораторий. Общие требования
- ГОСТ Р 51000.2-95 Общие требования к аккредитующему органу
- ГОСТ Р 51000.3-96 Общие требования к испытательным лабораториям
- ГОСТ Р 8.563-96 ГСИ. Методики выполнения измерения
- EN 45001 Общие требования к деятельности испытательных лабораторий
- EN 45002 Общие требования при оценке испытательных лабораторий
- ИСО/МЭК 25 Общие требования к оценке технической компетентности испытательных лабораторий
- ИСО/МЭК 2 Общие термины и определения в области стандартизации и смежных видов деятельности
- ИСО/МЭК 45 Общие требования к представлению результатов испытаний
- ИСО 10253: 1995 Качество воды. Тест по угнетению роста морских водорослей Skeletonema costatum и Phaeodactilum tricornutum
- ТУ 6-09-04711-81 Кальция хлорид
- ТУ 16-064. 011-84 Микрокомпрессоры
- ТУ 64-1-816-77 Камеры счетные
- ТУ 64-1-3326-81 Биолюминометр БЛМ-8703 М
- Норматив водного надзора (НВН) 33-5.3.01-85 Инструкция по отбору проб для анализа сточных вод
- РД 118-02-90 Методическое руководство по биотестированию воды. Утв. Госкомприроды СССР от 06.08.90 г. № 37.
- Керiвний нормативний документ (КНД) 211.1.4.047- 95 Методика бioтестування морськоi води та стiчноï, яка вiдводиться в море. Методика
- КНД 211.1.4.054-97 Методика визначення гостроï токсичностi води на ракоподiбних Daphnia magna Straus
- КНД 211.1.4.055-97 Методика визначення гострoï летальноï токсичностi води на ракоподiбних Ceriodaphnia affinis Lilljeborg
- КНД 211.1.4.056-97 Методика визначення хронiчноï токсичностi води на ракоподiбних Ceriodaphnia affinis Lilljeborg
- КНД 211.1.4.057-97 Методика визначення гocтpoï летальноï токсичностi води на рибах Poecilia reticulata Peters
- КНД 211.1.4.058-97 Методика визначення гостроï токсичностi води на водоростях Scenedesmus quadricauda (Тurp) Breb
- КНД 211.1.4.059-97 Методика визначення токсичностi води на iнфузорiях Tetrahymena pyriformis (Ehrenberg) Schewiakoff
- КНД 211.1.4.060-97 Методика визначення токсичностi води на бактерiях Photobacterium phosphoreum (Cohn) Ford
- Методические указания по разработке нормативов предельно допустимых сбросов вредных веществ в поверхностные водные объекты (Уточненная редакция). Утв. Министром природных ресурсов Российской Федерации от 30.09.99
- Методические указания по разработке нормативов предельно допустимых вредных воздействий на водные объекты. Утв. Первым заместителем Министра природных ресурсов Российской Федерации и Первым заместителем Председателя Государственного Комитета Российской Федерации по охране окружающей среды от 26.02.99
3. ОБЩИЕ ПОЛОЖЕНИЯ
3.1. Руководство устанавливает процедуры проведения методик биотестирования с использованием лабораторных культур гидробионтов - представителей основных трофических звеньев водной экосистемы: бактерий, простейших, водорослей, ракообразных и рыб.
3.2. Методики биотестирования предназначены для определения острой (в краткосрочных экспериментах) и хронической (в долгосрочных экспериментах) токсичности сточных и природных (пресных и морских) вод, донных отложений, загрязняющих химических веществ (смеси химических веществ) и буровых растворов. Выбор методики для определения токсичности того или иного объекта тестирования следует производить с учетом поставленной задачи в области охраны и использования водных объектов.
3.3. Способы обработки и оценки результатов биотестирования основаны на стандартных и широко используемых в отечественной и международной практике методах статистической обработки экспериментальных данных.
3.4. Помимо методик биотестирования, представленных в настоящем Руководстве, допускается использование других методик, разработанных и утвержденных в установленном порядке.
3.5. Настоящий документ разработан в дополнение и развитие РД 118-02-90 Методическое руководство по биотестированию воды. Утв. Госкомприроды СССР от 06.08.90 г. № 37.
4. ОТБОР, ХРАНЕНИЕ, ПОДГОТОВКА ПРОБ, ПРИГОТОВЛЕНИЕ РАСТВОРОВ ВЕЩЕСТВ, РАЗБАВЛЕНИЙ ПРОБ ВОДЫ, ВОДНЫХ ВЫТЯЖЕК ИЗ ДОННЫХ ОТЛОЖЕНИЙ И БУРОВЫХ РАСТВОРОВ
4.1. Пробы поверхностных вод отбирают согласно ГОСТ 17.1.5.05, сточных - по НВН 33-5.3.01. Пробы подземных вод отбирают в соответствии с инструкциями или рекомендациями по проведению наблюдений за режимом подземных вод по ведомственной сети скважин. Пробы отработанного бурового раствора отбирают из-под вибрационного сита. Пробы донных отложений отбирают дночерпателями (модели Петерсена, Экмана, Берджа или др).
4.2. Пробы, отобранные для биотестирования, не подлежат консервированию химическими веществами или замораживанию.
4.3. Пробы воды отбирают в количестве, указанном в соответствующих методиках биотестирования. Для отбора и хранения проб используют стеклянную посуду, которую заполняют под пробку и плотно закрывают.
4.4. Пробы донных отложений отбирают в количестве, которое обеспечивает приготовление из них водных вытяжек в объемах, указанных в соответствующих методиках.
4.5. Биотестирование проб воды (водных вытяжек) проводят не позднее 6 ч после отбора (приготовления водной вытяжки), а при отсутствии такой возможности допускается биотестирование проб воды (водные вытяжки), которые хранились в темноте в доверху наполненной плотно закрытой посуде при температуре 4±2°С не более 72 ч.
4.6. Перед биотестированием пробы воды (водные вытяжки) перемешивают и фильтруют через фильтровальную бумагу по ГОСТ 12026. Если того требует цель биотестирования, пробы воды (водные вытяжки) не фильтруют.
4.7. Для приготовления водной вытяжки пробу донных отложений высушивают до воздушно сухого состояния при температуре 20±5°С, удаляют остатки растений, камешки и т.д., измельчают в ступке и просеивают через сито с диаметром отверстий 1 мм. Затем взвешивают необходимое количество донных отложений и заливают водой по ГОСТ 6709 в соотношении 1:4. Смесь встряхивают в течение 1 часа с помощью встряхивателя. Затем смесь переносят в центрифужный стакан и центрифугируют в течение 15 мин при 3000 об/мин. После чего надосадочную жидкость сливают и используют для биотестирования.
4.8. Пробы отработанных буровых растворов отбирают из-под фильтрационного сита в количестве, которое обеспечивает приготовление взвешенной твердой фазы (ВТФ) бурового раствора для биотестирования (п. 4.7).
Пробы отбирают в чистые полиэтиленовые емкости таким образом, чтобы под крышкой оставался слой воздуха толщиной 2 см. После чего пробы направляют в лабораторию в емкостях-холодильниках с использованием «мокрого» льда (сухой лед для этих целей не используется). Температура хранения проб должна быть в пределах 0-4°С. Срок хранения проб в емкостях-холодильниках при соблюдении соответствующих условий хранения возможен до трех месяцев, после вскрытия емкостей для подготовки их к испытаниям срок хранения не должен превышать двух недель.
Нефильтрованную ВТФ испытывают на ракообразных и рыбах, фильтрованную - на водорослях.
4.9. Перед биотестированием буровых растворов их тщательно перемешивают в смесителе со скоростью вращения 1000 об/мин. Проба не пригодна для биотестирования, если рН пробы бурового раствора ниже 9, если на стенках сосуда с пробой появились черные пятна или если образец бурового раствора имеет неприятный запах. Затем пробу бурового раствора смешивают с отфильтрованной морской водой (или искусственной морской водой) в соотношении 1:9. Перемешивают при помощи магнитной мешалки в течение 5 мин. Полученную суспензию отстаивают в течение 1 ч до образования твердой фазы на дне сосуда. Раствор с ВТФ переливают в один прием в другую посуду для проведения испытаний, вторично перемешивают в течение 5 мин. В некоторых случаях отстоявшийся образец не имеет четкого фазового раздела, в таком случае весь объем пробы (ВТФ) используют для биотестирования. Последующее консервирование или хранение подготовленных образцов не допускается.
Слитый для биотестирования раствор суспензии бурового раствора принимают за 100-процентную концентрацию ВТФ, которую используют при разбавлении ее морской природной или искусственной водой для приготовления соответствующих концентраций суспензии.
4.10. Для биотестирования химического вещества (далее - вещества) или смеси химических веществ (далее - смеси веществ) готовят исходный раствор, используя воду по ГОСТ 6709. Далее из исходного раствора готовят серию растворов с разными концентрациями вещества (смеси веществ), используя питьевую воду по ГОСТ 2874 (питьевую воду предварительно дехлорируют путем отстаивания).
4.11. Для определения среднего летального (эффективного) разбавления пробы воды (водной вытяжки), бурового раствора - ЛР50 (ЭР50) или средней летальной (эффективной) концентрации вещества (смеси веществ) - ЛК50 (ЭК50) готовят серию (не менее пяти) разбавлений пробы воды, бурового раствора или серию (не менее пяти) растворов с разными концентрациями исследуемого вещества (смеси веществ).
5. УСЛОВИЯ БЕЗОПАСНОГО ПРОВЕДЕНИЯ РАБОТ
При работе с химическими веществами и сточными водами необходимо соблюдать требования безопасности по ГОСТ 12.4.021.
Организация обучения работающих безопасности труда по ГОСТ 12.0.004.
Безопасность при работе с электроустановками обеспечивается по ГОСТ 12.1.019 и в соответствии с требованиями инструкций к оборудованию.
Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
6. ТРЕБОВАНИЯ К КВАЛИФИКАЦИИ ЛИЦ, ПРОВОДЯЩИХ БИОТЕСТИРОВАНИЕ
К выполнению биотестирования и обработке результатов биотестирования допускаются лица, освоившие методические приемы водной токсикологии, с квалификацией "техник", "лаборант".
7. МЕТОДИКА БИОТЕСТИРОВАНИЯ ПО СНИЖЕНИЮ УРОВНЯ БИОЛЮМИНЕСЦЕНЦИИ БАКТЕРИЙ PHOTOBACTERIUM PHOSPHOREUM (COHN) FORD
7.1. Назначение и область применения
7.1.1. Настоящая «Методика...» устанавливает процедуру определения токсичности сточных, поверхностных, подземных и морских вод, донных отложений (водных вытяжек), водных растворов отдельных веществ и их смесей.
7.2. Принцип методики
7.2.1. Методика основана на установлении различия между уровнем люминесценции бактерий, помещенных в анализируемую пробу (опыт), и уровнем люминесценции бактерий, помещенных в 3%-ный раствор натрия хлористого для биотестирования пресных вод или в морскую воду без токсических веществ (природную или искусственную) для биотестирования морских вод (контроль).
7.2.2. Критерием токсичности является снижение уровня люминесценции бактерий на 50% и более в опыте по сравнению с контролем в течение 30 мин.
7.2.3. Люминесценцию бактерий измеряют при помощи специального прибора - биолюминометра и выражают в условных единицах.
7.3. Характеристики погрешности измерений
Границы, в которых находится относительная погрешность определения токсичности по данной методике с заданной доверительной вероятностью Р=0,95, составляют ± 40%.
Наибольшее возможное значение среднего квадратического отклонения случайной составляющей относительной погрешности определения токсичности по данной методике σ (δ) составляет 20%.
Характеристики погрешности установлены по результатам внутрилабораторного эксперимента с использованием эталонного вещества - калия двухромовокислого (К2Сr2О7).
Алгоритм установления характеристик погрешности методики приведен в приложении Б.
7.4. Средства измерений, вспомогательные устройства, материалы, реактивы
Применяют следующие средства измерений, вспомогательные устройства, материалы и реактивы:
- биолюминометр типа 8703 М по ТУ 2-858-003 или другого с набором кювет;
- холодильник, обеспечивающий температуру от минус 15 до плюс 6 °С;
- дозаторы пипеточные вместимостью 20-1000 мм3 по ТУ 64-1-3329;
- термометр по ГОСТ 112 с ценой деления шкалы 1°С;
- колбы мерные вместимостью 0,5 и 1,0 дм3 по ГОСТ 1770, 2-го класса точности;
- цилиндры мерные вместимостью 10 см3 по ГОСТ 1770, 2-го класса точности;
- бумагу фильтровальную по ГОСТ 12026;
- воду дистиллированную по ГОСТ 6709;
- калий двухромовокислый по ГОСТ 4220;
- калий хлористый по ГОСТ 4234;
- кальций хлористый по ТУ 6-09-4711;
- кислоту борную по ГОСТ 9656;
- магний хлористый 6-водный по ГОСТ 4209;
- натрий углекислый по ГОСТ 4201;
- натрий сернокислый по ГОСТ 4166;
- натрий хлористый по ГОСТ 4233.
7.5. Условия выполнения биотестирования
7.5.1. Биотестирование проводят в помещении без вредных испарений и газов при температуре 20±4°С.
7.5.2. Объем пробы воды (водной вытяжки) для определения токсичности должен быть не менее 100 см3.
7.5.3. Для обеспечения оптимальных условий свечения бактерий в анализируемую пробу воды (водную вытяжку из донных отложений, в т.ч. морских) вносят навеску натрия хлористого в таком количестве, чтобы его концентрация в растворе составила 3 %.
7.5.4. Для контроля и приготовления разбавлений проб воды (водной вытяжки) используют 3 %-ный раствор натрия хлористого в дистиллированной воде.
7.5.5. При биотестировании проб морской воды навеску натрия хлористого не вносят, а для контроля и разбавлений проб используют природную морскую воду без токсических веществ, либо искусственную морскую воду. Искусственную морскую воду готовят на дистиллированной воде, в которую вносят реактивы, представленные в таблице 7.1. Искусственную морскую воду можно также приготовить из профессиональной морской соли Wiegandt (производство Германия).
Таблица 7.1
Состав (согласно ИСО 10253) искусственной морской воды, соленость 34%о, рН 8,0
Реактив |
Концентрация, г/дм3 |
Реактив |
Концентрация, г/дм3 |
|
NaCl |
22,000 |
КСl |
0,650 |
|
MgCl2*6H2O |
9,700 |
NaHCО3 |
0,200 |
|
Na2SO4 (безводный) |
3,700 |
Н3ВО3 |
0,023 |
|
СаСl2 (безводный) |
1,000 |
|
|
7.5.6. Для приготовления исходного раствора вещества (смеси веществ) и его разбавлений используют 3 %-ный раствор натрия хлористого.
7.5.7. Для приготовления растворов смеси веществ, отдельно для каждого вещества готовят исходные растворы, определенные объемы которых добавляют в 3 %-ный раствор натрия хлористого.
7.5.8. Результаты биотестирования учитывают, если ЭК50 калия двухромовокислого (К2Сr2О7) для культуры бактерий находилась в интервале его концентраций 0,5-1,2 мг/дм3.
7.6. Подготовка к выполнению биотестирования
7.6.1. Для биотестирования используют лиофилизированную культуру светящихся бактерий - Photobacterium phosphoreum (Cohn) Ford, которая поставляется в комплекте с биолюминометром. При хранении в морозильной камере холодильника в запаянных ампулах при температуре минус 15°С культура пригодна для биотестирования в течение года.
7.6.2. Каждую новую партию культуры, а также непосредственно перед биотестированием культуру проверяют на пригодность к биотестированию путем определения средней эффективной концентрации (ЭК50) раствора эталонного вещества калия двухромовокислого (К2Сr2О7). Для этого готовят исходный раствор с концентрацией 1,0 г К2Сr2О7 на 1 дм3 3%-ного раствора натрия хлористого в дистиллированной воде. Далее, разбавляя исходный раствор 3 %-ным раствором натрия хлористого, готовят серию растворов с концентрациями К2Сr2О7 от 0,1 до 2,0 мг/дм3. Биотестирование этих растворов проводят в течение 30 мин в соответствии с процедурой, приведенной в п. 7.7. На основании полученных результатов рассчитывают ЭК50 К2Сr2О7 в соответствии с приложением В.
Если ЭК50 находится в экспериментально установленном диапазоне реагирования тест-объекта, который равен 0,5-1,2 мг/дм3 К2Сr2О7, культура бактерий пригодна для биотестирования.
Если ЭК50 не находится в указанном диапазоне реагирования, необходимо использовать другую партию культуры, проверив ее пригодность для биотестирвания описанным выше способом.
7.6.3. До начала биотестирования флакон с охлажденной лиофилизированной культурой бактерий выдерживают в течение 30-40 мин при температуре (20±4)°С.
7.6.4. Во флакон с культурой, объем которого составляет 10 см3, наливают 2 см3 1,5%-ного раствора натрия хлористого и содержимое флакона тщательно перемешивают. Этого объема полученной суспензии бактерий достаточно для 100 измерений.
7.6.5. Суспензию бактерий выдерживают при температуре (20±4)°С в течение 45 мин с целью ее реактивации и стабилизации люминесценции бактерий.
7.6.6. Для сохранения активности суспензию бактерий помещают в ледяную баню.
7.7. Выполнение биотестирования
При биотестировании выполняют следующие операции:
- в три контрольные кюветы наливают по 1 см3 3%-ного раствора натрия хлористого (морской воды природной или синтетической);
- в три другие кюветы (опыт) наливают по 1 см3 анализируемой пробы воды (водной вытяжки) или раствора вещества (смеси веществ);
- в каждую кювету прибавляют по 20 мм3 суспензии бактерий;
- содержимое кювет тщательно перемешивают;
- кюветы помещают в биолюминометр и через 30 мин измеряют уровень люминесценции суспензии бактерий в условных единицах.
7.8. Обработка и оценка результатов
7.8.1. На основании результатов трех параллельных
определений люминесценции бактерий в контроле и опыте находят среднее
арифметическое уровней люминесценции бактерий в контроле (![]() ) и в опыте (
) и в опыте (![]() ).
).
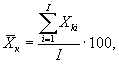 (7.1)
(7.1)
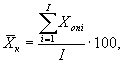 (7.2)
(7.2)
где ![]() ,
, ![]() - результат i-го измерения уровня
люминесценции бактерий в контроле и опыте соответственно;
- результат i-го измерения уровня
люминесценции бактерий в контроле и опыте соответственно;
i - номер измерения уровня люминесценции бактерий в контроле (опыте); i = 1,..., l;
I - количество параллельных измерений уровня люминесценции бактерий в контроле (опыте); I = 3.
Снижение уровня люминесценции бактерий в опыте по сравнению с контролем (Р) рассчитывают в процентах по формуле
![]() (7.3)
(7.3)
7.8.2. Вывод о наличии или отсутствии токсичности анализируемой пробы воды (водной вытяжки) или раствора вещества (смеси веществ) делают на основании величины Р. Проба воды (водной вытяжки) или раствора вещества (смеси веществ) считается токсичной, если величина Р составляет 50% и более. В этом случае для количественной оценки токсичности пробы воды (водной вытяжки) устанавливают ее среднее эффективное разбавление - ЭР50.
7.8.3. Для количественной оценки токсичности вещества
(смеси веществ) устанавливают среднюю эффективную концентрацию - ЭК50
(приложение
В).![]()
7.9. Контроль воспроизводимости результатов определения токсичности
Контроль воспроизводимости результатов определения токсичности проводят в объеме 5% от количества текущих измерений.
Контроль воспроизводимости проводят по результатам двух определений токсичности анализируемых проб воды (водной вытяжки), растворов вещества (смеси веществ), полученных в условиях воспроизводимости (ЭP1 и ЭР2 или ЭK1 и ЭК2).
Решение об удовлетворительности воспроизводимости определений принимается при условии:
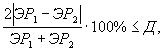
где Д - норматив оперативного контроля воспроизводимости составляет 56%.
8. МЕТОДИКА БИОТЕСТИРОВАНИЯ ПО СНИЖЕНИЮ ПРИРОСТА КОЛИЧЕСТВА ИНФУЗОРИЙ TETRAHYMENA PYRIFORMIS (EHRENBERG) SCHEWIAKOFF
8.1. Назначение и область применения
Настоящая «Методика...» устанавливает процедуру определения токсичности сточных, поверхностных и подземных вод, донных отложений (водных вытяжек), водных растворов отдельных веществ и их смесей.
8.2. Принцип методики
8.2.1. Методика определения токсичности основана на установлении различия между количеством инфузорий в анализируемой пробе (опыт) и количеством инфузорий в 0,1 % растворе натрия хлористого (контроль).
8.2.2. Критерием токсичности является достоверное снижение коэффициента прироста инфузорий в опыте по сравнению с контролем за 24 ч (условно «острая токсичность») и 96 ч (условно «хроническая токсичность») биотестирования.
8.3. Характеристики погрешности измерений
Границы, в которых находится относительная погрешность определения токсичности по данной методике с заданной доверительной вероятностью Р=0,95, составляют ±60%.
Наибольшее возможное значение среднего квадратического отклонения случайной составляющей относительной погрешности определения токсичности по данной методике σ (δ) составляет 30%.
Характеристики погрешности установлены по результатам внутрилабораторного эксперимента с использованием эталонного вещества - калия двухромовокислого (К2Сr2О7).
Алгоритм установления характеристик погрешности методики приведен в приложении Б.
8.4. Средства измерений, вспомогательные устройства, материалы, реактивы
Применяют следующие средства измерений, вспомогательные устройства, материалы и реактивы:
- весы лабораторные по ГОСТ 24104, 2-го класса точности с наибольшей предельной нагрузкой 200 г;
- микроскоп, который обеспечивает увеличение в 100 раз;
- стерилизатор воздушный медицинский по ГОСТ 22649;
- термометр по ГОСТ 112 с ценой деления шкалы 1°С;
- термостат, обеспечивающий температуру (27±1)°С;
- центрифугу, обеспечивающую 3000 об/мин;
- шкаф сушильный, обеспечивающий температуру (160±5)°С в течение 2 ч;
- камеру Горяева или другую счетную камеру для подсчета инфузорий;
- колбы плоскодонные вместимостью 50 см3 по ГОСТ 25336;
- колбы мерные вместимостью 0,5 и 1,0 дм3 по ГОСТ 1770, 2-го класса точности;
- пробирки вместимостью 10-15 см3;
- пипетки мерные вместимостью 0,1; 1,0 и 5,0 см3 по ГОСТ 29227, 2-го класса точности;
- посуду для транспортирования и хранения проб воды вместимостью 100 см3;
- пипетки капиллярные вместимостью 0,1 см3 с делениями 0,01 см3 по ГОСТ 29227;
- цилиндры мерные вместимостью 0,1, 0,5 и 1,0 дм3 по ГОСТ 1770, 2-го класса точности;
- штативы для пробирок;
- бумагу фильтровальную по ГОСТ 12026;
- вату для изготовления ватно-марлевых пробок;
- марлю для изготовления ватно-марлевых пробок;
- воду дистиллированную по ГОСТ 6709;
- воду питьевую по ГОСТ 2874;
- глюкозу по ГОСТ 6038;
- йод по ГОСТ 4159, 5% спиртовой раствор;
- калий двухромовокислый по ГОСТ 4220;
- натрий хлористый по ГОСТ 4233;
- пептон бактериальный по ГОСТ 13805;
- дрожжи хлебопекарные по ГОСТ 171.
8.5. Условия выполнения биотестирования
8.5.1. Биотестирование проводят в помещении без вредных испарений и газов при температуре воздуха (27±1)°С.
8.5.2. Объем пробы воды (водной вытяжки) для определения токсичности должен быть не менее 100 см3.
8.5.3. Для контроля и приготовления разбавлений проб воды (водной вытяжки) используют 0,1% раствор натрия хлористого в дистиллированной воде.
8.5.4. Результаты биотестирования учитывают, если ЭК50 за 24 ч калия двухромовокислого (К2Сr2О7) для культуры инфузорий находилась в диапазоне его концентраций 0,1 - 0,5 мг/дм3.
8.6. Подготовка к выполнению биотестирования
8.6.1. Для биотестирования используют лабораторную культуру инфузорий Tetrahymena pyriformis (Ehrenberg) Schewiakoff.
Культивируют инфузорий в стерильных условиях в пробирках в термостате.
Тщательно вымытые и высушенные пробирки предварительно стерилизуют сухим жаром в сушильном шкафу при температуре (160±5)°С в течение 2 ч с момента достижения указанной температуры. Перед стерилизацией пробирки закрывают ватно-марлевыми пробками и заворачивают в бумагу. Пипетки для посева инфузорий стерилизуют так же, предварительно завернув в бумагу.
Инфузорий культивируют на питательной среде следующего состава (табл. 8.1).
Таблица 8.1
Состав питательной среды для культивирования инфузорий
|
Вещество |
Концентрация, г/дм3 дистиллированной воды |
Вещество |
Концентрация, г/дм3 дистиллированной воды |
|
Глюкоза |
5,0 |
Натрий хлористый |
1,0 |
|
Пептон бактериальный |
20,0 |
Дрожжевой экстракт |
1,0 см3/дм3 |
Питательную среду готовят следующим образом. Пептон растворяют в 200 см3 дистиллированной воды и фильтруют через фильтровальную бумагу или вату. Глюкозу и натрий хлористый растворяют отдельно в 50 см3 и фильтруют через фильтровальную бумагу. Для приготовления дрожжевого экстракта в 1 дм3 кипящей дистиллированной воды вносят 25 г дрожжей и кипятят 5 мин. Раствор центрифугируют 30 мин при 3000 об/мин и надосадочную жидкость фильтруют через фильтр («синяя лента»).
Полученные растворы пептона и глюкозы смешивают и добавляют дрожжевой экстракт. Общий объем среды доводят дистиллированной водой до 1,0 дм3. После перемешивания измеряют рН среды и доводят ее до рН 7,1 добавлением 2 н натрия гидроокиси (NaOH). Среду разливают в пробирки по 5 см3, закрывают ватно-марлевыми пробками и стерилизуют при 1 атм 30 мин.
Культуру инфузорий вносят в стерильные пробирки с питательной средой в количестве 0,04 см3 и помещают в термостат при температуре (27+1) °С. Каждые 7-10 дней культуру инфузорий пересевают на свежую питательную среду.
Для длительного хранения культуры инфузорий ее выращивают на питательной среде следующего состава: глюкоза - 5 г, вода питьевая - 100 см3, рН среды 7,1. Среду разливают по 20 см3 в колбы вместимостью 50 см3 и стерилизуют, как указано выше. В остывшую среду вносят по 0,5 см3 трехсуточной культуры тетрахимены. Колбы помещают в затемненное место при температуре (20±2)°С. При этих условиях культура инфузорий сохраняется в течение двух месяцев, после чего ее необходимо пересеять на свежую питательную среду.
8.6.2 Для биотестирования используют 3-суточную культуру инфузорий, выращенную на питательной среде, состав которой указан в таблице 8.1. Плотность суспензии клеток в культуре должна составлять (6-8·104) кл/см3.
8.6.3 Периодически в процессе культивирования (не реже одного раза в месяц), определяют пригодность культуры инфузорий для биотестирования. Для этого устанавливают среднюю эффективную концентрацию (ЭК50) раствора эталонного вещества К2Сr2О7 за 24 ч биотестирования. Готовят исходный раствор с концентрацией 1,0 г К2Сr2О7 в 1 дм3 0,1 %-ого раствора натрия хлористого. Далее, разбавляя исходный раствор 0,1%-ным раствором натрия хлористого, готовят серию растворов с концентрациями К2Сr2О7 от 0,1 до 1,0 мг/дм3. Биотестирование этих растворов проводят в течение 24 ч в соответствии с процедурой, приведенной в 8.7. На основании полученных результатов определяют ЭК50 за 24ч К2Сr2О7 в соответствии с приложением В.
Если ЭК50 за 24 ч находится в экспериментально установленном диапазоне реагирования тест-объекта, который составляет 0,1-0,5 мг/дм3 К2Сr2О7, культура инфузорий пригодна для биотестирования. Если ЭК50 за 24 ч не находится в указанном диапазоне реагирования, необходимо проверить условия культивирования тест-объекта, чистоту культуры и, при необходимости, заменить ее на новую.
8.7. Выполнение биотестирования
При биотестировании выполняют следующие операции.
8.7.1. В три пробирки вместимостью 10-15 см3 наливают по 5 см3 пробы воды (водной вытяжки) или раствора вещества (смеси веществ) - опыт. Другие три пробирки заполняют таким же объемом 0,1% раствора натрия хлористого - контроль.
8.7.2. В каждую из опытных и контрольных пробирок капиллярной пипеткой добавляют 0,04 см3 (2 капли) 3-х суточной культуры инфузорий и определяют исходное количество клеток в контроле и опыте.
Подсчет инфузорий проводят под микроскопом в камере Горяева. Можно использовать гемоцитометр или любой другой прибор для подсчета частиц. Подсчет инфузорий в камере Горяева выполняют в следующей последовательности. Содержимое пробирки тщательно перемешивают, продувая воздух через пипетку. Этой же пипеткой отбирают суспензию инфузорий из пробирки, наносят по одной капле на сетки в счетной камере и фиксируют клетки 5%-м спиртовым раствором йода. Для этого конец стеклянной палочки смачивают раствором йода и затем касаются им капель суспензии на сетках камеры. Затем камеру накрывают покровным стеклом, которое притирают по бокам до появления колец интерференции. Через 1-2 мин начинают подсчет инфузорий в пяти больших (или восьмидесяти малых квадратах), расположенных по диагонали сетки счетной камеры. Из каждой контрольной и опытной пробирки подсчитывают не менее трех капель.
8.7.3. После определения исходного количества инфузорий пробирки помещают в термостат при температуре (27±1)°С.
8.7.4. Биотестирование может длиться 24 или 96 ч. В конце биотестирования подсчитывают количество инфузорий в контроле и опыте, как это описано в 8.7.2.
8.8. Обработка и оценка результатов
8.8.1. На основании результатов подсчета клеток в каждой капле определяют количество инфузорий (кл/см3) в контроле и опыте по формуле
![]() (8.1)
(8.1)
где mk(on)ij - количество подсчитанных инфузорий в камере в контроле (опыте) для i-той капли и j-гo параллельного определения;
i - номер капли суспензии;
j - номер параллельного определения;
V - объем части камеры, имеющей площадь маленького квадрата;
n - количество подсчитанных квадратов.
Для каждого параллельного определения в опыте и контроле вычисляют среднее арифметическое количества инфузорий в 1 см3 по формуле
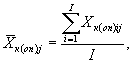 (8.2)
(8.2)
где I - количество капель суспензии.
8.8.2. Для определения токсичности пробы воды (водной вытяжки) или раствора вещества (смеси веществ) рассчитывают для каждого параллельного определения коэффициент прироста инфузорий в контроле и опыте по формуле
![]() (8.3)
(8.3)
где ![]() - количество
инфузорий в j-ом параллельном
определении в контроле (опыте) через промежуток времени t, кл/см3;
- количество
инфузорий в j-ом параллельном
определении в контроле (опыте) через промежуток времени t, кл/см3;
![]() - исходное
количество инфузорий в j-ом параллельном определении в контроле (опыте),
кл/см3.
- исходное
количество инфузорий в j-ом параллельном определении в контроле (опыте),
кл/см3.
8.8.3 Вывод о наличии или отсутствии токсичности пробы воды (водной вытяжки) или раствора вещества (смеси веществ) делают на основании установления достоверности снижения коэффициента прироста инфузорий в опыте по сравнению с контролем.
Для этого рассчитывают среднее арифметическое коэффициентов прироста инфузорий в опыте и контроле, среднее квадратическое отклонение коэффициентов прироста, ошибку среднего арифметического, критерий достоверности.
Среднее арифметическое коэффициентов прироста инфузорий определяют по формуле
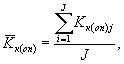 (8.4)
(8.4)
где J - количество параллельных определений, J = 3.
Среднее квадратическое отклонение коэффициентов прироста инфузорий в контроле (опыте) определяют по формуле
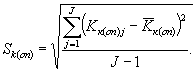 (8.5)
(8.5)
Ошибку среднего арифметического коэффициентов прироста инфузорий в контроле (опыте) определяют по формуле
![]() (8.6)
(8.6)
Критерий достоверности (td) различия между коэффициентами прироста инфузорий в опыте и контроле определяют по формуле
 (8.7)
(8.7)
Рассчитанную величину t сравнивают со значением критерия Стьюдента (tst) для уровня значимости 5% и степени свободы f = 2(J - 1) = 4, (tf=4 = 2,78). Если рассчитанная величина t больше значения критерия Стьюдента или равна ему, то различие между коэффициентами прироста в опыте и контроле достоверно. В этом случае считают, что анализируемая проба воды (водная вытяжка) или раствор вещества (смеси веществ) токсична (токсичен).
8.8.4. Для количественной оценки токсичности пробы воды (водной вытяжки) устанавливают ее эффективное разбавление (ЭР), т.е. максимальное разбавление, при котором наблюдается достоверное различие между коэффициентами прироста инфузорий в контроле и опыте за 24 или 96 ч биотестирования (ЭР за 24 ч или ЭР за 96 ч).
8.8.5. Для количественной оценки токсичности вещества (смеси веществ) устанавливают эффективную концентрацию (ЭК) вещества (смеси веществ), т.е. минимальную концентрацию, при которой наблюдается достоверное различие коэффициентов прироста количества инфузорий в контроле и опыте за 24 или 96 ч биотестирования (ЭК за 24 ч или ЭК за 96 ч).
8.9. Контроль воспроизводимости результатов определения токсичности
Контроль воспроизводимости результатов определения токсичности проводят в объеме 5% от количества текущих измерений.
Контроль воспроизводимости проводят по результатам двух определений токсичности пробы воды (водной вытяжки), вещества (смеси веществ), полученных в условиях воспроизводимости (ЭР1, ЭР2 или ЭК1, ЭК2).
Решение об удовлетворительности воспроизводимости определений принимается при условии:
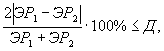
где Д - норматив оперативного контроля воспроизводимости составляет 83%.
9. МЕТОДИКА БИОТЕСТИРОВАНИЯ ПО УГНЕТЕНИЮ РОСТА ОДНОКЛЕТОЧНЫХ ПРЕСНОВОДНЫХ ВОДОРОСЛЕЙ SCENEDESMUS QUADRICAUDA (TURP) BREB
9.1. Назначение и область применения
Настоящая «Методика...» устанавливает процедуру определения острой и хронической токсичности сточных, поверхностных и подземных вод, донных отложений (водных вытяжек), буровых растворов, водных растворов отдельных веществ и их смесей.
9.2. Принцип методики
9.2.1. Методика основана на установлении различия между интенсивностью роста водорослей в анализируемой пробе (опыт) и культуральной среде (контроль).
9.2.2. Критерием токсического действия является снижение на 50% и более численности клеток водорослей в опыте по сравнению с контролем за 72 ч биотестирования (условно "острая токсичность") и 7 суток (условно "хроническая токсичность").
9.3. Характеристики погрешности измерений
Границы, в которых находится относительная погрешность определения токсичности по данной методике с заданной доверительной вероятностью Р=0,95, составляют ±34%.
Наибольшее возможное значение среднего квадратического отклонения случайной составляющей относительной погрешности определения токсичности по данной методике σ (δ) составляет 17%.
Характеристики погрешности установлены по результатам внутрилабораторного эксперимента с использованием эталонного вещества - калия двухромовокислого (К2Сr2О7).
Алгоритм установления характеристик погрешности методики приведен в приложении Б.
9.4. Средства измерений, вспомогательные устройства, материалы, реактивы
Применяют следующие средства измерений, вспомогательные устройства, материалы и реактивы:
- люминостат с освещением рабочей зоны 2000-3000 лк от ламп дневного света;
- термометр лабораторный по ГОСТ 215, цена деления шкалы 0,1°С;
- микроскоп с кратностью увеличения не менее 400 раз;
- колориметр фотоэлектрический (ФЭК-56 либо КФК-3) или спектрофотометр, или прибор для измерения быстрой или замедленной флуоресценции;
- покровные стекла по ГОСТ 6672;
- предметные стекла по ГОСТ 9284;
- камеру счетную Горяева по ТУ 42-816 или Нажотта по ТУ 64-1-816;
- посуду стеклянную для отбора и хранения проб воды вместимостью 1 дм3;
- колбы плоскодонные конические вместимостью 250 см3 по ГОСТ 25336;
- колбы мерные вместимостью 0,5 и 1,0 дм3 по ГОСТ 1770, 2-го класса точности;
- пипетки мерные вместимостью от 1 до 10 см3 по ГОСТ 29227, 2-го класса точности;
- дозаторы пипеточные вместимостью 0,1 и 0,5 см3 по ТУ 64-1-3326;
- цилиндры мерные вместимостью 0,1; 0,5 и 1,0 дм3 по ГОСТ 1770, 2-го класса точности;
- вату для изготовления ватно-марлевых пробок;
- марлю для изготовления ватно-марлевых пробок;
- бумагу фильтровальную по ГОСТ 12026;
- фильтры мембранные № 4;
- фильтровальный аппарат;
- воду дистиллированную по ГОСТ 6709;
- воду питьевую по ГОСТ 2874;
- рН-метр;
- прибор для измерения концентрации кислорода в воде;
- холодильник, который обеспечивает температуру от 2 до 8 °С;
- шкаф сушильный для стерилизации посуды;
- плитку электрическую по ГОСТ 14919;
- баню водяную;
- спиртовку;
- весы лабораторные общего назначения по ГОСТ 24104, 2-го класса точности с наибольшей массой взвешивания 200 г;
- железо хлорное по ГОСТ 4147;
- калий азотнокислый по ГОСТ 4217;
- калий двухромовокислый по ГОСТ 4220;
- калий фосфорнокислый двузамещенный по ГОСТ 2493;
- магний сернокислый по ГОСТ 4523.
9.5. Условия выполнения биотестирования
9.5.1. Биотестирование проводят в помещении без вредных испарений и газов, при температуре воздуха (20±2)°С, при освещении лампами дневного света с интенсивностью 2000-3000 лк, при естественной смене дня и ночи.
9.5.2. Объем пробы воды (водной вытяжки), бурового раствора, раствора вещества (смеси веществ) для определения токсичности должен быть не менее 1 дм3.
9.5.3. Численность клеток водорослей в исходной культуре, подготовленной для биотестирования, должна быть не менее 5 млн. кл/см3. Культура должна находиться в экспоненциальной фазе роста.
9.5.4. Начальная численность клеток водорослей в опыте и контроле перед началом биотестирования - не менее 30 тыс. кл/см3.
9.5.5. Рабочий объем пробы в контрольных и в опытных колбах составляет 50-100 см3.
9.5.6. Результаты учитывают, если численность водорослей в контроле увеличилась за 96 ч биотестирования не менее, чем в 3 раза; ЭК50 за 48 ч калия двухромовокислого (К2Сr2О7) для культуры водорослей находилась в диапазоне его концентраций 1,3-2,5 мг/дм3
9.6. Подготовка к выполнению биотестирования
9.6.1. Для биотестирования используют лабораторную культуру одноклеточных зеленых протококковых водорослей Scenedesmus quadricauda (Тurp) Breb.
9.6.2. Лабораторную культуру водорослей выращивают на среде Прата в конических плоскодонных колбах объемов 250-300 см3 в люминостате с интенсивностью освещения не менее 2000-3000 лк при температуре (20±2)°С.
При культивировании и биотестировании водорослей используют химически чистую стеклянную посуду. Для этого посуду промывают смесью бихромата калия и серной кислоты (хромовой смесью), затем тщательно водопроводной водой и 3-4 раза дистиллированной водой. Посуду, используемую для культивирования и биотестирования, за исключением мерной, стерилизуют в сушильном шкафу при 160°С в течение 1,5 ч. Не разрешается пользоваться для мытья посуды синтетическими поверхностно-активными веществами и органическими растворителями. Можно пользоваться питьевой содой.
Для приготовления питательной среды Прата (табл. 9.1) сначала готовят исходные растворы солей на дистиллированной воде: калия азотнокислого - 100,0 г/дм3; магния сернокислого - 10,0 г/дм3; калия фосфорнокислого двузамещенного - 10,0 г/дм3. Навеску железа хлорного 0,5 г растворяют в 0,5 дм3 дистиллированной воды. Полученные исходные растворы солей хранят в холодильнике. В случае помутнения растворов их заменяют на свежие.
Чтобы получить питательную среду Прата для культивирования водорослей, соответствующие объемы исходных растворов (кроме железа хлорного) добавляют по 1 мл в 1 дм3 дистиллированной воды в последовательности их расположения в таблице 9.1. Стерилизуют полученный раствор кипячением на водяной бане 15 мин, охлаждают и добавляют туда 1 мл хлорное железо из исходного раствора.
Таблица 9.1
Состав питательной среды Прата
|
Реактив |
Концентрация, г/дм3 |
|
Калий азотнокислый (KNO3) |
0,1 |
|
Магний сернокислый (Mg2SO4•7H2О) |
0,01 |
|
Калий фосфорнокислый двузамещенный (К2НРО4•3Н2О) |
0,01 |
|
Железо хлорное (FeCl3•6Н2О) |
0,001 |
9.6.3. При культивировании периодически обновляют культуру водорослей, пересевая ее на свежую питательную среду не реже одного раза в 10 дней. Для этого в стерильную колбу объемом 250-300 см3 со свежей средой Прата объемом 150 см3 над пламенем спиртовки наливают 15-20 см3 верхнего слоя исходной культуры (содержимое исходной культуры при этом не перемешивают). Начальная плотность клеток в новой колбе составляет примерно 100-150 тыс. кл/см3, что дает светло-зеленую окраску. В случае ослабления интенсивного роста клеток в культуре, к питательной среде добавляют витамин В12.
После посева колбу закрывают стерильной ватно-марлевой пробкой и бумажным колпачком, перемешивают и помещают в люминостат. В процессе культивирования культуру водорослей периодически перемешивают, встряхивая 1 -2 раза в сутки.
9.6.4. При биотестировании используют 3-х суточную культуру водорослей, находящуюся в экспоненциальной фазе роста.
Для этого в стерильную колбу со средой Прата объемом 150 см3 приливают из исходной культуры водорослей верхний слой клеток (около 15-20 см3) и колбу ставят в люминостат для подращивания культуры водорослей.
Через 3-е суток подсчитывают численность клеток (которая должна составлять примерно 5 млн.кл/см3).
Далее расчетным путем устанавливают, какое количество культуры водорослей необходимо взять, чтобы получить в опытном и контрольном объеме среды Прата необходимую плотность клеток по 30 тыс. кл/см3 (как правило это 0,5-1 см3 культуры водорослей).
Для подсчета количества клеток водорослей используют счетную камеру Горяева (или другую). Подсчет проводят в соответствии с процедурой, описанной в 9.7.2.
Количество клеток водорослей в 1 см3 в опыте и в контроле определяют (п. 9.8.1.) по формуле (9.1).
9.6.5. Периодически (не реже одного раза в месяц) культуру водорослей проверяют на пригодность для биотестирования. Для этого устанавливают среднюю эффективную концентрацию (ЭК50 за 48 ч) раствора эталонного вещества калия двухромовокислого Готовят исходный раствор К2Сr2О7 с концентрацией 1 г/дм3, используя дистиллированную воду. Далее из исходного раствора готовят серию растворов с концентрациями К2Сr2О7 от 1,0 до 3,0 мг/дм3 с интервалом 0,5 мг/дм3, используя среду Прата (опыт). Для контроля берут среду Прата без токсиканта. Затем в опытные и контрольные колбы добавляют водоросли в экспоненциальной фазе роста плотностью 30 тыс.кл/см3. Биотестирование этих растворов проводят продолжительностью 48 ч в соответствии с процедурой, изложенной в 9.7.
На основании полученных результатов рассчитывают процент снижения численности клеток водорослей в протестированных растворах К2Сr2О7 по сравнению с контролем и определяют концентрацию К2Сr2О7, которая вызывает снижение численности водорослей на 50% (ЭК50 за 48 ч). Вычисление результатов проводят в соответствии с приложением В.
Если полученная величина ЭК50 за 48 ч находится в экспериментально установленном диапазоне реагирования тест-объекта, который равен 1,3-2,5 мг/дм3 К2Сr2О7, культура водорослей пригодна для биотестирования.
Если ЭК50 за 48 ч К2Сr2О7 не находится в указанном диапазоне реагирования, то проверяют условия культивирования тест-объекта, чтобы выяснить причины ухудшения состояния культуры. При необходимости культуру заменяют.
9.7. Выполнение биотестирования
При биотестировании выполняют следующие операции.
9.7.1. В конические колбы вместимостью 250 см3 разливают по 100 см3 среды Прата (контроль), в другие колбы - исследуемые пробы воды (водной вытяжки), бурового раствора (опыт). Заполнение опытных колб (в различных разбавлениях) проводят следующим образом: без разбавления - 100 см3 исследуемой пробы; 50 см3 исследуемой пробы и 50 см3 среды Прата (разбавление в 2 раза); 10 см3 пробы и 90 см3 среды (разбавление в 10 раз); 1 см3 пробы и 99 среды (разбавление в 100 раз); 0,1 см3 пробы и 99,9 среды (разбавление в 1000 раз).
Повторность в опыте и контроле трехкратная.
В опытные колбы без разбавления исследуемой пробы добавляют растворы исходных питательных солей Прата в количестве 0,1 см3 в порядке расположения их в таблице 9.1. Далее, в опытные колбы с разбавлением пробы в 2 раза - добавляют растворы исходные растворы питательных солей среды Прата по той же схеме, что и выше, но в количестве 0,05 см3. При разбавлении исследуемой пробы в 10 раз - добавляют по 0,01 см3, а при разбавлениях пробы в 100 и 1000 раз, исходные питательные соли не добавляют (их количеством можно пренебречь).
Затем в опытные и контрольные колбы вносят по 0,5 см3 исходной культуры водорослей S. quadricauda в экспоненциальной фазе роста численностью около 5 млн. кл/см3 (при этом численность клеток водорослей в опытных и контрольных колбах будет составлять около 30 тыс. кл/ см3).
При исследовании растворов различных концентраций вещества (смеси веществ) в конические колбы наливают по 100 см3 среды Прата (как в контрольные, так и в опытные). В опытные колбы добавляют различные объемы исходного раствора исследуемого вещества (смеси веществ) для создания нужной концентрации и вносят по 0,5 см3 исходной культуры водорослей S. quadricauda в экспоненциальной фазе роста численностью 5 млн. кл/см3. В контроль кроме водорослей ничего не вносят.
После этого колбы закрывают ватно-марлевыми пробками, встряхивают и помещают в люминостат. Экспонируют, соблюдая условия п. 9.5.1 Содержимое каждой колбы перемешивают один - два раза в сутки.
9.7.2. В начале биотестирования в каждой колбе определяют исходную численность клеток. Исходная численность клеток должна составлять не менее 30 тыс. кл/см3 в случае подсчета в счетной камере и не менее 50 тыс. кл/см3 - в случае подсчета оптическим методом.
Затем считают численность клеток ежедневно, тщательно перемешивая содержимое колб, в течение 3-х суток в остром опыте и 7-и суток - в хроническом.
Для подсчета численности клеток водорослей используют счетные камеры Горяева или Нажотта (п. 9.7.2).
Для этого пипеткой отбирают суспензию водорослей из колбы, наносят по одной капле на сетки в счетной камере Горяева. Затем камеру накрывают покровным стеклом, которое притирают по бокам до появления колец интерференции. Через 1-2 мин начинают подсчет водорослей в пяти больших (или восьмидесяти малых квадратах), расположенных по диагонали сетки счетной камеры, или в 25 больших квадратах всей камеры при малой плотности водорослей. Из каждой контрольной и опытной колбы просчитывают не менее трех капель.
9.7.3. Допустимо для определения численности клеток использовать фотоэлектроколориметр типа ФЭК-56, К.ФК-3 или спектрофотометр, или прибор для измерения флуоресценции водорослей (быстрой или замедленной) с дальнейшим определением численности клеток по калибровочной кривой.
Построение калибровочной кривой для определения численности клеток водорослей проводят следующим образом. Исходную культуру водорослей последовательно разбавляют питательной средой в 2, 4, 6... n раз. Численность клеток в каждой колбе подсчитывают в счетной камере не менее 3-х раз и вычисляют среднее значение. На фотоэлектроколориметре или спектрофотометре, или приборе для измерения флуоресценции водорослей определяют соответствующую этой численности клеток оптическую плотность или уровень флуоресценции. Как правило, для измерения оптической плотности или флуоресценции водорослей Ph. tricornutum используют кюветы 10 мм толщиной (или другие), длина волны измерения оптической плотности на КФК-3 составляет 360 нм.
По результатам измерений строят калибровочную кривую по формуле
E = f(N), (14.1)
где Е - оптическая плотность;
N - численность клеток в 1 см3 культуры.
Необходимо учесть, что калибровочная кривая соответствует определенному устройству, кювете, длине волны и культуре.
Периодически, один раз в месяц, необходимо проверять калибровочную кривую.
9.7.4. Через 72 ч или 7 суток биотестирование прекращают. В каждой колбе подсчитывают численность клеток водорослей.
9.8. Обработка и оценка результатов
9.8.1. На основании результатов подсчета клеток в каждой капле определяют численность клеток водорослей (кл/см3) в контроле и опыте по формуле
где mk(on)ij - количество подсчитанных клеток водорослей в камере в контроле (опыте) для i-той капли и j-го параллельного определения;
i - номер капли суспензии;
j - номер параллельного определения;
V - объем части камеры, имеющей площадь маленького квадрата;
n - количество подсчитанных квадратов.
Для каждого параллельного определения в опыте и контроле вычисляют среднее арифметическое численности клеток водорослей в 1 см3 по формуле
 (9.2)
(9.2)
где I - количество капель суспензии.
9.8.2. На основании результатов трех параллельных определений численности клеток водорослей в контроле и опыте находят средние арифметические численности клеток водорослей в контроле (опыте) по формуле
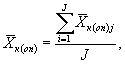 (9.3)
(9.3)
где J - количество параллельных определений численности клеток водорослей в контроле (опыте); J = 3.
Рассчитывают численность клеток водорослей в опыте в процентах от их численности в контроле по формуле
![]() (9.4)
(9.4)
где Р - численность клеток водорослей в опыте, %;
![]() - среднее
арифметическое численности клеток водорослей в опыте, кл/см3;
- среднее
арифметическое численности клеток водорослей в опыте, кл/см3;
![]() - среднее
арифметическое численности клеток водорослей в контроле, кл/см3.
- среднее
арифметическое численности клеток водорослей в контроле, кл/см3.
9.8.3. Вывод о наличии или отсутствии токсичности анализируемой пробы воды (водной вытяжки), бурового раствора или раствора вещества (смеси веществ) делают на основании величины Р. Проба воды (водная вытяжка), раствор вещества (смеси веществ) считается токсичной (токсичным), если величина Р составляет 50% и менее.
9.8.4. Для количественной оценки токсичности пробы воды (водной вытяжки), бурового раствора устанавливают ее среднее эффективное разбавление за 72 ч (96 ч) или 7 сут биотестирования (ЭР50 за 72 (96) ч или ЭР50 за 7 сут).
Для количественной оценки токсичности вещества (смеси веществ) устанавливают среднюю эффективную концентрацию вещества (смеси веществ) за 72 ч или 7 сут биотестирования (ЭК50 за 72 ч или ЭК50 за 7 сут).
9.8.5. Расчет ЭР50 за 72 (96) ч (ЭР50 за 7 сут) или ЭК50 за 72 (96) ч (ЭК50 за 7 сут) проводят в соответствии с приложением В.
9.9. Контроль воспроизводимости результатов определения токсичности
Контроль воспроизводимости результатов определения токсичности проводят в объеме 5% от количества текущих измерений.
Контроль воспроизводимости проводят по результатам двух определений токсичности пробы воды (водной вытяжки), буровых растворов, раствора вещества (смеси веществ) полученных в условиях воспроизводимости (ЭР1), ЭР2) или (ЭК1, ЭК2).
Решение об удовлетворительности воспроизводимости определений принимается при условии:
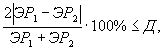
где Д - норматив оперативного контроля воспроизводимости составляет 45%.
10. МЕТОДИКА БИОТЕСТИРОВАНИЯ ПО ГИБЕЛИ РАКООБРАЗНЫХ DAPHNIA MAGNA STRAUS
10.1. Назначение и область применения
Настоящая «Методика...» устанавливает процедуру определения острой летальной токсичности сточных, поверхностных и подземных вод, донных отложений (водных вытяжек), буровых растворов, водных растворов отдельных веществ и их смесей.
10.2. Принцип методики
10.2.1. Методика основана на установлении различия между количеством погибших дафний в анализируемой пробе (опыт) и культивационной воде (контроль).
10.2.2. Критерием острой летальной токсичности является гибель 50% дафний и более в опыте по сравнению с контролем за 96 ч биотестирования.
10.3. Характеристики погрешности измерений
Границы, в которых находится относительная погрешность определения токсичности по данной методике с заданной доверительной вероятностью Р=0,95, составляют ±66%.
Наибольшее возможное значение среднего квадратического отклонения случайной составляющей относительной погрешности определения токсичности по данной методике σ (δ) составляет 34%.
Характеристики погрешности установлены по результатам внутрилабораторного эксперимента с использованием эталонного вещества - калия двухромовокислого (К2Сr2О7).
Алгоритм установления характеристик погрешности методики приведен в приложении Б.
10.4. Средства измерений, вспомогательные устройства, материалы, реактивы
Применяют следующие средства измерений, вспомогательные устройства, материалы и реактивы:
- микрокомпрессор аквариумный АЭН ТУ 16-064-011;
- аппарат для встряхивания ТУ 64-1-1081;
- мешалка лабораторная ТУ 25-05-2160;
- оксиметр любого типа, с погрешностью измерения не более 0,5 мг О2/дм3;
- лупа складная ГОСТ 7954, ТУ 3-3-227;
- груши резиновые разные (пипеточные луковицы) ТУ 38-106-003;
- газ мельничный № 25-43 (число отверстий, приходящихся на 1 см соответствует номеру) ГОСТ 4403;
- термолюминостат, поддерживающий температуру воды (20±2)°С, освещенность (500+100) лк;
- весы лабораторные по ГОСТ 24104, 2 класса точности, с наибольшей предельной нагрузкой 200 г;
- воронки разные лабораторные ГОСТ 25336;
- бюксы или стаканчики для взвешивания, диаметром 30, 40 мм ГОСТ 7148;
- центрифуга лабораторная медицинская ТУ 5-375-4261;
- термометр по ГОСТ 112 с ценой деления шкалы 1°С; холодильник, поддерживающий температуру (4±2)°С;
- шкаф сушильный электрический общелабораторного назначения, ГОСТ 13474;
- рН-метр ГОСТ 25.7416.0171 или аналоги;
- колбы мерные по ГОСТ 1770, вместимостью 0,5 и 1,0 дм3 по ГОСТ 1770, 2 класса точности;
- бумагу фильтровальную по ГОСТ 12026;
- вату и марлю для изготовления ватно-марлевых пробок;
- пипетки мерные вместимостью от 1 до 10 см3 по ГОСТ 29227, 2 класса точности;
- пипетки автоматические дозаторы любого типа объемом 0,1-0,2 см3;
- посуду стеклянную: вместимостью 2 дм3 для культивирования дафний; вместимостью от 100 до 150 см3 для биотестирования; вместимостью 1 дм3 для транспортирования и хранения проб воды;
- пробирки стеклянные, вместимостью 10 см3 ГОСТ 25336;
- трубки стеклянные внутренним диаметром 5-7 мм для отлова дафний;
- цилиндры мерные вместимостью 0,1; 0,5 и 1,0 дм3 по ГОСТ 1770, 2 класса точности;
- дрожжи хлебопекарные по ГОСТ 171;
- культура зеленых водорослей (для корма - родов Chlorella или Scenedesmus);
- железа хлорид по ГОСТ 4147;
- калий азотнокислый по ГОСТ 4217;
- калий двухромовокислый по ГОСТ 4220;
- калий фосфорнокислый двузамещенный по ГОСТ 2493;
- магний сернокислый по ГОСТ 4523.
10.5. Условия выполнения биотестирования
10.5.1. Биотестирование проводят в помещении, где не хранят и не работают с летучими веществами, не используют обработку помещения инсектицидами.
10.5.2. Объем пробы воды (водной вытяжки), бурового раствора, раствора вещества (смеси веществ) для определения острой летальной токсичности должен быть не менее 1 дм3.
10.5.3. Температура анализируемой пробы при биотестировании должна быть (20±2)°С, концентрация кислорода в пробе в начале биотестирования - не менее 6 мг/дм3. Если его концентрация ниже 6 мг/дм3, пробу аэрируют микрокомпрессором. Воздух должен подаваться равномерно до достижения концентрации кислорода 6 мг/дм3. Во время биотестирования пробу не аэрируют.
Битестирование проводят при рассеянном свете. Не допускается попадание прямых солнечных лучей на тест-объект. Длительность светового периода соответствует естественному. Рекомендуется использовать термолюминостат.
10.5.4. Плотность посадки односуточных дафний в опыте и контроле должна составлять 10 экземпляров на 100 см3. Повторность трехкратная.
10.5.5. Результаты учитывают, если в конце биотестирования концентрация кислорода в анализируемых пробах была не менее 2 мг/дм3, температура воды составляла (20±2)°С, количество погибших дафний в контроле не превышало 10%, ЛК50 за 24 ч эталонного вещества К2Сr2О7 для культуры дафний находилась в диапазоне его концентраций 0,9-2,5 мг/дм3.
10.6. Подготовка к выполнению биотестирования
10.6.1. В качестве тест-объекта используют лабораторную культуру дафний - Daphnia magna Straus (Cladocera, Crustacea).
Условия культивирования (и биотестирования) дафний соответствуют п. 10.5.
Культуру дафний выращивают в стеклянной посуде вместимостью до 2 дм3. Посуду моют питьевой содой и тщательно ополаскивают дистиллированной водой. Нельзя применять синтетические моющие средства и органические растворители.
Для культивирования дафний используют питьевую воду. Питьевую воду предварительно дехлорируют путем отстаивания и аэрируют микрокомпрессором до достижения концентрации растворенного кислорода не менее 6 мг/дм3.
Начальная плотность культуры дафний должна быть от 10 до 15 особей в 1 дм3. Один раз в неделю взрослых дафний в возрасте до 4 недель и молодь (для дальнейшего поддержания культуры) пересаживают отдельно в посуду со свежей водой.
Пересаживают дафний при помощи стеклянной трубки внутренним диаметром 5-7 мм так, чтобы их не травмировать. Для этого конец трубки помещают под поверхность воды и держат до тех пор, пока дафнии не перейдут в трубку. Аэрировать воду в посуде с дафниями не рекомендуется.
Дафний кормят один раз в сутки суспензией зеленых водорослей и один раз в неделю - суспензией хлебопекарных дрожжей.
Для приготовления дрожжевого корма 1 г свежих или 0,5 г воздушно-сухих дрожжей заливают 100 см3 дистиллированной воды. После набухания дрожжей суспензию тщательно перемешивают и отстаивают в течение 30 мин. Надосадочную жидкость добавляют в посуду с дафниями в количестве 5 см3 на 1 дм3 воды.
В качестве водорослевого корма для дафний рекомендуется использовать зеленые протококковые водоросли - сценедесмус или хлореллу. Их выращивают в соответствии с 9.6.2. Водоросли вносят в культуру дафний из расчета 1 см3 суспензии водорослей (плотность клеток составляет примерно 350 млн.кл/см3). Суспензию водорослей получают центрифугированием или отстаиванием в холодильнике в течение 2-3 суток. Надосадочную жидкость сливают, а осадок разбавляют в 2 раза дистиллированной водой и используют в качестве корма.
10.6.2. Для биотестирования используют дафний в возрасте до 24 ч, которых кормят за 2-3 ч до начала биотестирования. Чтобы получить необходимое количество тест-объектов для биотестирования, 20-30 самок дафний с выводковыми камерами, полными яиц или зародышей, за одни сутки до биотестирования пересаживают в стеклянную посуду емкостью от 0,5 до 1,0 дм3 с водой для культивирования и вносят корм. После появления молоди (каждая самка может выметать от 10 до 40 молодых дафний) взрослых особей удаляют.
10.6.3. Не реже одного раза в месяц культуру односуточных дафний проверяют на пригодность к биотестированию. С этой целью устанавливают среднюю летальную концентрацию за 24 ч биотестирования (ЛК50 за 24 ч) раствора эталонного вещества двухромовокислого калия (К2Сr2О7). Для этого готовят исходный раствор К2Сr2О7 1 г/дм3, используя дистиллированную воду. Далее, разбавляя исходный раствор культивационной водой, готовят серию растворов от 0,5 до 4,0 мг/дм3 К2Сr2О7 с интервалом 0,5 мг/дм3 (опыт). Контролем служит культивационная вода. Биотестирование этих растворов проводят продолжительностью 24 ч в соответствии с процедурой, изложенной в 10.7. На основании полученных результатов рассчитывают ЛК50 за 24 ч двухромовокислого калия в соответствии с приложением В.
Если полученная ЛК50 за 24 ч находится в экспериментально установленном диапазоне реагирования тест-объекта, который равен 0,9-2,5 мг/дм3 К2Сr2О7 культура дафний пригодна для биотестирования.
Если ЛK50 за 24 ч К2Сr2О7 не находится в указанном диапазоне реагирования, проверяют условия культивирования тест-объекта, чтобы выяснить причины ухудшения состояния культуры. При необходимости культуру заменяют на новую.
10.7. Выполнение биотестирования
При биотестировании выполняют следующие операции.
10.7.1. Пробу воды (водную вытяжку) или буровой раствор соответствующего разбавления, а также растворы различных концентраций вещества (смеси веществ) наливают в стеклянные сосуды по 100 см3 (опыт). Другие сосуды наполняют таким же объемом отфильтрованной воды из емкостей, где культивируются дафнии (контроль). Повторность в опыте и контроле трехкратная.
10.7.2. В каждый опытный и контрольный сосуд помещают по 10 дафний в возрасте до 24 ч. Их быстро переносят стеклянной трубкой диаметром 5-7 мм, погрузив ее в воду.
10.7.3. Продолжительность биотестирования составляет 96 ч. Во время биотестирования дафний не кормят.
10.7.4. В конце биотестирования визуально подсчитывают количество живых дафний. Живыми считают дафний, которые свободно передвигаются в толще воды или всплывают со дна сосуда не позже, чем через 15 сек после его легкого встряхивания. Остальных дафний считают погибшими.
10.7.5. После подсчета дафний в контроле и опыте в каждом сосуде определяют концентрацию растворенного кислорода.
10.8. Обработка и оценка результатов
10.8.1. На основании результатов трех параллельных определений количества живых дафний в контроле и опыте находят средние арифметические количества живых дафний в контроле (опыте) по формуле
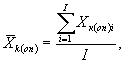 (10.1)
(10.1)
где:![]() - результат i-го измерения количества живых дафний в контроле
(опыте);
- результат i-го измерения количества живых дафний в контроле
(опыте);
i - номер измерения количества живых дафний в контроле опыте); i = i,...,I;
I - количество параллельных измерений количества живых дафний в контроле (опыте); I = 3.
Рассчитывают в процентах количество погибших дафний в опыте по отношению к контролю по формуле
![]() (10.2)
(10.2)
10.8.2. Вывод о наличии или отсутствии острой летальной токсичности пробы воды (водной вытяжки), бурового раствора или раствора вещества (смеси веществ) делают на основании величины А. Если величина А составляет 50% дафний и более, считают, что анализируемая проба проявляет острую летальную токсичность. В этом случае для количественной оценки токсичности анализируемой пробы воды (водной вытяжки) или бурового раствора устанавливают ее среднее летальное разбавление за 96 ч биотестирования (ЛР50 за 96 ч).
Для количественной оценки токсичности вещества (смеси веществ) устанавливают среднюю летальную концентрацию вещества (смеси веществ) за 96 ч биотестирования (ЛК50 за 96 ч).
10.8.3. Расчет ЛК50 за 96 ч (ЛР50 за 96 ч) проводят в соответствии с приложением В.
10.9. Контроль воспроизводимости результатов определения токсичности
Контроль воспроизводимости результатов определения токсичности проводят в объеме 5% от количества текущих измерений.
Контроль воспроизводимости проводят по результатам двух определений токсичности анализируемых пробы воды (водной вытяжки), бурового раствора, раствора вещества (смеси веществ) полученных в условиях воспроизводимости (ЛР1, ЛР2 или ЛК1, ЛК2).
Решение об удовлетворительности воспроизводимости определений принимается при условии:
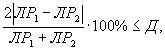
где Д - норматив оперативного контроля воспроизводимости составляет 94%.
11. МЕТОДИКА БИОТЕСТИРОВАНИЯ ПО ГИБЕЛИ РАКООБРАЗНЫХ CERIODAPHNIA AFFINIS LILLJEBORG
11.1. Назначение и область применения
Настоящая «Методика...» устанавливает процедуру определения острой летальной токсичности сточных, поверхностных и подземных вод, донных отложений (водных вытяжек), водных растворов отдельных веществ и их смесей.
11.2. Принцип методики
Методика основана на установлении различия между количеством погибших цериодафний в анализируемой пробе (опыт) и культивационной воде (контроль).
Критерием острой летальной токсичности является гибель 50% цериодафний и более в опыте по сравнению с контролем за 48 ч биотестирования.
11.3. Характеристики погрешности измерений
Границы, в которых находится относительная погрешность определения токсичности по данной методике с заданной доверительной вероятностью Р=0,95, составляют ±61%.
Наибольшее возможное значение среднего квадратического отклонения случайной составляющей относительной погрешности определения токсичности по данной методике σ (δ) составляет 31%.
Характеристики погрешности установлены по результатам внутрилабораторного эксперимента с использованием эталонного вещества - калия двухромовокислого (К2Сr2О7).
Алгоритм установления характеристик погрешности методики приведен в приложении Б.
11.4. Средства измерений, вспомогательные устройства, материалы, реактивы
Применяют следующие средства измерений, вспомогательные устройства, материалы и реактивы:
- микрокомпрессор аквариумный АЭН ТУ 16-064-011;
- аппарат для встряхивания ТУ 64-1-1081;
- мешалка лабораторная ТУ 25-05-2160;
- оксиметр любого типа, с погрешностью измерения не более 0,5 мг О2/дм3;
- лупа складная ГОСТ 7954, ТУ 3-3-227;
- груши резиновые разные (пипеточные луковицы) ТУ 38-106-003;
- газ мельничный № 25-43 (число отверсти, приходящихся на 1 см соответствует номеру) ГОСТ 4403;
- термолюминостат, поддерживающий температуру воды (20±2)°С, освещенность (500±100) лк;
- весы лабораторные по ГОСТ 24104, 2 класса точности, с наибольшей предельной нагрузкой 200 г;
- воронки разные лабораторные ГОСТ 25336;
- бюксы или стаканчики для взвешивания, диаметром 30, 40 мм ГОСТ 7148;
- центрифуга лабораторная медицинская ТУ 5-375-4261;
- термометр по ГОСТ 112 с ценой деления шкалы 1°С;
- холодильник, поддерживающий температуру (4±2)°С;
- шкаф сушильный электрический общелабораторного назначения, ГОСТ 13474;
- рН-метр ГОСТ 25.7416.0171 или аналоги;
- колбы мерные по ГОСТ 1770, вместимостью 0,5 и 1,0 дм3 по ГОСТ 1770, 2 класса точности;
- бумагу фильтровальную по ГОСТ 12026;
- вату и марлю для изготовления ватно-марлевых пробок;
- пипетки мерные вместимостью от 1 до 10 см3 по ГОСТ 29227, 2 класса точности;
- пипетки автоматические дозаторы любого типа объемом 0,1-0,2 см3.
- посуду стеклянную: вместимостью 2 дм3 для культивирования дафний; вместимостью от 100 до 150 см3 для биотестирования; вместимостью 1 дм3 для транспортирования и хранения проб воды;
- пробирки стеклянные, вместимостью 10 см3 ГОСТ 25336;
- трубки стеклянные внутренним диаметром 5-7 мм для отлова дафний;
- цилиндры мерные вместимостью 0,1; 0,5 и 1,0 дм3 по ГОСТ 1770, 2 класса точности;
- дрожжи хлебопекарные по ГОСТ 171;
- культура зеленых водорослей (для корма - родов Chlorella или Scenedesmus);
- железа хлорид по ГОСТ 4147;
- калий азотнокислый по ГОСТ 4217;
- калий двухромовокислый по ГОСТ 4220;
- калий фосфорнокислый двузамещенный по ГОСТ 2493;
- магний сернокислый по ГОСТ 4523;
11.5. Условия выполнения биотестирования
11.5.1. Биотестирование проводят в помещении, где не хранят и не работают с химическими веществами, не используют обработку помещений.
11.5.2. Объем пробы воды (водной вытяжки), водного раствора вещества (смеси веществ) для определения острой летальной токсичности должен быть не менее 1 дм3.
11.5.3. Температура анализируемой пробы при биотестировании должна быть равна (25±2)°С, концентрация кислорода в пробе в начале биотестирования - не менее 6 мг/дм3. Если его концентрация ниже 6 мг/дм3, пробу аэрируют микрокомпрессором. Воздух должен подаваться равномерно до достижения концентрации кислорода 6 мг/дм3. Во время биотестирования пробу не аэрируют.
Биотестирование проводят при рассеянном свете. Не допускается попадание прямых солнечных лучей на цериодафний. Длительность светового периода соответствует естественному. Рекомендуется использовать термолюминостаты.
11.5.4. Плотность посадки цериодафний возрастом 4-8 час в опыте и контроле составляет 1 экземпляр на 10 см3. Повторность 10-и кратная.
11.5.5. Результаты учитывают, если в конце биотестирования концентрация кислорода в пробе была не менее 2 мг/дм3, температура во время биотестирования составляла (25±2)°С, количество погибших цериодафний в контроле не превышало 10%, ЛК50 за 24 ч эталонного вещества К2Сr2О7 для культуры односуточных цериодафний находилась в диапазоне его концентраций 0,9-3,3 мг/дм3.
11.6. Подготовка к выполнению биотестирования
11.6.1. В качестве тест-объекта используют лабораторную культуру цериодафний - Ceriodaphnia affinis Lilljeborg (Cladocera, Crustacea).
Условия культивирования цериодафний соответствуют п. 11.5.
Цериодафний рекомендуется культивировать в посуде вместимостью 2 дм3. Ее моют питьевой содой и тщательно ополаскивают дистиллированной водой. Нельзя применять для мытья синтетические моющие средства и органические растворители.
Для культивирования цериодафний используют питьевую воду по ГОСТ 2874. Питьевую воду предварительно дехлорируют путем отстаивания и аэрируют микрокомпрессором до достижения концентрации растворенного кислорода не менее 6 мг/дм3. Оптимальная температура для культивирования цериодафний соcтавляет (25±2)°С.
Начальная плотность посадки культуры должна быть от 10 до 15 особей молоди цериодафний на 1 дм3 воды. Первый помет цериодафний должен появляться не позднее 6 сут. За неделю каждая самка должна выметать не менее 10 молодых цериодафний. Два раза в неделю взрослых цериодафний в возрасте до 2 недель и молодь пересаживают отдельно в посуду со свежей водой.
Для пересаживания цериодафний используют стеклянную трубку с вытянутым концом и резиновой грушей на другом конце. Цериодафний пересаживают осторожно, чтобы их не травмировать.
Кормят цериодафний один раз в сутки суспензией хлебопекарных дрожжей, а раз в неделю - суспензией зеленых водорослей. Для приготовления дрожжевого корма 1 г свежих или 0,5 г воздушно-сухих дрожжей заливают 100 см3 дистиллированной воды. После набухания дрожжей суспензию тщательно перемешивают и отстаивают в течение 30 мин. Надосадочную жидкость добавляют в посуду с цериодафниями в количестве 5 см3 на 1 дм3 воды.
В качестве водорослевого корма для цериодафний рекомендуется использовать зеленые протококковые водоросли - сценедесмус или хлореллу. Их выращивают в соответствии с 9.6.2. Водоросли вносят в культуру цериодафний из расчета 1 см3 суспензии водорослей (плотность клеток составляет примерно 350 млн. кл/см3). Суспензию водорослей получают центрифугированием или отстаиванием в холодильнике в течение 2-3 суток. Надосадочную жидкость сливают, а осадок разбавляют в 2 раза дистиллированной водой и используют в качестве корма.
11.6.2. Для биотестирования используют цериодафний в возрасте 4-8 часов.
Для получения тест-объектов за 24 ч до биотестирования необходимое количество самок цериодафний возрастом от 7 до 14 сут, выводковые камеры которых наполнены яйцами, пересаживают в стеклянную посуду вместимостью от 0,5 до 1,0 дм3, которая заполнена водой для культивирования. В эту воду перед пересаживанием цериодафний вносят корм. От каждой самки можно получить до 6 молодых цериодафний.
За 2-3 ч до начала биотестирования в посуду с цериодафниями вносят корм и удаляют взрослых особей.
11.6.3. Не реже одного раза в месяц культуру цериодафний возрастом 4-8 час проверяют на пригодность для биотестирования.
Для определения пригодности культуры цериодафний для биотестирования устанавливают среднюю летальную концентрацию раствора эталонного вещества - двухромовокислого калия (К2Сr2О7) за 24 ч биотестирования (ЛК50 за 24 ч). Для этого готовят исходный раствор К2Сr2О7 концентрацией 1 г/дм3, используя дистиллированную воду. Далее из исходного раствора готовят серию растворов с концентрациями К2Сr2О7 от 0,5 до 4,0 мг/дм3 с интервалом 0,5 мг/дм3, используя культивационную воду (опыт). Контролем служит культивационная вода. Биотестирование этих растворов проводят продолжительностью 24 ч в соответствии с процедурой, изложенной в 11.7. На основании полученных результатов рассчитывают ЛК50 за 24 ч в соответствии с приложением В.
Если полученная величина ЛК50 за 24 ч находится в экспериментально установленном диапазоне реагирования тест-объекта, который равен 0,9-3,3 мг/дм3 К2Сr2О7, культура цериодафний пригодна для биотестирования.
Если ЛК50 за 24 ч не находится в указанном диапазоне реагирования, проверяют условия культивирования тест-объекта, при необходимости культуру заменяют.
11.7. Выполнение биотестирования
При биотестировании выполняют следующие операции.
11.7.1. Разбавление анализируемой проб воды (водной вытяжки) и растворы с разными концентрациями вещества (смеси веществ) готовят прибавлением определенного объема пробы в культивационную воду.
Затем подготовленных к анализу проб воды (водной вытяжки) или растворы разных концентраций вещества (смеси веществ) наливают по 15 см3 в 10 стеклянных сосудов (опыт). Другие десять сосудов наполняют таким же объемом культивационной воды (контроль).
11.7.2. В каждый опытный и контрольный сосуд помещают по 1 экземпляру цериодафний в возрасте 4-8 ч. Их переносят из сосудов для культивирования трубкой с вытянутым концом и диаметром от 5 до 7 мм.
11.7.3. Продолжительность биотестирования составляет 48 ч. Во время биотестирования цериодафний не кормят.
11.7.4. В конце биотестирования визуально подсчитывают количество живых цериодафний. Живыми считают цериодафний, которые свободно двигаются в толще воды или всплывают со дна сосуда после его легкого встряхивания.
11.7.5. После подсчета цериодафний в контроле и опыте в каждом сосуде определяют концентрацию растворенного кислорода.
11.8. Обработка и оценка результатов
11.8.1. На основании результатов десяти параллельных определений количества живых цериодафний в контроле и опыте находят средние арифметические количества живых цериодафний в контроле (опыте) по формуле
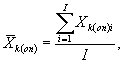 (11.1)
(11.1)
где ![]() - результат i-гo измерения количества живых
цериодафний в контроле (опыте);
- результат i-гo измерения количества живых
цериодафний в контроле (опыте);
i - номер измерения количества живых цериодафний в контроле опыте); i = i,...,I
I - количество параллельных измерений количества живых цериодафний в контроле (опыте); I = 10.
Рассчитывают в процентах количество погибших цериодафний в опыте по отношению к контролю по формуле
![]() (11.2)
(11.2)
11.8.2. Вывод о наличии или отсутствии острой летальной токсичности анализируемой пробы воды (водной вытяжки) или раствора вещества (смеси веществ) делают на основании величины А. Если величина А составляет 50% цериодафний и более, считают, что анализируемая проба проявляет острую летальную токсичность. В этом случае для количественной оценки токсичности анализируемой пробы устанавливают ее среднее летальное разбавление за 48 ч биотестирования (ЛР50 за 48 ч).
Для количественной оценки токсичности вещества (смеси веществ) устанавливают среднюю летальную концентрацию вещества (смеси веществ) за 48 ч биотестирования (ЛК50 за 48 ч).
Для количественной оценки токсичности вещества (смеси веществ) устанавливают среднюю летальную концентрацию вещества (смеси веществ) за 48 ч биотестирования (ЛК50 за 48 ч).
11.8.3. Расчет ЛК50 за 48 ч (ЛР50 за 48 ч) проводят в соответствии с приложением В.
11.9. Контроль воспроизводимости результатов определения токсичности
Контроль воспроизводимости результатов определения токсичности проводят в объеме 5% от количества текущих измерений.
Контроль воспроизводимости проводят по результатам двух определений токсичности анализируемой пробы воды (водной вытяжки), раствора вещества (смеси веществ) полученных в условиях воспроизводимости (ЛР1, ЛР2 или ЛК1, ЛК2).
Решение об удовлетворительности воспроизводимости определений принимается при условии:
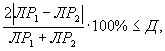
где Д - норматив оперативного контроля воспроизводимости составляет 86%.
12. МЕТОДИКА БИОТЕСТИРОВАНИЯ ПО ВЫЖИВАЕМОСТИ И ПЛОДОВИТОСТИ РАКООБРАЗНЫХ CERIODAPHNIA AFFINIS LILLJEBORG
12.1. Назначение и область применения
Настоящая «Методика...» устанавливает процедуру определения хронической токсичности сточных, поверхностных и подземных вод, донных отложений (водных вытяжек), водных растворов отдельных веществ и их смесей.
12.2. Принцип методики
Методика основана на установлении различия между показателями выживаемости и (или) плодовитости цериодафний в анализируемой пробе (опыт) и культивационной воде (контроль).
Критерием хронической токсичности является статистически достоверное увеличение количества погибших исходных цериодафний и (или) уменьшение количества новорожденных особей в опыте по сравнению с контролем на протяжении трех последовательных пометов за (7±1) сут.
12.3. Характеристики погрешности измерений
Границы, в которых находится относительная погрешность определения токсичности по данной методике с заданной доверительной вероятностью Р=0,95, составляют ±63%.
Наибольшее возможное значение среднего квадратического отклонения случайной составляющей относительной погрешности определения токсичности по данной методике σ (δ) составляет 32%.
Характеристики погрешности установлены по результатам внутрилабораторного эксперимента с использованием эталонного вещества - калия двухромовокислого (К2Сr2О7).
Алгоритм установления характеристик погрешности методики приведен в приложении Б.
12.4. Средства измерений, вспомогательные устройства, материалы, реактивы
Применяют средства измерений, вспомогательные устройства, материалы, реактивы, указанные в 11.4.
12.5. Условия выполнения биотестирования
12.5.1. Биотестирование проводят в помещении где не хранят и не работают с химическими веществами, не используют обработку помещений инсектицидами.
12.5.2. Объем пробы воды (водной вытяжки), раствора вещества (смеси веществ) для определения хронической токсичности должен быть не менее 2 дм3.
12.5.3. Температура анализируемой пробы при биотестировании должна быть равна (25±2)°С, концентрация кислорода в пробе в начале биотестирования - не менее 6 мг/дм3. Если его концентрация ниже 6 мг/дм3, пробу аэрируют микрокомпрессором. Воздух должен подаваться равномерно до достижения концентрации кислорода 6 мг/дм3. Во время биотестирования пробу не аэрируют.
12.5.4. Плотность посадки односуточных дафний в опыте и контроле составляет 1 экземпляр на 15 см3.
12.5.5. Результаты учитывают, если в конце биотестирования концентрация кислорода в пробе была не менее 2 мг/дм3, температура пробы во время биотестирования составляла (25±2)°С, количество погибших цериодафний в контроле не превышало 10%, ЛК50 за 24 ч эталонного вещества К2Сr2О7 для культуры односуточных цериодафний находилась в диапазоне его концентраций 0,9-3,3 мг/дм3.
Биотестирование проводят при рассеянном свете. Не допускается попадание прямых солнечных лучей на цериодафний. Длительность светового периода соответствует естественному. Рекомендуется использовать термолюминостат.
12.6. Подготовка к выполнению биотестирования
В качестве тест-объекта используют лабораторную культуру ракообразных Ceriodaphnia affinis Lilljeborg (Cladocera, Crustacea). Культивирование цериодафний в лабораторных условиях, подготовка к биотестированию, процедура определения пригодности культуры для биотестирования приведены в 11.6.
12.7. Выполнение биотестирования
12.7.1.При биотестировании выполняют следующие операции. Приготовленные разбавления анализируемой пробы воды (водной вытяжки) или растворы с различными концентрациями вещества (смеси веществ) наливают по 15 см3 в десять сосудов (опыт). Другие десять сосудов заполняют таким же объемом культивационной воды (контроль).
12.7.2. В каждый из опытных и контрольных сосудов помещают по 1 экземпляру цериодафний. Их переносят из сосудов для культивирования трубкой с вытянутым концом и диаметром от 5 до 7 мм.
12.7.3. Ежесуточно в каждом сосуде проводят замену пробы на свежую. Для этого содержимое сосуда переливают в дополнительный сосуд (например, чашку Петри, бюкс или другой плоский сосуд соответствующего размера). Освободившийся сосуд заполняют свежей пробой. В каждом дополнительном сосуде регистрируют наличие цериодафний. Исходную цериодафнию пересаживают в приготовленный сосуд и вносят корм (суспензию дрожжей).
Появившуюся молодь подсчитывают и удаляют. Биотестирование заканчивают после того, как 60% исходных самок в контроле дадут по три последовательных помета. Продолжительность биотестирования составляет (7±1) сут.
12.8. Обработка и оценка результатов
12.8.1. После окончания биотестирования подсчитывают количество исходных выживших самок и количество появившейся молоди в расчете на одну самку в каждом параллельном определении в контроле и опыте.
12.8.2. Достоверность различий между опытом и контролем по показателям выживаемости и плодовитости устанавливают по критерию Стьюдента (tmeop). Для этого вычисляют фактический критерий достоверности разницы (tфакт) и сравнивают его с теоретическим (tmeop).
Значение t факт находят по формуле
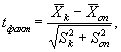 (12.1)
(12.1)
где ![]() - средние
арифметические показателей выживаемости или плодовитости в контроле и опыте;
- средние
арифметические показателей выживаемости или плодовитости в контроле и опыте;
Sk, Sоn - ошибки средних арифметических в контроле и опыте.
Значение tтеор табличная величина. Для уровня значимости Р = 5 % и числа степеней свободы F = 2 (10-1) = 18 tтеор = 2,1 (табл. 12.1).
Таблица 12.1
Значения критерия Стьюдента
|
Число степеней свободы |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
tтеор |
2,20 |
2,18 |
2,16 |
2,14 |
2,13 |
2,12 |
2,11 |
2,10 |
2,09 |
2,09 |
Если tфaкт ≥ tтeop, то разница между результатами биотестирования в опыте и контроле считается статистически достоверной. На этом основании делают вывод о том, что проба воды (водная вытяжка) или раствор вещества (смеси веществ) оказывает хроническое токсическое действие.
Если tфакт < tтeop, то разница между результатами биотестирования в опыте и контроле считается статистически недостоверной. На этом основании делают вывод о том, что проба воды (водная вытяжка) или раствор вещества (смеси веществ) не оказывает хронического токсического действия.
12.8.3. Для количественной оценки токсичности пробы воды (водной вытяжки) устанавливают ее эффективное разбавление (ЭР), т.е. максимальное разбавление, при котором наблюдается достоверное увеличение количества погибших исходных цериодафний и (или) уменьшение количества появившихся особей в опыте по сравнению с контролем на протяжении трех последовательных пометов за (7±1) сут.
12.8.4. Для количественной оценки токсичности вещества (смеси веществ) устанавливают эффективную концентрацию (ЭК) вещества (смеси веществ), т.е. минимальную концентрацию, при которой наблюдается достоверное увеличение количества погибших исходных цериодафний и (или) уменьшение количества появившихся особей в опыте по сравнению с контролем на протяжении трех последовательных пометов за (7±1) сут.
12.9. Контроль воспроизводимости результатов определения токсичности
Контроль воспроизводимости результатов определения токсичности проводят в объеме 5% от количества текущих измерений.
Контроль воспроизводимости проводят по результатам двух определений токсичности анализируемой пробы воды (водной вытяжки), раствора вещества (смеси веществ) полученных в условиях воспроизводимости (ЭP1, ЭР2 или ЭК1, ЭК2).
Решение об удовлетворительности воспроизводимости определений принимается при условии:
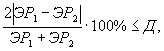
где Д - норматив оперативного контроля воспроизводимости составляет 89%.
13. МЕТОДИКА БИОТЕСТИРОВАНИЯ ПО ГИБЕЛИ РЫБ POECILLIA RETICULATA PETERS
13.1. Назначение и область применения
Настоящая «Методика...» устанавливает процедуру определения острой летальной токсичности сточных и поверхностных и подземных вод, донных отложений (водных вытяжек), буровых растворов, водных растворов отдельных веществ и их смесей.
13.2. Принцип методики
Методика основана на установлении различия между количеством погибших рыб в анализируемой пробе (опыт) и воде, которая не содержит токсических веществ (контроль).
Критерием острой летальной токсичности является гибель 50% рыб и более в опыте по сравнению с контролем за 96 ч биотестирования.
13.3. Характеристики погрешности измерений
Границы, в которых находится относительная погрешность определения токсичности по данной методике с заданной доверительной вероятностью Р=0,95, составляют ± 42%.
Наибольшее возможное значение среднего квадратического отклонения случайной составляющей относительной погрешности определения токсичности по данной методике σ (δ) составляет 21%.
Характеристики погрешности установлены по результатам внутрилабораторного эксперимента с использованием эталонного вещества - калия двухромовокислого (К2Сr2О7).
Алгоритм установления характеристик погрешности методики приведен в приложении Б.
13.4. Средства измерений, вспомогательные устройства, материалы, реактивы
Применяют следующие средства измерений, вспомогательные устройства, материалы, реактивы:
- аквариумы емкостью 50 и 200 дм3;
- микрокомпрессор аквариумный АЭН ТУ 16-064, 011;
- оксиметр любого типа, с погрешностью измерения не более 0,5 мг О2/дм3;
- рН-метр ГОСТ 25.7416.0171 или аналоги;
- приспособление для термостатирования;
- весы лабораторные по ГОСТ 24104, 2-го класса точности с наибольшей предельной нагрузкой 200 г;
- термометр по ГОСТ 112 с ценой деления шкалы 1°С;
- холодильник, поддерживающий температуру (4±2)°С;
- колбы мерные вместимостью 0,5 и 1,0 дм3 по ГОСТ 1770, 2-го класса точности;
- бумагу фильтровальную по ГОСТ 12026;
- пипетки мерные вместимостью от 1 до 10 см3 по ГОСТ 29227, 2-го класса точности;
- посуду для транспортирования и хранения проб воды вместимостью 5 дм3;
- сачок для отлова рыбы;
- стеклянную палочку;
- цилиндры мерные вместимостью 0,1; 0,5 и 1,0 дм3 по ГОСТ 1770, 2-го класса точности;
- воду дистиллированную по ГОСТ 6709;
- воду питьевую по ГОСТ 2784;
- калий двухромовокислый по ГОСТ 4220.
13.5. Условия выполнения биотестирования
13.5.1. Биотестирование проводят в помещении где не хранят и не работают с химическими веществами, не используют обработку помещений инсектицидами.
Используют рассеянный свет, естественный световой период.
13.5.2. Объем пробы воды (водной вытяжки), бурового раствора, вещества (смеси веществ) для определения острой летальной токсичности должен быть не менее 30 дм3.
13.5.3. Температура анализируемой пробы должна равняться (25±1)°С, концентрация растворенного кислорода не менее 4 мг/дм3. Если концентрация растворенного кислорода меньше, пробу аэрируют микрокомпрессором.
13.5.4. Плотность посадки гуппи в возрасте 24-48 час в опыте и контроле должна быть 10 экземпляров рыб на 5 дм3. Повторность двух - трехкратная.
13.5.5. Результаты учитывают, если при биотестировании концентрация растворенного кислорода была не менее 4 мг/дм3, температура составляла (25±1)°С, количество погибших рыб в контроле не превышало 10%, ЛК50 за 24 ч калия двухромовокислого (К2Сr2О7) для рыб находилась в диапазоне концентраций 106-175 мг/дм3.
13.6. Подготовка к выполнению биотестирования
13.6.1. В качестве тест-объекта используют мальков гуппи в возрасте не более двух суток (от 24 до 48 ч).
Для получения тест-объекта выбирают рыб не старше двух лет (продолжительность жизни гуппи 3-3,5 года), без каких-либо признаков заболевания.
Отобранных самцов и самок рекомендуется содержать в отдельных аквариумах. При совместном содержании самцы растут медленнее и имеют меньшие размеры. Половозрелые гуппи имеют хорошо развитые половые признаки, что облегчает их сортировку. Самцы, как правило, мельче (3-4 см) и имеют более яркую окраску, чем самки. У них преобладают серовато-коричневые тона с очень яркими красными, голубыми, зелеными и черными пятнами. Самки больше самцов, до 6 см в длину, чаще желтовато-зеленые. Анальный плавник у самок округлый. У молодых самцов он имеет ту же форму, но со временем, в период полового созревания, он начинает удлиняться и превращается в подвижный гоноподий.
Для содержания производителей пригодны любые термостатируемые аквариумы, которые обеспечивают температуру воды (25±1)°С.
Плотность посадки самцов 1-2 дм3 воды на экземпляр, самок - не менее 4 дм3. Перед размещением рыб аквариумы засаживают растениями без жестких, режущих кромок. Предпочтение следует отдавать густым мелколистным и, обязательно, плавающим растениям (риччия, сальвиния). Спереди или в центре аквариума должно быть свободное пространство для плаванья.
Аквариумы освещают верхним светом не менее 8 ч в сутки. В качестве источника света используют обычные лампы дневного света.
Для содержания производителей используют питьевую воду по ГОСТ 2874, которую отстаивают на протяжении 7 сут. Воду аэрируют, фильтруют и термостатируют при температуре (25±1)°С. Содержание растворенного в воде кислорода должно быть не менее 4 мг/дм3. Один раз в месяц 1/3 часть воды заменяют на свежую. Добавляемая вода должна быть той же температуры, что и в аквариуме. Вместо испарившейся воды добавляют дистиллированную воду.
Кормят производителей гуппи 3-5 раз в день живым кормом. Корм дается в таком количестве, чтобы рыбы съедали его без остатка за 3-5 мин.
Для получения тест-объектов самцов и самок помещают в один аквариум для совместного содержания. Гуппи относятся к рыбам с внутриутробным развитием икры, способным к нересту полностью сформировавшихся мальков. Готовность самки к нересту определяется наличием хорошо заметного темного пятна перед анальным плавником. При этом форма брюшка приближается к прямоугольной и оно становится намного шире спины.
Самку, готовую к нересту, помещают в отдельную нерестовую посудину. Вместимость ее должна быть не менее 4 дм3 с большим количеством мелколистных растений. Нерестовые посудины заполняют водой такого же качества, как и для содержания производителей, и термостатируют при температуре (25±1)°С. Самок после нереста удаляют, так как они поедают мальков.
Мальков рекомендуется кормить «пылью», состоящей из инфузорий, эвглен, коловраток, молоди ветвистоусых рачков и науплиусов веслоногих рачков.
При отсутствии «пыли» молодь гуппи можно кормить перетертой сухой дафнией или каким-либо другим сухим кормом. На 100 рыб его необходимо не более 1 г в сутки. По мере того, как растут рыбы, в их рацион вводят резаный трубочник, мотыль, коретру и другие живые корма. Одно-двухнедельных мальков кормят до 5 раз в день, более взрослых - 2-3 раза.
Мальков сортируют, чтобы избежать неравномерности развития, и постепенно переводят из нерестовых посудин в аквариумы сначала вместимостью 50 дм3, а далее 200 дм3. Аквариумы заполняют водой такого же качества, как и для производителей гуппи.
13.6.2. Тест-организмы (возрастом 1-2 суток) перед серией экспериментов проверяют на пригодность для биотестирования.
Для определения пригодности рыб для биотестирования устанавливают среднюю летальную концентрацию раствора эталонного вещества калия двухромовокислого (К2Сr2О7) за 24 ч биотестирования (ЛК50 за 24 ч). Для этого готовят исходный раствор К2Сr2О7 концентрацией 10 г/дм3, используя дистиллированную воду. Далее из исходного раствора готовят серию растворов с концентрациями К2Сr2О7 от 100 до 200 мг/дм3 с интервалом 25 мг/дм3, используя культивационную воду. Биотестирование этих растворов проводят продолжительностью 24 ч в соответствии с процедурой, изложенной в 13.7. На основании полученных результатов рассчитывают ЛК50 за 24 ч калия двухромовокислого.
Если полученная величина ЛК50 К2Сr2О7 за 24 ч находится в экспериментально установленном диапазоне реагирования тест-объекта 106-175 мг/дм3, гуппи пригодны для биотестирования.
Если ЛК50 за 24 ч К2Сr2О7 не находится в указанном диапазоне реагирования, то проверяют условия культивирования тест-объекта, чтобы выяснить причины ухудшения состояния культуры.
13.7. Выполнение биотестирования
При биотестировании выполняют следующие операции.
13.7.1. Разбавления пробы воды (водной вытяжки), буровых растворов и растворы с разными концентрациями вещества (смеси веществ) готовят прибавлением определенного объема анализируемой пробы в дехлорированную питьевую воду по ГОСТ 2874.
13.7.2. Приготовленные пробы воды (водных вытяжек) или растворы с различными концентрациями вещества (смеси веществ) наливают в сосуды по 5 дм3 (опыт). Другие сосуды наполняют таким же объемом дехлорированной питьевой водой (контроль). Повторность в опыте и контроле трехкратная.
13.7.3. В каждый из опытных и контрольных сосудов помещают по 10 экземпляров гуппи в возрасте от 24 до 48 ч.
13.7.4. Продолжительность биотестирования составляет 96 ч. Во время биотестирования рыб не кормят.
13.7.5. Ежедневно подсчитывают количество живых рыб и удаляют погибших. Погибшими считают рыб, которые не подают признаков движения или дыхания при прикосновении к ним стеклянной палочкой.
13.8. Обработка и оценка результатов
13.8.1. На основании результатов трех параллельных определений количества живых рыб в контроле и опыте находят средние арифметические количества живых рыб в контроле (опыте) по формуле
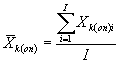 , (13.1)
, (13.1)
где![]() - результат i-гo
измерения количества живых рыб в контроле (опыте);
- результат i-гo
измерения количества живых рыб в контроле (опыте);
i - номер измерения количества живых рыб в контроле (опыте);
I - количество параллельных измерений количества живых рыб в контроле (опыте); I = 3.
Рассчитывают в процентах количество погибших рыб в опыте по отношению к контролю по формуле
![]() (13.2)
(13.2)
13.8.2. Вывод о наличии или отсутствии острой летальной токсичности пробы воды (водной вытяжки) делают на основании величины А. Если величина А составляет 50% и более, считают, что анализируемая проба проявляет острую летальную токсичность. В этом случае для количественной оценки токсичности пробы воды (водной вытяжки) устанавливают ее среднее летальное разбавление за 96 ч биотестирования (ЛР50 за 96 ч).
Для количественной оценки токсичности раствора вещества (смеси веществ) устанавливают среднюю летальную концентрацию вещества (смеси веществ) за 96 ч биотестирования (ЛК50 за 96 ч).
13.8.3. Расчет ЛК50 за 96 ч (ЛР50 за 96 ч) проводят в соответствии с приложением В.
13.9. Контроль воспроизводимости результатов определения токсичности
Контроль воспроизводимости результатов определения токсичности проводят в объеме 5% от количества текущих измерений.
Контроль воспроизводимости проводят по результатам двух определений токсичности пробы воды (водной вытяжки), бурового раствора, раствора вещества (смеси веществ), полученных в условиях воспроизводимости (ЛР1, JIP2) или (ЛК1, ЛК2).
Решение об удовлетворительности воспроизводимости определений принимается при условии:
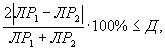
где Д - норматив оперативного контроля воспроизводимости составляет 58%.
14. МЕТОДИКА БИОТЕСТИРОВАНИЯ ПО УГНЕТЕНИЮ РОСТА ОДНОКЛЕТОЧНЫХ МОРСКИХ ВОДОРОСЛЕЙ PHAEODACTYLUM TRICORNUTUM BOHLIN
14.1. Назначение и область применения
Настоящая «Методика...» устанавливает процедуру определения острой летальной токсичности природных морских вод; сточных вод разной солености; буровых растворов, сбрасываемых в морские воды, растворов отдельных веществ и их смесей в морской воде, морских донных отложений (водных вытяжек).
14.2. Принцип методики
14.2.1. Методика основана на установлении различия между интенсивностью роста клеток водорослей в анализируемой пробе (опыт) и культуральной среде (контроль).
14.2.2. Критерием токсического действия является снижение на 50% и более численности клеток водорослей в опыте по сравнению с контролем за 72 ч биотестирования (условно "острая токсичность") и 7 суток (условно "хроническая токсичность"). Для буровых растворов острая токсичность определяется за 96 ч.
14.3. Характеристики погрешности измерений
Границы, в которых находится относительная погрешность определения токсичности по данной методике с заданной доверительной вероятностью Р=0,95, составляют ±23%.
Наибольшее возможное значение среднего квадратического отклонения случайной составляющей относительной погрешности определения токсичности по данной методике σ (δ) составляет 22%.
Характеристики погрешности установлены по результатам внутрилабораторного эксперимента с использованием эталонного вещества - калия двухромовокислого (К2Сr2О7).
Алгоритм установления характеристик погрешности методики приведен в приложении Б.
14.4. Средства измерений, вспомогательные устройства, материалы, реактивы
Применяют следующие средства измерений, вспомогательные устройства, материалы, реактивы:
- люминостат с освещением рабочей зоны 2000-3000 лк от ламп дневного света;
- термометр лабораторный по ГОСТ 215, цена деления шкалы 0,1°С;
- микроскоп с кратностью увеличения не менее 400 раз;
- колориметр фотоэлектрический (ФЭК-56 либо КФК-3) или спектрофотометр, или прибор для измерения быстрой или замедленной флуоресценции;
- покровные стекла по ГОСТ 6672;
- предметные стекла по ГОСТ 9284;
- камеру счетную Горяева по ТУ 42-816 или Нажотта по ТУ 64-1-816;
- посуду стеклянную для отбора и хранения проб воды вместимостью 1 дм3;
- колбы плоскодонные конические вместимостью 250 см3 по ГОСТ 25336;
- колбы мерные вместимостью 0,5 и 1,0 дм3 по ГОСТ 1770, 2-го класса точности;
- пипетки мерные вместимостью от 1 до 10 см3 по ГОСТ 29227, 2-го класса точности;
- дозаторы пипеточные вместимостью 0,1 и 0,5 см3 по ТУ 64-1-3326;
- цилиндры мерные вместимостью 0,1; 0,5 и 1,0 дм3 по ГОСТ 1770, 2-го класса точности;
- вату для изготовления ватно-марлевых пробок;
- марлю для изготовления ватно-марлевых пробок;
- бумагу фильтровальную по ГОСТ 12026;
- фильтры мембранные № 4;
- фильтровальный аппарат;
- воду дистиллированную по ГОСТ 6709;
- воду питьевую по ГОСТ 2874;
- рН-метр;
- прибор для измерения кислорода в воде;
- холодильник, который обеспечивает температуру от 2 до 8 °С;
- шкаф сушильный для стерилизации посуды;
- плитку электрическую по ГОСТ 14919;
- баню водяную;
- спиртовку;
- весы лабораторные общего назначения по ГОСТ 24104, 2-го класса точности с наибольшей массой взвешивания 200 г;
- железо хлорное по ГОСТ 4147;
- калий азотнокислый по ГОСТ 4217;
- калий двухромовокислый по ГОСТ 4220;
- калий хлористый по ГОСТ 4234;
- кальций хлористый по ТУ 6-09-4711;
- кислоту борную по ГОСТ 9656;
- кобальт хлористый по ГОСТ 4525;
- магний хлористый по ГОСТ 4209;
- марганец хлористый по ГОСТ 612;
- натрий углекислый по ГОСТ 4201;
- натрий сернокислый по ГОСТ 4166;
- натрий фосфорнокислый однозамещенный по ГОСТ 245;
- натрий хлористый по ГОСТ 4233;
- соль морскую профессиональную (Wiegandt, производство Германия).
14.5. Условия выполнения биотестирования
14.5.1. Биотестирование проводят в помещении без вредных испарений и газов при температуре 20±2°С, равномерном освещении лампами дневного света с интенсивностью 2000-3000 лк, при естественной смене дня и ночи.
14.5.2. Объем проб воды (водной вытяжки), бурового раствора, раствора вещества (смеси веществ) для определения токсичности должен быть не менее 1 дм3.
14.5.3. Численность клеток водорослей в исходной культуре, подготовленной для биотестирования, должна быть не менее 5 млн. кл/см3. Культура должна находиться в экспоненциальной фазе роста.
14.5.4. Начальная численность клеток водорослей в опыте и контроле перед началом биотестирования должна быть не менее 30 тыс. кл/см3.
14.5.5. Рабочий объем пробы в контрольных и в опытных колбах составляет 50-100 см3. Повторность 3-х кратная.
14.5.6. Результаты учитывают, если численность клеток водорослей в контроле увеличилась за 96 ч биотестирования не менее, чем в 3 раза; ЭК50 за 96 ч калия двухромовокислого (К2Сr2О7) для культуры водорослей находилась в диапазоне его концентраций 5,8-10,0 мг/дм3.
14.6. Подготовка к выполнению биотестирования
14.6.1. Для биотестирования используют лабораторную культуру одноклеточных морских золотистых водорослей Phaeodactylum tricornutum Bohlin.
14.6.2. Лабораторную культуру водорослей выращивают на среде Гольдберга в конических плоскодонных колбах объемов 250-300 см3 в люминостате с интенсивностью освещения не менее 2000-3000 лк при температуре (20±2)°С.
При культивировании и биотестировании водорослей используют химически чистую стеклянную посуду. Для этого посуду промывают смесью бихромата калия и серной кислоты (хромовой смесью), затем тщательно водопроводной водой и 3-4 раза дистиллированной водой. Посуду, используемую для культивирования и биотестирования, за исключением мерной, стерилизуют в сушильном шкафу при 160°С в течение 1,5 ч. Не разрешается пользоваться для мытья посуды синтетическими поверхностно-активными веществами и органическими растворителями. Можно пользоваться питьевой содой.
Для приготовления питательной среды Гольдберга в модификации Кабановой (табл. 14.1) сначала готовят исходные растворы солей (№№ 1, 2, 3, 4) на дистиллированной воде в мерных колбах объемом 100 см3. Полученные исходные растворы солей хранят в холодильнике. В случае помутнения растворов их заменяют на свежие.
Чтобы получить питательную среду Гольдберга для культивирования водорослей, в стерильную колбу объемом 2000 см3 отмеряют 1000 см3 отфильтрованной морской воды и пастеризуют дважды на водяной бане в течение 20 мин при температуре 80°С. После второй пастеризации в охлажденную воду добавляют необходимое количество исходных растворов №№ 1, 2, 3 в том порядке, как они указаны в таблице 14.1. Полученный раствор снова ставят на водяную баню, пастеризуют 20 мин при температуре 80°С, охлаждают и добавляют раствор № 4.
Состав питательной среды Гольдберга в модификации Кабановой
|
Номер исходного раствора |
Реактив |
Навеска реактива, г на 100 см3 дистиллированной воды |
Количество (см3) каждого раствора на 1 дм3 морской воды |
|
1 |
KNO4 |
10,1 |
2,0 |
|
2 |
NaH2PO4 |
1,421 |
0,5 |
|
3 |
МnСl2 * 4Н20 |
0,01979 |
1,0 |
|
CoCl2 * 6Н2О |
0,02379 |
||
|
4 |
FeCl3 * 6Н2О |
0,02703 |
1,0 |
Морскую воду для приготовления среды Гольдберга отбирают в условно чистом районе моря, фильтруют через двойной бумажный или мембранный фильтр, аэрируют на протяжении 10 сут. Вместо природной можно использовать искусственную морскую воду (табл. 14.1) или водный раствор профессиональный морской соли (Wiegandt, производство Германия).
Поскольку морская вода в разных морях и отдельных акваториях моря имеет различную соленость, необходимо иметь культуру водорослей, адаптированную к солености воды, подлежащей биотестированию.
Если соленость исходной природной или искусственной морской воды, на которой готовили питательную среду для культуры водорослей, выше, чем соленость анализируемой пробы воды (водной вытяжки), бурового раствора, тогда указанную исходную воду разбавляют дистиллированной водой до необходимой солености и используют ее для приготовления новой питательной среды.
Если культура водорослей выращивалась на среде с меньшей соленостью, чем соленость анализируемой воды, то готовят новую питательную среду, доведя соленость исходной морской воды до более высокой солености, используя соли, указанные в таблице 7.1 или профессиональную морскую соль (Wiegandt, производство Германия).
К новой питательной среде с пониженной (повышенной) соленостью культуру водорослей адаптируют.
Адаптацию водорослей к среде нужной солености проводят постепенно меняя соленость питательной среды по следующей схеме. В стерильную колбу объемом 250 см3 над пламенем спиртовки наливают 80 см3 исходной культуры водорослей в экспоненциальной фазе роста (в возрасте 3-х сут.), добавляет 20 см3 питательной среды необходимой солености и культивируют при указанных условиях. При этом объем адаптируемой культуры составляет 100 см3. Через каждые 5 сут меняют соотношение адаптируемой культуры и питательной среды: 60 см3 адаптируемой культуры и 40 см3 новой питательной среды; 40 см3 культуры и 60 см3 среды; 20 см3 культуры и 80 см3 среды. Каждый раз культуру водорослей пересевают в новую стерильную колбу на свежую питательную среду с той соленостью, к которой проводят адаптацию. Через 20 дней адаптацию заканчивают. Затем водоросли пересевают на свежую питательную среду, культивируют 5 сут, после чего проверяют пригодность культуры к биотестированию по К2Сr2О7.
Если соленость морской воды отличается от солености питательной среды с культурой водорослей не более, чем на 3-5%о, адаптацию не проводят.
14.6.3. Культивируя водоросли, периодически обновляют культуру, пересевая ее на свежую питательную среду не реже одного раза в 10 дней. Для этого в стерильную колбу объемом 250-300 см3 со свежей средой объемом 150 см3 над пламенем спиртовки приливают 15-20 см3 верхнего слоя исходной культуры (содержимое исходной культуры при этом не перемешивают). Начальная плотность клеток в новой колбе составляет примерно 100-150 тыс. кл/см3. В случае ослабления интенсивного роста клеток в культуре, к питательной среде добавляют витамин В12.
После посева колбу закрывают стерильной ватно-марлевой пробкой и бумажным колпачком, перемешивают и помещают в люминостат. В процессе культивирования культуру водорослей периодически перемешивают, встряхивая 1 -2 раза в сутки.
14.6.4. При биотестировании используют 3-х суточную культуру водорослей, находящуюся в экспоненциальной фазе роста.
Для этого в стерильную колбу со средой Гольдберга объемом 150 см3 приливают из исходной культуры водорослей верхний слой клеток (около 15-20 см3) и колбу ставят в люминостат для подращивания культуры водорослей.
Через 3-е суток подсчитывают численность клеток (которая должна составлять примерно 5 млн. кл/см3).
Далее расчетным путем устанавливают, какое количество культуры водорослей необходимо добавить, чтобы получить в опытном и контрольном объеме среды необходимую плотность клеток 30 тыс. кл/см3 (как правило это 0,5-1 см3 культуры водорослей).
Для подсчета количества клеток водорослей используют счетную камеру Горяева (или Нажотта). Подсчет в камере Горяева проводят в соответствии с процедурой, описанной в 9.7.2.
Количество клеток водорослей в 1 см3 в опыте и в контроле определяют (п. 9.8.1.) по формуле (9.1).
14.6.5. Периодически (не реже одного раза в месяц) определяют пригодность культуры водорослей к биотестированию. Для этого устанавливают среднюю эффективную концентрацию за 96 ч биотестирования (ЭК50 за 96 ч) эталонного вещества калия двухромовокислого (К2Сr2О7). Готовят исходный раствор К2Сr2О7 с концентрацией 1 г/дм3, используя дистиллированную воду. Далее к питательной среде Гольдберга добавляют необходимое количество исходного раствора К2Сr2О7, то есть готовят серию растворов с концентрациями К2Сr2О7 от 1,0 до 10,0 мг/дм3 (опыт). Затем в опытные и контрольные колбы (со средой Гольдберга) добавляют культуру водорослей в количестве примерно 0,5 см3, что соответствует плотности 30 тыс. кл/см3.
Опытные и контрольные образцы биотестируют на протяжении 96 ч в соответствии с процедурой, изложенной в 14.7. На основании полученных результатов рассчитывают ЭК50 за 96 ч двухромовокислого калия. Если полученная ЭК50 за 96 ч находится в экспериментально установленном диапазоне реагирования тест-объекта, который равен 5,8-10,0 мг/дм3 К2Сr2О7, культура водорослей пригодна для биотестирования.
Если ЭК50 за 96 ч не находится в указанном диапазоне реагирования, то проверяют условия культивирования тест-объекта, чтобы выяснить причины ухудшения состояния культуры. При необходимости культуру заменяют.
14.7. Выполнение биотестирования
При биотестировании выполняют следующие операции.
14.7.1. В конические колбы вместимостью 250 см3 наливают по 100 см3 среды Гольдберга (контроль), в другие колбы - исследуемые пробы воды (водной вытяжки), бурового раствора(опыт). Заполнение опытных колб (в различных разбавлениях) проводят следующим образом: без разбавления -100 см3 исследуемой пробы; 50 см3 исследуемой пробы и 50 см3 среды Гольдберга (разбавление в 2 раза); 10 см3 пробы и 90 см3 среды (разбавление в 10 раз); 1 см3 пробы и 99 см3 среды (разбавление в 100 раз); 0,1 см3 пробы и 99,9 см3 среды (разбавление в 1000 раз). Повторность в опыте и контроле трехкратная.
В опытные колбы без разбавления исследуемой пробы добавляют растворы исходных питательных солей Гольдберга в порядке расположения их в таблице 14.1 в количестве, соответственно, 0,2; 0,05; 0,1; 0,1 см3. Далее, в опытные колбы с разбавлением пробы в 2 раза - добавляют растворы исходных питательных солей по той же схеме, что и выше, но в количестве в 2 раза меньше (соответственно, 0,1; 0,025; 0,05; 0,05 см3). При разбавлении исследуемой пробы в 10 раз - добавляют соответственно 0,02; 0,005; 0,01; 0,01 см3, а при разбавлениях пробы в 100 и 1000 раз, исходные растворы солей питательной среды Гольдберга не добавляют (их количеством можно пренебречь).
Затем в опытные и контрольные колбы вносят по 0,5 см3 исходной культуры водорослей Ph. tricornutum в экспоненциальной фазе роста численностью около 5 млн. кл/см3 (при этом численность клеток водорослей в опытных и контрольных колбах будет составлять около 30 тыс.кл/см3).
При исследовании растворов различных концентраций вещества (смеси веществ) в конические колбы наливают по 100 см3 среды Гольдберга (как в контрольные, так и в опытные). В опытные колбы добавляют различные объемы исходного раствора исследуемого вещества (смеси веществ) для создания нужной концентрации и вносят по 0,5 см3 исходной культуры водорослей Ph. tricornutum в экспоненциальной фазе роста численностью 5 млн. кл/см3. В контроль кроме водорослей ничего не вносят.
После этого колбы закрывают ватно-марлевыми пробками, встряхивают и помещают в люминостат. Экспонируют, соблюдая условия п. 9.5.1. Содержимое каждой колбы перемешивают один - два раза в сутки.
14.7.2. В начале биотестирования в каждой колбе определяют исходную численность клеток. Исходная численность клеток должна составлять не менее 30 тыс. кл/см3 - в случае подсчета в счетной камере, и не менее 50 тыс. кл/см3 - в случае подсчета оптическим методом.
Затем считают численность клеток ежедневно, тщательно перемешивая содержимое колб, в течение 3-х суток в остром опыте и 7-и суток - в хроническом.
Для подсчета численности клеток водорослей используют счетные камеры Нажотта или Горяева (п. 9.7.2).
14.7.3. Допустимо для определения численности клеток использовать фотоэлектроколориметр типа ФЭК-56, КФК-3 или спектрофотометр, или прибор для измерения флуоресценции водорослей (быстрой или замедленной) с дальнейшим определением численности клеток по калибровочной кривой.
Построение калибровочной кривой для определения численности клеток водорослей проводят следующим образом. Исходную культуру водорослей последовательно разбавляют питательной средой в 2, 4, 6... n раз. Численность клеток в каждой колбе подсчитывают в счетной камере не менее 3-х раз и вычисляют среднее значение. На фотоэлектроколориметре или спектрофотометре, или приборе для измерения флуоресценции водорослей определяют соответствующую этой численности клеток оптическую плотность или уровень флуоресценции. Как правило, для измерения оптической плотности или флуоресценции водорослей Ph. tricornutum используют кюветы 10 мм толщиной (или другие), длина волны измерения оптической плотности на КФК-3 составляет 360 нм.
По результатам измерений строят калибровочную кривую по формуле
E = f(N), (14.1)
где Е - оптическая плотность;
N - численность клеток в 1 см3 культуры.
Необходимо учесть, что калибровочная кривая соответствует определенному устройству, кювете, длине волны и культуре.
Периодически, один раз в месяц, необходимо проверять калибровочную кривую.
14.7.4. Через 72 ч или 7 суток биотестирование прекращают. В каждой колбе подсчитывают численность клеток водорослей.
14.8. Обработка и оценка результатов
14.8.1. На основании результатов подсчета клеток в каждой капле определяют численность клетокводорослей (кл/см3) в контроле и опыте по формуле
![]() (14.2)
(14.2)
где mk(on)ij - количество подсчитанных водорослей в камере в контроле (опыте) для i-той капли и j-го параллельного определения;
i - номер капли суспензии;
j - номер параллельного определения;
V - объем части камеры, имеющей площадь маленького квадрата;
n - количество подсчитанных квадратов.
Для каждого параллельного определения в опыте и контроле вычисляют среднее арифметическое численности водорослей в 1 см3 по формуле
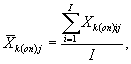 (14.3)
(14.3)
где I - количество капель суспензии.
14.8.2. На основании результатов трех параллельных определений численности клеток водорослей в контроле и опыте находят средние арифметические численности клеток водорослей в контроле (опыте) по формуле
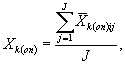 (14.4)
(14.4)
где J - количество параллельных определений численности клеток водорослей в контроле (опыте); J = 3.
Рассчитывают численность клеток водорослей в опыте в процентах от их численности в контроле по формуле
![]() (14.5)
(14.5)
где Р - численность клеток водорослей в опыте, %;
![]() - среднее
арифметическое численности клеток водорослей в опыте, кл/см3;
- среднее
арифметическое численности клеток водорослей в опыте, кл/см3;
![]() - среднее
арифметическое численности клеток водорослей в контроле, кл/см3.
- среднее
арифметическое численности клеток водорослей в контроле, кл/см3.
14.8.3. Вывод о наличии или отсутствии токсичности анализируемой пробы воды (водной вытяжки), бурового раствора или раствора вещества (смеси веществ) делают на основании величины Р. Анализируемая проба считается токсичной, если величина Р составляет 50% и менее.
14.8.4. Для количественной оценки токсичности пробы воды (водной вытяжки), бурового раствора устанавливают ее среднее эффективное разбавление за 72-96 ч или 7 сут биотестирования (ЭР50 за 72-96 ч или ЭР50 за 7 сут).
14.8.5. Для количественной оценки токсичности вещества (смеси веществ) устанавливают среднюю эффективную концентрацию за 72 ч или 7 сут биотестирования (ЭК50 за 72 ч или ЭК50 за 7 сут).
14.8.5. Расчет ЭР50 за 72 -96 ч (ЭР50 за 7 сут) или ЭК50 за 72 ч (ЭК50 за 7 сут) проводят в соответствии с приложением В.
14.9. Контроль воспроизводимости результатов определения токсичности
Контроль воспроизводимости результатов определения токсичности проводят в объеме 5% от количества текущих измерений.
Контроль воспроизводимости проводят по результатам двух определений токсичности анализируемой пробы воды (водной вытяжки), бурового раствора, водного раствора вещества (смеси веществ) полученных в условиях воспроизводимости (ЭР1, ЭР2) или (ЭК1, ЭК2).
Решение об удовлетворительности воспроизводимости определений принимается при условии:
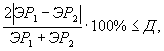
где Д - норматив оперативного контроля воспроизводимости составляет 45%.
15. МЕТОДИКА БИОТЕСТИРОВАНИЯ ПО ГИБЕЛИ РАКООБРАЗНЫХ ARTEMIA SALINA L.
15.1. Назначение и область применения
Настоящая «Методика...» устанавливает процедуру определения острой летальной токсичности природных морских вод; сточных вод разной солености; буровых растворов, сбрасываемых в морские воды, растворов отдельных веществ и их смесей в морской воде, морских донных отложений (водных вытяжек).
15.2. Принцип методики
15.2.1. Методика основана на установлении различия между количеством погибших личинок артемий - науплиусов в анализируемой пробе (опыт) и воде, которая не содержит токсических веществ (контроль).
15.2.2. Критерием острой летальной токсичности воды (водной вытяжки), раствора вещества (смеси веществ) является гибель 50% науплиусов и более в опыте по сравнению с контролем за 72 ч биотестирования, буровых растворов - за 96 ч биотестирования.
15.3. Характеристики погрешности измерений
Границы, в которых находится относительная погрешность определения токсичности по данной методике с заданной доверительной вероятностью Р=0,95, составляют ±37%.
Наибольшее возможное значение среднего квадратического отклонения случайной составляющей относительной погрешности определения токсичности по данной методике σ (δ) составляет 13%.
Характеристики погрешности установлены по результатам внутрилабораторного эксперимента с использованием эталонного вещества - калия двухромовокислого (К2Сr2О7).
Алгоритм установления характеристик погрешности методики приведен в приложении Б.
15.4. Средства измерений, вспомогательные устройства, материалы, реактивы
Применяют следующие средства измерений, вспомогательные устройства, материалы и реактивы:
- лампы дневного света;
- аквариумный микрокомпрес АЭН ТУ 16-064-011;
- оксиметр любого типа с погрешностью измерения не более 0,5 мг О2/дм3;
- прибор для измерения солености воды;
- рН-метр ГОСТ 25.7416.0171 или аналоги;
- осветитель;
- холодильник, поддерживающий температуру (4±2)°С;
- кристаллизаторы;
- бумагу фильтровальную по ГОСТ 12026;
- бумагу черную;
- пипетки мерные вместимостью 0,1; 1.0, 2,0 и 5,0 см3 по ГОСТ 29227, 2-го класса точности;
- пипетки пастеровские;
- стаканы химические вместимостью 50, 100 и 500 см3 по ГОСТ 25336;
- цилиндры мерные вместимостью 0,1; 0,5 и 1,0 см3 по ГОСТ 1770;
- чашки Петри;
- воду дистиллированную по ГОСТ 6709;
- калий двухромовокислый по ГОСТ 4220;
- калий хлористый по ГОСТ 4234;
- кальций хлористый по ТУ 6-09-4711;
- кислоту борную по ГОСТ 9656;
- магний хлористый по ГОСТ 4209;
- натрий углекислый по ГОСТ 4201;
- натрий сернокислый по ГОСТ 4166;
- натрий хлористый по ГОСТ 4233;
- соль морскую профессиональную (Wiegandt, производство Германия).
15.5. Условия выполнения биотестирования
15.5.1. Биотестирование проводят в помещении где не хранят и не работают с химическими веществами, не используют обработку помещений инсектицидами
15.5.2 Биотестирование проводят при температуре 20±2°С, освещении не более 1000 л к, естественном световом периоде.
15.5.3. Объем пробы воды (водной вытяжки), раствора вещества (смеси веществ) должен быть не менее 0,5 дм3, бурового раствора - 1,0 дм3.
15.5.4. Контрольная природная или искусственная вода должна иметь необходимую соленость, рН 8,0-8,5. До начала биотестирования контрольную воду аэрируют на протяжении 1-2 сут при помощи микрокомпрессора.
15.5.5. Науплиусы артемий для биотестирования должны быть в возрасте до 1 суток.
15.5.6. Плотность посадки науплиусов - 20 экземпляров на объем пробы 40-50 см3, при трех - пятикратной повторности.
15.5.7. Результаты биотестирования учитывают, если температура воздуха и пробы воды во время биотестирования составляла (20±2)°С, ЛК50 за 72ч К2Сr2О7 для науплисов артемий находилась в диапазоне его концентраций 6,5-8,0 мг/дм3, количество погибших науплиусов в контроле не превышало 10 %.
15.6. Подготовка к выполнению биотестирования
15.6.1. В качестве тест-объекта используют односуточных науплиусов ракообразных Artemia salina L.
Чтобы получить исходный материал для биотестирования 0,1 г сухих яиц артемий помещают в химический стакан объемом 500 см3 и заливают дехлорированной питьевой водой, которую предварительно отстаивают и аэрируют на протяжении суток. Через 30 мин, не взбалтывая содержимое стакана, сливают слой воды над яйцами, которые осели, удаляя таким образом погибшие яйца и пустые оболочки. Процедуру повторяют не менее трех раз. Затем отмытые яйца заливают морской водой необходимой солености, рН 8,0-8,5, с концентрацией кислорода не менее 7 мг/дм3 и при слабой аэрации выдерживают до выклева. Используют природную морскую воду, которая не содержит токсических веществ, или искусственную морскую воду (согласно п. 4.13 и п. 7.5.5.).
Предварительной адаптации артемий к нужной солености не проводят, так как рачек эвригалинный и может переносить соленость в широком диапазоне.
При аэрации и температуре воды (20 ± 2)°С выклев науплиусов происходит через 48 ч. При температуре 25°С - через 24 ч.
Науплиусы артемий в течение 3-4 сут после выклева из яиц не нуждаются в кормлении в связи с эндогенным питанием. Поэтому в эксперименте их не кормят.
15.6.2. Каждую новую партию яиц проверяют на выклев. Используют яйца при выклеве 60-90%. Для получения синхронизованного материала первых науплиусов тщательно отбирают укороченной пастеровской пипеткой, концентрируя их возле одной из стенок направленным источником света (новорожденные науплиусы имеют положительный фототаксис).
За час в стакане накапливаются новые науплиусы, их также переносят при помощи пипетки в отдельный сосуд с морской водой и используют для биотестирования.
15.6.3. Односуточных науплиев проверяют на пригодность к биотестированию. Для этого устанавливают среднюю летальную концентрацию за 72 ч биотестирования (ЛК50 за 72 ч) эталонного вещества калия двухромовокислого (К2Сr2О7). Готовят исходный раствор К2Сr2О7 с концентрацией 1 г/дм3, используя дистиллированную воду. Далее готовят серию растворов К2Сr2О7 с концентрациями от 4,0 до 10,0 мг/дм3, используя контрольную природную (из условно чистого района) или искусственную морскую воду. Биотестирование этих растворов проводят продолжительностью 72 ч в соответствии с процедурой, изложенной в 15.7. На основании полученных результатов рассчитывают ЛК50 за 72 ч для К2Сr2О7. Если найденная ЛК50 за 72 ч находится в диапазоне реагирования тест-объекта, который равен 6,5-8,0 мг/дм3 К2Сr2О7, науплиусы пригодны для биотестирования (существуют разные по чувствительности рассы артемий).
Если ЛК50 за 72 ч К2Сr2О7 не находится в указанном диапазоне реагирования, проверяют науплиусов артемий из новой порции яиц той же партии, или заменяют партию яиц.
15.7. Выполнение биотестирования
При биотестировании выполняют следующие операции.
15.7.1. В чашки Петри наливают по 40 см3 различных разбавлений исследуемых проб воды (водной вытяжки), бурового раствора или различные концентрации раствора вещества (смеси веществ) и контрольную воду.
15.7.2. В каждый из контрольных и опытных сосудов пастеровской пипеткой помещают по 20 науплиусов в возрасте до 1 сут. Повторность в контроле и опыте трехкратная. Контролем служит природная или искусственная морская вода необходимой солености.
15.7.3. Продолжительность биотестирования составляет 72 ч. На протяжении этого времени науплиусов не кормят. Биотестирование буровых растворов проводят 96 ч.
15.7.4. Подсчет науплиусов, которые выжили в контроле и опыте, проводят визуально на лабораторном столе под бинокуляром МБС - 9 или МБС - 10.
15.7.5. Особей считают живыми, если они свободно двигаются в толще воды или находятся вблизи дна, но при этом не перестают интенсивно двигать конечностями. Мертвых науплиусов удаляют.
15.8. Обработка и оценка результатов
15.8.1. На основании результатов трех параллельных определений количества живых науплиусов артемий в контроле и опыте находят средние арифметические количества живых науплиусов артемий в контроле (опыте) по формуле
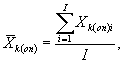 (15.1).
(15.1).
где:![]() - результат i-го измерения количества живых науплиусов артемий в
контроле (опыте);
- результат i-го измерения количества живых науплиусов артемий в
контроле (опыте);
i - номер измерения количества живых науплиусов артемий в контроле (опыте);
I - количество параллельных измерений количества живых науплиусов артемий в контроле (опыте); I = 3.
Рассчитывают в процентах количество погибших науплиусов артемий в опыте по отношению к контролю по формуле
![]() (15.2)
(15.2)
15.8.2. Вывод о наличии или отсутствии острой летальной токсичности пробы воды (водной вытяжки), бурового вещества или раствора вещества (смеси веществ) делают на основании величины А. Если величина А составляет 50% науплиусов и более, считают, что проба воды (водная вытяжка), буровой раствор или раствор вещества (смеси веществ) проявляет острую летальную токсичность. В этом случае для количественной оценки токсичности анализируемой пробы устанавливают ее среднее летальное разбавление за 72-96 ч биотестирования (ЛР50 за 72-96 ч).
Для количественной оценки токсичности вещества (смеси веществ) устанавливают среднюю летальную концентрацию вещества (смеси веществ) за 72 ч биотестирования (ЛК50 за 72 ч).
15.8.3. Установление ЛК50 за 72 ч (ЛР50 за 72-96 ч) проводят в соответствии с приложением В.
15.9. Контроль воспроизводимости результатов определения токсичности
Контроль воспроизводимости результатов определения токсичности проводят в объеме 5% от количества текущих измерений.
Контроль воспроизводимости проводят по результатам двух определений токсичности анализируемой пробы воды (водной вытяжки), бурового раствора или водного раствора вещества (смеси веществ), полученных в условиях воспроизводимости (ЛР1, ЛР2 или ЭК1, ЭК2).
Решение об удовлетворительности воспроизводимости определений принимается при условии:
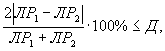
где Д - норматив оперативного контроля воспроизводимости составляет 45%.
16. МЕТОДИКА БИОТЕСТИРОВАНИЯ ПО ГИБЕЛИ РЫБ POECILLIA RETICULATA PETERS
16.1. Назначение и область применения
Настоящая «Методика...» устанавливает процедуру определения острой летальной токсичности природных морских вод; сточных вод разной солености; буровых растворов, сбрасываемых в морские воды, растворов отдельных веществ и их смесей в морской воде, морских донных отложений (водных вытяжек).
16.2. Принцип методики
16.2.1. Методика основана на установлении различия между количеством погибших рыб в анализируемой пробе (опыт) и воде, которая не содержит токсических веществ (контроль) - природная морская вода из условно чистого района или искусственная морская вода (п. 7.5.5).
16.2.2. Критерием острой летальной токсичности является гибель 50% рыб и более в опыте по сравнению с контролем за 96 ч биотестирования.
16.3. Характеристики погрешности измерений
Границы, в которых находится относительная погрешность определения токсичности по данной методике с заданной доверительной вероятностью Р=0,95, составляют 30%.
Наибольшее возможное значение среднего квадратического отклонения случайной составляющей относительной погрешности определения токсичности по данной методике σ (δ) составляет 15%.
Характеристики погрешности установлены по результатам внутрилабораторного эксперимента с использованием эталонного вещества - калия двухромовокислого (К2Сr2О7).
Алгоритм установления характеристик погрешности методики приведен в приложении Б.
16.4. Средства измерений, вспомогательные устройства, материалы, реактивы
Применяют следующие средства измерений, вспомогательные устройства, материалы и реактивы:
- аквариумы вместимостью 50 и 200 дм3;
- прибор для аэрации воды воздухом;
- прибор для измерения концентрации кислорода в воде (оксиметр);
- прибор для измерения солености воды;
- рН-метр;
- приспособление для термостатирования;
- весы лабораторные по ГОСТ 24104, 2-го класса точности с наибольшей массой взвешивания 200 г;
- термометр по ГОСТ 112 с ценой деления шкалы 1°С;
- холодильник, поддерживающий температуру (4±2)°С;
- колбы мерные вместимостью 0,5 и 1,0 дм3 по ГОСТ 1770, 2-го класса точности;
- бумагу фильтровальную по ГОСТ 12026;
- пипетки мерные вместимостью от 1 до 10 см3 по ГОСТ 29227, 2-го класса точности;
- посуду для транспортирования и хранения проб воды вместимостью 5 дм3;
- сачок для отлова рыбы;
- стеклянную палочку;
- цилиндры мерные вместимостью 0,1; 0,5 и 1,0 дм3 по ГОСТ 1770, 2-го класса точности;
- калий двухромовокислый по ГОСТ 4220;
- калий хлористый по ГОСТ 4234;
- кальций хлористый по ТУ 6-09-4711;
- кислоту борную по ГОСТ 9656;
- магний хлористый 6-водный по ГОСТ 4209;
- натрий углекислый по ГОСТ 4201;
- натрий сернокислый по ГОСТ 4166;
- натрий хлористый по ГОСТ 4233.
16.5. Условия выполнения биотестирования
16.5.1. Биотестирование проводят в помещении без вредных испарений и газов при рассеяном свете, естественной смене дня и ночи.
16.5.2. Объем пробы для определения острой летальной токсичности должен быть не менее 30 дм3.
16.5.3. Температура пробы воды (водной вытяжки), бурового раствора, водного раствора вещества (смеси веществ) при биотестировании должна равняться (25±1)°С, концентрация растворенного кислорода должна быть не менее 4 мг/дм3. Если концентрация растворенного кислорода меньше, воду аэрируют микрокомпрессором.
16.5.4. Для контроля и разбавления проб используют природную (из условно чистого района) или искусственную морскую воду (п. 7.5.5.).
16.5.5. Мальки гуппи должны находиться в возрасте 24- 48 ч.
16.5.6. Плотность посадки - 10 экземпляров рыб на 5 дм3. Повторность трехкратная.
16.5.7. Результаты учитывают, если при биотестировании концентрация растворенного кислорода была не менее 4 мг/дм3, температура пробы во время биотестирования составляла (24±1)°С, количество погибших рыб в контроле не превышало 10%, ЛК50 за 96 ч калия двухромовокислого (К2Сr2О7) для культуры гуппи находилась в интервале его концентраций 45-60 мг/дм3
16.6. Подготовка к выполнению биотестирования
16.6.1. В качестве тест-объекта используют культуру гуппи - Poecillia reticulata Peters в возрасте не старше 2 суток (24-48 ч).
Гуппи - широко распространенная аквариумная живородящая рыба. Выдерживает значительные колебания солености. Для биотестирования используют гуппи, адаптированных к различной солености. Изменение солености от 0 до 20%о гуппи переносят без адаптации. Постепенная адаптация к океанической солености занимает около двух недель (через два - три дня рыб переводят в воду с соленостью на 2-3%о выше).
Для содержания (культивирования) гуппи используют термостатированные аквариумы, обеспечивающие плотность посадки тест-объектов из расчета 1-2 дм3 воды на 1 экземпляр, производителей - не менее 4 дм3 на 1 экземпляр.
Аквариум заполняют отстоянной и проаэрированной в течение 7 сут природной или искусственной морской водой необходимой солености, рН 8,0-8,5, температура 25-27°С. Каждые три дня часть воды (1/4-1/5 часть) заменяют свежей. Первоначальный объем воды в аквариумах поддерживают, доливая дистиллированную воду вместо испарившейся и контролируя соленость с помощью солемера. Ил со дна аквариума убирают регулярно при помощи сифона.
Кроме рыб, в аквариум можно помещать зеленую водоросль рода энтероморфа, которая при хорошем освещении хорошо развивается и служит для гуппи укрытием и кормом.
Кормят гуппи 1-2 раза в сутки, производителей чаще, сухим (дафнии, циклопы) или живым кормом (мотыль, трубочник, дафнии, циклопы). Корм вносят в таком количестве, чтобы рыбы съедали его без остатка за 3-5 мин, так как излишки приводят к ухудшению качества воды в аквариуме. Особенно осторожно следует кормить рыб живыми дафниями и циклопами, которые в морской воде быстро погибают и могут служить источником сильного загрязнения.
Самцов и самок рекомендуется содержать в отдельных аквариумах. При совместном содержании самцы растут медленнее и имеют меньшие размеры. Половозрелые гуппи имеют хорошо развитые половые признаки, что облегчает их сортировку. Самцы, как правило, мельче (3-4 см) и имеют более яркую окраску, чем самки. У них преобладают серовато-коричневые тона с очень яркими красными, голубыми, зелеными и черными пятнами. Самки больше самцов, до 6 см в длину, чаще желтовато-зеленые. Анальный плавник у самок округлый. У молодых самцов он имеет ту же форму, но со временем, в период полового созревания, он начинает удлиняться и превращается в подвижный гоноподий.
Для получения молоди отбирают производителей не старше двух лет (продолжительность жизни гуппи в аквариумных условиях 3-3,5 года) и за три дня до постановки опытов помещают в общий аквариум для спаривания. Соотношение самцов и самок 2:1. Необходимо учитывать, что однажды оплодотворенная самка может нереститься несколько раз.
Самку готовят к нересту, помещая в отдельную термостатированную нерестовую емкость объемом не менее 4 дм3. Готовность самки к вымету мальков определяют по наличию хорошо заметного темного пятна перед анальным плавником. При этом форма брюшка приближается к прямоугольной и оно становится намного шире спины. После окончания нереста самок изолируют, так как они поедают потомство.
Мальки рождаются совершенно сформированными. Лучшим кормом для них является «пыль», состоящая из представителей разных морских организмов: инфузорий, коловраток, молоди ветвистоусых рачков и науплиусов веслоногих рачков. При отсутствии «пыли» молодь гуппи кормят перетертыми сухими дафниями или любым другим измельченным сухим кормом. На 100 рыб вносят не более 1 г сухого корма. По мере роста в рацион рыб вводят измельченный трубочник, мотыль, и другой живой корм. Одно-, двухнедельных мальков кормят до 5 раз в сутки, более взрослых 2-3 раза. Вносимые порции корма должны быть небольшими и поедаться рыбами в течение 3-5 мин.
Мальков сортируют по размерам и постепенно переводят из нерестовых аквариумов в выростные (вначале объемом 50 дм3, а затем - 200 дм3). С появлением первых признаков половых различий самцов отделяют от самок и продолжают выращивать в отдельных аквариумах. Мальки становятся половозрелыми в 4-6 месяцев.
При солености от 0 до 18-20 %о особых трудностей с выращиванием и размножением гуппи не возникает. Для тестирования морских вод с более высокой соленостью целесообразно получать исходный материал в пресной воде (или воде с соленостью до 18-20%о) с последующей адаптацией к более высокой солености.
16.6.2. Мальков гуппи в возрасте 24-48 ч проверяют на пригодность для биотестирования.
Для этого устанавливают среднюю летальную концентрацию за 96 ч биотестирования (ЛК50 за 96 ч) раствора эталонного вещества калия двухромовокислого (К2Сr2О7). Для этого готовят исходный раствор К2Сr2О7 с концентрацией 10 г/дм3, используя дистиллированную воду. Далее из исходного раствора готовят серию растворов с концентрациями К2Сr2О7 от 100 до 200 мг/дм3 с интервалом 25 мг/дм3, используя природную или искусственную морскую воду. Биотестирование этих растворов проводят продолжительностью 96 ч в соответствии с процедурой, изложенной в 16.7. На основании полученных результатов рассчитывают ЛК50 за 96 ч калия двухромовокислого.
Если полученная величина ЛК50 за 96 ч находится в экспериментально установленном диапазоне реагирования тест-объекта 45-60 мг/дм3 К2Сr2О7, гуппи пригодны для биотестирования.
Если ЛК50 за 96 ч К2Сr2О7 не находится в указанном диапазоне реагирования, то проверяют условия культивирования тест-объекта, чтобы выяснить причины ухудшения состояния культуры.
16.7. Выполнение биотестирования
16.7.1. Разбавления пробы воды (водной вытяжки), бурового раствора, исходного раствора вещества (смеси веществ) проводят прибавлением определенного объема исследуемой пробы воды (водной вытяжки), бурового раствора или исходного раствора вещества (смеси веществ) в природную или искусственную морскую воду определенной солености.
16.7.2. Анализируемую пробу наливают в аквариумы по 5 дм3 (опыт). Другие аквариумы наполняют таким же объемом природной или искусственной морской воды (контроль). Повторность в опыте и контроле трехкратная.
16.7.3. В каждый из опытных и контрольных аквариумов помещают по 10 экземпляров гуппи в возрасте от 24 до 48 ч.
16.7.4. Продолжительность биотестирования составляет 96 ч. Во время биотестирования рыб не кормят.
16.7.5. Ежедневно подсчитывают количество живых рыб и удаляют погибших. Погибшими считают рыб, которые не подают признаков движения или дыхания при прикосновении к ним стеклянной палочки.
16.8. Обработка и оценка результатов
16.8.1. На основании результатов трех параллельных определений количества живых рыб в контроле и опыте находят средние арифметические количества живых рыб в контроле (опыте) по формуле
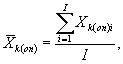 (16.1)
(16.1)
где:![]() - результат i-го измерения количества живых рыб в контроле
(опыте);
- результат i-го измерения количества живых рыб в контроле
(опыте);
i - номер измерения количества живых рыб в контроле (опыте);
I - количество параллельных измерений количества живых рыб в контроле (опыте); I=3.
Рассчитывают в процентах количество погибших рыб в опыте по отношению к контролю по формуле
![]() (16.2)
(16.2)
16.8.2. Вывод о наличии или отсутствии острой летальной токсичности пробы воды (водной вытяжки), бурового раствора или раствора вещества (смеси веществ) делают на основании величины А. Если величина А составляет 50% рыб и более, считают, что проба воды (водная вытяжка), бурового раствора или раствор вещества (смеси веществ) проявляет острую летальную токсичность. В этом случае для количественной оценки токсичности пробы воды (водной вытяжки), бурового раствора устанавливают ее среднее летальное разбавление за 96 ч биотестирования (ЛР50 за 96 ч).
Для количественной оценки токсичности вещества (смеси веществ) устанавливают среднюю летальную концентрацию вещества (смеси веществ) за 96 ч биотестирования (ЛК50 за 96 ч).
16.8.3. Расчет ЛК50 за 96 ч (ЛР50 за 96 ч) проводят в соответствии с приложением В.
16.9. Контроль воспроизводимости результатов определения токсичности
Контроль воспроизводимости результатов определения токсичности проводят в объеме 5% от количества текущих измерений.
Контроль воспроизводимости проводят по результатам двух определений токсичности пробы воды (водной вытяжки), бурового раствора, водного раствора вещества (смеси веществ), полученных в условиях воспроизводимости ЛР1, ЛР2 или ЛК1, ЛК2 или ЛР1 ЛР2.
Решение об удовлетворительности воспроизводимости определений принимается при условии:
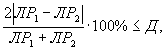
где Д - норматив оперативного контроля воспроизводимости составляет 52%.
ПРИЛОЖЕНИЯ
Приложение А
Термины и определения
В настоящем Руководстве используются следующие термины и определения.
Биологическое тестирование воды (водной вытяжки раствора химического вещества) - экспериментальное определение токсичности воды (водной вытяжки, раствора химического вещества) по изменению определенного показателя жизнедеятельности тест-объекта.
Воспроизводимость результатов биотестирования - характеристика качества биотестирования, отражающая близость результатов, полученных по одной методике, на одном и том же эталонном веществе, но в различных условиях (разными операторами или в разных лабораториях, или в разное время).
Диапазон реагирования тест-объекта - нормированный интервал концентраций, в котором находится средняя летальная или средняя эффективная концентрация эталонного вещества.
Загрязняющее воду вещество, загрязняющее вещество - вещество в воде, вызывающее нарушение норм качества воды. ГОСТ 17.1.1.01-77.
Исходный раствор - концентрированный водный раствор исследуемого вещества, из которого готовят растворы с разными концентрациями этого вещества.
Качество воды - характеристика состава и свойств воды, определяющая ее пригодность для конкретных видов водопользования. ГОСТ 17.1.1.01-77.
Концентрация средняя летальная (JIK50) - концентрация токсического вещества, вызывающая гибель 50 % тест-объекта при установленных условиях экспозиции в течение заданного срока наблюдений.
Концентрация средняя эффективная (ЭК50) - концентрация токсического вещества, вызывающая изменение тест-реакции на 50 % при установленных условиях экспозиции в течение заданного срока наблюдений.
Критерий токсичности - установленное значение изменения выбранного показателя жизнедеятельности тест-объекта, на основании которого делают вывод о токсичности тестируемого объекта.
Острая токсичность - токсичность воды (водной вытяжки, раствора химического вещества), проявляющаяся вследствие кратковременного воздействия токсического вещества.
Острая летальная токсичность воды - летальная токсичность воды, (водной вытяжки, раствора химического вещества), обусловленная кратковременным воздействием токсического вещества.
Показатель жизнедеятельности водного организма - морфологическая, физиологическая, биохимическая или другая характеристика состояния водного организма.
Предельно допустимый сброс - масса вещества в сточных водах, максимально допустимая к отведению с установленным режимом в данном пункте водного объекта в единицу времени с целью обеспечения норм качества воды в контрольном пункте. ГОСТ 17.1.1.01-77.
Сточная вода - вода, сбрасываемая в установленном порядке в водные объекты после ее использования или поступившая с загрязненной территории. Водный кодекс Российской Федерации, ст. 1.
Сходимость результатов биотестирования - характеристика качества биотестирования, которая отражает близость результатов, полученных по одной методике, на одном и том же эталонном веществе, в одинаковых условиях (в одной лаборатории, одним и тем же оператором, в одно и то же время).
Тест-объект - водный(ые) организм(ы), чувствительный(е) к действию токсических веществ и специально подготовленный(е) в лабораторных условиях к биотестированию.
Тест-реакция - изменение выбранного показателя жизнедеятельности тест-объекта под воздействием токсического вещества.
Токсическое вещество - вещество, способное в определенной концентрации вызывать патологические изменения или гибель водных организмов.
Токсичность - свойство воды (водной вытяжки, раствора химического вещества), обусловленное наличием в ней токсических веществ и характеризующее ее способность нарушать жизнедеятельность водных организмов.
Токсический эффект - результат воздействия токсиканта на водный организм, проявляющийся в изменении показателей его жизнедеятельности.
Уровень токсичности воды (водной вытяжки, раствора химического вещества) - количественная характеристика токсичности воды (водной вытяжки, раствора химического вещества), определяемая через минимальную кратность разбавления, при котором токсичность воды уже не проявляется.
Приложение Б
Алгоритм установления характеристик погрешности методик биотестирования
Метрологические характеристики методик биотестирования устанавливают в ходе экспериментальных исследований в соответствии с требованиями методики на растворах эталонных веществ с известными токсическими свойствами.
Для установления метрологических характеристик методик биотестирования в условиях межлабораторного эксперимента в каждой из лабораторий-участниц (К - количество лабораторий-участниц) каждым из исполнителей (Lk - количество исполнителей в k-той лаборатории) получают серии из Nkl результатов Xkln в условиях сходимости на каждом из эталонных веществ.
Б.1. Сходимость устанавливают по Nkl результатам каждой из KL серий самостоятельных экспериментов, проведенных в каждой из K лабораторий каждым из L исполнителей, для чего эти результаты проверяют на наличие грубой погрешности по одному из известных критериев. Результаты с грубой погрешностью отбрасывают и по оставшимся данным вычисляют значение среднего результата Хkl и его среднее квадратичное отклонение (СКО) по формулам
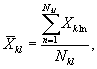 (Б.1)
(Б.1)
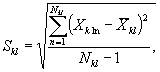 (Б.2)
(Б.2)
![]() (Б.3)
(Б.3)
где k - номер лаборатории-участницы межлабораторного эксперимента, k=1,..., К;
l - номер исполнителя (серии), l = 1,..., Lk (L > 2);
n - номер эксперимента в серии, n = 1,..., Nki,
Xkln - результат эксперимента n в серии l лаборатории k;
fkl - число степеней свободы, по которым вычисляют значение Skl.
Полученные значения выборочных СКО проверяют на соответствие одной генеральной совокупности с помощью критерия Фишера. Для чего рассчитывают величину Fkl по формуле
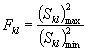 (Б.4)
(Б.4)
и сравнивают ее с табличным значением критерия Фишера для соответствующего числа степеней свободы. Значения Fтaбл. приведены в таблице Б.1.
Если Fkl > Fтабл, то соответствующее СКО (Skl)max или (Skl)min, которое приводит к превышению Fkl над Fтабл., из дальнейших расчетов исключают. Процедуру сравнения (Skl)max (Skl)min осуществляют до тех пор, пока не будет справедливым Fkl < Fтабл.
Причем общее количество результатов (после отбрасывания результатов с грубой погрешностью) должно удовлетворять условию
![]()
Далее все не исключенные по критерию Фишера выборки результатов полагают однородными и по ним вычисляют СКО, которое характеризует сходимость результатов, по формулам
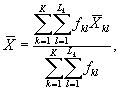 (Б.5)
(Б.5)
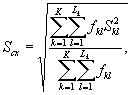 (Б.6)
(Б.6)
![]() (Б.7)
(Б.7)
Таблица Б.1
Значения F в зависимости от степеней свободы f1 i f2 для Р=0,95
|
f2 |
f1=2 |
4 |
8 |
12 |
16 |
20 |
24 |
50 |
¥ |
|
2 |
19,0 |
19,2 |
19,4 |
19,4 |
19,4 |
19,4 |
19,4 |
19,5 |
19,5 |
|
4 |
6,9 |
6,4 |
6,0 |
5,9 |
5,8 |
5,8 |
5,8 |
5,7 |
5,6 |
|
6 |
5,1 |
4,5 |
4,2 |
4,0 |
3,9 |
3,9 |
3,8 |
3,8 |
3,7 |
|
8 |
4,5 |
3,8 |
3,4 |
3,3 |
3,2 |
3,2 |
3,1 |
3,0 |
2,9 |
|
10 |
4,1 |
3,5 |
3,1 |
2,9 |
2,8 |
2,8 |
2,7 |
2,6 |
2,5 |
|
12 |
3,9 |
3,3 |
2,8 |
2,7 |
2,6 |
2,5 |
2,5 |
2,4 |
2,3 |
|
14 |
3,7 |
3,1 |
2,7 |
2,5 |
2,4 |
2,4 |
2,4 |
2,2 |
2,1 |
|
16 |
3,6 |
3,0 |
2,6 |
2,4 |
2,3 |
2,3 |
2,2 |
2,1 |
2,0 |
|
18 |
3,6 |
2,9 |
2,5 |
2,3 |
2,2 |
2,2 |
2,2 |
2,0 |
1,9 |
|
20 |
3,5 |
2,9 |
2,4 |
2,3 |
2,2 |
2,1 |
2,1 |
2,0 |
1,8 |
|
30 |
3,3 |
2,7 |
2,3 |
2,1 |
2,0 |
1,9 |
1,9 |
1,8 |
1,6 |
|
60 |
3,2 |
2,5 |
2,1 |
1,9 |
1,8 |
1,8 |
1,7 |
1,6 |
1,4 |
|
120 |
3,1 |
2,4 |
2,0 |
1,8 |
1,7 |
1,6 |
1,6 |
1,4 |
1,2 |
|
|
3,0 |
2,4 |
1,9 |
1,8 |
1,6 |
1,6 |
1,5 |
1,4 |
1,0 |
Для равного количества экспериментов N в каждой из L серий формулы (Б.5)-(Б.7) соответственно переходят в следующие:

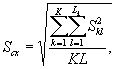
![]()
Сходимость ![]() или
или ![]() Scx методики биотестирования на данном
эталонном веществе рассчитывают по формулам
Scx методики биотестирования на данном
эталонном веществе рассчитывают по формулам
![]()
![]() (Б.8)
(Б.8)
где ![]() - коэффициент,
учитывающий смещенность оценки СКО.
- коэффициент,
учитывающий смещенность оценки СКО.
Значения коэффициента ![]() приведены в таблице
Б.2.
приведены в таблице
Б.2.
Подобные вычисления выполняют для каждого эталонного
вещества. По вычисленным значениям сходимости (в процентах) на разных эталонных
веществах устанавливают сходимость методики биотестирования ![]() Причем, если проверка
по критерию Фишера показала однородность соответствующих СКО, то сходимость
методики биотестирования вычисляют как средневзвешенное значений сходимости на
эталонных веществах по формуле
Причем, если проверка
по критерию Фишера показала однородность соответствующих СКО, то сходимость
методики биотестирования вычисляют как средневзвешенное значений сходимости на
эталонных веществах по формуле
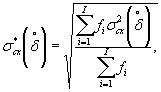 (Б. 9)
(Б. 9)
где i - номер эталонного вещества, i = 1,..., I;
I - количество эталонных веществ.
Если проверка по критерию Фишера показала неоднородность соответствующих СКО, то за сходимость методики биотестирования принимают наибольшее из вычисленных значений сходимости на эталонных веществах.
Б.2. Для оценивания внутрилабораторной воспроизводимости вычисляют средние значения для каждой из К лабораторий и соответствующие СКО по формулам
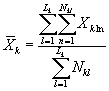 ,
(Б.10)
,
(Б.10)
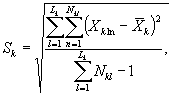 (Б.11)
(Б.11)
![]() (Б.12)
(Б.12)
Полученные значения выборочных СКО проверяют на соответствие одной генеральной выборке по критерию Фишера и по не исключенным данным вычисляют СКО, которое характеризует внутрилабораторную воспроизводимость, по формулам
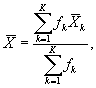 (Б.13)
(Б.13)
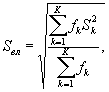 (Б.14)
(Б.14)
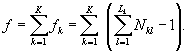 (Б.15)
(Б.15)
Таблица Б.2
Значения γ(f) в зависимости от числа степеней свободы
|
f |
γ(f) |
f |
γ(f) |
|
1 |
1,253 |
15 |
1,017 |
|
2 |
1,128 |
16 |
1,016 |
|
3 |
1,085 |
17 |
1,015 |
|
4 |
1,064 |
18 |
1,014 |
|
5 |
1,051 |
19 |
1,013 |
|
6 |
1,042 |
20 |
1,013 |
|
7 |
1,037 |
25 |
1,010 |
|
8 |
1,032 |
30 |
1,008 |
|
9 |
1,028 |
35 |
1,007 |
|
10 |
1,025 |
40 |
1,006 |
|
11 |
1,023 |
45 |
1,006 |
|
12 |
1,021 |
50 |
1,005 |
|
13 |
1,019 |
60 |
1,004 |
|
14 |
1,018 |
|
|
При условии равного количества данных в сериях формулы (Б.13)-(Б.15) трансформируются в следующие:
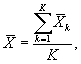
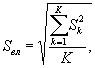
![]()
Внутрилабораторную воспроизводимость ![]() или
или ![]() методики
биотестирования на данном эталонном веществе рассчитывают по формулам
методики
биотестирования на данном эталонном веществе рассчитывают по формулам
![]()
![]() (Б.16)
(Б.16)
Подобные вычисления выполняют для каждого из
эталонных веществ. По вычисленным значениям внутрилабораторной воспроизводимости
(в процентах) на разных эталонных веществах устанавливают внутрилабораторную
воспроизводимость методики биотестирования ![]() Причем, если проверка
по критерию Фишера показала однородность соответствующих СКО, то внутрилабораторную
воспроизводимость методики биотестирования вычисляют как средневзвешенное
значений внутрилабораторной воспроизводимости на эталонных веществах по формуле
Причем, если проверка
по критерию Фишера показала однородность соответствующих СКО, то внутрилабораторную
воспроизводимость методики биотестирования вычисляют как средневзвешенное
значений внутрилабораторной воспроизводимости на эталонных веществах по формуле
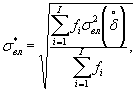 (Б.17)
(Б.17)
где i - номер эталонного вещества, i = 1,..., I;
I - количество эталонных веществ.
Если проверка по критерию Фишера показала неоднородность соответствующих СКО, то за внутрилабораторную воспроизводимость методики биотестирования принимают наибольшее из вычисленных значений внутрилабораторной воспроизводимости на эталонных веществах.
Б.3. Для оценивания межлабораторной воспроизводимости
вычисляют среднее значение ![]() по всем лабораториям
и соответствующее СКО по формуле
по всем лабораториям
и соответствующее СКО по формуле
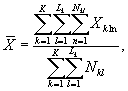 (Б.18)
(Б.18)
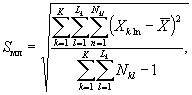 (Б.19)
(Б.19)
![]() (Б.20)
(Б.20)
Межлабораторную воспроизводимость ![]() или
или ![]() методики
биотестирования на данном эталонном веществе вычисляют по формулам
методики
биотестирования на данном эталонном веществе вычисляют по формулам
![]()
![]() (Б.21)
(Б.21)
Погрешность определения токсичности по методике биотестирования вычисляют по формуле
![]() (Б.22)
(Б.22)
Подобные вычисления выполняют для каждого из
эталонных веществ. По вычисленным значениям межлабораторной воспроизводимости (в
процентах) на разных эталонных веществах устанавливают межлабораторную
воспроизводимость методики биотестирования ![]() Причем, если проверка
по критерию Фишера показала однородность соответствующих СКО, то
межлабораторную воспроизводимость методики биотестирования вычисляют как
средневзвешенное значений межлабораторной воспроизводимости на эталонных
веществах по формуле
Причем, если проверка
по критерию Фишера показала однородность соответствующих СКО, то
межлабораторную воспроизводимость методики биотестирования вычисляют как
средневзвешенное значений межлабораторной воспроизводимости на эталонных
веществах по формуле
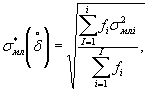 (Б.23)
(Б.23)
где i - номер эталонного вещества, i = 1,..., I;
I - количество эталонных веществ.
Если проверка по критерию Фишера показала неоднородность соответствующих СКО, то за внутрилабораторную воспроизводимость методики биотестирования принимают наибольшее из вычисленных значений внутрилабораторной воспроизводимости на эталонных веществах.
Приложение В
Установление средней эффективной (летальной) концентрации токсического вещества (смеси веществ) и среднего эффективного (летального) разбавления воды (водной вытяжки), бурового раствора
Среднюю эффективную (летальную) концентрацию ЭК50 (ЛК50) или среднее эффективное (летальное) разбавление ЭР50 (ЛР50) устанавливают графическим способом (рис. В.1). На оси абсцисс откладывают десятичные логарифмы величин концентраций вещества (разбавлений пробы воды или водной вытяжки, бурового раствора), а на оси ординат - проценты изменения тест-реакции (гибели тест-объектов) по отношению к контролю, которые переводят в пробиты (табл. В.1). Через полученные точки проводят прямую. Потом из точки на оси ординат, которая соответствует 5 пробитам (50%), проводят линию, параллельную оси абсцисс, до пересечения с линией графика. Из точки пересечения опускают перпендикуляр на ось абсцисс. Точке пересечения перпендикуляра и оси абсцисс соответствует десятичный логарифм ЭК50 (ЛК50) или ЭР50 (ЛР50). По логарифму находят значение ЭК50 (ЛК50) в мг/дм3 или ЭР50 (ЛР50) в процентах или безразмерных величинах (в кратности разбавления, долях и др.).
Таблица В.1
Пробитные величины
|
Процент изменения тест-реакции |
Пробиты |
Процент изменения тест-реакции |
Пробиты |
|
1 |
2 |
3 |
4 |
|
1 |
2,67 |
32 |
4,53 |
|
2 |
2,95 |
33 |
4,56 |
|
3 |
3,12 |
34 |
4,59 |
|
4 |
3,25 |
35 |
4,61 |
|
5 |
3,35 |
36 |
4,64 |
|
6 |
3,45 |
37 |
4,67 |
|
7 |
3,52 |
38 |
4,69 |
|
8 |
3,59 |
39 |
4,72 |
|
9 |
3,66 |
40 |
4,75 |
|
10 |
3,72 |
41 |
4,77 |
|
11 |
3,77 |
42 |
4,80 |
|
12 |
3,83 |
43 |
4,82 |
|
13 |
3,87 |
44 |
4,84 |
|
14 |
3,92 |
45 |
4,87 |
|
15 |
3,96 |
46 |
4,90 |
|
16 |
4,01 |
47 |
4,92 |
|
17 |
4,05 |
48 |
4,95 |
|
18 |
4,08 |
49 |
4,97 |
|
19 |
4,12 |
50 |
5,00 |
|
20 |
4,16 |
51 |
5,03 |
|
21 |
4,19 |
52 |
5,05 |
|
22 |
4,22 |
53 |
5,08 |
|
23 |
4,26 |
54 |
5,10 |
|
24 |
4,29 |
55 |
5,13 |
|
25 |
4,33 |
56 |
5,15 |
|
26 |
4,36 |
57 |
5,18 |
|
27 |
4,39 |
58 |
5,20 |
|
28 |
4,42 |
59 |
5,23 |
|
29 |
4,45 |
60 |
5,25 |
|
30 |
4,48 |
61 |
5,28 |
|
31 |
4,50 |
62 |
5,31 |
|
63 |
5,33 |
82 |
5,92 |
|
64 |
5,36 |
83 |
5,95 |
|
65 |
5,39 |
84 |
5,99 |
|
66 |
5,41 |
85 |
6,04 |
|
67 |
5,44 |
86 |
6,08 |
|
68 |
5,47 |
87 |
6,13 |
|
69 |
5,50 |
88 |
6,18 |
|
70 |
5,52 |
89 |
6,23 |
|
71 |
5,55 |
90 |
6,28 |
|
72 |
5,58 |
91 |
6,34 |
|
73 |
5,61 |
92 |
6,41 |
|
74 |
5,64 |
93 |
6,48 |
|
75 |
5,67 |
94 |
6,55 |
|
76 |
5,71 |
95 |
6,64 |
|
77 |
5,74 |
96 |
6,75 |
|
78 |
5,77 |
97 |
6,88 |
|
79 |
5,81 |
98 |
7,05 |
|
80 |
5,84 |
99 |
7,32 |
|
81 |
5,88 |
|
|
а)
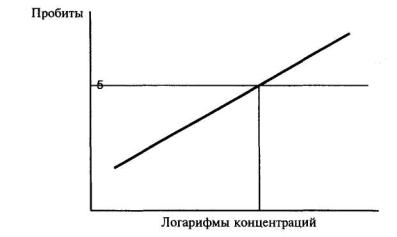
б)
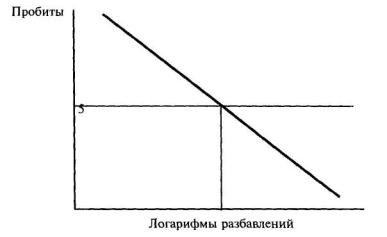
Рис. B.1. Установление графическим способом
(а) эффективной (летальной) концентрации вещества (смеси веществ) и (б) среднего эффективного (летального) разбавления воды (водной вытяжки), бурового раствора
Приложение Г
Форма протокола биотестирования_____________________________________________________________________________ (название Министерства, ведомства, если необходимо) _____________________________________________________________________________ (название организации, структурным подразделением которой является лаборатория, если необходимо) ______________________________________________________________________________ (название лаборатории, аттестованной на право проведения измерений; аттестат аккредитации №_____ от ____ ) ______________________________________________________________________________ (адрес лаборатории, телефон, факс) Протокол биотестирования № ___ от _______Наименование заказчика ________________________________________________________ Основание для проведения работ _________________________________________________ Наименование объекта контроля __________________________________________________ Дата, время, место отбора пробы __________________________________________________ Дата поступления пробы в лабораторию____________________________________________ Вид пробы_____________________________________________________________________
Заведующий лабораторией______________________________________________________ (подпись, Ф.И.О.)
|
Приложение Д
Разработчики методик «руководства по определению методом биотестирования токсичности вод, донных отложений, загрязняющих веществ и буровых растворов»
Артюхова В.И., канд. биол. наук (раздел 9);
Божко Т.В. (разделы 10-12, приложение В);
Гроздов А.О., канд. биол. наук (раздел 15);
Губарь Т.В. (разделы 4, 10-12, приложение В);
Дмитриева А.Г., канд. биол. наук (раздел 9);
Дятлов С.Е., канд. биол. наук (разделы 14, 15);
Жмур Н.С., канд. биол. наук (разделы 11, 12);
Зоммер Е.А., канд. биол. наук (раздел 10);
Исакова Е.Ф., канд. биол. наук (раздел 10);
Калиниченко Е.А. (приложение Б);
Котко Л.О. (разделы 4, 10-12, приложение В);
Крайнюкова А.Н., д-р биол. наук (разделы 1 - 15, приложения А, Г);
Красовский Г.М., д-р мед. наук (раздел 10);
Кузнецов А.М. (раздел 7);
Кузьмич В.Н., канд. биол. наук (разделы 1-3, приложение А);
Лесников Л.А., канд. биол. наук (раздел 10);
Новосадова Т.Г., канд. биол. наук (разделы 8, 10);
Петросян А.Г., канд. биол. наук (разделы 14, 15);
Сальников М.В., канд. техн. наук (раздел 7)
Соколова С.А., канд. биол. наук (разделы 4, 13, 14-16);
Старцева А.И. (разделы 9, 10, 11, 14, 15);
Ткаченко Г.Н. (раздел 9);
Ульянова И.П. (разделы 4, 7-9, 14, 15);
Усенко О.В., канд. биол. наук (разделы 7, 8);
Федотов А.С., канд. вет. наук (раздел 13, 16);
Флеров Б.А., д-р биол. наук (разделы 11, 12);
Хоружая Т.А., д-р биол. наук (разделы 1-3, 9-10);
Шадрина Л.А., канд. биол. наук (разделы 14, 15);
Шипилова И.Г. (разделы 1, приложение Г);
Щербань Э.П., канд. биол. наук (раздел 10).
Ответственные исполнители Руководства выражают благодарность Е.Н. Ладейщиковой за помощь, оказанную при подготовке Руководства.