|
УТВЕРЖДАЮ Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации _____________ А.Ю. Попова 2 июля 2019 г. |
1.2. ОБЩИЕ ВОПРОСЫ. ГИГИЕНА, ТОКСИКОЛОГИЯ, САНИТАРИЯ
Подходы к обоснованию биологической профилактики
вредного воздействия металлсодержащих наночастиц
Методические
рекомендации
МР 1.2.0147-19
I. Область применения
1.1. В настоящих методических рекомендациях (далее - методические рекомендации) представлен рекомендуемый порядок обоснования, разработки и экспериментальной апробации способов биологической профилактики вредных эффектов действия металлсодержащих наночастиц, воздействие которых на человека возникает либо в производстве и применении соответствующих наноматериалов, либо в связи с аэрозольным загрязнением воздуха рабочих помещений и атмосферного воздуха при различных пирометаллургических и химических технологиях.
1.2. Методические рекомендации предназначены для специалистов органов и организаций Роспотребнадзора, а также могут быть использованы другими заинтересованными лицами и организациями.
II. Общие положения
2.1. Методические рекомендации разработаны с целью решения задач повышения резистентности организма человека к вредному действию металлсодержащих наночастиц с помощью комплекса безвредных биологически активных средств (далее -биопротекторов).
2.2. Сфера воздействия наночастиц (далее - НЧ) металлов и их оксидов на человека не ограничивается производством и применением специальных наноматериалов. Она распространяется на ряд давно существующих отраслей промышленности: в составе аэрозолей конденсации обычно имеется наряду с химически идентичными или близкими по составу микрометровыми частицами (далее - МЧ) значительная фракция ультратонких металлсодержащих частиц, включающая наноразмерную субфракцию.
2.3. Токсичность (включая генотоксичность и предполагаемую канцерогенность) НЧ в целом значительно выше токсичности соответствующих МЧ [1].
2.4. Существует принципиальная возможность снижения рисков для здоровья, связанных с воздействием металлсодержащих НЧ, путем повышения резистентности организма к их цитотоксичности, органо-системной токсичности и генотоксичности с помощью средств биологической профилактики [2 - 6].
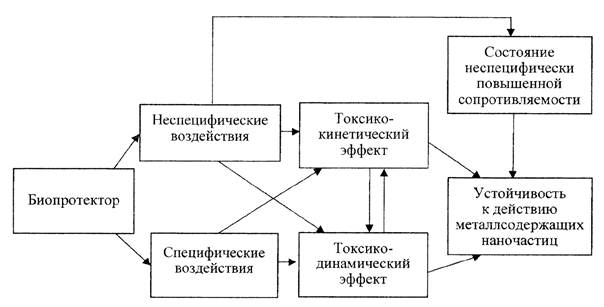
2.5. Токсикокинетический и токсикодинамический эффекты биопротекторов взаимообусловлены (рис. П1.1 в приложении 1 к настоящим методическим рекомендациям):
- снижение дозы яда в органе-мишени приводит к снижению интенсивности патологического процесса;
- повышение резистентности приводит к снижению токсического повреждения клеток и органов, контролирующих процессы элиминации вещества в организме.
2.6. Как токсикодинамические, так и токсикокинетические биопротекторы могут быть:
- специфичными по отношению к конкретному металлу, действуя на свойственные именно ему ключевые звенья развития интоксикации;
- направленными на механизмы, существенные в токсикокинетике и/или токсикодинамике большой группы токсичных НЧ (антиоксидантное, противорадикальное, мембраностабилизирующее действие);
- преимущественно неспецифичными, если их защитный эффект реализуется на организменном уровне по типу состояния неспецифически повышенной сопротивляемости (например, адаптогены различного происхождения).
III. Выбор биопротекторов для испытания
3.1. Системный подход к поиску биопротекторов направлен на использование:
- «токсикокинетических биопротекторов», нацеленных на повышение эффективности естественных механизмов элиминации наночастиц и/или продуктов их растворения «in vivo» и тем самым на снижение задержки токсичного металла в организме и в органах-мишенях;
- «токсикодинамических биопротекторов», нацеленных на ослабление первичных механизмов токсичности (например, свободно-радикального оксидативного стресса), повышение функциональных резервов организма, использование физиологических и токсикологических антагонизмов;
- «специфичных биопротекторов», специфичных по отношению к конкретному металлу, действующих на свойственные именно ему ключевые звенья развития интоксикации; либо направленными на механизмы, которые существенны в токсикокинетике и/или токсикодинамике большой группы НЧ;
- «неспецифичных биопротекторов», защитный эффект которых реализуется по типу состояния неспецифически повышенной сопротивляемости, характеризующегося повышением реактивности и эффективности различных защитных и компенсаторных механизмов (адаптогены) [8].
3.2. Сочетание двух или более биопротекторов с не полностью совпадающими точками приложения и неодинаковыми механизмами действия является более эффективным, чем их изолированное применение [9].
3.3. Действие однонаправленных биопротекторов не суммируется, и выбор следует сделать в пользу тех из них, которые обладают наибольшей эффективностью защиты от действия конкретного токсиканта [9].
3.4. При любом токсическом воздействии комплекс биопротекторов, точки приложения и механизмы защитного действия которых не идентичны, дает более выраженный профилактический эффект: наиболее целесообразен теоретически обоснованный подбор многокомпонентных «биопрофилактических комплексов» (далее - БПК).
3.5. При выборе биопротекторов необходимо рассматривать средства, которые имеют разрешение на применение в практике в установленном порядке.
IV. Экспериментальное моделирование токсичности
металлсодержащих
наночастиц и ее ослабления действием биопротекторов
4.1. Наночастицы металлов или их оксидов, в отношении которых проводится поиск средств биологической профилактики, должны иметь охарактеризованные свойства (форма, размеры, химический состав, растворимость в биологических средах), соответствующие наночастицам в реальных промышленных условиях (рекомендации представлены в приложении 2 к настоящим методическим рекомендациям),
4.2. Оборудование для проведения токсикологических, биохимических и морфологических исследований должно эксплуатироваться в соответствии с техническим паспортом и инструкцией по применению, своевременно проходить метрологический контроль и калибровку в установленном порядке.
4.3. Необходимо обеспечить точность дозировки наночастиц (для парентерального, внутрижелудочного введений, интратрахеальных инстилляций - стабильные наносуспензии с контролируемой минимальной агрегацией частиц; для ингаляционного воздействия наноаэрозолей - установки типа «только нос» с автоматически регулируемыми и контролируемыми параметрами экспозиции).
4.4. Животные должны содержаться в условиях, соответствующих СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)».
4.5. Оптимальным видом подопытных животных для проведения экспериментов являются лабораторные белые крысы возрастом от 3 до 4 месяцев.
4.6. Выбор пути введения НЧ в организм определяется достижимостью при нем указанного совпадения дозы и режима экспозиции.
4.7. При любом способе экспозиции к НЧ в эксперимент рекомендуется вводить одновременно и наблюдать параллельно 4 группы крыс:
- первая - контрольная (получающая «пустые» экспозиции - введение жидкости-носителя, на которой готовилась суспензия НЧ, или помещение в затравочную камеру, аналогичную основной, но с подачей чистого воздуха);
- вторая подвергается воздействию НЧ;
- третья - такому же воздействию на фоне или после периода воздействия БПК;
- четвертая - соответствующего по режиму воздействия БПК без НЧ.
4.8. Экспозиции к НЧ крыс второй и третьей группы необходимо проводить параллельно во времени при условии строгого совпадения показателей дозы и режима экспозиций.
4.9. Экспериментальное моделирование субхронической и хронической интоксикации:
а) суспензии НЧ вводят до 3 раз в неделю внутрибрюшинно объемом до 4 мл при дозах токсичных НЧ, эквивалентных 0,1 от предварительно оцененной ЛД50 при однократном в/б введении, а при относительно низкой токсичности и невозможности определить ЛД50 - около 2 мг на крысу (все вышеприведенные дозировки могут корректироваться с учетом наблюдений за состоянием животных в течение первой недели экспозиции).
В случае, если отсутствуют данные изучения конкретного вида НЧ, рекомендуется провести 2-недельный пилотный эксперимент (чтобы убедиться, что указанная дозировка не является ни слишком низкой и вызывает сдвиги хотя бы части показателей по отношению к контрольным значениям, ни слишком высокой и не вызывает гибели части животных).
Повторное внутрижелудочное введение суспензий НЧ применимо, но интенсивность пенетрации их из желудочно-кишечного тракта в кровь зависит от многих трудноконтролируемых условий, что делает менее надежным соблюдение требования равенства дозировки НЧ в группах. Хроническая ингаляционная экспозиция крыс к наноаэрозолям также может использоваться лишь при условии равенства экспозиций.
б) длительность эксперимента 5 - 7 недель. Оцениваемые эффекты могут использоваться для прогнозирования хронической токсичности наноматериалов и ее ослабления на фоне действия биопротекторов.
4.10. Экспериментальное моделирование реакции организма на отложение НЧ в глубоких отделах дыхательных путей крысы:
- однократное интратрахеальное введение 1 мл водной суспензии, содержащей нановещество (при размере нановещества до 50 нм вводится менее 2 мг суспензии; при размере нановещества свыше 50 нм вводится более 2 мг суспензии) на 1 животное;
- биопротекторы даются крысам на протяжении месяца перед введением наночастиц;
- бронхоальвеолярную жидкость (далее - БАЛЖ) получают для исследования через 24 часа после введения наночастиц.
4.11. Биопротекторы вводятся перорально (предпочтительно с питьем или кормом), пример дозировки и способа назначения биопротекторов дан в приложении 3. Пример использования метода приведен в приложении 4.
V. Оценка эффективности биопрофилактического комплекса
5.1. Оценка эффектов подострого и хронического воздействия наночастиц на системно-организменном уровне проводится с использованием как можно более широкого набора показателей и тестов из числа принятых в общей профилактической токсикологии. Рекомендуемый перечень показателей интоксикации включает в себя следующие:
- динамика массы тела и массовые коэффициенты внутренних органов;
- оценка способности центральной нервной системы к суммации подпороговых импульсов (по так называемому суммационно-пороговому показателю) [10];
- оценка активности исследовательского поведения по числу заглядываний в отверстия специальной доски («норковый рефлекс»);
- сбор суточной мочи для учета объема диуреза, измерения плотности, концентрации креатинина, дельта-аминолевулиновой кислоты, копропорфирина;
- взятие проб капиллярной крови для оценки числа эритроцитов, ретикулоцитов, содержания гемоглобина, числа лейкоцитов и лейкоцитарной формулы и для цитохимического определения активности сукцинатдегидрогеназы лимфоцитов, служащей интегральным показателем напряженности энергетического метаболизма на организменном уровне;
- определение в крови, собранной при забое крыс, важнейших биохимических показателей (общий белок, альбумин, глобулины, билирубин, церулоплазмин, малонилдиальдегид, щелочная фосфатаза, холинэстераза, аланин- и аспартаттрансаминазы, гамма-глютаминтрансфераза, каталаза, свободные SH-группы);
- проведение хронической ингаляционной экспозиции с дополнительной оценкой клеточных и биохимических характеристик жидкости, полученной при бронхоальвеолярном лаваже (далее - БАЛЖ), сдвига некоторых биохимических характеристик внеклеточной жидкости, полученной при центрифугировании БАЛЖ (повышения активности лактатдегидрогеназы и некоторых лизосомальных ферментов - амилазы, щелочной фосфатазы, гамма-глютамилтрансферазы);
- определение показателей биоаккумуляции и биораспределения наночастиц в органах, тканях и клетках-мишенях осуществляется по возможности разными методами (атомно-адсорбционная и атомно-эмиссионная спектроскопия, спектроскопия электронного парамагнитного резонанса, электронная микроскопия), позволяющими определять как суммарное накопление в этом органе, так и накопление его в виде не растворившихся наночастиц;
- гистологическое, цитологическое исследование перечисленных органов с преимущественной биоаккумуляцией наночастиц;
- в случаях, когда для развития патологического действия особое значение имеет воздействие на конкретные клетки-мишени и повреждение субклеточных структур, важным является исследование внутриклеточной локализации НЧ;
- накопление наночастиц в богатых клетками ретикулоэндотелиальной системы центральных органах иммунитета (например, интерферон-гамма, лактоферин, интерлейкины 2 и 8, иммуноглобулины, НСТ-тест);
- накопление наночастиц в костном мозге (исследование миелограммы);
- исследование на повреждение ДНК циркулирующих лейкоцитов крови, клеток органов-мишеней с помощью таких широко известных тестов, как метод ДНК-комет и анализ полиморфизма длин амплифицированных фрагментов [11, 12, 13];
- подсчет числа микроядер в полихроматофильных эритроцитах костного мозга как показатель мутагенного и предположительно канцерогенного действия [14].
5.2. Оценка эффектов острого действия НЧ на глубокие дыхательные пути по клеточной реакции альвеолярного фагоцитоза проводится по изменениям:
- общей клеточности;
- клеточного состава;
- отношения нейтрофильных лейкоцитов к альвеолярным макрофагам в свободной популяции глубоких дыхательных путей, получаемой путем бронхоальвеолярного лаважа;
- биохимических показателей.
5.3. Оценка эффективности защитного действия испытанного БПК основана на выявлении статистически значимой благоприятной разницы между средними значениями показателей интоксикации в группах «НЧ» и «НЧ + БПК» при отсутствии статистически значимых неблагоприятных различий. Отсутствие таких различий между группами «БПК» и контрольной является важным свидетельством безопасности применения испытываемого БПК.
5.4. Для повышения надежности выводов, основанных на межгрупповых сопоставлениях, в оценку значимости парных различий по t-критерию Стьюдента рекомендуется вводить одну из известных поправок на множественные сравнения (например, поправку Бонферрони). Дополнительную информацию может дать сравнительная оценка с помощью методов, основанных на математической теории распознавания образов (например, с помощью дискриминатного анализа).
5.5. Доказанный в эксперименте защитный эффект и собственная безвредность того или иного БПК могут послужить основанием для того, чтобы рекомендовать проведение контролируемого курса на специально подобранной группе добровольцев-испытуемых.
5.6. Пересчет доз, испытанных в эксперименте, в дозы для человеческого применения осуществляется на основе соотношения уровней основного обмена крысы и человека с учетом справочных и литературных данных о суточной потребности человека в микронутриентах, входящих в состав БПК.
5.7. Некоторые микроэлементы и витамины рекомендуется использовать в максимальных дозах диапазона, учитывая компенсацию микроэлементного дисбаланса, возникающего при действии того или иного токсичного металла, и коррекцию вызываемых им метаболических нарушений [15 - 17].
Приложение 1
к МР 1.2.0147-19
Приложение 2
к МР 1.2.0147-19
Не все металлические и металл-оксидные наночастицы (далее - Ме-НЧ), производимые для технического, медицинского и иного применения отвечают требованиям, сформулированным в п. 4.1 настоящих методических рекомендаций, и могут быть использованы в целях экспериментов, рассматриваемых настоящими методическими рекомендациями. В частности, такие Ме-НЧ нередко имеют химически модифицированную поверхность, что неопределенным образом меняет их токсичность. Кроме того, не все Ме-НЧ, встречающиеся в воздухе как побочный продукт высокотемпературных технологических продуктов, имеют указанное практическое применение и поэтому производятся как искусственные (engineered).
Исходя из этих соображений, для экспериментального моделирования интоксикаций с целью испытания профилактической эффективности биопротекторов рекомендуется специально получать водные взвеси Ме-НЧ нужного химического состава и дисперсности без каких-либо биологически активных примесей. Наиболее подходящим способом синтеза Ме-НЧ является лазерная абляция металлических мишеней особой чистоты (99,99 %) под слоем деионизированной воды (рис. П1.2).
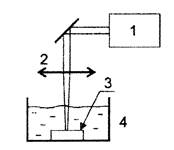
Рис.
П2.1. Схема метода получения водной суспензии Ме-НЧ:
1 - лазер, 2 - фокусирующая линза, 3 - металлическая мишень,
4 - кювета с деионизированной водой
Как показано схематически на рисунке П2.1, мишень, представляющая собой тонкую (1 мм) металлическую пластинку, помещается на дно стеклянной кюветы, содержащей 3 - 5 мл деионизированной воды. Используется лазерная система, основанная на иттербиевом волоконном лазере с длиной волны 1 080 нм, длительностью импульса 100 нс, энергией импульса 1 мДж и частотой повторения 21 кГц.
Поверхность мишени, предварительно очищенной деионизированной водой в ультразвуковой бане, сканируется лазерным пятном с диаметром 40 мкм и мощностью от 15 до 80 Дж/см2. Толщина водного слоя над мишенью от 2 до 10 мм. Скорость сканирования около 270 мм/с, сканируемая зона от 25 до 300 мм2. Продолжительность процедуры абляции от 1 до 60 мин. Масса снятого абляцией металла измеряется взвешиванием мишени до и после этой процедуры на аналитических весах.
Эта методика позволяет получать наночастицы, состоящие из элементных благородных металлов (например, серебра и золота) и из оксидов остальных металлов. Химическая идентичность поверхностного слоя полученных Ме-НЧ оценивается по рамановским спектрам с помощью конфокального микроскопа.
Стабильность наносуспензий, охарактеризованная постоянством величины дзета-потенциала, как правило, является высокой (дзета-потенциал вплоть до 42 mV), что позволяет повысить концентрацию суспензии путем частичного испарения воды при 50 °С. Этим способом удается достичь концентрации 0,5 мг/л без изменения размера и химической идентичности Ме-НЧ.
Средний диаметр производимых частиц зависит от эмпирически подбираемого режима абляции, но диапазон разброса по размерам обычно узок (пример приведен на рисунке П2.2), а агрегаты первичных Ме-НЧ имеют наноразмеры и легко разрушаются при ультраозвучивании, которое лишь для некоторых недостаточно стабильных суспензий оказывается целесообразным непосредственно перед введением в организм.
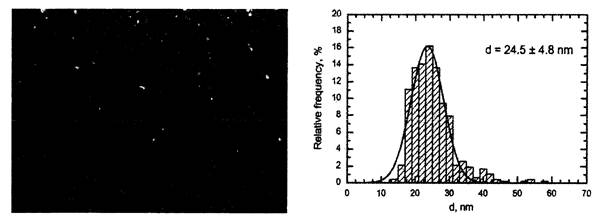
Рис. П2.2. Наночастицы оксида меди (СuО)
в суспензии, приготовленной
для экспериментов на животных (сканирующая электронная микроскопия
с увеличением×103860 и функция распределения частиц по диаметру)
Приложение 3
к МР 1.2.0147-19
Рекомендуемый состав биопрофилактического комплекса для включения в исследование на лабораторных животных выглядит следующим образом. Глютаминовая кислота дается в форме 1,5 % раствора ее натриевой соли в неограниченное питье вместо воды. Пектины подмешиваются в корм в количестве, соответствующем средней потребляемой дозе: приблизительно 1000 мг/кг веса тела. Таблетки, например, глицина и цистеина (в более доступной и метаболически активной форме ацетилцестеина), а также те или иные поливитаминно-полиминеральные драже измельчаются и добавляются к другой порции корма в расчете на среднюю потребляемую дозу в соответствии с рекомендуемыми потребностями организма крысы, но несколько выше последних (учитывая повышенный расход их организмом в условиях токсического стресса). Препараты рыбьего жира, богатого жирными кислотами класса омега-3, также добавляются к корму либо вводятся внутрижелудочно через зонд.
Рекомендуемый состав биопрофилактического комплекса, направленного против воздействия наночастиц оксида меди (для крыс и других мелких лабораторных животных), приведен в таблице П3.1.
Таблица П3.1
Состав,
дозировка и способ назначения биопротекторов лабораторным
животным при субхронической интоксикации наночастицами оксида меди
|
Биопротекторы |
Дозировка на 1 крысу и способ назначения |
|
|
Глютамат |
160 - 180 мг (как 1,5 % раствор в питье взамен воды) |
|
|
Яблочный пектин |
200 мг (в корме) |
|
|
Глицин |
12 мг (в корме) |
|
|
Ацетилцистеин |
30 мг (в корме) |
|
|
Рыбий жир (как источник витамина А и жирных кислот класса омега-3) |
1 капля (в корме) |
|
|
Поливитаминно-полиминеральный комплекс |
в дозировке, обеспечивающей каждой крысе (в корме): |
|
|
Витамин В12 |
0,15 мкг |
|
|
Витамин С |
4,4 мг |
|
|
Витамин Е |
0,84 мг |
|
|
Железо |
0,6 мг |
|
|
Селен |
5,8 мкг |
|
|
Цинк |
1,25 мг |
|
|
Молибден |
3,75 мкг |
|
|
Марганец |
16,7 мкг |
|
Приложение 4
к МР 1.2.0147-19
В качестве примера приводится краткая оценка эффективности БПК, состав которого приведен в приложении 3 и который был испытан на лабораторных животных (белых крысах) при действии наночастиц оксида меди (СuО).
Стабильные водные суспензии наночастиц оксида меди (СuО) со средним диаметром (±s.d.) 20 ± 10 нм в концентрации 0,5 мг/мл вводили крысам-самкам весом 150 - 220 г внутрибрюшинно в дозе 10 мг/кг массы тела по 3 раза в неделю. Контрольным животным аналогичным образом вводили соответствующий объем стерильной деионизированной воды, которая использовалась для приготовления суспензии. Каждой крысе всего осуществлено 19 введений. Отдельные группы животных получали те же инъекции на фоне перорального приема БПК. Каждая из 4 групп включала по 12 - 15 особей. Как введение наночастиц оксида меди или воды, так и умерщвление животных во всех группах проводились параллельно.
Состояние организма крыс оценивалось по большому числу (свыше 40) общепризнанных функциональных, биохимических и морфологических (с морфометрией) критериев токсического действия. Для оценки генотоксического действия наночастиц оксида меди (CuO) «in vivo» использовали ПДАФ-анализ.
Данные таблицы П4.1 демонстрируют снижение под влиянием БПК задержки меди в организме крыс, подвергавшихся воздействию наночастиц оксида меди (СuО) (тенденция к снижению отмечена во всех исследованных органах, в том числе статистически значимое - в селезенке).
В таблице П4.2 приведены те функциональные показатели состояния организма, по которым при действии этих НЧ были выявлены неблагоприятные сдвиги по сравнению с контрольными величинами, причем на фоне действия БПК эти сдвиги были по части этих показателей ослаблены, но ни по одному не усилены.
Содержание
меди в органах крыс (мкг на г сухой ткани) (![]() )
)
|
Группы крыс, получавшие: |
Почки |
Печень |
Селезенка |
Головной мозг |
|
Воду (контроль) |
42,4 ± 2,9 |
12,2 ± 2,4 |
22,5 ± 2,1 |
18,9 ± 0,7 |
|
Наночастицы оксида меди (СuО) |
62,5 ± 7,1* |
28,8 ± 6,3* |
24,2 ± 1,5 |
21,5 ± 1,7 |
|
Наночастицы оксида меди (СuО) + БПК |
59,4 ± 10,0 |
22,1 ± 3,5* |
18,0 ± 2,5° |
18,8 ± 1,4 |
|
Воду + БПК |
50,4 ± 5,6 |
10,6 ± 0,3 |
25,3 ± 2,2 |
20,8 ± 1,5 |
Различия статистически значимы (р < 0,05 по t-критерию Стьюдента с поправкой Бонферрони для множественных сравнений) в сравнении: * - с контрольной группой; º - с группой, получавшей наночастицы оксида меди (СuО) без БПК.
Некоторые
функциональные показатели состояния организма крыс,
подвергавшихся субхронической затравке медно-оксидными
частицами (НЧ) и тому же воздействию на фоне БПК (![]() )
)
|
Показатели |
Группы крыс, получавшие: |
|||
|
Наночастицы оксида меди |
Наночастицы оксида меди + БПК |
Воду + БПК |
Воду (контроль) |
|
|
Гемоглобин в крови, г/л |
134,1 ± 3,5* |
143,1 ± 3,2*▪ |
166,8 ± 4,6 |
166,1 ± 4,0 |
|
Эритроциты, 1012/л |
1,61 ± 0,05* |
1,63 ± 0,03* |
1,69 ± 0,05 |
1,84 ± 0,03 |
|
Ретикулоциты, ‰ |
28,9 ± 2,14* |
16,0 ± 1,59*▪ |
11,0 ± 1,87 |
10,45 ± 0,78 |
|
Активность сукцинатдегидрогеназы, число гранул на 50 лимфоцитов |
656,75 ± 11,99* |
807,5 ± 20,85*▪ |
766,1 ± 19,53 |
737,1 ± 10,74 |
|
Малоновый диальдегид в сыворотке крови, нмоль/л |
3,7 ± 0,17* |
4,32 ± 0,24▪ |
4,1 ± 0,17 |
4,0 ± 0,123 |
|
Масса печени, г на 100 г массы тела |
4,03 ± 0,14* |
3,96 ± 0,22 |
3,50 ± 0,13 |
3,60 ± 0,12 |
Различия статистически значимы (р < 0,05 по t-критерию Стьюдента с поправкой Бонферрони для множественных сравнений) в сравнении: * - с контрольной группой; ▪ - с группой «Наночастицы оксида меди (СuО)».
Таблица П4.3
Морфометрические
характеристики повреждения проксимальных извитых канальцев почек крыс,
подвергавшихся субхронической затравке наночастицами оксида меди на фоне приема
БПК или без него (![]() )
)
|
Группы крыс, получавшие: |
Длина участка десквамации щеточной каемки, % |
Длина участка десквамации эпителия, % |
|
Наночастицы оксида меди (СuО) |
8,36 ± 0,76* |
1,16 ± 0,38* |
|
Наночастицы оксида меди (СuО) + БПК |
5,98 ± 0,46▪ |
0,98 ± 0,35* |
|
Воду |
5,39 ± 0,42 |
0,33 ± 0,13 |
|
Воду + БПК |
6,03 ± 0,57 |
0,73 ± 0,21 |
Различия статистически значимы (р < 0,05 по t-критерию Стьюдента с поправкой Бонферрони для множественных сравнений) в сравнении: * - с контрольной группой; ▪ - с группой «Наночастицы оксида меди (СuО)».
Гистологическое изучение тканей печени, почек, селезенки и головного мозга, сочетавшееся с морфометрией, выявило у крыс, подвергавшихся субхроническому воздействию наночастиц оксида меди (СuО), ряд выраженных патологических изменений, существенно ослабленных при том же воздействии на фоне приема БПК. Некоторые примеры, иллюстрирующие это, приводятся в таблице П4.3.
Из данных таблицы П4.4 видно, что на фоне приема БПК оказалась значимо ослабленной фрагментация ДНК клеток печени, селезенки и головного мозга, вызываемая субхронической интоксикацией крыс наночастицами оксида меди (СuО), то есть ослаблен ее генотоксический эффект.
Таблица П4.4
Влияние
БПК и/или наночастиц оксида меди на коэффициент фрагментации геномной ДНК
(ПДАФ-тест) в клетках различных органов (![]() )
)
|
Органы |
Группы крыс, получавшие: |
|||
|
Наночастицы оксида меди (СuО) |
Наночастицы оксида меди (СuО) + БПК |
Воду + БПК |
Воду (контроль) |
|
|
Печень |
0,426 ± 0,0020* |
0,404 ± 0,002*▪ |
0,394 ± 0,0040 |
0,396 ± 0,0020 |
|
Селезенка |
0,460 ± 0,0020* |
0,418 ± 0,0015*▪ |
0,377 ± 0,0028* |
0,369 ± 0,0016 |
|
Головной мозг |
0,355 ± 0,0020 |
0,335 ± 0,0021* |
0,356 ± 0,0025 |
0,354 ± 0,0028 |
Различия статистически значимы (р < 0,05 по t-критерию Стьюдента с поправкой Бонферрони для множественных сравнений) в сравнении: * - с контрольной группой; ▪ - с группой «Наночастицы оксида меди (СuО)».
Библиографические ссылки
1. Experimental Research into Metallic and Metal Oxide Nanoparticle Toxicity In Vivo / B.A. Katsnelson, L.I. Privalova, M.P. Sutunkova, I.A. Minigalieva, V.B. Gurvich, V.Y. Shur, E.V. Shishkina, О.Н. Makeyev, I.E. Valamina, A.N. Varaksin, V.G. Panov // Bioactivity of Engineered Nanoparticles - 2017. p. 259 - 319 Chapter.
2. Подходы к организации массовой биологической профилактики вредного влияния химического загрязнения среды обитания на здоровье детского населения и к оценке ее эффективности (опыт Свердловской области): Пособие для врачей / сост.: С.В. Кузьмин, Б.А. Кацнельсон, Л.И. Привалова и др. Екатеринбург, 2004.
3. Кацнельсон Б.А., Привалова Л.И., Гурвич В.Б. и др. О роли биопрофилактики в системе мер управления профессиональными и экологически обусловленными химическими рисками для здоровья населения. Токсикологический вестник. 2015; 1: 10 - 21.
4. Кацнельсон Б.А., Привалова Л.И., Гурвич В.Б. и др. Способ профилактики вредных эффектов общетоксического и генотоксического действия наносеребра на организм. Патент Российской Федерации № 2530639. 2014.
5. Кацнельсон Б.А., Привалова Л.И., Гурвич В.Б. и др. Способ профилактики вредных эффектов общетоксического и генотоксического действия наночастиц оксида меди на организм. Патент Российской Федерации № 2560682. 2015.
6. Минигалиева И.А., Кацнельсон Б.А., Привалова Л.И. и др. Способ повышения устойчивости организма к хроническому комбинированному токсическому действию наночастиц оксида никеля и оксида марганца. Патент Российской Федерации №2597157. 2016.
7. Кацнельсон Б.А., Дегтярева Т.Д., Привалова Л.И., Солобоева Ю.И., Киреева Е.П., Минигалиева И. А., Сутункова М.П., Еременко О.С., Береснева О.Ю., Кочнева Н.И. Биологическая профилактика экологически обусловленных нарушений здоровья: теоретические предпосылки, экспериментальные данные, оценка эффективности, практическая реализация // Биосфера, № 3, т. 2, 2010. С. 375 - 385.
8. Привалова Л.И., Кацнельсон Б.А., Гурвич В.Б., Минигалиева И.А., Сутункова М.П., Макеев О.Г., Валамина И.Е., Шур В.Я., Григорьева Е.В., Клинова С.В., Шишкина Е.В. О некоторых принципах и способах повышения резистентности организма к вредным эффектам металлсодержащих наночастиц // Токсикологический вестник, № 6, 2016. С. 4 - 10.
9. Дегтярева Т.Д. Экспериментально-теоретическое обоснование принципов биологической профилактики хронических интоксикаций неорганическими соединениями: автореф. дис. докт. биол. наук. ФНЦГ им. Ф.Ф. Эрисмана, Москва, 2002.
10. Розин М.А. Определение некоторых временных характеристик сгибательного рефлекса задних конечностей животных. Воспроизведение заболеваний у животных для экспериментально-терапевтических исследований. Ленинград, 1954. С. 3 - 4.
11. Katsnelson В.A., Privalova L.I., Gurvich V.B., Makeyev О.Н., Shur V.Ya., Beikin Y.B., Sutunkova M.P., Kireyeva E.P., Minigalieva I.A., Loginova N.V., Vasilyeva M.S., Korotkov A.V., Shuman E.A., Vlasova L.A., Shishkina E.V., Tyurnina A.E., Kozin R.V., Valamina I.E., Pichugova S.V. and Tulakina L.G. Comparative in Vivo Assessment of Some Adverse Bioeffects of Equidimensional Gold and Silver Nanoparticles and the Attenuation of Nanosilver’s Effects with a Complex of Innocuous Bioprotectors. Int J Mol Sci. 2013, 14: 2449 - 2483.
12. Minigalieva I.A., Katsnelson B.A., Panov V.G., Privalova L.I., Varaksin A.N., Gurvich V.B., Sutunkova M.P., Shur V.Y., Shishkina E.V., Valamina I.E., Zubarev I.V., Makeyev O.H., Meshtcheryakova E.Y., Klinova SV. In vivo toxicity of copper oxide, lead oxide and zinc oxide nanoparticles acting in different combinations and its attenuation with a complex of innocuous bio-protectors. Toxicology. 2017, 380: 72 - 93.
13. Minigalieva I.A., Katsnelson B.A., Privalova L.I., Sutunkova M.P., Gurvich V.B., Shur V.Y., Shishkina E.V., Valamina I.E., Makeyev O.H., Panov V.G., Varaksin A.N., Bushueva T.V., Sakhautdinova R.R., Klinova S.V., Solovyeva S.N., Meshtcheryakova E.Y. Combined Subchronic Toxicity of Aluminum (III), Titanium (IV) and Silicon (IV) Oxide Nanoparticles and Its Alleviation with a Complex of Bioprotectors. Int. J. Mol. Sci. 2018, 19(3), 837: 1 - 28.
14. Юркин А.Ю. Методические особенности анализа микроядер в клетках человека и животных при скрининге и мониторинге кластогенных факторов в окружающей среде / А.Ю. Юркин: дис. канд. мед. наук: 03.00.25. Томск, 2003. 184 с.
15. Механизмы токсического действия неорганических соединений / Ю.А. Ершов, Т.В. Плетенева. М.: Медицина, 1989. С. 199 - 207.
16. Биомониторинг металлов / Е.А. Можаев, А.Н. Литвинов // Гигиена и санитария. № 7. 1988. С. 53 - 56.
17. Metal Toxicology / R. Goyer, C. Klaussen, M. Waalkes. New York: San Diego Acad. Press, 1997. 525 p.
Методические рекомендации разработаны ФБУН «Екатеринбургский медицинский-научный центр профилактики и охраны здоровья рабочих промпредприятий» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (проф., д.м.н., Л.И. Привалова, к.м.н. М.П, Сутункова, к.б.н. И.А. Минигалиева. С.В. Клинова, д.м.н. В.Б. Гурвич, проф., д.м.н. Б.А. Кацнельсон).
СОДЕРЖАНИЕ