|
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА И ПРОДОВОЛЬСТВИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ (Минсельхозпрод России) ДЕПАРТАМЕНТ ВЕТЕРИНАРИИ 107139, Москва, Орликов пер., 1/11 Для телеграмм: Москва, 84 Мннроссельхозпрод Телекс: 417738 ЛЕН Телефон: 975-58-50 11.10.99 г. № 13-7-2/1759 |
|
УТВЕРЖДАЮ Зам. руководителя Департамента ветеринарии Министерства сельского хозяйства и продовольствия РФ ____________ В.В. Селиверстов 11 октября 1999 г. |
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по бактериологической диагностике
смешанной кишечной инфекции
молодняка животных, вызываемой
патогенными энтеробактериями
1. Общие положения
1.1. Смешанная кишечная инфекция - остропротекающая инфекционная болезнь молодняка разных видов сельскохозяйственных животных, которая имеет полиэтиологическую природу и вызывается двумя-тремя и более видами патогенных энтеробактерий, относящимся к родам Escherichia, Citrobacter, Proteus, Morganella, Klebsiella, Salmonella. Помимо указанных микроорганизмов возбудителями болезни могут быть также бактерии других родов и семейств - Yersinia, Pseudomonas, Staphylococcus, Streptococcus, Clostridium и пр. Наряду с бактериальными агентами нередко (особенно на крупных фермах) болезнь обусловливают корона- и ротавирусы.
1.2. Болезнь возникает в первые дни и недели жизни животных и проявляется чаще в виде энзоотической вспышки, развитию которой способствуют различные факторы, связанные с несоблюдением технологических и ветеринарно-санитарных требований воспроизводства стада, а также нарушением режимов содержания и кормления молодняка.
1.3. Смешанная кишечная инфекция может протекать в кишечной (энтеритной) и септической формах. При кишечной форме возбудители болезни локализуются только в желудочно-кишечном тракте и брыжеечных лимфоузлах, регионарных поражённым участкам кишечника; при септической форме - в паренхиматозных органах, различных тканях, а также в кишечнике и брыжеечных лимфоузлах. Основными клиническими признаками болезни являются: потеря аппетита, понос, переходящий в профузный, нарастающая слабость, депрессия, учащенное дыхание и сердцебиение, обезвоживание организма (при затяжном течении); нередко наблюдается поражение центральной нервной системы (возбуждение, судороги), иногда пневмония, артриты; температура тела в пределах нормы, в отдельных случаях повышена на 0,5 - 1 °С, в предагональном состоянии она снижается ниже нормы.
1.4. Патологоанатомические изменения у погибших животных имеют картину катарального или катарально-геморрагического гастроэнтерита, на слизистой желудка, тонкого отдела кишечника и слепой кишки могут встречаться язвы, нередко отмечаются множественные точечные, полосчатые и пятнистые кровоизлияния на слизистой желудка, толстого и тонкого отделов кишечника, под капсулой селезенки, эпи- и эндокарде (клапанах); иногда отмечается очаговая катаральная пневмония и отек легких, дистрофия печени; регионарные брыжеечные лимфатические узлы как правило увеличены, отечны, на разрезе розового или красно-вишневого цвета; при вскрытии черепной коробки - гиперемия кровеносных сосудов и отек ткани головного мозга. Указанные изменения могут быть в отдельных или одновременно в нескольких органах.
1.5. Диагноз на смешанную кишечную инфекцию в хозяйствах устанавливают на основании совокупности эпизоотологических данных (возраст заболевших животных, массовость поражения, стационарность и др.), клинических признаков болезни, патологоанатомической картины и результатов бактериологического (при необходимости еще и вирусологического) исследования патологического материала от больных или погибших животных.
2. Отбор материала для исследования
2.1. Для посмертной бактериологической диагностики в лабораторию направляют 2 - 4 свежих трупа погибших или убитых с диагностической целью больных животных (желательно не подвергавшихся лечению антибактериальными препаратами). В случае невозможности доставки целого трупа посылают следующий патологический материал: голову, трубчатую кость, сердце, перевязанное лигатурой вблизи разреза сосудов и аорты, селезенку, долю печени с желчным пузырем, брыжеечные лимфатические узлы, регионарные воспаленному участку кишечника, а также пораженный отрезок тонкого отдела кишечника, перевязанный с двух концов лигатурой (в отдельной таре или полиэтиленовом пакете). Указанный патологический материал исследуют в день поступления его в лабораторию.
2.2. Для прижизненной бактериологической диагностики в лабораторию направляют фекалии больных диареей животных, не подвергавшихся лечению антибактериальными препаратами. Пробы фекалий берут от 5 - 6 больных животных одной фермы в стерильные пробирки по 2 - 3 г непосредственно из прямой кишки с помощью прокипяченного резинового катетера. Пробирки вместе с сопроводительной запиской упаковывают в полиэтиленовый пакет или картонную коробку.
При невозможности быстрой доставки проб фекалий в лабораторию (через 3 - 4 часа после взятия) их консервируют стерильным 30 %-ным глицериновым раствором в соотношении 1:2 (см. приложение).
2.3. Пробы фекалий и содержимого тонкого отдела кишечника (в количестве не более 0,5 г) разводят в 10 см3 стерильного 0,85 %-ного раствора хлорида натрия, тщательно размешивают и затем выдерживают 10 - 15 минут при комнатной температуре для осаждения крупных частиц. Надосадочную жидкость используют для посева на питательные среды не позднее 1 - 2 часов после приготовления взвесей. При исследовании консервированных фекалий, их тщательно размешивают, после чего разводят физиологическим раствором в 5 - 10 раз.
3. Выделение культур энтеробактерий, изучение их морфологических, культуральных и ферментативных свойств
3.1. Патологический материал (за исключением содержимого тонкого отдела кишечника и фекалий) засевают в пробирки с МПБ и на плотные дифференциально-диагностические среды в чашках: Эндо (или Левина) и среду Плоскирева (или висмут-сульфит агар). Содержимое тонкого отдела кишечника и фекалий засевают только на указанные выше плотные среды в чашках. Кроме того для выделения из фекалий сальмонелл неразведенные пробы фекалий засевают еще в одну из сред обогащения (селенитовый бульон, магниевую, Мюллера или др.) в соотношении 1:5.
3.1.1. Посев материала в МПБ проводят пастеровской пипеткой. Посевы на плотные среды в чашках из внутренних органов и тканей, указанных в п. 2.3, делают путем отпечатков разрезанной поверхностью кусочка органа из предварительно профламбированного участка на подсушенную питательную среду или вносят материал пастеровской пипеткой на поверхность среды, а затем равномерно растирают его стеклянным шпателем.
3.1.2. Содержимое тонкого отдела кишечника, взятое путем соскоба с пораженного участка слизистой оболочки, суспендируют в 10 см3 стерильного 0,85 %-ного раствора хлорида натрия, затем засевают суспензию бактериологической петлей на подсушенные в термостате плотные дифференциально-диагностические среды в чашках широким частым штрихом по всей поверхности среды. Аналогичным образом проводят посев разведенных фекалий.
3.2. Пробирки с посевами в МПБ из внутренних органов и тканей инкубируют при температуре 37 - 38 °С в течение 18 - 24 часов. При наличии в МПБ помутнения среды культуру микроскопируют и в случае обнаружения мелких грамотрицательных палочек пересевают ее на агар Эндо (или Левина) и среду Плоскирева (или висмут-сульфит агар) в чашках, которые помещают в термостат (37 - 38 °С ) на 18 - 24 часа.
Пересев культур, полученных в МПБ, на плотные селективные среды проводят в том случае, если отсутствует рост колоний на этих средах в первичных посевах из соответствующих органов и тканей.
3.3. Чашки с посевами на агаре Эндо (или Левина) из внутренних органов, тканей или фекалий инкубируют при температуре 37 - 38 ° С в течение 18 - 24 часов. После просмотра культур пересевают колонии лактозоположительных бактерий (круглые, средних размеров S-формы, красно-малинового цвета на агаре Эндо и темно-фиолетового цвета на агаре Левина с наличием или отсутствием металлического блеска) в чашки с МПА и средой Минка в соответствии с рекомендациями, изложенными в действующих «Методических указаниях по бактериологической диагностике колибактериоза (эшерихиоза) животных».
При наличии на агаре Эндо (или Левина) роящегося налета, характерного для протея, пересевают его на скошенный МПА (культуры из двух-трех внутренних органов, тканей или фекалий). Чашки и пробирки с посевами инкубируют 18 - 20 часов при той же температуре.
3.4. Чашки с первичными посевами на агаре Плоскирева инкубируют при температуре 37 - 38 °С в течение 24 - 36 часов. После просмотра культур пересевают мелкие круглые колонии S-формы полупрозрачные, сероватого цвета с голубым оттенком в пробирки со скошенным МПА (по 1 - 2 колонии с культур из двух-трех внутренних органов, тканей или фекалий, каждую колонию в отдельную пробирку), которые помещают в термостат на 18 - 24 часа.
В том случае, если пересев проводят на комбинированную среду (Олькеницкого, Клиглера), то каждую колонию пересевают в одну пробирку с этой средой и в одну пробирку со скошенным МПА.
3.5. Суточные культуры бактерий на скошенном МПА или комбинированной среде, выделенные из внутренних органов, тканей или фекалий, микроскопируют (окраска по Граму) и при наличии в мазках однородных мелких грамотрицательных палочек, не образующих спор и капсул (бактерии вида Klebsiella pneumoniae образуют капсулу), используют для изучения ферментативных, патогенных, антигенных свойств, а также (при необходимости) определения подвижности в полужидком МПА. Для выявления у культур клебсиелл капсулы окраску мазков проводят по методу Гинса (тушью).
3.6. Ферментативные свойства изучают у 2 - 6 агаровых (в порядке исключения у бульонных) культур бактерий, выделенных из одного патологического материала, на наборе сред с углеводами и индикатором Андреде или полужидких средах с индикатором ВР, куда входят среды с глюкозой, лактозой, сахарозой, маннитом, мальтозой, а также на средах с мочевиной, сернокислым железом (определение сероводорода), агаре Симонса, в бульоне Хоттингера или МПБ (определение индола), мясопептонной желатине, среде с фенилаланином.
При использовании комбинированной среды Олькеницкого или Клиглера учитывают изменения, вызываемые представителями разных родов энтеробактерий в этой среде, после чего данную культуру изучают по другим необходимым биохимическим тестам.
Засеянные пробирки инкубируют при температуре 37 - 38 °С.
Предварительные результаты изучения ферментативных свойств культур учитывают через 24 часа, окончательные результаты - через 48 часов. Изучение ферментативных свойств культур энтеробактерий можно проводить также с помощью тест-системы для биохимической идентификации энтеробактерий. Родовую и видовую принадлежность культур устанавливают по показателям таблицы.
Следует учитывать, что у бактерий рода Proteus встречаются нероящиеся штаммы, образующие при росте на плотных питательных средах мелкие круглые колонии S-формы сероватого цвета. Важными признаками родовой идентификации таких штаммов является их способность дезаминировать фенилаланин и разжижать желатин.
При наличии у культур отклонений от основных показателей таблицы используют дополнительные тесты: реакции с метилротом и Фогес-Проскауэра, наличия образования оксидазы, определение подвижности и др.
СХЕМА
БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ ПАТОЛОГИЧЕСКОГО
МАТЕРИАЛА НА СМЕШАННУЮ КИШЕЧНУЮ ИНФЕКЦИЮ
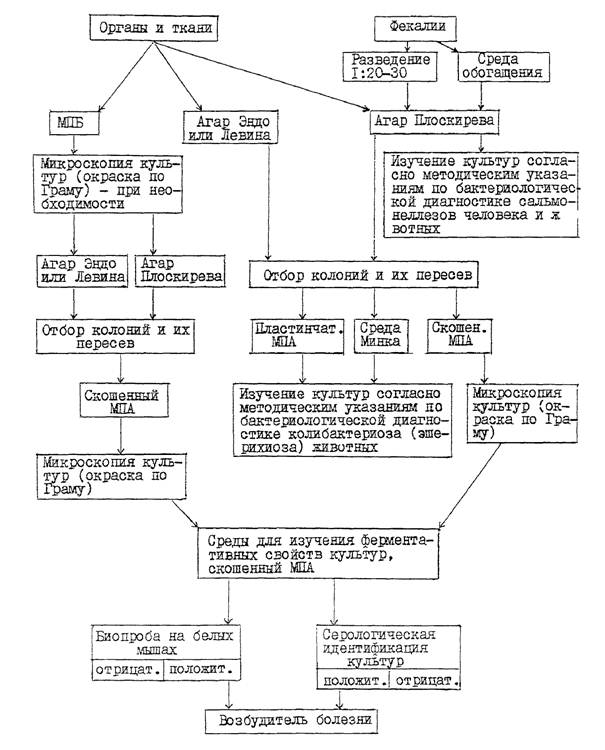
4. Серологическая идентификация культур бактерий
4.1. Серологическую идентификацию культур эшерихий и сальмонелл проводят в соответствии с действующими «Методическими указаниями по бактериологической диагностике колибактериоза (эшерихиоза) животных» и «Методическими указаниями по лабораторной диагностике сальмонеллезов человека и животных, обнаружению сальмонелл в кормах, продуктах питания и объектах внешней среды». Культуры названных бактерий относят к возбудителям болезни на основании показателей, указанных в этих методических указаниях.
Дифференциальные признаки энтеробактерий по ферментативным свойствам
|
№ п/п |
Тесты |
РОДЫ И ВИДЫ БАКТЕРИЙ |
|||||||||||
|
Escherichia coli |
Citrobacter |
Enterobacter |
Klebsiella pneumoniae |
Salmonella (подрод 1) |
Proteus |
Morganella morganii |
Yersinia enterocolitica (t° 22 - 25 °C) |
||||||
|
freundii |
diversus |
aerogenes |
cloacae |
vulgaris |
mirabilis |
мухоfaciens |
|||||||
|
Основные |
|
||||||||||||
|
1 |
Глюкоза |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ (к) |
|
2 |
Лактоза |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
- |
- |
|
(-) |
(-) |
(-) |
(-) |
(-) |
|||||||||
|
3 |
Сахароза |
± |
± |
± |
+ |
+ |
+ |
- |
+ |
± |
+ |
- |
+ |
|
(-) |
|||||||||||||
|
4 |
Маннит |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
|
5 |
Мальтоза |
± |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
- |
+ |
- |
+ |
|
6 |
Рост на агаре Симонса |
- |
+ |
+ |
+ |
+ |
+ |
+ |
± |
+ |
± |
- |
- |
|
(-) |
|||||||||||||
|
7 |
Образование индола |
+ |
- |
+ |
- |
- |
± |
- |
+ |
- |
- |
+ |
± |
|
(-) |
|||||||||||||
|
8 |
Образование сероводорода |
- |
+ |
- |
- |
- |
- |
+ |
+ |
+ |
- |
- |
- |
|
(-) |
|||||||||||||
|
9 |
Расщепление мочевины |
- |
± |
+ |
- |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
|
10 |
Разжижение желатины |
- |
- |
- |
± |
-(+) |
- |
- |
+ |
+ |
+ |
- |
- |
|
11 |
Дезаминирование фенилаланина |
- |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
|
Дополнительные |
|
||||||||||||
|
1 |
Реакция с метилротом |
+ |
+ |
+ |
- |
- |
± |
+ |
+ |
+ |
+ |
+ |
- |
|
2 |
Реакция Фогес-Проскауэра |
- |
- |
- |
+ |
+ |
± |
- |
- |
± |
+ |
- |
+ |
|
3 |
Подвижность |
± |
|
|
+ |
+ |
- |
|
+ |
+ |
+ |
|
+ |
Обозначения: «+» - ферментация сахара (КГ), образование индола, расщепление мочевины и т.д.
«-» - отсутствие ферментации сахара, образования индола, расщепления мочевины и т.д.
«±» - различные показатели
«(-)» - отдельные штаммы не вызывают ферментации сахара, образования индола и т.д.
«(+)» - замедленное разжижение желатины.
4.2. Для серотипирования культур морганелл, выделенных из патологического материала, применяют набор нативных морганеллезных агглютинирующих серогрупповых сывороток. Серологическую типизацию культур осуществляют в соответствии с наставлением по применению указанных сывороток, утвержденным Департаментом ветеринарии МСХиП РФ 28.04.1997 г. При выделении культур морганелл патогенной серологической группы их относят к возбудителям болезни и у таких культур патогенные свойства в биопробе на белых мышах не определяют.
4.3. Ускоренное обнаружение эпизоотических штаммов морганелл в первичных смешанных культурах, полученных после посева патологического материала на среду Плоскирева, с одновременной серологической типизацией их осуществляют в реакции нейтрализации антител (РНАт) в соответствии с «Методическими указаниями по ускоренной индикации эпизоотических штаммов морганелл в реакции нейтрализации антител», утвержденными Департаментом ветеринарии МСХиП РФ 24.03.1999 г. Для постановки РНАт применяют набор агглютинирующих морганеллезных серогрупповых сывороток, указанный в п. 4.2, и набор морганеллезных эритроцитарных диагностикумов, которые используют в соответствии с «Наставлением по применению набора диагностикумов морганеллезных эритроцитарных», утвержденному Департаментом ветеринарии МСХиП РФ 24.03.1999 г. При обнаружении в реакции нейтрализации антител эпизоотических штаммов морганелл серогрупп О1, О16, О26, О29, О33, О45, О49, «13» выделение чистых культур данных бактерий и изучение их морфологических, культурально-биохимических и патогенных свойств не проводят.
5. Определение патогенных свойств культур бактерий
5.1. Патогенные свойства определяют у культур бактерий, относящихся к родам Proteus, Citrobacter, Klebsiella, а также родам Escherichia и Morganella, не имеющих адгезивные антигены и не типируемых по О-антигену, в биопробе на белых мышах.
5.2. Для определения патогенных свойств бактерий используют
агаровые культуры вышеуказанных микроорганизмов, выделенные из двух внутренних
органов и тканей погибших или фекалий больных животных. С каждой из двух
культур одного вида бактерий готовят смывы стерильным физиологическим
раствором, устанавливают взвесь бактерий в концентрации 1 млрд микробных
клеток/см3 (10 единиц по оптическому стандарту мутности), после чего
их смешивают в равной пропорции.![]()
5.3. Взвесями культур каждого вида бактерий заражают по три белые мыши массой 14 - 15 г внутрибрюшинно в дозе 0,5 млрд микробных клеток. Культуру признают патогенной в случае гибели двух и более мышей в течение трех суток после заражения и относят ее к возбудителю болезни.
5.4. При выделении культур энтеробактерий, относящихся к одному виду того или иного рода, указанного в п. 1.1, из селезенки, крови сердца, костного, головного мозга (не менее, чем из двух перечисленных органов и тканей) свежего трупа животного патогенные свойства этих культур в биопробе на белых мышах не определяют и их серологическую типизацию не проводят; такие культуры относят к возбудителю болезни.
6. Учет результатов бактериологического исследования
6.1. Бактериологический диагноз на смешанную кишечную инфекцию молодняка сельскохозяйственных животных устанавливают на основании выделения из патологического материала культур, принадлежащим к двум и более родам энтеробактерий, указанных в п. 1.1, и относящихся к возбудителям болезни по одному из показателей, изложенных в п.п. 4.1, 4.2, 5.3, 5.4.
6.2. Результаты бактериологического исследования формулируют: «Из присланного патологического материала (указать какого) выделены возбудители смешанной кишечной инфекции (указать какие виды бактерий, типы адгезивных антигенов у энтеропатогенных эшерихий, серогруппу в случае серотипирования культур эшерихий и морганелл)».
6.3. При необходимости определяют антибиотикочувствительность каждого вида выделенной культуры возбудителя кишечной инфекции в соответствии с действующими «Методическими указанию по определению чувствительности к антибиотикам возбудителей инфекционных болезней сельскохозяйственных животных».
6.4. Общий срок бактериологического исследования патологического материала до 7 суток.
Методические указания разработаны Л.С. Кавруком, С.В. Бритовой, А.Б. Кононенко (ВНИИ ветсанитарии, гигиены и экологии), В.А. Седовым, Л.А. Тарановой (Центральная научно-методическая ветлаборатория Минсельхозпрода РФ).
С утверждением настоящих Методических указаний утрачивают силу «Методические указания по бактериологической диагностике смешанной кишечной инфекции молодняка животных, вызываемой патогенными энтеробактериями», утвержденные ГУВ Министерства сельского хозяйства и продовольствия СССР 12 ноября 1991 г.
Приложение
1. Глицериновый раствор для консервирования фекалий
Состав: Глицерин нейтральный - 300 см3
Натрий хлористый - 5 г
Вода дистиллированная - 700 см3
Раствор стерилизуют при 1 атм (121 °С) в течение 20 мин или прогревают в водяной бане (100 °С) в течение 30 - 40 мин.
2. Среда с мочевиной (по Преусу)
Состав: Бульон Хоттингера или
мартеновский бульон - 1000 см3
Агар-агар - 15 г
Глюкоза - 5 г
50 % водный раствор мочевины 20 см3
0,2 % раствор бромтимолблау 12 см3
Приготовление: к стерильному расплавленному агару на бульоне Хоттингера или мартеновском бульоне с pH 6,9 - 7,0 добавляют глюкозу, растворы мочевины и индикатора бромтимолблау. Расплавленную среду разливают в стерильные пробирки по 5 см3 и стерилизуют однократно текучим паром 20 мин. Перед употреблением среду скашивают. Готовая среда имеет зеленовато-оливковый цвет.
При расщеплении мочевины среда приобретает синий цвет, при отсутствии расщепления мочевины она окрашивается в желтый цвет.
3. Цитратный агар Симонса
Для определения способности бактерий усваивать цитратно-аммонийные соли используют коммерческую сухую среду, которую готовят согласно указаниям на этикетке препарата, или агар Симонса, приготовленный на основе жидкой среды Козера.
Состав среды Козера:
Натрий-аммоний фосфорнокислый
двузамещенный (NaNH4∙НРО4×4Н2О) - 1,5 г
Калий фосфорнокислый
однозамещенный (KН2РО4) - 1 г
Магний сернокислый (MgSO4×7Н2O) - 0,2 г
Натрий лимоннокислый (Na3С6Н5O7×5Н2O) - 3 г
Дистиллированная вода - 1000 см3
Для приготовления агара Симонса к 1 дм3 среды Козера добавляют 20 г агар-агара и 10 см3 индикатора бромтимолблау. Последний готовят из расчета: бромтимолблау 1 г; 0,1 N раствор NaOH - 25 см3 (для получения указанного раствора к 100 см3 дистиллированной воды добавляют 0,4 г NaOH), дистиллированная вода - 475 см3.
Среду нагревают до полого расплавления агара, фильтруют через ватно-марлевый фильтр, затем разливают в пробирки по 5 см3 и стерилизуют при 0,5 атм в течение 15 мин. Готовая среда имеет зеленовато-оливковый цвет. Перед употреблением среду скашивают.
Бактерии, способные усваивать питратно-аммонийные соли, дают рост на агаре Симонса с изменением его в синий цвет. При отсутствии указанного свойства роста культуры не происходит и цвет среды не изменяется.
4. Среда для определения сероводорода
К 1 дм3 расплавленного стерильного 1,7 %-ного МПА добавляют 0,2 г сернокислого железа (FeSO4×7H2O), 0,3 г серноватистокислого натрия-тиосульфата (Na2S2O3×5H2O), 1 г лактозы, 12 см3 0,2 % водного раствора фенолрота. После размешивания компонентов среду разливают в стерильные пробирки по 6 - 7 см3 и стерилизуют текучим паром в течение 20 мин. Готовая среда имеет бордово-красный цвет. Перед употреблением среду скашивают так, чтобы она имела столбик размером 2,5 - 3 см.
Среду засевают агаровой культурой бактерий вначале на скошенную поверхность, а затем уколом в столбик. В случае образования сероводорода среда в столбике окрашивается в черный цвет. При отрицательном результате почернения среды не наступает.
5. Реактивы для обнаружения индола
5.1. Реактив Эрлиха
Состав: Пара-диметиламинобензальдегид - 1 г
Спирт этиловый 96° - 95 см3
Соляная кислота концентрированная - 20 см3
Приготовление и хранение: альдегид растворяют в спирте, затем добавляют кислоту; хранят реактив в закрытом темном флаконе.
5.2. Реактив Ковача
Состав: Пара-диметиламинобензальдегид - 5 г
Спирт амиловый - 75 см3
Соляная кислота концентрированная - 25 см3
Приготовление и хранение: альдегид растворяют в спирте при нагревании в водяной бане (50 - 55 °С), после остывания смеси добавляют кислоту; хранят реактив при температуре 4 - 6 °С.
Применение реактивов: к двухсуточной культуре бактерий в бульоне Хоттингера добавляют 0,5 см3 реактива Эрлиха или Ковача, пробирки встряхивают и через 1 - 2 мин учитывают результаты. В случае образования индола верхний слой жидкости приобретает красно-малиновый цвет, при отрицательной реакции он окрашивается в желтый цвет.
5.3. Индикаторные бумажки для определения индола
Предварительно готовят следующий реактив:
Пара-диметиламинобензальдегид - 5 г
Ортофосфорная кислота концентрированная (Н3РO4) - 10 см3
Спирт этиловый 96° - 50 см3
Полученный реактив переливают в эмалированный металлический кювет, в который помещают кусочки фильтровальной бумаги. Смоченные реактивом бумажки высушивают на воздухе при комнатной температуре, затем нарезают полосками размером 0,7 - 0,8×10 - 12 см. Бумажки имеют желтый цвет. Хранят их в банке из темного стекла, закрытой резиновой или корковой пробкой.
Для приготовления индикаторных бумажек можно использовать реактив Эрлиха или Ковача.
Применение: после посева изучаемой культуры бактерий в бульон Хоттингера или МПБ помещают в пробирку полоску индикаторной бумажки, верхний конец которой прижимают ватной пробкой. Нижний конец бумажки должен быть на расстоянии не менее 2 - 3 см от поверхности среды. Засеянные пробирки, инкубируют в термостате в течение двух суток. При наличии индолообразования нижний конец индикаторной бумажки окрашивается в красно-малиновый цвет, при отрицательной реакции цвет бумажки не изменяется.
6. Среда с фенилаланином
Для определения способности бактерий дезаминировать фенилаланин используют коммерческую сухую среду, которую готовят по прописи, указанной на этикетке, или среду приготовленную по следующему рецепту:
Дрожжевой экстракт сухой - 3 г
ДL-фенилаланин - 2 г
(или L-фенилаланин - 1 г)
Натрий фосфорнокислый двузамещенный (Na2HPO4×12H2O) - 1 г
Натрий хлористый (NaCl) - 5 г
Агар-агар - 12 г
Вода дистиллированная - 1000 см3
Компоненты растворяют в воде при нагревании, pH не устанавливают, среду фильтруют через ватно-марлевый фильтр, разливают в пробирки по 3 - 4 см3 и стерилизуют при 0,5 атм в течение 15 мин. После стерилизации среду скашивают.
Применение: к о дно-двухсуточной культуре на среде с фенилаланином в наклонном положении добавляют 10 - 12 капель 10 % раствора хлорного железа (FeCl3×6H2O). При положительной реакции через 2 - 3 мин культура окрашивается в зелено-синий или зеленовато-голубой цвет, при отрицательной реакции цвет культуры не изменяется.
7. Среда Кларка для реакций с метилротом и Фогес-Проскауэра
Состав: Пептон ферментативный - 5 г
Калий фосфорнокислый двузамещенный (K2НРО4×3Н2О) - 5 г
Глюкоза - 5 г
Вода дистиллированная -1000 см3
Приготовление: после растворения компонентов в воде устанавливают pH среды 6,9 - 7,0, затем кипятят ее 2 - 3 мин, фильтруют через бумажный фильтр, разливают в пробирки по 5 см3 и стерилизуют при 0,5 атм в течение 15 мин.
Применение: для постановки реакции с метилротом из пробирки с двухсуточной культурой бактерий в среде Кларка отсасывают в чистую сухую пробирку 2,5 см3 жидкости, добавляют к ней 8 - 10 капель индикатора метилрота, пробирку встряхивают, после чего учитывают реакцию. Изменение цвета культуры зависит от величины pH: розовое окрашивание (при pH ниже 5,0) означает положительную реакцию, желтое окрашивание (при pH выше 6,0) - отрицательную реакцию, светло-оранжевое окрашивание (при pH 5,0 - 6,0) - сомнительную реакцию.
Состав индикатора метилрота:
Метиловый красный - 0,01 г
Спирт этиловый 96° - 30 см3
Вода дистиллированная - 20 см3
Приготовление: навеску краски растворяют в спирте, затем добавляют воду и смесь размешивают. Хранят индикатор в темном месте под притертой пробкой.
Для постановки реакции Фогес-Проскауэра к 2,5 см3 культуры бактерий добавляют вначале 1 см3 6 %-ного спиртового раствора α-нафтола, а затем 0,4 см3 40 %-ного водного раствора KОН, пробирку тщательно встряхивают и спустя 3 - 5 мин учитывают результаты. При наличии в культуре ацетилметилкарбинола она окрашивается в розовый цвет - положительная реакция, окраска культуры в желтый цвет свидетельствует об отрицательной реакции, при сомнительной реакции культура окрашивается в светло-оранжевый цвет.
Состав реактивов для реакции Фогес-Проскауэра:
а) α-нафтол (С10Н8O) - 30 г
Спирт этиловый 96° - 500 см3
б) Калий гидроокись (KОН) - 120 г
Бода дистиллированная - 300 см3
8. Среды для предварительной идентификации культур лактозоотрицательных бактерий
8.1. Среда Олькеницкого
Состав: Лактоза - 10 г
Сахароза - 10 г
Глюкоза - 1 г
Аммоний-железо (II) сульфат (FeSO4×(NH4)SO4×6Н2O) - 0,2 г
Натрий тиосульфат (Na2S2O3×5Н2O) - 0,3 г
Мочевина - 10 г
Феноловый красный (0,4 % водный раствор) - 4 см3
Агар питательный сухой - 25 г
Вода дистиллированная - 1000 см3
Приготовление: компоненты растворяют в небольшом объеме дистиллированной воды нагретой до температуры 45 - 50 °С; сухой питательный агар расплавляют в отдельной посуде в остальной части дистиллированной воды при нагревании, затем смешивают растворы солей и расплавленного агара, фильтруют через марлевый фильтр, устанавливают pH 7,2 - 7,4, после чего добавляют раствор индикатора и тщательно размешивают его; готовую среду разливают в пробирки по 6 - 7 см3 и стерилизуют текучим паром дробно в течение трех суток ежедневно по 20 мин. Стерильную среду скашивают таким образом, чтобы столбик был не менее 2 - 2,5 см. Готовая среда имеет бледно-розовый цвет.
Применение: для посева используют агаровую культуру бактерий, которую засевают бактериологической петлей вначале на поверхность скошенной части среды (косяка), затем уколом в столбик. Засеянные пробирки инкубируют при 37 - 38 °С в течение 24 - 48 часов.
В культурах, ферментирующих только глюкозу, столбик окрашивается в желтый цвет, косяк имеет розовый цвет. В культурах, ферментирующих глюкозу, а также лактозу и сахарозу или только один из последних двух сахаров, столбик и косяк окрашиваются в желтый цвет. Культуры, расщепляющие мочевину, окрашивают столбик и косяк в красный цвет; при образовании сероводорода столбик (или часть его) приобретает черный цвет. Газообразование устанавливают по наличию трещин и разрывов в столбике среды.
Среда Клиглера
Агар Клиглера готовят из сухой коммерческой среды согласно рецепту, указанному на этикетке.
При отсутствии готовой среды ее приготовляют по следующему рецепту:
Лактоза - 10 г
Сахароза - 10 г
Глюкоза - 1 г
Железо сернокислое (FeSO4×7Н2O) - 0,2 г
Натрий тиосульфат (Na2S2O3×5Н2O) - 0,08 г
Натрий сульфит (Na2SO3) - 0,04 г
Феноловый красный (0,2 % раствор в 50 % этиловом спирте - 12 см3
Агар питательный сухой - 20 г
Вода дистиллированная - 1000 см3
Порядок и последовательность растворения компонентов среды, величина pH, объем готовой среды в пробирках и режим стерилизации такие же, как и при приготовлении среды Олькеницкого. Готовая среда имеет буровато-красный или оранжево-красный цвет.
Применение: условия посева культур бактерий, время инкубирования пробирок и характер изменений в столбике и на косяке среды аналогичны тем, которые наступают в среде Олькеницкого.
СОДЕРЖАНИЕ
