СПРАВОЧНИК
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
В ВЕТЕРИНАРИИ
ВИРУСНЫЕ, РИККЕТСИОЗНЫЕ
И ПАРАЗИТАРНЫЕ БОЛЕЗНИ
Под редакцией Б.И. АНТОНОВА
![]()
МОСКВА АГРОПРОМИЗДАТ 1987
Составители: Б.И. Антонов, В.В. Борисова, Л.П. Каменева, Л.И. Ковалерчук, Г.А. Михальский, В.Д. Певнева, Л.И. Прянишникова.
В книге даны методы лабораторного исследования патологического материала с целью определения возбудителей вирусных, риккетсиозных и паразитарных болезней животных. Они изложены по единой схеме. Методы унифицированы и стандартизированы.
Для ветврачей и фельдшеров, лаборантов ветеринарных лабораторий.
ПРЕДИСЛОВИЕ
Успешное выполнение намеченной ХХVII съездом КПСС широкой программы развития в нашей стране агропромышленного комплекса в немалой степени зависит от хорошей организации ветеринарного обслуживания животноводства, четко налаженной работы ветеринарных диагностических лабораторий. Проводимые в лабораториях исследования позволяют правильно организовать мероприятия по предупреждению инфекционных и инвазионных болезней, а в случаях возникновения заболевания своевременно поставить диагноз и принять целенаправленные меры по его быстрейшей ликвидации.
В работе ветеринарных лабораторий все большее применение находят современные методы исследований, одновременно идет совершенствование диагностики многих заболеваний, предлагаются новые более чувствительные и достоверные методы, позволяющие полнее и на ранних стадиях выявлять заболевших животных и тем самым способствовать быстрейшему оздоровлению хозяйств.
Специалисты лабораторий постоянно расширяют перечень показателей и болезней, на которые проводятся исследования.
За последнее время утверждено значительное количество инструктивных документов по проведению лабораторных исследований, что позволило более четко организовать работу специалистов, улучшить качество исследований, получать сопоставимые результаты.
Оснащение лабораторий современным оборудованием позволяет внедрять в работу более точные инструментальные методы.
В своей работе ветеринарные лаборатории не могут использовать всего многообразия предлагаемых методов исследования из-за того, что они или недостаточно апробированы, или из-за сложности используемого оборудования. Имеют место случаи, когда предлагаемые различными авторами методы при определении одних и тех же показателей дают несовпадающие результаты. Поэтому в настоящий справочник включены методы лабораторных исследований патологического материала, полученного от больных, убитых или павших сельскохозяйственных животных, апробированные Центральной ветеринарной лабораторией и утвержденные в разные годы бывшим Министерством сельского хозяйства СССР.
Книга содержит методические указания по диагностике вирусных, риккетсиозных, хламидиозных болезней, а также методические указания по лабораторной диагностике паразитарных болезней животных и пчел.
Методики излагаются по единой схеме: взятие и пересылка патологического материала, методы его обработки, микроскопические исследования, включая световую и люминесцентную микроскопию, выделение возбудителей на куриных эмбрионах и культурах клеток, заражение лабораторных животных, гистологические исследования, идентификация и дифференциация возбудителей с использованием различных методов, определение биологической активности вакцин и исследования на напряженность иммунитета.
Методы лабораторных исследований, представленные в справочнике, унифицированы и стандартизированы, что создает возможность для стандартизации аппаратов, приборов, инструментов, посуды, реактивов, биопрепаратов и другого специального имущества, определения объема подготовки специалистов и степень оснащения ветеринарных диагностических лабораторий. Таким образом, стандартизация методов исследования является способом наведения строгого порядка в ветеринарной лабораторной работе.
МЕТОДЫ ДИАГНОСТИКИ ВИРУСНЫХ
И РИККЕТСИОЗНЫХ ИНФЕКЦИЙ
БОЛЕЗНИ, ОБЩИЕ ДЛЯ ВСЕХ ВИДОВ ЖИВОТНЫХ
БЕШЕНСТВО
Методические указания
по лабораторной диагностике бешенства
(утверждены 27 февраля 1970 г.)
1. Диагноз на бешенство ставят на основании комплекса эпизоотологических, клинических, патологоанатомических данных и главным образом на основании лабораторных исследований.
2. Для исследования направляют в лабораторию с нарочным: свежий труп или голову от собаки (кошки, лисицы, песца, овцы, теленка и др.), от крупных животных - голову или головной мозг (свежий или консервированный в 30 - 50 %-ном растворе глицерина). Для серологических исследований пригоден только неконсервированный мозг.
3. Лабораторная диагностика бешенства заключается в микроскопическом исследовании головного мозга (с целью обнаружения телец Бабеша-Негри), серологическом (обнаружение специфического рабического антигена), а также в постановке биологической пробы на белых мышах или кроликах.
Порядок исследований.
4. Из головного мозга, поступившего для исследования, делают сначала засев на питательные среды. Часть мозга сразу же помещают в холодильник и сохраняют на случай необходимости повторного исследования. Из оставшейся части мозга берут материал для микроскопического исследования, серологических реакций и биологической пробы.
Примечание. Вскрытие трупа, изъятие мозга и другие работы проводят в стерильных условиях при строгом соблюдении мер личной профилактики (прочная фиксация головы животного, защита рук двумя парами перчаток - хирургическими и анатомическими; для защиты глаз надевают очки, а на нос и рот - марлевую повязку).
I. Микроскопические исследования
5. Для микроскопического исследования делают отпечатки и мазки из разных участков головного мозга.
6. Для приготовления отпечатка кусочки головного мозга (аммонов рог, кора полушарий, мозжечок, продолговатый мозг) кладут на фильтровальную бумагу, сложенную в 4 - 6 слоев. К поверхности среза несколько раз (3 - 4) подряд прикасаются чистым предметным стеклом, слегка надавливая его, чтобы на стекле получился тонкий отпечаток.
7. Мазки делают из тех же участков головного мозга. Для этого кусочки мозга растирают в фарфоровой ступке пестиком или в пробирке стеклянной палочкой до образования гомогенной массы, из которой делают грубые мазки на обезжиренном предметном стекле.
Можно делать мазки и другим способом. Для этого небольшой кусочек мозга кладут на край предметного стекла, а другим стеклом раздавливают его и размазывают от одного края до другого, в результате чего на поверхности стекла получается тонкий равномерный мазок.
8. Полученные мазки или отпечатки окрашивают одним из следующих способов:
а) окраска по Муромцеву. Изготовленные, еще влажные мазки или отпечатки сразу же фиксируют в этиловом или метиловом спирте или в смеси спирта пополам с эфиром или ацетоном (химически чистым) в течение 1 - 2 ч и после этого промывают водой. Сосуд с фиксатором должен быть хорошо закрыт, чтобы предупредить испарение фиксирующей жидкости. После промывания водой влажные мазки помещают на 5 - 10 мин в раствор краски Мансона, разведенной водой 1:40. Затем краску сливают и тут же мазки погружают в 10 %-ный водный раствор танина на 8 - 10 мин до появления голубоватой окраски. После этого мазки промывают водой, высушивают фильтровальной бумагой, проводят через смесь из равных частей спирта с ацетоном (химически чистым) или спирта с ксилолом и снова высушивают фильтровальной бумагой. Окрашенный мазок должен иметь светло-голубой фон, при этом ядра нервных клеток окрашиваются в синий цвет, а тельца Бабеша-Негри - в бледно-фиолетовый с темными включениями;
б) окраска по Селлерсу. На приготовленный влажный отпечаток или мазок наносят на 4 - 5 с смесь реактива «А» (метиленовый синий - 2 г, метиловый спирт без ацетона - 100 мл) и реактива «В» (основной фуксин - 0,5 г, этиловый спирт без следов ацетона - 100 мл). Рабочий раствор красителя состоит из 15 мл реактива «А», 2 - 4 мл реактива «В» и 25 мл метилового спирта. После окраски препарат промывают проточной водой и высушивают.
В окрашенном мазке цитоплазма нейронов ярко-синяя, ядрышки темно-синие, эритроциты кирпично-красные, тельца Бабеша-Негри пурпурно-красные с отчетливо видной базофильной структурой телец;
в) окраска по Михину. Мазки или отпечатки фиксируют в смеси спирта и эфира (поровну) в течение 5 - 10 мин, после чего их просушивают фильтровальной бумагой и окрашивают в течение 30 - 40 мин краской Гимза (1 - 2 капли на 1 мл дистиллированной воды), быстро промывают подкисленным спиртом (1 капля ледяной уксусной кислоты на 30 мл 96°-ного спирта), а затем водой, просушивают фильтровальной бумагой и подвергают исследованию. Если материал был в глицерине, то его предварительно хорошо прополаскивают в воде и просушивают фильтровальной бумагой.
В окрашенном препарате при микроскопическом исследовании основной фон должен быть красным с фиолетовым оттенком. При преобладании синего тона мазок снова обмывают подкисленным спиртом и промывают водой. Пирамидальные нервные клетки имеют синеватый цвет с интенсивно черным ядром, а тельца Бабеша-Негри - розово-красный с точечными включениями темно-синего цвета;
г) окраска по Борману-Гайнуллиной. Тонкие мазки или отпечатки в течение 5 мин фиксируют в смеси следующего состава: спирта и эфира (поровну) - 98 мл, ледяной уксусной кислоты - 2 мл; после фиксации их погружают на 5 мин в 10 % -ный раствор кристаллической соды, а затем промывают водой и просушивают на воздухе. Зафиксированные мазки в течение 2 мин окрашивают краской, приготовленной перед ее употреблением (насыщенного водного раствора метиленовой сини - 3 капли, насыщенного основного раствора фуксина - 2 капли, водопроводной воды - 20 мл). Раствор краски наливают на мазок, фиксируют над пламенем горелки, затем краску оставляют еще на одну минуту, после чего промывают водой и просушивают фильтровальной бумагой.
В окрашенном мазке основной фон должен быть ярко-красным, протоплазма нервных клеток окрашивается в красновато-синий цвет, а их ядра - в темно-синий, тельца Бабеша-Негри окрашиваются в землянично-красный цвет с типично гранулярной структурой. Эритроциты имеют вид неокрашенных кружочков.
II. Серологические исследования
9. Реакция диффузной преципитации в агаровом геле. Реакция применяется для обнаружения специфического рабического антигена в неконсервированном головном мозге животных, павших от уличного бешенства, а также у животных, на которых ставилась биопроба. Для реакции можно использовать несвежий (до 1 мес.) головной мозг.
Реакцию выполняют на предметных обезжиренных стеклах, на которые наносят 2,5 мл расплавленного и охлажденного до 60 °С агарового геля, приготовленного по прописи: сухой агар-агар - 12 - 15 г; химически чистый хлористый натрий - 8,5 г; 1 %-ный раствор (фильтрованный) метилоранжа на 50°-ном спирте - 5 - 10 мл; мертиолят - 0,01 г; вода дистиллированная - 1 л.
Примечание. Для постановки реакции лучше употреблять агар-агар фирмы «Дифко», он полностью растворяется, фильтрование среды не требуется. Другие сорта агар-агара требуют тщательной фильтрации.
После застывания агара в нем делают лунки с помощью тонкостенной металлической или стеклянной трубочки с внутренним диаметром 4 - 5 мм, располагая их согласно трафарету (см. рис. 1 - 4).
Для реакции используют кусочки головного мозга крупных животных - аммонов рог, кору полушарий, мозжечок, продолговатый мозг; крыс, сусликов, морских свинок, хомяков и др. - три каких-либо отдела мозга; мышей - весь головной мозг.
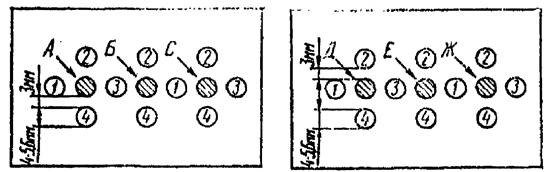
Рис. 1. Схема постановки микропреципитации:
А - кора (левое полушарие); Б - кора (правое
полушарие); С - аммонов рог (левый);
Д - аммонов рог (правый); Е - мозжечок; Ж - продолговатый
мозг;
1, 2, 3, 4 - разведения глобулина, соответственно
1:2, 1:4, 1:8, 1:16.
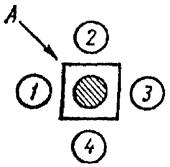
Рис. 2. Положительная РП со всеми разведениями глобулина
(кора головного мозга овцы, уличное бешенство)
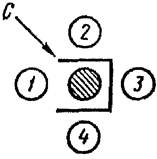
Рис. 3. Положительная РП с разведениями глобулина 1:4; 1:8,
1:16
(аммонов рог собаки, уличное бешенство)
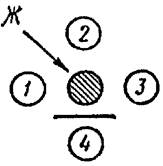
Рис. 4. Положительная РП с разведениями
глобулина 1:16,
отсутствуют линии преципитации с разведениями 1:2, 1:4, 1:8
(продолговатый мозг собаки, уличное бешенство)
Мозг растирают в фарфоровой ступке пестиком или в самой черепной коробке в «пасту», которой заполняют луночки для антигена. Остальные луночки заполняют преципитирующим антирабическим глобулином в разведении 1:2, 1:4, 1:8, 1:16. Объем используемых ингредиентов составляет 0,02 мл.
Контроли с положительными и отрицательными антигенами ставят одновременно на отдельном стекле с использованием того же агара по тому же трафарету.
После того как ингредиенты реакции помещены в соответствующие луночки, предметные стекла переносят во влажную камеру (чашки Петри с влажной фильтровальной бумагой или ватой) и ставят в термостат на 6 ч при температуре 37 - 38 °С. Затем чашки оставляют при комнатной температуре еще на 18 ч.
Учет реакции проводят через 3, 6 и 24 ч после ее постановки. Во избежание высыхания агара стекла с реакцией после каждого просмотра помещают в те же чашки Петри, содержащие увлажненную вату.
При положительной реакции преципитации в агаре между лунками с глобулином и антигеном могут образовываться одна, две и очень редко три параллельно расположенные линии преципитации. Образовавшиеся линии преципитации видимы визуально при просвечивании стекол осветителем снизу вверх под углом приблизительно 45°.
При отрицательных показаниях реакции преципитации ставят биопробу.
10. Реакция иммунофлуоресценции. Основана на выявлении специальными микроскопами (МЛ-1, МЛ-2, МЛ-3 и др.) вирусного антигена, вступившего в реакцию со специфической антирабической сывороткой, «меченой» флуоресцирующим красителем.
Для реакции делают тонкие и равнослойные отпечатки на тщательно обезжиренных стеклах из свежего или свежемороженого головного мозга. Отпечатки готовят из кусочков головного мозга (аммонов рог, кора полушарий, мозжечок, продолговатый мозг) так же, как и для микроскопического исследования. От каждого кусочка мозга готовят не менее 4 препаратов. Для контроля аналогично делают препараты из мозга здорового животного.
После высушивания на воздухе препараты фиксируют в ацетоне в течение 4 ч при температуре не выше 4 °С. Сосуд с фиксатором должен быть хорошо закрыт, чтобы предупредить испарение фиксирующей жидкости. После фиксации ацетоном наносят на препараты несколько капель конъюгата (флуоресцирующий антирабический гамма-глобулин) в рабочем разведении. Затем их помещают во влажную камеру (чашку Петри или закрытый эмалированный кювет с увлажненным дном) на 20 - 30 мин при температуре 25 °С.
После этого препараты промывают водой или фосфатным буферным раствором (pH 7,2 - 7,4) в течение 1 ч, затем ополаскивают дистиллированной водой, высушивают на воздухе и подвергают исследованию. Препараты просматривают под иммерсионной системой. Для иммерсии используют нелюминесцирующее масло.
В окрашенном препарате при люминесцентной микроскопии мозговая ткань флуоресцирует (светится) тусклым серовато-желтым цветом. Антиген вируса бешенства выявляется в препаратах в виде ярких желтовато-зеленых или зеленых гранул различной формы и величины - от едва заметных до имеющих 15 - 20 мкм в диаметре.
В контрольном препарате желто-зеленых интенсивно светящихся гранул не отмечается.
При исследовании с помощью метода флуоресцирующих антител диагноз бешенства считается установленным, если в нескольких полях зрения микроскопа обнаруживают достаточное количество (не менее 10) типичных гранул с ярким зеленоватым свечением различной величины. В контроле подобных образований не должно быть.
При отсутствии положительной флуоресценции ставят биологическую пробу.
III. Биологическая проба
11. Биологическую пробу на бешенство ставят, если получен отрицательный результат: при микроскопическом исследовании (тельца Бабеша-Негри не обнаружены), при серологических реакциях (специфический рабический антиген не выявлен), а также при выявлении атипичных включений. Биологическую пробу проводят на белых мышах или кроликах.
12. Опытных мышей или кроликов заражают 10 %-ной суспензией из исследуемого мозга на физиологическом растворе или мясопептонном бульоне с pH 7,2 - 7,4. Для приготовления суспензии используются те же участки головного мозга, из которых брали материал для микроскопического и серологического исследований.
Вырезанные участки головного мозга собирают в стерильную пробирку и взвешивают, а затем тщательно растирают в ступке пестиком, после чего добавляют физиологический раствор или мясопептонный бульон из расчета получения 10 %-ной суспензии. Полученную суспензию отстаивают в течение 10 мин и для заражения используют надосадочную жидкость.
Если патологический материал был загрязнен, то надосадочную жидкость сливают в другой сосуд (пробирку) и к ней добавляют по 500 - 1000 ЕД пенициллина и стрептомицина на 1 мл жидкости, после чего отстаивают еще 30 мин при комнатной температуре и затем используют для заражения. Суспензию необходимо готовить в стерильных условиях и при строгом выполнении правил личной профилактики.
Биологическая проба на белых мышах. Для заражения используют белых мышей массой 8 - 10 г. Для каждого исследования берут 6 мышей, из которых трех заражают в головной мозг, а трех - подкожно. При заражении в мозг иглу вводят в точке за линией, соединяющей задние углы и немного в стороне от линии, проходящей посередине головы. Место заражения протирают спиртом. Суспензию вводят в дозе 0,03 мл. Для предупреждения глубокого проникновения иглы в мозг на ее кончик надевают ограничитель - небольшой кусочек резиновой трубки, который укрепляют на расстоянии 2 - 3 мм от конца иглы. При подкожном заражении суспензию вводят в область кончика носа (в верхнюю губу) в дозе 0,05 мл. На месте введения суспензии образуется небольшая припухлость. Зараженных мышей помещают в стеклянные банки и наблюдают за ними в течение 30 дн. При положительном результате биологической пробы у мышей обычно на 7 - 15-й день после заражения развивается клиника паралитического бешенства.
Вначале отмечаются вялость, взъерошенность шерсти и своеобразная горбатость, а также нарушение координации движений. Затем наступает паралич задних конечностей, а позднее - передних, переходящих в общий паралич, заканчивающийся смертью. Продолжительность болезни 2 - 3 сут.
С развитием общего паралича мышей умерщвляют при помощи эфирного или хлороформенного наркоза. У павших и убитых мышей вскрывают черепную полость, делают засев из мозга на питательные среды, после чего извлекают головной мозг, из которого готовят препараты для микроскопического и иммунобиологических исследований.
При отсутствии клинических проявлений бешенства у зараженных мышей в течение 30 дн. их уничтожают. Банки, в которых они содержались, тщательно дезинфицируют.
Биологическая проба на кроликах. Для постановки биологической пробы берут четырех кроликов массой не менее 1,5 кг каждый. Двух кроликов заражают в мозг и двух внутримышечно в области бедра. Суспензию вводят интрацеребрально в дозе 0,2 мл, а внутримышечно - в дозе 2 мл.
При положительном результате биологической пробы кролики заболевают в течение 16 - 21 дня. Заболевание бешенством протекает у кроликов в тихой паралитической форме со смертельным исходом. У павших кроликов извлекают головной мозг и дальнейшее исследование проводят так же, как и при заражении мышей. Наблюдение за кроликами ведут в течение 45 - 50 дн. По истечении указанного срока кроликов уничтожают. Клетки, в которых содержались подопытные животные, дезинфицируют.
IV. Гистологическое исследование*
________
* Гистологическое исследование используют в качестве дополнительного метода
Для гистологического исследования берут кусочки аммонова рога, коры полушарий, мозжечка, продолговатого мозга и фиксируют в одной или двух порциях ацетона так, чтобы продолжительность фиксации была в пределах 6 - 18 ч. Лучше фиксацию в ацетоне оставлять на ночь. Затем патматериал проводят через две порции ксилола, выдерживая по 30 мин в каждой, и через две порции парафина - по 1 ч в каждой. Готовые срезы депарафинируют обычным методом и окрашивают по Ленцу или Туревичу:
окраска по Ленцу. Срезы окрашивают раствором эозина 1 - 3 мин (0,5 г эозина растворяют в 100 мл 60°-ного этилового спирта). Эозин быстро смывают водой и в течение 1 мин окрашивают метиленовой синькой Лёфлера, промывают водой, осторожно подсушивают фильтровальной бумагой и дифференцируют раствором едкого натра в абсолютном спирте (5 капель едкого натра на 30 мл спирта) до бледно-розового цвета. На препарат наливают раствор уксусной кислоты (1 капля ледяной уксусной кислоты на 60 мл абсолютного спирта) и держат до появления слабо-синей окраски, быстро смывают спиртом и просветляют ксилолом в течение 4 - 5 мин.
Тельца Бабеша-Негри окрашиваются в ярко-красный цвет с синими включениями, цитоплазма ганглиозных клеток - в бледно-голубой;
окраска по Туревичу. Депарафинированные срезы сразу после проводки через спирты и дистиллированную воду окрашивают гематоксилином Вейгерта или Эрлиха, промывают дистиллированной водой. Затем окрашивают 1 %-ным водным раствором кислого фуксина в течение 1 мин и тщательно промывают дистиллированной водой до появления бледно-розового оттенка. После промывки обрабатывают смесью (в равных частях) насыщенного водного раствора пикриновой кислоты (на 1 л горячей дистиллированной воды 25 - 30 г пикриновой кислоты) и 96°-ного спирта. При обработке наблюдают отхождение облачков красной краски, и срезы через 10 - 20 с приобретают желтый оттенок. Срезы быстро прополаскивают в воде и слегка обсушивают фильтровальной бумагой. Затем так же быстро проводят через абсолютный или 96°-ный спирт, карбол-ксилол, чистый ксилол и заключают в бальзам.
Тельца Бабеша-Негри - вишнево-красного цвета, ядра клеток - черные или синие в зависимости от того, каким гематоксилином они окрашены. По форме и величине тельца Бабеша-Негри весьма разнообразны, находятся в цитоплазме и отростках нервных клеток в виде многочисленных или одиночных экземпляров. Чаще тельца Бабеша-Негри обнаруживают в крупных ганглиозных клетках, причем клетки, содержащие их, не имеют выраженных признаков дегенерации.
Нередко обнаруживают другие включения, которые из-за ряда сходных признаков иногда принимают за тельца Негри. Следует иметь в виду, что в мозге здоровых кошек и белых мышей иногда содержатся неспецифические ацидофильные тельца-включения. Эти тельца можно отдифференцировать от телец Негри по отсутствию внутренних гранул и гомогенности основной субстанции.
Для бешенства также характерны признаки острого энцефаломиелита: преимущественно вокруг мелких вен обнаруживают периваскулярные инфильтраты, состоящие в основном из лимфоидных клеток, имеющих вид клеточных муфт. В ганглиозных клетках головного мозга могут быть хроматолиз, вакуолизация и острое набухание клеток, а также гибель отдельных клеток. В области поврежденных нервных клеток довольно постоянна пролиферативная реакция глии, принимающая форму истинной нейронофагии с последующим замещением нервных клеток элементами размножившейся глии. Такое скопление клеток пролиферата на месте распавшейся нервной клетки носит название «узелка бешенства» - на срезе иногда можно проследить процесс развития узелка.
Содержание
|
I. Микроскопические исследования. 2 II. Серологические исследования. 4 IV. Гистологическое исследование. 7
|