Государственное
санитарно-эпидемиологическое нормирование
Российской Федерации
Федерации Федеральная служба по надзору в сфере
защиты прав потребителей
и благополучия человека
4.2.
МЕТОДЫ КОНТРОЛЯ.
БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика внебольничной
пневмонии пневмококковой этиологии
Методические
рекомендации
МР 4.2.0114-16
Москва 2017
1. Разработаны Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Ю.В. Демина), ГБОУ ВПО ПГМУ им. ак. Е.А. Вагнера Минздрава России (И.В. Фельдблюм, Ю.А. Захарова, В.В. Николенко, Н.Н. Воробьева, С.О. Голоднова, А.В. Климашина), МБУЗ «Городская клиническая больница № 8» г. Челябинска (О.А. Орлова), ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора (В.В. Малеев, Г.А. Шипулин, С.Б. Яцышина, К.О. Миронов), «Научно-исследовательский институт антимикробной химиотерапии» ГБОУ ВПО «Смоленская ГМА» Минздрава России (Р.С. Козлов, С.А. Рачина), ФГБУ «Научно-исследовательский институт эпидемиологии и микробиологии им. Н.Ф. Гамалея» Минздрава России (И.С. Тартаковский), ФГБУЗ «Научно-исследовательский институт детских инфекций» ФМБА России (С.В. Сидоренко, В.В. Гостев, М.О. Волкова).
2. Утверждены и введены в действие Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации А.Ю. Поповой 20 октября 2016 г.
3. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель
Федеральной службы _______________________ А.Ю. Попова 20 октября 2016 г. |
4.2.
МЕТОДЫ КОНТРОЛЯ.
БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика внебольничной пневмонии
пневмококковой этиологии
Методические рекомендации
МР 4.2.0114-16
1. Область применения
1.1. Настоящие методические рекомендации (далее - МР) определяют порядок лабораторной диагностики заболеваний, в первую очередь пневмоний пневмококковой этиологии.
1.2. Методические рекомендации предназначены для специалистов организаций, осуществляющих лабораторную диагностику заболеваний органов дыхания, индикацию патогенов инфекций верхних и нижних дыхательных путей.
2. Термины и сокращения
БАЛ - бронхоальвеолярный лаваж
ВКО - внутренний контрольный образец
ВОЗ - всемирная организация здравоохранения
ВП - внебольничная пневмония
ГЭ/мл - количество геном-эквивалентов в 1 миллилитре
ДНК - дезоксирибонуклеиновая кислота
ИХА - иммунохроматографический анализ
КОЕ/мл - колониеобразующие единицы в 1 миллилитре
МО - медицинская организация
МПК - минимальная подавляющая концентрация
МУ - методические указания
β-НАД - никотинамидадениндинуклеотид
OК - отрицательный контроль экстракции
ОРВИ - острая респираторная вирусная инфекция
ОРИТ - отделение реанимации и интенсивной терапии
ПК - положительный контроль экстракции
ПЦР - полимеразная цепная реакция
СМЖ - спинномозговая жидкость
СП - санитарно-эпидемиологические правила
УФ-бокс - ультрафиолетовый бокс
ФКР - Федеральные клинические рекомендации
ЭДТА - этилендиаминтетрауксусная кислота
CNA-агар - селективный агар для выделения грамположительных бактерий с налидиксовой кислотой и колимицином
EUCAST - European on Antimicrobial Susceptibility Testing (Европейская система тестирования антимикробной восприимчивости)
3. Общие положения
Пневмонии - группа различных по этиологии, патогенезу, морфологической характеристике острых инфекционных заболеваний, характеризующихся поражением легких с обязательным наличием внутриальвеолярной экссудации, сопровождающихся симптомами патологии нижних отделов дыхательных путей (лихорадка, кашель, выделение мокроты, возможно гнойной, боль в грудной клетке, одышка) и рентгенологическими признаками «свежих» очагово-инфильтративных изменений в легких при отсутствии очевидной диагностической альтернативы. Внебольничной пневмонией считают заболевание, возникшее во внебольничных условиях (вне стационара или позднее 4 недель после выписки из него) или диагностируемое в первые 48 часов с момента госпитализации, а также развивающееся у пациента, не находившегося в домах сестринского ухода длительного медицинского наблюдения более 14 суток.
По данным федерального статистического наблюдения (форма № 2 «Сведения об инфекционных и паразитарных заболеваниях»), за 2011 - 2014 гг. заболеваемость ВП в России находилась на уровне 310 - 380 на 100 тыс. населения (600 - 750 случаев на 100 тыс. детей в возрасте до 14 лет).
У отдельных категорий граждан, в частности у военнослужащих срочной службы, медицинских работников, заболеваемость пневмококковыми пневмониями превышает уровень заболеваемости среди населения в целом.
Показатель смертности при ВП в 2011 - 2014 гг. составлял 2,9 - 3,9 на 100 тыс. населения (у детей в возрасте до 14 лет - 0,3- 0,4 на 100 тыс.). В структуре младенческой смертности заболевания органов дыхания стоят на третьем месте (около 7 %), из них около 74 % приходится на пневмонии.
Этиологическая структура ВП может различаться в зависимости от возраста пациентов, тяжести заболевания и наличия сопутствующей патологии. По зарубежным данным, пневмококковые пневмонии диагностируют у 5 % взрослых амбулаторных пациентов, 17,3 % госпитализированных в терапевтические отделения и 21 % - в отделения интенсивной терапии. В Российской Федерации по расчетным данным частота пневмококковых пневмоний у детей в возрасте от 1 месяца до 15 лет составляет 490 случаев на 100000 детского населения соответствующего возраста, в возрасте от 1 месяца до 4 лет - 1060 случаев.
Дети первых лет жизни являются основными источниками пневмококковой инфекции, заражая окружающих взрослых. Так, при средней частоте носительства у взрослых в 5 - 7 %, среди взрослых, проживающих с детьми, она может достигать 30 %.
По данным отчетной формы государственного статистического наблюдения в России (ф-2), пневмококковая этиология ВП подтверждается лишь в 1,3 % случаев.
Создавшаяся ситуация требует поиска новых диагностических подходов и разработки алгоритмов выявления S. pneumoniae, включая стандартизацию бактериологических и серологических тестов, внедрение в работу практической медицины современных молекулярно-биологических и иммунохроматографических способов детекции возбудителя.
4. Биологические свойства Streptococcus
pneumoniae, общая
характеристика методов лабораторной диагностики
Возбудитель пневмококковой пневмонии, S. pneumoniae или пневмококк, входит в состав семейства Streptococcaceae, род Streptococcus, как вид условно-патогенных бактерий. Пневмококки - грамположительные каталазо- и оксидазоотрицательные мелкие шаровидные бактерии (кокки), являющиеся факультативными анаэробами.
При микроскопии часто имеют ланцетовидную форму, располагаются парами (диплококк), нередко имеют капсулу. Из жидких питательных сред под микроскопом визуализируются цепочками средней длины. При искусственном культивировании пневмококк нуждается в специальных питательных основах, обогащенных дефибринированной кровью животных. Рост возбудителя в искусственных условиях культивирования стимулирует повышенное содержание в атмосфере СO2.
На плотных питательных средах пневмококк образует мелкие (1 - 2 мм в диаметре), округлые, блестящие, бесцветные колонии с ровным краем, мягкой консистенции, которые в большинстве случаев через 24 часа инкубации имеют сферическую форму с уплощенным центром, образующимся в результате аутолиза (шероховатая R-форма).
На 5 %-м кровяном агаре вокруг колоний пневмококка характерно образование зеленящей зоны альфа-гемолиза. Наиболее вирулентные капсульные бактерии могут располагаться в виде капель росы, в последующем принимая сливной рост (мукоидная М-форма). Гладкие, компактные, точечные колонии (S-форма) преобладают у авирулентных штаммов.
Рост S. pneumoniae на жидких питательных средах характеризуется диффузным помутнением бульона без образования пленки.
Биохимическая активность пневмококка во многом совпадает с активностью других зеленящих стрептококков: он разлагает глюкозу, лактозу, мальтозу, сахарозу, не ферментирует маннит, салицин и сорбит, однако в отличие от других представителей зеленящих форм стрептококков не обладает способностью к росту при температуре 45 °С.
Видовая специфичность пневмококка выражается в способности ферментировать инулин, чувствительности к оптохину и солям желчных кислот (дезоксихолату и таурохолату натрия). Вместе с тем в последние годы появились изоляты, устойчивые к оптохину (до 10 % от всей популяции).
Вирулентность пневмококка в первую очередь обусловлена наличием полисахаридной капсулы, обеспечивающей антифагоцитарную активность, а также протеина адгезии, протеазы секреторного IgA, тейхоевой кислоты и фрагментов пептидогликана, активизирующих комплемент по альтернативному типу.
В зависимости от химического строения капсульного полисахарида выделяют более 90 серологических типов S. pneumoniae: серогруппы (обозначаются цифрами, например: серогруппа 6) и входящие в них серотипы (обозначаются буквами, например: серотип 6А). Определение серологических типов проводится с использованием серологических методик, основанных на реакции набухания капсулы в присутствии иммунной сыворотки или в реакции латкес-агглютинации. Альтернативным способом определения серогрупп (серотипов) является детекция специфических локусов бактериальной ДНК, вовлеченных в биосинтез капсульного полисахарида, с помощью различных ПЦР-методик или секвенирования ДНК.
Более 90 % инвазивных заболеваний вызывается 23 серотипами возбудителя, которые входят в широко используемую в настоящее время полисахаридную вакцину (1, 2, 3, 4, 5, 6В 7F, 8, 9N, 9V, 10А, 11А, 12F, 14, 15В, 17F, 18С, 1-9F, 19А, 20, 22F, 23F, 33F).
Спектр антибиотикорезистентности пневмококка зависит от географического места изоляции и вида материала, из которого изолирован штамм (мазок из носоглотки, спинномозговая жидкость и др.). В России уровень устойчивости пневмококков, выделенных из нестерильных локусов, к пенициллинам (МПК > 0,06 мг/л) составляет в среднем 11 %, к макролидам - 7 %, к тетрациклинам - 25 %, к ко-тримоксазолу - 39 %. Полирезистентностью (устойчивостью к 3 и более классам антимикробных препаратов) обладает 14,5 % штаммов пневмококка, большинство из которых (> 90 %) выделено из респираторных образцов. Пневмококки 23-й, 19-й и 6-й серогрупп (серотипы 23F, 19F, 19А, 6В) часто характеризуются повышенной устойчивостью к пенициллину и другим антибактериальным препаратам, а также могут обладать полирезистентными свойствами, что обусловлено генетическими мутациями циркулирующих возбудителей.
Микроскопическое исследование относится к простым ускоренным методам обнаружения S. pneumoniae, позволяющим получить предварительный результат. Бактериоскопия окрашенного по Граму мазка определяет морфотип потенциального бактериального патогена. Ценность метода и решаемые задачи различаются в зависимости от того, из какого локуса организма отобран клинический материал.
Модифицированным вариантом микроскопии в комбинации с серологической диагностикой S. pneumoniae является метод Нейфельда или феномен набухания капсулы при взаимодействии с неразведенной специфической антипневмококковой сывороткой (I, II, III типов) в присутствии синьки Лёффлера. Метод основан на способности капсул пневмококков увеличиваться в объеме в присутствии гомологичной антисыворотки, что регистрируют светооптической микроскопией. При положительном результате наблюдается резкое увеличение капсул пневмококков. При отрицательном результате капсулы едва заметны. Реакция набухания специфична и не дает положительного результата с другими капсульными бактериями, однако с его помощью невозможно идентифицировать не имеющие капсулы S. pneumoniae.
Пневмококки, имеющие капсулу, также можно визуализировать по методу Бурри-Гинса. По Бурри материал перемешивают с тушью, на фоне которой будут выделяться неокрашенные бактерии и капсулы. В модификации Гинса приготовленный по Бурри препарат дополнительно окрашивается фуксином Циля, при этом бактерии приобретают ярко малиновую окраску, а их капсулы остаются неокрашенными.
У пациентов, принимавших антибактериальные препараты, данные методы могут давать ложно-отрицательные результаты, поскольку в этом случае в клиническом материале могут присутствовать пневмококки, лишенные капсулы. Следует помнить, что при переходе S. pneumoniae из S в R-форму капсульные антигены утрачиваются.
Бактериологический метод позволяет выделить «чистую» культуру возбудителя, провести его видовую идентификацию и серотипирование, определить чувствительность к антимикробным препаратам.
Основной сложностью при выделении культуры пневмококка является требовательность к условиям культивирования и склонность микроорганизма к быстрому аутолизу (саморазрушению). Ограничением метода может быть сложность получения мокроты и значительная продолжительность исследования (результат определяется спустя 48 - 72 часа с момента забора биологического материала). Диагностическая ценность будет ниже при исследовании крови и широком использовании антимикробных препаратов на догоспитальном этапе (низкий уровень высеваемости).
Отправной точкой идентификации пневмококков на кровяном агаре является гемолитическая реакция стрептококков. S. pneumoniae - α-гемолитический (зеленящий) стрептококк, который по морфологическим признакам роста трудно отличим от других α-гемолитических («зеленящих») стрептококков - S. mitis, S. oralis, S. sanguis, S. parasanguis, S. gordonii.
Признаками, подтверждающими видовую принадлежность изолята, являются его морфология (грамположительные кокки), отсутствие каталазо- и оксидазообразования, чувствительность к оптохину и лизис солями желчи. Оптохин (этилгидрокупреина гидрохлорида) селективно подавляет рост пневмококка в отличие от других «зеленящих» стрептококков. Соли желчи (в особенности дезоксихолат натрия и таурохолат натрия) обладают способностью избирательно лизировать колонии S. pneumoniae на агаре или в бульоне. Метод основан на активации пневмококковых аутолизинов - ферментов, участвующих в синтезе клеточной стенки, что приводит к визуальному лизису S. pneumoniae в течение 0,5 - 2 ч. Однако примерно для 14 % пневмококков наблюдается неполный лизис. Дифференциальная диагностика S. pneumoniae проводится с прочими представителями рода Streptococcus: S. pseudopneumoniae (чувствительного к оптохину, но устойчивого к желчи), S. pyogenes группы А (чувствительного к бацитрацину и положительного в ПИРА-тесте), S. agalactiae группы В (положительного в тесте с гиппуратом Na и САМР-тесте), зеленящими стрептококками группы S. viridans (как правило, растущих в тиогликолевой среде при температуре 45 °С). От представителей других родов: Neisseria spp., Haemophilus spp. и Corynebacterium spp., дающих схожий рост на средах первичного посева с атипичными формами пневмококков, их отличают морфология, оксидазная и каталазная активность.
Необходимо помнить, что в современной популяции до 10 % изолятов пневмококков устойчивы к оптохину, они также резистентны и к бета-лактамным антибиотикам. В то же время рост некоторых «зеленящих» стрептококков подавляется оптохином.
Принадлежность S. pneumoniae, устойчивых к оптохину, необходимо подтверждать с использованием комплекса тестов, дифференцирующих между собой различные виды стрепрококков, с помощью тест-систем коммерческого производства, разрешенных к применению в Российской Федерации.
К сожалению, один из современных методов идентификации бактерий по белковому профилю, MALDI-масс-спектрометрия, не может быть использован для идентификации S. pneumoniae в связи с высоким сходством белкового профиля различных видов α-гемолитических стрептококков.
Конечным этапом бактериологической диагностики S. pneumoniae является определение чувствительности к антибиотикам. В настоящее время теоретически обоснованным считается подход к оценке чувствительности, предлагаемый Европейским сообществом (European on Antimicrobial Susceptibility Testing - EUCAST), основанный на признании факта существования различий между микробиологической и клинической чувствительностыо/устойчивостью микроорганизмов. Для обоснования клинических критериев EUCAST использует фармакокинетические/фармакодинамические закономерности зависимости между величиной МПК антибактериального препарата в отношении микроба-возбудителя, фармакологическими характеристиками препарата и эффективностью лечения.
К способам обнаружения антигена пневмококка с целью его ускоренного выявления может быть отнесен метод латекс-агглютинации, основанный на выявлении пневмококковых капсульных полисахаридных антигенов с применением поливалентной специфической пневмококковой сыворотки. Антиген, содержащийся в исследуемом образце, взаимодействует со специфичными гомологичными антителами, которыми покрыты латексные частицы. В присутствии гомологичного антигена латексные частицы агглютинируют. В отсутствии антигена, они остаются в виде гомогенной суспензии.
Исследование проводят непосредственно с чашки первичного посева. Можно использовать сам биологический материал, как правило, ликвор или сыворотку крови. Быстроту получения результата и простоту теста могут нивелировать перекрестные реакции с антигенами других стрептококков. К преимуществам метода относят быстроту и простоту исполнения, к недостаткам - высокую стоимость, невозможность определения антигена в нестерильном биологическом материале.
В последние годы все большую популярность приобретают быстрые тесты «у постели больного», в частности иммунохроматографический экспресс-тест для выявления пневмококкового клеточного полисахарида (с-полисахарида) в моче.
Тест адаптирован только для образцов мочи взрослых пациентов и применяется до начала антибактериальной терапии. Не рекомендуется проводить данное исследование среди лиц, ранее перенесших внебольничную пневмонию или получивших профилактическую прививку от S. pneumoniae в течение 5 дней, предшествующих тестированию. Время выполнения исследования составляет 15 минут, чувствительность теста, по данным литературы, - 86 - 90 %, специфичность - 71 - 97 %.
Ряд международных сообществ рекомендует этот метод в качестве дополнительного способа диагностики пневмококковых пневмоний, прежде всего у пациентов с тяжелым течением заболевания. Диагностическая значимость теста снижается в популяциях с высоким носительством пневмококков S. pneumoniae и S. mitis. Отрицательный результат теста не исключает наличия пневмококковой инфекции.
Полимеразная цепная реакция (ПЦР) является прямым методом быстрой диагностики инфекционных болезней, позволяющим обнаруживать в качестве аналита специфичные участки генома инфекционного агента. Многообразие видов стрептококков, многие из которых являются непатогенными комменсалами верхних дыхательных путей, бессимптомное носительство пневмококка при применении ПЦР, как и в случае использования других методов, вызывает сложности и накладывает определенные ограничения.
Традиционно используемый для видового типирования бактерий ген 16S RNA не может быть использован в качестве мишени для ПЦР, поскольку гомология между разными видами стрептококков составляет 99 %.
В качестве диагностической мишени для ПЦР чаще используют гены, кодирующие факторы патогенности S. pneumoniae, в первую очередь, пневмолизин (ply) и аутолизин (lytA), ген, кодирующий пневмококковый поверхностный антиген (psaA), и протеин, участвующий в биосинтезе полисахаридов капсулы (cpsA). Все эти мишени могут быть использованы для обнаружения ДНК S. pneumoniae в крови, плевральной жидкости и ликворе, поскольку из множества видов стрептококков только S. pneumoniae может вызывать инвазивную инфекцию.
Исследования отделяемого со слизистой оболочки верхних дыхательных путей показали, что ply может присутствовать в геноме S. oralis и S. mitis, a lytA - в геноме S. mitis. Ген, кодирующий пневмококковый поверхностный антиген (psaA), также имеет высокую гомологию со стрептококками группы viridans. В связи с этим, тесты по обнаружению ply, lytA и psaA рекомендуют использовать только для стерильных локусов (кровь и плевральная жидкость, ликвор).
Вместе с тем существуют гены, отсутствующие у стрептококков группы viridans. К таким участкам ДНК S. pneumoniae относится cpsA, который содержится только у изолятов S. pneumoniae, имеющих капсулу, а также фрагмент ДНК Spn9802, обнаруживающийся у всех S. pneumoniae и у единичных изолятов S. pseudopneumoniae.
Учитывая факт повсеместного носительства S. pneumoniae, диагностика пневмококковой пневмонии по нестерильным локусам методом ПЦР в качественном формате (результат: обнаружено/не обнаружено) затруднена. В таких случаях решением проблемы служит применение ПЦР в количественном формате. Использование в качестве диагностической мишени локусов Spn9802 или cpsA в совокупности с этой методикой позволило судить о пневмококковой этиологии пневмонии при исследовании аспиратов из носоглотки больных. Диагностическая чувствительность метода относительно «золотого стандарта» составила 94 %, специфичность - 98 %.
Помимо детекции ДНК возбудителя, проводимого с целью этиологической расшифровки случая пневмококковой инфекции, метод ПЦР также используют для определения серологических типов возбудителя, циркулирующих на различных территориях, с целью оптимального планирования иммунопрофилактики и мониторинга эффективности использования существующих вакцин.
В настоящее время определены нуклеотидные последовательности всех генов, вовлеченных в биосинтез капсульного полисахарида (cps-локус генома S. pneumoniae), для всех серотипов S. pneumoniae, способных вызывать инвазивные формы инфекции.
Основными преимуществами основанных на ПНР методик для определения серологических вариантов S. pneumoniae являются сравнительно низкая стоимость и возможность определения свойств возбудителя без этапа культивирования. В отличие от традиционных методик (определение серологических вариантов S. pneumoniae с использованием метода электрофореза) ПЦР в режиме «реального времени» отличают меньшее количество этапов исследования и одинаковая чувствительность для всех серотип-специфических мишеней, включенных в реакционную смесь, поскольку при этой методике нет необходимости проведения амплификации мишеней различной длины.
Результаты ПЦР-исследования должны учитываться в совокупности с результатами других методов в комплексной диагностике ВП.
5. Показания к обследованию
А. Подозрение на внеболъничную крупозную пневмонию (плевропневмонию)
Инфекционный процесс характеризуется острым началом с потрясающего озноба, повышения температуры тела до 39 - 40 °С и выше. В последующем присоединяются боли в грудной клетке, тахипноэ и тахикардия. Отмечается умеренный цианоз в результате гипоксии, вызванной нарушением вентиляции легких или шунтирования крови, раздувание крыльев носа, вначале сухой кашель, затем продуктивный с трудно отделяемой вязкой с прожилками крови или ржавого цвета мокротой. Как правило, процесс наблюдается в одном легком, чаще правом, может охватывать одну нижнюю, среднюю или две доли. При обследовании выявляется ограничение подвижности пораженной половины грудной клетки, усиление голосового дрожания над областью воспаления, укорочение перкуторного звука, ослабление дыхания, крепитация, реже - шум трения плевры. По мере развития определяется бронхиальное дыхание, разнокалиберные хрипы. При рентгенологическом исследовании имеет место усиление легочного рисунка, со 2 - 3-го дня интенсивное затемнение ткани легких с расширением тени от корня легкого к периферии, при поражении плевры - выпот в плевральной полости. В периферической крови выявляют нейтрофильный гиперлейкоцитоз со сдвигом формулы влево.
Б. Подозрение на внебольничную очаговую бронхопневмонию
Как правило, дебют заболевания происходит на фоне острого респираторного процесса (бронхита), характеризуется общей слабостью, повышенной утомляемостью, потливостью, усилением одышки, тахикардией, повышением температуры. Кашель сопровождается слизистой или слизисто-гнойной мокротой. Очаги воспаления обычно возникают в задних и задне-нижних сегментах легких. При аускультации определяются влажные мелко- и среднепузырчатые хрипы, реже крепитация и трение плевры.
В. Подозрение на пневмонию у детей
По мнению экспертов ВОЗ, бактериальную пневмонию у детей следует подозревать при сочетании фебрильной температуры и синдрома дыхательных расстройств, определяемого у детей до 2 месяцев - более 60 дыханий в минуту; для детей 2 - 12 месяцев - более 50 дыханий в минуту; для детей старше 12 месяцев - более 40 дыханий в минуту при условии отсутствия признаков бронхиальной обструкции. Диагноз пневмонии подтверждается по результатам рентгенологического исследования.
6. Лабораторная диагностика внебольничной пневмонии
пневмококковой этиологии
Согласно МУ 3.1.2.3047-13 «Эпидемиологический надзор за внебольничными пневмониями» лабораторные исследования по этиологической расшифровке спорадической заболеваемости ВП осуществляют в лабораториях МО в соответствии с действующими нормативными правовыми и методическими документами. При эпидемиологическом расследовании случаев заболевания в зарегистрированном эпидемическом очаге ВП исследования материала от больных проводят в лаборатории МО и в организации, обеспечивающей государственный санитарно-эпидемиологический надзор.
Условием качественного проведения лабораторной диагностики является соблюдение пераналитического, аналитического и постаналитического этапов.
6.1. Преаналитический этап
Отбор материала для лабораторного исследования от больного проводит специалист МО. Сбор биологического материала осуществляют в день обращения пациента за медицинской помощью до начала этиотропного лечения. Лица, ответственные за сбор, хранение и транспортирование образцов биологических материалов, должны владеть навыками безопасной работы с биологическим материалом.
6.1.1. Правила получения биологического материала
При подозрении на ВП пневмококковой этиологии исследуют материал дыхательных путей (мокрота и ее индуцированный вариант, трахеальный аспират, пробы в ходе бронхоскопии), плевральную жидкость, венозную кровь, ликвор, мочу, материал, полученный при аутопсии. При недоступности материала из дыхательных путей для ряда методов допускается проведение исследования мазков из ротоглотки и носоглотки.
У госпитализированных пациентов отбор материала проводят при поступлении (не позднее вторых суток) и до назначения антибиотиков. При невозможности выполнения указанного требования материал забирают перед введением очередной дозы антимикробного препарата.
Мокрота
Для микроскопического и бактериологического исследования
Сбор свободно отделяемой мокроты осуществляют натощак или не ранее двух часов после еды. Предварительно пациента просят почистить зубы и тщательно прополоскать рот кипяченой водой.
Больной делает несколько глубоких вдохов с задержкой дыхания на несколько секунд, затем с силой производит выдох, что способствует появлению продуктивного кашля и отделению мокроты. Пациент откашливает мокроту (не слюну!) в стерильный контейнер. Объем образца должен составить не менее 3 мл для взрослых (около 1 мл для детей).
Хранение образца в стерильной емкости:
- при комнатной температуре 20 - 25 °С - до 2 ч;
- при температуре холодильной камеры 2 - 8 °С - до 24 ч.
Для исследования методом ПЦР в количественном формате
Используются только наборы реагентов, в инструкции которых указан этот тип клинического материала. Сбор мокроты аналогичен предыдущему пункту.
Хранение образца в стерильной емкости:
- при комнатной температуре 20 - 25 °С - до 6 ч;
- при температуре холодильной камеры 2 - 8 °С - до 24 ч;
- при температуре морозильной камеры -(16 - 20) °С - до 1 мес.
Индуцированная мокрота
Для микроскопического и бактериологического исследования
Перед процедурой взятия материала пациент получает сальбутамол через дозирующий ингалятор для предотвращения бронхоспазма. Затем в течение 15 мин через струйный небулайзер (аэрозольный аппарат) подается кислород со скоростью 5 л/мин с 5 мл 5 %-го стерильного раствора NaCl. После этого проводится постукивание по передней и задней стенкам грудной клетки с целью стимуляции отхождения мокроты. Пациента просят откашлять мокроту (не слюну!) в стерильный контейнер. Объем образца должен быть не менее 3 мл для взрослых (около 1 мл для детей).
В случае если мокрота не откашливается, процедуру рекомендуют комбинировать с последующим получением аспирата из трахеи.
Хранение образца в стерильной емкости:
- при комнатной температуре 20 - 25 °С - до 2 ч;
- при температуре холодильной камеры 2 - 8 °С - до 24 ч.
Для исследования методом ПЦР в количественном формате
Используются только наборы реагентов, в инструкции которых указан этот тип клинического материала. Сбор мокроты аналогичен предыдущему пункту.
Хранение образца в стерильной емкости:
- при комнатной температуре 20 - 25 °С - до 6 ч;
- при температуре холодильной камеры 2 - 8 °С - до 24 ч;
- при температуре морозильной камеры -(16 - 20) °С - до 1 мес.
Мазки со слизистой оболочки верхних дыхательных путей
Бактериоскопия мазков с задней стенки глотки не проводится в связи с недостаточной информативностью результата.
Бактериологический посев мазков с задней стенки глотки осуществляется лишь при невозможности получения свободно отделяемой и индуцированной мокроты (детский возраст, дебют пневмонии).
Для бактериологического исследования
Мазки берут в специальную транспортную систему типа Амиеса (Copan®) сухим стерильным зондом из полистирола с вискозным тампоном (специальной щеткой) вращательными движениями с задней стенки глотки, аккуратно прижимая язык пациента шпателем.
После забора материала рабочую часть зонда с тампоном помещают в стерильную одноразовую пробирку с транспортной средой. При использовании коммерческих тампонов фирмы Copan® после погружения в питательную среду конец зонда с тампоном (1 см) отламывают, придерживая крышкой пробирки с расчетом, чтобы он позволил плотно закрыть пробирку.
Хранение образца в коммерческой транспортной среде (типа Амиеса, Copan®) при комнатной температуре 20 - 25 °С - до 48 ч (не допускается хранение в условиях холодильника и термостата).
Для исследования методом ПЦР в количественном формате
Осуществляют при невозможности получения свободно отделяемой и индуцированной мокроты (детский возраст, дебют пневмонии). Используют только наборы реагентов, в инструкции которых указан этот тип клинического материала.
Материал берут после полоскания полости рта кипяченой водой комнатной температуры. Если полость носа заполнена слизью, перед процедурой рекомендуется ее удалить. В течение 6 часов перед процедурой нельзя использовать медикаменты, орошающие носоглотку или ротоглотку и препараты для рассасывания во рту.
Мазки у пациента берут двумя разными зондами - сначала со слизистой нижнего носового хода, а затем из ротоглотки, при этом концы зондов с тампонами после взятия мазков последовательно помещают в одну пробирку объемом 1,5 - 2 мл с 0,5 мл транспортной среды для респираторных мазков.
Мазки со слизистой носоглотки у детей берут сухим стерильным назофарингеальным велюр-тампоном на пластиковом аппликаторе, у взрослых - сухим стерильным зондом из полистирола с вискозным тампоном. Зонд вводят легким движением по наружной стенке носа на глубину 2 - 3 см до нижней раковины, слегка опускают книзу, вводят в нижний носовой ход под нижнюю носовую раковину, делают вращательное движение и удаляют вдоль наружной стенки носа. Общая глубина введения зонда должна составлять примерно половину расстояния от ноздри до ушного отверстия (3 - 4 см для детей и 5 - 6 см для взрослых). После забора материала конец зонда с тампоном опускают в стерильную одноразовую пробирку с транспортной средой до места слома, при этом гибкая часть зонда сворачивается спиралью, далее, прикрывая сверху пробирку крышкой, рукоятку зонда опускают вниз, добиваясь полного отламывания верхней части зонда. Пробирку герметично закрывают.
Мазки из ротоглотки берут сухим стерильным зондом из полистирола с вискозным тампоном вращательными движениями с поверхности миндалин, небных дужек и задней стенки ротоглотки, аккуратно прижимая язык пациента шпателем. После забора материала рабочую часть зонда с тампоном помещают в стерильную одноразовую пробирку с транспортной средой и зондом с мазком из носоглотки. Конец зонда с тампоном (1 см) отламывают, придерживая крышкой пробирки с расчетом, чтобы он позволил плотно закрыть пробирку.
Хранение образца в коммерческой транспортной среде (типа «Транспортная среда для хранения и транспортировки респираторных мазков», ФБУН ЦНИИЭ Роспотребнадзора):
- при комнатной температуре 20 - 25 °С - до 6 ч;
- при температуре холодильной камеры 2 - 8 °С - до 72 ч;
- при температуре морозильной камеры -(16 - 20) °С - до 1 мес.
Трахеальный аспират
Для микроскопического и бактериологического исследования
Манипуляцию проводят натощак после чистки зубов и полоскания полости рта водой. Пациента просят сделать несколько глубоких вдохов с задержкой дыхания на несколько секунд, затем с силой выдохнуть. Это способствует появлению продуктивного кашля и очищению верхних дыхательных путей от мокроты. После присоединения мукус-экстрактора через трубку-переходник к отсосу катетер для забора трахеального аспирата вводится в глотку через полость рта. Вследствие раздражения слизистой в области голосовой щели провоцируется кашлевой рефлекс и проводится извлечение трахеального содержимого через стерильный катетер (6 или 7 размера) с помощью отсоса. Материал переносят в стерильную емкость (контейнер).
Объем трахеального аспирата должен составлять не менее 3 - 5 мл для взрослых (около 1 мл для детей).
Хранение образца в стерильной емкости:
- при комнатной температуре 20 - 25 °С - до 2 ч;
- при температуре холодильной камеры 2 - 8 °С - до 24 ч.
Для исследования методом ПЦР
Сбор материала аналогичен предыдущему пункту.
Хранение образца в стерильной емкости:
- при комнатной температуре 20 - 25 °С - до 6 ч;
- при температуре холодильной камеры 2 - 8 °С - до 24 ч;
- при температуре морозильной камеры -(16 - 20) °С - до 1 мес.
Плевральная жидкость
Для микроскопического и бактериологического исследования
Перед проведением чрескожной аспирации тщательно очищают выбранный участок кожи 70 %-м раствором этилового спирта; затем дезинфицируют его 1 - 2 %-м раствором йода или другим дезинфицирующим средством (разрешенным к применению для этих целей в установленном порядке) для предотвращения контаминации; избыток йода удаляют марлевой салфеткой, смоченной 70 %-м спиртом, во избежание ожога кожи пациента.
Соблюдая правила асептики, выполняют чрескожную аспирацию для получения пробы плевральной жидкости. Удаляют пузырьки воздуха из шприца и немедленно переносят пробу в стерильную емкость и (или) транспортные системы со специальными средами коммерческого или местного производства.
Отправлять в лабораторию пробу в шприце с иглой, закрытой стерильной резиновой пробкой, не рекомендуется из-за вероятности прокола сотрудником кожных покровов (при проведении манипуляции), а также из-за образования плотного сгустка в результате присутствия в плевральной жидкости большого количества белковых компонентов.
Рекомендуемый объем плевральной жидкости, который необходимо направить в лабораторию, составляет 10 - 15 мл.
Хранение образца:
- в стерильной емкости:
○ при комнатной температуре 20 - 25 °С - до 2 ч;
○ при температуре холодильной камеры 2 - 8 °С - до 24 ч.
- в коммерческой транспортной среде «для посева крови» (тип Oxoid, BD, Hi-Media и пр.):
○ при комнатной температуре 20 - 25 °С - до 24 ч;
○ при температуре термостатирования 35 - 37 °С - до 48 ч.
- в транспортных питательных средах, приготовленных в лаборатории (тиогликолевая среда):
○ при комнатной температуре 20 - 25 °С - до 24 ч;
○ при температуре термостатирования 35 - 37 °С - до 48 ч.
Примечание. Посев биологического материала в указанные питательные среды позволяет оценить выросшие колонии без учета их количества в исследуемом образце.
Для исследования методом ПЦР
Сбор материала аналогичен предыдущему пункту. Плевральную жидкость помещают в стерильный контейнер.
Хранение образца в стерильной емкости:
- при комнатной температуре 20 - 25 °С - до 6 ч;
- при температуре холодильной камеры 2 - 8 °С - до 24 ч;
- при температуре морозильной камеры -(16 - 20) °С - до 1 мес.
Пробы, полученные при бронхоскопии (БАЛ, сосков с бронхов, биоптат легких)
Для микроскопического и бактериологического исследования
Бронхоскопия выполняется в условиях оксигенотерапии (ингаляция кислорода через носовые катетеры с помощью маски Вентури либо маски с резервуаром). Если не удается обеспечить достаточную оксигенацию крови, бронхоскопия выполняется в условиях неинвазивной вентиляции легких. У больных на искусственной вентиляции легких процедура выполняется под общей анестезией в условиях миоплегии через адаптер респиратора, снабженный клапаном для бронхоскопа.
Для получения пробы БАЛ осуществляют следующее.
1. Фибробронхоскоп проводят в бронх до его «заклинивания», после чего с помощью одноразовых шприцов через биопсийный канал бронхоскопа вводят отдельными порциям подогретый до 37 °С 0,9 %-й раствор натрия хлорида (общий объем от 5 - 20 до 100 мл).
2. Перед введением следующей порции физиологического раствора осторожно отсасывают жидкость введенной частью шприца в стерильный одноразовый контейнер с завинчивающейся крышкой или оставляют в закрытом шприце, предварительно удалив из него воздух (как правило, 50 - 70 % введенного физиологического раствора находится в лаваже). С целью предотвращения коллапса альвеол отсасывание проводят при 50 - 80 мм рт. ст.
3. Каждую отсасываемую порцию собирают в отдельную посуду.
4. По окончании процедуры соединяют пробы, полученные из одного и того же участка. Пробы из разных участков (например, правая верхняя доля легкого и правая нижняя доля) следует соединять вместе только после консультации с лечащим врачом.
5. В направлении указывают общий объем введенного физиологического раствора.
Для получения пробы соскоба с бронхов проводят следующее.
1. Через биопсийный канал бронхоскопа вводят телескопический двойной катетер с обработанным полиэтиленгликолем (или другим соответствующим реактивом) дистальным концом для предотвращения контаминации пробы.
2. Собирают материал в стерильный контейнер или транспортную питательную среду.
3. Доставляют материал в лабораторию.
Для получения биоптата легких получают кусочки ткани легких размером 1 - 3 см2.
Хранение образца:
- в стерильной емкости:
○ при комнатной температуре 20 - 25 °С - до 2 ч;
○ при температуре холодильной камеры 2 - 8 °С - до 24 ч;
- в транспортных питательных средах (тиогликолевая среда и пр.):
○ при комнатной температуре 20 - 25 °С - до 24 ч;
○ при температуре термостатирования 35 - 37 °С - до 48 ч.
Примечание. Посев биологического материала в питательные среды позволяет оценить выросшие колонии без учета их количества в исследуемом образце.
Для исследования методом ПЦР
Сбор материала аналогичен предыдущему пункту. Материал, полученный при заборе соскоба с бронхов, и кусочки биоптата легких помещают в стерильную пробирку типа Эппендорф с 0,3 мл стерильного физиологического раствора.
Хранение образца:
- при комнатной температуре 20 - 25 °С - до 6 ч;
- при температуре холодильной камеры 2 - 8 °С - до 24 ч;
- при температуре морозильной камеры -(16 - 20) °С - до 1 мес.
Венозная кровь
Для микроскопического и бактериологического исследования
В связи с низкой информативностью микроскопия цельной крови при внебольничной пневмонии средней тяжести не проводится. При тяжелых формах пневмонии или подозрении на генерализованную инфекцию микроскопия осуществляется (см. ниже) для выдачи предварительного результата.
Пробы для микроскопического и бактериологического исследования получают пункцией из периферических вен (чаще локтевого сгиба). Собирают 2 пробы из двух сосудов. У больных, в комплекс терапии которым включены антибиотики, собирают 6 проб в течение 48 ч. Сбор проб крови производят у постели больного или в процедурном кабинете. Для получения пробы необходимо:
- продезинфицировать участок кожи над выбранным для пункции сосудом и обработать кожу тампоном, смоченным 70 %-м этиловым спиртом, затем другим тампоном, смоченным 1 - 2 %-м раствором йода или другим дезинфицирующим средством (разрешенным к применению для этих целей в установленном порядке), круговыми движениями, начиная от центра, в течение 30 с;
- подождать, пока высохнет обработанный участок, не допускать пальпирование сосуда после обработки кожи перед введением иглы;
- с использованием иглы-бабочки у взрослых вводят во флакон с коммерческой питательной средой 10 - 30 мл крови, у детей - 0,5 - 3,0 мл, предварительно обработав колпачок флакона спиртом. При отсутствии коммерческих сред кровь забирают шприцем и переносят в транспортные среды, приготовленные в лабораторных условиях (не менее 2 флаконов). В этом случае необходимо учитывать возможность контаминации образца посторонней микрофлорой;
- для первичной микроскопии снимают иглу-переходник с адаптера системы для забора крови, каплю крови, свободно вытекающую из системы, наносят на предметное стекло, оставляя до полного высыхания, стекло помещают в стерильный контейнер (чашку Петри). При использовании шприца кровь иглой наносят на предметное стекло только после посева во флаконы;
- после венепункции и посева крови для предотвращения возможного раздражения (ожога) с участка кожи пациента стирают остатки йода с помощью тампона, смоченного 70 %-м этиловым спиртом.
Хранение образца:
- в коммерческой транспортной среде «для посева крови»:
○ при комнатной температуре 20 - 25 °С - до 24 ч;
○ при температуре термостатирования 35 - 37 °С - до 48 ч.
- в транспортных питательных средах, приготовленных в лаборатории (тиогликолевая среда, двухфазная среда и пр.):
- при комнатной температуре 20 - 25 °С - до 24 ч;
- при температуре термостатирования 35 - 37 °С - до 48 ч.
Примечание. Посев биологического материала в указанные питательные среды позволяет оценить выросшие колонии без учета их количества в исследуемом образце.
Для исследования методом латекс-агглютинации
Кровь забирается натощак в коммерческие вакуумные пробирки (разрешенные к применению в РФ), диаметром 4 - 9 мл с активатором свертывания или конические центрифужные пробирки для получения сыворотки.
Хранение образца:
- в коммерческих вакуумных пробирках при комнатной температуре 20 - 25 °С - до 24 ч;
- в конических центрифужных пробирках при комнатной температуре 20 - 25 °С - до 2 ч.
Для исследования методом ПЦР
Взятие венозной крови проводят натощак или через 3 ч после приема пищи из локтевой вены в положении сидя в пробирки с антикоагулянтом (ЭДТА).
Непосредственно перед венепункцией производится дезинфекция кожи в месте венепункции циркулярными движениями от центра к периферии дважды 70 %-м раствором спирта или 1 - 2 %-м раствором йода. Необходимо дождаться полного высыхания дезинфицирующего средства и провести манипуляцию, не касаясь места обработки кожи. После венепункции следует удалить оставшийся йод с поверхности кожи, чтобы избежать ожога.
После взятия крови пробирку следует несколько раз (6 - 8) плавно перевернуть вверх дном, чтобы кровь в пробирке тщательно перемешалась. Пробирку поместить в штатив.
Хранение образца в пробирке с антикоагулянтом:
- при комнатной температуре 20 - 25 °С - до 6 ч (с количественной оценкой результата);
- при комнатной температуре 20 - 25 °С - до 12 ч (для обнаружения нуклеиновых кислот без учета их количества);
- при температуре холодильной камеры 2 - 8 °С - до 24 ч (качественный и количественный анализ).
Не допускается замораживание цельной крови!
Ликвор (спинномозговая жидкость)
При подозрении на генерализованную форму инфекции сбор ликвора проводят медленным заполнением трех пробирок тремя порциями материала для исследования (4,0 - 5,5 мл СМЖ, полученного при люмбальной пункции из субарахноидального пространства между позвонками L3 - L4, L4 - L5 или L5 - S1, а также при пунктировании боковых желудочков мозга). Используют стерильные пробирки с плотно закрывающимися крышками.
Для микроскопического и бактериологического исследования
Для первичного бактериологического посева 1,0 мл ликвора (обычно вторая порция) в стерильной пробирке немедленно при 35 - 37 °С (с учетом комплексного обследования на менингококковую инфекцию) доставляют в лабораторию.
С целью повышения высеваемости микроорганизмов, исключения контаминации посторонней микрофлорой ликвор непосредственно на месте проведения манипуляции в асептических условиях с помощью стерильного шприца с иглой может быть перенесен в коммерческий флакон для посева крови (разрешенный к применению в РФ) с последующим транспортированием в лабораторию. При этом остатки материала (каплю забранного образца) переносят на предметное стекло для микроскопии, высушивают и помещают в стерильный контейнер (чашку Петри) для транспортирования вместе с основной пробой.
Хранение образца:
- в стерильной емкости при температуре 35 - 37 °С - до 2 ч;
- в коммерческой транспортной среде «для посева крови» при температуре термостатирования 35 - 37 °С - до 48 ч.
Примечание. Посев биологического материала в указанную питательную среду позволяет оценить выросшие колонии без учета их количества в исследуемом образце.
Для исследования методом латекс-агглютинации
Используется ликвор, собранный в стерильную коническую пробирку для бактериологического посева.
Хранение образца в стерильной емкости при комнатной температуре 20 - 25 °С - до 24 ч.
Для исследования методом ПЦР
Ликвор в количестве 0,2 мл отбирают в стерильную пробирку.
Хранение образца в стерильной емкости:
- при комнатной температуре 20 - 25 °С - до 6 ч;
- при температуре холодильной камеры 2 - 8 °С - до 24 ч;
- при температуре морозильной камеры -(16 - 20) °С - до 1 мес.
Моча
Для исследования методом ИХА
Наиболее достоверный результат может быть получен при исследовании порции мочи, собранной после ночного отдыха до завтрака. Образцы мочи для исследования объемом 5 - 10 мл помещают в стандартные пластиковые контейнеры.
Хранение образца в стерильной емкости:
- при комнатной температуре 20 - 25 °С - до 24 ч;
- при температуре холодильной камеры 2 - 8 °С - до 14 сут.;
- при температуре морозильной камеры -(16 - 20) °С - до 1 мес.
Аутопсийный материал
В случае летального исхода исследуется посмертный (аутопсийный) материал, который следует собирать в начале вскрытия. Наиболее приемлемым для бактериологического исследования принято считать отбор материала в первые 15 часов после смерти, хороших результатов достигают при отборе проб крови из сердца путем трансторакальной пункции до вскрытия.
Для микроскопического и бактериологического исследования
Учитывая высокую степень контаминации биологического материала посторонней микрофлорой, дезинфекцию выбранного для пункции участка можно выполнить методом прижигания ткани шпателем. Пробы (кусочки) органов и/или тканей объемом не менее 3 - 5 см3 отбирают стерильным инструментом (индивидуальным для каждого органа) и помещают в отдельную стерильную емкость (одноразовые стерильные контейнеры с завинчивающейся крышкой или чашки Петри - d = 55 мм). Кровь, гной из вскрытых полостей, спинномозговую и другие жидкости отбирают стерильным шприцем в объеме не менее 7 - 10 мл и доставляют в шприце. Материал из легких забирают только с тех морфологически измененных участков, которые указывают на наличие инфекционного процесса.
Хранение образца в стерильной емкости:
- при комнатной температуре 20 - 25 °С - до 2 ч;
- при температуре холодильной камеры 2 - 8 °С - до 24 ч.
Для исследования методом ПЦР
Сбор материала аналогичен предыдущему пункту.
Хранение образца в стерильной емкости:
- при комнатной температуре 20 - 25 °С - до 6 ч;
- при температуре холодильной камеры 2 - 8 °С - до 24 ч;
- при температуре морозильной камеры -(16 - 20) °С - до 1 мес. (кроме цельной крови).
6.1.2. Маркировка материала
На этикетке пробирок (контейнеров и пр.) с материалом указываются: порядковый номер образца, соответствующий номеру в сопроводительном документе, и по возможности, фамилия и инициалы, тип материала.
В сопроводительном документе (направлении) к материалу, собранному для исследования в лаборатории, необходимо указать:
- наименование учреждения, которое направляет материал на исследования, телефон, адрес электронной почты;
- фамилию и имя обследуемого больного (если этого не требует положение о конфиденциальности);
- возраст;
- дату взятия материала для лабораторного исследования;
- тип материала;
- дату заболевания или контакта с больным;
- предполагаемый диагноз;
- степень тяжести заболевания;
- наличие осложнений;
- данные о вакцинации против пневмококка (вакцинирован/не вакцинирован/нет данных);
- Ф. И. О., должность, дату отправки материала и контактный телефон, по которому можно связаться с данным сотрудником.
В сопроводительном документе (направлении) при исследовании аутопсийного материала дополнительно указывают дату и время смерти, а также отделение, в котором умер больной, дату и время вскрытия.
6.1.3. Транспортирование материала
При транспортировании проб внутри одного здания пробирки/контейнеры с биологическим материалом помещают в штативы и специальные герметичные контейнеры-переноски.
При необходимости транспортирования биологического материала в другие организации образцы от каждого пациента помещают в индивидуальный герметичный пакет с адсорбирующим материалом и дополнительно упаковывают в общий герметичный пакет и общий термоконтейнер.
Сопроводительные документы помещают в индивидуальную упаковку отдельно от биологического материала и прочно прикрепляют снаружи контейнера. Транспортирование материала осуществляет обученный персонал в специально оборудованном для этих целей санитарном транспорте.
В сроки хранения биологического материала включены сроки транспортирования с обязательным учетом температурного режима.
6.2. Аналитический этап
Комплекс исследований по микробиологической диагностике внебольничной пневмонии пневмококковой этиологии выполняется в бактериологических лабораториях, имеющих разрешительные документы для работы с микроорганизмами III - IV групп патогенности (опасности).
Персонал, участвующий непосредственно в проведении лабораторных исследований, должен соблюдать общие правила работы с микроорганизмами (СП 1.3.2322-08) и стандарты безопасной рабочей среды (ГОСТ Р 52905-07 (ИСО 15190:2002). Все сотрудники лаборатории обязаны выполнять инструкции и правила безопасности, изложенные в технических паспортах к приборам и в инструкциях к диагностическим наборам реагентов. В выполнении исследований принимают участие сотрудники, имеющие соответствующее специальное образование, квалификацию, подтвержденные дипломом и сертификатом. Им необходимо периодически проходить курсы повышения квалификации и профессиональной переподготовки в установленном порядке. Требования к знаниям и умениям специалистов должны соответствовать образовательным стандартам, действующим на территории России. Для выполнения исследований используют стандартные для микробиологической (ПЦР) лаборатории оборудование, диагностические наборы реагентов и расходные материалы, имеющие соответствующие сертификаты качества и действующий срок годности, разрешенные к применению на территории России в установленном порядке.
Аналитический этап включает микроскопическое исследование (в классическом и модифицированном варианте), выделение чистой культуры возбудителя, определение чувствительности к антибиотикам, латекс-агглютинацию, ИХА, ПЦР, определение серологических типов S. pneumoniae.
Некоторые виды биологического материала требуют предварительной обработки, заключающейся в снижении вязкости (густая и неоднородная по консистенции мокрота) и гомогенизации (секционный материал) с последующим фракционированием путем центрифугирования.
6.2.1. Микроскопическое исследование
Оборудование:
- ламинарный бокс 2-го класса биологической безопасности;
- микроскоп бинокулярный с осветителем, набором объективов и окуляров;
- центрифуга лабораторная;
- кюветы и штативы-рельсы для фиксации и окрашивания мазков;
- прибор для покраски мазков (автоматический аналог);
- дозаторы переменного объема полуавтоматические (автоматические);
- спиртовка (газовая горелка);
- приборы и программы информационного обеспечения (компьютер, принтер, электронные информационные системы).
Реагенты:
- наборы реагентов для окраски микропрепаратов метиленовым синим, фуксином Циля, по Граму, Бури-Гинса и др.;
- синька Леффлера;
- специфические антипневмококковые сыворотки (I, II, III типов).
Средства дезинфекции
Дезинфицирующие средства в концентрации и времени экспозиции, указанные в инструкциях по их использованию.
Лабораторная посуда и расходные материалы:
- стекла предметные и покровные стандартных размеров для микропрепаратов;
- петля микробиологическая (d = 2 мм);
- чашки Петри;
- наконечники стерильные для дозаторов переменного объема;
- перчатки резиновые;
- контейнеры и емкости для обеззараживания медицинских отходов.
Классический метод окраски
На середину предметного стекла пипеткой (стерильным наконечником дозатора) наносят каплю крови, спинномозговой жидкости, БАЛ и другой материал. При необходимости материал можно центрифугировать и проводить микроскопию осадка. Мокроту предварительно помещают в стерильную чашку Петри, петлей захватывают гнойно-слизистый комочек, промывают его в физиологическом растворе, затем петлей или наконечником дозатора растирают на предметном стекле. Материал по поверхности стекла распределяют так, чтобы диаметр образующегося мазка соответствовал величине небольшой монеты. Стекло оставляют в горизонтальном положении и высушивают. Фиксацию препарата проводят над пламенем горелки или спиртовки.
Окраску мазка проводят ручным или автоматизированным методом. В качестве красителя используют водный раствор метиленового синего (или производят окраску по Граму).
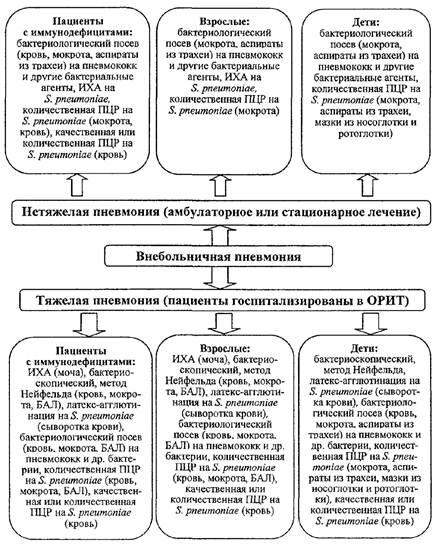
В нативном препарате ликвора клетки S. pneumoniae чаще визуализируются ланцетовидной формы, располагаются парами, имеют капсулу (рис. 1.)
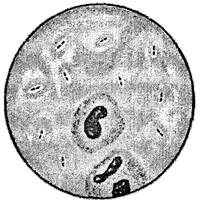
Рис. 1. Окраска ликвора по Граму (в мазке видны
ланцетовидные диплококки,
окруженные бесцветной капсулой, встречаются единичные
палочкоядерные нейтрофилы)
В мазке крови, имеющем голубой фон, хорошо видны окрашенные в темно-синий цвет лейкоциты и между ними (или внутри них) множество мелких диплококков. В мазках из других органов чаще встречаются мелкие не имеющие капсулы диплококки, что затрудняет их дифференциальную диагностику с другой бактериальной микрофлорой (прежде всего в образцах из «нестерильного» материала).
Бактериоскопия мазков из носо- и ротоглотки не проводится в связи с их недостаточной информативностью.
Метод Нейфельда или феномен набухания капсулы является модифицированным вариантом микроскопии и серологической диагностики S. pneumoniae. При его использовании на три покровных стекла наносят по одному комочку свежевыделенной мокроты (СМЖ, сыворотки крови), к каждому из которых прибавляют каплю неразведенной специфической антипневмококковой сыворотки (I, II, III типов) и каплю синьки Лёффлера. Капли тщательно смешивают, покрывают предметным стеклом с лункой, смазанной по краям вазелином. Через две минуты рассматривают висячие капли под микроскопом с иммерсионной системой. При положительном результате видно резкое увеличение капсул пневмококков. При отрицательном результате капсулы едва заметны. Реакция набухания специфична и не дает положительного результата с другими капсульными бактериями.
По методу Бурри на край предметного стекла наносят каплю исследуемого материала и каплю туши. Смесь перемешивают и делают мазок, высушивают на воздухе, и, не фиксируя, микроскопируют. Фон препарата - темно-дымчатый, микробные тела и их капсулы не окрашиваются.
Препарат, изготовленный по Бурри, можно фиксировать смесью Никифорова, отмыть водой, окрасить фуксином Циля, разведенным 1:3 в течение 3 - 5 мин. На темном фоне мазка выделяются неокрашенные капсулы, внутри которых находятся бактерии ярко малинового цвета (метод Гинса).
6.2.2. Выделение чистой культуры возбудителя
Оборудование:
- ламинарный бокс 2-го класса биологической безопасности;
- микроскоп бинокулярный с осветителем, набором объективов и окуляров;
- термостаты электрические для выращивания бактерий, поддерживающие температуру в камере в пределах (35 - 45 ± 1) °С;
- центрифуга лабораторная;
- весы лабораторные общего назначения;
- анаэростат или СO2-инкубатор, поддерживающий температуру в камере в пределах (37 ± 1) °С, содержание СO2 на уровне 3 - 7 %;
- дистиллятор;
- стерилизатор паровой электрический;
- холодильник фармацевтический, поддерживающий температуру от 4 до 8 °С для хранения культур, биологических субстратов и реагентов;
- спиртовки (газовые горелки);
- прибор для покраски мазков (автоматический аналог);
- дозаторы переменного объема полуавтоматические (автоматические);
- счетчики колоний (автоматический аналог);
- водяная баня (сухо-воздушный инкубатор);
- дополнительное оборудование для автоматизации процесса выделения и изучения микроорганизмов (аппараты средоварения, станции первичного посева, анализатор крови, автоматические «ридеры» для считывания результатов тестирования бактериальных культур);
- приборы и программы информационного обеспечения (компьютер, принтер, электронные информационные системы).
Реагенты:
- транспортные питательные среды (Амиеса с углем и без угля, Стюарта, Кери Блейра и пр.);
- готовые питательные среды для посева и инкубации крови;
- питательные среды для культивирования S. pneumoniae на базе обогащенных субстратов универсальные (кровяной агар, шоколадный агар, эритрит-агар, тиогликолевая среда и др.), дифференциально-диагностические (CNA-агар), хромогенные;
- наборы реагентов для окраски микропрепаратов;
- диагностические наборы реагентов (коммерческие тест-системы) для идентификации S. pneumoniae по биохимическим свойствам.
Средства дезинфекции
Дезинфицирующие средства в концентрации и времени экспозиции, указанные в инструкциях по их использованию.
Лабораторная посуда и расходные материалы:
- одноразовые стерильные контейнеры с устойчивым основанием, тампоны-зонды (Swab) для сбора и транспортирования образцов биологического материала (мокроты, плевральной жидкости, трахеального аспирата, бронхоальвеолярного лаважа, мочи, ликвора, секционного материала и пр.);
- чашки бактериологические (Петри) для выращивания микробиологических культур;
- шпатели, тампоны-зонды для посева, пересева биологических материалов, выросших культур микроорганизмов;
- штативы и поддоны для пробирок и контейнеров, чашек Петри;
- кюветы и штативы-рельсы для фиксации и окрашивания мазков;
- петли бактериологические;
- наконечники стерильные для дозаторов переменного объема;
- посуда мерная лабораторная стеклянная и пластиковая;
- газогенераторные пакеты;
- пипетки пластиковые пастеровские градуированные для стандартизации объема и переноса жидкостей;
- перчатки резиновые;
- контейнеры и емкости для обеззараживания медицинских отходов.
Посев первичного материала проводят на специальные питательные среды с высоким содержанием аминного азота и нативного белка животного происхождения.
Для материала, не содержащего нормофлору, используют кровяной, шоколадный, колумбийский агары, а также полужидкую тиогликолевую среду в качестве среды обогащения, в которой посевной материал оставляют на сутки в стандартном режиме инкубации при 35 - 37 °С 16 - 20 часов.
При выделении пневмококка из «нестерильного материала предпочтение отдают питательным средам со специальными ингибирующими добавками (CNA-агар).
В плотной среде необходимо предусмотреть присутствие дефибринированной крови барана для оценки гемолитических свойств пневмококка. С учетом сложившейся лабораторной практики допускается использование человеческой крови (эритроцитарной массы). При этом следует помнить о возможности получения сомнительных результатов.
В первый квадрант вносят материал, проворачивая тампон и придавливая его к поверхности агара. Жидкий материал вносят стерильной пипеткой или наконечником дозатора в объеме 0,05 мл (1 капля).
Во второй и следующие квадранты материал засевают микробиологической петлей, захватывая площадку предыдущего квадранта лишь двумя штрихами. Между посевами на квадранты петлю стерилизуют прожиганием, либо меняют ее при использовании одноразовых петель. Не допускается касания краев чашки Петри. На каждом квадранте производят по 10 штрихов (рис. 2.).
Рис. 2. Посев методом истощающих штрихов (квадрантов)
Инкубацию посевного материала, по возможности, осуществляют в атмосфере с повышенным содержанием СO2. Наиболее распространенным методом создания таких условий является использование эксикатора, в который помещается зажженная свеча, при горении утилизирующая кислород. Когда свеча гаснет, концентрация СO2 достигает 3 % (не допускается использование свечи с красителями). Однако наиболее эффективным является применение СO2 термостата или анаэростата со специальными газогенераторными пакетами.
Через 16 - 20 часов инкубации в стандартном режиме S. pneumoniae формируют мелкие, округлые, блестящие, бесцветные с ровным краем и мягкой консистенции колонии с зоной α-гемолиза. В некоторых случаях (чаще при использовании человеческой крови или эритроцитарной массы) может наблюдаться зона гемолиза промежуточной формы (между α- и β-).
В зависимости от степени выраженности капсулы, отмечено несколько типов колоний.
Колонии с сильно развитой капсулой (преимущественно у S. pneumoniae серотипа 3) имеют несколько миллиметров в диаметре, напоминают каплю масла на агаровой поверхности и бывают настолько слизистыми, что их идентификация не представляет существенных проблем. В полужидкой питательной среде такие изоляты, как правило, дают нежный хлопьевидный осадок (комочек ваты).
Колонии с менее выраженной капсулой обычно небольших размеров, их выделение сопряжено с определенными трудностями. При длительной инкубации (до 48 ч) центральная часть колонии может опускаться, давая характерную «блюдцеобразную форму», до полного уплощения и образования на поверхности агара «шляпки гвоздя», что объясняется действием пневмококковых аутолизинов.
Авирулентные формы пневмококков на плотных средах формируют гладкие, компактные, точечные колонии. В полужидкой среде имеют придонно-пристеночный рост. Именно такие формы необходимо, прежде всего, идентифицировать не только от близких видов стрептококков, но и от других представителей бактериальной флоры (Neisseria, Haemophilus, Corynebacterium).
Фенотипическую идентификацию S. pneumoniae проводят по таким признакам, как отсутствие каталазной и оксидазной активности, а также по специфическим методам, основными из которых являются чувствительность к оптохину (зона задержки роста вокруг диска превышает 14 мм при концентрации препарата в диске 6 мкг и 15 мм - при концентрации 5 мкг) и лизис бактериальной культуры в присутствии солей желчи (наличие зоны лизиса вокруг коммерческого диска с желчью в концентрации 3 мкг). Использование нативной, сухой или медицинской желчи не обеспечивает достоверных результатов, поскольку такая желчь не стандартизована по содержанию желчных кислот.
Дополнительным тестом может служить отсутствие роста бактериальной культуры пневмококка при 45 °С в стандартном режиме инкубации (тест проводят методом посева чистой культуры в полужидкую среду для контроля стерильности, разлитую в пробирку в объеме 9 - 10 мл). У прочих зеленящих стрептококков, составляющих нормофлору дыхательных путей (S. mitis, S. oralis, S. salivarius, S. mutans и др.), в этих условиях инкубации в питательной среде будет наблюдаться хороший бактериальный рост.
Основные дифференцирующие признаки Streptococcus pneumoniae от других представителей семейств Streptococcaceae и Enterococcus, схожих по тинкториальным и культуральным свойствам и дающих на агарах с содержанием крови барана и человека зоны α- или β-гемолиза, представлены в табл. 1 и 2.
Таблица 1
Дифференцирующие признаки штаммов Streptococcus
pneumoniae,
чувствительных к оптохину, от других представителей
семейства Streptococcaceae
|
Виды стрептококков |
Тест с желчью |
Рост при 45 °С |
|
Streptococcus pneumoniae |
+ |
- |
|
Streptococcus pseudopneumoniae |
- |
- |
|
Streptococcus группы viridians |
(-) |
(+) |
|
«+» - признак положительный «-» - признак отрицательный «(+)» - признак чаще положительный «(-)» - признак чаще отрицательный |
||
Таблица 2
Дифференцирующие признаки штаммов Streptococcus
pneumoniae
со сниженной чувствительностью, устойчивых к оптохину,
от других представителей семейства Streptococcaceae и Enterococcus
|
Виды стрептококков |
Тест с желчью |
Рост при 45 °С |
ПИРА-тест |
Тест с гиппуратом натрия |
|
Streptococcus pneumoniae |
+ |
- |
- |
- |
|
Streptococcus pyogenes |
- |
- |
+ |
- |
|
Streptococcus agalactiae |
(-) |
- |
- |
+ |
|
Streptococcus spp. (группы viridians) |
(-) |
(+) |
(-) |
(-) |
|
Enterococcus spp. |
- |
+ |
+ |
(+) |
|
«+» - признак положительный «-» - признак отрицательный «(+)» - признак чаще положительный «(-)» - признак чаще отрицательный |
||||
Клинически значимым при остром воспалительном процессе считают выделение S. pneumoniae из мокроты в количестве > 105 КОЕ/мл; из БАЛ - > 104 КОЕ/мл; из биоптата, полученного с помощью защищенных щеток, - > 103 КОЕ/мл. При исследовании стерильных жидкостей организма (кровь, плевральная жидкость, ликвор) основанием для постановки этиологического диагноза пневмококковой инфекции служит выделение S. pneumoniae в любом количестве.
6.2.3. Определение чувствительности к антибиотикам
Оборудование:
- ламинарный бокс 2-го класса биологической безопасности;
- термостаты электрические для выращивания бактерий, поддерживающие температуру в камере в пределах (35 ± 1) °С;
- анаэростат или СO2-инкубатор, поддерживающий температуру в камере в пределах (35 ± 1) °С, содержание СO2 на уровне 3 - 7 %;
- холодильник фармацевтический, поддерживающий температуру 4 - 8 °С для хранения культур, биологических субстратов и реагентов;
- спиртовки (газовые горелки);
- дозаторы переменного объема полуавтоматические (автоматические);
- прибор для определения концентрации бактериальных клеток (стандарт мутности по Мак-Фарланду);
- дополнительное оборудование для автоматизации процесса выделения и изучения микроорганизмов (автоматические анализаторы, диспенсеры дисков, приборы для оценки антибиотикочувствительности диско-диффузионным методом и методом серийных разведений и пр.);
- приборы и программы информационного обеспечения (компьютер, принтер, электронные информационные системы).
Реагенты:
- питательные среды для определения чувствительности S. pneumoniae на базе обогащенных субстратов универсальные (МХА с 5%-й кровью);
- диски с антибиотиками профильной группы, Е-тесты, планшеты и стрипы с лиофилизированными бульонами и серийными разведениями антимикробных препаратов.
Средства дезинфекции
Дезинфицирующие средства в концентрации и времени экспозиции, указанные в инструкциях по их использованию.
Лабораторная посуда и расходные материалы:
- чашки бактериологические (Петри) для выращивания микробиологических культур;
- шпатели, тампоны-зонды для посева, пересева биологических материалов, выросших культур микроорганизмов;
- штативы и поддоны для пробирок и контейнеров, чашек Петри;
- петли бактериологические;
- наконечники стерильные для дозаторов переменного объема;
- посуда мерная лабораторная стеклянная и пластиковая;
- газогенераторные пакеты;
- пипетки пластиковые пастеровские градуированные для стандартизации объема и переноса жидкостей;
- перчатки резиновые;
- контейнеры и емкости для обеззараживания медицинских отходов.
Методами определения антибиотикочувствительности пневмококков являются: метод серийных разведений (количественный, референтный); диско-диффузионный метод (полуколичественный); Е-тест (промежуточный).
В национальных Федеральных клинических рекомендациях (ФКР) «Определение чувствительности микроорганизмов к антимикробным препаратам», 2014 г. даны методология оценки чувствительности S. pneumoniae к антимикробным препаратам, пограничные значения МПК и зон подавления роста для определения клинических категорий чувствительности, экспертные правила оценки чувствительности по системе EUCAST.
Учитывая, что в большинстве клинических лабораторий России основным методом является диско-диффузионный, ниже приводятся параметры его постановки согласно ФКР.
Питательная среда: агар Мюллер-Хинтон + 5 % дефибринированной лошадиной крови и 20 мг/л β-НАД (МХ-П).
Инокулюм: показатель мутности 0,5 по стандарту Мак-Фарланда (при использовании колоний с кровяного агара) и 1,0 (с шоколадного агара).
Инкубация: 5 % СO2, (35 ± 1) °С, (18 ± 2) ч.
Учет результатов: чашку Петри помещают дном книзу так, чтобы свет падал на поверхность агара под углом 45 °С (в отраженном свете), снимают крышку. При измерении зон ориентируются на зону полного подавления видимого роста. При показателе S (чувствительный) инкубацию продлевают до 24 ч.
Контроль качества: Streptococcus pneumoniae АТСС 49619.
Необходимо помнить, что пневмококки, как все грамположительные бактерии, обладают природной устойчивостью к азтреонаму, темоциллину, полимиксину В (колистину) и налидиксовой кислоте, как представители стрептококков - к фузидиевой кислоте и аминогликозидам.
Скрининговым тестом для оценки чувствительности S. pneumoniae к бета-лактамным антибиотикам является определение чувствительности к оксациллину (1 мкг в диске). Именно с него начинают изучение лекарственной чувствительности пневмококков и выявляют пенициллин-устойчивые штаммы. Базовыми антибиотиками для изучения антибиотикограммы могут быть моксифлоксацин, эритромицин, клинидамицин и тетрациклин, антибиотиками резерва - хлорамфеникол, триметоприм/сульфаметоксазол, ванкомицин, линезолид, рифампицин (табл. 3).
Таблица 3
Критерии интерпретации результатов определения
чувствительности
S. pneumoniae: диаметры зон подавления роста (мм) и
пограничные значения МПК (мг/мл) антимикробных препаратов
|
Антимикробный препарат |
Содержание в диске (мкг) |
Диаметры зон подавления роста (мм) |
Пограничные значения МПК (мг/л) |
Примечание |
||
|
S* ≥ |
R** < |
S ≤ |
R > |
|||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Скрининг |
||||||
|
Оксациллин |
1 |
20 |
|
|
|
Штамм, чувствительный к оксациллину, чувствителен ко всем β-лактамным антибиотикам, для которых разработаны пограничные значения (см. ФКР). При устойчивости к оксациллину во всех случаях к β-лактамным антибиотикам требуется определение МПК (метод серийных разведений, Е-тест) |
|
Базовые препараты |
||||||
|
Моксифлоксацин |
5 |
22 |
22 |
0,5 |
0,5 |
Возможно проведение скрининга с норфлоксацином. Изоляты, чувствительные к норфлоксацину (зона ≥ 12 мм при концентрации в диске 10 мкг), расцениваются как чувствительные к моксифлоксацину |
|
Эритромицин |
15 |
22 |
19 |
0,25 |
0,5 |
Штамм, чувствительный к эритромицину, считается чувствительным к азитромицину, кларитромицину и рокситромицину |
|
Клиндамицин |
2 |
19 |
19 |
0,5 |
0,5 |
Анттагонизм между клинидамицином и макролидами (при постановке теста диски с эритромицином и клинидамицином располагают на расстоянии между краями дисков 12 - 16 мм) свидетельствует о наличии индуцибельной резистентности к клиндамицину (D-феномен). Монотерапия клинидамицином противопоказана из-за риска формирования полной резистентности. Если антагонизм не выявляется, изолят расценивают как чувствительный |
|
Тетрациклин |
30 |
25 |
22 |
1 |
2 |
Штамм, чувствительный к тетрациклину, является чувствительным к доксициклину и миноциклину. Для штаммов, устойчивых к тетрациклину, требуется определение МПК к доксициклину и миноциклину |
|
Препараты резерва |
|
|
|
|
|
|
|
Хлорамфеникол |
30 |
21 |
21 |
8 |
8 |
|
|
Триметоприм/сульфаметоксазол |
1,25/23,75 |
18 |
15 |
1 |
2 |
|
|
Ванкомицин |
5 |
16 |
16 |
2 |
2 |
|
|
Линезолид |
10 |
22 |
19 |
2 |
4 |
|
|
Рифампицин |
5 |
22 |
17 |
0,06 |
0,5 |
|
|
________ *S - чувствительный, **R - устойчивый (интервальные отклонения относятся к промежуточному критерию чувствительности/устойчивости - I). |
||||||
Номенклатуру антимикробных средств, используемых при постановке антибиотикограммы, необходимо адаптировать в каждом медицинском учреждении с учетом специфики лечебно-диагностического процесса.
Оборудование:
- ламинарный бокс 2-го класса биологической безопасности;
- термостаты электрические для выращивания бактерий, поддерживающие температуру в камере в пределах (35 - 37 ± 1) °С;
- центрифуга лабораторная;
- анаэростат или СO2-инкубатор, поддерживающий температуру в камере в пределах (37 ± 1) °С, содержание СO2 на уровне 3 - 7 %;
- холодильник фармацевтический, поддерживающий температуру 4 - 8 °С для хранения культур, биологических субстратов и реагентов;
- водяная баня (сухо-воздушный инкубатор);
- приборы и программы информационного обеспечения (компьютер, принтер, электронные информационные системы).
Реагенты:
- диагностические наборы (тест-системы) для проведения латекс-агглютинации.
Средства дезинфекции
Дезинфицирующие средства в концентрации и времени экспозиции, указанные в инструкциях по их использованию.
Лабораторная посуда и расходные материалы:
- одноразовые стерильные контейнеры с устойчивым основанием, тампоны-зонды (Swab) для сбора и транспортирования образцов биологического материала;
- шпатели, тампоны-зонды для посева, пересева биологических материалов, выросших культур микроорганизмов;
- штативы и поддоны для пробирок и контейнеров, чашек Петри;
- пипетки пластиковые пастеровские градуированные для стандартизации объема и переноса жидкостей;
- перчатки резиновые;
- контейнеры и емкости для обеззараживания медицинских отходов.
При тестировании биологических материалов (ликвор, сыворотка) для реакции используют прозрачную надосадочную жидкость образца, предварительно прогретого в сухо-воздушном инкубаторе или на водяной бане и центрифугированного (профильтрованного) для получения прозрачной надосадочной жидкости. Минимальный объем для тестирования 0,5 мл. Одну каплю каждого латексного реактива (предварительно реактивы рекомендуют тщательно встряхнуть) наносят на специальные бумажные карты, приложенные к набору. Затем добавляют 30 мкл исследуемого материала (надосадочная фракция) к каждой капле латексного реактива. Перемешивают чистым аппликатором. Осторожно покачивают бумажную карту. Агглютинация в течение 2 мин свидетельствует о присутствии в испытуемом образце специфического антигена.
Для обнаружения антигена в бактериальной культуре выделенные на питательном агаре изоляты собирают петлей (в количестве 10 - 12 колоний), тщательно эмульгируют в физиологическом растворе, предварительно нанесенном на агглютинационную карту, для получения гомогенной суспензии. Латексный реагент, содержащий сенсибилизированные кроличьи антитела, специфичные для S. pneumoniae, наносят на карту, перемешивают с полученной суспензией и регистрируют на наличие четкой агглютинации в течение 2 мин (рис. 3).

Рис. 3. Латекс-агглютинация: положительный (слева)
и отрицательный (справа) результаты
Для выполнения реакции латекс-агглютинации используют наборы латексных диагностических препаратов, например, Slidex pneumo-Kit (BioMerieux).
В настоящее время выпускают наборы с различными комбинациями моноклональных антител для выявления антигенов наиболее часто встречаемых в диагностике бактериальных менингитов (S. pneumoniae, N. meningitidis (серогруппы А, В, С, Y/W 135), Н. influenzae тип В, S. agalactiae группы В, Е. coli K1 и др.).
6.2.5. Иммунохроматографический анализ (ИХА)
Оборудование:
- ламинарный бокс 2-го класса биологической безопасности;
- холодильник фармацевтический, поддерживающий температуру 4 - 8 °С для хранения культур, биологических субстратов и реагентов;
- приборы и программы информационного обеспечения (компьютер, принтер, электронные информационные системы).
Реагенты:
- диагностические наборы реагентов (тест-системы) для выявления антигенов ДНК возбудителя.
Средства дезинфекции
Дезинфицирующие средства в концентрации и времени экспозиции, указанные в инструкциях по их использованию.
Лабораторная посуда и расходные материалы:
- одноразовые стерильные контейнеры с устойчивым основанием, тампоны-зонды (Swab) для сбора и транспортирования образцов биологического материала;
- штативы и поддоны для пробирок и контейнеров;
- наконечники стерильные для дозаторов переменного объема;
- пипетки пластиковые пастеровские градуированные для стандартизации объема и переноса жидкостей;
- перчатки резиновые;
- контейнеры и емкости для обеззараживания медицинских отходов.
Для проведения иммунохроматографического экспресс-теста используют тест-кассету в герметичной упаковке (фольга) в форме открывающейся книжки (рис. 4).
Рис. 4. Тест-система для иммунохроматографического метода
Тест-кассета содержит мембрану с нанесенными на нее в виде двух отдельных полосок кроличьими антителами к антигену S. pneumoniae и козьими антителами против IgG кролика в комбинации с конъюгатом из кроличьих антител к антигену S. pneumoniae и антивидовых антител, конъюгированных с окрашенными частицами. Вторая полоска дает контрольную линию, проявляющуюся розовым или красным цветом. Кассета имеет лунку, расположенную на противоположной стороне устройства, для внесения в тест исследуемого образца. В комплект входят Реагент А - (1 пластиковый флакон-капельница - 5,0 мл) цитратно-фосфатный буфер с лаурилсульфатом, Твином-20 и азидом натрия, тампоны для отбора образца мочи пациента, разработанные специально для использования в тесте, положительный контрольный тампон с высушенными на тампоне инактивированными S. pneumoniae и отрицательный контрольный тампон.
Перед постановкой реакции охлажденный или замороженный образец следует разморозить. Мочу для исследования непосредственно перед тестированием перемешивают легким вращательным движением. Стерильный тампон на аппликаторе, прилагаемый к диагностическому набору, погружают в мочу и помещают в кассету. Из пластиковой капельницы в кассету добавляют 3 капли реагента А (рис. 5).
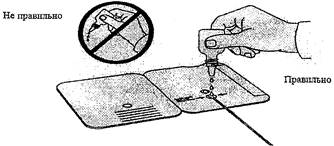
Рис. 5. Постановка иммунохроматографического экспресс-теста
По окончании процедуры устройство закрывают, чтобы привести исследуемый образец мочи в контакт с тест-полоской.
При наличии в моче антигена S. pneumoniae происходит его связывание с находящимися на подложке антителами окрашенного конъюгата, а также с иммобилизированными на мембране кроличьими антителами к антигену S. pneumoniae, в результате чего возникает окрашенная розовая или красная линия в зоне чтения образца. Иммобилизированные на полоске в виде линии козьи антитела против IgG кролика также связывают окрашенный конъюгат и формируют вторую линию - контрольную.
Положительный результат регистрируют через 10 - 15 мин по наличию двух окрашенных линий в зоне чтения. На отрицательный результат указывает одна окрашенная контрольная линия, свидетельствующая об отсутствии антигена S. pneumoniae в тестируемом образце. Отсутствие окрашенной контрольной линии указывает на недействительные результаты.
Положительные и отрицательные контрольные образцы должны ставиться для каждого вновь открытого набора или в каждом отдельном случае согласно требованиям процедуры внутри лабораторного контроля качества. Для постановки контрольных реакций из пластиковой капельницы в кассету добавляют 6 капель реагента А.
6.2.6. Полимеразная цепная реакция (ПЦР)
Лаборатории, использующие методы амплификации нуклеиновых кислот, должны иметь санитарно-эпидемиологическое заключение о возможности проведения работ с возбудителями III - IV групп патогенности, работа организуется согласно СП 1.3.2322-08, МУ 1.3.2569-09.
Лаборатория в соответствии с этапами проведения анализа должна включать рабочую зону 1 (для приема, регистрации, разбора и первичной обработки материала), рабочую зону 2 (для выделения (экстракции) нуклеиновых кислот), рабочую зону 3 (для проведения реакции амплификации и учета ее результатов).
Рекомендуется разделить рабочую зону 3 на две подзоны (3а и 3б) и разместить их в отдельных помещениях. В подзоне 3а осуществляют приготовление реакционных смесей, в подзоне 3б проводят амплификацию нуклеиновых кислот и учет результатов амплификации при использовании гибридизационо-флуоресцентного метода детекции.
Оборудование, реагенты, средства дезинфекции, лабораторная посуда и расходные материалы.
Рабочая зона 1
1. Бокс биологической безопасности III класса защиты или бокс биологической безопасности II класса защиты.
2. Центрифуга для пробирок объемом 5 - 100 мл до 3 тыс. об./мин.
3. Микроцентрифуга/вортекс.
4. Настольная центрифуга для микропробирок (типа «Эппендорф» или аналоги) объемом 1,5 - 2 мл до 10000 g.
5. Твердотельный термостат для пробирок объемом 1,5 мл с диапазоном рабочих температур 25 - 100 °С.
6. Термостатируемый шейкер для пробирок.
7. Отдельный набор автоматических пипеток переменного объема.
8. Одноразовые полипропиленовые завинчивающиеся или плотно закрывающиеся микропробирки на 1,5 мл или 2,0 мл.
9. Одноразовые наконечники для пипеток переменного объема с фильтром до 200 и до 1000 мкл.
10. Штативы для наконечников, микропробирок объемом 1,5 мл.
11. Комбинированный холодильник с камерами, поддерживающими температуру от 2 до 8 °С и не выше минус 16 °С (для хранения исследуемого материала). Возможно отдельное использование холодильника с камерой, поддерживающей температуру от 2 до 8 °С, и морозильника с камерой, поддерживающей температуру не выше минус 16 °С.
12. Морозильная камера на минус 70 °С (при необходимости, в случае длительного хранения материала).
13. Емкость с регламентируемым дезинфицирующим раствором.
14. Емкость с 70 %-м этиловым спиртом.
Рабочая зона 2
1. Бокс биологической безопасности II или III класса биологической защиты.
2. Микроцентрифуга/вортекс.
3. Настольная центрифуга для микропробирок (типа «Эппендорф» или аналоги) объемом 1,5 - 2 мл до 10000 g.
4. Твердотельный термостат для пробирок объемом 1,5 мл с диапазоном рабочих температур 25 - 100 °С.
5. Вакуумный отсасыватель медицинский с колбой-ловушкой.
6. Отдельный набор автоматических пипеток переменного объема.
7. Одноразовые полипропиленовые завинчивающиеся или плотно закрывающиеся пробирки объемом 1,5 мл или 2,0 мл.
8. Одноразовые наконечники для дозаторов переменного объема до 200 мкл.
9. Одноразовые наконечники для дозаторов переменного объема с фильтром до 100, 200 и до 1000 мкл.
10. Штативы для наконечников, микропробирок на 1,5 мл.
11. Холодильник с камерами, поддерживающими температуру от 2 до 8 °С и не выше минус 16 °С (для хранения наборов, предназначенных для выделения нуклеиновых кислот). Возможно отдельное использование холодильника с камерой, поддерживающей температуру от 2 до 8 °С, и морозильника с камерой, поддерживающей температуру не выше минус 16 °С.
12. Холодильник с камерой, поддерживающей температуру от 2 до 8 °С (для хранения препаратов нуклеиновых кислот). Не допускается хранение препаратов нуклеиновых кислот в одном холодильнике с компонентами набора для выделения нуклеиновых кислот.
13. Емкость с дезинфицирующим раствором.
14. Отдельный халат, шапочки, обувь и одноразовые перчатки по МУ 1.3.2569-09.
15. Одноразовые пластиковые контейнеры для сброса и инактивации материалов.
16. Допускается использование автоматизированного оборудования для выделения нуклеиновых кислот.
17. Коммерческие наборы реагентов, зарегистрированные и разрешенные для использования в России в установленном порядке.
Рабочая зона 3
1. Бокс биологической безопасности II и III класса или настольный бокс с бактерицидной лампой (ПЦР-бокс; УФ-бокс).
2. Программируемые термоциклеры (персональные, многомодульные, с функцией амплификации в режиме «реального времени») и автоматизированные станции. Выбор термоциклера или автоматизированной станции определяется методами амплификации нуклеиновых кислот и коммерческими наборами реагентов, используемыми в лаборатории, характером выполняемых задач и финансовыми возможностями.
4. Микроцентрифуга/вортекс.
5. Отдельный набор автоматических пипеток переменного объема.
6. Одноразовые полипропиленовые пробирки для амплификации объемом 0,5 (0,2) мл.
7. Одноразовые наконечники для пипеток переменного объема с фильтром до 10, 100 и 200 мкл, свободные от ДНКаз.
8. Штативы для наконечников, микропробирок на 0,5 (0,2) мл.
9. Холодильник с камерами, поддерживающими температуру от 2 до 8 °С и от минус 18 °С до минус 25 °С (для хранения наборов, предназначенных для проведения обратной транскрипции и амплификации нуклеиновых кислот). Возможно отдельное использование холодильника с камерой, поддерживающей температуру от 2 до 8 °С, и морозильника с камерой, поддерживающей температуру от минус 18 °С до минус 25 °С.
10. Емкость для сброса отработанных расходных материалов.
11. С целью автоматизации процедуры приготовления реакционных смесей для амплификации допускается использование автоматизированного оборудования для раскапывания реагентов.
12. Коммерческие диагностические наборы реагентов (тест-ситемы), зарегистрированные и разрешенные для использования в России в установленном порядке.
Этап пробоподготовки
Некоторые виды биологического материала, перечисленные в данном разделе, требуют предварительной обработки перед проведением исследования.
Мокрота или аспират из трахеи. Вязкая по консистенции мокрота подлежит обработке реагентом, разрушающим мукополисахариды (например, препаратом «муколизин» или аналогом). С целью снижения вязкости в емкость с мокротой добавляется реагент в количестве, равном количеству мокроты. После инкубации при комнатной температуре до просветления мокроты (не более 20 мин) 100 мкл мокроты используют для экстракции ДНК. При необходимости повторного проведения анализа остаток обработанной мокроты замораживают.
Бронхоальвеолярный лаваж или промывные воды бронхов. Образец перемешивают переворачиванием в исходной емкости. Автоматическим дозатором, используя наконечник с фильтром, отбирают 1 мл образца и переносят в пробирку объемом 1,5 мл для проведения центрифугирования при 10 тыс. об./мин в течение 10 мин. Надосадочную жидкость аккуратно отбирают, используя наконечник с фильтром, оставляя над осадком 200 мкл жидкости, в которой ресуспендируют осадок. Полученную суспензию (100 мкл) используют для экстракции ДНК. При необходимости повторного проведения анализа оставшийся материал замораживают.
Секционный материал гомогенизируют с использованием стерильных фарфоровых ступок и пестиков, затем готовят 10 %-ю суспензию на стерильном физиологическом растворе или фосфатном буфере. Суспензию переносят в пробирку на 1,5 мл и центрифугируют при 10 тыс. об./мин в течение 5 мин. Надосадочную жидкость (100 мкл) используют для экстракции ДНК. При необходимости повторного проведения анализа остаток суспензии замораживают.
Экстракция нуклеиновых кислот
Методика экстракции ДНК из исследуемых образцов методом высаливания
1. Раствор для лизиса (если он хранился при температуре от 2 до 8 °С) прогреть при температуре 65 °С до полного растворения кристаллов.
2. Отобрать необходимое количество одноразовых пробирок объемом 1,5 мл с завинчивающимися или плотно закрывающимися крышками (включая отрицательный и положительный контроли экстракции, если они предусмотрены для проведения ПЦР-исследования). Внести в каждую пробирку по 10 мкл ВКО (если он предусмотрен для проведения ПЦР-исследования). Добавить в пробирки по 300 мкл раствора для лизиса. Промаркировать пробирки.
3. Внести в пробирки с раствором для лизиса и ВКО (если используется) по 100 мкл исследуемых образцов, используя для каждого образца отдельный наконечник с фильтром.
4. В пробирку отрицательного контроля (ОК) экстракции внести 100 мкл ОКО, пробирку положительного контроля (ПК) экстракции внести 90 мкл ОКО и 10 мкл ПКО (если они предусмотрены для проведения ПЦР-исследования).
5. Плотно закрыть крышки, тщательно перемешать на вортексе. Поместить пробирки в термостат с температурой 65 °С на 5 мин. Перемешать и затем осадить капли на вортексе.
6. Добавить в пробирки по 400 мкл раствора для преципитации, плотно закрыть крышки, перемешать на вортексе.
7. Центрифугировать пробирки на микроцентрифуге в течение 5 мин при 12 тыс. g (например, 13,4 тыс. об./мин для микроцентрифуги MiniSpin, Eppendorf или аналоги).
8. Не захватывая осадок, удалить надосадочную жидкость из каждой пробирки отдельным наконечником без фильтра на 200 мкл, используя вакуумный отсасыватель.
9. Добавить в пробирки по 500 мкл раствора для отмывки 3, плотно закрыть крышки, осторожно промыть осадок, переворачивая пробирки 3 - 5 раз. Можно провести процедуру одновременно для всех пробирок, для этого необходимо накрыть пробирки в штативе сверху крышкой или другим штативом, прижать их и переворачивать штатив.
10. Центрифугировать пробирки на микроцентрифуге в течение 1 мин при 12 тыс. g.
11. Не захватывая осадок, удалить надосадочную жидкость из каждой пробирки отдельным наконечником без фильтра на 200 мкл, используя вакуумный отсасыватель.
12. Аналогично провести одну отмывку 200 мкл раствора для отмывки 4.
13. Поместить пробирки с открытыми крышками в термостат с температурой 65 °С на 5 мин для подсушивания осадка.
14. Добавить в пробирки по 50 мкл буфера для элюции (РНК-буфера) и перемешать на вортексе. Поместить пробирки в термостат с температурой 65 °С на 5 мин, периодически перемешивая на вортексе. Допускается увеличение объема элюции до 120 мкл (см. инструкцию к используемому набору реагентов для амплификации).
15. Центрифугировать пробирки на микроцентрифуге в течение 1 мин при 12 тыс. g. Надосадочная жидкость содержит очищенные ДНК. Пробы готовы к постановке реакции ПЦР.
16. Очищенная ДНК может храниться при температуре от 2 до 8 °С до 4 ч, при температуре от минус 24 до минус 16 °С в течение недели и при температуре не выше минус 68 °С в течение года. С целью хранения необходимо, не захватывая осадок, перенести надосадочную жидкость (содержащую ДНК) в стерильную пробирку.
ПЦР-амплификация с детекцией в режиме «реального времени» в качественном формате
Выбор пробирок для амплификации зависит от используемого амплификатора с системой детекции в режиме «реального времени». Для внесения в пробирки реагентов, проб ДНК и контрольных образцов используются одноразовые наконечники с фильтрами.
А. Подготовка пробирок для амплификации
А1. Подготовка пробирок для проведения амплификации при помощи соответствующего комплекта реагентов
Общий объем реакционной смеси - 30 (25) мкл, включая объем пробы к ДНК - 10 мкл.
1. Отобрать необходимое количество пробирок с ПЦР-смесью-FL для амплификации ДНК исследуемых и контрольных проб. Убедиться, что воск полностью покрывает раствор на дне пробирок.
2. На поверхность воска внести по 10 мкл ПЦР-буфера-А, при этом он не должен проваливаться под воск и смешиваться с ПЦР-смесью-FL.
3. В подготовленные пробирки внести по 10 мкл проб ДНК.
4. Поставить контрольные реакции:
- отрицательный контроль ПЦР (K-) - внести в пробирку 10 мкл К-;
- положительный контроль ПЦР (K+) - внести в пробирку 10 мкл К+;
- отрицательный контроль экстракции (ОК) - внести в пробирку 10 мкл пробы, выделенной из образца ОКО;
- положительный контроль экстракции (ПК, если используется в наборе реагентов) - внести в пробирку 10 мкл пробы, выделенной из образца ПКО.
А2. Подготовка пробирок для проведения амплификации при помощи комплектов реагентов (например, «ПЦР-комплект» вариант FRT-50F или аналоги)
Общий объем реакционной смеси - 25 мкл, включая объем пробы к ДНК - 10 мкл.
1. Разморозить необходимое количество пробирок с ПЦР-смесью-FL. Перемешать содержимое пробирок с ПЦР-смесью-FL, ПЦР-буфером-В и полимеразой (TaqF) и осадить капли кратковременным центрифугированием (1 - 2 с) с помощью центрифуги/вортекса.
2. Отобрать необходимое количество пробирок или стрипов для амплификации ДНК исследуемых и контрольных проб.
3. Для проведения N реакций смешать в отдельной пробирке 10×(N + 1) мкл ПЦР-смеси-FL, 5×(N + 1) мкл ПЦР-буфера-В и 0,5×(N + 1) мкл полимеразы (TaqF).
4. Перемещать подготовленную смесь на вортексе и осадить капли кратковременным центрифугированием с помощью центрифуги/вортекса.
5. Внести в каждую пробирку по 15 мкл подготовленной смеси.
6. В подготовленные пробирки внести по 10 мкл ДНК, полученных на этапе экстракции.
7. Поставить контрольные реакции:
- отрицательный контроль ПЦР (K-) - внести в пробирку 10 мкл K-;
- положительный контроль ПЦР (K+) - внести в пробирку 10 мкл K+;
- отрицательный контроль экстракции (ОК) - внести в пробирку 10 мкл пробы, выделенной из образца ОКО;
- положительный контроль экстракции (ПК, если используется в наборе реагентов) - внести в пробирку 10 мкл пробы, выделенной из образца ПКО.
Б. Проведение амплификации с детекцией в режиме «реального времени»
1. Запрограммировать прибор (амплификатор с системой детекции в режиме «реального времени») для выполнения амплификации и детекции флуоресцентного сигнала в соответствии с инструкцией к набору реагентов, учитывая рекомендованные каналы для флуорофоров.
2. Установить пробирки в ячейки реакционного модуля прибора. Перед установкой в амплификатор планшетного типа необходимо осадить капли со стенок пробирок кратковременным (1 - 3 с) центрифугированием на центрифуге/вортексе.
3. Запустить выполнение программы амплификации с детекцией флуоресцентного сигнала.
4. По окончании выполнения программы приступить к анализу и интерпретации результатов.
Анализ результатов проводят с помощью программного обеспечения прибора, используемого для проведения ПЦР с детекцией в режиме «реального времени». Согласно инструкции производителя наборов реагентов устанавливают все необходимые настройки параметров, включая уровень пороговой линии, устранение выбросов (если предусмотрено) и другие, указанные для конкретного набора реагентов. Положительным считают образец, в котором кривая флуоресценции пересекает установленную на соответствующем уровне пороговую линию, что определяет наличие (или отсутствие) для данной пробы значения порогового цикла Ct в соответствующей графе в таблице результатов по определенному каналу детекции. При этом кривая флуоресценции данной пробы должна пересекать пороговую линию на участке характерного экспоненциального подъема флуоресценции. В случае если экспоненциальный подъем не очевиден (линия флуоресценции похожа на прямую линию) следует проанализировать необработанные (сырые) данные. Если в сырых данных экспоненциальный подъем флуоресценции отсутствует, результат по этой пробе считать отрицательным.
В. Интерпретация и выдача результатов исследования при использовании амплификации с детекцией в режиме «реального времени»
Результат ПЦР-исследования считается достоверным, если получены правильные результаты для положительных и отрицательных контролей.
Принцип интерпретации результатов следующий:
1. ДНК искомого возбудителя обнаружена, если для данной пробы в таблице результатов по каналу для соответствующего флуорофора определено значение порогового цикла Ct, не превышающее указанное во вкладыше к набору реагентов граничное значение.
2. ДНК искомого возбудителя не обнаружена, если для данной пробы в таблице результатов по каналам для соответствующего флуорофора не определено (отсутствует) значение порогового цикла Ct, а значение порогового цикла Ct по каналу для детекции ВКО не превышает указанное во вкладыше к набору реагентов граничное значение.
3. Результат анализа невалидный, если для данной пробы не определено (отсутствует) значение порогового цикла Ct по каналу для детекдии ДНК возбудителя, и по каналу для детекции ВКО значение Ct также не определено (отсутствует) или превышает указанное граничное значение. В этом случае требуется повторить ПЦР-исследование соответствующего образца, начиная с этапа экстракции ДНК. При повторении результатов рекомендовать повторный сбор материала для анализа.
4. Результат анализа сомнительный, если для данной пробы значение порогового цикла Ct по каналу для детекции ДНК возбудителя превышает указанное во вкладыше к набору реагентов граничное значение, а значение порогового цикла Ct по каналу для детекции ВКО не превышает указанное во вкладыше к набору реагентов граничное значение. В этом случае требуется повторить ПЦР-исследование соответствующего образца, начиная с этапа экстракции ДНК. При повторении результатов или получении значения порогового цикла Ct по каналам для детекции ДНК возбудителя менее граничного, образец считать положительным.
Граничные значения Ct указываются во вкладыше, прилагаемом к набору реагентов. Подробная информация по программированию приборов, анализу и интерпретации результатов также указана в методических рекомендациях по применению конкретного набора реагентов.
По значению Ct, полученного для исследуемого образца, можно косвенно судить о количестве ДНК возбудителя в пробе: чем меньше значение Ct, тем больше ДНК в исследуемой пробе, и наоборот. То есть, если значение Ct в исследуемом образце равно или меньше, чем значение Ct для K+ по данному каналу детекции, можно считать, что количество ДНК возбудителя большое; если значение Ct в исследуемом образце больше, чем значение Ct для K+ по данному каналу детекции, можно считать, что количество ДНК возбудителя небольшое; если кривая флуоресценции пересекает пороговую линию на последних циклах амплификации - в пробе содержатся следовые количества ДНК возбудителя.
ПЦР-амплификация с детекцией в режиме «реального времени» в количественном формате
Порядок проведения количественного исследования аналогичен качественному анализу за исключением использования на этапе ПЦР дополнительных образцов - калибраторов, входящих в набор реагентов, с известной концентрацией ДНК S. pneumoniae и ДНК ВКО, которые указываются во вкладыше к набору реагентов. Особенности анализа результатов амплификации помимо этого связанны с расчетом концентраций ДНК S. pneumoniae и ДНК ВКО.
В результате исследования учитывают эффективность экстракции (потери ДНК при экстракции), для чего определяют соотношение концентрации ДНК ВКО до экстракции и расчетную концентрацию ДНК ВКО после экстракции. Полученное значение используют при расчете реальной концентрации ДНК S. pneumoniae в исследуемом образце. Дополнительным контролем проведения количественного исследования служит расчет концентрации ДНК ПКО и сравнение полученного значения с истинной концентрацией ДНК в препарате ПКО, которая указана во вкладыше к набору реагентов.
Клинически значимым при исследовании материала от пациентов с подозрением на внебольничную пневмонию, проведенного методом ПЦР в качественном и (или) количественном формате, можно считать обнаружение ДНК S. pneumoniae в мокроте (или аспирате из трахеи) в количестве > 105 ГЭ/мл (или копий/мл). В БАЛ и аутопсийном материале клинически значимой является концентрация 104 - 105 ГЭ/мл (или копий/мл). При исследовании венозной крови любое количество ДНК является значимым. Однако если пациент применял антибиотики до обращения за медицинской помощью, диагностически значимая концентрация может быть ниже.
6.2.7. Определение серологических типов Streptococcus pneumoniae
Для серотипирования бактериальных культур S. pneumoniae с целью повышения эффективности наблюдения за циркулирующими штаммами возбудителя и оценки эффективности вакцинопрофилактики в настоящее время используют два метода лабораторной диагностики: латекс-агглютинацию и ПЦР.
Метод латекс-агглютинации
Порядок проведения исследования аналогичен п. 6.2.4.
Отличие заключается в использовании нескольких латексных реагентов, содержащих сенсибилизированные кроличьи антитела, специфичные для определенной серологической группы S. pneumoniae.
Метод ПЦР
Порядок проведения исследования аналогичен п. 6.2.6.
Для определения серотипов S. pneumoniae с помощью ПЦР в режиме «реального времени» может быть использована методика, предполагающая исследование 16 серотип-специфических мишеней в 4 реакционных смесях. Каждая из реакционных смесей содержит праймеры и зонды для проведения ПЦР на амплификаторах с пятью каналами флуоресцентной детекции. Методика предназначена для определения пневмококков, ассоциированных с инвазивными формами инфекции, капсульные антигены которых включены в состав 10- и 13-валентных конъюгированных вакцин. Серотип-специфические праймеры и зонды распределены по реакционным смесям следующим образом:
а) реакционная смесь № 1 - 3, 6ВА, 19F, 9VA;
б) реакционная смесь № 2 - 1, 14, 23F, 4;
в) реакционная смесь № 3 - 18, 9NL, 15AF, 11AD;
г) реакционная смесь № 4 - 2, 5, 7AF, 19А.
Каждая реакционная смесь содержит праймеры и зонд для амплификации положительного внутреннего контроля - фрагмента гена cps.
Порядок проведения исследования с использованием данной методики, условия проведения амплификации и интерпретации результатов опубликованы в работе К.О. Миронова и соавторами (К.О. Миронов и соавт., 2014). Выбор методики для определения серологических типов S. pneumoniae зависит от их предполагаемого распространения в наблюдаемой популяции на данной территории, эпидемиологической обстановки и проведения иммунопрофилактических мероприятий. Для расширенного эпидемиологического исследования могут быть использованы альтернативные зарубежные или отечественные методики, предполагающие детекцию большего количества серотип-специфических мишеней.
6.3. Постаналитический этап
Сбор, хранение и утилизация отходов
Весь доставленный на исследование в лабораторию биологический материал после выполнения назначенных тестов архивируется. Сроки хранения биопроб в архиве лаборатории (в специальных опломбированных биксах, холодильниках, низкотемпературных камерах, лиофилизированном виде и пр.) зависят от вида материала и исследуемых компонентов. Обеззараживание биологического материала, сбор, хранение и утилизация отходов микробиологических лабораторий проводятся в соответствии с требованиями СП 1.3.2322-08 и СП 2.1.7.2790-10.
Контроль качества лабораторных исследований
Охватывает условия хранения и соблюдения сроков годности реактивов, питательных сред, тест-систем, дисков с антибиотиками и пр., наличие на рабочих местах инструкций по применению методик и использованию аппаратуры; наличие журналов регистрации сервисного обслуживания и ремонта оборудования, графика его поверки.
Внутрилабораторный контроль качества включает в себя контроль за соблюдением требований к условиям проведения анализа (лабораторные помещения, воздушная среда, температурные режимы инкубации и хранения, режимы дезинфекции и стерилизации и т.д.), выполнением регламентированных процедур ведения тестовых культур, использованием заведомо положительных и отрицательных контролей; оценку доверительных границ полученного количественного результата; систематический анализ результатов контрольных процедур. Документальное оформление результатов таких контрольных процедур осуществляется в утвержденных регистрационных формах согласно СП 1.2.036-95 от 28.08.1995.
Внешнюю оценку качества проводят специальными организациями, имеющими лицензию на проведение межлабораторных испытаний. В случае неудовлетворительной оценки полученных результатов в лаборатории необходимо принимать экстренные меры по устранению ошибок.
В рамках организации контроля качества большое внимание необходимо уделять разработке и внедрению на рабочих местах стандартных операционных процедур, которые включают обучение среднего и младшего медицинского персонала, аудит соблюдения персоналом их требований, оценку и оптимизацию организационных возможностей выполнения; разработку внутренних документов системы управления качеством; процедуры внутрилабораторного контроля качества, лабораторных исследований в программах внешней оценки качества, оценку результатов внутрилабораторного и внешнелабораторного контроля.
Ведение медицинской документации
Архивированию подлежат первичная медицинская документация: бланки направлений, документы аналитического этапа (результаты исследований пациентов, протоколы производственного контроля внешней среды, материалы по контролю качества). Порядок ведения медицинской документации и формы основных журналов регламентированы приказом МЗ СССР от 04.10.1980 № 130 «Об утверждении форм первичной медицинской документации учреждений здравоохранения» и СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности». Сроки хранения журналов определены приказом МЗ СССР от 30.05.1974 № 493.
6.4. Алгоритм лабораторной диагностики
Алгоритм лабораторной диагностики ВП при подозрении на пневмококковую этиологию различен для пневмоний с различной тяжестью течения, для пациентов с выраженным иммунодефицитом и детей. Различия будут наблюдаться в предпочтительном наборе методов лабораторной диагностики, порядке их использования и спектре биологического материала для исследования.
При «тяжелых» формах ВП (госпитализация в ОРИТ), которые могут быть обусловлены инвазивной пневмококковой инфекцией, диагностические тесты должны быть в первую очередь направлены на быструю выдачу предварительного результата. Методами экспресс-анализа у взрослых будут являться ИХА (исследование мочи), бактериоскопический метод и метод Нейфельда (исследование БАЛ, промывных вод бронхов, биоптата бронхов, полученного с помощью защищенных щеток, биоптата легких, плевральной жидкости), латекс-агглютинация (исследование сыворотки крови).
Исследование плевральной жидкости выполняется при наличии плеврального выпота и условий безопасного проведения плевральной пункции (визуализация на латерограмме свободно смещаемой жидкости с толщиной слоя > 1,0 см) и предусматривает бактериоскопию мазка, окрашенного по Грамму, с последующим культуральным исследованием.
Положительный результат бактериоскопии, латекс-агглютинации и ИХА является предварительным, в то время как отрицательный результат не может исключить наличие пневмококковой инфекции.
Для идентификации S. pneumoniae может применяться ПЦР (исследование мокроты, аспиратов из трахеи или БАЛ в количественном формате, крови и плевральной жидкости в качественном или количественном формате).
Бактериологический метод (исследование крови, БАЛ, плевральной жидкости, мокроты) служит для подтверждения предварительного диагноза и определения чувствительности к антибактериальным препаратам.
При выделении возбудителя также возможно проведение молекулярно-генетического «серотипирования». Именно у этой категории пациентов выделяют наиболее вирулентные капсульные штаммы пневмококка. Алгоритм диагностики «тяжелых» форм пневмоний должен учитывать возможность присутствия других возбудителей бактериальной природы (микст-формы), а также легионеллезную и вирусно-бактериальную этиологию заболевания. Именно поэтому в комплекс диагностических мер необходимо включить дополнительные методы по выделению прочих бактериальных патогенов с учетом спектра их чувствительности к антибиотикам, провести экспресс-диагностику на присутствие легионелл, вирусов гриппа (в период эпидемического подъема) и других возбудителей ОРВИ (преимущественно у детей до 5 лет и лиц старше 65 лет).
При «нетяжелых» формах ВП целью этиологической диагностики является получение наиболее достоверного и полного результата. В качестве предварительной диагностики у взрослых может использоваться ИХА (моча). Для идентификации S. pneumoniae может применяться ПЦР (исследование мокроты, аспиратов из трахеи или БАЛ в количественном формате, крови и плевральной жидкости в качественном или количественном формате). Для окончательной постановки диагноза и определения чувствительности к антибиотикам проводят бактериологическое исследование мокроты или аспиратов из трахеи, а также венозной крови.
При диагностике нетяжелых форм пневмоний необходимо учитывать возможность микоплазменной, хламидийной и вирусной этиологии (грипп во время эпидемического подъема, остальные ОРВИ у детей до 5 лет и взрослых старше 65 лет). У детей высока вероятность смешанной бактериально-вирусной инфекции.
При проведении лабораторной диагностики ВП у детей следует учитывать, что ИХА не применяется, а получение полноценной мокроты бывает затруднительно. С целью отбора образцов для анализа рекомендуется применять способы индукции мокроты или брать аспираты из трахеи. Если же удается получить мокроту (или аспираты из трахеи), экспресс-анализ у детей проводится с помощью бактериоскопии и метода Нейфельда (исследование мокроты, аспиратов из трахеи, плевральной жидкости), латекс-агглютинации при тяжелом течении (исследование сыворотки крови), ПЦР (исследование крови в качественном или количественном формате (при тяжелом течении), мокроты, аспиратов из трахеи или БАЛ в количественном формате, плевральной жидкости в качественном или количественном формате). При невозможности получения мокроты и аспиратов из трахеи у детей допустимо для исследования методом ПЦР в количественном формате использование мазков из верхних дыхательных путей (ротоглотка и носоглотка), однако в связи с возможным носительством пневмококка диагностическая ценность такого материала гораздо ниже; в этом случае клинически значимым можно считать обнаружение ДНК S. pneumoniae в количестве ≥ 105 ГЭ/мл (105 копий/мл). При интерпретации результатов бактериоскопии и латекс-агглютинации следует учитывать высокий уровень носительства пневмококков и стрептококков группы viridans в популяции детей.
Диагностика ВП у пациентов с выраженным иммунодефицитом требует исследования расширенного этиологического спектра Наряду с лабораторной диагностикой, нацеленной на выделение пневмококка в зависимости от тяжести состояния (см. выше), в комплекс лабораторных исследований включают тесты по обнаружению профильных патогенов, регламентированные МУК 4.2.3115-13. Биологическим материалом для исследования является мокрота, венозная кровь, инвазивные респираторные образцы (БАЛ, материал, полученный при бронхоскопии, защищенной браш-биопсии и др.) и плевральная жидкость. Культуральное исследование инвазивных респираторных образцов при ВП рекомендуется проводить пациентам с иммунодефицитом. Данный метод может использоваться в отдельных случаях при тяжелой ВП, а также неэффективности стартовой антибактериальной терапии (АБТ).
При расшифровке вспышек ВП должен быть использован комплекс методов лабораторной диагностики.
Биологический материал (выделенные культуры пневмококка) от больных с тяжелым или атипичным течением из эпидемических очагов пневмококковой инфекции следует направлять в региональный научно-методический центр по мониторингу или соответствующие референс-центры согласно действующим нормативным документам. Целью исследований в этом случае будет углубленное изучение биологических свойств изолятов S. pneumoniae, их эпидемиологическое типирование (маркирование) и оценка устойчивости к противомикробным средствам (антибиотикам, бактериофагам, дезинфицирующим средствам и пр.).
7. Библиографический указатель
1. Акимкин В.Г. и др. Организационно-эпидемиологические аспекты профилактики внебольничной пневмонии в воинских коллективах/ В. Г. Акимкин, А. Б. Белевитин, В. Д. Мосягин и др.// Военно-медицинский журнал. 2009. № 9. С. 56 - 63.
2. Баранов А.А. и др. Стрептококки и пневмококки: Руководство для врачей/ А.А. Баранов, Н.И. Брико, Л.С. Намазова-Баранова, Л.А. Ряпис. Ростов-на-Дону: Феникс, 2013. 302 с.
3. Баранов А.А. и др. Пневмококковая инфекция и связанные с ней заболевания - серьезная проблема современного здравоохранения/ А.А. Баранов, Л.С. Намазова, В.К. Таточенко// Ж. Педиатрическая фармакология. 2008. Т. 5. № 1. С. 28 - 33.
4. Брико Н.И. Бремя пневмококковых инфекций и направления совершенствования эпидемиологического надзора в России// Эпидемиология и инфекционные болезни. Актуальные вопросы. 2013. № 6. С. 4 - 9.
5. ГОСТ Р 52905-2007 (ИСО 15190:2002) «Национальный стандарт Российской федерации. Лаборатории медицинские. Требования безопасности. Medical laboratories. Requirements for safety (утв. 01.07.2009).
6. Инструкция к набору реагентов Binax NOW «Streptococcus pneumoniae test». http://www.biograd.ru/sites/default/files/BmaxNOW%20S.pneumoniae.pdf/ (дата обращения: 07.10.2015).
7. Клинические рекомендации «Определение чувствительности микроорганизмов к антимикробным препаратам» (утв. ноябрь 2014 г.).
8. Козлов Р. С. Пневмококки: прошлое, настоящее и будущее. Смоленск: Смоленская государственная медицинская академия, 2005. 128 с.
9. Козлов Р. С. с соавт. Антибиотикорезистентность Streptococcus pneumoniae в России в 1999 - 2005 гг.: Результаты многоцентровых проспективных исследований ПеГАС-I и ПеГАС-II// КМАХ. 2006. Т. 8. № 1. С. 33 - 47.
10. Козлов Р. С. и др. Выделение, идентификация и определение чувствительности к антибиотикам Streptococcus pneumoniae/ Р.С. Козлов, О.У. Стецюк, Т.М. Богданович [и др.]// Клиническая микробиология и антимикробная химиотерапия. 2000. № 1. С. 88 - 98.
11. Ломинадзе Г.Г. и др. Использование метода MALDI-TOF масс-спектрометрии для ускорения идентификации микроорганизмов в гемокультурах пациентов с подозрением на сепсис/ Г.Г. Ломинадзе, Е.А. Семенова, О.В. Мотузова [и др.]// Лабораторная диагностика. «ЛАБОРАТОРИЯ ЛПУ». 2014. № 4. С. 17 - 20.
12. Малеев В.В. и др. Внебольничные пневмонии: классификация, патогенез, этиология, эпидемиология, лабораторная диагностика на современном этапе/ В. В. Малеев, Е.Б. Ежлова, Ю.В. Демина [и др.]. М: ЦНИИЭ, 2013. 65 с.
13. Маянский Н.А. и др. Определение капсульных серотипов пневмококка методом мультиплексной ПЦР/Н.А. Маянский, Н.М. Алябьева, Л.К. Катосова [и др.]// Вопросы диагностики в педиатрии. 2010. № 6, С. 6 - 10.
14. МУ 3.1.2.3047-13 «Эпидемиологический надзор за внебольничными пневмониями» (утв. 10.01.2013).
15. МУК 4.2.3115-13 «Лабораторная диагностика внебольничных пневмоний» (утв. 21.10.2013).
16. Миронов К.О. и др. Идентификация и серотипирование российских штаммов Streptococcus pneumoniae с применением методик, основанных на ПЦР/ К.О. Миронов, А.Е. Платонов, Р.С. Козлов// Клиническая микробиология и антимикробная химиотерапия. 2011. Т. 13. № 4. С. 304 - 313.
17. Миронов К.О. и др. Методика ПЦР в режиме реального времени для определения серотипов Streptococcus pneumoniae/ К.О. Миронов, А.Е. Платонов, Е.А. Дунаева [и др.]// Журн. микробиол. 2014. № 1. С. 41 - 48.
18. Николенко В.В. и др. Опыт использования иммунохроматографического теста для диагностики пневмококковой пневмонии/ В. В. Николенко, И.В. Фельдблюм, Н.Н. Воробьева [и др.]// ЖМЭИ. 2015. № 3. С. 18 - 24.
19. Практические рекомендации «Выделение, идентификация и определение чувствительности к антибиотикам Streptococcus neumoniae»/ Под ред. Страчунского Л. С.// Клиническая микробиология и антимикробная химиотерапия. 2000. Т. 2. № 1. С. 88 - 98.
20. МУК 4.2.3115-13 «Лабораторная диагностика внебольничных пневмоний» Приложение «Правила получения биологического материала» (утв. 21.10.2013).
21. Рачина С.А. и др. Структура бактериальных возбудителей внебольничной пневмонии в многопрофильных стационарах Смоленска/ С.А. Рачина, Р.С. Козлов, Е.П. Шаль [и др.]// Пульмонология. 2011. № 1. С. 5 - 18.
22. СП 1.3.2322-08 «Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней» (утв. 28.01.2008, с изменениями от 2.06.2009).
23. СП 3.1.2.3116-13 «Профилактика внебольничных пневмоний» (утв. 18.11.2013).
24. СанПиН 2.1.7.2790-10 «Санитарно-эпидемиологические требования к обращению с медицинскими отходами» (утв. 09.12.2010).
25. СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности» (утв. 28.08.1995).
26. Середкина М.А. и др. Микробиологическое исследование аутопсийного материала и интерпретация его результатов/ М.А. Середкина, О.И. Кречикова, М.В. Сухорукова [и др.] И Клиническая микробиология и антимикробная химиотерапия. 2000. Т. 2. № 2. С. 79 - 85.
27. Сидоренко С.В. и др. Пневмококковая инфекция и современные возможности ее профилактики - эпидемиологический обзор ситуации в мире и в России/ С.В. Сидоренко, Ю.В. Лобзин, С.М. Харит [и др.]// Вопросы современной терапии. 2010. № 1 (9). С. 54 - 61.
28. Федеральный закон от 27.11.2011 № 99-ФЗ «О лицензировании отдельных видов деятельности».
29. Фельдблюм И.В. и др. Эпидемиологические проявления заболеваемости и смертности от пневмоний среди населения г. Перми/ И.В. Фельдблюм, С.О. Голоднова, В.В. Семериков// Медицинский алфавит. 2015. № 17 (258). С. 13 - 17.
30. Фельдблюм И.В. и др. Уровень и внутригодовая динамика носительства S. pneumonia среди различных групп взрослого населения/ И.В. Фельдблюм, С.О. Голоднова, В. В. Семериков// Эпидемиология и инфекционные болезни. Актуальные вопросы. 2015. № 5. С. 13 - 16.
31. Чучалин А.Г. и др. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению, профилактике/ А.Г. Чучалин, А.И. Синкопальников, Р.С. Козлов [и др.]// Клин. Микробиол. антибиот. химиотер. 2010. № 3 (12). С. 186 - 225.
32. Abdeldaim G. М. et al. Toward a quantitative DNA-based definition of pneumococcal pneumonia: a comparison of Streptococcus pneumoniae target genes, with special reference to the Spn9802 fragment/ G.M. Abdeldaim, K. Stralin, P. Olcen [et al.]// Diagn. Microbiol. Infect. Dis. 2008. Vol. 60. P. 143 - 150.
33. Bentley S.D. et al. Genetic Analysis of the Capsular Biosynthetic Locus from All 90 Pneumococcal Serotypes/ S.D. Bentley, D.M. Aanensen, A. Mavroidi [et al.]// PLoS Genet. 2006. Vol. 2. № 3. e31.
34. Carvalho M.G. et al. Revisiting pneumococcal carriage by use of broth enrichment and PCR techniques for enhanced detection of carriage and serotypes/ M.G. Carvalho, F.C. Pimenta, D. Jackson [et al.]// J. Clin. Microbiol. 2010. Vol. 48. № 5. P. 1611 - 1618.
35. Catterall J.R. Streptococcus pneumonia/ J.R. Catterall// Thorax. 1999. Vol. 54. P. 929 - 937.
36. Dominguez J. et al. Detection of Streptococcus pneumonia antigen by a rapid immunochromatographic assay in utinesamples/ J. Dominguez, N. Gali, S. Blanco [et al.]// Chest. 2001. Vol. 119. P. 243 - 249.
37. European on Antimicrobial Susceptibility Testing - EUCAST. http://www.eucast.org/ (дата обращения: 07.10.2015).
38. Fine M. J. et al. Prognosis and outcomes of patients with community-acquired pneumonia. A meta-analysis/ M.J. Fine, M.A. Smith, C.A. Carson [et al.]//JAMA. 1996. Vol. 275(2). P. 134 - 141.
39. Gutierrez F. et al. Evaluation of the immunochromatographic Binax NOW assay for detection of Streptococcus pneumoniae urinary antigen in a prospective study of community-acquired pneumonia in Spain/ F. Gutierrez, M. Masia, J.C. Rodriguez [et al.]// Clin. Infect. Dis. 2003. Vol. 36(3). P. 286 - 292.
40. Kawamura Y. et al. Determination of 16S rRNA sequences of Streptococcus mitis and Streptococcus gordonii and phylogenetic relationships among members of the genus Streptococcus/ Y. Kawamura, X.-G. Hou, F. Sultana [et al.]// Int. J. Syst. Bacteriol. 1995. Vol. 45. P. 406 - 408.
41. Mandell L.A. et al. Canadian guidelines for the initial management of community-acquired pneumonia: an evidence-based update by the Canadian Infectious Diseases Society and the Canadian Thoracic Society. The Canadian Community-Acquired Pneumonia Working Group/ L.A. Mandell, T.J. Marrie, R.F. Grossman [et al.]// Clin Infect Dis. 2000, Vol. 31(2). P. 383 - 421.
42. Mavroidi A. et al. Genetic Relatedness of the Streptococcus pneumoniae Capsular Biosynthetic Loci/ A. Mavroidi, D.M. Aanensen, D. Godoy [et al.]// J. Bacteriol. 2007. Vol. 189. № 21. P. 7841 - 7855.
43. Pai R. et al. Sequential multiplex PCR approach for determining capsular serotypes of Streptococcus pneumoniae isolates/ R. Pai, R.E. Gertz, B. Beall// J. Clin. Microbiol. 2006. Vol. 44. № 1. P. 124 - 131.
44. Park H. K. et al. Identification of the cpsA gene as a specific marker for the discrimination of Streptococcus pneumoniae from viridans group streptococci/ H.K. Park, S.-J. Lee, J.W. Yoon [et al.]// J. of Med. Microbiol. 2010. Vol. 59. P. 1146 - 1152.
45. PCR Deduction of Pneumococcal Serotypes, http://www.cdc.gov/streplab/pcr.html/ (дата обращения: 07.10.2015).
46. Rudan I. et al. Epidemiology and etiology of childhood pneumonia /I. Rudan, C. Boschi-Pinto, Z. Biloglav [et al.]// Bull World Health Organ. 2008. Vol. 86(5). P. 408 - 416.
47. Simoes A.S. et al. Rapid identification of noncapsulated Streptococcus pneumoniae in nasopharyngeal samples allowing detection of co-colonization and reevaluation of prevalence/ A.S. Simoes, C. Valente, de Lencastre H., R. Sa-Leao// Diagn. Microbiol. Infect. Dis. 2011. Vol. 71. P. 208 - 216.
48. Sinclair A. et al. Systematicreview and metaanalysis of a urinebased pneumococcal antigen test for diagnosis of communityacquired pneumonia caused by Streptococcus pneumoniae/ A. Sinclair, X. Xie, M. Teltscher, N. Dendukuri// J. Clin. Microbiol. 2013. Vol. 51 (7). P. 2303 - 2310.
49. Smith M. D. et al. Rapid diagnosis of bacteremic pneumococcal infections in adults by using the Binax NOW Streptococcus pneumoniae urinary antigen test: a prospective, controlled clinical evaluation/ M. D. Smith, P. Derrington, R. Evans [et al.]// J. Clin. Microbiol. 2003. Vol. 41 (7). P. 2810 - 2813.
50. Stralin K. et al. Comparison of sputum and nasopharyngeal aspirate samples and of the PCR gene targets lytA and Spn9802 for quantitative PCR for rapid detection of pneumococcal pneumonia/ K. Stralin, B. Herrmann, G. Abdeldaim [et al.]// J. Clin. Microbiol. 2014. Vol. 52. P. 83 - 89.
51. Tatochenko V. et. al. Streptococcus pneumonia serotype distribution children in the Russian Federation before the introduction of pneumococcal conjugate vaccines into the national immunization program/ V. Tatochenko, S. Sidorenko, L. Namazova-Baranova [et al.]// Expert review of vaccine. 2014. Vol. 2 (13). P. 257 - 264.
52. Weichselbaum A. Current blood culture methods and systems: clinical concepts, technology, and interpretation of results/ Weichselbaum A.// Clin. Infect. Dis. 1996. Vol. 23. P. 40 - 46.
53. Whatmore A.M. et. al. Genetic relationships between clinical isolates of Streptococcus pneumoniae, Streptococcus oralis, and Streptococcus mitis: characterization of «atypical» pneumococci and organisms allied to S. mitis harboring S. pneumoniae virulence factor-encoding genes/ A. M. Whatmore, A. Efstratiou, A. P. Pickerill [et al.]// Infect. Immun. 2000. Vol. 68. P. 1374 - 1382.
Приложение 1
Основные дифференцирующие тесты Streptococcus pneumoniae
Постановка каталазного теста
Реагенты:
- ID Color Catalase - набор для определения каталазной активности микроорганизмов (каталожный номер - 55561. Набор на 100 определений).
- Возможно использование 3 %-го раствора перекиси водорода.
Метод:
1. Нанести 1 каплю реактива ID Color Catalase (3 %-го раствора перекиси водорода) на предметное стекло.
2. Тщательно суспендировать несколько изолированных колоний суточной культуры испытуемого микроорганизма в реактиве, используя пастеровскую пипетку, деревянную палочку или платиновую бактериологическую петлю.
3. Немедленно приступить к учету результатов.
Интерпретация:
- Положительный результат теста: появление пузырьков кислорода в течение 5 с.
- Отрицательный результат теста: отсутствие пузырьков кислорода.
Возможные причины получения ошибочных результатов:
- Ложноотрицательные результаты: при использовании культуры
микроорганизмов старше 24 ч.
- Ложноположительные результаты: при внесении частиц питательной среды, обогащенной кровью (каталаза содержится в эритроцитах).
Контроль качества:
- Положительный результат теста с Staphylococcus aureus АТСС 25923.
- Отрицательный результат теста с Streptococcus pneumoniae АТСС 49619.
Постановка оксидазного теста
Реагенты:
- ОКСИ-тест - набор для определения оксидазной активности микроорганизмов (каталожный номер - 10003324. Набор на 50 определений).
Метод:
1. Достать из тубуса ОКСИ-теста пинцетом тест-полоску на предметное стекло (в чашку Петри)
2. Нанести и втереть в зону индикации полоски несколько изолированных колоний суточной культуры испытуемого микроорганизма, используя пастеровскую пипетку, деревянную палочку или платиновую бактериологическую петлю*.
________
* Перед нанесением штамма можно предварительно в зону индикации полоски добавить 10 мкл реактива для теста ОКСИДАЗА (кат. № 10003375).
3. Через 0,5 - 1,0 мин приступить к учету результатов.
Интерпретация:
- Положительный результат теста: появление синего окрашивания тест-полоски в месте нанесения бактериальной культуры.
- Отрицательный результат теста: отсутствие синего окрашивания.
Возможные причины получения ошибочных результатов:
- Ложноотрицательные результаты: при использовании культуры микроорганизмов старше 24 ч, недостаточное количество нанесенного материала.
- Ложноположительные результаты: низкое качество препарата.
Контроль качества:
- Положительный результат теста с Pseudomonas aeruginosa АТСС 27853.
- Отрицательный результат теста с Streptococcus pneumoniae АТСС 49619.
Постановка оптохинового теста
Реагенты:
- Диски с оптохином:
• каталожный номер - 55912. Набор - 2 флакона по 30 дисков (5 μg в диске);
• каталожный номер - 1166851. Набор 50 дисков в тубе (5 μg в диске);
• флакон 100 дисков (6 мкг в диске).
Метод:
1. Обильно засеять поверхность кровяного агара в чашке, используя либо чистую культуру испытуемого микроорганизма, либо патологический исследуемый материал (если одновременно проводится выделение чистой культуры возбудителя).
2. Наложить оптохиновый диск на поверхность засеянного агара.
3. Инкубировать при температуре 37 °С в атмосфере СO2, используя GENbox СO2 генератор (каталожный номер - 96126) в течение 18 - 24 ч.
4. Определить наличие зоны вокруг диска с оптохином.
5. Измерить диаметр зоны задержки роста, включая диаметр диска с оптохином.
Интерпретация:
- Положительный результат теста: наличие зоны задержки роста > 15 мм (для дисков с концентрацией 5 μg) и ≥ 14 мм (для дисков 6 мкг) в диаметре.
- Отрицательный результат теста: рост вокруг диска, как и без него.
Возможные причины получения ошибочных результатов:
- Ложноотрицательные результаты: 5 % пневмококков резистентны к оптохину.
- Ложноположительные результаты: отдельные штаммы стрептококков группы viridans чувствительны к оптохину.
Контроль качества:
- Положительный результат теста с Streptococcus pneumoniae АТСС 49619.
- Отрицательный результат теста с Enterococcus faecalis АТСС 29212.
Постановка теста с желчью
Реагенты:
- Диски с желчью (Набор - 1 флакон по 100 дисков).
Метод:
1. Обильно засеять поверхность кровяного агара в чашке, используя либо чистую культуру испытуемого микроорганизма, либо патологический исследуемый материал (если одновременно проводится выделение чистой культуры возбудителя).
2. Наложить диск с желчью на поверхность засеянного испытуемой культурой агара.
3. На поверхность диска нанести несколько капель стерильной дистиллированной воды (до полного пропитывания диска).
4. Инкубировать при температуре 37 °С в атмосфере СO2, используя GENbox СO2 генератор (каталожный номер - 96126) в течение 18 - 24 ч.
5. Определить наличие зоны вокруг диска с желчью.
Интерпретация:
- Положительный результат теста: наличие зоны задержки роста.
- Отрицательный результат теста: рост культуры вокруг диска, как и без него.
Возможные причины получения ошибочных результатов:
- Ложноотрицательные результаты: низкое качество реактива.
- Ложноположительные результаты: отдельные штаммы стрептококков группы viridans лизируются желчью.
Контроль качества:
- Положительный результат теста с Streptococcus pneumoniae АТСС 49619.
- Отрицательный результат теста с Enterococcus faecalis АТСС 29212.
Постановка теста с гиппуратом натрия
Реагенты:
- ГИППУРАТ-тест - набор для определения способности бактериальных штаммов гидролизовать гиппурат натрия (каталожный номер - 10003321. Набор на 50 определений).
Метод:
1. Гомогенизировать в 0,5 мл физиологического раствора чистую 24 ч культуру микроорганизмов и довести до стандарта 2-й степени по McFarland.
2. Погрузить 1 полоску теста в суспензию до полного погружения рабочей зоны.
3. Инкубировать при 37 °С в течение 22 - 24 ч.
4. После инкубации осторожно по стенке пробирки добавить 4 капли реактива для HIP (каталожный номер 10003368).
5. Оставить на 5 - 10 мин при комнатной температуре (15 - 25 °С).
6. Определить наличие синего (синефиолетового) кольца.
Интерпретация:
- Положительный результат теста: появление синего (сине-фиолетового) кольца.
- Отрицательный результат теста: отсутствие окрашивания (светло-синее окрашивание).
Возможные причины получения ошибочных результатов:
- Ложноотрицательные результаты: при использовании культуры микроорганизмов старше 24 ч.
- Ложноположительные результаты: превышение сроков инкубации при комнатной температуре (более 5 - 10 мин).
Контроль качества:
- Положительный результат теста с Streptococcus agalactiae CСM 6187.
- Отрицательный результат теста с Streptococcus pneumoniae АТСС 49619.
Постановка ПИРА-теста
Реагенты:
- ПИРА-тест - набор для определения пирролидамилариламидазы микроорганизмов (каталожный номер - 10003344. Набор на 50 определений).
Метод:
1. Достать из тубуса ПИРА-теста пинцетом тест-полоску на предметное стекло (в чашку Петри).
2. В зону индикации полоски нанести 20 мкл стерильной дистиллированной воды.
3. В зону индикации нанести несколько изолированных колоний суточной культуры испытуемого микроорганизма, используя пастеровскую пипетку, деревянную палочку или платиновую бактериологическую петлю.
4. Полоску инкубировать 10 мин при комнатной температуре.
5. Добавить в зону индикации 1 каплю реактива для ПИРА-теста (каталожный номер 10003379), пользуясь дозатором или капельницей во флаконе.
6. Через 1 - 2 мин приступить к учету результатов.
Интерпретация:
- Положительный результат теста: появление красного окрашивания тест-полоски в месте нанесения бактериальной культуры.
- Отрицательный результат теста: желтое (бесцветное) окрашивание.
Возможные причины получения ошибочных результатов:
- Ложноотрицательные результаты: при использовании культуры
микроорганизмов старше 24 ч, недостаточное количество нанесенного материала.
- Ложноположительные результаты: низкое качество реактива.
Контроль качества:
- Положительный результат теста с Enterococcus faecalis АТСС 29212.
- Отрицательный результат теста с Streptococcus pneumoniae АТСС 49619.
Постановка температурного теста
Метод:
1. Засеять чистую культуру испытуемого микроорганизма в глубину пробирки, разлитой высоким столбиком (6 - 7 мм) с питательной средой для контроля стерильности (СКС).
2. Инкубировать в течение 18 - 24 часов при температуре 45 °С в стандартном режиме.
3. Определить наличие роста в глубине СКС или на поверхности КА.
Интерпретация:
- Положительный результат теста: наличие роста.
- Отрицательный результат теста: отсутствие роста.
Возможные причины получения ошибочных результатов:
- Ложноотрицательные результаты: нарушен температурный режим инкубации.
- Ложноположительные результаты: нарушен температурный режим инкубации.
Контроль качества:
- Положительный результат теста с Enterococcus faecalis АТСС 29212.
- Отрицательный результат теста с Streptococcus pneumoniae АТСС 49619.
Приложение 2
Алгоритм лабораторной диагностики внебольничной
пневмонии
пневмококковой этологии