4.2.
МЕТОДЫ КОНТРОЛЯ.
БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Контроль дезинфекционных камер
Методические
указания
МУК 4.2.1035-01
1. Методические указания разработаны: Московским городским центром дезинфекции (МГЦД) Минздрава Российской Федерации (Г.И. Останин - главный врач; Р.Р. Ибадулин, С.Л. Коваленко - исполнители). Испытательным лабораторным центром МГЦД (профессор М.И. Леви - руководитель; М.И. Леви, Р.С. Зотова - исполнители). Научный руководитель разработки профессор М.И. Леви. Учреждения-соисполнители: Московский городской центр дезинфекции.
2. Утверждены Главным государственным санитарным врачом Российской Федерации - Первым заместителем Министра здравоохранения Российской Федерации 23.05.01.
3. Введены взамен «Методических указаний по контролю дезинфекционных камер», 1995.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Главный государственный санитарный врач Российской Федерации - Первый заместитель Министра здравоохранения Российской Федерации Г.Г. Онищенко 23 мая 2001 г. МУК 4.2.1035-01 Дата введения - 1 октября 2001 г. |
4.2.
МЕТОДЫ КОНТРОЛЯ.
БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Контроль дезинфекционных камер
Методические указания
1. Общие положения и область применения
1.1. Настоящие МУК составлены на основе «Методических указаний по контролю дезинфекционных камер», утвержденных в 1995 г.
1.2. Методические указания предназначены для специалистов, осуществляющих контроль за работой дезинфекционных камер.
1.3. В целях обеспечения надежного обеззараживания вещей, дезинфекционные камеры, находящиеся в организациях Министерства здравоохранения Российской Федерации или других ведомствах, подвергаются техническому, термическому и бактериологическому контролю.
Контроль дезинфекционных камер осуществляется в плановом порядке организациями дезинфекционного профиля, имеющими соответствующую лицензию, не реже одного раза в квартал.
2. Технический контроль
2.1. Технический контроль дезинфекционных камер имеет своей целью установить исправность как камеры, так и ее оборудования (манометр, термометр, вентили), а также паропроводов и воздуховодов.
2.2. Цельность дезинфекционной камеры и ее оборудования можно определить визуальным методом. Кроме того, для проверки работы вентилей, герметичности камеры или ее частей, проходимости паропроводов применяют методы пробного пуска пара и пробного обогрева.
Если после закрытия вентиля отрезок трубы, расположенный за ним, продолжает нагреваться, то это свидетельствует о дефекте вентиля (пропускает пар). Такие вентили подлежат ремонту или замене.
2.3. Точность показаний термометра проверяется следующим образом: испытуемый термометр вместе с контрольным (выверенным) погружают в воду, нагретую соответственно до 60 - 80 - 90 °С, сравнивая при этом показания термометров. Разность показаний проверяемого и контрольного термометров не должна превышать ±1 °С.
2.4. Для проверки работы манометров к фланцу трехходового крана присоединяют проверяемый манометр, параллельно присоединяют контрольный манометр и по разнице показаний проверяемого и контрольного делают вывод о его исправности.
Неисправный манометр заменяют новым, проверенным и опломбированным.
2.5. Правильность работы форсунки, предназначенной для продуцирования мелкодисперсных растворов формалина, определяется одним из двух методов:
2.5.1. Первый, более объективный метод, заключается в следующем: в бачок форсунки наливают 200 - 300 мл слабоподкрашенной воды (добавляют чернил, фуксина, синьки), на противоположной форсунке стене укрепляют экран (лист белой бумаги или картона) и производят распыление жидкости. Затем осматривают экран. При наличии равномерного распределения и преобладания мелких пятен - делается заключение об удовлетворительной работе форсунки.
При неравномерном распределении пятен и преобладании крупных пятен, мазков, потеков - делается заключение о неудовлетворительной работе форсунки. Последняя подлежит ремонту, после чего следует произвести повторное испытание форсунки.
2.5.2. Во втором случае снимают одинарный зонт камеры и, если он имеет выдвижную полосу, то ее выдвигают. Это дает возможность хорошо видеть сопло форсунки, производящей распыление формалина. Если зонт состоит из трех частей, то для указанных целей отодвигают в сторону среднюю часть зонта. Затем пускают в форсунку пар и при открытой двери камеры наблюдают за работой форсунки, бачок которой предварительно наполняют водой. Если при распылении форсункой жидкости преобладают мелкие капли, то работа форсунки считается удовлетворительной.
При преобладании крупных капель, которые по выходе из сопла форсунки тут же падают на пол камеры, форсунку считают непригодной к дальнейшей эксплуатации и она должна быть отрегулирована.
2.6. Проверка аппарата Беньяминсона-Крупина («Б-К») производится путем пробного пуска пара. Для этого в бачок аппарата наливают формалин, в котором концентрация формальдегида предварительно определена лабораторным путем. Затем в бачок пускают пар, который экстрагирует формальдегид из кипящего раствора формалина. Эффективность извлечения формальдегида из формалина следует проверять каждые пять минут с момента пуска пара в аппарат путем отбора проб формалина в количестве 10 мл через спускной кран аппарата.
Таких проб следует взять четыре: первую - через 5 мин, вторую - через 10 мин, третью - через 15 мин, четвертую - через 20 мин.
Пробы направляют в лабораторию для определения содержания формальдегида в них, и на основе данных анализов составляется динамика экстрагирования формальдегида из формалина.
Как правило, в 3-ей пробе (через 15 мин) формальдегид отсутствует. Крайне редко он обнаруживается в 4-ой пробе (через 20 мин).
Такие результаты дают основание для заключения о вполне удовлетворительной работе аппарата. Если же в 4-ой пробе раствора формалина окажется некоторое количество формальдегида, то испытание следует повторить. Если же и при повторной проверке будет обнаружен формальдегид, то следует взять через 5 мин после 4-ой пробы - пятую. Если в ней не будет обнаружен формальдегид, то работу аппарата «Б-К» следует признать удовлетворительной, отметив, что полное извлечение формальдегида из раствора формалина в аппарате заканчивается только к 25-ти минутам.
При обнаружении же формальдегида в пробе после 25-минутной экспозиции следует признать данный аппарат «Б-К» не пригодным к дальнейшей эксплуатации и принять меры к устранению функциональных или конструктивных дефектов аппарата.
2.7. Герметичность дверей в паровой камере КС-3 проверяют при давлении пара в камере 0,5 атм.; в пароформалиновой - при температуре по угловому термометру 80 - 97 °С. При этих условиях пар не должен выходить через двери камеры.
3. Термический контроль
3.1. Степень нагрева в термических дезинфекционных камерах определяется объективным методом - термометрией при помощи термометров. Градуированная часть наружного термометра расположена снаружи камеры, конец его с ртутным шариком введен внутрь камеры.
Наружные термометры выпускаются двух видов: прямые и угловые.
Весь процесс дезинфекции в камере контролируется с помощью психрометра.
3.2. Динамику температуры в камере регистрируют по следующим этапам:
• температура до начала обогрева камеры;
• подогрев камеры до температуры, с которой начинается отсчет экспозиции;
• поддержание определенной температуры в течение экспозиции.
Все перечисленные показания температуры регистрируют в протоколе работы камеры.
3.3. Показания наружных термометров камеры свидетельствуют лишь о температуре воздуха и пара в камере, но не о температуре, которая в этот период времени была в обеззараживаемых вещах, находящихся в камере. Для определения температуры в обеззараживаемых вещах, обеспечивающей бактерицидный (инсектицидный) эффект, используются максимальные термометры.
Эффективность обеззараживания в дезинфекционных камерах зависит не только от требуемой температуры в камере, но и от равномерного распределения ее в вещах, загружаемых в камеру.
3.3.1. Равномерность распределения температуры в вещах в различных местах камеры определяют как по вертикали (на уровне воротника одежды и карманов), так и по горизонтали (в вещах передней части камеры - перед дверью в разгрузочное помещение камеры; в вещах, расположенных в средней части камеры, и в вещах, обращенных к загрузочной двери камеры). Определение равномерности распределения температуры внутри вещей производится при помощи 9 или 15-ти максимальных термометров в зависимости от объема камеры.
3.3.2. В загрузочной камере максимальные термометры должны размещаться в толще вещей (под воротниками, в карманах или складках одежды). Для этого термометры укладывают в специальные мешочки-кисеты совместно с тест-объектами и размещают в 9-ти точках по схеме, подобной расположению печатей на конверте, на двух уровнях: в верхней и средней частях камеры.

Объем дезинфекционной камеры > 2 м3
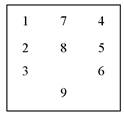
Объем дезинфекционной камеры 2 м3
Такое размещение термометров позволяет получить сведения о температурном режиме в различных частях камеры. При проведении температурного контроля дезкамер принято добавлять еще один термометр, который помещается в камере на уровне углового термометра и служит для проверки показаний последнего.
3.4. При равномерном распределении температуры в вещах, находящихся в камере, разница в показаниях термометров (перепады) допускается в следующих пределах:
• 3 °С - при паровом способе дезинфекции;
• 5 - 7 °С - при паровоздушном способе дезинфекции;
• 2 - 5 °С - при пароформалиновом способе дезинфекции.
При этом должно быть учтено, что низшая граница перепада температур должна соответствовать нижней границе проверяемого режима дезинфекции по показаниям наружного термометра:
• 100 - 104 °С - при паровом способе дезинфекции;
• 80 - 97 °С - при паровоздушном способе дезинфекции;
• 49 - 57 °С - при пароформалиновом способе дезинфекции.
3.5. Причиной несоответствия указанных параметров температуры может быть неправильная загрузка камеры (превышение установленных норм загрузки или переуплотнение в отдельных местах камеры). При исключении этой причины необходимо тщательно обследовать техническое состояние камеры.
3.6. Максимальные термометры подлежат систематической проверке, которую производят тем же способом, что и наружные термометры камер (п. 2.3).
4. Аппаратура, материалы, лабораторная посуда и реактивы
4.1. Средства измерения
|
Весы лабораторные общего назначения 2-го класса точности |
ГОСТ 24104-80Е |
|
Ионометр универсальный ЭВ-74 или потенциометр pH-340 |
|
|
Колбы исполнения 2, 2-го класса точности, номинальной вместимостью 50, 100, 200, 500, 1000 (см3) |
|
|
Микроскоп биологический МБИ-1, МБИ-2 |
ГОСТ 8284-78 |
|
Пипетки исполнения 5, 1, 2-го класса точности |
|
|
Термометр (ртутный) с диапазоном измерения от 0 до 100° |
4.2. Вспомогательное оборудование
|
Облучатель бактерицидный настенный ОБМ-150 или других марок |
ТУ 16-535-84 |
|
Пинцет медицинский |
ГОСТ 212011-89 |
|
Термостат, позволяющий поддерживать температуру (15 - 65) °С с отклонением от заданной 1 °С |
ТУ 64-1-1382-72 |
|
Холодильник бытовой электрический |
|
|
Шкаф сушильный стерилизационный ШСС-80П или других марок, позволяющий поддерживать температуру (160 ± 5) °С |
ТУ 64-1-9009-74 |
|
Штативы пластмассовые или металлические |
|
|
Лента клеевая на бумажной основе |
|
|
Пакеты из полимерных и комбинированных материалов |
4.3. Лабораторная посуда и материалы
|
Бутылки стеклянные для химических реактивов |
|
|
Вата медицинская гигроскопическая |
|
|
Воронки стеклянные |
|
|
Кастрюли эмалированные |
|
|
Марля медицинская |
ГОСТ 9412-77 |
|
Петля бактериологическая |
|
|
Пробирки типов П1 диаметром 16 мм, высотой 150 мм |
|
|
Спиртовка лабораторная стеклянная |
|
|
Стекла предметные для микроскопов |
|
|
Чашки биологические (Петри) |
|
|
Пробирки для микропроб однократного применения (пробирки Эппендорфа) |
ТУ 64-2-300-80 |
|
Инсулиновые флаконы |
ТУ 64-2-10-87 |
4.4. Реактивы, питательные среды
|
Агар микробиологический |
ГОСТ 17206-84 |
|
Бромтимоловый синий |
ТУ 6-09-20-86-77 |
|
Вода дистиллированная |
|
|
Глюкоза, ч. |
|
|
Спирт этиловый ректификованный |
|
|
Натрий хлористый |
5. Бактериологический контроль
5.1. Эталонами бактериологического контроля надежности обеззараживания вещей в камере служат следующие культуры:
• при обработке вещей из очагов инфекций, вызванных неспорообразующими микробами - золотистый стафилококк (Staphylococcus aureus) штамм 906;
• при обработке вещей из очагов туберкулеза - непатогенная микобактерия (Mycobacterium) штамм В-5;
• при обработке вещей из очагов инфекций, вызванных споро-образующими микробами - культура Bacillus cereus штамм 96 в споровой форме (антракоид).
5.2. Тест-культуры должны обладать типичными свойствами и следующей устойчивостью:
• Staphylococcus aureus - к температуре 60 °С в течение 25 мин, к 2 %-ному раствору формалина в течение 20 мин;
• Mycobacterium штамм В-5 - к температуре 60 °С при 60 мин экспозиции, к 5 %-ному раствору формалина при экспозиции 25 мин;
• споры В. cereus штамм 96 - к действию текучего пара в течение 4 - 6 мин или кипячению в течение 25 мин.
53. Для поддержания устойчивости культуры следует хранить при температуре +4 °С. Стафилококк и В. cereus - на мясопептонном агаре (МПА) в столбике под слоем стерильного вазелинового масла; культуру В-5 - на картофельно-глицериновой среде или 2 %-ном глицериновом МПА. Можно хранить культуры в запаянных ампулах, лиофильно высушенные. Пересевать рабочие культуры стафилококка, В. cereus и В-5 следует не реже одного раза в 3 месяца.
6. Приготовление индикаторов биологических, применяемых для определения устойчивости культур и при контроле дезкамер
6.1. Испытание устойчивости культур к формалину и пару проводят на батистовых или бязевых тест-объектах. Для их приготовления кусок белого батиста или бязи погружают на 24 ч в холодную водопроводную воду, затем стирают с мылом, кипятят, сушат и гладят горячим утюгом (с целью удаления аплитуры). В приготовленном куске ткани с помощью иглы выдергивают нитки в продольном направлении на расстоянии 11 мм друг от друга, а в поперечном - на расстоянии 6 мм. По этим линиям ткань разрезают ножницами на тест-объекты и по 50 штук раскладывают в чашки Петри. Последние заворачивают в бумагу и стерилизуют в автоклаве 30 мин при температуре 120 °С (1 атм.).
6.2. Индикаторами биологического контроля эффективности дезинфекции вещей в камерах служат инсулиновые флаконы с сухими культурами бактерий (индикатор биологический БИК-ИЛЦ).
6.3. Культуры бактерий готовят следующим образом:
6.3.1. Суточную бульонную культуру стафилококка засевают на скошенную поверхность питательного агара для выращивания микроорганизмов и инкубируют в термостате при температуре (37 ± 1) °С в течение 18 - 24 ч. Выращенную культуру смывают с помощью стерильных бус сахарозо-желатиновой средой и разводят этой же средой до концентрации 2 - 1010 м. к. в 1 мл. Затем автоматической пипеткой по 0,02 мл взвеси культуры наносят непосредственно на нижнюю внутреннюю поверхность инсулинового флакона или пробирки Эппендорфа. Инсулиновые флаконы закрывают ватно-марлевой пробкой. Флаконы и пробирки Эппендорфа помещают в термостат при 37 °С на сутки для подсушивания. Индикаторы биологические БИК-ИЛЦ хранят в бытовом холодильнике. Срок годности - 1 год.
6.3.2. Культуру микобактерий штамма В-5 выращивают на картофельно-глицериновой среде или 2 %-ном глицериновом питательном агаре при температуре (37 ± 1) °С в течение 4-х суток. Затем добавляют сахарозо-желатиновую среду и с помощью стерильных бус смывают выросшую культуру с поверхности агара. Этой же средой доводят концентрацию культуры до 2 - 1010 м. к. в 1 мл. Автоматической пипеткой по 0,02 мл взвеси наносят на внутреннюю поверхность инсулинового флакона и закрывают ватно-марлевой пробкой. Ставят в термостат при 37 °С на сутки для подсушивания. Индикаторы биологические БИК-ИЛЦ хранят в холодильнике. Срок годности - 6 месяцев.
6.3.3. Культуру В. cereus для получения спор высевают на скошенный пшеничный агар и выращивают двое суток в термостате при 37 °С, а затем еще 5 - 7 дней при комнатной температуре в темном месте. Культуру проверяют перед смывом на спорообразование (окрашенные по Граму мазки просматривают под микроскопом). К дальнейшей работе пригодны культуры, содержащие не менее 80 - 90 % спор при просмотре 5 полей зрения. После этого выросшую культуру смывают с поверхности с помощью сахарозо-желатиновой среды и стерильных бус. В последующем доводят концентрацию спор до 2 - 1010 м. к. в 1 мл. Автоматической пипеткой по 0,02 мл взвеси наносят на внутреннюю поверхность инсулинового флакона или пробирки Эппендорфа. Инсулиновые флаконы закрывают ватно-марлевой пробкой. Флаконы и пробирки Эппендорфа помещают в термостат при 37 °С на сутки для подсушивания. Срок годности - 1 год.
7. Определение устойчивости культур к действию формалина
7.1. В день опыта готовят рабочие растворы формалина на стерильной дистиллированной воде. Концентрацию раствора берут в зависимости от вида культуры (устойчивость Staphylococcus aureus штамм 906 испытывают в 2 %-ном растворе, а устойчивость культуры Mycobacterium штамм В5 - в 5 %-ном растворе формалина). При постановке опытов в стеклянную колбу пипеткой наливают требуемый объем соответствующего раствора формалина (из расчета на каждый тест-объект по 3 мл). Легкими покачиваниями колбы достигают смачивания всех тест-объектов дезинфицирующим раствором и с этого момента начинают отсчет экспозиции. Через 10 - 20 - 30 мин (для культур Staphylococcus aureus штамм 906) и через 15 - 25 - 35 мин (для тестов, зараженных культурой Mycobacterium штамм В-5) стерильным пинцетом извлекают по 2 тест-объекта из раствора формалина и погружают для нейтрализации в пробирки с 10 мл 2 %-ного раствора аммиака (1 мл 25 %-ного нашатырного спирта + 9 мл стерильной дистиллированной воды). Через 5 минут тест-объекты переносят во вторую пробирку с 10 мл стерильного физраствора и также выдерживают 5 мин. Затем каждый тест-объект засевают в пробирки с 5 мл соответствующей жидкой питательной средой.
7.2. Контролем служат два тест-объекта, не подвергающиеся действию формалина, но погруженные в пробирку со стерильным физраствором на срок, равный действию формалина. Перед посевом контрольные тест-объекты промывают также как и опытные.
7.3. Посевы помещают в термостат при (37 ± 1) °С. Предварительные результаты учитывают через 24 - 48 ч (для тестов с Mycobacterium штамм В-5 - через 4 дня), окончательные - через 7 суток.
8. Определение термоустойчивости культур
8.1. Устойчивость культур к температуре проверяют в водяной бане (лучше с терморегулятором).
8.2. Суточные культуры Staphylococcus aureus штамм 906 и 4-суточные Mycobacterium штамм В-5, выращенные соответственно на МПА (pH = 7,2 - 7,4) и 2 %-ном глицериновом агаре, смывают физиологическим раствором (5 мл на чашку Петри), фильтруют через ватномарлевый фильтр и разводят до концентрации 2 млрд, микробных тел в 1 мл по оптическому стандарту. Полученные суспензии разливают по 1 мл в три стерильные пробирки (по одной пробирке на каждую экспозицию), которые помещают в водяную баню, предварительно нагретую до 60 °С. Для наблюдения за температурой в баню погружают опущенный в пробирку с водой термометр. Через 15 - 25 - 35 мин из пробирок со взвесью культуры Staphylococcus aureus штамм 906 и через 40 - 60 - 80 мин из пробирок со взвесью культуры Mycobacterium штамм В-5 стерильной пипеткой отбирают на каждую экспозицию 1 мл взвеси и засевают по 0,5 мл в две пробирки с 5 мл мясопептонного или 2 %-ного глицеринового бульона.
8.3. Посевы выдерживают в термостате при (37 ± 1) °С в течение 7 суток. Предварительный учет результатов проводят через 24 - 48 ч (для культуры Staphylococcus aureus штамм 906) и через 72 - 96 ч (для культуры Mycobacterium штамм В-5).
8.4. Для проверки термоустойчивости культур В. cereus три пробирки со споровой взвесью помещают в кипящую водяную баню на 15 - 25 - 35 мин. По истечении этого времени по 0,5 мл взвеси из соответствующей пробирки засевают в две пробирки с мясопептонным бульоном (МПБ) и посевы инкубируют 7 суток при температуре (37 ± 1) °С. Контролем служит посев непрогретой взвеси испытуемой культуры в мясопептонный или 2 %-ный глицериновый бульоны.
9. Определение устойчивости спор В. cereus к пару
9.1. Устойчивость спор В. cereus к пару проверяют в аппарате Ойль-Мюллера следующим образом:
В колбу наливают воду и нагревают ее до кипения. На предварительно обожженную сетку помещают два зараженных тест-объекта. Сетку вносят в зону действия текучего пара. Через 3 мин действия пара тесты извлекают и засевают в две пробирки с бульоном. На обожженную сетку вновь вносят два теста на экспозицию 4 мин и так повторяют, увеличивая экспозицию снова на 1 мин - до 9 мин. Засеянные тест-объекты помещают в термостат при температуре (37 ± 1) °С на 7 дней. Предварительный учет результатов проводят через 48 ч.
9.2. Аппарат Ойль-Мюллера может быть заменен колбой емкостью 0,75 - 1 л с широким удлиненным горлом. Корковая пробка колбы на 1/3 срезается по вертикали для выхода пара. Через пробку должна быть пропущена проволока, имеющая на конце металлическую сетку диаметром 3 - 3,5 см, на которую помещают тест-объекты.
9.3. Если после воздействия формалина, соответствующей температуры и пара наблюдается рост культур в мясопептонном или 2 %-ном глицериновом бульонах, необходимо произвести пересев на плотные питательные среды для того, чтобы убедиться в наличии роста исходной культуры.
9.4. Культуры, используемые для приготовления индикаторов биологических БИК-ИЛЦ, подвергаются контролю на термо- и формалино-устойчивость не реже 1 раза в 6 месяцев.
10. Проведение бактериологического контроля
10.1. Бактериологический контроль эффективности дезинфекции вещей в камерах проводится с помощью индикаторов биологических БИК-ИЛЦ, приготовленных по методике, указанной в п. 4.4.3, и упакованных в упаковочную ленту. Приготовленные таким образом носители нумеруют и помещают в мешочек размером 10×15 см, в котором имеется специальное отделение для максимального термометра. Мешочки размещают в контрольные точки (п. 3.3.2).
10.2. После проведения испытания индикаторов биологических БИК-ИЛЦ извлекают из мешочков, помещают в полиэтиленовый пакет и с соответствующим направлением доставляют в лабораторию для дальнейшего исследования.
10.3. В бактериологической лаборатории при соблюдении правил асептики проводят исследование. С этой целью индикаторы биологические БИК-ИЛЦ извлекают из упаковки и добавляют (в т.ч. ив контрольные) по 1 мл цветной питательной среды с индикатором бромтимоловым синим, а в пробирки Эппендорфа - по 0,5 мл этой же среды.
Посевы с индикаторами биологическими Staphylococcus aureus и В. cereus инкубируют в термостате при температуре (37 ± 1) °С в течение 2 суток.
Учет результатов проводят путем ежедневного визуального осмотра. При наличии роста культуры цвет среды в присутствии индикатора меняется с сине-зеленого на желтый. В этом случае делают высев на плотные питательные среды - мясопептонный или желточно-солевой агары - для сопоставления выделенной культуры с контрольной.
10.4. При обнаружении неудовлетворительных результатов бактериологическая лаборатория извещает об этом по телефону руководителя медицинского учреждения и направляет ему заключение о результатах бактериологического контроля.
В случае обнаружения роста хотя бы в одном из посевов индикатора биологического - проводят повторный контроль работы камеры. При этом более тщательно проверяют ее техническое состояние, норму загрузки вещей, правильность их размещения в камере.
Приложение 1
Приготовление питательных сред
1. Пшеничный агар
К 1 кг дробленного пшеничного зерна или пшеничной крупы (Артек, Полтавская) добавить 2 л дистиллированной воды. Через 18 - 24 ч настой осторожно слить (не отжимая зерна) и долить дистиллированной водой до 2-х л. Затем добавить 50 г агар-агара, нагреть до полного растворения и завернуть в толстый слой ваты для медленного охлаждения и лучшего выпадения осадка. На следующий день срезать осадок, растопить среду и установить pH = 7,4. После этого среду разливают по пробиркам и стерилизуют текучим паром три дня подряд по 40 - 60 мин. После стерилизации скашивают.
2. Мясопептонный бульон с индикатором бромтимоловым синим
К 1000 мл мясопептонного бульона добавить 5 г глюкозы до полного растворения последней, профильтровать раствор через ватно-марлевый фильтр и добавить 2,5 мл 1 %-ного спиртового раствора бромтимолового синего. Установить pH = 7,3 ± 0,1; разлить во флаконы и стерилизовать при 110 °С в течение 30 мин.
Цвет среды из сине-зеленого при проращивании спор меняется на желтый.
3. Глицериновый бульон (2 %)
К 1000 мл мясопептонного бульона pH = 7,2 ± 0,1 добавить 20 мл глицерина, стерилизовать в течение 3 мин при температуре 120 °С.
4. Глицериновый агар (2 %)
К 1000 мл мясопептонного бульона pH = 7,2 ± 0,1 добавить 20 г агар-агара и 20 мл глицерина. Стерилизовать 30 мин при температуре 120 °С.
5. Картофельно-глицериновая среда
Сырой картофель (из расчета 200 г очищенного картофеля на 1000 мл водопроводной воды) тщательно вымыть, очистить от кожуры и глазков, нарезать мелкими ломтиками, залить водопроводной водой и кипятить 30 мин после закипания (молодой картофель употреблять нельзя!). Отвар отстоять и профильтровать в холодном состоянии через ватно-марлевый фильтр. Довести объем фильтрата до 1000 мл и установить pH = 7,2 ± 0,1. Добавить 5 г пептона и 25 г агара. Нагреть, помешивая, до полного расплавления агара, профильтровать через ватно-марлевый фильтр, после чего добавить 1 г меда и 20 мл глицерина, разлить по флаконам и стерилизовать при 120 °С в течение 30 мин. После стерилизации среду во флаконах скашивают.
6. Сахарозо-желатиновая среда
К 100 мл дистиллированной воды добавить 1 г желатина и 5 г сахарозы. Дать постоять среде 2 ч при комнатной температуре. Затем стерилизуют в автоклаве при 120 °С в течение 30 мин.
Приложение 2
Направление для проведения биологического контроля работы дезинфекционных камер
|
Московский
городской Испытательный
лабораторный |
В
Центр санэпиднадзора ________________________________ |
|
№_______ |
|
|
___________ 200_ г. |
|
|
При этом прилагаются индикаторы биологические БИК-ИЛЦ в количестве ______________ за № № _____________________ для проведения контроля дезкамеры ____________________________________. «___» ______________ 200_ г. Зав. лабораторией ____________________ В испытательный лабораторный центр Возвращаются индикаторы биологические БИК-ИЛЦ за № № _____________________ для проведения контроля дезкамеры системы ___________________________________ принадлежащий ____________________________________________________________ находящийся по адресу: _____________________________________________________ проведенного «__» _____________ 200__ г. Индикаторы биологические БИК-ИЛЦ в лабораторию сдал ______________ (_______________) Заключение Индикаторы биологические БИК-ИЛЦ № № ____________ не дали роста тест-культуры. Индикаторы биологические БИК-ИЛЦ № № ______________ дали рост исходной культуры. «____» ____________200____ г. Зав. лабораторией ______________________
|
|