Государственное санитарно-эпидемиологическое
нормирование
Российской Федерации
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение
остаточных количеств касугамицина
в воде, почве, зеленой массе, соломе
и зерне риса методом
высокоэффективной жидкостной
хроматографии
Методические указания
МУК 4.1.3291-15
Москва 2015
1. Разработаны сотрудниками ФГБНУ «Всероссийского НИИ защиты растений» (И.А Цибульская, Т.Д. Черменская, А.С. Комарова, В.В. Человечкова).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 22 мая 2015 г. № 1).
3. Утверждены руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации A.Ю. Поповой 28 июля 2015 г.
4. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель
Федеральной службы _______________________ А.Ю. Попова 28 июля 2015 г. |
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение остаточных количеств
касугамицина в воде, почве, зеленой массе,
соломе и зерне риса методом высокоэффективной
жидкостной хроматографии
Методические указания
МУК 4.1.3291-15
Свидетельство
о метрологической аттестации
№ 01.5.04.194/01.00043/2015
Настоящие методические указания устанавливают порядок применения метода высокоэффективной жидкостной хроматографии для определения остаточных количеств касугамицина в диапазоне концентраций в воде 0,001 - 0,01 мг/дм3, в почве - 0,05 - 0,5 мг/кг, в зеленой массе и соломе - 1,0 - 10,0 мг/кг, в зерне риса 0,1 - 1,0 мг/кг.
Методические указания носят рекомендательный характер.
Касугамицин.
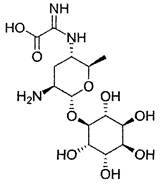
[5-амино-2-метил-6-(2,3,4,5,6-пентагидроксициклогексилокси)тетрагидропиран-3-ил]амино-α-иминоуксусная кислота (IUPAC).
C14H25N3O9.
Молекулярная масса 379,4.
Химически чистое вещество представляет собой бесцветное кристаллическое вещество.
Температура плавления: 202 - 204 °С.
Давление пара при 25 °С: < 1,3×10-2 мПа.
Растворимость (в г/дм3 при 25 °С): вода - 228; метанол - 0,003; в ацетоне и ксилоле < 0,001.
Стабилен при комнатной температуре. Стабилен в слабых кислотах и нестабилен в сильных кислотах и щелочах. DT50 (50 °С) 47 дней (pH 5), 14 дней (pH 9).
Краткая токсикологическая характеристика
Острая пероральная токсичность LD50 для крыс более 5000 мг/кг, острая дермальная токсичность LD50 для кроликов превышает 2000 мг/кг. Не оказывает раздражающего действия на кожу и слизистую оболочку глаз кролика, не обладает мутагенными и тератогенными свойствами, не влияет на репродукцию крыс.
Область применения препарата
Системный фунгицид и бактерицид, получаемый ферментацией Streptomyces kasugaensis. Используется для контроля грибных и бактериальных заболеваний на рисе, овощных и плодовых культурах.
Не фитотоксичен для риса, томатов, сахарной свеклы, картофеля и др.
В России для касугамицина гигиенические нормативы не установлены.
1. Погрешность измерений
При соблюдении всех регламентированных условий проведения анализа в точном соответствии с данной методикой погрешность (и ее составляющие) результатов измерений при доверительной вероятности Р = 0,95 не превышает значений, приведенных в табл. 1, для соответствующих диапазонов концентраций.
Метрологические параметры
|
Анализируемый объект |
Диапазон определяемых концентраций, мг/кг, (мг/дм3) |
Показатель точности*) (границы относительной погрешности), ±δ, % (Р = 0,95) |
Показатель повторяемости (среднеквадратическое отклонение повторяемости), σr, % |
Показатель воспроизводимости (среднеквадратическое отклонение воспроизводимости), σR, % |
Предел повторяемости (значение допустимого расхождения между двумя результатами параллельных определений), r, % |
Предел воспроизводимости (значение допустимого расхождения между двумя результатами измерений, полученных в разных лабораториях) R, %, (Р = 0,95) |
|
Вода |
0,001 - 0,01 |
23 |
8 |
12 |
22 |
34 |
|
Почва |
0,05 - 0,5 |
23 |
8 |
12 |
22 |
34 |
|
Зерно |
0,1 - 1,0 |
22 |
7 |
11 |
20 |
31 |
|
Солома |
1,0 - 10,0 |
22 |
7 |
11 |
20 |
31 |
|
Зеленая масса |
1,0 - 10,0 |
22 |
7 |
11 |
20 |
31 |
|
*) соответствует расширенной неопределенности Uотн. при коэффициенте охвата k = 2. |
||||||
Полнота извлечения, стандартное отклонение,
доверительный интервал среднего результата
|
Анализируемый объект |
Метрологические параметры, Р = 0,95, n = 20 |
||||
|
Предел количественного определения, мг/кг (мг/дм3) |
Диапазон определяемых концентраций, мг/кг (мг/дм3) |
Полнота извлечения вещества, % |
Стандартное отклонение, % |
Доверительный интервал среднего результата, ± % |
|
|
Вода |
0,001 |
0,001 - 0,01 |
77,1 |
2,16 |
3,03 |
|
Почва |
0,05 |
0,05 - 0,5 |
78,1 |
1,69 |
2,37 |
|
Зерно |
0,1 |
0,1 - 1,0 |
78,0 |
2,31 |
3,24 |
|
Солома |
1,0 |
1,0 - 10,0 |
78,1 |
2,17 |
3,04 |
|
Зеленая масса |
1,0 |
1,0 - 10,0 |
77,2 |
1,84 |
2,58 |
2. Метод измерений
Методика основана на определении касугамицина методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием УФ-детектора после его извлечения из образцов подкисленным метанолом, для почвы - раствором щелочи и последующей очистки на патроне для твердофазной экстракции.
Идентификация касугамицина проводится по времени удерживания, количественное определение - методом абсолютной калибровки.
Избирательность метода обеспечивается сочетанием условий подготовки проб и хроматографирования.
3. Средства измерений, реактивы, вспомогательные
устройства и материалы
3.1. Средства измерений
|
Жидкостный хроматограф с быстросканирующим ультрафиолетовым детектором, снабженный дегазатором, автоматическим пробоотборником и термостатом колонки |
|
|
Весы аналитические с пределом взвешивания до 210 г и пределом допускаемой погрешности 0,1 мг |
|
|
Весы технические с пределом взвешивания до 150 г и пределом допускаемой погрешности 0,1 г |
|
|
Колбы мерные на 10, 100 см3 |
|
|
Микродозаторы одноканальные переменного объема от 100 до 1000 мм3 и от 1 до 5 см3 |
|
|
Цилиндры мерные на 50 и 100 см3 |
Примечание. Допускается использование средств измерения с аналогичными или лучшими характеристиками.
3.2. Реактивы
|
Ацетонитрил для ВЭЖХ |
ТУ 2634-002-54260861-2013 |
|
Вода для лабораторного анализа (бидистиллированная, деионизованная) |
|
|
Метанол, хч |
|
|
Касугамицин, аналитический стандарт с содержанием д.в. 90,0 % |
|
|
Кислота ортофосфорная, хч |
|
|
Кислота соляная, хч |
|
|
Натрия гидроокись, хч |
|
|
Подвижная фаза: 0,001 %-й раствор соляной кислоты в метаноле |
|
Примечание. Допускается использование реактивов с более высокой квалификацией, не требующих дополнительной очистки растворителей.
3.3. Вспомогательные устройства и материалы
|
Аналитическая колонка, заполненная сорбентом для очень полярных и водорастворимых соединений, работающая в режиме гидрофильной жидкостной хроматографии, (50×2,1) мм, 1,7 мкм |
|
|
Вакуумный манипулятор для работы с патронами для твердофазной экстракции |
|
|
Колбы круглодонные на шлифе вместимостью 25, 100, 250 см3 |
|
|
Патроны № 1 для твердофазной экстракции, заполненные октадецильной фазой для полярных аналитов, по 0,5 г |
|
|
Патроны № 2 для твердофазной экстракции, заполненные сильным катионообменником, по 0,4 г |
ТУ 4215-002-0545-931-94 |
|
Пробирки полипропиленовые центрифужные с крышками объемом 50 см3 |
|
|
Ротационный вакуумный испаритель с мембранным насосом, с пределом вакуума до 10 мбар |
|
|
Центрифуга с максимальной рабочей частотой вращения 4000 об./мин |
|
|
Устройство перемешивающее (50 - 200 колебаний в мин) |
ТУ 4389-007-44330709-2011 |
Примечание. Допускается применение оборудования с аналогичными или лучшими техническими характеристиками.
4. Требования безопасности
4.1. При выполнении измерений необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007-76, требования по электробезопасности при работе с электроустановками по ГОСТ 12.1.019-09, а также требования, изложенные в технической документации на жидкостный хроматограф.
4.2. Помещение лаборатории должно быть оборудовано приточно-вытяжной вентиляцией, соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91 и иметь средства пожаротушения по ГОСТ 12.4.009-83. Содержание вредных веществ в воздухе не должно превышать ПДК (ОБУВ), установленных ГН 2.2.5.1313-03 и ГН 2.2.5.2308-07.
Организация обучения работников безопасности труда - по ГОСТ 12.0.004-90.
5. Требования к квалификации операторов
Измерения в соответствии с настоящей методикой может выполнять специалист-химик, имеющий опыт работы методом высокоэффективной жидкостной хроматографии, ознакомленный с руководством по эксплуатации хроматографа, освоивший данную методику и подтвердивший экспериментально соответствие получаемых результатов нормативам контроля погрешности измерений по п. 13.
6. Условия измерений
При выполнении измерений выполняют следующие условия:
- процессы приготовления растворов и подготовки проб к анализу проводят при температуре воздуха (20 ± 5) °С и относительной влажности не более 80 %;
- выполнение измерений на жидкостном хроматографе проводят в условиях, рекомендованных технической документацией к прибору.
7. Подготовка к определению
7.1. Кондиционирование колонки
Перед началом анализа аналитическую колонку кондиционируют в потоке подвижной фазы (0,1 - 0,2 см3/мин) до стабилизации нулевой линии.
7.2. Подготовка патронов для очистки экстрактов
Патрон № 1 или № 2 для твердофазной экстракции промывают последовательно 3 см3 метанола и 3 см3 воды, после чего они готовы к работе.
7.3. Приготовление растворов
7.3.1. 0,005 М раствор ортофосфорной кислоты: (0,5 ± 0,01) г 98 %-й ортофосфорной кислоты помещают в мерную колбу объемом 1 дм3, растворяют в бидистиллированной воде и доводят объем до метки.
7.3.2. Для приготовления 0,005 М гидроксида натрия в мерную колбу объемом 1 дм3 помещают 0,2 г натрия гидроокиси и доводят объем бидистиллированной водой до метки.
7.3.3. Для приготовления 0,01 %-го раствора соляной кислоты в метаноле в мерную колбу объемом 1 дм3 помещают 0,1 см3 концентрированной соляной кислоты и доводят объем метанолом до метки.
7.3.4. Для приготовления 0,001 %-го раствора соляной кислоты в метаноле в мерную колбу объемом 100 см помещают 10 см3 0,01 %-го раствора соляной кислоты в метаноле, и доводят объем метанолом до метки.
7.3.5. Для приготовления 1N соляной кислоты в мерную колбу объемом 10 см помещают 1,7 см3 концентрированной соляной кислоты и доводят объем водой до метки.
7.4. Приготовление основного
и градуировочных растворов
7.4.1. Основной раствор с концентрацией 1,0 мг/см3: точную навеску касугамицина (50 ± 0,5) мг помещают в мерную колбу вместимостью 50 см3, растворяют в метаноле и доводят объем до метки тем же растворителем.
Градуировочные растворы с концентрациями касугамицина 0,2; 0,4; 0,8; 1,5; 2,0 мкг/см3 готовят методом последовательного разбавления по объему, используя в виде растворителя подвижную фазу.
7.4.2. Раствор № 1 с концентрацией 2,0 мкг/см3: в мерную колбу вместимостью 100 см3 вносят 0,2 см3 основного раствора и доводят до метки подвижной фазой.
7.4.3. Раствор № 2 с концентрацией 1,5 мкг/см3: в мерную колбу вместимостью 10 см3 помещают 0,15 см3 основного раствора и доводят до метки подвижной фазой.
7.4.4. Раствор № 3 с концентрацией 0,8 мкг/см3: в мерную колбу вместимостью 10 см3 помещают 4 см3 раствора № 1 и доводят объем до метки подвижной фазой.
7.4.5. Раствор № 4 с концентрацией 0,4 мкг/см3: в мерную колбу вместимостью 10 см3 помещают 2 см3 раствора № 1 и доводят объем до метки подвижной фазой.
7.4.6. Раствор № 5 с концентрацией 0,2 мкг/см3: в мерную колбу вместимостью 10 см3 помещают 1 см3 раствора № 1 и доводят объем до метки подвижной фазой.
Основной раствор можно хранить в холодильнике при температуре 0 - 4 °С в течение 1 месяца, градуировочные растворы - в течение суток,
При изучении полноты определения касугамицина в воде, почве, зеленой массе, соломе и зерне риса используют растворы вещества в подвижной фазе, приготовленные из основного раствора методом последовательного разбавления по объему растворителем.
7.5. Построение градуировочного графика
Для построения градуировочного графика (площадь пика - концентрация касугамицина в растворе) в хроматограф вводят по 10 мм3 градуировочных растворов (не менее 3-х параллельных измерений для каждой концентрации, не менее 4-х точек по диапазону измеряемых концентраций). Затем измеряют площади пиков и строят график зависимости среднего значения площади пика от концентрации касугамицина в градуировочном растворе.
Методом наименьших квадратов рассчитывают градуировочный коэффициент (K) в уравнении линейной регрессии:
|
C = K⋅S, где |
S - площадь пика градуировочного раствора.
Градуировку признают удовлетворительной, если значение коэффициента линейной корреляции оказывается не ниже 0,99.
Градуировочную характеристику необходимо проверять при замене реактивов, хроматографической колонки или элементов хроматографической системы, а также при отрицательном результате контроля градуировочного коэффициента.
Градуировочную зависимость признают стабильной при выполнении следующего условия:
|
|
С - аттестованное значение массовой концентрации касугамицина в градуировочном растворе,
СK - результат контрольного измерения массовой концентрации касугамицина в градуировочном растворе,
λконтр. - норматив контроля градуировочного коэффициента, %. (λконтр. = 10 % при Р = 0,95).
7.6. Проверка хроматографического поведения
касугамицина на патроне № 1
В круглодонную колбу емкостью 10 см3 отбирают 1 см3 стандартного раствора касугамицина с концентрацией 10 мкг/см3. Отдувают растворитель током воздуха. Остаток растворяют в 1 см3 воды и переносят на подготовленный патрон № 1 (п. 7.2.). Колбу обмывают 1 см3 воды и смыв тоже переносят на патрон. Промывают патрон 10 см3 воды. Элюаты от нанесения и промывки собирают фракциями по 2 см3, упаривают досуха, растворяют в 1 см3 подвижной фазы и анализируют по п. 9.6.
Фракции, содержащие касугамицин, объединяют и вновь анализируют.
Устанавливают уровень вещества в элюате, определяют полноту смывания с патрона и необходимый для очистки объем элюата.
7.7. Проверка хроматографического поведения
касугамицина на патроне № 2
В круглодонную колбу емкостью 10 см3 отбирают 1 см3 стандартного раствора касугамицина с концентрацией 10 мкг/см3. Отдувают растворитель током воздуха. Остаток растворяют в 5 см3 воды и переносят на подготовленный патрон № 2 (п. 7.2.). Промывают патрон 5 см3 воды, элюат отбрасывают. Затем элюируют касугамицин 6 см3 1N соляной кислоты со скоростью 1 - 2 капли в секунду. Отбирают фракции по 2 см3, упаривают досуха, растворяют в 1 см3 подвижной фазы и анализируют по п. 9.6.
Фракции, содержащие касугамицин, объединяют и вновь анализируют.
Устанавливают уровень вещества в элюате, определяют полноту смывания с патрона и необходимый для очистки объем элюата.
Примечание. Проверку хроматографического поведения касугамицина следует проводить обязательно, поскольку профиль вымывания может изменяться при использовании новой партии патронов и растворителей.
8. Отбор проб и хранение
Отбор проб производится в соответствии с «Унифицированными правилами отбора проб сельскохозяйственной продукции, пищевых продуктов и объектов окружающей среды для определения микроколичеств пестицидов» (№ 2051-79 от 21.08.79), а также в соответствии с ГОСТ Р 31861-12 «Вода. Общие требования к отбору проб»; ГОСТ 28168-89 «Почвы. Отбор проб»; ГОСТ 13586.3-83 «Зерно. Правила приемки и методы отбора проб» и ГОСТ 6293-90 «Рис. Требования при заготовке и поставке». Пробы зерна и соломы для определения остатков в урожае хранят в бумажной или тканевой упаковке при комнатной температуре. Перед анализом пробы зерна доводят до стандартной влажности и измельчают.
Для длительного хранения пробы почвы подсушиваются при комнатной температуре в отсутствие прямого солнечного света.
Сухие почвенные образцы могут храниться в течение года. Перед анализом сухую почву доводят до стандартной влажности, просеивают через сито с отверстиями диаметром 1 мм.
9. Проведение определения
9.1. Определение касугамицина в воде
Пробу воды (200 см3) количественно переносят на подготовленный патрон № 1 (п. 7.2). Промывают патрон 5 см3 воды. Элюаты собирают в круглодонную колбу емкостью 250 см3 и упаривают досуха на ротационном испарителе при температуре не выше 40 °С. Сухой остаток растворяют в 1 см3 подвижной фазы и анализируют на содержание касугамицина по п. 9.6.
9.2. Определение касугамицина в почве
10 г почвы помещают в полипропиленовую центрифужную пробирку вместимостью 50 см3 и добавляют 30 см3 0,005 М раствора натрия гидроксида. Пробирку плотно закрывают, встряхивают на аппарате для встряхивания в течение 10 мин, центрифугируют при скорости 4000 об./мин в течение 10 мин. Аликвоту экстракта - 12 см3 далее очищают по п. 9.4.
9.3.
Определение касугамицина в зеленой массе,
соломе и зерне риса
Навеску измельченной пробы (10 г - зерно; 2 г - зеленая масса, солома) помещают в полипропиленовую центрифужную пробирку вместимостью 50 см3 и добавляют 40 см3 0,01% соляной кислоты в метаноле. Пробирку плотно закрывают, встряхивают на аппарате для встряхивания в течение 10 мин, центрифугируют при скорости 4000 об./мин в течение 10 мин. Аликвоту (8 см3 - зерно; 4 см3 - зеленая масса, солома) помещают в круглодонную колбу и упаривают досуха на ротационном испарителе при температуре не выше 40 °С. Дальнейшую очистку экстракта проводят по п. 9.5.
9.4. Очистка на патроне № 2
Аликвоту экстракта почвы, полученную по п. 9.2, количественно переносят на подготовленный патрон (п. 7.2). Промывают патрон 5 см3 воды. Касугамицин элюируют 3 см3 1N соляной кислоты. Элюат количественно переносят в круглодонную колбу емкостью 25 см3 и упаривают досуха на ротационном испарителе при температуре не выше 40 °С. Сухой остаток растворяют в 1 см3 подвижной фазы и анализируют на содержание касугамицина по п. 9.6.
9.5. Очистка на патроне № 1
Остаток в колбе, полученный при упаривании экстрактов (п. 9.3), количественно переносят двумя порциями воды по 1 см3 на подготовленный патрон № 1 (п. 7.2). Промывают патрон 5 см3 воды. Элюаты объединяют, количественно переносят в круглодонную колбу емкостью 25 см3 и упаривают досуха на ротационном испарителе при температуре не выше 40 °С. Сухой остаток растворяют в 1 см3 подвижной фазы и анализируют на содержание касугамицина по п. 9.6.
9.6. Условия хроматографирования
Жидкостный хроматограф с быстросканирующим ультрафиолетовым детектором, снабженный дегазатором, автоматическим пробоотборником и термостатом колонки.
Аналитическая колонка, заполненная сорбентом для очень полярных и водорастворимых соединений, работающая в режиме гидрофильной жидкостной хроматографии, (50×2,1) мм, 1,7 мкм.
Температура колонки (30 ± 1) °С.
Подвижная фаза: смесь ацетонитрила (А) и 0,005 М ортофосфорной кислоты (В) в градиентном режиме: от 100 % к 40 % компонента А за 5 мин.
Скорость потока элюента 0,2 см3/мин.
Рабочая длина волны УФ-детектора 220 нм.
Объем вводимой пробы 10 мм3.
Время удерживания касугамицина составляет (4,3 ± 0,1) мин.
10. Обработка результатов анализа
Количественное определение проводят методом абсолютной калибровки. Содержание касугамицина в пробе (X, мг/кг) вычисляют по формуле:
|
|
Sx - площадь пика касугамицина на хроматограмме испытуемого образца, (AU);
K - градуировочный коэффициент, найденный на стадии построения соответствующей градуировочной зависимости;
V - объём пробы, подготовленной для хроматографического анализа, см3;
Р - навеска (г) или объем (см3) анализируемой части образца (для воды 200 см3, для почвы 4 г, для зерна 2 г, для соломы и зеленой массы 0,2 г).
Содержание остаточных количеств касугамицина в образце вычисляют как среднее из двух параллельных определений.
Образцы, дающие пики большие, чем стандартный раствор касугамицина с концентрацией 10,0 мкг/см3, разбавляют подвижной фазой для ВЭЖХ.
11.
Проверка приемлемости результатов
параллельных определений
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, расхождение между которыми не превышает предела повторяемости (1):
|
|
Х1, Х2 - результаты параллельных определений, мг/кг;
r - значение предела повторяемости, (r = 2,8σr).
При невыполнении условия (1) выясняют причины превышения предела повторяемости, устраняют их и вновь выполняют анализ.
12. Оформление результатов
Результат анализа представляют в виде:
|
|
![]() - среднее арифметическое результатов
определений, признанных приемлемыми, мг/кг;
- среднее арифметическое результатов
определений, признанных приемлемыми, мг/кг;
Δ - граница абсолютной погрешности, мг/кг.
|
|
δ - граница относительной погрешности методики (показатель точности в соответствии с диапазоном концентраций), %.
В случае, если содержание компонента менее нижней границы диапазона определяемых концентраций, результат анализа представляют в виде:
«содержание вещества в пробе «менее нижней границы определения» (например: менее 0,1 мг/кг*, где * - 0,1 мг/кг - предел обнаружения касугамицина в зерне).
13. Контроль
качества результатов измерений
Оперативный контроль погрешности и воспроизводимости измерений осуществляется в соответствии с ГОСТ Р ИСО 5725-1-6-2002 «Точность (правильность и прецизионность) методов и результатов измерений».
13.1. Стабильность результатов измерений контролируют перед проведением измерений, анализируя один из градуировочных растворов.
13.2. Плановый внутрилабораторный оперативный контроль процедуры выполнения анализа проводится с применением метода добавок.
Величина добавки Сд должна удовлетворять условию:
|
Сд = Δл,Х + Δл,Хʹ, где |
±Δл,Х (±Δл,Хʹ) - характеристика погрешности (абсолютная погрешность) результатов анализа, соответствующая содержанию компонента в испытуемом образце (расчетному значению содержания компонента в образце с добавкой, соответственно), мг/кг; при этом:
|
Δл = ±0,84⋅Δ, где |
Δ - граница абсолютной погрешности, мг/кг:
|
|
δ - граница относительной погрешности методики (показатель точности в соответствии с диапазоном концентраций), %.
Результат контроля процедуры Кк рассчитывают по формуле:
|
Кк = Хʹ - Х - Сд, где |
Xʹ, X, Сд - среднее арифметическое результатов параллельных определений (признанных приемлемыми по п. 11) содержания компонента в образце с добавкой, испытуемом образце, концентрация добавки, соответственно, мг/кг.
Норматив контроля К рассчитывают по формуле:
Проводят сопоставление результата контроля процедуры Кк с нормативом контроля (К).
Если результат контроля процедуры удовлетворяет условию
|
|Кк| ≤ К, |
(2) |
процедуру анализа признают удовлетворительной.
При невыполнении условия (2) процедуру контроля повторяют. При повторном невыполнении условия (2) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры к их устранению.
13.3. Проверка приемлемости результатов измерений, полученных в условиях воспроизводимости.
Расхождение между результатами измерений, выполненных в двух разных лабораториях, не должно превышать предела воспроизводимости (R):
|
|
(3) |
Х1, Х2 - результаты измерений в двух разных лабораториях, мг/кг;
R - предел воспроизводимости (в соответствии с диапазоном концентраций), %.