4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ
И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Использование методов полиморфизма
длин рестрикционных фрагментов
(рибопринтинг, электрофорез
в пульсирующем поле) для идентификации
возбудителей I - II групп патогенности
Методические
рекомендации
МР 4.2.0090-14
1. Разработаны Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Ю.В. Демина, Н.В. Шеенков); ФКУЗ «Российский научно-исследовательский противочумный институт «Микроб» Роспотребнадзора (В.Е. Куклев, Н.А. Осина, А.В. Осин, И.Н. Шарова, А.С. Абдрашитова, Н.С. Червякова, С.А. Щербакова); ФКУЗ «Иркутский научно-исследовательский противочумный институт» Роспотребнадзора (С.В. Балахонов, М.В. Чеснокова, М.В. Афанасьев, Л.В. Миронова, С.А. Татарников, Е.Г. Токмакова, Г.В. Вдовиченко, А.С. Остяк, М.Б. Ярыгина, Е.А. Басов); ФКУЗ «Волгоградский научно-исследовательский противочумный институт» Роспотребнадзора (В.А. Антонов, Г.А. Ткаченко, С.С. Савченко, В.В. Алексеева, О.В. Зинченко, И.М. Шпак, М.А. Гришина, Н.В. Вьючнова, О.С. Ульянова, Д.В. Викторов).
2. Утверждены руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации А.Ю. Поповой 13 мая 2014 г.
3. Введены впервые
Содержание
|
УТВЕРЖДАЮ |
|
Руководитель Федеральной службы |
|
по надзору в сфере защиты прав |
|
потребителей и благополучия человека, |
|
Главный государственный санитарный |
|
врач Российской Федерации |
|
А.Ю. Попова |
|
13 мая 2014 г. |
|
Дата введения: с момента утверждения |
4.2.
МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ
И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Использование
методов полиморфизма длин рестрикционных
фрагментов (рибопринтинг, электрофорез в пульсирующем поле)
для идентификации возбудителей I - II групп патогенности
Методические рекомендации
МР 4.2.0090-14
1. Область применения
1.1. Настоящие методические рекомендации (далее по тексту - рекомендации) предназначены для специалистов лабораторий, осуществляющих диагностические, мониторинговые и научные исследования с возбудителями опасных инфекционных болезней.
1.2. Рекомендации определяют проведение молекулярного типирования с помощью методов полиморфизма длин рестрикционных фрагментов (рибопринтинг, электрофорез в пульсирующем поле): методические основы, рекомендации к организации и оснащению лабораторий, основные этапы осуществления анализа, способы учета и интерпретации результатов.
2. Общие положения
2.1. Процедура молекулярного типирования возбудителей бактериальных инфекций с использованием электрофореза в пульсирующем поле (PFGE) заключается в рестрикции тотальной ДНК исследуемого изолята редкощепящими эндонуклеазами и последующем разделении полученных фрагментов в агарозном геле в гомогенном электрическом поле с периодическим изменением направления его приложения. Полученные в результате электрофореза специфический для каждого изолята набор фрагментов ДНК (PFGE-профиль) подвергаются математической обработке с использованием пакетов специальных программ и сравнительному анализу с формированием дендрограмм.
2.2. Процедура молекулярного типирования возбудителей бактериальных инфекций с использованием рибопринтинга (автоматическое риботипирование) заключается в рестрикции тотальной ДНК микроорганизма рестриктазами с последующим электрофоретическим разделением полученных фрагментов и переносом их на мембрану, где происходит гибридизация с зондами, комплементарными нуклеотидным последовательностям генов 5S, 16S и 23S рибосомальной ДНК. Результатом анализа является выявление на мембране набора специфических фрагментов ДНК различного размера (от 1 до 50 т.п.н.), т.н. «рибопринт», который является уникальным для каждого вида бактерий.
3. Основные этапы исследования
3.1. Электрофорез в пульсирующем поле
Проведение электрофореза в пульсирующем поле включает в себя 8 этапов.
3.1.1. Культивирование микроорганизмов.
Назначение: получение достаточного количества исследуемой культуры на соответствующих плотных питательных средах.
3.1.2. Приготовление агарозных блоков.
Назначение: получение агарозных блоков, содержащих определенное количество бактериальных суспензий исследуемых штаммов микроорганизмов и протеиназы K.
3.1.3. Лизис клеток в агарозных блоках.
Назначение: обработка подготовленных по п. 3.1.2 блоков в лизирующем растворе с протеиназой K для разрушения клеточных стенок бактерий.
3.1.4. Отмывка агарозных блоков.
Назначение: очистка агарозных блоков после обработки по п. 3.1.3 от остатков лизирующего раствора и протеиназы K.
3.1.5. Рестрикция ДНК в агарозных блоках.
Назначение: рестрикция тотальной ДНК, полученной в агарозных блоках после обработки по пп. 3.1.3 и 3.1.4.
3.1.6. Электрофорез в пульсирующем поле.
Назначение: разделение полученных после обработки по п. 3.1.5 фрагментов ДНК в агарозном геле при использовании пульсирующего электрического поля.
3.1.7. Учет результатов.
Назначение: визуализация фрагментов ДНК в агарозном геле с помощью бромида этидия.
3.1.8. Интерпретация результатов.
Назначение: математическая обработка полученных данных с целью сравнения полученных PFGE-профилей и определения степени родства между изученными в данном эксперименте или ранее изученными изолятами.
3.2. Рибопринтинг
Проведение рибопринтинга включает в себя 4 этапа.
3.2.1. Культивирование микроорганизмов.
Назначение: получение достаточного количества исследуемой культуры на соответствующих плотных питательных средах.
3.2.2. Подготовка проб для исследования.
Назначение: приготовление бактериальной суспензии, прогревание при различных температурах и обработка лизирующим раствором для получения полногеномной ДНК.
3.2.3. Проведение автоматического риботипирования.
Назначение: проведение рестрикции тотальной ДНК в подготовленных по п. 3.2.2 пробах, разделение фрагментов в агарозном геле и их перенос на мембрану, гибридизация фрагментов с зондами, меченными флуоресцентной меткой.
3.2.4. Учет и интерпретация результатов.
Назначение: математическая обработка результатов исследования с целью сравнения полученных рибопринтов с имеющимися в базе данных и определения видовой принадлежности изученных штаммов микроорганизмов.
4. Основные требования к организации исследований
4.1. Лаборатории должны быть оснащены оборудованием для проведения исследований с использованием методов полиморфизма длин рестрикционных фрагментов (рибопринтинг, электрофорез в пульсирующем поле) (прилож. 1).
4.2. Лаборатории должны быть оснащены расходными материалами и реактивами для проведения исследований с использованием методов полиморфизма длин рестрикционных фрагментов (рибопринтинг, электрофорез в пульсирующем поле) (прилож. 2).
4.3. Подготовку реактивов для осуществления рибопринтинга и электрофореза в пульсирующем поле проводят с использованием реактивов с классом чистоты не ниже ч.д.а. по схемам, представленным в прилож. 3.
4.4. Материалом для исследования при осуществлении молекулярного типирования с использованием рибопринтинга и электрофореза в пульсирующем поле являются чистые культуры возбудителей особо опасных инфекционных болезней, предварительно идентифицированные для каждой нозологии до вида, рода либо семейства.
4.5. Исследование осуществляют в боксированных помещениях и боксах биологической безопасности II В класса. Тип дезинфицирующего вещества определяется видом патогена, с которым проводится работа.
4.6. Культивирование микроорганизмов осуществляют на неселективных плотных питательных средах, предназначенных для накопления культур. Недопустимо использование сред, содержащих индикаторы, антибактериальные вещества.
5. Проведение PFGE
5.1. Культивирование микроорганизмов
Культивирование штаммов Y. pestis осуществляется на казеиново-дрожжевом агаре (pH 7,6) в течение 2 суток при температуре 28 °С. Посев производят таким образом, чтобы получить изолированные колонии. Из 2-суточной агаровой культуры исследуемого штамма отбирают одну типичную изолированную колонию и пересеивают на пластинку агара Хоттингера pH 7,2 (для получения бактериальной массы, необходимой для постановки пульс-электрофореза), а также одновременно на скошенный столбик казеиново-дрожжевого агара (для обеспечения возможности исследования той же колонии в случае необходимости).
Культивирование штаммов V. cholerae осуществляют на щелочном казеиново-дрожжевом агаре (pH 7,6) в течение 18 - 24 ч при температуре 37 °С. Из 18-часовой агаровой культуры исследуемого штамма отбирают одну типичную изолированную колонию и пересеивают на пластинку щелочного агара (для получения бактериальной массы, необходимой для постановки пульс-электрофореза), а также одновременно в столбик полужидкого агара (для обеспечения возможности исследования той же колонии в случае необходимости).
Культивирование В. mallei осуществляют на сердечно-мозговом агаре BHI (pH 7,2) в течение 24 ч при температуре 37 °С. После инкубации отбирают одну типичную изолированную колонию и пересеивают на пластинку с сердечно-мозговым агаром (pH 7,2) (для получения бактериальной массы, необходимой для постановки пульс-электрофореза).
Дополнительно производится посев на чашку с триптиказо-соевым агаром штамма Salmonella ser. Braenderup Н9812, используемого в качестве контрольного при проведении PFGE.
5.2. Приготовление агарозных блоков
Подготовку оборудования, расходных материалов и реактивов осуществляют в соответствии с данными табл. 1.
В предварительно промаркированные стеклянные пробирки с охлажденным CSB-буфером стерильным ватным тампоном вносят культуру исследуемых штаммов Y. pesis, V. cholerae, В. mallei и осторожно растирают. Затем переносят 2 мл полученной суспензии в пробирки для денситометра или кювету для спектрофотометра и измеряют оптическую плотность, доводят показатель до требуемого добавлением CSB или культуры (табл. 2).
Перечень
оборудования, расходных материалов и реактивов,
необходимых для приготовления агарозных блоков
|
Водяная баня-шейкер |
Устанавливают температуру 54 °С |
|
Твердотельный термостат |
Установить температуру 57 °С |
|
Форма для заливки агарозных блоков |
Обрабатывают 70°-м этиловым спиртом, собирают, помещают в металлический поддон, застеленный марлевой салфеткой, смоченной дезраствором. Лунки формы маркируют с обеих сторон в соответствии с номерами исследуемых штаммов |
|
Стеклянные пробирки |
Внести по 3 мл охлажденного CSB-буфера |
|
Буфер для суспендирования клеток (например: CSB - Cell Suspension Buffer или эквивалент) |
В соответствии с прилож. 3, затем охлаждают |
|
1 % агароза для приготовления блоков (например: SeaKemGold или эквивалент) |
В соответствии с прилож. 3 |
|
Стоковый раствор протеиназы K (20 мг/мл) |
В соответствии с прилож. 3 |
|
Микроцентрифужные пробирки объемом 1,5 мл |
|
|
Пробирки для денситометра или кюветы для спектрофотометра |
|
|
Стерильные ватные тампоны |
|
Показатели оптической плотности микробной взвеси
|
Прибор для измерения оптической плотности |
Единицы измерения |
Показатель |
|
Спектрофотометр (длина волны 610 нм) |
Оптическая плотность (OD) |
0,8 - 1,0 |
|
Денситометр |
Единицы МакФарланда (McF) |
3,7 - 3,8 (для V. cholerae) 3,6 - 3,7 (для Y pestis) 3,6 - 3,7 (для В. mallei) |
Полученную суспензию В. mallei инактивируют в присутствии мертиолята натрия при температуре 56 °С в течение 1 ч. Далее взвесь концентрируют до плотности 2,4×109 - 3,0×109 м.к./мл при помощи трехкратного центрифугирования (центрифугируют 1 мл бактериальной взвеси в микроцентрифужной пробирке объемом 1,5 мл в течение 10 - 15 мин при 12000 об./мин, удаляют надосадочную жидкость, к осадку добавляют 1 мл бактериальной взвеси, осадок ресуспендируют и т.д.). К полученному осадку добавляют 0,5 мл CSB-буфера, после чего подогревают до температуры 50 °С.
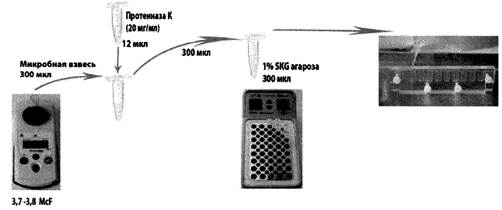
Приготовленную бактериальную суспензию каждого штамма в объеме 300 мкл переносят в предварительно маркированные микроцентрифужные пробирки объемом 1,5 мл. В каждую пробирку со взвесью добавляют по 12 мкл стокового раствора протеиназы K (20 мг/мл), перемешивают осторожно пипетированием. Затем 300 мкл полученной смеси добавляют к 300 мкл предварительно расплавленной и разлитой в микроцентрифужные пробирки объемом 1,5 мл 1 %-й SKG-агарозы, аккуратно, тщательно перемешивают пипетированием. Пробирки помещают в твердотельный термостат, нагретый до 57 °С, и заливают в ячейку формы для заливки блоков (табл. 3, рис. 1).
Для каждого исследуемого штамма заливают по две ячейки формы (при использовании многоразовой формы) или по четыре ячейки (при использовании одноразовой формы). Агарозные блоки оставляют для застывания в форме при комнатной температуре на 10 - 15 мин.
Компоненты для приготовления агарозных блоков
|
Компонент |
Объем на один образец |
|
Бактериальная суспензия |
300 мкл |
|
Протеиназа K (20 мг/мл) |
12 мкл |
|
1 %-я SKG-агароза |
300 мкл |
Рис. 1. Схема приготовления агарозных блоков
5.3. Лизис клеток в агарозных блоках
Подготовку оборудования, расходных материалов и реактивов осуществляют в соответствии с данными табл. 4.
Отбирают необходимое количество центрифужных пробирок объемом 50 мл, помещают их в штатив, находящийся на смоченной дезинфицирующим раствором салфетке в поддоне с формой для заливки блоков, маркируют.
Перечень оборудования, расходных материалов и реактивов, необходимых для лизиса клеток в агарозных блоках
|
Водяная баня-шейкер |
Устанавливают температуру 54, 50 или 37 °С |
|
Буфер для лизиса клеток (CLB - Cell Lysis Buffer) |
В соответствии с прилож. 3 |
|
Стоковый раствор протеиназы K (20 мг/мл) |
В соответствии с прилож. 3 |
|
Центрифужные пробирки объемом 50 мл |
|
|
Штатив для центрифужных пробирок объемом 50 мл |
|
В каждую подготовленную пробирку вносят 5 мл CLB и добавляют 25 мкл протеиназы K (20 мг/мл), раствор тщательно перемешивают.
После застывания агарозных блоков (п. 3.1.2) форму для заливки разбирают, агарозные блоки каждого штамма аккуратно шпателем переносят в соответствующие пробирки со смесью CLB + протеиназа K и полностью погружают в лизирующий раствор. Затем пробирки плотно закрывают крышками и переносят в штатив водяной бани-шейкера (уровень воды в бане должен быть выше уровня лизирующего буфера в пробирках). Инкубация в лизирующем растворе осуществляется:
• для V. cholerae в течение 1 ч при температуре 54 °С и интенсивности покачиваний 80 мин-1;
• для Y. pestis в течение 2 ч при температуре 50 °С и интенсивности покачиваний 90 мин-1;
• для В. mallei в течение 36 - 38 с при температуре 37 °С без покачивания.
На эффективность процедуры лизиса клеток в агарозных блоках указывает прозрачность блоков после завершения данного этапа.
5.4. Отмывка агарозных блоков
Подготовку оборудования, расходных материалов и реактивов осуществляют в соответствии с данными табл. 5.
Перечень оборудования, расходных материалов и реактивов, необходимых для отмывки агарозных блоков
|
Водяная баня-шейкер |
Устанавливают температуру 50 °С |
|
ТЕ-буфер |
В соответствии с прилож. 3 подогреть до температуры 50 °С, удерживать температуру в течение всего времени отмывки |
|
Деионизованная вода |
Подогреть до температуры 50 °С, удерживать температуру в течение всего времени отмывки |
|
Центрифужные пробирки объемом 50 мл |
|
|
«Крышка-сито» (Screened Plug Сар или эквивалент) для пробирки объемом 50 мл |
|
|
Штатив для центрифужных пробирок объемом 50 мл |
|
Отмывку агарозных блоков осуществляют на водяной бане-шейкере при температуре 50 °С, интенсивности покачиваний 100/мин по следующей схеме:
• деионизированной водой - двукратно по 15 мл;
• ТЕ-буфером - по 15 мл, для V. cholerae трехкратно, для Y. pestis, В. mallei пятикратно.
Продолжительность каждой отмывки - 20 мин.
По окончании этапа лизиса клеток пробирки достают из водяной бани-шейкера, снимают крышки и надевают на пробирки специальные «крышки-сита», после чего сливают лизирующий раствор в емкость с дезинфицирующим раствором. Затем в пробирку через «крышку-сито» вносят 15 мл подогретой до 50 °С деионизированной воды, проверяют полноту погружения блоков в воду, закрывают пробирки и помещают их в водяную баню-шейкер. Инкубируют в течение 20 мин. Далее повторяют отмывку блоков водой и ТЕ-буфером в соответствии с указанной выше схемой.
По окончании отмывки проводят рестрикцию ДНК или блоки переносят в пробирки с 5 - 10 мл ТЕ-буфера и хранят при температуре 4 °С.
5.5. Рестрикция ДНК в агарозных блоках
Для рестрикции ДНК V. cholerae используют эндонуклеазу NotI (изошизомер - CciNI) - сайт узнавания GC↑GGCCGC и SfiI - сайт узнавания GGCCNNNN↑NGGCC.
Для рестрикции ДНК Y pestis используют эндонуклеазу AscI (изошизомер РаlА) - сайт узнавания GG↑CGCGCC и XbaI - сайт узнавания T↑CTAGA.
Для рестрикции ДНК В. mallei используют эндонуклеазу XbaI - сайт узнавания T↑CTAGA.
Для рестрикции ДНК контрольного штамма Salmonella ser. Braenderup Н98124 подвергают расщеплению ферментом XbaI - сайт узнавания T↑CTAGA.
Подготовку оборудования, расходных материалов и реактивов осуществляют в соответствии с данными табл. 6.
Перечень оборудования, расходных материалов и реактивов, необходимых для рестрикции ДНК в агарозных блоках
|
Водяная баня-шейкер |
Устанавливают температуру 50 или 37 °С |
|
10 × буфер для рестрикции |
|
|
Рестриктазы NotI, SfiI, AscI, XbaI |
|
|
Микроцентрифужные пробирки объемом 1,5 мл |
|
|
Штатив для микроцентрифужных пробирок объемом 1,5 мл |
|
Отбирают в штатив три ряда микроцентрифужных пробирок объемом 1,5 мл: первый, второй ряд - в соответствии с количеством исследуемых образцов, третий - в соответствии с количеством проб контрольного штамма:
• первый ряд - для рестрикции ферментом NotI для V. cholerae, AscI для Y. pestis;
• второй - для рестрикции ферментом SfiI для V. cholerae, XbaI для Y. pestis;
• третий - для рестрикции ДНК контрольного штамма Salmonella ser. Braenderup Н98124 (рекомендуется подготовить 3 агарозных пластинки контрольного штамма на гель из 10 лунок или 4 - на гель из 15 лунок).
В отдельной пробирке готовят раствор для пререстрикционной обработки (табл. 7) из расчета на одну пробу 200 мкл. Для каждого типа рестриктаз готовят отдельный пререстрикционный буфер. Переносят по 200 мкл в подготовленные пробирки.
Состав пререстрикционного раствора
|
Компонент |
Объем на 1 образец |
|
Деионизованная вода |
180 мкл |
|
10-кратный буфер для рестрикции |
20 мкл |
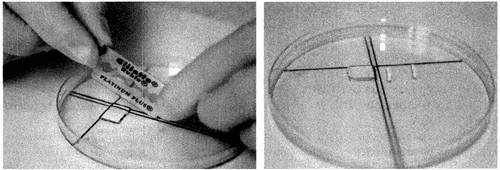
Для рестрикции агарозный блок должен быть нарезан (рис. 2).
Рис. 2. Процедура нарезания агарозных пластинок
Отмытый агарозный блок (п. 3.1.4) переносят в крышку чашки Петри, дозатором или безворсовой салфеткой удаляют избыток ТЕ-буфера, блок выравнивают по разметке, от него лезвием отрезают пластинку шириной 2 мм и переносят шпателем в микроцентрифужную пробирку объемом 1,5 мл с пререстрикционным буфером. Остаток блока помещают в пробирку с ТЕ-буфером для хранения (4 °С). Инкубацию агарозных пластинок в пререстрикционном буфере осуществляют при комнатной температуре 10 - 15 мин или в течение 5 - 10 мин при оптимальной для работы ферментов температуре: 37 °С - для NotI, AscI и XbaI, 50 °С - для SfiI.
После пререстрикции из пробирок аккуратно дозатором удаляется пререстрикционный буфер.
В отдельных пробирках готовятся растворы каждого фермента NotI, AscI, XbaI и SfiI в соответствующем буфере (табл. 8) на общее число образцов.
Состав растворов ферментов и условия рестрикции
|
Компонент |
Рестрикция NotI |
Рестрикция SfiI |
Рестрикция XbaI |
Рестрикция AscI |
|
на 1 образец, мкл |
||||
|
Деионизованная вода |
174,5 |
177,5 |
176,5 |
360,0 |
|
10-кратный буфер для рестрикции |
20 |
20 |
20 |
40 |
|
Фермент |
4 |
1 |
2 |
60 |
|
(10 Ед/мкл) |
(40 Ед/мкл) |
(20 Ед/мкл) |
(1 Ед/мкл) |
|
|
БСА (10 мг/мл) |
1,5 |
1,5 |
1,5 |
- |
|
|
Инкубация |
Инкубация |
Инкубация |
Инкубация |
|
37 °С 4 часа |
50 °С 4 часа |
37 °С 4 часа |
37 °С 4 часа |
|
В пробирки с агарозными пластинками переносят по 200 мкл подготовленного раствора фермента (460 мкл для рестрикционной смеси AscI), пробирки закрывают, раствор осторожно перемешивают покачиванием и следят, чтобы агарозные пластинки находились в растворе фермента. Далее осуществляют рестрикцию: образцы инкубируются в течение 4 ч на водяной бане при температуре 37 °С - для ферментов для NotI, AscI и XbaI и 50 °С - для фермента SfiI.
5.6. Электрофорез в пульсирующем поле
Подготовку оборудования, расходных материалов и реактивов осуществляют в соответствии с данными табл. 9.
Перечень оборудования, расходных материалов и реактивов, необходимых для проведения электрофореза в пульсирующем поле
|
Водяная баня-шейкер |
Устанавливают температуру 57 °С |
|
0,5 × ТВЕ |
В соответствии с прилож. 3 |
|
1 %-я агароза для проведения пульс-электрофореза (SeaKemGold или аналог) |
В соответствии с прилож. 3 |
|
Микроцентрифужные пробирки объемом 1,5 мл |
|
|
Штатив для микроцентрифужных пробирок объемом 1,5 мл |
|
По окончании этапа рестрикции из пробирок аккуратно удаляют раствор фермента, в каждую пробирку добавляют по 200 мкл 0,5 × ТВЕ и пробирки инкубируют при комнатной температуре в течение 5 мин. Затем на зубцы гребенки, расположенной на рабочем столе, шпателем выкладывают агарозные пластинки в соответствии с заранее определенной схемой расположения исследуемых и контрольных образцов; избытки 0,5 × ТВЕ на зубцах гребенки подсушиваются безворсовой салфеткой или отбираются дозатором с тонким носиком (рис. 3).
Рис. 3. Перенос агарозных пластинок на гребенку,
установка гребенки в форму для заливки
Расположенные на зубцах гребенки агарозные пластинки подсушивают на воздухе в течение 5 - 7 мин, затем гребенку переносят в форму для заливки геля (агарозные пластинки должны находиться на лицевой стороне гребенки, зубцы гребенки должны плотно прилегать к основанию формы). После установки гребенки в форму осторожно заливают 1 %-ю SKG-агарозу, время полимеризации 30 - 45 мин. Если при заливке произошло образование пузырей в геле, их сразу удаляют наконечником.
Устанавливают рамку для фиксации агарозного геля в электрофорезную камеру. Затем заполняют камеру 0,5 × ТВЕ (объем 2,2 л), включают прибор и насос для циркуляции буфера. После заполнения контура буфером включают установку для охлаждения буфера (выставляют температуру 14 °С), оставляют буфер для охлаждения на 30 мин. После застывания геля гребенку аккуратно вынимают, форму для заливки геля разбирают. Гель должен остаться на подложке, с наружной стороны которой салфеткой удаляют остатки агарозы. Гель на подложке устанавливают в рамку, размещенную в электрофорезной камере.
При исследовании V. cholerae и Y. pestis используются разные программы электрофоретического разделения продуктов рестрикции.
Алгоритм программирования прибора (типа Chef Mapper или аналог) при исследовании холерного вибриона:
Программа состоит из двух блоков.
Блок 1: интервал времени переключения от 2 до 10 с, продолжительность - 13 ч.
Блок 2: интервал времени переключения от 20 до 25 с, продолжительность - 6 ч.
1. Начать программирование нажатием кнопки Multi-State на приборе.
Далее отвечать на запросы программы в соответствии с представленным ниже алгоритмом:
2. Program with Interrupts?
0 = No
после выбора каждого значения нажимать ‘Enter’
3. Block 1 Runtime?
13 hours
4. Block 1, State 1:
a. 6.0 volts
b. angle = 60.0
c. Initial switch time = 2 s
d. Final switch time = 10 s
e. Ramping factor, a = 0 (linear)
5. Continue with another state (Vector)?
1 = Yes
Block 1, State 2:
a. 6.0 volts
b. angle = -60.0
угол режима 2 должен быть отрицательным
c. Initial switch time = 2 s
d. Final switch time = 10 s
e. Ramping factor, a = 0 (linear)
6. Continue with another state (Vector)?
0 = No
7. Continue with another Block?
1 = Yes
8. Block 2 Runtime?
6 hours
9. Block 2, State 1:
a. 6.0 volts
b. angle = 60.0
c. Initial switch time = 20 s
d. Final switch time = 25 s
e. Ramping factor, a = 0 (linear)
10. Continue with another state (Vector)? 1 = Yes
11. Block 2, State 2:
a. 6.0 volts
b. angle = -60.0
угол режима 2 должен быть отрицательным
c. Initial switch time = 20 s
d. Final switch time = 25 s
e. Ramping factor, a = 0 (linear)
12. Continue with another state (Vector)? 0 = No
13. Continue with another Block? 0 = No
14. A program is in memory, please enter another command.
15. Нажать кнопку Start Run для запуска программы.
Алгоритм программирования прибора при исследовании возбудителя чумы:
Программа состоит из одного блока: интервал времени переключения от 1,76 до 18,66 с, продолжительность - 17,5 ч.
1. Начать программирование нажатием кнопки «Auto-algoritm» на приборе.
2. Указать минимальный и максимальный диапазоны масс: 25 kb - low MW, 215 kb - high MW.
Далее принимать все параметры, устанавливаемые по умолчанию путем нажатия ‘Enter’, кроме параметра Run time, который должен быть изменен на 17,5 ч.
3. После появления сообщения «А program is in memory, please enter another command» нажать кнопку Start Run для запуска программы.
Наиболее эффективное фракционирование дифференцирующих фрагментов ДНК В. mallei достигается с использованием режима интерполяции при следующих пульсовых интервалах: 5 с - 10 ч, 20 с - 10 ч, 40 с - 9 ч, 50 с - 1 ч. Напряженность электрического поля - 4 В/см.
Время электрофореза необходимо оптимизировать с учетом требований по разделению фрагментов ДНК контрольного штамма: нижний фрагмент размерного стандарта Salmonella ser. Braenderup Н98124 должен располагаться на 1,0 - 1,5 см выше края геля.
5.7. Учет результатов
По окончании электрофореза гель вынимают из камеры, снимают с подложки и помещают в раствор бромида этидия на 20 мин для окрашивания. После окрашивания гель переносят в емкость с деионизованной водой и отмывают в течение 40 мин со сменой воды каждые 20 мин.
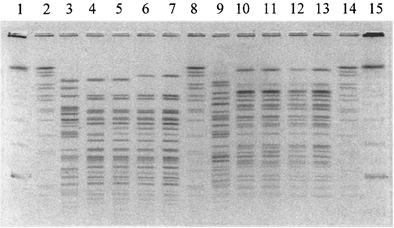
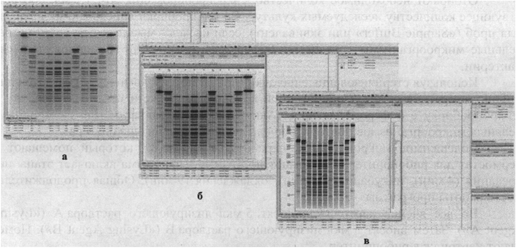
Затем гель просматривают в трансиллюминаторе и осуществляют видеорегистрацию результатов с использованием системы гель-документации. Для проведения дальнейшего анализа файл с изображением геля сохраняют в формате *tif (рис. 4а, б).
Рис. 4а. NotI-генерируемые паттерны
рестрикции ДНК V. cholerae:
1, 15 - CHEF DNA Size Standart, lambda ladder, 0,05 - 1 Mb;
2, 8, 14 - ДНК Salmonella ser. Braenderup
H98124, рестрицированная XbaI;
3 - 7, 9 - 13 - рестрицированная ДНК штаммов V. cholerae.
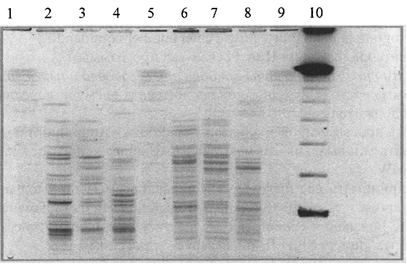
Рис. 4б. Паттерны рестрикции ДНК Y. pestis
разных подвидов:
1, 5, 9 - ДНК Salmonella ser. Braenderup Н98124, рестрицированная XbaI;
2, 3 и 6, 7 - ДНК штаммов Y. pestis основного подвида, рестрицированных XbaI и AscI,
соответственно; 4 и 8 - ДНК штамма Y. pestis алтайского подвида,
рестрицированная
XbaI и AscI, соответственно; 10 - CHEF
DNA Size Standart, lambda ladder, 0,05 - 1 м.п.н.
5.8. Интерпретация результатов
Анализ полученных PFGE-профилей и математическая обработка данных проводятся с использованием программного обеспечения (например: BioNumerics 6.6. или аналог).
Сохраненный в формате *tif файл импортируется в сформированную базу данных (рис. 5а), поэтапно проводится его обработка (рис. 5б), нормализация и идентификация размеров фрагментов каждого паттерна в соответствии с используемым размерным стандартом (PFGE-паттерн Salmonella ser. Braenderup Н98124 или маркер - CFIEF DNA Size Standart, lambda ladder, 0,05 - 1 м.п.н.) (рис. 5в).
Рис. 5. Этапы импортирования и обработки геля в
программе
обработки данных (например: BioNumerics или аналог)
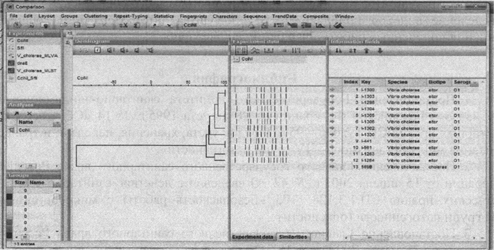
После импорта полученных PFGE-профилей в базу данных проводится кластерный анализ с использованием алгоритма UPGMA, формируется дендрограмма (рис. 6).
Рис. 6. UPGMA дендрограмма, построенная на основании
сравнения
PFGE-профилей V. cholerae
6. Проведение рибопринтинга
6.1. Культивирование микроорганизмов
Высев выделенных культур проводят на неселективные среды с целью получения изолированных колоний. Тип питательных сред и температура инкубирования определяются видом патогена. Посевы выдерживают не более 18 - 24 ч. После получения чистых культур проводят определения их тинкториальных свойств (окраска по Граму).
6.2. Подготовка проб
Отбирают необходимое количество микропробирок объемом 1,5 мл, соответствующее количеству исследуемых культур. Во все пробирки вносят 200 мкл буфера для проб («Sample Buffer» или эквивалент), если исследуемые штаммы грамотрицательные микроорганизмы, или 40 мкл буфера для проб - если грамположительные бактерии.
Используя стерилизованные палочки (прилагаются к комплекту реагентов для рибопринтера), касаются изолированной колонии на чашке и переносят палочку в микропробирку с буфером для проб. Аккуратно перемешивают. Для грамположительных микроорганизмов повторить предыдущие операции еще один раз.
Содержимое микропробирок переносят в картридж, который помещают в термостат для рибопринтера, запускают программу. Программа включает этапы нагревания (4 мин), инкубации (13 мин), охлаждения (9 мин). Общая продолжительность работы программы - 26 мин.
Во все ячейки картриджа вносят 5 мкл лизирующего раствора A («Lysing Agent А»). Затем вносят 5 мкл лизирующего раствора В («Lysing Agent В»). Помещают картридж в рибопринтер.
6.3. Проведение автоматического риботипирования
Загрузку реагентов производят в соответствии с инструкцией к прибору. Исследование проводится в автоматическом режиме.
6.4. Учет и интерпретация результатов
Учет результатов проводят с помощью программного обеспечения к прибору. Определение видовой принадлежности проводится автоматически на основании сравнения полученных риботипов с базой данных прибора.
Библиография
1. Постановление Государственного комитета санитарно-эпидемиологического надзора Российской Федерации от 28 августа 1995 г. № 14 «Об утверждении санитарных правил СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности».
2. Постановление Главного государственного санитарного врача Российской Федерации от 15 апреля 2003 г. № 42 «О введении в действие санитарно-эпидемиологических правил СП 1.3.1285-03 «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)».
3. Постановление Главного государственного санитарного врача Российской Федерации от 23 марта 2009 г. № 18 «Об утверждении санитарно-эпидемиологических правил СП 3.1.7.2492-09 «Профилактика чумы».
4. Постановление Главного государственного санитарного врача Российской Федерации от 9 июня 2009 г. № 43 «Об утверждении санитарно-эпидемиологических правил СП 3.1.1.2521-09 «Профилактика холеры. Общие требования к эпидемиологическому надзору за холерой на территории Российской Федерации».
5. Приказ Роспотребнадзора от 17 марта 2008 г. № 88 «О мерах по совершенствованию мониторинга за возбудителями инфекционных и паразитарных болезней».
6. МУК 4.2.2218-07 «Лабораторная диагностика холеры», утверждены Роспотребнадзором 31 мая 2007 г.
7. МУ 3.1.3.2355-08 «Организация и проведение эпидемиологического надзора в природных очагах чумы на территории Российской Федерации», утверждены Роспотребнадзором 30 апреля 2008 г.
8. МУ 4.2.2831-11 «Лабораторная диагностика сапа», утверждены Роспотребнадзором 14 января 2011 г.
9. МУК 4.2.2940-11 «Порядок организации и проведения лабораторной диагностики чумы для лабораторий территориального, регионального и федерального уровней», утверждены Роспотребнадзором 14 июля 2011 г.
10. МУК 4.2.2870-11 «Порядок организации и проведения лабораторной диагностики холеры для лабораторий территориального, регионального и федерального уровней», утверждены Главным государственным санитарным врачом Российской Федерации 25 мая 2011 г.
Приложение 1
1. Суховоздушный термостат, обеспечивающий температуру (37 ± 1) °С.
2. Прибор для определения оптической плотности микробной взвеси.
3. Автоклав.
4. pH-метр с диапазоном pH 0 - 14.
5. Весы электронные 2 класса точности с пределом измерений до 600 г.
6. Боксы биологической безопасности II и III классов защиты.
7. Настольный бокс с бактерицидной лампой (ПЦР-бокс, УФ-бокс).
8. Холодильник с камерами, поддерживающими температуру от 2 до 8 °С и не выше минус 16 °С. Возможно отдельное использование холодильника с камерой, поддерживающей температуру от 2 до 8 °С, и морозильника с камерой, поддерживающей температуру не выше минус 16 °С.
9. Микроволновая печь.
10. Твердотельные термостаты для микропробирок 1,5/0,5 мл с диапазоном рабочих температур 25 - 100 °С.
11. Вортексы (микроцентрифуги/встряхиватели).
12. Магнитная мешалка.
13. Водяная баня.
14. Водяная баня-шейкер со штативом для пробирок объемом 50 мл.
15. Сухожаровой шкаф с диапазоном температур 10 - 250 °С.
16. Аквадистиллятор.
17. Деионизатор.
18. Комплект дозаторов механических или электронных с интервалами дозируемых объемов (0,5 - 10 мкл, 5 - 50 мкл, 10 - 100 мкл, 20 - 200 мкл, 100 - 1000 мкл).
19. Ультрафиолетовый трансиллюминатор, обеспечивающий излучение с длиной волны 320 или 280 нм.
20. Система гель-документирования, обеспечивающая цифровую обработку изображения.
21. Система для проведения гель-электрофореза в пульсирующем поле (PFGE).
22. Рибопринтер RiboPrinter.
23. Программное обеспечение для системы гель-документирования.
24. Программное обеспечение для филогенетического анализа данных генотипирования и графического отображения полученных результатов.
25. Программное обеспечение (BioNumerics версия 6.0.).
Лабораторная посуда и расходные материалы
1. Колбы стеклянные мерные на 25, 50, 100, 250, 500 и 1000 мл.
2. Стаканы мерные полипропиленовые на 50, 100, 250, 500, 1000 мл.
3. Цилиндры мерные на 100, 200 и 1000 мл.
4. Чашки Петри стандартные диаметром 100 мм или пластмассовые одноразового применения диаметром 85 мм.
5. Пробирки стеклянные бактериологические.
6. Пипетки стеклянные мерные 1, 5, 10 мл.
7. Петли микробиологические.
8. Штативы для пробирок объемом 50, 5, 1,5 мл и для наконечников.
9. Штативы «рабочее место» для микропробирок объемом 1,5 мл.
10. Микроцентрифужные полипропиленовые пробирки с крышками объемом 1,5 мл.
11. Пробирки с винтовой горловиной объемом 1,5 мл, снабженной крышкой с петлей и кольцевой прокладкой, стерильные.
12. Пробирки с юбкой устойчивости и закручивающейся крышкой объемом 50, 5 мл.
13. Наконечники одноразовые для дозаторов с фильтром объемом до 10, 100, 200 и 1000 мкл.
14. Мерные цилиндры на 1 л, 250, 100, 50 мл.
15. Колбы конические для плавления агарозы.
16. Флаконы на 1 л, 500 мл с закручивающейся крышкой.
17. Плотики для водяной бани для пробирок объемом 1,5 мл.
18. Форма для заливки геля.
19. Платформа для заливки геля размером 21×14 см в комплекте с рамкой размером 21×14 см.
20. Держатель с гребенкой на 15 лунок.
21. «Крышка-сито» (Screened Plug Сар) для пробирок объемом 50 мл.
22. Лезвие (для нарезания агарозных блоков).
23. Шпатель.
24. Перчатки латексные, одноразовая защитная одежда, пакеты для автоклавирования.
Приложение 2
Реактивы:
1. ЭДТА динатривая соль, хч.
2. Трис-(оксиметил)аминометан, хч, осч, UltraPure.
3. Борная кислота, хч.
4. Натрий лаурилсаркозин (саркозил), Molecular Biology Grade.
5. Хлорид натрия, хч.
6. Гидроокись натрия, хч.
7. Соляная кислота, хч.
8. Бромид этидия.
9. Агароза для пульс-электрофореза (например, «SeaKemGold Agarose»).
10. Вода дистиллированная по ГОСТ 6709-72.
11. Раствор хлористого натрия 0,85 %-й, ГОСТ 4233-77.
12. Вода бидистиллированная стерильная.
13. Вода без нуклеаз (стерилизованная фильтрацией).
14. Этиловый спирт.
15. Среды для культивирования возбудителей опасных инфекционных болезней.
Ферменты:
1. Протеиназа K.
2. Эндонуклеаза рестрикции CciNI (изошизомер NotI).
3. Эндонуклеаза рестрикции NotI.
4. Эндонуклеаза рестрикции SfiI.
5. Эндонуклеаза рестрикции XbaI.
Наборы:
1. Набор фермента PVU II, 48 тестов (например, «PVU II RIBOPRINTER KIT (17720601) when 1 kit purchased» или эквивалент).
2. Набор фермента ECO I, 48 тестов (например, «ECO I RIBOPRINTER KIT (17720533) when 1 kit purchased» или эквивалент).
3. Набор реагентов и материалов для рибопринтинга.
Приложение 3
1) 5 × ТВЕ буфер.
Приготовление: в 800 мл дистиллированной воды растворяют 54 г Трис-основания, 27,5 г борной кислоты, добавляют 20 мл 0,5 Моль раствора ЭДТА (pH 8,0), объем доводят до 1 л.
2) 10 × ТВЕ, pH ~ 8,3.
Состав: 0,89 Моль Трис-аминометан, 0,89 Моль борная кислота, 0,5 Моль ЭДТА.
Приготовление: 107,8 г Трис-аминометана, 55,03 г борной кислоты, 3,72 г ЭДТА, объем доводят до 1 л. Хранят при температуре 6 - 8 °С.
3) 0,5 × ТВЕ для проведения электрофореза.
Растворить 125 мл 10 × ТВЕ в 2350 мл бидистиллированной воды. Хранят при температуре плюс 6 - 8 °С.
4) 0,5 М раствор ЭДТА.
Для приготовления 0,5 Моль раствора ЭДТА-Na2 навеску соли массой 18,61 г, взвешенную на аналитических весах, помещают в химический стакан объемом 100 мл, добавляют 80 мл бидистиллированной воды, перемешивают на магнитной мешалке и доводят pH до 8,0 ± 0,1 посредством добавления 10 N раствора гидроокиси натрия (NaOH). После растворения кристаллов ЭДТА объем доводят бидистиллированной водой до 100 мл. Раствор хранят в темной полипропиленовой посуде при температуре (4 ± 1) °С в течение года.
5) 1 Моль трис-буфер (pH 8,0).
Для приготовления 1 Моль трис-буфера (pH 8,0 ± 0,1), навеску триса массой 12,1 г, взвешенную на аналитических весах, помещают в химический стакан объемом 100 мл, помещенный на магнитную мешалку, добавляют 95 мл бидистиллированной воды. После полного растворения соли доводят pH до 8,0 ± 0,1 добавлением 5 N соляной кислоты (НСl) и доводят объем бидистиллированной водой до 100 мл. Раствор хранят при температуре (4 ± 1) °С в течение года.
6) ТЕ-буфер.
Состав: Трис-НСl - 10 мМоль, ЭДТА - 1 мМоль, pH 8,0.
Приготовление: к 988 мл деионизованной воды добавить 10 мл 1 Моль раствора Трис-HCl и 2 мл 0,5 Моль раствора ЭДТА (pH 8,0), стерилизовать автоклавированием. Хранят при температуре (6 - 8) °С.
7) Стоковый раствор протеиназы K (20 мг/мл).
Растворить 20 мг протеиназы K в 1 мл бидистиллированной воды, приготовить аликвоты объемом 250 мкл. Хранить при температуре минус 20 °С; перед применением разморозить, встряхнуть на микроцентрифуге/встряхивателе.
8) Буфер для суспендирования клеток (типа CSB - Cell Suspension Buffer).
Смешать 2 мл 1 М Трис (pH 8,0) и 4 мл 0,5 М ЭДТА (pH 8,0), довести объем до 20 мл бидистиллированной водой. Хранить при температуре 4 °С.
9) Буфер для лизиса клеток (CLB - Cell Lysis Buffer).
Смешать 2,5 мл 1 М Трис (pH 8,0), 5 мл 0,5 М ЭДТА (pH 8,0) и 5 мл 10 % (либо 1,67 мл 30 %) N-лаурилсаркозина натрия, довести объем до 50 мл бидистиллированной водой.
10) Агароза 1 %-я для приготовления блоков (SeaKemGold).
В термостойкую колбу помещают 0,25 г агарозы, добавляют 25 мл ТЕ-буфера. Расплавляют агарозу на средней мощности СВЧ-печи с перемешиванием каждые 10 с до полного растворения кристаллов (для предотвращения повышения концентрации агарозы во время плавления рекомендуется перед помещением в СВЧ-печь взвесить колбу с агарозой и буфером, добавить 5 мл воды, затем плавить до достижения исходной массы). После расплавления используют для заливки блоков или готовят аликвоты для хранения при температуре 4 °С.
11) Агароза 1 %-я для проведения пульс-электрофореза (SeaKemGold).
В термостойкую колбу помещают 1,5 г агарозы, добавляют 150 мл ТЕ-буфера. Расплавляют агарозу на средней мощности СВЧ-печи с перемешиванием каждые 10 с до полного растворения кристаллов. После расплавления раствор агарозы заливают в форму для геля.