Инструкция по микробиологическому контролю
производства высокостойких безалкогольных напитков
ИК 10-5031536-105-91
(утв. НПО НМВ 28 июня 1991 г.)
Срок введения с: 1 января 1992 г.
впервые
Общие положения
Микробиологический контроль на производстве по выпуску высокостойких напитков (со сроком хранения до 6 месяцев) заключается в проверке качества готовой продукции и эффективности проводимых санитарно-гигиенических мероприятий.
Контроль осуществляется путем определения микроорганизмов - показателей санитарно-гигиенического состояния производства и микроорганизмов, вызывающих порчу напитков. Для оценки качества сырья, полуфабрикатов, готовых напитков и санитарно-гигиенического состояния производства в Инструкции даны микробиологические нормативы. Соответствие продукции микробиологическим нормативам является гарантией биологической стойкости напитков в течение 6 месяцев.
В случае их несоответствия принимаются меры по установлению и ликвидации причин обсеменения производства, контролю параметров мойки и дезинфекции оборудования, технологических процессов производства и предотвращению тем самым снижения качества напитков.
При организации микробиологического контроля следует руководствоваться настоящей Инструкцией по микробиологическому контролю высокостойких напитков, инструкцией санитарно-микробиологического контроля пивоваренного и безалкогольного производства и технологическими инструкциями по производству напитков.
Работу по микробиологическому контролю выполняют микробиологические предприятия. Результаты анализов регистрируют в рабочих журналах.
В целях улучшения санитарно-гигиенических и технологических режимов производства напитков микробиологическую оценку качества готовой продукции, мойки и дезинфекции следует включать в оценку качества труда цехового персонала при выплате премиальных доплат.
1.0. Подготовка к микробиологическим работам бокса, посуды, материалов, реактивов и питательных сред
1.1. Общие требования к микробиологическому боксу по технологической инструкции "Санитарно-микробиологического контроля пивоваренной и безалкогольной промышленности", 1985 г.
1.2. Подготовка посуды и материалов
1.2.1. Всю новую посуду, предназначенную для микробиологических работ, кипятят в подкисленной воде (раствор соляной кислоты объемной долей 1 - 2 %) в течение 15 мин и затем ополаскивают дистиллированной водой.
1.2.2. Посуду с питательными средами после подсчета на них кишечных палочек, дрожжей, плесеней обеззараживают перед мойкой путем стерилизации в автоклаве при 121 °С в течение 30 мин или кипячением в течение 1 часа.
1.2.3. Способы и режимы стерилизации проводятся в соответствии с технологической инструкцией санитарно-микробиологического контроля пивоваренной и безалкогольной промышленности, 1985 г.
Стерильную посуду хранят в плотно закрывающихся шкафах или ящиках с крышками.
Срок хранения стерильной посуды - не более 30 суток.
1.2.4. Изготовление ватных тампонов для взятия смывов с оборудования.
Ватный тампон должен быть закреплен на проволоке или деревянной палочке, пропущенной через ватную пробку.
Тампон вместе с пробкой вставляют в пробирку с 5 см3 питьевой воды (тампон не должен касаться жидкости), и все вместе стерилизуется в автоклаве при (121 ± 1) °С в течение 20 мин.
1.2.5. Подготовка ватных стерильных пробок. Пробки используют для отбора вымытых бутылок. Ватные пробки укладываются в чашки Петри по 5 - 8 штук или по 2 - 3 штуки, заворачивают в бумагу. Стерилизуют в сушильном шкафу в течение 3 часов при (150 ± 1) °С.
1.3. Приготовление растворов, реактивов
1.3.1. Реактивы для окраски по Граму (модификация Г.П. Калины).
Приготовление реактива 1.
В 100 см3 96 % этилового спирта растворяют 0,5 г кристаллического фиолетового.
Приготовление реактива 2.
К 96 см3 спиртового раствора йодистого калия с массовой концентрацией 5 г/дм3 добавляют 2 см3 спиртового раствора основного фуксина с массовой концентрацией 50 г/дм3 и 2 см3 спиртового раствора йода с массовой концентрацией 50 г/дм3.
Йодистый калий растворяют в спирте в водяной бане при температуре (45 ± 5) °С при постоянном помешивании.
1.3.2. Приготовление реактивов из метиленового голубого:
а) приготовление основного спиртового раствора метиленового голубого.
10 г метиленового голубого смешивают со 100 см3 96 % этилового спирта. Раствор ставят в термостат при температуре 37 °С на 24 ч, а затем фильтруют в термостате при той же температуре. Срок хранения основного раствора метиленового голубого в термостате при температуре 37 °С - не более 3 месяцев при условии герметичной укупорки;
б) приготовление рабочего раствора метиленового голубого.
Основной раствор помещают в водяную баню при температуре 45 °С на 5 - 10 мин, перемешивают до полного растворения кристаллов. Затем быстро охлаждают до температуры 20 °С и 5 см3 этого раствора прибавляют к 195 см3 дистиллированной воды. Смесь хорошо перемешивают. Срок хранения рабочего раствора метиленового голубого - не более 7 суток при температуре не выше 9 - 10 °С;
в) приготовление раствора метиленового голубого для окраски препаратов.
К 30 см3 основного спиртового раствора метиленового голубого прибавляют 100 см3 дистиллированной воды и 1 см3 раствора гидроокиси калия с массовой концентрацией 10 г/дм3.
1.3.3. Приготовление карболового раствора кристаллического фиолетового для окраски препаратов.
1 г красителя кристаллического фиолетового растирают в ступке с 2 г кристаллической карболовой кислоты до кашицы, прибавляют небольшими порциями 10 см3 96 % этилового спирта. Таким образом получают основной раствор для приготовления рабочего раствора.
К 10 см3 основного карболового раствора кристаллического фиолетового добавляют 90 см3 дистиллированной воды. Тщательно перемешивают.
Растворы хранят в темном флаконе под притертой пробкой.
1.3.4. Раствор двууглекислого натрия для нейтрализации напитка.
10 г двууглекислого натрия помещают в мерную колбу вместимостью 100 см3, растворяют в дистиллированной воде, доводят объем раствора до метки. Раствор разливают в пробирки и стерилизуют при (121 ± 1) °С в течение 15 мин.
1.3.5. Водно-спиртовой раствор с концентрацией спирта 70 %.
Для получения 70 % водно-спиртового раствора необходимо на 70 см3 96 % спирта добавить 26 см3 дистиллированной воды.
1.4. Приготовление питательных сред
1.4.1. Среды для обнаружения бактерий группы кишечных палочек (БГКП).
1.4.1.1. Среда Кесслер (с лактозой) двойной концентрации (все компоненты увеличены в 2 раза).
К 1 дм3 водопроводной воды добавляют 20 г пептона и 100 см3 стерильной желчи (желчь бычья или других сельскохозяйственных животных). Смесь кипятят на водяной бане при помешивании 20 - 30 мин. Затем фильтруют ее через ватно-марлевый фильтр, добавляют 5,0 г лактозы, доводят объем водой до 1 дм3. Устанавливают pH 7,4 - 7,6, используя 1 н растворы NaOH или HCl и проверяя значение pH на потенциометре или универсальной индикаторной бумагой. Добавляют 8 см3 водного раствора генцианового фиолетового с массовой концентрацией 10 г/дм3, разливают во флаконы с поплавками по 100 см3 и стерилизуют при (121 ± 1) °С в течение 10 мин. Готовая среда должна иметь темно-фиолетовый цвет.
1.4.1.2. Сухая среда Кесслер (модифицированная) производства Литовского НИИМС (г. Каунас) по ТУ 49-365-76 с учетом изм. № 2 от 01.05.85.
Приготовление среды для посева проводят согласно прописи на этикетке. Для приготовления среды двойной концентрации навеску сухой среды увеличивают в 2 раза.
1.4.1.3. Среда Эндо.
Среда Эндо выпускается в сухом виде Дагестанским НПО "Питательные среды". Ее следует готовить согласно прописи, указанной на этикетке банки. Изготовленные и разлитые в стерильные чашки Петри среды можно хранить при температуре 4 °С до 10 сут.
1.4.2. Среда для определения общего количества бактерий (мезофильных аэробных и факультативно-анаэробных микроорганизмов).
Сухой питательный агар производства Дагестанского НПО "Питательные среды". Приготовление среды для посева проводят согласно прописи на этикетке.
1.4.3. Среды для обнаружения дрожжей и плесневых грибов.
1.4.3.1. Солодовое сусло с массовой долей сухих веществ (7,5 ± 0,5) %.
Сусло фильтруют через полотно или фильтровальную бумагу и стерилизуют 30 мин в автоклаве при (112 ± 1) °С. Затем сусло декантируют. В сусле сахарометром определяют содержание сухих веществ. Сусло разбавляют водой до массовой доли сухих веществ (7,5 ± 0,5) %, разливают в колбы и стерилизуют при (116 ± 1) °С в течение 20 мин.
1.4.3.2. Солодовый агар.
К 1 дм3 солодового сусла с массовой долей сухих веществ (7,5 ± 0,5) % прибавляют 20 г агара. Среду нагревают до полного растворения агара. Разливают среду в колбы, пробирки и стерилизуют при (116 ± 1) °С в течение 20 мин.
1.4.4. Приготовление стерильной воды.
Питьевую воду разливают в пробирки по 10 см3 (для промывки мембранных фильтров) и по 100 см3 в колбы (для споласкивания мытых бутылок) и стерилизуют при (112 ± 1) °С в течение 30 мин.
1.4.5. Качество вновь приготовленных питательных сред проверяют путем параллельного посева одних и тех же проб продукта на новую среду и на среду от партии, с которой ранее проводилась работа. Качество вновь приготовленной среды считают удовлетворительным, если при подсчете количество выросших на ней колоний оказывается близким к количеству, полученному при использовании контрольной среды.
1.4.6. Плотные питательные среды в холодильнике могут храниться до 3 месяцев, жидкие питательные среды - 10 - 14 дней.
Для проверки стерильности питательных сред их следует поставить в термостат при 30 °С на 48 ч. Если после этого на плотных питательных средах не обнаруживается колоний микроорганизмов, а в жидких средах нет помутнения среды или осадка, свидетельствующих о росте микроорганизмов, питательные среды считаются стерильными.
1.5. Рекомендуемый перечень оборудования, материалов и реактивов для микробиологических работ по "Инструкции санитарно-микробиологического контроля пивоваренного и безалкогольного производства", 1988 г.
2.0. Отбор проб, подготовка их к анализу
2.1. Отбор проб
2.1.1. Вода питьевая. Пробы воды отбираются из крана основной линии подачи воды. Выбирают часто используемые краны (в отделении водоподготовки, купажном и цехе розлива). Сливные краны с большим отверстием не пригодны для отбора воды из-за доступа воздуха при отборе пробы. Необходимо избегать протекающих кранов и кранов, подверженных загрязнению, например, расположенных близко к полу.
Перед отбором пробы кран очищают тампоном, смоченным в 70 % спирте, и фламбируют. При фламбировании кран необходимо нагревать до такой температуры, чтобы первые порции воды при открытии крана закипали.
Кран открывают и спускают воду в течение 1 мин. Это дает возможность стечь стоячей воде и получить среднюю пробу. После чего заполняют водой стерильную бутылку в количестве 0,5 л.
2.1.2. Обработанная вода. Воду отбирают из трех точек:
- после угольного фильтра;
- после полировочного фильтра;
- перед сатуратором в цехе розлива.
Отбор производят аналогичным способом, описанным выше.
2.1.3. Сахарный сироп. Пробу сиропа отбирают после фильтр-пресса (на выходе). Предварительно пробоотборный кран промывают стерильной водой для удаления следов сахара, который может карамелизироваться при фламбировании крана. После чего протирают 70 % спиртом, фламбируют, спускают струю сиропа (не менее 5 литров) и отбирают в стерильную колбу.
2.1.4. Купажный сироп. Отбор проб производят из трех точек:
- емкость для приготовления;
- емкость для хранения (напорная емкость);
- из трубопровода перед сатуратором (цех розлива).
Отбор проб производят аналогичным способом, описанным выше для сахарного сиропа. Из емкостей при отсутствии пробоотборного крана пробу отбирают фламбированным пробоотборником.
2.1.5. Концентрированные соки, сокосодержащие концентраты.
Из отобранной упаковки (бочки) стерильным пробоотборником или ложкой после тщательного перемешивания (включая и поверхностный слой) отбирают для анализа 50 - 100 см3 пробы. Отобранную пробу помещают в стерильный стакан (колбу).
2.1.6. Готовый напиток. Отбирают напиток с линии розлива в количестве 11 бутылок:
5 бут. - для определения дрожжей и плесневых грибов в напитке в день розлива;
1 бут. - для определения БГКП в напитке в день розлива;
5 бут. - для определения дрожжей и плесневых грибов в напитке после 2-недельного его хранения при 20 °С.
2.2. Отбор проб для оценки качества мойки и дезинфекции оборудования
2.2.1. Мытые бутылки. С помощью фламбированного пинцета берут стерильные ватно-марлевые пробки и закрывают ими горловины пяти мытых бутылок, выходящих из бутылкомоечной машины. Отбор производят по одной бутылке из каждого ряда.
2.2.2. Последние смывные воды после мойки и дезинфекции оборудования.
Пробы отбирают из следующих точек:
- емкость для сахарного сиропа;
- емкость для купажного сиропа;
- трубопровод перед сатуратором;
- трубопровод из сатуратора.
Пробоотборные краны обрабатывают 70 % спиртом, фламбируют и отбирают пробы в количестве 0,5 л.
2.2.3. Разливочная машина. Последние промывные воды отбирают из разливочных рожков после мойки и дезинфекции машины. Пробы воды отбирают из нескольких рожков (не менее 10 % рожков от общего количества их в машине). Из каждого рожка проба отбирается в отдельную стерильную бутылку.
2.2.4. Взятие смывов с насосов для перекачки сиропов*.
Отсоединяют фланцы входного и выходного патрубков насоса, после чего берут смывы с внутренней поверхности насоса. Смывы берут стерильным увлажненным ватным тампоном, закрепленном на проволочке или деревянной палочке (см. п. 1.2.4). Непосредственно перед взятием смыва тампон увлажняют наклонением пробирки или опусканием тампона вниз. После взятия смыва пробку с тампоном вновь вставляют в пробирку так, чтобы тампон погрузился в воду.
_____________
* Смывы отбирают только с насосов, имеющих устройство для их взятия.
2.2.5. Микробиологические анализы отобранных проб проводят не более чем через 4 ч с момента отбора проб. Пробы хранят в холодильнике.
2.3. Подготовка проб к анализу
2.3.1. Отобранные пробы перед исследованием перемешивают.
2.3.2. Готовый напиток. Перед взятием пробы напитка из бутылки кроненпробку протирают ватным тампоном, смоченным в 70 % спирте. Затем фламбированным ключом быстро снимают кроненпробку. Горловину открытой бутылки фламбируют над пламенем спиртовки и отбирают необходимый для анализа объем напитка.
Не допускается фламбировать закупоренную кроненпробкой бутылку, т.к. она может взорваться.
2.3.3. Освобождение напитка от диоксида углерода и нейтрализация.
Для этого напиток отбирают в стерильную колбу стерильным цилиндром или пипеткой в количестве 100 см3 (нормируемый объем напитка для определения отсутствия бактерий группы кишечных палочек) и закрывают ватной пробкой. Колбу с напитком помещают в водяную баню с температурой 30 - 35 °С. Частым легким встряхиванием колбы освобождаются от диоксида углерода, после чего проводят нейтрализацию напитка.
Для этого стерильным раствором двууглекислого натрия с массовой концентрацией 100 г/дм3 (п. 1.3.4) доводят до pH напитка 7,0. Реакцию среды проверяют при помощи индикаторной бумаги, для этого стерильной стеклянной палочкой или пипеткой наносят капли исследуемого напитка на полоску индикаторной бумаги и полученную окраску немедленно сравнивают со шкалой.
3.0. Техника выполнения анализа методом мембранных фильтров
3.1. Подготовка мембранных фильтров
Мембранные фильтры "Владипор" марки MDA-MA № 4,5 или 5, проверенные на отсутствие механических повреждений, помещают в стеклянный стакан (небольшую эмалированную емкость, медицинский стерилизатор) с дистиллированной водой, нагретой до 80 °С, и медленно доводят до кипения на слабом огне, после чего воду заменяют и кипятят 10 мин. Для более полного удаления оставшихся растворителей из фильтров смену воды и последующее кипячение повторяют 2 - 3 раза, после чего они готовы к работе. Во избежание деформации фильтра во время кипячения, в стакан помещают стеклянные бусы или короткие стеклянные палочки с закругленными концами. Хранить фильтры можно в дистиллированной воде, перед использованием их вновь стерилизуют кипячением.
Для определения бактерий используют фильтр № 4 или № 5, для дрожжей и плесеней - № 6.
3.2. Подготовка фильтровального аппарата к анализу
Фильтровальный аппарат (фильтр Зейтца) в собранном виде заворачивают в бумагу и стерилизуют в автоклаве при (121 ± 1) °С в течение 20 - 30 мин.
Для фильтрации стерильный аппарат вставляют в вакуумную колбу и вакуумным шлангом присоединяют к насосу. Снимают воронку аппарата и фламбированным пинцетом осторожно вынимают из стакана стерильный мембранный фильтр. Для исключения возможного повреждения поверхности мембраны следует брать ее пинцетом только за кромки. Фильтр кладут на столик аппарата, устанавливают воронку и закрепляет ее держателем.
3.2.1. Фламбирование пинцета (стерилизация пламенем). Концы пинцета погружают в 96 % этиловый спирт. Затем вынимают и поджигают в пламени спиртовки. После остывания в течение 4 - 5 сек. используют стерилизованный пинцет.
3.3. Фильтрование
Исследуемый объем пробы выливают в воронку и включают кнопку насоса.
Пробы в количестве 100 см3 и более отбирают стерильными цилиндрами, в количестве 10 см3 - стерильными пипетками.
Для фильтрации достаточно вакуума 0,3 - 1,0 кг/см3. После прохождения жидкости через фильтр колбу держат под вакуумом в течение 5 - 7 сек. (для полного удаления следов жидкости) и отключают.
Снимают воронку и с помощью фламбированного пинцета осторожно снимают фильтр. Для этого один конец пинцета подсовывают под фильтр вдоль его кромки.
Открывают чашку Петри с питательной средой и опускают, не переворачивая на нее фильтр. Накладывать фильтр следует так, чтобы между ним и поверхностью питательной среды не образовывались пузырьки воздуха. Для этого противоположный край фильтра (напротив пинцета) должен лечь на поверхность среды, а затем постепенно накладывается весь фильтр "накатом" на среду.
Поверхность фильтра с осевшими на нее бактериями должна быть обращена вверх. Чашку закрывают и на дне чашки под каждым фильтром делают надписи с указанием номера профильтрованной пробы. На одну чашку можно поместить 3 - 4 фильтра с условием, чтобы фильтры не соприкасались.
Перед фильтрацией следующей пробы столик и воронку прибора тщательно фламбируют. Для этого их протирают тампоном, смоченным в спирте и закрепленным на металлической палочке, после чего обжигают в пламени горящего тампона.
Кроме фламбирования фильтровального прибора можно перед следующей пробой проводить кипячение его в кастрюле с водой, которая устанавливается недалеко от рабочего места. Вода должна быть заранее доведена до кипения и полностью покрывать фильтр. Кипячение проводят в течение 1 - 2 минут.
Вынимается стерильный фильтр фламбированными щипцами.
4.0. Микробиологические нормативы для оценки качества сырья, полуфабрикатов, готовых напитков и санитарно-гигиенического состояния производства
Микробиологические показатели готовой продукции зависят от ряда факторов: качества обработанной воды, соблюдения технологических режимов производства напитков, мойки и дезинфекции оборудования и др.
Выпуск продукции в соответствии с микробиологическими нормативами определяет ее качество и свидетельствует о высоком санитарно-гигиеническом уровне производства.
Предельно допустимые количества микроорганизмов для обработанной воды, полуфабрикатов, готовых напитков и для оценки санитарно-гигиенического состояния производства приведены в табл. 1.
В готовом напитке для определения бактерий группы кишечных палочек (БГКП) впервые вводится нормированный объем напитка 100 см3, в котором БГКП (колиформные бактерии) должны отсутствовать. Этот показатель вводится вместо ранее определяемого коли-индекса напитка (количество бактерий группы кишечных палочек в 1 кв. дм воды) по ГОСТ 2874-82 (ГОСТ 18963-73) "Вода питьевая. Методы санитарно-бактериологического анализа".
Аналогичные показатели определения БГКП (колиформных бактерий) введены для обработанной воды, используемой в производстве высокостойких напитков.
В обработанной воде определяется общее количество мезофильных аэробных и факультативно-анаэробных микроорганизмов в 100 см3, вместо ранее определяемого в 1 см3.
Для сиропов, готовых напитков и для оценки качества мойки и дезинфекции оборудования введены нормативы на дрожжи и плесневые грибы для объемов от 10 до 100 см3.
Предельно допустимое содержание микроорганизмов в нормируемых объемах выражается количеством колониеобразующих единиц - КОЕ.
Превышение содержания микроорганизмов в указанных объемах не гарантирует сохранение качества напитков в процессе их хранения.
Заводские лаборатории осуществляют контроль всех показателей, представленных в табл. 1, за исключением определения в готовом напитке патогенных микроорганизмов, в т.ч. сальмонелл.
Определение патогенных микроорганизмов проводят в нормируемом объеме напитка - 100 см3, вместо ранее определяемого в 25 см3. Патогенные микроорганизмы, в т.ч. сальмонеллы, не допускаются в 100 см3.
Микробиологические нормативы для оценки качества сырья, полуфабрикатов, готовых напитков и санитарно-гигиенического состояния производства
|
Наименование пробы (продукта) |
Периодичность |
Высеваемый объем для определения группы микроорганизмов, см3 |
Предельно допустимое кол-во микроорганизмов в высеваемом объеме |
||||
|
дрожжи, плесневые грибы |
кол-во мезофильных, аэробных и факультативноанаэробных микроорганизмов |
БГКП (колиформные бактерии) |
дрожжи, плесневые грибы |
кол-во мезофильных, аэробных и факультативно-анаэробных микроорганизмов |
БГКП (колиформные бактерии) |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Питьевая вода (по ГОСТ 2874-82) |
ежемесячно |
- |
1,0 |
333 |
- |
100/1 см3 |
Коли-индекс |
|
Обработанная вода после угольного фильтра |
еженедельно |
- |
10 |
100 |
- |
10/10 см3 |
Отсутствие в 100 см3 |
|
Обработанная вода после полировочного фильтра |
еженедельно |
- |
100 |
100 |
- |
10/100 см3 |
Отсутствие в 100 см3 |
|
Обработанная вода перед сатуратором |
еженедельно |
100 |
- |
- |
15 |
- |
- |
|
Сахарный сироп |
еженедельно |
10 |
- |
- |
10 |
- |
- |
|
Концентрированные соки, сокосодержащие концентраты |
еженедельно |
10 |
- |
- |
Отсутствие в 10 см3 |
- |
- |
|
Купажный сироп: |
еженедельно |
|
|
|
|
|
|
|
- купажная емкость |
|
10 |
- |
- |
10 |
- |
- |
|
- напорная емкость |
|
10 |
- |
- |
10 |
- |
- |
|
Купажный сироп из трубопровода перед сатуратором |
еженедельно |
10 |
- |
- |
5 |
- |
- |
|
Готовый напиток: |
|
|
|
|
|
|
|
|
- в день розлива** |
еженедельно |
100 |
- |
100 |
15 |
- |
БГКП отсутствие в 100 см3, сальмонеллы в <...> не допускаются |
|
- после 2-х недель хранения |
|
100 |
- |
- |
15 |
- |
- |
|
Оценка санитарногигиенического состояния производства: |
|
|
|
|
|
|
|
|
Мытые бутылки |
еженедельно |
100 см3 воды |
- |
100 см3 воды |
15/100 см3 |
- |
Отсутствие в 100 см3 |
|
Промывные воды: |
|
|
|
|
|
|
|
|
- фильтр-пресс для фильтрации сахарного сиропа |
еженедельно |
100 |
- |
- |
15 |
- |
- |
|
- купажные емкости |
еженедельно |
100 |
- |
- |
15 |
- |
- |
|
Промывные воды из разливочной машины |
еженедельно |
100 |
- |
- |
15 |
- |
- |
|
Трубопроводы |
еженедельно |
100 |
- |
100 (ежемесячно) |
15 |
- |
Отсутствие в 100 см3 |
|
Смывы с насосов*** (смыв со 100 см3) |
еженедельно |
- |
- |
- |
10 |
- |
- |
______________
* При эпидемиологическом неблагополучии в регионе по кишечным инфекциям анализ воды проводится не реже 1 раза в 2 недели.
** В готовом напитке проводится анализ на патогенные микроорганизмы один раз в квартал. Патогенные микроорганизмы, в т.ч. сальмонеллы, не допускаются.
*** Смывы отбирают только с насосов, имеющих устройство для их взятия.
Анализ на патогенные микроорганизмы проводят санитарно-эпидемиологические станции.
5.0. Методы анализа
5.1. Определение бактерий группы кишечных палочек (колиформных бактерий)
5.1.2. Сущность метода
В соответствии с принятой международной номенклатурой к бактериям группы кишечных палочек (БГКП) отнесены грамотрицательные, не образующие спор палочки, сбраживающие лактозу с образованием кислоты и газа при температуре 37 °С в течение 24 - 48 ч, в основном являющиеся представителями родов Echerichia, Citrobacter, Enterobacter, Klebsiella, Serratia (т.е. учитываются, как цитратотрицательные, так и цитроположительные варианты БГКП).
Определение БГКП (колиформных бактерий) в напитках производят прямым посевом в питательную среду или методом мембранных фильтров.
5.1.2. Подготовка к анализу.
Для определения БГКП (колиформных бактерий) в напитке прямым посевом в питательную среду его освобождают от диоксида углерода и нейтрализуют (по 2.3.3). При использовании для посева метода мембранных фильтров освобождение от диоксида углерода и нейтрализацию напитка не производят.
БГКП (колиформные бактерии) в напитках с мякотью плодов определяют только прямым посевом.
5.1.3. Проведение анализа.
Количество засеваемой пробы определяется нормируемым объемом. В табл. 2 даны нормируемые объемы исследуемых проб для определения отсутствия бактерий группы кишечных палочек.
|
Наименование пробы |
Засеваемый объем, см3 |
|
Готовый напиток |
100 |
|
Обработанная вода после угольного фильтра |
100 |
|
Обработанная вода после полировочного фильтра |
100 |
|
Смывная вода с оборудования |
100 |
|
Смывная вода с мытых бутылок |
100 |
5.1.4. Прямой посев.
Подготовленную пробу напитка в количестве 100 см3 засевают в среду Кесслер с лактозой двойной концентрации, разлитую по 100 см3 во флаконы с поплавками (приготовление среды см. п. 1.4.1.1). Посев производят в 2-х повторностях.
Посевы помещает в термостат при (37 ± 1) °С на 24 ч.
При отсутствии признаков роста на среде Кесслер с лактозой (газообразование или помутнение) среды дают заключение об отсутствии БГКП (колиформных бактерий) в 100 см3 и о соответствии исследуемого образца нормативу на БГКП (колиформных бактерий). При наличии признаков роста - газообразования, помутнения среды Кесслер с лактозой - для окончательного заключения о наличии в продукте БГКП из флаконов производят высев на чашки со средой Эндо. Высев производят с таким расчетом, чтобы получить отдельные колонии, для чего берут петлей посевной материал и проводят посев частым штрихом. Перед посевом дно чашки со средой Эндо делят на четыре сектора. Посев из каждого флакона со средой Кесслер с лактозой производят на отдельный сектор. Лучшие результаты получают при посеве на отдельную чашку.
Чашки с посевами помещают крышками вниз в термостат при (37 ± 1) °С на 18 - 24 ч.
5.1.5. Учет результатов.
При отсутствии на среде Эндо колоний, типичных для бактерий группы кишечных палочек (колиформных бактерий) - красных с металлическим блеском или без него, роговых и бледно-розовых - засеянный объем продукта считается незагрязненным ими, т.е. исследуемый продукт соответствует нормативу на БГКП (колиформных бактерий).
При наличии на среде Эндо типичных для кишечных палочек (колиформных бактерий) колоний их продолжают изучать.
При обнаружении на чашках со средой Эндо мелких бесцветных колоний микробиолог лаборатории должен указанные чашки передать в лабораторию санитарно-эпидемиологической станции для дальнейшего изучения.
Из изолированных колоний, характерных или подозрительных на БГКП, делают препараты, окрашивают их по Граму и микроскопируют.
Для приготовления препарата на чистое и охлажденное после фламбирования предметное стекло наносят петлей небольшое количество культуры из исследуемой колонии, не размешивая в воде. Затем в каплю вносят петлей каплю реактива 1, приготовленного по п. 1.3.1. Смесь распределяют на участке примерно 1 см2, просушивают при (20 ± 2) °С и фиксируют, медленно пронося предметное стекло над пламенем горелки. На одном стекле можно готовить по шесть-восемь мазков, отделяя их один от другого линиями, проведенными с лицевой стороны стекла.
Препарат ополаскивают водой и тщательно просушивают фильтровальной бумагой.
После просушивания на препарат наносят с избытком реактив 2 (п. 1.3.1) так, чтобы жидкость покрыла всю поверхность стекла. Продолжительность окрашивания 0,51 мин. После окрашивания препарат быстро ополаскивают проточной водой, направляя струю под углом на стекло. Препарат просушивают фильтровальной бумагой и просматривают под микроскопом с иммерсионной системой. Микробы, красящиеся по Граму, будут темно-фиолетового цвета, не красящиеся по Граму (бактерии группы кишечных палочек) - красного цвета.
Обнаружение грамотрицательных, не содержащих спор, палочек указывает на наличие БГКП (колиформных бактерий) в анализируемом объеме продукта и несоответствие его микробиологическому нормативу.
При обнаружении БГКП только в одной из повторностей - анализ следует повторить. Если БГКП будут вновь обнаружены в одной из повторностей, то это свидетельствует о несоответствии продукта микробиологическому нормативу.
5.2. Определение общего количества мезофильных аэробных и факультативно-анаэробных микроорганизмов (общее количество бактерий)
5.2.1. Сущность метода.
Метод основан на количественном подсчете колоний микроорганизмов, вырастающих на плотном питательном агаре, при температуре (30 ± 1) °С в течение 72 ч.
5.2.2. Подготовка к анализу.
Анализ проводят методом мембранных фильтров. Техника выполнения анализа по п. 3.0.
Перед выполнением анализа питательный агар (среда для определения общего количества бактерий) расплавляют на водяной бане (или используют свежеприготовленную среду), остужают до 50 °С и разливают в стерильные чашки Петри примерно по 10 - 12 см3, чтобы среда ровно покрывала дно чашки. Чашки оставляют для застывания среды, после чего используют для анализа.
5.2.3. Проведение анализа.
Количества засеваемых проб обработанной воды для определения общего количества мезофильных аэробных и факультативно-анаэробных микроорганизмов представлены в табл. 3.
Нормируемые объемы проб даны с учетом требований микробиологических нормативов.
Таблица 3
|
Наименование пробы |
Засеваемый объем, см3 |
|
Обработанная вода после угольного фильтра |
10 |
|
Обработанная вода после полировочного фильтра |
100 |
5.2.4. Посев.
В воронку фильтровального аппарата вносят нормируемый объем пробы воды. По окончании фильтрации мембранный фильтр переносят в чашки Петри на поверхность питательной среды для определения общего количества бактерий, приготовленной по п. 1.4.2. Чашки закрывают и на дне чашки против фильтра ставят номер пробы. Из каждой пробы делают посев в двух повторностях.
5.2.5. Выращивание.
Чашки с фильтрами помещают крышками вниз в термостат при 30 °С на 72 ч. Чашки с посевами распределяют в термостате таким образом, чтобы расстояние между стойками чашек, а также и стенками термостата было не менее 3 см.
Допускается предварительный учет через 48 ч с последующим окончательным учетом еще через 24 ч.
5.2.6. Учет и обработка результатов.
Количество выросших колоний подсчитывают на каждом фильтре, для более точного учета пользуются лупой с увеличением от 4 до 10 раз. После подсчета колоний на фильтре с параллельной пробой, находят среднее арифметическое число колоний.
Среднее арифметическое от подсчитанных количеств колоний, выросших на двух параллельных фильтрах, засеянных из одной пробы, является общим количеством мезофильных аэробных и факультативно-анаэробных микроорганизмов в нормируемом объеме пробы.
5.3. Метод определения дрожжей и плесневых грибов
5.3.1. Сущность метода.
Метод основан на посеве определенных количеств продукта в селективную агаризованную среду, культивировании посевов при (24 ± 1) °С в течение 5 суток, подсчете всех видимых колоний дрожжей и плесневых грибов, типичных по макро- и (или) микроскопической морфологии.
5.3.2. Подготовка к анализу.
Анализ проводят методом мембранных фильтров. Техника выполнения анализа по п. 3.0.
Перед выполнением анализа солодовый агар (среда для определения дрожжей и плесневых грибов) расплавляют на водяной бане (или используют свежеприготовленную среду), остужают до 50 °С и разливают в стерильные чашки Петри примерно по 10 - 12 см3, чтобы среда ровно покрывала дно чашки. Чашки оставляют для застывания среды, после чего используют для анализа.
5.3.3. Проведение анализа.
Количества засеваемых проб для определения дрожжей и плесневых грибов представлены в табл. 4. Объемы проб даны с учетом требований микробиологических нормативов.
Таблица 4
|
Наименование пробы |
Засеваемый объем, см3 |
|
Сахарный сироп |
10 |
|
Купажный сироп |
10 |
|
Концентрированные соки (осветленные), сокосодержащие концентраты |
10 |
|
Готовый напиток в день розлива |
100 |
|
Готовый напиток после 2-х недель хранения |
100 |
|
Обработанная вода, отобранная перед сатуратором |
100 |
|
Смывная вода с мытых бутылок |
100 |
5.3.4. Посев.
В воронку фильтровального аппарата вносят нормируемый объем исследуемой пробы. Для лучшей фильтрации проб сиропа в воронку вносят сначала 20 см3 стерильной воды, после чего 10 см3 исследуемой пробы сиропа. Предварительно перед фильтрацией концентрированный сок или сокосодержащий концентрат разводят стерильной водой в соотношении 1:5. По окончании фильтрации пробы (напиток, сироп, сок) фильтр промывают 2 см3 стерильной воды для удаления остаточных следов кислоты, консерванта. Затем фильтр переносят в чашки Петри на поверхность суслового агара.
Чашки закрывают и на дне против фильтра ставят номер пробы. Из каждой пробы делают посев в двух повторностях.
Чашки с посевами выдерживают в термостате при температуре (24 ± 1) °С течение 5 суток с предварительным учетом через двое суток.
Через 2 сут термостатирования проводят учет типичных колоний, а через 5 сут - окончательный, наблюдая за ростом дрожжей и плесневых грибов визуально, а при необходимости просматривают микроскопический препарат.
Если имеется один термостат и одновременно необходимо выращивать посевы для определения общего количества микроорганизмов при (20 ± 1) °С, а также дрожжей и плесневых грибов при (24 ± 1) °С, то допускается выращивание последних при (30 ± 1) °С
5.3.5. Обработка результатов.
Количество выросших колоний на каждой чашке подсчитывают, пользуясь лупой с увеличением в 4 - 10 раз.
Колонии дрожжей на сусловом агаре чаще всего имеют белый цвет, матовоблестящие, плотные с ровными краями.
Плесневые грибы имеют различную окраску (белую, черную, зеленоватую), с поверхности колонии покрыты пушистым мицелием.
Количество колоний дрожжей и плесневых грибов подсчитывают отдельно. После подсчета колонии на фильтре с параллельной пробой находят среднее арифметическое число колоний, которое и является количеством дрожжей или плесневых грибов в нормируемом объеме пробы. В микробиологическом нормативе (п. 4.0) указано общее количество дрожжей и плесневых грибов в нормируемом объеме. При анализе осветленных концентрированных соков, сокосодержащих концентратов отсутствие на мембране колоний дрожжей и (или) плесневых грибов свидетельствует о соответствии исследуемого продукта микробиологическому нормативу. Обнаружение роста дрожжей и (или) плесневых грибов указывает на его несоответствие нормативу.
5.4. Определение дрожжей и плесневых грибов в неосветленных концентрированных соках, соках с мякотью (накопительный метод)
Метод предназначен для исследования нормируемого объема продукта, в котором в соответствии с микробиологическим нормативом дрожжи и (или) плесневые грибы должны отсутствовать.
Определение проводят в два этапа:
1 - накопление микроорганизмов в солодовом сусле;
2 - выделение их (определение наличия) на солодовом агаре.
Схема проведения анализа представлена в приложении 1.
5.4.1. Проведение анализа.
В колбу с 50 мл стерильного солодового сусла, приготовленного по п. 1.4.3.1, вносят 10 мл исследуемого образца (нормируемый объем для определения отсутствия дрожжей и плесневых грибов). Посев проводят в двух повторностях.
Колбы с посевом помещают в термостат при температуре (24 ± 1) °С на 36 - 48 часов. Через 36 - 48 часов инкубации из колбы стерильной пипеткой берут 2 - 3 см3 среды с посевным материалом и делают посев в стерильную чашку Петри. Чашки должны быть заранее промаркированы. Не позднее чем через 15 мин в чашки добавляют (14 ± 1) см3 солодового агара (приготовленного по п. 1.4.3.2), охлажденного до (45 ± 1) °С и немедленно легкими круговыми движениями перемешивают.
После застывания чашки переворачивают вверх дном и ставят в термостат при температуре (24 ± 1) °С на 48 часов.
5.4.2. Обработка результатов.
Отсутствие на солодовом агаре типичных для дрожжей и плесневых грибов колоний (см. п. 5.3.5) свидетельствует о соответствии засеянного объема продукта микробиологическому нормативу.
Наличие роста дрожжей и (или) плесневых грибов свидетельствует о несоответствии продукта микробиологическому нормативу.
В 10 см3 неосветленных концентрированных соках (с мякотью) не допускается наличие дрожжей и плесневых грибов.
5.5. Метод микроскопирования
5.5.1. Сущность метода.
Метод основан на просмотре окрашенных препаратов под микроскопом для ориентировочной характеристики микрофлоры производства безалкогольных напитков.
5.5.2. Проведение анализа.
Для приготовления препарата из агаровой культуры на чистое предметное стекло наносят каплю стерильной воды, вносят в нее петлей культуру, тщательно перемешивают и растирают на площади 1 кв. см. Препарат высушивают при комнатной температуре, фиксируют на пламени спиртовки и красят метиленовым синим (по п. 1.3.2) или раствором карболового кристаллического фиолетового (по п. 1.3.3).
5.6. Контроль питьевой воды
Анализ воды следует проводить в соответствии с ГОСТ 8963-73 "Вода питьевая. Методы санитарно-бактериологического анализа".
Согласно ГОСТ 2874-82 в 1 см3 воды не должно содержаться более 100 бактерий, число бактерий группы кишечных палочек в 1 л воды (коли-индекс) не более 3.
Воду исследуют на вводе в установку по водоподготовке и в производственных цехах (купажном, разливочном).
5.7. Методы контроля санитарно-гигиенического состояния производства
5.7.1. Оборудование, трубопроводы. Контроль качества мойки и дезинфекции осуществляется непосредственно перед началом их работы и определяется путем отбора последних смывных вод. Правила отбора проб см. по п. 2.2.2.
В промывных водах проверяют содержание дрожжей и плесневых грибов (см. п. 5.3). Высеваемый объем промывных вод - 100 см3.
В 100 см3 допускается не более 15 клеток дрожжей и плесневых грибов.
Один раз в месяц после проведения общей дезинфекции в промывных водах определяют содержание БГКП (колиформных бактерий). Высеваемый объем промывных вод - 100 см3. БГКП должны отсутствовать в 100 см3 промывных вод.
В случае несоответствия требованиям нормативов по санитарной обработке оборудования необходимо проводить дополнительную мойку и дезинфекцию технологической линии.
5.7.2. Разливочная машина. Последние смывные воды отбирают из рожков разливочной машины. Пробы отбирают отдельно из нескольких рожков. Проверяется не менее 10 % рожков от общего количества их в машине.
В промывных водах проверяют содержание дрожжей и плесневых грибов (см. п. 5.3). Высеваемый объем промывных вод - 100 см3. Определение дрожжей и плесневых грибов проводят отдельно в каждой пробе, взятой с одного рожка.
После подсчета результатов посева находят среднее арифметическое число колоний.
В 100 см3 смывных вод разливочной машины допускается не более 15 клеток дрожжей и плесневых грибов.
5.7.3. Насосы для перекачки сахарного и купажного сиропов. Качество мойки и дезинфекции внутренней поверхности насосов определяют взятием смывов.
Смывы берут стерильными увлажненными ватными тампонами, закрепленными на палочке или проволоке (см. п. 1.2.4).
Смывы берут с внутренней поверхности приблизительно 100 см3. После взятия смыва пробку с тампоном вновь вставляют в пробирку так, чтобы тампон погрузился в воду. Проводят посев всей смывной воды. В смывной воде проверяют содержание дрожжей и плесневых грибов (см. п. 5.3).
В смывах, взятых с 100 см3, допускается не более 15 клеток дрожжей и плесневых грибов.
5.7.4. Бутылки. Для контроля чистоты мойки бутылок берут 100 см3 стерильной воды. Для анализа отбирают из бутылкомоечной машины 5 бутылок. В первую бутылку вливают 100 см3 стерильной воды. Бутылку держат над спиртовкой под углом 45°, чтобы не попала микрофлора из воздуха. Поворотом бутылки смачивают водой всю внутреннюю поверхность ее, после чего смывную воду сливают в следующую бутылку. Таким образом, одной порцией воды обрабатывают все 5 бутылок. Из последней бутылки воду выливают обратно в колбу или бутылку, в которой была вода.
Во всем объеме (100 см3) промывной воды определяют содержание дрожжей или плесневых грибов (см. п. 5.3), а также БГКП (см. п. 5.1).
В 100 см3 промывной воды допускается не более 15 клеток дрожжей и плесневых грибов, БГКП - отсутствуют.
5.7.5. Воздух. При проведении анализа открытые чашки Петри с сусловым агаром (для определения количества дрожжей и плесневых грибов) размещают во время работы в производственных помещениях (цех розлива, купажное отделение).
Чашки выдерживают 30 мин, затем закрывают и производят выращивание (см. п. 5.3.4).
Микробиологический показатель - не более 50 клеток дрожжей и плесневых грибов на чашке Петри.
5.8. Рекомендации по санитарной обработке оборудования
5.8.1. Моющие средства. Для мойки оборудования используют тринатрийфосфат (из расчета 14 г на 3,75 дм3 воды), кальцинированную или каустическую соду с массовой долей 2 %. Растворы моющих средств применяют только в горячем виде (температура не ниже 70 °С).
5.8.2. Дезинфектант. Для дезинфекции применяют растворы гипохлорита натрия.
5.8.3. Ежедневно.
По окончании работы все емкости (сахарные, купажные), фильтр-пресс, трубопроводы, разливочную машину обрабатывают моющим раствором. Промывают обработанной водой, после чего через всю линию пропускают хлорную воду с 6 - 8 мг/дм3 активного хлора, взятую с водоподготовки. Хлорную воду оставляют в трубопроводах до начала работы. Перед работой линии хлорную воду сливают, промывают отработанной водой.
Чистка полов и нижней части стен моющим раствором, споласкивание водой.
5.8.4. Еженедельно.
Всю линию обрабатывают моющим раствором. Промывают отработанной водой. Дезинфицируют раствором гипохлорита натрия с содержанием активного хлора 50 мг/дм3, выдерживают 30 мин. Промывают обработанной водой. В случае необходимости до начала работы трубопроводы заполняют хлорной водой с содержанием активного хлора 5 - 8 мг/дм3.
5.8.5. Ежемесячно.
Мойка и дезинфекция всей производственной линии по п. 5.8.4. Цех розлива - все <...>, конвейер - обрабатывают моющим раствором, споласкивают водой и дезинфицируют раствором гипохлорита натрия с содержанием активного хлора 80 мг/дм3, выдерживают 20 мин, после чего промывают водой.
Купажное отделение - протирают наружную часть всего оборудования, изготовленного из нержавеющей стали.
Приложение 1
Метод накопления в жидкой среде с последующим высевом на агаризованную среду
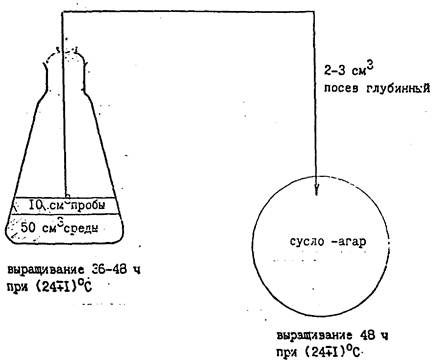
Приложение 2
Схема отбора проб для микробиологических анализов
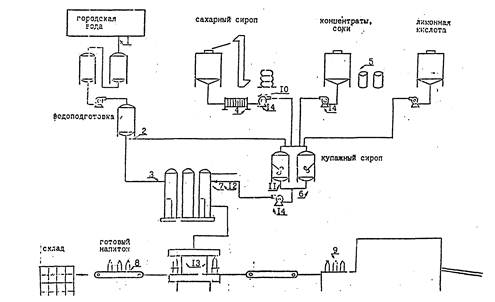
Условные обозначения
|
№ п/п |
Проба |
Место отбора пробы |
|
1 |
вода |
основной источник подачи городской воды |
|
2 |
вода |
после водоподготовки |
|
3 |
вода |
вход в сатуратор |
|
4 |
сахарный сироп |
после фильтр-пресса |
|
5 |
сокосодержащие концентраты, концентрированные соки |
упаковочная тара |
|
6 |
купажный сироп |
купажные емкости |
|
7 |
купажный сироп |
вход в сатуратор |
|
8 |
готовый напиток |
выход из разливочной машины |
|
9 |
чистая бутылка |
выход из бутылочной машины |
|
10 |
смывная вода |
сахарная емкость с фильтр-пресса |
|
11 |
смывная вода |
купажные емкости |
|
12 |
смывная вода |
трубопровод перед сатуратором |
|
13 |
смывная вода |
разливочная машина |
|
14 |
смывы с насосов |
внутренняя поверхность насоса для перекачки сиропов |
Журнал
микробиологического контроля производства высокостойких напитков
|
Дата анализа |
Исследуемый объект |
Место отбора пробы |
Высеваемый объем |
Количество микроорганизмов в исследуемом объеме |
Примечание и подпись микробиолога |
|||
|
дрожжи, плесневые грибы |
ОМЧ |
БГКП |
||||||
|
в день изготовления |
через 2 недели хранения |
|||||||
|
Заместитель генерального директора НПО НМВ |
В.А. Поляков |
|
Согласовано |
|
|
Заместитель Главного государственного санитарного врача СССР |
В.И. Чибураев |
|
28 июня 1991 г. |
|
СОДЕРЖАНИЕ