ФЕДЕРАЛЬНАЯ
СЛУЖБА ПО НАДЗОРУ
В СФЕРЕ ПРИРОДОПОЛЬЗОВАНИЯ
|
УТВЕРЖДАЮ Директор ФБУ «Федеральный центр ______________________ В.В. Новиков «10» 10 2014 г. |
ТОКСИКОЛОГИЧЕСКИЕ МЕТОДЫ КОНТРОЛЯ
МЕТОДИКА ИЗМЕРЕНИЙ КОЛИЧЕСТВА Daphnia magna Straus ДЛЯ
ОПРЕДЕЛЕНИЯ ТОКСИЧНОСТИ ПИТЬЕВЫХ, ПРЕСНЫХ
ПРИРОДНЫХ И СТОЧНЫХ ВОД, ВОДНЫХ ВЫТЯЖЕК ИЗ
ГРУНТОВ, ПОЧВ, ОСАДКОВ СТОЧНЫХ ВОД,
ОТХОДОВ ПРОИЗВОДСТВА И ПОТРЕБЛЕНИЯ
МЕТОДОМ ПРЯМОГО СЧЕТА
ПНД Ф
Т 14.1:2:3:4.12-06
Т 16.1:2:2.3:3.9-06
Методика допущена для целей
государственного
экологического контроля
МОСКВА
(издание 2014 г.)
СОДЕРЖАНИЕ
НАЗНАЧЕНИЕ И ОБЛАСТЬ ПРИМЕНЕНИЯ МЕТОДИКИ
Настоящий документ устанавливает методику определения острой токсичности проб вод (поверхностных пресных, грунтовых, питьевых, сточных) и водных вытяжек из грунтов, почв, осадков сточных вод, отходов производства и потребления по смертности тест-объекта Daphnia magna Straus в лабораторных условиях.
1. ПРИНЦИП МЕТОДИКИ
Методика основана на определении смертности дафний (Daphnia magna Straus) при воздействии токсических веществ, присутствующих в исследуемой пробе, по сравнению с контрольной культурой в среде, не содержащей токсических веществ. Количество живых и мертвых дафний определяется методом прямого счета.
Острое токсическое действие исследуемой воды или водной вытяжки из почв, осадков сточных вод и отходов на дафний устанавливается по их смертности (летальности) за определенный период экспозиции. Критерием острой токсичности служит гибель 50 % и более дафний за 48 часов в исследуемой пробе при условии, что в контрольном эксперименте все рачки сохраняют свою жизнеспособность.
В экспериментах по определению острого токсического действия устанавливают:
- среднюю летальную концентрацию отдельных веществ (кратность разбавления вод или водных вытяжек из почв, грунтов, осадков сточных вод и отходов), вызывающую гибель 50 % и более тест-организмов за 48-часовую экспозицию (ЛК50-48, ЛКР50-48);
- безвредную кратность разбавления вод, водных вытяжек, вызывающую гибель не более 10 % тест-объектов за 48-часовую экспозицию (БКР10-48).
2. МЕТРОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ МЕТОДИКИ
Настоящая методика обеспечивает получение результатов анализов с погрешностями, не превышающими значений, приведенных в таблице 1.
Диапазоны измерений определяемой характеристики, значения показателей повторяемости и воспроизводимости
|
Диапазон измерений количества дафний, шт. |
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости), σr, % |
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости), σR, % |
Предел повторяемости (относительное значение допускаемого расхождения между тремя результатами параллельных определений), r, % |
Предел воспроизводимости (относительное значение допускаемого расхождения между двумя результатами, полученными в двух лабораториях), R, % |
|
От 0 до 7 включ. |
18 |
20 |
60 |
55 |
|
Св. 7 до 10 включ. |
10 |
13 |
33 |
36 |
3. ОБОРУДОВАНИЕ, МАТЕРИАЛЫ, РЕАКТИВЫ
Для проведения исследований по данной методике необходимы следующие средства измерений, материалы и реактивы:
3.1 Средства измерений
- весы лабораторные общего назначения (ГОСТ Р 53228-2008);
- гири (ГОСТ OIML R 111-1-2009);
- pH-метр электронный любого типа, например, pH-420, ТУ 4215-008-81696414-2007;
- люксметр Ю116 (ГОСТ 8.014-72);
- фотоэлектроколориметр ИПС-03, ТУ 4437-003-26218570-2006;
- термометр цифровой «Замер-1» ТУ 4215-002-13245171-01;
- цилиндры вместимостью 25, 50, 100, 1000 см3 второго класса точности (ГОСТ 1770-74);
- колбы мерные 2 25-2, 2-50-2, 2-100-2 (ГОСТ 1770-74);
- пипетки градуированные вместимостью 1,2, 5, 10 см3 с ценой деления 0,1 см3 (ГОСТ 29227-91);
- пипетки автоматические (дозаторы) любого типа вместимостью 0,1 см3 и 0,2 см3.
3.2 Вспомогательное оборудование
- климатостат Р-2 (ТУ 4211-004-26218570-2006) или климатостат В3 (ТУ 4211-008-26218570-2009), позволяющие поддерживать освещение лампами дневного света или светодиодами (1200 - 2500) лк, фотопериод (12 + 12 часов) и температуру окружающего воздуха (20 ± 1) °С;
- устройство для экспонирования рачков УЭР-03
(ТУ 3615-006-26218570-2009) в комплекте со стеклянными пробирками объемом 100 см3;
- культиватор КВ-05 для культивирования водорослей (ТУ 3615-006-26218570-2007);
- центрифуга лабораторная с комплектом пробирок 50 - 100 см3, скорость вращения ротора 4000 - 5000 об/мин;
- аппарат для встряхивания жидкости АВУ-6С, ТУ 64-1-2451-78;
- холодильник бытовой, обеспечивающий замораживание (-20 ± 1) °С и хранение проб (от +2 до +4) °С;
- пипетки стеклянные объемом 2 см2 с отрезанным и оплавленным концом для пересадки рачков (ГОСТ 29227-91);
- воронки лабораторные (ГОСТ 25336-82);
- воронка Бюхнера (ГОСТ 9147-80);
- стаканы стеклянные лабораторные вместимостью 150, 200, 250, 1000 см3 (ГОСТ 25336-82):
- сита почвенные (ТУ 46-47-885-73);
- шпатели металлические (ГОСТ 19126-2007);
- пробоотборник объемом 500 - 700 см3 (ГОСТ 6859-72);
- буры почвенные (ГОСТ 27753.1-88);
- батометр-бутылка на штанге тип ГР-16М (ТУ 25-04-1749);
- щупы винтообразные с продольным вырезом, поршневые (ГОСТ 2517-2012);
- ножи почвенные (ГОСТ 23707-95);
- лопаты (ГОСТ 19596-87);
- склянки и банки стеклянные с винтовым горлом, с прокладкой и крышкой или с притертой пробкой для отбора и хранения проб вместимостью 500, 1000, 2000, 5000 см3 (ТУ 6-19-6-70);
- флаконы и банки цилиндрические полиэтиленовые или политетрафторэтановые с навинчивающимися крышками для отбора и хранения проб и реактивов вместимостью 100, 250, 500, 1000, 2000, 5000 см3 (ТУ 6-19-45).
3.3 Тест-культура, материалы и реактивы
- тест-культура Daphnia magna Straus;
- культура зеленой водоросли Chlorella vulgaris Beijer;
- дрожжи хлебопекарные ГОСТ Р 54845-2011;
- вода дистиллированная (ГОСТ 6709-72);
- вода питьевая (ГОСТ Р 51232-98);
- калий двухромовокислый ХЧ или ЧДА (ГОСТ 4220-75);
- калий азотнокислый ХЧ или ЧДА (ГОСТ 4217-77);
- калий фосфорнокислый однозамещенный ХЧ или ЧДА (ГОСТ 4198-75);
- магний сернокислый 7-водный ХЧ или ЧДА (ГОСТ 4523-77);
- железо лимоннокислое Ч (ТУ 6-09-2562-77);
- кислота борная ХЧ (ГОСТ 9656-75);
- аммоний ванадиевокислый мета Ч или ЧДА (ГОСТ 9336-75);
- марганец хлористый Ч или ЧДА (ГОСТ 612-75);
- молибдена окись Ч (ТУ 6-09-4471-77);
- цинка сульфат 7-водный ХЧ или ЧДА (ГОСТ 4174-77);
- кислота соляная ХЧ или ЧДА (ГОСТ 3118-77);
- кислота азотная 10 %-ный раствор (ГОСТ 4461-77);
- натрия гидроокись ХЧ или ЧДА (ГОСТ 4328-77);
- ткани шелковые (для муки и крахмала - мельничный газ) № 25 - 43 (ГОСТ 4403-91);
- фильтры бумажные обеззоленные «белая лента» (ТУ 6-09-1678-77, ГОСТ 12026-76);
- фильтры мембранные с диаметром пор 0,45; 3,5 мкм «Владипор» марки МФАС-ОС-2 (ТУ 6-55-221-1029-89), МФАС-П-4 (ТУ 6-55-221-903-88) или аналогичные зарубежного производства;
- вата хлопковая медицинская гигроскопическая (ГОСТ 5556-81);
- бинт марлевый медицинский (ГОСТ 1172-93).
Примечание. Допускается использование средств измерений, вспомогательного оборудования, реактивов и материалов другого типа, имеющих аналогичные метрологические и технические характеристики.
4. УСЛОВИЯ БЕЗОПАСНОГО ПРОВЕДЕНИЯ РАБОТ
При работе с химическими веществами, загрязненными грунтами, почвами, осадками сточных вод, отходами и сточными водами соблюдают требования техники безопасности по ГОСТ 12.1.007-76, ГОСТ 12.1.008-76.
При пробоподготовке загрязненных грунтов, почв, осадков сточных вод и отходов пользуются средствами индивидуальной защиты по ГОСТ 12.4.016-83, ГОСТ 12.4.020-82, ГОСТ 12.4.034-2001.
К воздуху производственных помещений предъявляют санитарно-гигиенические требования по ГОСТ 12.1.005-88.
Безопасность при работе с электроустановками обеспечивают по ГОСТ Р 12.1.019-2009 и в соответствии с требованиями инструкций к оборудованию.
Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91, СНиП 21-01-97.
Рабочие столы и поверхности должны содержаться в чистоте. После завершения работ проводится влажная уборка рабочих поверхностей.
Работающий персонал должен пройти обучение безопасности труда по ГОСТ 12.0.004-90.
5. ТРЕБОВАНИЕ К КВАЛИФИКАЦИИ ЛИЦ, ПРОВОДЯЩИХ БИОТЕСТИРОВАНИЕ
К биотестированию допускаются специалисты, имеющие опыт работы в лаборатории, освоившие методические приемы водной токсикологии и уложившиеся в нормативы контроля при освоении методики.
6. УСЛОВИЯ ПРОВЕДЕНИЯ БИОТЕСТИРОВАНИЯ
Биотестирование проводится в нормальных лабораторных условиях, помещение не должно содержать токсичных паров и газов.
Температура окружающего воздуха в лаборатории (17 - 27) °С. Атмосферное давление (84 - 106) кПа (630 - 800 мм рт.ст.). Освещение помещения может быть естественным или искусственным и не ограничено особыми требованиями.
Температура в климатостате Р2 (В3) для биотестирования (20 ± 1) °С.
Освещение в климатостате Р2 или В3 обеспечивается лампами дневного света или светодиодами. Освещенность для дафний составляет (1200 - 2500) лк при фотопериоде (день/ночь) 12 + 12 часов.
7. ПОДГОТОВКА К ПРОВЕДЕНИЮ БИОТЕСТИРОВАНИЯ
Для проведения биотестирования предварительно разрабатывают программу отбора проб, готовят посуду, оборудование для отбора проб и проведения биотестирования, пробоотборники, места хранения отобранных проб, а также рабочие места для обработки доставленных в лабораторию проб и исследования их на токсичность. Все процедуры предварительной подготовки должны исключать попадание токсичных, органических и каких-либо других веществ из окружающей среды в исследуемую воду или в водные вытяжки из почв, грунтов, осадков сточных вод и отходов.
7.1. Подготовка посуды для отбора, хранения проб и биотестирования
Отбор проб воды обычно производится в посуду из пластика, а если в воде содержаться нефтепродукты, моющие средства и пестициды, то в банки из темного стекла. Отбор проб почв, осадков сточных вод и отходов следует производить в банки из темного стекла.
Посуда для отбора проб и биотестирования должна быть химически чистой. Ее промывают 10 %-ным раствором азотной кислоты. Стенки посуды сначала смачивают этим раствором, после этого оставляют на 2 - 3 часа и затем тщательно промывают водопроводной водой. Возможные остатки кислоты нейтрализуют раствором пищевой соды и в заключении посуду 3 - 4 раза промывают дистиллированной водой. Сильно загрязненную посуду, а также новую посуду промывают водой, затем заполняют 10 % раствором азотной кислоты и выдерживают не менее суток. После этого ее промывают раствором соды, водопроводной и несколько раз дистиллированной водой. Не следует использовать для мытья посуды хромовую смесь, синтетические поверхностно-активные вещества и органические растворители. Для сушки и стерилизации посуду, кроме мерной, помещают на один час в сушильный шкаф при 160 ± 5 °С. Если емкости могут разрушаться при температуре 160 °С, то их стерилизуют в паровом стерилизаторе при температуре 121 ± 2 °С (105 Па) в течение 20 мин.
7.2. Подготовка проб к биотестированию
7.2.1. Отбор, транспортировка и хранение водных проб
Общие процедуры отбора проб вод, а также требования к устройствам для пробоотбора определены в следующих нормативных документах:
- ГОСТ 17.1.5.04-81 «Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия»;
- ГОСТ 17.1.5.05-85 «Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков»;
- ГОСТ 31861-2012 «Вода. Общие требования к отбору проб»;
- ГОСТ 31862-2012 «Вода питьевая. Отбор проб»;
- ПНД Ф 12.15.1-08 «Методические указания по отбору проб для анализа сточных вод»;
- Р 52.24.353-2012 «Отбор проб поверхностных вод суши и очищенных сточных вод»;
Место отбора проб и периодичность отбора устанавливают в соответствии с программой исследования в зависимости от водного объекта (ГОСТ 31861-2012).
В зависимости от задач исследования определяют тип пробы: точечная, составная или другая в соответствии с ГОСТ 31861-2012.
Для проведения острого токсикологического анализа надо отобрать не менее 500 см3 водной пробы.
Способы отбора, транспортировки, хранения, подготовки к выполнению биотестирования должны обеспечить неизменность состава проб в период между отбором проб и их анализом.
Пробы отбирают вручную специальными приспособлениями или с применением автоматических пробоотборников, при этом емкости для проб должны быть изготовлены из нетоксичного материала, легко выниматься из пробоотборника для очистки и мытья. При отборе пробы с поверхности водоема или водотока используют стеклянную или полиэтиленовую бутыль (Р 52.24.353-2012).
Для отбора глубинных проб воды из озер, водохранилищ, прудов и рек следует использовать батометры.
Отбор питьевых вод перед поступлением в распределительную сеть производят из кранов на водоводах, расположенных на входе в установку обеззараживания. Пробы воды распределительной сети отбирают в периоды наибольшего расхода воды (ГОСТ 31862-2012). Водопроводную воду отбирают из-под крана после интенсивного слива, многократно ополоснув его отбираемой водой. Кран антисептической обработке не подвергается.
Отбирать природные и сточные воды следует в местах наибольшего перемешивания. Отбор сточных вод необходимо производить в той части потока, где взвешенные частицы распределены более равномерно. Очищенные сточные воды необходимо отбирать до их хлорирования.
Для проведения анализа сточных вод на токсичность предпочтительно отбирать составную среднесуточную пробу, собирая ее порциями с периодичностью один час. Точечные (разовые) пробы допустимо использовать только в исключительных случаях.
Не допускается консервирование проб, предназначенных для исследования на токсичность.
Отобранные пробы наливают до краев в дважды промытые отбираемой водой банки или флаконы и закрывают без пузырьков воздуха пришлифованными стеклянными пробками или полиэтиленовыми крышками. Пробы упаковывают в деревянные ящики для переноски проб и прокладывают бумагой или ветошью. В жаркую погоду пробы для обеспечения лучшей сохранности рекомендуется транспортировать в контейнерах-холодильниках при пониженных положительных температурах. Зимой для предохранения проб от промерзания контейнеры должны быть оборудованы термоизолирующими прокладками. Следует избегать попадания прямого солнечного света на транспортируемые пробы.
При отборе пробы заполняют акт (см. Приложение 1), в котором отмечают:
- шифр пробы;
- цель пробоотбора;
- дату;
- время;
- место отбора пробы;
- температуру воды;
- ФИО и подпись отбиравшего пробы.
На бутыли размещают этикетку с указанием шифра пробы. При отборе проб необходимо соблюдать технику безопасности.
Пробы, поступающие в лабораторию для исследования, должны быть зарегистрированы в журнале регистрации с обязательным указанием количества емкостей и номера акта, составленного при отборе проб.
Биотестирование проб воды проводят не позднее 6 часов после их отбора. При невозможности проведения анализа в указанный срок пробы воды охлаждают до (+2) - (+4) °С. В этих условиях пробы до анализа могут храниться не более суток. О продолжительности хранения проб воды делают отметку в протоколе биотестирования. В исключительных случаях, при отсутствии летучих органических веществ, допускается замораживание проб до (-20) °С ниже нуля и их хранение до двух недель. При этом следует иметь в виду, что после размораживания токсичность воды может измениться. Если пробы требуется отстаивать или фильтровать, то обе эти процедуры должны производиться до замораживания.
7.2.2. Подготовка проб воды к биотестированию
Если пробы были охлаждены или заморожены, то перед биотестированием их доводят до комнатной температуры. Крупнодисперсные включения, присутствующие в сточных водах, следует удалить фильтрацией пробы через пористый обеззоленный фильтр «белая лента». Нельзя использовать мелкопористый фильтр, например, «синяя лента», поскольку он может задерживать коллоидные вещества, что скажется на результатах биотестирования.
Природные воды фильтруют через мембранные фильтры с диаметром пор 3 - 5 мкм или через пористый обеззоленный фильтр.
Используемый для обеззараживания питьевых и сточных вод активный хлор является токсическим веществом, поэтому перед биотестированием таких вод его необходимо удалить отстаиванием пробы в открытой емкости с широким горлом при температуре (+2) - (+4) °С в течение 3 - 5 часов.
Проба воды, подготовленная к биотестированию, должна иметь pH 7,0 - 8,5. Если pH пробы не укладывается в эти пределы, то устанавливается токсичность отдельно до и после коррекции кислотности пробы 10 %-ным раствором НС1 или 10 %-ным раствором NaOH. Коррекция pH не должна вызывать химической реакции с веществами пробы (выпадение осадка, комплексообразование) и увеличивать ее объем более, чем на 5 %. В протоколе опыта указываются оба результата биотестирования, однако заключение о токсичности дается по пробы до коррекции кислотности.
Пробы грунтовых или других вод с высоким содержанием двухвалентного железа (более 1 мг/дм3) следует предварительно отстаивать не менее 24 часов при температуре от (+2) до (+4) °С. После этого осветленная вода сифонируется и анализируется на токсичность.
7.2.3. Отбор, транспортировка, хранение проб грунтов и почв
Отбор проб грунтов и почв, их транспортировка и хранение осуществляют в соответствии с:
- ГОСТ 17.4.3.01-83 «Охрана природы. Почвы. Общие требования к отбору проб»;
- ГОСТ 17.4.4.02-84 «Почвы. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа»;
- ГОСТ 27753.1-88 «Грунты тепличные. Методы отбора проб»;
- ГОСТ 28168-89 «Почвы. Отбор проб»;
- ГОСТ 12071-2000 «Грунты. Отбор, упаковка, транспортирование и хранение образцов».
Пробные площадки закладывают на участках с однородным почвенным и растительным покровом.
При контроле загрязнения почв предприятиями промышленности пробные площадки намечают вдоль векторов «розы ветров» (ГОСТ 17.4.4.02-84). Фоновые образцы почвы для проведения контрольных измерений на токсичность отбирают на незагрязненных участках обследуемых территорий, имеющих аналогичный тип почвы.
Точечные пробы отбирают на пробной площадке из одного или нескольких слоев или горизонтов методом конверта или любым другим способом с таким расчетом, чтобы каждая проба представляла собой часть почвы, типичной для генетических горизонтов или слоев данного вида почвы. На каждые 20 га площади закладывают не менее одной пробной площадки размером 10×10 м (ГОСТ 17.4.4.02-84). При обследовании площади менее 0,5 га размер площадки уменьшают до 5×5 м.
При исследовании тепличных грунтов вся площадь теплицы разбивается на пробные площадки. Площадь одной пробной площадки должна составлять 230 - 270 м2. Границы пробной площадки определяются элементами тепличных конструкций. В теплице, свободной от растений, отбор проб производят равномерно на всей площади пробной площадки. На пробной площадке, занятой растениями, точечные пробы отбирают в рядах между растениями (ГОСТ 27753.1-88).
Для отбора проб почв используют нож, шпатель или почвенный бур.
Объединенную пробу получают путем смешивания точечных проб одинакового объема, отобранных на одной пробной площадке. Для этого точечные пробы переносят на клеенку или крафт-бумагу, перемешивают и квартуют (сокращают) в 3 - 4 раза. Почву после квартования отбирают несколькими равными порциями и переносят в стеклянные банки с герметичной крышкой. Таким образом, получают объединенную пробу, масса которой должна составлять не менее 1 кг.
Используемые способы отбора, транспортировки, хранения, пробоподготовки должны обеспечить неизменность состава проб почв и грунтов к моменту их биотестирования.
При отборе проб почвы составляют акт по утвержденной форме (см. Приложение 1). На емкость с пробой наклеивают этикетку, на которой указывается шифр пробы.
Пробы, которые поступают в лабораторию, регистрируют в журнале регистрации с указанием количества емкостей и номера акта отбора проб.
Пробы почв и грунтов анализируют не позднее 12 ч с момента отбора. Если данное условие нельзя выполнить, то объединенные пробы хранят в холодильнике в емкостях с плотно закрытой крышкой до одной недели при температуре от (+2) до (+4) °С. Не допускается консервирование пробы почв для анализа на токсичность.
7.2.4. Приготовление водной вытяжки из грунтов и почв
Отобранные для проведения биотестирования грунты и почвы разрыхляют шпателем и освобождают от инородных материалов. К ним относятся механические включения, такие как промышленные, строительные, бытовые отходы и т.п., а также галечник, обломки камней, корневищ и веток. Возможность удаления таких включений из пробы устанавливается на основе изучения полевого описания места ее отбора. Данные сведения должны присутствовать в сопроводительной документации (акт отбора проб) к пробам, направленным на токсикологический анализ.
После этого пробы переносят на чистые листы плотной бумаги и доводят до воздушно-сухого состояния в хорошо проветриваемом помещении или в вытяжном шкафу. Высушенную почву просеивают сквозь сито с размером ячеек 1 мм и выдерживают открытыми не менее 2-х часов при комнатной температуре и влажности воздуха.
Подготовленную пробу почвы распределяют на ровной поверхности слоем в 1 см и отбирают из 5-ти точек методом конверта. Отобранная проба с массой около 200 г разделяется на две равные части: для биотестирования и для определения гигроскопической влажности после высушивания до постоянной массы. Пересчет воздушно-сухой пробы на массу абсолютно-сухой проводят по формуле 1:
где ΔМабс.сух - масса абсолютно-сухого образца, г; ΔМвоздух - масса воздушно-сухого образца почвы, г; Кср - коэффициент пересчета массы воздушно-сухой пробы на массу абсолютно-сухой (среднее из трех измерений).
Для определения массовой доли почвы в воздушно-сухой пробе необходимо:
1. Взвесить три пустых высушенных бюкса с крышками, записав их массу (Мо), затем взвесить эти же бюксы с навесками (около 1 г) воздушно-сухой пробы (Мвоздух).
2. Поместить открытые бюксы с воздушно-сухими пробами в сушильный шкаф и выдержать в течение 3 часов при температуре (110 ± 5) °С. Затем закрыть бюксы притертыми крышками, перенести в эксикатор и дождаться их полного остывания (30 - 50 мин). Взвесить бюксы с навесками абсолютно-сухой пробы и записать их массы (Мабс.сух). После первого взвешивания пробы почвы необходимо еще несколько раз по 1 - 2 часа высушивать и охлаждать в эксикаторе, добиваясь расхождения в массе менее 0,005 г. Точность взвешивания должна составлять 0,001 г.
3. На основе полученных данных рассчитать значения коэффициента пересчета Кi для каждого эксперимента по формуле 2:
где Кi - коэффициент пересчета в i-том измерении; Мабс.сух.i - масса бюкса с абсолютно-сухим образцом в i-м измерении, г; Мвоздух.сух.i - масса бюкса с воздушно-сухим образцом в i-м измерении, г; Мoi - масса пустой бюкса в i-м измерении, г.
4. По результатам трех последних измерений массы бюксов производится расчет среднего значения (Ксp) по формуле 3:
Водную вытяжку из почвы для биотестирования готовят в соотношении 1 часть почвы и 4 части дистиллированной воды. Воду для удаления углекислого газа, который растворяет карбонаты кальция и магния, предварительно кипятят 30 мин, а затем охлаждают и аэрируют.
Для получения водной вытяжки берут 100 г пробы почвы в воздушно-сухом состоянии, пересчитав навеску на ее абсолютно-сухую массу. Количество почвы должно быть достаточным для получения объема экстракта, необходимого при выполнении всех процедур биотестирования. Навеску почвы переносят в колбу емкостью 1000 см3 и приливают 4-кратное количество дистиллированной воды.
Полученную смесь в течение 2-х часов перемешивают на аппарате для встряхивания жидкости и затем отстаивают 30 мин. Надосадочная жидкость отбирается сифонированием и фильтруется через мембранные фильтры с диаметром пор 3 - 5 мкм или через бумажные обеззоленные фильтры «белая лента». Если первые порции фильтрата оказываются мутными, то их нужно несколько раз фильтровать до получения прозрачного раствора.
При устойчивом появлении окраски и (или) повышенной мутности водной вытяжки, характерных для некоторых типов почв (гумусированные, дерново-подзолистые, торфяные и др.), водную вытяжку из них готовят в соотношении 1 часть почвы и 10 частей дистиллированной воды.
Вытяжка из почв должна иметь величину pH в диапазоне 7,0 - 8,5. При необходимости вытяжку перед серийным разбавлением предварительно нейтрализуют. После нейтрализации пробы аэрируют 10 - 20 мин для стабилизации pH.
Требуемые разбавления водной вытяжки для биотестирования готовят согласно п. 7.2.7.
7.2.5. Отбор, транспортировка и хранение проб осадков сточных вод, отходов производства и потребления
Отбор, транспортировку и хранение проб осадков сточных вод, отходов производства и потребления производят согласно следующим нормативным документам (если условия, указанные в данных документах, противоречат требованиям настоящей методики, следует руководствоваться последней):
- Отходы минерального происхождения. Рекомендации по отбору и подготовке проб. Общие положения. ПНД Ф 12.4.2.1-99;
- Отбор проб почв, грунтов, осадков биологических очистных сооружений, шламов промышленных сточных вод, донных отложений искусственно созданных водоемов, прудов-накопителей и гидротехнических сооружений ПНД Ф 12.1:2:2.2:2.3.2-03;
- СП 2.1.7.1386-03 «Определение класса опасности токсичных отходов производства и потребления».
Выделяют несколько групп отходов:
- ПО: отходы производства (производственные отходы);
- ТБО: отходы потребления (твердые бытовые отходы);
- смесь ПО и ТБО (смешанные отходы).
По агрегатному состоянию различают твердые (пылеобразные, порошкообразные, зернистые, шлаки, гранулированные, кусковые), пасто-, смоло- и студнеобразные и др. Кроме того, отходы могут быть гомогенными или гетерогенными.
Отбор проб проводится на пробных площадках из емкостей накопителя или из источника образования отхода. На каждые 20 га накопителя закладывается не менее 1 пробной площадки (СП 2.1.7.1386-03).
Для отбора проб с больших по площади хранилищ отходов выделяют пробную площадку в виде квадрата со сторонами не менее 10 м. Для небольших накопителей (менее 0,5 га) пробная площадка должна быть не менее 5×5 м. Точечные пробы отбираются на пробных площадках из одного или нескольких слоев или горизонтов методом конверта по диагонали или любым другим способом с таким расчетом, чтобы в каждом случае проба представляла собой типичную часть отхода. Объединенная проба составляется путем смешивания точечных проб (не менее 5 проб), отобранных на одной площадке или из одной емкости (СП 2.1.7.1386-03).
При отборе проб из кучи точечные пробы берут с ее вершины, основания и боковых поверхностей. Число проб из кучи высотой до 2 м должно быть не менее 9 и увеличиваться на 4 пробы с каждым дополнительным метром высоты (ФР 1.39.2007.03222).
При отборе проб ТБО необходимо установить его состав. Он включает входящие в ТБО компоненты (бумага, картон, пищевые отходы, дерево, пластик, стекло, черный и цветной металл, текстиль, кожа, резина, камни, штукатурка и др.), а также их процентное содержание. Для лабораторных исследований из массы каждого компонента отхода отбирают в отдельный пакет его составляющие. Масса пробы каждого из компонентов должна быть не менее 300 г.
Состав производственных отходов определяется производителем (собственником) отхода самостоятельно или с привлечением аккредитованных в установленном порядке организаций (СП 2.1.7.1386-03).
Для отбора проб отходов используют шпатель или почвенный бур. Отбор сыпучих отходов из тары (вагон, кузов автомобиля, контейнер и др.) производят с помощью щупа. Количество и необходимый объем отбираемой пробы отхода зависит от его агрегатного состояния, влажности, степени однородности и его зернистости (для сыпучих отходов).
Точечные пробы отходов перед объединением тщательно гомогенизируют. Обращаясь с твердыми сыпучими и пастообразными отходами, используют металлические шпатели. Полужидкие отходы гомогенизируют встряхиванием.
Объединенная проба отхода при отсутствии специальных требований должна составлять не менее 1 кг.
Пробы отходов не подлежат консервированию. В лабораторию пробы должны поступить не позднее, чем через 12 ч после отбора. При невозможности проведения анализа в указанный срок пробы охлаждают до (+2) - (+4) °С. В этих условиях пробы жидких и органических отходов до анализа могут храниться не более одних суток, твердых - не более одной недели.
Пробы отходов, поступившие в лабораторию на исследование, должны быть документально оформлены и маркированы. Необходимыми сопроводительными документами являются акт пробоотбора (см. Приложение 1). Маркировка отходов осуществляется в произвольной форме, но с обязательным занесением обозначений в лабораторный журнал.
7.2.6. Приготовление водной вытяжки из осадков сточных вод, отходов производства и потребления
Водную вытяжку из осадков сточных вод и отходов готовят из соотношения «твердая фаза : жидкость» 1:10. В качестве жидкости используют дистиллированную воду.
Твердые отходы. Пробу хорошо перемешивают. Для подготовки пробы отходов требуется 3 кг, пробы осадков сточных вод - около 2 кг. Отобранные пробы делят на две части, одну из которых возвращают в сосуд для хранения, другую разрыхляют и тщательно просматривают. При наличии частиц более 10 мм их аккуратно измельчают с помощью металлического шпателя до меньшего размера. Механически размалывать смесь недопустимо. Затем пробу высушивают до воздушно-сухого состояния как указано в п. 7.2.4.
После этого пробу методом квартования сокращают в 3 - 4 раза. На гладкой ровной поверхности (на крафт-бумаге, клеенке или полиэтиленовой пленке) перемешанную пробу разделяют на равные квадраты. Затем в шахматном порядке из квадратов отбирают порции всей толщины слоя и объединяют порции в пробу с абсолютно-сухой массой не менее 200 г. Влажность осадков и отходов определяют по п. 7.2.4.
Для получения вытяжки используют воздушно-сухую пробу, масса которой в перерасчете на абсолютно-сухую пробу должна составлять 100 г. После выщелачивания 100 г такой пробы будет получено около 900 см3 водной вытяжки. Это необходимо учитывать при расчете количества отбираемой порции.
Жидкие отходы и осадки сточных вод. Жидкие и содержащие менее 1 % взвешенного вещества отходы и осадки сточных вод не подвергают выщелачиванию, а сразу исследуют на токсичность после фильтрации через фильтр «белая лента» или после центрифугирования.
Выполнение процедуры подготовки экстракта выщелачивания. В сосуд, содержащий отход или осадок сточных вод с абсолютно-сухой массой 100 г, добавляют дистиллированную воду в соотношении «сухая масса : жидкость» 1:10 (наиболее удобно использовать 1000 см3 воды на 100 г отхода в расчете на абсолютно-сухую массу). При меньшем количестве пробы соответственно снижается и объем дистиллированной воды.
Полученную смесь в течение 7 - 8 часов слабо перемешивают на аппарате для встряхивания жидкости, обеспечивая нахождение твердого вещества во взвешенном состоянии. После окончания перемешивания раствор с осадком оставляют на ночь для отстаивания. После этого жидкость над осадком сифонируют.
Если после отстаивания жидкость становится прозрачной, то фильтрование не производится. При наличии в экстракте взвешенного вещества жидкость необходимо профильтровать через фильтр «белая лента» в воронке Бюхнера с применением слабого вакуума. В случае применения фильтрования это отмечают в рабочем журнале. Для освобождения водной вытяжки от взвешенных частиц возможно применение центрифугирования (10 минут при 3000 оборотов в минуту). Если мутность водной вытяжки из отхода сохраняется и после фильтрации, то в исключительных случаях допускается ее отстаивание в холодильнике до 5 суток (ФР 1.39.2007.03222). После этого жидкость над осадком сифонируют.
Полученный после выщелачивания экстракт исследуют на токсичность. Процедуру биотестирования начинают не позднее, чем через 6 часов после приготовления вытяжки из осадка, отхода. Если это невозможно, то допускается хранение экстракта в холодильнике не более 48 часов при температуре (+2) - (+4) °С.
Перед биотестированием измеряют pH и температуру в полученном экстракте. Водная вытяжка из осадков сточных вод или отходов должна иметь pH 7,0 - 8,5. При необходимости проводят коррекцию pH пробы, после которой ее аэрируют в течение 10 - 20 мин. Температуру пробы доводят до температуры рабочего помещения.
Если необходимо установить влияние фактора pH на результаты биотестирования токсичности водных вытяжек из отходов в тех случаях, когда величина pH выходит за пределы диапазона 7,0 - 8,5, токсикологический эксперимент проводят на пробах до и после их коррекции. За результат принимается токсичность исходной пробы. Данные регистрируют в журнале. Приготовление разбавлений водной вытяжки для биотестирования проводят по п. 7.2.7.
При делении проб осадков сточных вод или отходов на жидкую и твердую фракции на токсичность проверяют как жидкую фракцию, так и экстракт из твердой фракции. Если какая-либо из этих частей оказалась токсичной, то токсичным считается весь отход.
7.2.7. Приготовление разбавлений исследуемых вод для биотестирования
Для приготовления разбавлений исследуемых вод используется культивационная вода. Анализируемые воды предварительно разделяют в 2 сосуда: один для разбавления, а другой для хранения раствора, если биотестирование необходимо будет повторить. Все растворы и их разбавления готовятся при комнатной температуре. Культивационная и исследуемая воды должны также иметь комнатную температуру.
Пресные поверхностные, грунтовые и сточные воды анализируются в 100, 33, 11, 3,7 и 1,2 %-ной концентрациях (ряд разбавлений, кратных трем). После получения предварительных результатов биотестирования при необходимости готовятся и анализируются дополнительные разбавления. В процессе приготовления разбавлений пробы тщательно перемешивают.
Подготовленная к биотестированию вода в объеме 300 см3 переносится в стеклянный стакан емкостью 500 см3. Для получения ряда разбавлений анализируемой пробы, кратным трем, в четыре стакана на 200 см3 добавляется по 160 см3 дистиллированной воды. После этого в первый из них вносится 80 см3 тестируемой воды, во второй, третий и четвертый переносится по 80 см3, соответственно, из первого, второго и третьего стаканов. Наряду с разбавленной тестируемой водой в отдельные стаканы вносится 160 см3 исходной воды для тестирования и 160 см3 контрольной (культивационной) воды. Таким образом, получается 6 следующих вариантов тестируемой пробы воды объемом 160 см3 каждая, включая контрольную пробу, в качестве которой используется дистиллированная вода:
1. Исходная (не разбавленная) проба воды, 100 %;
2. Проба, разбавленная в 3 раза, 33 %;
3. Проба, разбавленная в 9 раз, 11 %;
4. Проба, разбавленная в 27 раз, 3,7 %;
5. Проба, разбавленная в 81 раз, 1,2 %;
6. Контрольная проба, 0 %.
Если изначально известно, что исследуемые воды и вытяжки обладают гипертоксичностью, то пробы предварительно разбавляются культивационной водой в 9 раз. После этого также готовится ряд ее разбавлений, кратный трем (9, 27,81,243,729 раз).
При работе с водными вытяжками из отходов следует приготовить ряд разбавлений кратный 10-ти. Для этого подготовленная к биотестированию вытяжка в объеме 100 см3 переносится в стеклянный стакан емкостью 100 - 200 см3. Для получения ряда разбавлений анализируемой пробы, кратным десяти, в четыре аналогичных стакана добавляется по 180 см3 дистиллированной воды. После этого в первый из них переносится 20 см3 водного экстракта, во второй, третий и четвертый - по 20 см3, соответственно, из первого, второго и третьего стаканов. Наряду с разбавленной тестируемой водой в отдельные стаканы вносится 180 см3 исходной вытяжки для тестирования и 180 см3 контрольной (культивационной) воды. Таким образом, получается 6 следующих вариантов тестируемых пробы объемом 180 см3 каждая, включая контрольную пробу:
1. Исходная (не разбавленная) водная вытяжка, 100 %;
2. Вытяжка, разбавленная в 10 раз, 10 %;
3. Вытяжка, разбавленная в 100 раз, 1 %;
4. Вытяжка, разбавленная в 1000 раз, 0,1 %;
5. Вытяжка, разбавленная в 10000 раз, 0,01 %;
6. Контрольная вода.
7.3. Подготовка культивационной воды
В качестве культивационной воды используют питьевую воду, которая в течение 2 - 3 суток отстаивалась для удаления хлора в бесцветных стеклянных емкостях. При отсутствии качественной питьевой воды возможно использование бутилированной негазированной питьевой воды или не загрязненной поверхностной пресной или грунтовой воды, профильтрованной через мембранный фильтр с размером пор 3 - 5 мкм. Мембранные фильтры перед употреблением тщательно промывают и кипятят в дистиллированной воде не менее 10 мин.
Культивационная вода должна удовлетворять следующим требованиям:
- отсутствие органических загрязняющих веществ, хлора, токсических веществ, антагонистических для дафний организмов (сине-зеленых водорослей) и пищевых конкурентов (простейших, многоклеточных);
- pH 7,0 - 8,5;
- жесткость общая от 80 до 250 мг/дм3 (выраженная в СаСО3);
- температура от +19 до +25 °С.
В культивационной воде требуемого качества выживаемость тест-культуры рачков дафний за 48-часовой период биотестирования должна быть не ниже 100 %. При этом 50 %-ная гибель рачков в конце первых суток экспонирования должна наступать при внесении в нее бихромата калия в диапазоне концентрации (0,2 - 0,8) мг/дм3. Более низкая чувствительность к данному модельному токсиканту может быть вызвана присутствием в культивационной воде повышенного количества примесей, способных вступать с ним во взаимодействие. В результате этого токсикант становится менее доступным для тест-организма. Для повышения чувствительности биотеста можно разбавить культивационную воду дистиллированной водой в 1,5 - 3,0 раза. После разбавления культивационная вода должна быть не токсичной для рачков и обеспечивать их хорошую плодовитость в маточной и синхронной культуре.
7.4. Содержание и подготовка культуры дафний к биотестированию
Культуры дафнии (Daphnia magna Straus) и зеленой одноклеточной водоросли (Chlorella vulgaris Beijer) можно получить в лабораториях, занимающихся биотестированием, с предоставлением документа, подтверждающим их видовую принадлежность.
7.4.1. Транспортировка дафний
Культуру дафнии транспортируют в стеклянной емкости с крышкой (в термосе, если температура окружающей среды выходит за пределы 20 ± 2 °С). Емкость на 2/3 объема заполняется водой, в которой культивировались рачки. В нее стеклянной трубкой переносятся дафнии, количество которых не должно превышать 25 - 30 особей на 1 дм3 воды. Одновременно в эту же емкость в качестве корма добавляют 3 - 5 см3 водорослевой суспензии на 1 дм3 воды.
Доставленную культуру дафний осторожно переливают в емкость для культивирования, объем которой должен в 2 - 3 раза превышать количество воды с рачками. Емкость с дафниями помещают в климатостат. Для адаптации дафний в культуру течение 1 - 2 дней порциями приливают приготовленную культивационную воду (см. п. 7.3.).
В лаборатории содержат два вида культуры дафнии: маточную (см. п. 7.4.2) и синхронизированную (см. п. 7.4.3), используемую для проведения биотестирования.
7.4.2. Выращивание и содержание маточной культуры дафнии
Культуру дафний выращивают в климатостатах Р-2 или В3, обеспечивающих поддержание искусственного освещения (1200 - 2500) лк, 12-часовой световой и ночной периоды и температуру (20 ± 1) °С.
Выращивание культуры производится в стаканах объемом 1 дм3, которые наполняют на 3/4 объема культивационной водой и сажают туда самок дафний среднего размера с выводковыми камерами, заполненными эмбрионами. Отбирают взрослых самок стеклянной трубкой с оплавленными концами и внутренним диаметром отверстия 5 - 6 мм. Для уменьшения испарения емкости неплотно прикрывают пластинами из стекла или оргстекла. Маточная культура дафний поддерживается в одном или двух сосудах. Не реже одного раза в двое суток с поверхности воды в емкостях, в которых выращиваются рачки, следует снимать стерильной марлевой салфеткой дрожжевую и бактериальную пленку, а также очищать дно и стенки сосуда. Кормление дафний осуществляют в соответствии с требованиями пункта 7.4.4. Содержание растворенного кислорода в культиваторах должно быть не менее 5 мг/дм3. Не допускается искусственное аэрирование воды в сосудах с дафниями.
Пересадка культуры в свежую культивационную воду осуществляется один или два раза в неделю. Она необходима для удаления продуктов жизнедеятельности рачков и нормализации содержания кислорода в воде. Для этого вода вместе с рачками осторожно переливается в чистый сосуд так, чтобы накопившийся осадок остался на дне. В новую емкость для культивирования добавляется свежая порция культивационной воды. Плотность маточной культуры не должна превышать 20 - 25 особей на 1 дм3 культивационной воды.
Не допускается использование молоди маточной культуры для биотестирования.
7.4.3. Выращивание синхронизированной культуры
Биотестирование воды и водных вытяжек проводят только на синхронизированной культуре дафний. Синхронизированной является одновозрастная культура, полученная от одной самки путем ациклического партеногенеза в третьем поколении. Такая культура генетически однородна. Особи синхронизированной культуры дафний близки по устойчивости к токсическим веществам, одновременно созревают и дают генетически однородное потомство.
Для получения синхронизированной культуры отбирают одну самку средних размеров с выводковой камерой, заполненной эмбрионами. Особь помещают в стакан объемом 250 см3, заполненный на 3/4 культивационной водой, который устанавливают в климатостат. Появившаяся молодь переносится в большую емкость с объемом воды около 1 дм3 для продолжения культивирования. Полученное третье поколение рачков является синхронизированной культурой. Оно может быть использовано для биотестирования, однако возраст рачков не должен быть меньше 6 и больше 24 часов.
При проведении массовых анализов на токсичность следует одновременно вести культивирование 4 - 5 синхронизированных культур, отличающихся друг от друга по возрасту. Синхронизированную культуру выдерживают в условиях по п. 7.4.2, кормят по п. 7.4.4.
Пересадка плодоносящих самок в свежую культивационную воду осуществляется один раз в неделю. Родившуюся молодь ежедневно отсаживают и используют для биотестирования.
7.4.4. Подготовка корма и кормление
Дафниям необходимо обеспечить комбинированное дрожже-водорослевое питание. В качестве водорослевого корма используется культура зеленой водоросли Chlorella vulgaris Beijer. Культура водоросли выращивается в культиваторе КВ-05 в течение 24 часов на 5 %-ной среде Тамия (см. Приложение 5). Клетки водоросли отделяют центрифугированием. Осадок разбавляют культивационной водой до концентрации 0,5 - 0,6 ед. оптической плотности (прибор ИПС-03). Водорослевое кормление маточной и синхронизированной культур дафний производится через каждые 1 - 2 суток путем добавления в емкости с рачками указанной выше суспензии хлореллы. Количество добавляемой суспензии должно составлять около 1/20-ой части объема маточной и синхронизированной культуры дафний. При этом концентрация клеток водоросли после добавления в среду с рачками должна быть эквивалентна 0,02 - 0,03 ед. оптической плотности (прибор ИПС-03), что соответствует 300 - 450 тыс. клеток хлореллы на см3.
Для дрожжевого питания культуры рачков готовится суспензия из 1 г свежих или 0,5 г сухих хлебопекарных дрожжей в 100 см3 дистиллированной воды. После набухания суспензию тщательно перемешивают. Допускается хранить дрожжевую суспензию в холодильнике 1 - 2 суток. Кормление дрожжами производится 1 раз в неделю путем добавления по 3 см3 тщательно перемешанной дрожжевой суспензии на 1 дм3 культуры рачков. Водорослевый корм в этот день дается в меньшем количестве.
Кормление дафний производят до проведения токсикологического эксперимента. Дафний в опыте не кормят.
8. ПРОЦЕДУРА БИОТЕСТИРОВАНИЯ
Для определения острого токсического действия проводится биотестирование исходной исследуемой воды или водной вытяжки из грунтов, почв, осадков сточных вод, отходов и нескольких их разбавлений, приготовленных по п. 7.2.7.
Определение токсичности каждой пробы без разбавления и каждого разбавления проводится в трех параллельных сериях. В качестве контроля используется три параллельные серии с культивационной водой.
Биотестирование проводится с соблюдением требований к температуре, продолжительности фотопериода и качеству культивационной воды по п. 7.3.
Биотестирование проводится в специальных стеклянных емкостях («пробирках») объемом 100 см3, входящих в комплект устройства УЭР-03, которые заполняются 50 см3 исследуемой воды. В пробирки помещают по десять дафний в возрасте 6 - 24 ч. Чувствительность дафний к токсикантам иных возрастов будет существенно отличаться. Дафний отлавливают из емкостей, в которых выращивается синхронизированная культура. В отдельный химический стакан сначала отсаживают всех одновозрастных рачков, а затем с помощью стеклянной трубки с оплавленными краями и внутренним диаметром 5 - 6 мм переносят в пустые «пробирки» по 10 особей с минимальным объемом культивационной воды. После этого из «пробирок» удаляют культивационную воду и сразу добавляют контрольный или опытный раствор в объеме 50 см3.
Посадку рачков начинают с контрольной серии. В исследуемые растворы дафний помещают, начиная с больших разбавлений (меньших концентраций загрязняющих веществ). Для каждой серии исследуемой воды используется 3 «пробирки».
В экспериментах по определению острой токсичности дафний кормят только перед началом эксперимента, до отсадки рачков в пробирки с тестируемой водой. Во время опыта корм в пробирки с тестируемой водой не добавляют.
«Пробирки» с пробами воды и тест-организмами помещаются во вращающуюся кассету устройства для экспонирования рачков УЭР-03. Благодаря вращению кассеты происходит непрерывная и одинаковая аэрация всех тестируемых проб. При этом выбранная скорость вращения (6 - 8 оборотов в минуту) не создает стрессовой ситуации для самих рачков.
Учет смертности дафний в опыте и контроле проводят каждые 24 часа. Опыт прекращается, если в течение 24 часов во всех вариантах (разбавлениях тестируемой воды) наблюдается гибель более 50 % рачков.
Неподвижные особи считаются погибшими, если не начинают двигаться в течение 15 секунд после легкого покачивания пробирки.
В экспериментах по определению острой токсичности растворы не меняют.
Результаты наблюдений заносят в рабочий журнал (см. Приложение 2).
Если наблюдается гибель дафний в контроле, результаты опыта не учитывают, и он должен быть повторен.
После того, как результаты эксперимента учтены, в каждой пробирке проводят измерение pH. Температура в пробирках должна соответствовать (20 ± 2) °С, а pH 7,0 - 8,2. Все отклонения от установленных норм, а также данные по каждой серии разбавлений, исходной воды и контролю также заносят в рабочий журнал и протокол результатов эксперимента.
9. ОЦЕНКА РЕЗУЛЬТАТОВ ТОКСИКОЛОГИЧЕСКОГО АНАЛИЗА
При определении острой токсичности проб пресных поверхностных грунтовых, питьевых и сточных вод, водных вытяжек из грунтов, почв, осадков сточных вод, отходов и их разбавлений устанавливают:
• среднюю летальную кратность разбавления вод, водных вытяжек, вызывающую гибель 50 % тест-объектов за 48-часовую экспозицию (ЛКР50-48);
• безвредную кратность разбавления вод, водных вытяжек, вызывающую гибель не более 10 % тест-объектов за 48-часовую экспозицию (БКР10-48).
Для определения острой токсичности исследуемых вод, водных вытяжек осадков сточных вод и отходов рассчитывается процент погибших в тестируемой воде дафний (А, %) по сравнению с контролем:
где ![]() - количество выживших дафний в
контроле (среднее значение из трех параллельных определений);
- количество выживших дафний в
контроле (среднее значение из трех параллельных определений); ![]() - количество выживших дафний в
тестируемой воде (среднее значение из трех параллельных определений).
- количество выживших дафний в
тестируемой воде (среднее значение из трех параллельных определений).
При А ≤ 10 % тестируемая вода или водная вытяжка не оказывает острого токсического действия. Этот процент погибших рачков используется для расчета безвредной кратности разбавления тестируемых вод, например, при установлении класса опасности отходов. При А ≥ 50 % проба воды, водная вытяжка оказывает острое токсическое действие. Этой величиной руководствуются при определении средней летальной кратности разбавления тестируемых вод.
Если экспериментально не удалось получить точного значения концентрации отдельного вещества или кратности разбавления, вызывающей 50 %-ную гибель дафний за 48 часов экспозиции, то для получения значения ЛКР50-48 (ЛК50-48), без выполнения дополнительных экспериментов, используется расчетный метод определения по формуле 5:
где, Рб - величина разбавления (наибольшая), при которой процент погибших дафний в тестируемой воде (А) был ниже 50 %; Рм - величина разбавления (наименьшая), при которой процент погибших дафний в тестируемой воде (А) был выше 50 %; Аб и Ам - величины А, соответствующие этим разбавлениям, выраженных в долях единицы.
В качестве Рб и Рм берется та пара наибольших разбавлений, между которыми имеет место переход величины смертности 50 %. Аналогичным образом устанавливается ЛКР10-48 (ЛК10-48).
В качестве Рб и Рм берется та пара наибольших разбавлений, между которыми имеет место переход величины смертности 10 %.
Если даже при наибольшем разведении тестируемой воды смертность рачков была выше 10%, то безвредная кратность разбавления рассчитывается по формуле 6:
В качестве Рб и Рм берется та пара наибольших разбавлений, при которых показатель смертности (А) ближе всего к величине 10 %.
Пример № 1: Количество погибших дафний в тестируемой воде (А) по сравнению с контролем для 1, 3, 9, 27, 81-кратного разбавления тестируемой воды в долях составило, соответственно: 0,6; 0,45; 0,35; 0,20; 0,0. Анализ этих данных показывает, что переход через критерий острой токсичности в виде 50 %-ной смертности (в долях это 0,5) имеет место между разбавлениями тестируемой воды в 1 (Рм) и 3 (Pб) раз. Тогда, руководствуясь формулой (5), сначала рассчитывается показатель степени выражения, а затем величина ЛКР50-48:
|
|
Таким образом, устанавливают, что 43,5 %-ная концентрация исследуемой сточной воды вызывает 50 %-ную гибель тест-объектов за 48 часов, ЛКР50-48 = 2,3 (кратность разбавления в 2,3 раз).
Пример № 2: Количество погибших дафний в тестируемой воде (А) по сравнению с контролем для 1, 3, 9, 27, 81-кратного разбавления тестируемой воды в долях составило, соответственно: 1,0; 0,8; 0,35; 0,05; 0,0. Анализ этих данных показывает, что переход через критерий безвредной кратности разбавлений в виде 10 %-ной смертности (в долях это 0,1) имеет место между разбавлениями тестируемой воды в 9 (Рм) и 27 (Рб) раз. Тогда, руководствуясь формулой (6), сначала рассчитывается показатель степени выражения, а затем величина БКР10-48:
|
|
В этом случае 4,46 %-ная концентрация исследуемой сточной воды является безвредной, БКР10-48 = 22,4 (кратность разбавления в 22,4 раз).
Пример № 3: Количество погибших дафний в тестируемой воде (А) по сравнению с контролем для 1, 3, 9, 27, 81-кратного разбавления тестируемой воды в долях составило, соответственно: 1,0; 0,8; 0,6; 0,4; 0,15. Анализ этих данных показывает, что переход через критерий безвредной кратности разбавлений в виде 10 % смертности (в долях это 0,1) не наблюдается даже при наибольшем разбавлении тестируемой воды в 27 (Рм) и 81 (Рб) раз. Тогда, руководствуясь формулой (6), рассчитывается показатель степени выражения и величина БКР10-48:
|
|
В этом случае 0,99 %-ная концентрация пробы является безвредной для дафний, БКР10-48 = 102 (кратность разбавления в 102 раза).
По результатам определения острой токсичности вод ведутся записи в рабочем журнале (см. Приложение 2) и оформляется протокол биотестирования (см. Приложение 3).
10. КОНТРОЛЬ ЧУВСТВИТЕЛЬНОСТИ ТЕСТ-ОРГАНИЗМОВ К МОДЕЛЬНОМУ ТОКСИКАНТУ
Контроль определения токсичности воды проводится один раз в квартал по модельному токсиканту - калию двухромовокислому (K2Сr2О7). Диапазон концентраций модельного токсиканта, при действии которого в течение 24 часов гибнет 50 % дафний, составляет (0,2 - 0,8) мг/дм3. Удовлетворительные результаты, полученные при проверке диапазона реагирования тест-организмов на модельный токсикант, не обеспечивают гарантии адекватного реагирования организмов на другие токсиканты и тем более их смеси, однако регулярно проводимая проверка позволяет выявить ошибки при приготовлении исследуемых смесей и растворов, нарушения, допускаемые в процессе культивирования организмов и условий проведения опытов.
Определяют ту концентрацию модельного токсиканта, при которой за 24 часа гибнет 50 % подопытных организмов. Для этого методом последовательных разбавлений готовят серию растворов двухромовокислого калия в культивационной воде с концентрациями 0,1; 0,2; 0,4; 0,8; 1,6 мг/дм3. Испытания на дафниях проводят в соответствии с прописью методики.
Если концентрация двухромовокислого калия, вызвавшая острую токсичность за 24 часа, находится в интервале (0,2 - 0,8) мг/дм3, то чувствительность культуры дафний соответствует необходимым требованиям, и она может быть использована в биотестировании. Если концентрация модельного токсиканта, вызвавшая острую токсичность, не находится в данном интервале, то следует проверить точность приготовления исследуемых растворов и условия проведения опытов. Если ошибки при проведении опытов исключены, необходимо сменить культуру тест-организмов, т.е. взять новую культуру дафний в учреждениях, с получением документа о видовой принадлежности.
Если чувствительность дафний не укладывается в установленный диапазон по причине ухудшения качества водопроводной воды, используемой для приготовления культивационной воды, например, в период весенних паводков, то культура дафний не меняется. В этом случае проводятся мероприятия по улучшению качества культивационной воды, включая разбавление культивационной воды в 1,5 - 3 раза дистиллированной водой (п. 7.3.).
11. ОБРАБОТКА И ОФОРМЛЕНИЕ РЕЗУЛЬТАТОВ ТОКСИКОЛОГИЧЕСКОГО АНАЛИЗА
11.1 За результат
токсикологического анализа принимают среднее арифметическое значение (![]() ) трех результатов параллельных
определений количества дафний, выживших в тестируемой воде, расхождение между
которыми не должно превышать абсолютного значения предела повторяемости (r), относительное значение которого приведено в таблице 1:
) трех результатов параллельных
определений количества дафний, выживших в тестируемой воде, расхождение между
которыми не должно превышать абсолютного значения предела повторяемости (r), относительное значение которого приведено в таблице 1:
При невыполнении условия (8) выясняют причины появления неприемлемых результатов параллельных определений.
Расхождение между результатами
измерений, полученными в двух лабораториях ![]() , не должно превышать величины,
рассчитанной по формуле (9):
, не должно превышать величины,
рассчитанной по формуле (9):
где ![]() - результаты измерений, полученные в
условиях воспроизводимости;
- результаты измерений, полученные в
условиях воспроизводимости; ![]() - среднее арифметическое значение
результатов измерений, полученных в условиях воспроизводимости; R -
относительное значение предела воспроизводимости, приведенное в таблице 1, %.
- среднее арифметическое значение
результатов измерений, полученных в условиях воспроизводимости; R -
относительное значение предела воспроизводимости, приведенное в таблице 1, %.
При выполнении этого условия приемлемы оба результата измерений и в качестве окончательного может быть использовано их общее среднее значение.
При невыполнении условия приемлемости результатов, полученных в условиях воспроизводимости, могут быть использованы методы оценки приемлемости результатов измерений согласно раздела 5 ГОСТ Р ИСО 5725-6.
11.2 Результаты определений регистрируют в протоколе испытаний, который оформляют в соответствии с ГОСТ ИСО/МЭК 17025 - 2009.
Примечание - При представлении результата токсикологического анализа в документах, выдаваемых лабораторией, указывают:
- количество результатов параллельных определений, использованных для расчета результата анализа;
- способ определения результата токсикологического анализа (среднее арифметическое значение или медиана параллельных определений).
БИБЛИОГРАФИЯ
ГОСТ 12.0.004-90 «ССБТ. Организация обучения безопасности труда. Общие положения».
ГОСТ 12.1.004-91 «ССБТ. Пожарная безопасность. Общие требования».
ГОСТ 12.1.005-88 «ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны».
ГОСТ 12.1.007-76 «ССБТ. Вредные вещества. Классификация и общие требования безопасности».
ГОСТ 12.1.008-76 «ССБТ. Биологическая безопасность. Общие требования».
ГОСТ 12.4.016-83 «ССБТ. Одежда специальная защитная. Номенклатура показателей качества».
ГОСТ 12.4.020-82 «ССБТ. Средства индивидуальной защиты рук. Номенклатура показателей качества».
ГОСТ 12.4.034-2001 «ССБТ. Средства индивидуальной защиты органов дыхания. Классификация и маркировка».
ГОСТ 17.1.5.04-81 «Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия».
ГОСТ 17.1.5.05-85 «Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков».
ГОСТ 17.4.3.01-83 «Охрана природы. Почвы. Общие требования к отбору проб».
ГОСТ 17.4.4.02-84 «Почвы. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа».
ГОСТ 12071-2000 «Грунты. Отбор, упаковка, транспортирование и хранение образцов».
ГОСТ 27753.1-88 «Грунты тепличные. Методы отбора проб».
ГОСТ 28168-89 «Почвы. Отбор проб».
ГОСТ 31861-2012 «Вода. Общие требования к отбору проб».
ГОСТ 31862-2012 «Вода питьевая. Отбор проб».
ГОСТ Р 12.1.019-2009 «Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты».
ГОСТ Р ИСО 5725-6-2002 «Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике».
ГОСТ ИСО/МЭК 17025 - 2009 «Общие требования к компетентности испытательных и калибровочных лабораторий».
Жмур Н.С. Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по смертности и изменению плодовитости дафний. - ФР 1.39.2007.03222. М.: АКВАРОС, 2007. 52 с.
СНиП 21-01-97 «Пожарная безопасность зданий и сооружений».
СП 2.1.7.1386-03 «Определение класса опасности токсичных отходов производства и потребления».
ПНД Ф 12.15.1-08 «Методические указания по отбору проб для анализа сточных вод».
ПНД Ф 12.4.2.1-99 «Отходы минерального происхождения. Рекомендации по отбору и подготовке проб. Общие положения».
ПНД Ф 12.1:2:2.2:2.3.2-2003 «Отбор проб почв, грунтов, осадков биологических очистных сооружений, шламов промышленных сточных вод, донных отложений искусственно созданных водоемов, прудов-накопителей и гидротехнических сооружений».
Р 52.24.353-2012 «Отбор проб поверхностных вод суши и очищенных сточных вод».
ПРИЛОЖЕНИЕ 1 (рекомендуемое)
|
Акт отбора проб № ___
Отбор проб проведен в присутствии _________________________________________ подпись, расшифровка подписи Исполнитель ____________________________________________________________ подпись, расшифровка подписи |
||||||||||||||||||||||||||||||||||||||||||||||||||||
ПРИЛОЖЕНИЕ 2 (рекомендуемое)
Форма записи результатов биотестирования в рабочем журнале
|
1 |
Дата, время отбора проб |
10 февраля 2014 г., 12:20 |
|
2 |
Наименование объекта |
Городские очистные сооружения сточная вода |
|
3 |
Место отбора пробы |
После вторичных отстойников |
|
4 |
Вид отобранной пробы |
объединенная |
|
5 |
Время хранения пробы до начала биотестирования |
4 ч |
|
4 |
Используемые тест-организмы, возраст |
Daphnia magna, возраст 6 - 24 ч. |
|
5 |
Оборудование и условия биотестирования |
Климатостат Р2, температура (20 ± 1) °С, фотопериод: 12 ч. - световой, 12 ч. - ночной, освещенность искусственная (1400 лк) |
|
6 |
Время хранения пробы от отбора до начала биотестирования |
4 ч |
|
7 |
Режим кормления |
10 см3 суспензии водорослей хлорелла на 200 см3 синхронной культуры за 12 часов до проведения биотестирования |
|
8 |
Повторности для каждого разбавления воды |
Три |
|
9 |
Исследуемые концентрации сточных вод |
1,2; 3,7; 11; 33; 100 % |
|
10 |
Соответствующая степень разбавления сточных вод |
Разбавления в 1 (без разбавления) 3, 9, 27, 81 раз |
|
11 |
t, pH исследуемой воды |
21 °С, pH 7,2 |
|
12 |
Средняя летальная кратность разбавления в остром опыте ЛКР50-48 |
Кратность разбавления в 2,3 раз, 43,5 %-ная концентрация сточных вод |
|
13 |
Безвредное разбавление в остром опыте БКР10-48 |
Кратность разбавления в 22,4 раз, 4,46 %-ная концентрация сточных вод |
ПРИЛОЖЕНИЕ 3 (рекомендуемое)
|
Наименование организации ___________________________________________________ Наименование объекта _______________________________________________________ Биотестируемая среда ________________________________________________________ Условия отбора и транспортировки проб ________________________________________ Пробы отобраны (Ф. И. О., должность) _________________________________________ Дата отбора проб ____________________________________________________________ Дата доставки проб __________________________________________________________ Используемая методика измерения _____________________________________________ РЕЗУЛЬТАТЫ БИОТЕСТИРОВАНИЯ
Биотестирование проводил _________________________________________________ подпись, расшифровка подписи Руководитель организации _________________________________________________ подпись, расшифровка подписи |
ПРИЛОЖЕНИЕ 4 (справочное)
Daphnia magna Straus, используемая в качестве тест-объекта, относится к низшим ракообразным, отряду ветвистоусых.
Дафнии - низшие ракообразные, являющиеся частью планктона. Принадлежат к массовым видам, населяющим континентальные пресные водоемы, в том числе широко распространены на территории России.
Морфология. Тело дафний овальной формы, сжато с боков, заключено в прозрачный панцирь. Тело нечетко сегментировано на головной, грудной и брюшной отделы (рис. 1). Голова покрыта щитом, передний край которого вытянут, образуя рострум. Под рострумом расположены две пары конечностей: антеннулы и антенны, последние сильно развиты, служат для скачкообразного перемещения в толще воды. Пять пар грудных конечностей сильно расчленены, снабжены щетинками, служат для фильтрации воды, питания, дыхания. Брюшной (абдоминальный) отдел туловища заканчивается постабдоменом, дорсальный край которого имеет выемку, характерную для дафний данного вида. В головном отделе, не покрытом раковиной, расположена пара глаз: большой - сложный, маленький - простой. Под панцирем дафний легко различимы сердце, кишечник, выводковая камера, которая находится в спинной части туловища. В выводковой камере протекает эмбриональное развитие дафний.
Рост, развитие и размножение. Рост дафнии сопровождается линьками, так как увеличение тела возможно только когда хитиновый покров достаточно эластичен. Наиболее интенсивно дафнии растут первые дни после рождения, первые три линьки происходят каждые 12 часов. Оптимальное питание обеспечивает удвоение размеров рачков в промежутке между линьками. После наступления половой зрелости рост дафний замедляется, снижается и частота линек, линька происходит перед очередной откладкой яиц в выводковую камеру. Всего в течение жизни дафния может линять до 24 раз. Размеры дафний составляют минимум 0,5 мм (выметанная молодь), максимальные размеры самок - 6,0 мм. Самцы отличаются от самок меньшими размерами (2 - 2,5 мм), видоизмененной формой тела, постабдомена и антеннулы (рис. 1 б). В природе в летнее время, а в лаборатории при оптимальных условиях культивирования круглый год дафнии размножаются без оплодотворения - партеногенетически (рождаются только самки). При резком изменении условий существования или культивирования (похолодание, недостаток пищи, перенаселенность и т.п.) самки начинают продуцировать яйца, из которых созревают самцы и способные к половому размножению самки. После оплодотворения дафнии откладывают «зимние яйца» (рис. 1 в), размещающиеся в эффипиуме, образованном из части створок панциря. При очередной линьке эффипиум отделяется (в природе - осенью), и в таком состоянии яйца переживают неблагоприятный период (зима). Весной из них появляются самки, способные к партеногенетическому размножению.
Период созревания рачков при оптимальной температуре (+20 ± 2) °С и хорошем питании - 5 - 8 суток, длительность эмбрионального развития - 3 - 4 суток. Затем происходит вымет молоди (партеногенетических самок) каждые 3 - 4 суток. Количество молоди у молодых самок - 10 - 15, у зрелых - 30 - 40 особей. Повышение температуры среды и регулярный режим питания способствуют сокращению периода созревания яиц в выводковой камере и увеличению количества потомства, и наоборот, понижение температуры и сокращение количества пищи замедляет развитие и размножение дафний, но удлиняет продолжительность их жизни. В природе дафнии живут в среднем 20 - 25 суток, а в лаборатории при оптимальном режиме 3 - 4 месяца и более.
Питание и отношение к содержанию кислорода. По характеру питания относятся к фильтраторам. В природе дафнии питаются взвешенными в воде бактериями, одноклеточными водорослями, детритом, растворенными органическими веществами. Пища поступает с потоком воды, направленным грудными конечностями, через выросты - в брюшной желоб вдоль основания конечностей и ко рту рачка. Оптимальное для жизнедеятельности дафний содержание растворенного в воде кислорода 6 - 7 мг/дм3. Однако дафния достаточно устойчива к изменению кислородного режима и снижению растворенного в воде кислорода до 2 мг/дм3 и ниже, что связано с ее способностью синтезировать гемоглобин. Повышенное содержание гемоглобина в крови дафний при ухудшении кислородного режима сопровождается окрашиванием рачков в красный цвет, а также замедлением роста и размножения.
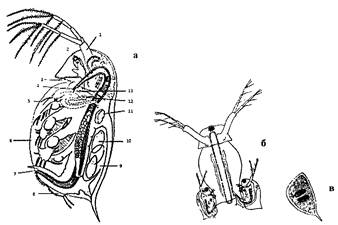
Рисунок - 1. Строение Daphnia magnet Straus:
а - самка: 1 - антенна, 2 - сложный глаз, 3 - антеннула, 4 - глотка, 5 - грудные ножки, 6 - створки панциря, 7 - каудальные когти, 8 - постабдомен, 9 - выводковая камера, 10 - партеногенетические яйца, 11 - сердце, 12 - кишечник, 13 - печеночные выросты; б - самка с самцами (копуляция); в - внешний вид эффипиума
ПРИЛОЖЕНИЕ 5 (обязательное)
Выращивание культуры водорослей
Выращивание культуры водоросли хлорелла (Chlorella vulgaris Beijer) производится в разработанном в Сибирском федеральном университете культиваторе КВ-05. В качестве реактора используется прозрачная бутыль из бесцветного стекла емкостью 400 см3, широко используемая в медицине при переливании препаратов. В реактор заливается суспензия водоросли в объеме (110 ± 10) см3. Для обеспечения углекислым газом, необходимого для осуществления процесса фотосинтеза, емкость с суспензией непрерывно вращается вокруг своей продольной оси. В результате вращения в культуральной среде поддерживается близкое к равновесному содержание СО2 за счет активного растворения углекислоты из воздуха.
Во время культивирования суспензия водоросли облучается светом лампы накаливания 40 Вт, 220 В, установленной в приборе над реактором. Постоянная температура среды, равная (36,0 ± 0,5) °С, поддерживается автоматическим включением и выключением встроенного вентилятора по команде блока термостабилизации прибора.
Питательная среда Тамия для культивирования водоросли хлорелла
|
Компоненты среды |
Концентрация |
|||
|
100 % среда Тамия, г/дм3 |
в 5 % среде Тамия для выращивания культуры водоросли в качестве корма рачков дафний |
|||
|
в среде для культивирования, г/дм3 |
Добавление компонента при приготовлении |
|||
|
концентрированных растворов, г/200 см3 |
5 %-ной среды Тамия, см3/дм3 |
|||
|
KNO3 |
5,0 |
0,25 |
20 |
2,5 |
|
MgSО4×7H2О |
2,5 |
0,125 |
10 |
2,5 |
|
КН2РО4 |
1,25 |
0,0625 |
5 |
2,5 |
|
Железо лимоннокислое |
0,003 |
0,0015 |
0,6 |
0,5 |
|
Микроэлементы |
|
|
раствор А раствор Б |
по 0,5 см3 растворов А и Б |
Растворы А и Б готовятся отдельно, раствор А (Н3ВО3 - 2.86 г/дм3; МnСl2×Н2О - 1,81 г/дм3; ZnSO4×5H2О - 0,222 г/дм3) и раствор Б (МоО3 - 17,64 мг/дм3; NH4VO3, - 22.96 мг/дм3) Затем отдельно стерилизуют каждый раствор 30 мин кипячением, охлаждают до температуры рабочего помещения и плотно закрывают притертой пробкой. Оба раствора можно хранить в холодильнике при температуре от (+2) до (+4) °С до трех месяцев.
Культура водоросли для кормления дафний выращивается на 5%-ной питательной среде Тамия*, состав которой представлен в таблице 2. Питательная среда и растворы всех солей готовятся на дистиллированной воде. Для избегания образования осадка навеску каждого вещества сначала растворяют в небольшом количестве воды (50 - 100) см3, а затем растворы сливают вместе в указанной последовательности и доливают воду до объема 1 дм3.
При систематическом потреблении культуры водоросли питательную среду удобнее готовить не из навесок солей, а из их концентрированных растворов (см. табл.). При приготовлении 1 дм3 5 % питательной среды Тамия эти растворы последовательно вносятся в указанном объеме в 0,5 дм3 дистиллированной воды. Затем добавляются заранее приготовленные растворы микроэлементов и лимоннокислого железа, общий объем среды доводится дистиллированной водой до 1 дм3. Растворы солей и микроэлементов, а также приготовленная питательная среда хранятся в холодильнике при (+2) - (+4) °С не более 3 месяцев.
Засев водоросли в культиватор КВ-05 производится с начальной оптической плотностью 0,010 ± 0,002 (кювета 2 см, λ = 560 нм, прибор ИПС-03). Для этого в (110 ± 10) см3 5 % питательной среды вносится (5 ± 1) см3 суспензии водоросли с оптической плотностью (0,210 ± 0,020), профильтрованной через 3 - 4 слоя марли или вату. Культура выращивается в полустационарном режиме, который достигается ее ежедневным пересевом в свежую среду. Такой режим культивирования позволяет без соблюдения условий стерильности поддерживать альгологически чистую культуру водоросли. При перерывах в работе свежевыращенную культуру водоросли можно хранить в холодильнике при температуре (+2) - (+4) °С в течение 2 - 4 месяцев.
_____________
*Допустимо использовать для кормления дафний культуру водоросли хлорелла, выращенную на более концентрированной среде Тамия (например, 50 %). В этом случае клетки водоросли должны быть отделены от питательной среды центрифугированием и ресуспензированы в небольшом количестве культивационной воды.
ПРИЛОЖЕНИЕ 6

ПРИЛОЖЕНИЕ 7