Методические указания
по проведению токсикологических исследований ингредиентов косметических средств
в эксперименте на животных
(утв. Главным государственным санитарным врачом РСФСР 30 ноября 1991 г.
№ 05РЦ/3140)
1. Общие положения
Развитие косметической отрасли промышленности, связанное с интенсивным синтезом и внедрением косметических полупродуктов, заменяющих натуральное сырье, диктует необходимость их тщательного токсикологического контроля с целью обеспечения выпуска высококачественной продукции, безвредной для потребителя.
Косметические изделия, в частности, косметические кремы, зубные пасты, лосьоны, эликсиры, средства декоративной косметики - губные помады, пудры, тени для век, тушь для ресниц и т.п., представляют собой сложную, многокомпонентную систему, в состав которой входят жировые, структурообразующие, поверхностно-активные вещества, эмульгаторы, наполнители, красители, специальные добавки (антимикробные, фотозащитные, антиоксиданты и др.), биологически активные вещества, отдушки. Последние в свою очередь представляют смесь различных синтетических душистых веществ.
Настоящие указания предусматривают программу токсикологических исследований разных ингредиентов косметических средств с целью их гигиенического регламентирования в готовых парфюмерно-косметических изделиях с учетом назначения, формы и условий применения.
В таблице 1 представлен перечень отдельных ингредиентов косметических средств, основные косметические изделия, в состав которых они могут входить (т.е. формы их применения), и основные пути контакта с потребителей, применяющий эти изделия.
Представленные в таблице 1 градации позволяют планировать первоочередность, последовательность и объем проведения токсикологических исследований косметических полупродуктов.
Токсикологическая оценка ингредиентов косметических средств проводится с целью предварительного отбора и последующего установления безопасных уровней воздействия, позволяющих регламентировать его содержание в рецептурах готовых изделий.
Косметические изделия также проходят доклиническую стадию изучения на животных для подтверждения безопасности композиции, содержащей новые ингредиенты, в целом и возможности передачи на клиническую апробацию.
Настоящие методические рекомендации относятся к этапу проведения токсикологических исследований косметических полупродуктов в эксперименте на животных.
Таблица 1
Ингредиенты или полупродукты косметических средств
|
Ингредиенты или полупродукты косметических средств |
Форма применения |
Основные пути воздействия на человека |
|||
|
кожа |
глаза |
желудок |
ингал. |
||
|
Жировые - масла, ланолин и его производные |
Кремы, губ. помады, шампуни, лосьоны, ополаскиватели |
+* |
+ |
+ |
-** |
|
Эмульгаторы-воски, спирты, стеараты, фосфаты, ПАВ с эмульгирующими свойствами |
Кремы, кремообраз. шампуни, ополаскиватели, краски для волос, тушь для ресниц |
+ |
+ |
- |
- |
|
Структурообразующие - воски, спирты |
Кремы, кремообраз. шампуни, ополаскиватели, губ. помады |
+ |
+ |
+ |
- |
|
ПАВ |
Шампуни, зуб. пасты, ополаскиватели, краски для волос |
+ |
+ |
+ |
- |
|
Солюбилизаторы |
Лосьоны |
+ |
+ |
- |
- |
|
Гелеобразущие |
Желеобразные шампуни, зуб. пасты, средства для рук, дезодоранты |
+ |
+ |
+ |
- |
|
Растворители-спирты, адипаты, гликоли, ПЭГи |
Лаки для ногтей, смывки лака, эликсиры, губ. помады, кремы |
+ |
+ |
+ |
- |
|
Наполнители - тальк, каолин и др. |
Пудры, тональные кремы, крем-маски, тени для век |
+ |
+ |
- |
- |
|
Красители неорганические, органические |
Средства декоративной косметики, кремы, лосьоны, краски для волос, шампуни и т.п. |
+ |
+ |
+ |
- |
|
Отдушки |
Во всех изделиях |
+ |
+ |
+ |
+ |
|
Биологически активные в-ва, витамины, ферменты и т.п. |
Кремы, лосьоны, шампуни |
+ |
+ |
+ |
- |
|
Спец. добавки: антимикробные, фотозащитные, отбеливающие |
Кремы, кремообразные шампуни, бальзамы и т.п. средства, губ. помады, лосьоны, дезодоранты зуб. пасты |
+ |
+ |
+ |
- |
|
пленкообразующие |
|
+ |
+ |
+ |
- |
|
антиоксиданты |
|
+ |
+ |
+ |
- |
|
антикариесные |
|
- |
- |
+ |
- |
|
реминерализующие |
|
- |
- |
+ |
- |
Обозначения: + - поступление возможно указанным путем
- - отсутствие поступления указанным путем
2. Общие требования к оценке токсических свойств ингредиентов косметических средств
2.1. Изучению подлежат все новые синтетические и натуральные соединения, перспективные к применению в косметической промышленности, а также применяемые, но не имеющие токсикологической характеристики. Объем токсикологических исследований для каждого соединения должен быть дифференцированным и определяться прежде всего его принадлежностью к химическим классам и степенью изученности последних, кроме этого должны учитываться назначение, состав и условия применения косметического изделия, в состав которого будет входить изучаемый полупродукт.
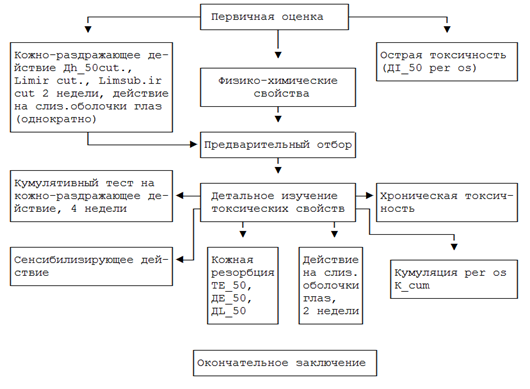
Схема проведения токсикологических исследований ингредиентов косметических средств представлена в таблице 2.
Таблица 2
Схема проведения токсикологического исследования ингредиентов косметических средств в эксперименте на лабораторных животных
2.2. При передаче ингредиента для токсикологического изучения разработчик в пояснительной записке должен представить все сведения о нем с указанием наименования (химического, торгового и синонимов), физико-химических свойств (молекулярная масса, летучесть, растворимость в воде и растворителях), степени чистоты, количестве и качестве примесей, стабильности, методики определения в составе рецептур. Представляются предполагаемые условия применения в составе готового изделия (кратность использования и т.п.).
2.3. Первичный отбор поступающих для исследования соединений основывается, кроме анализа физико-химических свойств, на двух показателях - острой токсичности и степени раздражающего действия (на кожу и слизистые оболочки глаз), лимитирующих возможность их применения в косметических изделиях, и решает вопрос о целесообразности проведения дальнейших исследований (1-й этап изучения).
2.4. Отобранные косметические полупродукты далее подвергаются комплексному токсикологическому исследованию (2-ой этап изучения) в подострых и хронических опытах, условия которых (продолжительность, дозы или уровни воздействия, их пути, набор тестов и т.д.) лимитируются путями его поступления в организм.
3. Оценка острой токсичности косметического сырья
3.1. Острая токсичность устанавливается не менее, чем на двух видах животных (мыши, крысы) при введении веществ в желудок и ингаляции. Количество животных в каждой группе должно быть не менее 8-10 особей. При установлении ДI50 на одном виде животных, для другого возможно применение метода одной точки. Вещество в неразведенном виде или в виде раствора, взвеси, эмульсии в индифферентном растворителе (вода, подсолнечное масло, 3 %-ный крахмальный клейстер) вводится в желудок животных через специальный зонд при помощи шприца. Вводимый объем не должен быть более 1 мл для мышей и 5 мл для крыс. Перед введением вещества и после него животные не должны получать пищу в течение 2 - 3 часов.
Величина ДI50 вычисляется с помощью одного из статистических методов (Кербера, пробит-анализа и т.п.).
3.3. Средне-смертельная концентрация при ингаляционном пути поступления (CI50) устанавливается для всех летучих косметических полупродуктов. При этом необходим метод химического анализа их в воздухе. При отсутствии метода ингаляционная затравка проводится в условиях статической насыщающей концентрации соединения при обычной комнатной температуре. Концентрации создаются в герметично закрытом 10-литровом эксикаторе или камере, куда за сутки до опыта помещается чашка Петри с налитым в нее веществом. Подопытные животные (мыши) помещаются в эксикатор на 1 час, контрольные животные на такой же срок помещаются в пустой эксикатор. Сравнительная оценка поведения и состояния животных позволяет охарактеризовать опасность ингаляционного воздействия продукта.
Косметический полупродукт не должен вызывать гибели или клинической картины интоксикации подопытных животных при ингаляции насыщающих концентраций.
3.4. По величине CI50 и ДI50 косметические полупродукты должны относиться к 3 и 4 классам веществ, умеренно и мало опасных для развития острого отравления, в соответствии с ГОСТ 12.1.007-76 «Вредные вещества. Классификация и общие требования безопасности».
3.5. Вещества, относящиеся к 1 и 2 классам опасности не должны допускаться к использованию в рецептурах косметических средств.
3.6. В виде исключения могут допускаться к использованию вещества 2-го класса опасности по ДI50 (например, консерванты и другие биологически активные вещества) при следующих условиях:
- представления заключения Фармкомитета или других медицинских учреждений о биологической активности этих соединений;
- строгой регламентации их безопасных уровней в рецептурах изделий по показателям углубленных исследований (см. п. 9);
- наличия методов контроля в составе косметических композиций.
4. Кожно-раздражающее действие
4.1. Исследование кожно-раздражащего действия в острых и повторных опытах проводится с целью получения представления о наличия или отсутствии у нового косметического полупродукта способности раздражать кожу подопытных животных, установления порога раздражающего действия (Iimircut), подпороговой (недействующей) концентрации сопоставления этих уровней с намечаемым к введению в рецептуру готового изделия к запрещению препаратов, обладающих раздражающим эффектом, на этом этаже изучения.
4.2. Исследование кожно-раздражающего действия косметических полупродуктов проводится на кроликах породы «Шиншилла» (масса 2,0 - 3,0 кг) и морских свинках светлой масти (масса 250 - 300 г). Количество кроликов не менее 2-х на каждую испытывающуюся концентрацию вещества, морских свинок в группе - 10 - 15 особей. Поскольку установление пороговых и подпороговых концентраций соединений требует значительного количества животных, а также с учетом того, что чувствительность кожи снижается в последовательности: кролик - морская свинка - человек, целесообразно в хронических опытах использовать морских свинок.
4.3. За сутки до эксперимента шерсть животных тщательно выстригается на симметричных участках обоих боков, один из которых служит контролем. Обязательным является также наличие интактной контрольной группы животных. Площадь обрабатываемой поверхности кожи должна быть стандартной и составлять 5 - 8 % поверхности тела животного, что соответствует следующим размерам поверхности человека, обрабатываемой косметическим изделием в зависимости от его назначения: лицо - 3 %, шея -1,5 %, кисти рук - 5 % (обе поверхности), голень - 6 %, стопа - 3,22 %. Выстригается у морских свинок поверхность тела площадью от 25 до 42 см2, у кроликов - от 56 до 88 см2.
4.4. Изучение местного раздражающего действия на кожу начинается с аппликаций вещества и его разведений в количестве: для жидкостей - несколько капель до высыхания, для твердых веществ - 50 %-ного раствора или мази, приготовленной на мазевой основе. Поскольку чаще всего косметическое сырье не растворяется в воде и нейтральных растворителях, в качестве разбавителей или мазевой основы могут быть использованы 70 % этиловый или изопропиловый спирты, ацетон, жидкая фракция ланолина, растительные масла. Растительные масла, ланолин иногда могут вызывать раздражение, поэтому необходимо иметь либо контрольную группу животных, либо наблюдать контрольные участки кожи подопытной группы, обрабатываемые разбавителями. Использование в качестве растворителя вазелина, парфюмерного (минерального) масла не рекомендуется, поскольку эти продукты сами могут вызывать раздражение.
4.5. Раздражающее действие косметических полупродуктов изучается в остром опыте (однократное воздействие), подостром (повторное ежедневное воздействие в течение 2-х недель) и хроническом. Длительность хронического эксперимента составляет от 2 до 18 месяцев и определяется как продолжительностью применения продукта в составе косметического изделия, так и другими показателями, в частности назначением соединения (жировое сырье, эмульгатор, консервант) и принадлежностью к химическому классу (см. п. 9).
4.6. При нанесении изучаемых соединений в течение 4-часовой экспозиции животные находятся в фиксированном состоянии (специальные станки, полужесткие воротники для кроликов, индивидуальные домики для морских свинок). Соединения наносятся на правый бок ежедневно открытым способом, на левый, контрольный бок наносится растворитель. В зависимости от назначения и условий применения в соответствии с аннотацией препарат либо оставляют на коже (ингредиент, входящий в состав кремов), либо смывают через определенное время (компоненты красок для волос), либо повторно наносят в течение дня (ингредиенты губных помад) и т.п.
4.7. Оценка местного действия на кожу. Реакция кожи оценивается сразу после окончания экспозиции и на следующие сутки перед повторным нанесением продукта. Оценка степени выраженности эритемы кожи кроликов проводится визуально, морских свинок - с помощью колориметрической линейки С.В. Суворова, и выражается в баллах. Применяются и другие показатели функционального состояния кожи: толщина кожной складки, температура, сопротивляемость кожи постоянному электрическому току, нейтрализующая способность. Результаты измерений должны быть статистически обработаны, а выводы сделаны с учетом критерия вредности всего комплекса отмечаемых изменений.
4.8. При наличии признаков раздражающего действия от однократного нанесения нативного соединения или его 50 % мази необходимо установление порогового и подпорогового (недействующего) уровней при повторных аппликациях соединений. Порог раздражающего действия косметических полупродуктов равен минимальной концентрации, вызывающей раздражающий эффект силой не более 1 балла у 50 % подопытных животных при двухнедельных ежедневных аппликациях.
4.9. Кратность разбавления изучаемого соединения должна быть двукратной: 50 - 25 - 10 - 5 - 1 и менее %% в зависимости от предполагаемого назначения.
4.10. В тех случаях, когда соединение обладает раздражающим действием на уровне концентраций, предполагаемых к использованию, делается вывод о его непригодности к применению в косметических изделиях.
4.11. Величины концентраций соединения в разбавителе, характеризующие порог раздражающего действия в подостром эксперименте и недействующий уровень, которые превышают или совпадают с предполагаемыми к использованию, являются отправными количественными критериями для выбора сенсибилизирующей или «рабочей» концентрации в эксперименте по изучению сенсибилизирующего действия косметического сырья.
5. Сенсибилизирующее действие
5.1. Изучение сенсибилизирующих свойств косметического сырья проводится двумя методами - однократного внутрикожного введения и повторных эпикутанных аппликаций на морских свинках светлой масти по 8 - 10 особей в группе.
5.2. Подготовка животных проводится так же, как и для оценки кожно-раздражающего действия (п. 4.3).
5.3. При использовании метода однократного внутрикожного введения 50 - 100 или 200 мкг продукта, разведенного в дистиллированной воде, ацетоне, спирте и пр. растворителях, вводится туберкулиновым шприцом однократно в объеме 0,02 мл в кожу наружной поверхности уха подопытных морских свинок, контрольной группе вводится растворитель в аналогичном объеме.
5.4. Выявление эффекта сенсибилизации проводится на 10-й день с помощью нанесения на кожу бока разрешающей дозы, которая предварительно определяется на других группах животных в однократных опытах и представляет собой подпороговую дозу по раздражающему эффекту. Чтение реакции проводится через 24 часа.
5.5. Может быть применена конъюнктивальная проба, при которой разрешающая концентрация, вводимая в конъюнктивальный мешок глаза животных на 10-й день, также предварительно устанавливается на других группах животных в однократных опытах по оценке раздражающего действия продукта на слизистые оболочки глаз и соответствует подпороговому, недействующему уровню. Чтение реакции проводится через 15 минут и 24 часа. Оценка реакции проводится в соответствии с общепринятыми подходами.
5.6. Положительный эффект свидетельствует о потенциальной аллергенной опасности продукта при внутрикожном пути поступления, который, однако, не является адекватным реальным условиям контакта потребителей с косметическим ингредиентом. Кроме того, применение этого метода ограничено возможностями разведения косметического сырья в индиферентных растворителях. В связи с этим основным и необходимым методом оценки сенсибилизирующих свойств изучаемых продуктов является метод повторных эпикутанных аппликаций, отвечающий специфике воздействия косметических средств.
5.7. Косметический полупродукт наносится на кожу бока морских свинок в концентрации, являющейся подпороговой по раздражающему эффекту (предварительно установленному при повторном, 2-недельном воздействии), 20 раз в течение месяца. Выявление эффекта сенсибилизации проводится после 10 и 20 аппликаций путем нанесения разрешающей концентрации продукта на интактный бок. Разрешающая концентрация равна пороговой по раздражающему действию в однократном эксперименте.
5.8. Кожные тесты и конъюнктивальная проба должны дополняться рядом лабораторных иммунологических специфических и неспецифических методов оценки сенсибилизации, выбор которых проводится с учетом сложности состава косметического полупродукта, его растворимости в воде и органических растворителях, принадлежности к определенным химическим классам.
5.9. По окончании опытов кожа животных подвергается гистологическому исследованию. Гисто-морфологическое сравнительное исследование биопсированной кожи подопытных и контрольных животных может дать необходимый дополнительный материал (особенно при количественной оценке) для решения вопроса истинности сенсибилизирующего эффекта.
5.10. Оценка сенсибилизирующего эффекта проводится по числу животных, давших аллергические реакции, с учетом комплекса всех примененных методик и критерия вредности отмеченных изменений.
Развитие сенсибилизации животных является противопоказанием к использованию косметического полупродукта, в изделиях в тex случаях, когда тестируемые концентрации совпадают с предполагаемыми уровнями его содержания в рецептуре изделий. Если положительный эффект отмечается на уровнях концентраций, превышающих те, которые предполагается реально вводить в рецептуры изделий, необходима дополнительная постановка эксперимента для установления порога аллергенного действия (Limal cutrs) и подпорогового (недействующего) уровня. Сопоставление этих концентраций должно лечь в основу регламентации соединения в составе готового парфюмерно-косметического изделия, либо явиться основанием к запрещению применения продукта из-за его аллергоопасности.
6. Кожно-резорбтивное действие
6.1. Количественным показателем резорции вещества через кожу является наличие его или его метаболитов в биосредах организма, что возможно установить, располагая соответствующими методами определения. Чаще всего кожно-резорбтивное действие оценивается по косвенным показателям: гибели подопытных животных с вычислением ДI50 или TI50, или при ее отсутствии, изменению функциональных показателей состояния отдельных органов и систем.
6.2. Изучение кожно-резорбтивного эффекта проводится в подостром эксперименте на белых беспородных мышах или крысах, по 10 особей в группах, исходная масса мышей 18 - 20 г, крыс - 180 - 200 г. Обязательно наличие контрольной группы такой же численности.
6.3. Хвосты животных, находящихся в фиксированном состоянии, погружаются в пробирки с изучаемым соединением на 2/3 длины, что составляет 5 % от поверхности тела (п. 4.3). В случае оценки твердых соединений - на 2/3 длины хвостов наносится их 50 %-я мазь. Ежедневная экспозиция продукта - 4 часа. Длительность всего эксперимента соответствует назначению изучаемого соединения и определяется также, как при оценке кожно-раздражающего эффекта (п. 4.5) от 2 недель до 2 месяцев.
6.4. В тех случаях, когда неразведенное соединение вызывает изменения кожи хвостов животных, сопровождающиеся нарушением целостности кожных покровов (покраснение, цианоз, шелушение, некроз) исследования необходимо продолжить на других группах при воздействии разных разведений продукта.
6.5. Для оценки функционального состояния различных органов и систем подопытных и контрольных животных используются интегральные и специфические показатели, исследуемые через каждые 5 дней первого месяца опыта, далее - каждый месяц. По окончании эксперимента определяются коэффициенты массы внутренних органов.
6.6. Наличие резорбтивного действия, доказанное статистически значимыми стойкими изменениями состояния изучаемых органов и систем подопытных животных и коэффициентов массы их внутренних органов с учетом критериев вредности наблюдаемых изменений, является основанием для того, чтобы запретить изучаемое соединение к использованию в косметических изделиях,
7. Действие на слизистые оболочки глаз
7.1. Изучение проводится на кроликах, реже - морских свинках. Количество животных в группе определяется условиями эксперимента, но не должно быть менее 2 - 3 для крупных (кролики) и 6 для мелких (м. свинки) на каждое разведение продукта.
7.2. Изучаемое соединение в количестве 1 - 2 капель (для жидких) или 50 мг (для твердых) вносится однократно в конъюнктивальный мешок правого глаза животных. Рекомендуется непосредственно после внесения продукта прижать у внутреннего угла глаза слезоносовой канал.
7.3. Реакция оценивается сразу после внесения вещества, через 1 час и через сутки. Регистрируется гиперемия, отечность слизистых оболочек, инъекция сосудов склеры, прозрачность роговицы. Контролем служит левый глаз животного.
7.4. При отсутствии реакции после однократного внесения продукта, а также в тех случаях, когда соединение предназначено для введения в рецептуры косметических «изделий для глаз» (тушь для ресниц, тени для век, кремы для кожи вокруг глаз и т.п.), проводится подострый месячный эксперимент с ежедневным внесением изучаемого полупродукта в конъюнктивальный мешок глаза животных.
7.5. Косметические полупродукты в концентрациях, близких к условиям применения, не должны вызывать раздражения слизистых оболочек глаз, склеры и роговицы.
7.6. Поверхностно-активные вещества (ПАВ), предназначенные для создания моющих средств - шампуней, ополаскивателей и т.д., рекомендуется тестировать на слизистых оболочках глаз кроликов в разведении 1:4. Отсутствие изменений слизистых оболочек при таком тестировании может служить обоснованием безопасности продукта при использовании потребителем. При оценке реакции целесообразно использовать в качестве эталона хорошо известные, применяемые образцы.
8. Оценка кумулятивного эффекта косметического сырья
8.1. Исследования проводятся с целью изучения способности соединений вызывать подострое отравление при повторном поступлении в организм в небольших дозах, что позволяет прогнозировать опасность развития хронического отравления.
8.2. Оценка кумулятивного эффекта проводится с помощью одного из общепринятых в токсикологии методов: метода Лима и соавторов (R.K. dimptal, 1969) или Ю.С. Кагана и В.В. Станкевича (1964). Подопытные животные - мыши или крысы. Основным показателем эффекта является гибель животных, а при ее отсутствии - функциональное состояние ряда органов и систем.
8.3. Результаты эксперимента позволяют вычислить коэффициент кумуляции, по величине которого можно судить о кумулятивной активности соединения. Косметическое сырье не должно обладать кумулятивным эффектом. Оценка эффекта по состоянию функциональных показателей ряда органов и систем подопытных животных должна вестись с учетом не только статистической значимости, но и критерия вредности отмеченных изменений.
9. Исследование хронической токсичности ингредиентов косметических средств
9.1. Исследование хронической токсичности ингредиента косметических средств проводится с целью установления степени его повреждающего действия на органы и системы организма при длительном введении, а также обратимости вызываемых им повреждений. Хроническая токсичность должна быть изучена не менее, чем на 2-х видах животных при двух путях поступления исследуемого соединения в организм. Основной способ введения исследуемого соединения зависит от способа применения готового косметического средства, в состав которого предполагается вводить это соединение (на кожу, волосы, слизистые оболочки).
9.2. Исследуемое соединение изучают не менее, чем в 3-х дозах: первая - минимальная доза должна быть близка к дозе, в которой данный ингредиент предполагается вводить в готовое косметическое средство; вторая - высшая доза, рассчитывается с учетом ДI50, полученной при изучении острой токсичности; третья доза является промежуточной между первой и второй дозами.
9.3. Продолжительность воздействия исследуемого соединения зависит от предполагаемой длительности его применения в составе готового косметического средства у человека.
Продолжительность воздействия исследуемого соединения экспериментальным животным в зависимости от длительности его применения у человека
|
Длительность применения у человека |
Длительность воздействия исследуемого соединения животным |
|
Однократно |
3 дня |
|
6 дней |
10 дней |
|
14 дней |
1 месяц |
|
30 дней |
4 месяца |
|
6 месяцев |
12 месяцев |
|
более 6 месяцев |
18 месяцев |
9.4. Во время проведения хронического эксперимента животные должны находиться под ежедневным наблюдением: отмечают общее состояние животных, их поведение, измеряют количество потребляемой пищи и воды, состояние кожного, волосяного покрова и слизистых оболочек, проводят регулярное взвешивание животных для контроля за изменением массы тела. Проводят также регулярное (ежемесячно) исследование морфологического состава периферической крови, функции барьерных органов, органов выделения. Все павшие животные, а также животные, забитые после окончания введения исследуемого соединения подвергаются вскрытию для патоморфологических исследований. Определяют изменение коэффициентов массы всех внутренних органов и гистоморфологическую картину паренхиматозных органов. За животными, оставленными в живых, проводят наблюдение в течение 1 месяца, после чего их обследуют по той же программе однократно.
9.5. Решение вопроса о разрешении к вводу изученного ингредиента в рецептуру косметического изделия зависит от характера и обратимости выявленных изменений состояния органов и систем подопытных животных с учетом критерия их вредности.
10. Биологически активные вещества (БАВ)
10.1. Особую группу веществ составляют так называемые биологически активные вещества: ферменты, витамины, экстракты растений, часто добавляемые в косметические изделия. К этой же группе соединений необходимо отнести и консерванты, предназначенные для защиты косметических изделий от микробной порчи. Некоторые вещества этой группы могут относиться к умеренно и даже высоко токсичным. Однако, по этому показателю они не могут представлять опасности для потребителей, поскольку добавляются в косметические изделия в количестве сотых и десятых долей процента от их массы.
Величина токсичности этой группы веществ характеризует их потенциальную опасность для работающих в условиях производства косметических изделий, что требует разработки рекомендаций специальных мер безопасности и индивидуальной защиты.
10.2. Дозы биологически активных соединений, реально входящие в косметические изделия, обосновываются и регламентируются в результате анализа существующей литературы и фармакопейных данных. Существенную роль при этом играют сведения о раздражающем и сенсибилизирующем эффектах при накожном пути воздействия.
10.3. Исследования новых препаратов, относящихся к группе БАВ, необходимо проводить в хроническом эксперименте с оценкой отдаленных эффектов в соответствии с требованиями, близкими к доклиническому изучению новых фармакологических веществ.
11. Оценка полученных результатов
11.1. Решение вопроса о допуске косметического ингредиента к введению в рецептуру косметического средства основывается на анализе всего комплекса результатов его токсикологического изучения: оценки степени токсичности и опасности при введении в желудок (ДI50), ингаляции (CI50), кумулятивного эффекта (Кcum), кожно-резорбтивного (ДI50 или TI50), степени выраженности кожно-раздражающего, сенсибилизирующего действия и действия на слизистые оболочки глаз.
11.2. Не допускаются к применению в косметических средствах вещества, относящиеся к 1 и 2 классам опасности (по ДI50 и CI50), обладающие кумулятивным эффектом (Кcum < 3), кожно-резорбтивным действием, а также выраженным кожно-раздражающим и сенсибилизирующим эффектами.
11.3. С учетом специфики применения косметических средств наибольшее значение имеет оценка кожно-раздражающего и сенсибилизирующего действия. В процессе изучения этих эффектов устанавливаются предельно-допустимые уровни (ПДУ) содержания ингредиентов в рецептурах по недействующим концентрациям на кожу морских свинок и кроликов в повторных экспериментах при указанных условиях проведения экспериментов (см. пп. 4, 5).
11.4. В концентрациях на уровне ПДУ ингредиенты не должны оказывать раздражающего действия на слизистые оболочки глаз и роговицу (см. п. 7).
11.5. Изучаемые вещества не должны вызывать изменений внутренних органов и систем подопытных животных при исследовании в хроническом эксперименте.
11.6. С учетом сведений литературы об опасности возникновения отдаленных эффектов у веществ, близких по химической структуре к изучаемым, необходимо включать в программу исследований оценку этих эффектов в соответствии с существующими методическими подходами.
11.7. Не допускаются к применению ингредиенты, обладающие отдаленными эффектами (канцерогенным, мутагенным, а также эмбриотропным).
Литература
1. Оценка воздействия вредных химических соединений на кожные покровы и обоснование предельно допустимых уровней загрязнения кожи. Методические указания № 2102-79 от 1 ноября 1979 г., М., 1980.
2. Постановка исследований по гигиеническому нормированию промышленных аллергенов в воздухе рабочей зоны. Методические рекомендации № 2121-80 от 23.01.1980, МЗ Латв. ССР, Рига, 1980.
3. Методические рекомендации по выявлению в эксперименте гиперчувствительности кожи к мазеобразным и вязким веществам, одобрены Ученым Советом ЦКВИ СССР от 12.05.1976 г., протокол № 9, М.,1979.
4. Методические рекомендации по колориметрии эритемы, наблюдаемой в дерматологическом эксперименте. М., 1977.
5. Методические указания о порядке оформления документации, представляемой в Фармакологический комитет для решения вопроса о проведении клинических испытаний фармакологических препаратов, предлагаемых в качестве лекарственных средств от 26.12.1977, М., 1978.
6. Методические указания к постановке исследований для обоснования санитарных стандартов вредных веществ в воздухе рабочей зоны № 2163-80 от 4.04.1980 г., М., 1980.
7. Требования к доклиническому изучению общетоксического действия новых фармакологических веществ (временные методические рекомендации) от 15.11.1984 г., М., 1985.
Рекомендации доложены на конференции отдела токсикологии НИИ гигиены труда и профзаболеваний АМН СССР, а также на заседании секции «Профилактическая токсикология» Московского научного общества токсикологов в декабре 1984 года.
|
Заместитель
|
Л.Г. Подунова |
Содержание