1.1. Общие вопросы. Гигиена, токсикология, санитария
Методические
указания
МУ 1.1.726-98
"ГИГИЕНИЧЕСКОЕ НОРМИРОВАНИЕ ЛЕКАРСТВЕННЫХ
СРЕДСТВ В ВОЗДУХЕ РАБОЧЕЙ ЗОНЫ, АТМОСФЕРНОМ
ВОЗДУХЕ НАСЕЛЕННЫХ МЕСТ И ВОДЕ ВОДНЫХ ОБЪЕКТОВ"
(утв.
и введены в действие Главным государственным
санитарным врачом РФ 28 декабря 1998 г.)
Дата введения: с момента утверждения
Взамен Методических указаний
"Гигиеническая оценка и нормирование
лекарственных средств: МУ 1.1.587-96",
утвержденных Госкомсанэпиднадзором
России 31 октября 1996 г.
1. Общие положения
1.1. Область применения
Методические указания (МУ) предназначены для научно-исследовательских институтов гигиенического профиля, медицинских институтов, ведомственных НИИ, токсикологических лабораторий и других учреждений, аккредитованных на право проведения разработок гигиенических нормативов, санитарных правил и норм, а также для органов государственного санитарно-эпидемиологического надзора и химико-фармацевтических предприятий.
МУ подготовлены в результате обобщения многолетнего опыта по гигиеническому нормированию ЛС в объектах производственной и окружающей среды и унификации требований и методов токсиколого-гигиенической оценки ЛС.
1.1.1. МУ разработаны с учетом специфического фармакологического действия лекарственных средств (ЛС) в дополнение к действующим нормативно-методическим документам, регламентирующим условия и подходы к обоснованию ПДК и ОБУВ химических веществ в воздухе рабочей зоны (6, 24, 25, 26, 28) и атмосферном воздухе населенных мест (2, 27), а также ПДК и ОДУ в воде водных объектов хозяйственно-литьевого и культурно-бытового водопользования (33).
1.1.2. При обосновании гигиенических нормативов в воздухе рабочей зоны настоящие МУ не распространяются на антимикробные препараты и антибиотики, гигиеническое нормирование которых проводится в соответствии с МУ (35).
1.2 Особенности нормирования лекарственных средств
Производство ЛС, являющихся в основном биологически высоко активными веществами, ставит перед органами санитарно-эпидемиологического надзора РФ и химико-фармацевтическими предприятиями задачу по предупреждению неблагоприятного воздействия ЛС на организм работающих, население и окружающую среду.
Для обеспечения опережающего развития исследований по разработке профилактических мероприятий необходима оптимизация методов обоснования гигиенических нормативов ЛС в различных объектах окружающей среды (воздух рабочей зоны, атмосферный воздух, вода водоемов).
Регламентирование содержания ЛС, как биологически активных препаратов, имеет ряд особенностей, обусловленных существующей системой разработки, изучения, регистрации и внедрения ЛС, а также условиями их промышленного применения и производства (1, 19, 21, 52, 54).
Для химико-фармацевтических предприятий, как правило, характерны небольшой объем выпуска конечных продуктов, широкая номенклатура ЛС и промежуточных продуктов синтеза, прерывистый и многостадийный характер технологических процессов, периодичность годового производства, небольшая продолжительность завершающих стадий получения ЛС.
Промышленному выпуску ЛС предшествуют разносторонние исследования биологической активности и токсических свойств в эксперименте на животных и испытания в клинических условиях. Это позволяет в ряде случаев существенно сократить объем токсикологических исследований по обоснованию гигиенических нормативов, а также использовать результаты доклинических экспериментальных и клинических испытаний для более надежного установления значений пороговых доз и концентраций, а также определения объема и направления гигиенической регламентации (1, 3, 19, 52, 54, 56).
1.2.1. Принципиальные подходы к гигиеническому нормированию ЛС не отличаются от общей методологии установления ПДК, ОБУВ, ОДУ химических веществ. Однако в связи с рядом особенностей ЛС, как специфического фактора загрязнений производственной и окружающей среды, создаются предпосылки для оптимизации, а в ряде случаев и существенного сокращения токсикологических исследований.
1.2.2. ЛС - вещество природного или синтетического происхождения или смесь веществ, используемых для лечения, профилактики и диагностики болезней; к ЛС относятся также препараты для предупреждения беременности. В России к ЛС относят средства, разрешенные Министерством Здравоохранения РФ для применения в установленном порядке.
1.2.3. На предприятиях по производству и переработке ЛС для всех веществ (сырье, промежуточные продукты, побочные продукты, вспомогательные вещества, конечные продукты и др.) должны разрабатываться гигиенические нормативы и методы аналитического определения их содержания в воздухе рабочей зоны и объектах окружающей среды (атмосферный воздух, вода водных объектов) с учетом гигиенических критериев для обоснования необходимости разработки ПДК и ОБУВ (ОДУ) вредных веществ (25).
1.2.4. При производстве готовых лекарственных форм, в том числе комбинированных, гигиеническому нормированию подлежат как субстанции всех ЛС, входящих в комбинацию, так и все вспомогательные вещества (наполнители, подсластители, разрыхлители, эмульгаторы и др.).
Токсиколого-гигиеническая оценка, изучение комбинированного действия, гигиеническое нормирование проводится с учетом биологической активности, степени токсичности и опасности основных и вспомогательных компонентов в соответствии с требованиями к постановке экспериментальных исследований по изучению характера комбинированного действия химических веществ (38) и нормирования смесей постоянного состава в воде (33).
1.2.5. При изучении и обосновании гигиенических нормативов ЛС необходимо учитывать следующее:
- высокую тропность или селективность к регулирующим центрам и определенным группам рецепторов, т.е. избирательность фармакологического действия;
- широкий диапазон фармакологических эффектов и величин терапевтических доз: от сотых долей мг (эстрогены) и нескольких мг (сердечные гликозиды, нейромедиаторы, некоторые антигипертензивные ЛС и др.) до десятков г (осмотические диуретики, корректоры кислотно-щелочного равновесия и др.);
- возможность развития отдаленных эффектов, в том числе влияние на синтез ДНК и РНК (цитостатики); возможность прямого воздействия на генеративную функцию (гормоны); способность вызывать психическую и физическую зависимость (наркотики);
- большие различия в объеме производства (от нескольких кг до десятков тонн в год), в численности занятых рабочих (от 2 - 3 до 30 и более человек), в объеме выбросов в атмосферу (от одного кг до нескольких десятков тонн в год) и сбросов сточных вод в водоемы;
- наличие исходной информации о фармакологических и токсикологических свойствах исследуемого ЛС, материалов клинических испытаний и/или ретроспективных клинико-эпидемиологических данных;
- преимущественное агрегатное состояние в воздухе рабочей зоны и атмосферном воздухе населенных мест в виде мелкодисперсных аэрозолей, так как ЛС в подавляющем большинстве являются кристаллическими порошками;
- способность многих ЛС активно изменять органолептические свойства воздуха и воды (запах, вкус, окраска, мутность, пенообразование);
- высокую стабильность ЛС, часто оцениваемую в фармакологии как благоприятное свойство, обеспечивающее пролонгированное терапевтическое действие, которая с гигиенических позиций является дополнительным показателем опасности (36);
- ЛС часто представляют собой комплекс из нескольких ингредиентов, что требует особых методических подходов при оценке их опасности и нормировании (38); см. также разделы 2.2.7.3, 3.4.4 и 4.11 настоящих МУ.
Сведения о ЛС содержатся в Государственном реестре, XI Государственной фармакопее. Государственная фармакопея регламентирует уровни высших допустимых (разовых и суточных) доз для ядовитых (список А) и сильнодействующих (список Б) ЛС.
Основные характеристики и этапы создания ЛС представлены в приложении 1 (10, 16, 17, 19, 21,52, 54, 58).
1.2.6. Для обоснования гигиенического норматива ЛС необходимы сведения о его химическом строении, физико-химических характеристиках, условиях производства, фармакологической активности, токсических свойствах (приложение 1; см. также п. 4.2).
1.2.7. Выбор адекватных методов и тестов для токсикологического исследования должен опираться на следующую информацию:
- механизм действия и специфические эффекты - для выбора тестов;
- противопоказания и побочные эффекты - для выявления характера токсического действия;
- принадлежность к структурному химическому ряду - для использования информации о близких по строению веществах;
- пути и способы введения - для определения опасности дополнительных путей поступления из окружающей среды, например, кожно-резорбтивного;
- кратность и продолжительность клинического применения - для предварительной оценки кумулятивных свойств;
- распространенность и частота применения населением - для определения схемы эксперимента, например, сроков проведения материальных нагрузок.
1.2.8. При отсутствии гигиенических нормативов (ПДК) и методов анализа ЛС ввод в эксплуатацию серийных производств или технологических процессов на основе промышленного регламента не допускается.
1.2.9. ОБУВ в воздухе рабочей зоны - временный ориентировочный гигиенический норматив. ОБУВ обосновывается путем расчета на основании параметров токсикометрии и терапевтических доз с использованием корреляционных зависимостей или путем интерполяций или экстраполяции в рядах соединений, близких по химической структуре, физико-химическим свойствам и характеру биологического действия с учетом положений, изложенных в методических указаниях по установлению ориентировочно безопасных уровней воздействия вредных веществ в воздухе рабочей зоны (26). ОБУВ утверждается Постановлением Главного государственного санитарного врача Российской Федерации сроком на 3 года, после чего указанный норматив может быть заменен постоянно действующим гигиеническим нормативом (ПДК) или переутвержден на новый срок в зависимости от перспективы производства и новой информации о токсических свойствах (4, 6).
ОБУВ устанавливается на период, предшествующий проектированию (для условий опытных и полузаводских установок). При проектировании производства, по согласованию с органами государственного санитарного надзора, допускается использование ОБУВ величиной не менее 1 мг/м в воздухе рабочей зоны (умеренно и малоопасные вещества).
Одновременно с обоснованием ПДК или ОБУВ веществ разрабатываются методы их контроля в воздухе рабочей зоны (5, 6).
1.2.10. Величина ОБУВ в атмосферном воздухе населенных мест устанавливается на срок 3 года для решения вопросов предупредительного санитарного надзора, обоснования требований к разработке санитарно-технических решений по охране атмосферного воздуха проектируемых предприятий по производству ЛС в соответствии с методическими указаниями по установлению ОБУВ загрязняющих веществ в атмосферном воздухе населенных мест (27).
1.2.11. ОДУ вещества в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования - временный гигиенический норматив. ОДУ разрабатывается на основе расчетных и экспресс-экспериментальных методов прогноза токсичности.
ОДУ применяется только на стадии предупредительного санитарного надзора за проектируемыми или строящимися предприятиями, реконструируемыми очистными сооружениями.
ОДУ устанавливается на срок 3 года. По истечении этого срока величина ОДУ отменяется, или должна быть пересмотрена, или заменяется научно обоснованной величиной ПДК с учетом представленных в Комиссию по государственному санитарно-эпидемиологическому нормированию при Минздраве России материалов.
При необходимости продления срока действия ОДУ, либо перевода ОДУ в ранг ПДК, Комиссия по государственному санитарно-эпидемиологическому нормированию рассматривает материалы обоснования ОДУ и направляет их на утверждение в Минздрав России с соответствующими рекомендациями. С момента утверждения величины ПДК ранее установленный ОДУ для данного вещества утрачивает силу (51).
ОДУ не применяется для текущего санитарного надзора, для надзора за загрязнением водных объектов. Поэтому разработка методов контроля для веществ, на которые устанавливаются ОДУ, не обязательна.
1.2.12. Государственный контроль за соблюдением настоящих положений осуществляется органами и учреждениями Госсанэпиднадзора МЗ РФ.
2. Гигиеническое нормирование лекарственных средств в воздухе рабочей зоны
2.1. Критерии для постановки исследований по обоснованию ОБУВ и ПДК ЛС в воздухе рабочей зоны
Критерии приоритетности и объема токсикологического исследования вредных веществ определены, в основном, действующими методическими указаниями (24, 25, 27, 28). Однако с учетом особенностей присущих ЛС, необходимо руководствоваться дополнительными условиями.
2.1.1. Гигиеническому нормированию в полном объеме, с проведением хронического токсикологического эксперимента, подлежат ЛС с относительно большими объемами производства (свыше 5 т в год, при количестве занятых работающих свыше 30 чел.).
2.1.2. Сокращение объема исследований и обоснование ПДК с использованием ускоренных методов возможно при соответствии изучаемого вещества ранее утвержденным критериям (24, 25, 40, 43), а также:
- при принадлежности ЛС к фармакологической группе, представители которой имеют утвержденную величину ПДК для воздуха рабочей зоны;
- годовом объеме производства до 5 тонн, количестве работающих, контактирующих с веществом, менее 30 человек.
- Ускоренное обоснование ПДК ЛС требует проведения исследований в объеме 1 и 2 этапов гигиенической регламентации (приложение 2).
2.1.3. Определение гигиенических нормативов (ПДК) нецелесообразно для высокоактивных ЛС, производство которых осуществляется периодически (2 - 3 мес. в год) в небольшом объеме (не более 200 кг/год) ограниченным контингентом работающих (не более 10 человек). К таким ЛС относятся:
- вещества с узкой зоной терапевтического действия - ТИ до 5 и низким уровнем терапевтических доз - МСТД менее 0,05 г, ВСТД менее 0,1 г;
- вещества с потенциальной возможностью отдаленных проявлений вредного эффекта: признанные канцерогенами - 1 - 2А группы (в соответствии с новой классификацией МАИР); способные вызывать психическую и физическую зависимость; оказывать влияние на синтез нуклеиновых кислот или прямое воздействие на генеративную функцию.
Оценка ЛС, отнесенных к указанным фармакологическим группам, проводится в объеме токсикологической экспертизы (этап I, приложение 2), с привлечением к обоснованию ретроспективных данных по их использованию в медицинской практике, данных доклинических и клинических испытаний (1, 10, 16, 17, 19, 21, 52, 54, 56, 58).
2.1.3.2. В условиях производства с ЛС, отнесенными к этим группам, исключается любой производственный контакт с веществом (вдыхание, попадание на кожу, заглатывание) (раздел 2.1.3). Полное исключение контакта обеспечивается индивидуальными, в том числе изолирующими, средствами защиты, проведением технологических операций по их обработке в герметичных боксах и др. Необходимы периодические медицинские осмотры, контроль за состоянием воздушной среды, загрязнением кожных покровов (по показаниям).
Нижний предел измерения (0,001 мг/м3) может быть уменьшен путем концентрирования пробы и увеличением времени ее отбора, которое может составлять до 70 % рабочей смены. Для отбора проб воздуха наиболее целесообразно использовать фильтры из ультратонкого стекловолокна марки ФСВ-А. При скорости аспирирования выше 20 л/мин, во избежание повреждения фильтра, в патрон за фильтром необходимо установить металлическую сетку и через каждые 30 минут отбора заменять фильтр. Суммарная погрешность измерений не должна превышать 25 %.
2.1.4. Клинико-гигиеническая проверка ПДК проводится путем изучения условий труда и состояния здоровья рабочих на действующих относительно крупнотоннажных предприятиях (годовой объем производства свыше 5 т, количество занятых рабочих свыше 30 чел.) в соответствии с МУ (24, 42).
2.2. Основные этапы токсикологических и гигиенических исследований
Исследования по гигиенической регламентации ЛС проводятся в соответствии с этапами, представленными в приложении 2. Экспериментальное изучение токсичности и определение параметров токсикометрии осуществляется по общепринятым требованиям (24, 25, 26) с учетом особенностей ЛС как специфического химического фактора, производственной среды. Качество лабораторных животных, их содержание и затравочная техника должны соответствовать действующим методическим указаниям к постановке исследований для обоснования санитарных стандартов вредных веществ в воздухе рабочей зоны (24).
В настоящих МУ использована система прогнозирования параметров токсикометрии и безопасных уровней воздействия, основанная на ретроспективном корреляционно-регрессионном анализе данных по ЛС и промышленным аэрозолям, имеющим законодательно утвержденные гигиенические нормативы (11, 49, 50, 59).
2.2.1. Исследование острой токсичности. Исследования проводятся на 2 - 3 видах лабораторных животных при пероральном, внутрибрюшинном и ингаляционном поступлении. При наличии литературных данных о параметрах острой токсичности целесообразно воспроизвести ранее полученные значения ЛД50 и ЛК50 на одном виде животных (9).
В случае известных величин ЛД50 (в мг/кг) при каком-то одном пути введения, выбор доз ЛС для установления ЛД50 при другом пути можно осуществлять с помощью следующих уравнений регрессии:
|
lgЛД50 в/ж = 0,87lgЛД50 в/бр + 0,78 |
(1) |
|
lgЛД50 в/ж = 0,77lgЛД50 п/к + 0,77 |
(2) |
|
lgЛД50 в/ж = 0,66lgЛД50 в/в* + 1 41 |
(3) |
|
lgЛД50 в/бр = 0,89lgЛД50 в/ж - 0,13 |
(4) |
Для оценки опасности острого ингаляционного отравления можно использовать уравнения, основанные на связи между среднесмертельными концентрациями при ингаляционном поступлении (мг/м3) и ЛД50 в/ж и в/б.
|
lgСЛ50 = 1,041lgЛД50 в/ж + 0,29 |
(5) |
|
lgСЛ50 = 0,91lgЛД50 в/бр + 1,03 |
(6) |
В представленных уравнениях и ниже по тексту при одновременном наличии смертельных доз и пороговых концентраций для мышей и крыс в качестве исходных взяты величины для наиболее чувствительного вида животных.
2.2.2. Установление порога острого действия. Для планирования исследований ингаляционной токсичности ЛС могут использоваться уравнения, полученные при анализе связей между порогами острого действия при ингаляционном воздействии (в мг/м3) и ЛД50 при внутрибрюшинном и пероральном поступлении:
|
lgLimac = 0,78lgЛД50 в/бр + 0,06 |
(7) |
|
lgLimac = 0,91lgЛД50 в/ж - 0,63 |
(8) |
|
lgLimac = 0,72lgLimac в/бр + 0,05 |
(9) |
|
lgLimac = 1,02 lgLimac в/ж + 0,10 |
(10) |
Исследования, как правило, проводятся при ингаляционном пути поступления. При сравнительном изучении ЛС, сходных по своей фармакологической активности с ранее нормированными в воздухе рабочей зоны препаратами, допустимо использование перорального или парентерального пути введения.
Условия проведения экспериментов должны соответствовать действующим нормативно-методическим указаниям (24, 25, 26, 44, 45). При выборе адекватных методов и тестов для токсикологического исследования и обоснования пороговых уровней целесообразно учитывать особенности нормирования ЛС (раздел 1.2). При этом необходимо различать методы интегральные, отражающие общетоксическое действие на органы и системы, и специфические методы, обусловленные фармакологическим и побочным действием ЛС.
Вместе с тем при исследовании ЛС разделение методов на интегральные и специфические весьма условно. В каждом отдельном случае интегральный показатель может перейти в разряд специфических, например, масса тела при изучении анаболиков и некоторых психотропных ЛС; уровень ректальной температуры при исследовании психотропных, тиреотропных и йодсодержащих средств и т.д. является специфическим показателем. Важно в пределах доступного, но не в ущерб ценности обоснования того или иного токсикологического параметра, оценить функциональное состояние органов и систем с использованием адекватных патогенетических обусловленных методов.
Оценку состояния организма подопытных животных необходимо проводить в динамике. Оценка интегральных и специфических показателей позволяет установить Limac, Limac pharm, Zsp. Далее в расчетных уравнениях для простоты написания используется обозначение только Limac.
2.2.2.3. При выборе уровня острого ингаляционного воздействия следует ориентироваться на величину МСТД для человека (в г):
|
lgLimac = 0,65lgМСТД + 1,75 |
(11) |
Если на уровне концентрации 100 мг/м3 изменения у подопытных животных не выявляются, то испытание более высоких концентраций аэрозоля ЛС нецелесообразно (28).
2.2.2.4. Исследования пульмонотоксического и фиброгенного действия осуществляется в соответствии с принципами и методами, изложенными в (28). В частности, эти исследования необходимы при изучении субстанций ЛС и сложных лекарственных форм, содержащих металлы и минеральные компоненты.
2.2.2.5. Оценку состояния организма подопытных животных необходимо проводить в динамике с учетом скорости и стойкости реакции. При наличии данных о токсико/фармакокинетике ЛС или его метаболита обследование животных целесообразно проводить в момент соответствующий максимальной концентрации химического соединения в исследуемом биосубстрате, а также в период снижения концентрации в 2 раза. Общие подходы к оценке зависимости биологического эффекта от содержания исследуемого вещества в биосубстратах изложены в методических рекомендациях (41).
2.2.2.6. Для выявления избирательности фармакологического действия ЛС и установления порогового эффекта рекомендуется использование методических приемов с применением известных фармакологических веществ в качестве нагрузок, перечень которых для основных групп ЛС (психотропные, сердечно-сосудистые и др.) представлен в приложениях 3 и 4. Влияние указанных фармакологических веществ на центральную нервную систему (снотворные, стимуляторы медиаторных процессов, катехоламины и др.), сердечно-сосудистую и другие регуляторные системы широко используются в фармакологическом скрининге (3, 10, 16, 17).
Критериями оценки для выявления фармакологических и/или патогенетических эффектов при применении нагрузочных тестов могут служить количественная оценка поведенческих и вегетативных проявлений по степени их выраженности, продолжительность и скорость восстановления в сравнении с реакцией контрольных животных на идентичное воздействие.
ЛС, используемые в качестве нагрузок, вводятся, как правило, в опытах на мышах и крысах внутрибрюшинно за 45 мин до основного эксперимента с последующей регистрацией длительности и выраженности вызываемых эффектов: гексеналовый сон (80 - 100 мг/кг); апоморфиновая и фенаминовая стереотипия (2 и 6 мг/кг соответственно); резерпиновый птоз и гипотермия (2 мг/кг); ареколиновый гиперкинез (25 мг/кг); никотиновый тремор (7 мг/кг); длительность жизни и наличие судорог у животных, получивших коразол (150 мг/кг); наличие судорог и гибель животных после максимального электрошока (50 мВ; 0,2 с, 50 ГЦ) по методу Суинъярда.
В случае взаимодействия с резерпином последний вводится за 4 часа до эксперимента, затем животные получают испытуемое вещество и через 45 минут оценивают изменение температуры, птоз и снижение двигательной активности (3, 18). Так, например, наиболее важные для группы нейролептиков эффекты - каталепсия, блокада апоморфиновой и фенаминовой стереотипии, гипотермия обусловлены их основным дофаминоблокирующим действием на молекулярном уровне и характеризует антипсихотические свойства.
Несмотря на кажущуюся простоту набора тестов, они четко отражают основной механизм и характерный спектр действия фармакологических групп веществ, перечисленных в приложениях 3 и 4, и позволяют получить информацию о характере испытуемого вещества, установить пороговые дозы и концентрации по влиянию на широкий спектр психотропной, противосудорожной и других видов активности, включая центральные нейромедиаторные системы (норадренергическую, холинергическую, дофаминергическую, серотонинергическую и ГАМК-эргическую).
Рекомендуемые модели фармакологических нагрузок могут быть использованы как при однократных, так и повторных воздействиях при условии выведения этих групп животных из последующего эксперимента.
2.2.3. Изучение кумулятивных свойств и особенностей биологического действия ЛС в подостром эксперименте. Для оценки кумулятивного действия по летальному эффекту рекомендуется использовать общепринятые в практике промышленной токсикологии тест субхронической токсичности Лима и соавт. в модификации К.К. Сидорова и метод Ю.С. Кагана и В.В. Станкевича с ежедневным введением 1/10 ЛД50. При необходимости специального изучения кумулятивных свойств вещества, в зависимости от величины вводимой дозы, желательно проведение эксперимента с введением крысам 2 - 3-х доз исследуемого ЛС (1/5 - 1/50 ЛД50) (48).
2.2.4. Изучение сенсибилизирующего и иммунотоксического действия ЛС. Оценка сенсибилизирующего действия ЛС осуществляется в соответствии с требованиями к постановке исследований по обоснованию предельно допустимых концентраций промышленных химических аллергенов в воздухе рабочей зоны и атмосферы (40) и рекомендациями по оценке аллергенных свойств фармакологических средств.
Поскольку в естественных условиях чаще наблюдается комбинированная сенсибилизация по сравнению с селективной формой, для более полной характеристики аллергенной активности ЛС рекомендуется проведение дополнительных исследований:
- активной и пассивной кожной анафилаксии;
- дегрануляции тучных клеток;
- специфического торможения миграции макрофагов;
- секреции гистамина из клеток-мишеней (тучные клетки, базофилы);
- титра комплемента в сыворотке крови по 50 % гемолизу;
- циркулирующих иммунных комплексов в тканях и сыворотке крови.
При исследовании ЛС, обладающих иммуномодулирующим действием, а также соединений, которые по своему химическому строению сходны с веществами, способными активно реагировать с молекулярными структурами и клеточными элементами иммунной системы, проводится оценка их иммунотоксических свойств. При проведении исследований необходимо руководствоваться методическими рекомендациями по экспериментальному изучению иммунотоксических свойств химических факторов окружающей среды (47).
Кроме того, рекомендуется руководствоваться положениями, изложенными в методических материалах по экспериментальному (фармакологическому) и клиническому испытанию иммуномодулирующего действия фармакологических средств и методических рекомендациях по оценке иммунотоксических свойств фармакологических средств.
Существенную помощь в решении вопроса о необходимости определения порога иммунотоксической активности можно получить из литературных сведений о ЛС и его аналогах, а также на основании данных визуального патоморфологического обследования органов иммуногенеза (селезенка, лимфоузлы, тимус), показателей лейкограммы (процентное и абсолютное содержание лимфоцитов, лейкоцитов, анализ лейкоформулы) экспериментальных животных в хроническом опыте при определении кумулятивных свойств лекарств и определении сенсибилизирующей активности.
Установление пороговой и подпороговой концентрации ЛС при ингаляционном воздействии осуществляется в подостром месячном эксперименте в условиях затравки животных 5 раз в неделю по 4 часа. Обследование животных проводят на 1, 2 и 4 неделе с момента эксперимента. Целесообразно изучение обратимости наблюдаемых изменений в восстановительном периоде после прекращения затравки.
Модуляцию клеточного иммунитета оценивают по относительному и абсолютному числу Т-лимфоцитов, выраженности реакции гиперчувствительности замедленного типа - ГЗТ, реакции "трансплантат против хозяина" - РТПХ и др. Оценку выраженности антителогенеза осуществляют путем определения абсолютного и относительного числа В-лимфоцитов, антителообразующих клеток селезенки (АОК) и агглютининов к эритроцитам барана.
Информативными показателями неспецифической резистентности организма являются исследования гемолитической активности комплемента, фагоцитарной активности лейкоцитов (определение % фагоцитов, фагоцитарного числа, количества активных фагоцитов, абсолютного фагоцитарного показателя, индекса завершенности фагоцитоза) и общей окислительно-восстановительной активности нейтрофилов в тесте восстановления нитросинего тетразолия (НСТ-тест).
Для выяснения патогенетических механизмов нарушения функционирования иммунной системы дополнительно рекомендуется оценка главных ее составляющих, включая распознавание, активацию, пролиферацию, дифференцировку и регуляцию.
Опасность иммунотоксического действия оценивается с учетом соотношения между пороговой концентрацией (Limim), установленной по влиянию веществ на систему иммунитета, и порогом хронического общетоксического действия. В том случае, если Limim < Limch, вещество регламентируется по иммунотоксическому действию (ПДК принимается на уровне недействующей концентрации). Если в результате эксперимента Limch < Limim, уровень ПДК устанавливается без учета иммунотоксических свойств.
При ускоренном обосновании ПДК или установлении ОБУВ проводится сопоставление Limim и недействующей концентрации с величиной гигиенического норматива, рассчитанной по параметрам общетоксического действия. Если расчетное значение ОБУВ находится на уровне или выше недействующей концентрации по иммунотоксическому действию, нормирование вещества осуществляется с учетом его иммуномоделирующих свойств. При более высоких значениях Limim по сравнению с расчетной величиной ОБУВ уровень гигиенического норматива устанавливается по общетоксическому действию вещества.
2.2.5. Оценка местного раздражающего и кожно-резорбтивного действия. Изучение местного раздражающего действия на кожу и слизистые оболочки и резорбции веществ через неповрежденную кожу проводится в соответствии с МУ (37). Для этих целей рекомендуется также использование метода Драйза (63).
При наличии у исследуемого вещества местного раздражающего или кожно-резорбтивного действия вносится пометка "требуется специальная защита кожи и глаз".
2.2.6. Обоснование ориентировочных безопасных уровней воздействия ЛС. При обосновании ОБУВ ЛС целесообразно провести предварительно расчет величины порога хронического ингаляционного действия (Limch в мг/м3) с использованием экспериментально установленных параметров токсикометрии (ЛД50 в/ж, КВР, Ккум, Limac, Limac pharm), Zsp и суточных терапевтических доз (МСТД и ВСТД в г):
|
lgLimch = 0,61lgLimac + 0,36lgМСТД - 0,27 |
(12) |
|
lgLimch = 0,82lgLimac + 0,36lgВСТД - 0,78 |
(13) |
|
lgLimch = 0,7lgМСТД + 0,82 |
(14) |
|
lgLimch = 0,74lgLimac - 0,83lgZsp - 0,46 |
(15) |
Достоверное влияние данных показателей на прогнозируемую величину Limch установлено также при анализе параметров токсикометрии группы промышленных аэрозолей:
|
Limch = 0,72lgLimac + 0,11lgЛД50 в/ж + 0,33lgKкум + 0,18lgKBP - 0,66lgZsp - 1,11 |
(16) |
|
Limch = 0,59lgЛД50 в/ж + 0,31lgKкум +0,31lgKBP - 0,64lgZsp - 1,51, |
(17) |
где Kкум - коэффициент куммуляции по Ю.С. Кагану и В.В. Станкевичу при введении 1/10 ЛД50.
КВР - коэффициент видовых различий.
Величина расчетного Limch в последующем послужит основой для надежного прогноза ОБУВ.
2.2.6.1. Обоснование ОБУВ (мг/м3) проводится путем расчета:
- по значениям минимальной и высшей суточной терапевтических доз (МСТД и ВСТД в г) на стадии предварительной токсикологической оценки или в случае принадлежности вещества к фармакологической группе, представители которой имеют утвержденную в законодательном порядке величину ПДК в воздухе рабочей зоны;
- по установленным в законодательном порядке санитарным нормативам для атмосферного воздуха или воды водоемов санитарно-бытового назначения, обоснованным по токсикологическому признаку вредности.
В других случаях для обоснования ОБУВ необходимо дополнительно использовать уравнения, учитывающие параметры токсикометрии (среднесмертельные дозы при пероральном и внутрибрюшинном введении, порог острого действия, коэффициент кумуляции при введении 1/10 ЛД50, коэффициент видовых различий, зона специфического действия).
Для установления ОБУВ рекомендуется производить расчеты по нескольким уравнениям с последующим вычислением среднегеометрической величины.
2.2.6.2. Расчет ОБУВ по МСТД и ВСТД не рекомендуется проводить:
- при наличии у вещества избирательного раздражающего, сенсибилизирующего действия или способности вызывать отдаленные эффекты;
- для веществ, являющихся физиологически необходимыми компонентами питания человека (например, витамины, ферменты и др.);
- для веществ, предназначенных для местного применения или парентерального введения.
Обоснование ОБУВ вышеуказанных веществ должно проводиться по аналогии с ранее нормированными фармакологическими препаратами или с использованием результатов подострого эксперимента, а также по уравнениям регрессии, полученным при анализе общей совокупности промышленных аэрозолей (п. 2.2.6.4).
2.2.6.3. Расчет ОБУВ по величине МСТД, ВСТД (г), ЛД50 (мг/кг) и Limac (мг/м3):
|
lgОБУВ = 0,77lgМСТД + 0,34 |
(18) |
|
lgОБУВ = 0,8lgВСТД - 0,06 |
(19) |
|
lgОБУВ = 0,21lgЛД50в/бр + 0,55lgМСТД - 0,33 |
(20) |
|
lgОБУВ = 0,45lgLimac + 0,5lgМСТД - 0,43 |
(21) |
|
lgОБУВ = 0,49lgМСТД + 0,42lgLimac + 0,11lgЛД50в/ж - 0,75 |
(22) |
При расчете используются ЛД50 для наиболее чувствительного вида животных и наименьшее значение Limac, установленного по изменению интегральных и специфических (Limac pharm) показателей.
2.2.6.4. Расчет ОБУВ по параметрам токсикометрии.
|
lgОБУВ = 0,78lgLimac + 0,87lgKкум - lgZsp - 1,96 |
(23) |
|
lgОБУВ = 0,62lgЛД50в/ж + 0,78lgKкум + 0,25lgКВР - 0,97lgZsp - 2,71 |
(24) |
|
lgОБУВ = 0,66lgLimac + 0,18lgЛД50в/ж + 0,78lgKкумlgZsp - 2,25 |
(25) |
При расчетах используется значение Kкум, установленного методом Ю.С. Кагана при введении 1/10 ЛД50.
Уравнения, в которые входит ЛД50 в/ж, не рекомендуется использовать для прогнозирования ОБУВ малотоксичных веществ (ЛД50 более 5 г/кг).
Расчет ОБУВ аэрозолей ЛС в воздухе рабочей зоны по величине среднесуточной ПДК в атмосферном воздухе и максимальной недействующей дозы для воды водоемов требует учета значения порога острого ингаляционного воздействия (Limac или Limac pharm).
|
lgОБУВ = 0,3lgПДКсc + 0,67lgLimac - 0,61 |
(26) |
|
lgОБУВ = 0,68lgLimac + 0,32МНД (мг/кг) - 0,61 |
(27) |
2.2.6.5. Ориентировочный расчет вероятностного значения безопасного уровня воздействия может быть проведен также с использованием собственной модификации формулы Габера.
|
|
(28а) |
|
|
(28б) |
где V - объем легочной вентиляции человека (м3/ч),
t - время работы (ч),
K1 - коэффициент, отражающий степень задержки аэрозоля в организме (в долях единицы);
K2 - коэффициент перехода от МСТД к уровню воздействия (ПДК, ОБУВ), отвечающий критериям безопасности для работающих и их потомства;
K3 - коэффициент перехода от ВСТД к уровню воздействия (ПДК, ОБУВ), отвечающий критериям безопасности для работающих и их потомства.
При проведении расчетов величину произведения V·t целесообразно принимать равной 10 м3 (61, 62), K1 = 1,0. Среднее значение K2 для ранее нормированных ЛС при расчете по МСТД составляет 30, а K3 при расчете по ВСТД - 100. Величины K2 и K3 для ЛС отдельных фармакологических групп, обладающих специфическим избирательным действием (гормоны, цитостатики, сульфаниламиды и др.) могут быть значительно выше приведенных значений (300 - 500).
В связи с этим, при практическом применении вышеприведенного уравнения желательно предварительно установить значение K2 и K3 для ранее нормированных ЛС исследуемой фармакологической группы и только в случае незначительных колебаний этих величин можно использовать среднюю величину коэффициента для расчета ОБУВ изучаемого ЛС.
2.2.7. Полная токсикологическая оценка.
2.2.7.1. Проведение хронического токсикологического эксперимента.
Хронический токсикологический эксперимент проводится в соответствии с рекомендациями (п. 2.1.1.) настоящих МУ. Выбор концентраций для проведения хронического ингаляционного воздействия осуществляется с учетом величин Limac, ОБУВ (раздел 2.2.6.), результатов подострого опыта (раздел 2.2.3.), а также прогнозируемой величины порога хронического действия (формулы 12 - 17).
Уровень порога хронического ингаляционного действия может быть рассчитан по следующим формулам:
|
lgLimch = 0,45lgLimac + 0,5lgМСТД |
(29) |
|
lgLimch = 0,56lgLimac + 0,13lgЛД50 + 0,33lgKкум - 0,89 |
(30) |
|
lgLimch = 0,65lgLimac + 0,36lgKкум - 0,64, |
(31) |
где Kкум - коэффициент кумуляции по Ю.С. Кагану и В.В. Станкевичу.
Условия эксперимента, критерии для установления порогов вредного действия должны соответствовать требованиям к постановке исследований для обоснования санитарных стандартов вредных веществ, гигиеническим критериям для обоснования необходимости разработки ПДК и ОБУВ (ОДУ) вредных веществ (24, 25) и положениям раздела 2.1 настоящих МУ.
В процессе хронического эксперимента должны быть установлены пороговая и недействующая концентрации по интегральным и специфическим фармакологическим показателям, определена зона специфического действия, выявлены органы и системы организма, чувствительные к действию исследуемого вещества.
2.2.7.2. При наличии показаний, в частности, в случае принадлежности вещества к классу ЛС, действующих преимущественно на центральную нервную систему, или структурном сходстве с ЛС, способными вызывать физическую или психическую зависимость, желательно исследовать возможность развития синдрома воздержания (абстиненции) после прекращения воздействия вещества. С этой целью в первый день восстановительною периода (через сутки после прекращения воздействия), а также в различные сроки этого периода проводится исследование состояния нервной системы, поведенческих реакций, зоосоциального поведения и др. Статистически достоверное изменение исследуемых показателей является признаком вредного действия вещества (лекарственная зависимость). Аналогичные исследования рекомендуется проводить при наличии данных о возможности развития синдрома отмены при воздействии препаратов других фармакологических групп.
2.2.7.3. При изучении комбинированных ЛС, содержащих два или более ЛС, необходимо исследовать токсичность каждого из компонентов отдельно, а также токсичность всей комбинации в целом. Общие принципы проведения подобных исследований представлены в методических рекомендациях (38). В связи с тем, что комбинированные ЛС могут содержать одно или несколько индивидуальных ЛС, имеющих гигиенические нормативы, исследования по установке ПДК для смеси целесообразно проводить в острых и подострых опытах. Такой подход позволяет определить ответственный за токсичность компонент либо наличие суммации или потенцирования действия составных компонентов.
На 1 и 2 этапах гигиенической регламентации (приложение 2) необходимо провести анализ и оценку доступных данных и литературной информации о потенциальных отдаленных эффектах ЛС - мутагенеза, бластомогенеза, тератогенеза, влияния на репродуктивную функцию.
На 3 этапе при наличии убедительных данных о возможности проявления отдаленных эффектов изучаемого ЛС (приложение 2) проводится экспериментальная оценка пороговых уровней (Limас, Limpharm и Limsp). В случае, если мутагенные и/или тератогенные свойства и влияние на репродуктивную функцию ЛС будут лимитирующими (Limsp < Limpharm или Limас), то обоснование норматива необходимо проводить с учетом этих особенностей действия ЛС в соответствии с МУ (46).
Сокращение экспериментальных исследований допускается при небольшом количестве работающих, контактирующих с веществом, менее 30 человек (раздел 2.1.2). В этом случае допускается использование данных по отдаленным эффектам, полученных на доклиническом этапе исследования ЛС, с пересчетом испытанных доз на возможное поглощенное количество ЛС при ингаляции.
В подходах к оценке потенциальных канцерогенных свойств ЛС следует руководствоваться положениями раздела 2.1.3 настоящих МУ, раздела 3.4 гигиенических критериев для обоснования необходимости разработки ПДК и ОБУВ (ОДУ) вредных веществ (25), принципами исследования потенциальной канцерогенности лекарственных препаратов (53), а также положениями методических рекомендаций по исследованию канцерогенных свойств фармакологических веществ и ЛС.
2.2.8. Обоснование ПДК ЛС в воздухе рабочей зоны. Обоснование ПДК ЛС в воздухе рабочей зоны проводится на основании анализа всего комплекса исследований (приложение 1, 2, 3); величин пороговых концентраций в условиях острого и хронического эксперимента, степени кумулятивности, прогнозируемых значений ОБУВ, результатов изучения условий труда и состояния здоровья работающих, параметров токсикометрии и ПДК ранее нормированных ЛС той же фармакологической группы или близких по химическому строению.
Ускоренное обоснование ПДК по сокращенной схеме исследований проводится в соответствии с критериями, приведенными в разделе 2.1.
Величина ПДК для ЛС рассчитывается путем уменьшения величины порога хронического действия на коэффициент запаса (K3). При выборе коэффициента запаса следует руководствоваться общими правилами, изложенными в методических указаниях (28).
Решение о величине K3 принимается с учетом особенностей действия ЛС, адекватности и чувствительности показателей, избранных для выявления минимально действующих (пороговых) концентраций, степени соответствия изменений в состоянии организма подопытных животных общепринятым критериям вредного действия.
3. Гигиеническое нормирование лекарственных средств в атмосферном воздухе населенных мест
3.1. Критерии для постановки исследований
3.1.1. Исследования по полной программе гигиенического нормирования с установлением порога хронического действия проводятся в следующих случаях:
- относительно большой объем производства (свыше 5 т в год) и выбросов ЛС в атмосферный воздух (свыше 100 кг в год);
- принадлежность исследуемого препарата к фармакологической группе, для представителей которой не установлен ПДК в атмосферном воздухе.
3.1.2. Для аэрозолей малотоксичных ЛС (ЛД50 в/ж > 5 г/кг, в/б > 1,0 г/кг; Limac > 100 мг/м3; ВСТД > 5 г; Kкум > 5,0), не обладающих выраженной фармакологической активностью (ВСТД ≥ 5 г), аллергизирующим действием и отдаленными эффектами устанавливается максимально разовая ПДК 0,5 мг/м3 и среднесуточная ПДК 0,15 мг/м3 (4 класс опасности).
3.1.3. При небольшом объеме производства (менее 200 кг в год) выносится заключение о полном запрете выброса ЛС в атмосферный воздух в случае:
- чрезвычайной и высокой опасности токсического действия ЛС - 1 и 2 класс опасности и токсичности (ТИ < 5, ЛД50 в/ж < 150 мг/кг; в/б < 15 мг/кг; CL50 < 100 мг/м3; Limac < 5 мг/м3) и выраженной фармакологической активности (МСТД < 0,05 г; ВСТД < 0,1 г);
- потенциальной возможности отдаленных проявлений вредного эффекта (см. раздел 2, п.п. 2.1.3), решение принимается в соответствии с положениями МУ 25);
- запрете контакта работающих с ЛС.
3.1.4. Исследования ЛС, упомянутые в п.п. 3.1.2 и 3.1.3, проводятся в объеме токсикологической экспертизы с привлечением данных доклинического и клинического исследования. Для текущего контроля содержания ЛС, упомянутых в п. 3.1.3, устанавливается контрольная концентрация вещества в выбросе. Расчет данной концентрации проводится по параметрам токсикометрии, значениям терапевтических доз и ПДК в воздухе рабочей зоны.
3.1.5. Сокращение объема исследований и обоснование ПДК с использованием ускоренных методов возможно в следующих случаях:
- при принадлежности ЛС к фармакологической группе, представители которой имеют утвержденную величину ПДК в атмосферном воздухе населенных мест;
- годовом объеме производства до 5 т, объеме выбросов в атмосферный воздух менее 100 кг в год;
- наличии гигиенического норматива в воздухе рабочей зоны, обоснованного по величине порога хронического действия;
- избирательном рефлекторном действии;
- избирательном аллергизирующем действии;
- для ЛС, представляющих собой смеси постоянного состава, состоящие из компонентов, для которых установлены ПДК в атмосферном воздухе при изолированном воздействии.
3.1.6. Ускоренное обоснование ПДК требует установления параметров острой токсичности, изучения кумулятивного, кожно-резорбтивного и раздражающего действия, определение порогов острого ингаляционного действия, изучения сенсибилизирующего действия. Обоснование ПДК возможно по аналогии с ранее нормированными фармакологическими препаратами путем расчета величины норматива по параметрам токсикометрии, терапевтическим дозам и ПДК в воздухе рабочей зоны, а также на основании результатов подострого (20 - 30-дневного круглосуточного) эксперимента.
3.1.7. ОБУВ не разрабатывается для веществ, опасных в плане развития отдаленных и необратимых эффектов, если их ПДК в воздухе рабочей зоны были установлены без учета этих эффектов.
3.2. Основные этапы токсикологических исследований
Для обоснования гигиенического норматива ЛС необходимы сведения о его химическом строении, физико-химических характеристиках, условиях производства и поступления в окружающую среду, фармакологической активности, токсических свойствах.
Исследования по гигиеническому нормированию ЛС проводятся в соответствии с требованиями методических указаний по обоснованию ПДК загрязняющих веществ в атмосферном воздухе населенных мест (2).
При обосновании гигиенического норматива допустимо использование отечественных и зарубежных данных о фармакологических и токсических свойствах исследуемого ЛС.
3.2.1. Исследование острой токсичности. Исследования проводят на 2 - 3 видах при пероральном и внутрибрюшном введении. При планировании эксперимента целесообразно использовать расчетные значения ЛД50, CL50 (раздел 2.2.1).
3.2.2. Установление порога острого действия. Исследования, как правило, проводят на крысах при ингаляционном пути поступления. При сравнительном изучении ЛС, сходных по своей фармакологической активности с ранее нормированными в атмосферном воздухе препаратами, допустимо использование перорального или парентерального пути введения. Продолжительность ингаляционной экспозиции - 4 часа. С целью накопления данных о биологической активности ЛС при ингаляционном поступлении желательно также установление порога острого действия при 24-часовом воздействии.
При планировании экспериментальных исследований целесообразно использовать расчетные методы (49, 50, 59), а также положения, представленные в разделе 2 настоящих МУ.
3.2.3. Изучение раздражающего, ольфакторного и сенсибилизирующего действия. Ольфакторное и раздражающее действие ЛС изучается в соответствии с действующими МУ. Оценка сенсибилизирующего и иммунотоксического действия ЛС осуществляется с учетом положений, изложенных в требованиях к постановке исследований по обоснованию предельно допустимых концентраций промышленных химических аллергенов (40), рекомендаций по экспериментальному изучению иммунотоксических свойств (47), оценке аллергенных свойств фармакологических средств (64), а также положений раздела 2.2.4 настоящих МУ.
3.2.4. Изучение кумулятивного действия. Исследование кумулятивного действия ЛС проводится методом Ю.С. Кагана с введением 1/10 ЛД50 или в тесте субхронической токсичности Лима и соавт. в модификации К.К. Сидорова.
3.2.5. Проведение подострого эксперимента. С целью ускоренного обоснования ПДК целесообразно проведение подострого ингаляционного (20 - 30-дневного круглосуточного) эксперимента с использованием 4 - 6 концентраций ЛС. В качестве первой исследуется концентрация, равная Limac. Каждая из последующих концентраций должна быть меньше предыдущей в 6 - 10 раз (если вещество высококумулятивное) или в 2,5 - 3 раза (если вещество малокумулятивное).
Интервал между обследованиями в течение подострого опыта определяется концентрацией и сроком проведения эксперимента. При воздействии высоких концентраций исследования биологических показателей проводятся с коротким интервалом времени (несколько часов). Для меньших концентраций, когда время наступления ожидаемого эффекта возрастает, интервалы между повторными исследованиями увеличиваются до 1 - 7 дней. На протяжении воздействия каждой концентрации проводится не менее 3 - 5 исследований, что позволяет установить время наступления определенных (стандартных) изменений изучаемых показателей у экспериментальных животных. В качестве стандартных принимаются изменения, соответствующие принятым в настоящее время критериям вредного действия в соответствии с методическими указаниями по обоснованию ПДК загрязняющих веществ в атмосферном воздухе населенных мест (2).
3.3. Обоснование ориентировочных безопасных уровней воздействия ЛС
Для обоснования ОБУВ необходимы сведения о величинах ЛД50, Limac кумулятивном действии, характере действия вещества на кожу и слизистые оболочки глаз, сенсибилизирующем действии, значениях терапевтических доз.
3.3.1. Обоснование ОБУВ проводится путем расчета (27, 49, 50):
- по значениям минимальной суточной терапевтической дозы (МСТД) и высшей допустимой суточной дозы (ВСТД);
- по параметрам токсикометрии (ЛД50 в/ж и в/б, Limac, Kкум при введении 1/10 ЛД50, Zsp);
- по установленным в законодательном порядке гигиеническим нормативам (ПДК, ОБУВ) для воздуха рабочей зоны.
Для установления ОБУВ рекомендуется производить расчеты по нескольким уравнениям с последующим вычислением среднегеометрической величины и с учетом значимости (весового коэффициента) уравнения:
|
|
(31) |
Y - величина ОБУВ (в логарифмических единицах), полученная по i-уравнению,
Wi - весовой коэффициент.
3.3.2. Ограничения для расчета ОБУВ по величине МСТД и ВСТД см. в п. 2.2.6.2.
3.3.3. Расчет величины ОБУВ по значению ПДК в воздухе рабочей зоны проводится с использованием следующих формул:
|
lgОБУВ = 0,67lgПДКр.з. - 1,7 (W = 1,0) |
(32) |
Кроме того следует использовать формулы, учитывающие класс опасности ЛС в воздухе рабочей зоны:
для ЛС 1 класса опасности:
|
lgОБУВ = 1,35lgПДКр.з. - 0,641 (W = 1,0) |
(33) |
для ЛС 2 класса опасности:
|
lgОБУВ = 0,1lgПДКр.з. - 1,99 (W = 1,0) |
(34) |
для ЛС 3 класса опасности:
при ПДКр.з. ≥ 2
|
ОБУВ = -0,00599 + 0,0115ПДКр.з. (W = 1,0) |
(35) |
при ПДКр.з. < 2
|
ОБУВ = 0,0218 + 0,00772ПДКр.з. (W = 1,0) |
(36) |
для ЛС 4 класса опасности:
3.3.4. Расчет величины ОБУВ по значениям МСТД и ВСТД (в г) проводится с применением следующих уравнений:
20 - суточный объем легочной вентиляции (м3);
K1 - коэффициент, отражающий степень задержки аэрозоля в организме (в долях единицы), при отсутствии данных K1 = 1,0;
K4 - коэффициент перехода от МСТД к допустимому уровню воздействия, рекомендуемый на уровне 800.
K5 - коэффициент перехода от ВСТД к допустимому уровню воздействия, рекомендуемый на уровне 2500.
Вышеприведенные формулы 40а и 40б целесообразно использовать для прогнозирования гигиенических нормативов ЛС, имеющих нормированные в атмосферном воздухе аналоги. Предварительно проводится расчет коэффициентов K4 и K5 для ранее исследованных ЛС и затем полученная величина используется для прогнозирования гигиенических нормативов других представителей данной фармакологической группы.
3.3.5. Расчет ОБУВ по значениям параметров токсикометрии:
|
lgОБУВ = 0,64lgLimac - 2,67 (W = 0,46) |
(41) |
|
lgОБУВ = 0,48lgLimac + 0,61lgKкум - 3 (W = 0,5) |
(42) |
|
lgОБУВ = 0,42lgМСТД + 0,16lgЛД50 в/бр - 2,01 (W = 0,8) |
(43) |
3.3.6. При обосновании ОБУВ полупродуктов синтеза лекарственных препаратов наряду с уравнениями 32 - 37, 41, 42 могут использоваться следующие уравнения:
|
lgОБУВ = 0,53lgЛД50 в/ж + 0,56lgKкум - 3,8 (W = 0,35) |
(44) |
|
lgОБУВ = 0,23lgЛД50 в/ж + 0,33lgLimac + 0,55Kкум - 3,56 (W = 0,5) |
(45) |
Следует также руководствоваться МУ (27).
3.4. Полная токсикологическая оценка
3.4.1. Полная токсикологическая оценка с хроническим экспериментом проводится в соответствии с п. 3.1.1 настоящих МУ, а также (2, 25). Выбор концентраций для проведения хронического ингаляционного эксперимента осуществляется с учетом величин Limac, ОБУВ (раздел 3.3), а также прогнозируемой величины порога хронического действия в условиях круглосуточного эксперимента.
|
lgLimch = 0,71lgПДКр.з. - 0,98 (W = 0,35) |
(46) |
|
lgLimch = 0,16lgЛД50 + 0,42lgLimac + 0,65Kкум - 2,65 |
(47) |
3.4.2. Условия эксперимента должны соответствовать требованиям методических указаний по обоснованию ПДК загрязняющих веществ в атмосферном воздухе населенных мест (2).
В связи с тем, что большинство ЛС представляют собой вредные вещества, находящиеся в воздухе в виде аэрозоля дезинтеграции, необходимо обращать особое внимание на точность дозирования поступления ЛС в затравочные камеры и поддержание относительно стабильных концентраций. Предпочтительным является использование автоматических систем поддержания заданных концентраций аэрозоля в затравочных камерах. Дисперсность исследуемого аэрозоля должна соответствовать размерам частиц ЛС, находящихся в атмосферном воздухе. При отсутствии данных натурных наблюдений в эксперименте целесообразно исследовать образцы аэрозоля ЛС с дисперсностью от 0,1 до 10 мкм, при этом частиц с диаметром 10 мкм должно быть не более 5 %, размером 2 мкм не менее 85 % от массы всех частиц.
3.4.3. При определении порога хронического действия ЛС наряду с интегральными показателями необходимо исследовать специфические показатели, характеризующие его избирательное фармакологическое и побочное токсическое действие. При этом используются физиологические, биохимические, гематологические методы, адекватные механизму фармакологического действия изучаемого ЛС и спектру его побочного действия (раздел 2, приложения 3 и 4).
3.4.4. При изучении комбинированных ЛС, содержащих два или более компонента, необходимо исследовать токсичность каждого из компонентов отдельно, а также токсичность всей комбинации в целом. Общие принципы подобных исследований представлены в методических рекомендациях к постановке экспериментальных исследований по изучению характера комбинированного действия химических веществ (38). В том случае, когда комбинированный эффект препарата обусловлен преимущественно действием одного (или нескольких, обладающих одинаковым фармакологическим действием) ЛС, гигиенический норматив устанавливается по данному веществу. Аналогичный подход используется при гигиеническом нормировании многокомпонентных препаратов постоянного состава, содержащих ранее не нормированные ингредиенты. Подобную смесь правомерно рассматривать как одно вещество и исследовать ее с применением обычной схемы гигиенического нормирования. Контроль за содержанием препарата в затравочных камерах и последующее обоснование гигиенического норматива проводится по наиболее активному лекарственному веществу.
3.4.5. В результате хронического эксперимента должны быть установлены пороговая и недействующая концентрации по интегральным и специфическим показателям, определена зона специфического действия, класс опасности, выявлены органы и системы организма, чувствительные к действию исследуемого вещества. В связи с тем, что большинство исследованных ЛС обладают преимущественно резорбтивным действием, для них необходимо устанавливать среднесуточную ПДК (ПДК устанавливается от порога хронического действия с учетом K3) и в дополнение к ней максимальную разовую концентрацию на уровне 98 % вероятности ее появления в хроническом эксперименте. Минимальные различия между максимально разовой и среднесуточной концентрациями должны составлять не менее 2,5 (2).
4. Гигиеническое нормирование лекарственных средств в воде водных объектов
4.1. Схема этапного обоснования нормативов ЛС в воде
Научной основой для определения оптимального объема исследований служит схема этапного нормирования (33, приложение 5).
Составной частью схемы является классификация опасности веществ, загрязняющих воду (приложение 6).
4.2. Физико-химическая характеристика вещества
Для определения объема, условий и цели исследования необходимо получить производственную и физико-химическую характеристику лекарственного препарата.
Особое внимание уделяется показателям растворимости, стабильности и параметрам, используемым для прогноза токсичности и опасности веществ. Необходимо указать примеси, т.к. они могут оказать влияние на токсичность и органолептические свойства.
4.3. Оценка стабильности и трансформации ЛС в водной среде
Цель исследования стабильности и трансформации веществ - уточнение класса опасности, величины норматива и определение химического ингредиента, подлежащего текущему санитарному контролю в воде. Дополнительно эти исследования могут позволить уточнить методы очистки сточных вод от изучаемого вещества.
Схема изучения стабильности и трансформации ЛС в воде включает минимальный и оптимальный наборы взаимодополняющих факторов (приложение 7).
4.3.1. Методы определения стабильности и трансформации включают физико-химические аналитические методики, органолептические исследования и методы биотестирования.
4.3.2. Класс опасности веществ по стабильности определяется последовательно на основании комплексной оценки (приложение 8). В качестве лимитирующего показателя стабильности химического агента принимается τ1/2 в "модельном водоеме" или показатели биоразлагаемости. Оценка опасности продуктов трансформации - по результатам опытов с дополнительными деструктирующими факторами.
4.3.3. Гигиеническая оценка опасности вещества и нормирование его в воде зависят от класса стабильности (приложение 8).
- Для чрезвычайно стабильных веществ, способных к биоаккумуляции в трофических цепях, класс опасности по токсико-гигиеническим показателям изменяется на единицу. Например, вещество 2 класса опасности, но чрезвычайно стабильное (1 класс стабильности), относят к 1 классу опасности. При установлении величины ПДК вводится дополнительный коэффициент запаса, равный 10.
- Если вещество отнесено к стабильным (2 класс стабильности), класс опасности остается неизменным, но в величину ПДК вводится дополнительный коэффициент запаса Kз = 5.
- Для веществ 3 класса стабильности при оценке опасности на первое место выступает сравнительная оценка опасности исходного вещества и продуктов трансформации. Норматив устанавливается по более опасному компоненту. Контроль по более опасному веществу (например, продукту трансформации) целесообразно периодически дополнять контролем за содержанием исходного вещества.
- Для веществ 4 класса стабильности нормативы не устанавливаются. Разрабатываются рекомендации по очистке производственных сточных вод от этих соединений. Если вещества разлагаются с образованием компонентов, свойственных составу природной воды, контроль может осуществляться по этим показателям. Если образуются новые вещества, обосновываются нормативы для продуктов трансформации.
4.4. Определение пороговых концентраций по влиянию веществ на органолептические свойства воды
Целью изучения органолептических свойств воды является установление пороговых концентраций веществ (ПКорг).
Исследование органолептических свойств воды осуществляется согласно МУ (33) и в соответствии с положениями, отраженными в работах (12, 13, 62).
Физиологически инертные вспомогательные вещества, абсолютно нерастворимые и несмачивающиеся, относящиеся к 4 классу опасности (ЛД50 > 10000), не вызывающие изменении в кратковременных опытах в дозах > 500 мг/кг, могут нормироваться, как взвешенные природные вещества на уровне 0,25 мг/л.
4.5. Экспериментальное установление пороговых концентраций веществ по влиянию на процессы самоочищения водных объектов
Целью экспериментального гигиенического исследования влияния ЛС на процессы естественного самоочищения водных объектов является обоснование ПК пороговых концентраций вещества по общесанитарному признаку вредности (ПКсан.).
Исследования осуществляются согласно МУ (33) и в соответствии с положениями, отраженными в работах (8, 14).
4.6. Установление смертельных эффектов веществ
В острых опытах устанавливают среднесмертельные дозы (ЛД50) на лабораторных животных.
Острая токсичность изучается при введении в желудок, нанесении на кожу, а в дополнительных опытах - для решения специальных задач - при парентеральном введении, например, внутрибрюшинном. Общепринятыми методами устанавливаются значения среднесмертельных доз (24, 26).
Токсичность при накожном нанесении изучается согласно методическим рекомендациям 2377-81 (23).
В дополнение к ЛД50 по данным острого опыта рассчитывают параметры, дающие первое представление о способности веществ к кумуляции: среднее время гибели (ЛТ50) и индекс кумуляции (60).
При нормировании ЛС, как правило, достаточен минимальный объем острых экспериментов с целью определения идентичности исследуемого образца изученному в доклинических испытаниях препарату. В ряде случаев вместо животных можно ограничиться опытами на культуре клеток или других доступных биотестах, например, дафниях, в соответствии с методическими указаниями (29) и приложением 11.
4.7. Порог однократного действия при поступлении ЛС в организм
Определение порога однократного действия ЛС необходимо в тех случаях, когда не установлены терапевтические разовые и суточные дозы.
Цель исследования:
- определить верхний предел доз для подострого эксперимента и оптимальное время наблюдения после введения вещества;
- получить характеристику кумулятивных свойств;
- при необходимости - изучить токсикокинетику и процесс детоксикации вещества;
- рассчитать зону острого действия.
4.7.1. Порог однократного действия определяется на белых крысах по интегральным и специфическим показателям с обязательным определением изменений в динамике в течение суток (или нескольких суток - в зависимости от ЛТ50). Время первого определения устанавливается, исходя из клинической картины отравления в остром опыте, но не позднее 2 часов, затем, например, через 4 или 6 - 12 - 24 часа после затравки, а также через 2, 4 и 8 дней после нее. Возможны и другие сроки наблюдения с учетом токсикодинамики и/или токсикокинетики. Порог однократного действия может быть установлен эмпирически или рассчитан как вероятностная величина (Dmin50 - среднепороговая величина однократного действия) или дополнен результатами токсикокинетических исследований.
4.7.2. Для специальных научных целей можно определить кинетику накопления и выведения вещества и/или его метаболитов в организме.
4.8. Токсикометрия в подострых опытах
Подострые опыты направлены на получение следующей информации:
- способность веществ к кумуляции;
- наиболее поражаемые функции, органы, системы организма, механизм токсического действия;
- пороговые дозы подострого или субхронического действия вещества на организм.
4.8.1. Для оценки кумуляции по смертельному эффекту целесообразно использовать метод Ю.С. Кагана и В.В. Станкевича, согласно которому подопытным животным в течение 4 месяцев вводится ежедневно вещество в нескольких постоянных дозах с последующим расчетом коэффициента кумуляции.
Процессы материальной кумуляции и детоксикации веществ целесообразно изучать в специальных токсикокинетических исследованиях.
4.8.2. Наибольшую информативную ценность представляет подострый эксперимент, направленный на определение характера (механизма) токсического действия; изучение токсикодинамики в рамках зависимости "доза-эффект" во времени; установление пороговой дозы подострого эксперимента (ПДпэк); расчет зоны кумулятивного действия; установление класса опасности по кумуляции; прогноз пороговой дозы хронического действия (ПДxp).
Условия проведения подострого опыта должны соответствовать требованиям, представленным в (33).
Набор методов должен предусматривать изучение как специфического, так и общетоксического действия по интегральным показателям. При оценке ЛС специфические эффекты связаны с механизмом фармакологического действия, "побочное действие" с гигиенических позиций рассматривается как общетоксическое, а "противопоказания" могут дать основания к дополнительному исследованию отдаленных (гонадо-, эмбриотоксичность, мутагенез) и нежелательных специфических (сенсибилизация, иммунотоксичность) эффектов.
4.8.3. В эксперименте изучается не менее 3 доз вещества. Выбор доз осуществляется на основе прогноза ПД и МНД, результатов определения порогов острого действия.
Для ЛС, принимаемых внутрь, дозы определяются, исходя из суточной терапевтической дозы. При этом высшая доза для подострого эксперимента должна быть в 5 - 10 раз ниже суточной терапевтической дозы, выраженной в мг/кг. Возможен пересчет терапевтических суточных доз веществ, вводимых парентерально, исходя из полученных в доклинических испытаниях соотношений терапевтической активности при разных путях поступления.
Шаг между дозами определяется кумулятивностью вещества: 3 - 5-кратный - для 3 - 4 классов, 5 - 10-кратный - для 1 - 2 классов кумуляции. Одним из критериев способности к кумуляции служит зона терапевтического действия: чем больше зона терапевтического действия (ЛД50/ТД), тем больше выражена способность к кумуляции.
4.8.4. Исследования проводятся, как правило, на белых крысах. При выраженных (более 5 раз) различиях в видовой чувствительности по 50 обязательны дополнительные исследования на наиболее чувствительном виде животных. Вид подопытных животных определяется также особенностью биологических эффектов изучаемого вещества. Например, для изучения аллергенного эффекта используются морские свинки, для выявления мутагенного эффекта - специальные линии мышей, для определения влияния на микрофлору кишечника - белые крысы и т.п.
4.8.5. Длительность опыта - не менее 30 дней. Однако опыт может быть продлен до 2 - 3 месяцев, если известно, что изучаемый препарат вызывает изменение замедленно реагирующих систем, например, липидного обмена, костной системы, обмена кальция и т.п.
После снятия фоновых показателей проводятся наблюдения на 5 - 10 - 20 и 30 сутки. Если не определялся порог однократного действия, необходимо исследование в 1 сутки.
4.8.6. В подостром опыте применяются дополнительные функциональные (физическая, термическая и т.п.) или материальные (амидопириновая, гексеналовая и т.п.) нагрузки: однократно в конце опыта или через каждые 2 недели. При выборе нагрузки следует учитывать данные исследования, свидетельствующие о том, что чем более нагрузка соответствует механизму действия ЛС, тем более закономерные данные могут быть получены (приложения 3, 4).
Наиболее предпочтительна нагрузка изучаемым веществом в дозах, превышающих порог однократного действия в 2 - 5 раз - в зависимости от способности к кумуляции.
После материальной нагрузки, особенно изучаемым веществом, животных выводят из эксперимента.
4.8.7. В результате подострого опыта определяется пороговая доза подострого эксперимента (ПДпэк) - доза ЛС, при энтеральном поступлении которой в организм в течение 30 дней возникают изменения, минимальные по статистическим и биологическим критериям.
В отличие от гигиены труда, при оценке опасности загрязнения окружающей среды учитывается неблагоприятное влияние ЛС на организм всей совокупности человеческой популяции, включая детей, стариков, больных и т.п. - на протяжении всей жизни. Поэтому показателем вредного действия считаются любые начальные изменения отдельных функциональных показателей. При этом важна дифференциация закономерных проявлений токсического действия веществ от случайных изменений.
После установления ПДпэк определяется способность веществ к кумуляции по отношению ЛД50/ПДпэк, класс опасности и коэффициент J для прогноза пороговой дозы хронического действия (приложение 9).
Величина коэффициента J зависит от способности веществ к кумуляции и степени изученности класса соединений, к которому относится изучаемое ЛС. Поскольку ЛС, как правило, относятся к изученным классам веществ с известным механизмом действия, допустимо использовать коэффициент J1 для прогноза ПДхр. по ПДпэк.
4.8.8. Коэффициент запаса для расчета МНД определяется по таблице (приложение 10), исходя из класса опасности вещества по кумуляции и по способности вызывать отдаленные эффекты. Из рассчитанных МНД выбирается наименьшая.
4.9. Проведение хронического санитарно-токсикологического опыта
4.9.1. Хронический опыт проводится в случаях, указанных в МУ (33). Кроме того, хронический опыт проводят, если в подостром опыте выявлены новые виды эффектов, развитие которых соизмеримо с длительностью жизни, например, изменение костной системы, героэффект.
Условия проведения хронического опыта представлены в (33).
4.9.2. На основании хронического эксперимента определяется пороговая доза (ПДхр.). В соответствии с приложением 10, определяется допустимая суточная доза при пероральном поступлении (ДСД) и МНД в миллиграммах на 1 кг веса тела. Если вещество является летучим, легко проникающим через кожу и достаточно широко распространено в окружающей среде, МНД устанавливается в процентах от допустимой суточной дозы в соответствии с существующими методиками и рекомендациями.
4.9.3. Оценка токсичности и опасности вещества проводится по классификации (приложение 9). При этом предпочтение отдается результатам хронического опыта перед подострым.
4.10. Обоснование величины ПДК (ОДУ) ЛС в воде
Для обоснования величины ПДК (ОДУ) исследуемого вещества в воде сопоставляются пороговые величины по органолептическому и общесанитарному признакам вредности и максимальная недействующая концентрация по токсикологическому признаку вредности (МНК).
4.10.1. МНК рассчитывается из величины МНД с учетом среднего веса человека и суточного водопотребления (включающего питьевую воду и используемую для приготовления пищи, чая, кофе) по формуле:
![]()
где М - средняя масса взрослого человека;
V - объем суточного водопотребления;
К - обобщенный коэффициент пересчета МНК по МНД.
Для России, с учетом районов с жарким климатом, в которых водопотребление реализуется в основном за счет воды и чая и составляет в сутки не менее 3 л, а также принятого среднего веса на уровне 60 кг, расчет МНК осуществляется по формуле:
МНК = МНД·20
4.10.2. Величина МНК сопоставляется с пороговыми концентрациями по органолептическому и общесанитарному признакам вредности и наименьшая из них принимается в качестве ПДК (ОДУ). Класс опасности устанавливается по таблице (приложение 6) с учетом стабильности (приложение 8).
4.11. Нормирование препаратов смешанного состава
4.11.1. Согласно действующему санитарному законодательству, регламентация смесей веществ в воде водных объектов может быть проведена лишь при наличии ВФС или ФС.
4.11.2. Технологические лекарственные смеси постоянного (фиксированного) состава, определенные ФС, подлежат изучению как одно вещество, с установлением суммарных пороговых концентраций веществ, действующих в составе смеси, по влиянию на органолептические свойства воды и санитарный режим водоемов, а также суммарных максимальных неэффективных доз по общетоксическим и специфическим эффектам. На этой основе устанавливают, как обычно, лимитирующий признак вредности и класс опасности изучаемой смеси. Суммарная нормативная величина, найденная по лимитирующему признаку вредности, предназначена для использования при решении вопросов предупредительного санитарного надзора, для расчета ПДВ и т.д., т.е. может использоваться в качестве ОДУ.
4.11.3. Для обоснования ПДК требуется определить индикаторные вещества, т.е. компонент смеси, по которому следует проводить аналитический контроль за реальным содержанием нормируемой смеси в воде в пределах суммарного норматива. Выбор индикаторного вещества необходимо проводить на основе критериев и принципов, приведенных ниже в порядке приоритетности:
- выявление наиболее токсичных и опасных компонентов и/или продуктов их трансформации;
- изучение сравнительной стабильности компонентов смеси в воде, в том числе по показателям биоразлагаемости;
- учет относительной массы (процентного содержания) ЛС, входящих в состав смеси;
- учет компонентов, определяющих технологическое предназначение препарата;
- наличие метода определения индикаторного вещества в воде.
Учитывают также характеристики биологической активности компонентов по данным литературы или по химической структуре, общие закономерности биотрансформации в организме и превращений в воде. Особого внимания требуют продукты трансформации, которые могут оказаться более токсичными и опасными, чем компоненты смеси. С другой стороны, в исходный состав смеси могут входить одно или более веществ, ранее не изученных по токсикологическим и гигиеническим критериям. В подобных случаях может возникнуть необходимость в дополнительном изучении индивидуального действия этих веществ (главным образом тогда, когда такое вещество может выступать как индикатор смеси). Гигиеническое нормирование смеси проводится согласно (60).
4.12. Особенности нормирования лекарственных средств в зависимости от их фармакологических свойств
С гигиенических позиций ЛС с учетом технологии производства и применения могут быть условно разделены на 5 групп, различающихся по некоторым особенностям научного обоснования нормативов в воде (63):
1-я - ЛС с преимущественным действием на функциональное состояние отдельных органов и систем;
2-я - химиотерапевтические средства, например, сульфаниламиды, антибиотики;
3-я - ЛС, влияющие на обмен веществ, витамины, адаптогены, эссенциальные средства;
4-я - ЛС для наружного применения;
5-я - полупродукты синтеза фармакологических препаратов.
Для каждой из перечисленных групп требуются дополнительные или уточняющие методические подходы.
4.12.1. При нормировании ЛС 1 группы следует рассматривать терапевтические дозы как действующие и изучать в подострых и хронических опытах дозы более низкие, чем терапевтические. Методы исследования должны включать как показатели, связанные с механизмом терапевтического действия, так и характеризующие побочные эффекты и противопоказания. Обязательно применение специфических дополнительных нагрузок.
4.12.2. При нормировании ЛС 2 группы - химиотерапевтических средств - следует учитывать их относительно малую токсичность наряду с высокой антимикробной и сенсибилизирующей активностью, что обусловливает необходимость изучать дисбиотическое действие на микробиоценоз организма подопытных животных и аллергенные эффекты.
Принимая во внимание то, что антибиотики и сульфаниламиды часто и длительно используются населением для лечения и в том числе - самолечения, необходимо в подострых и хронических опытах применять чередующиеся нагрузки изучаемым веществом в терапевтических дозах по системе, адекватной схеме лечения человека, но с учетом отличий длительности жизни и скорости обменных процессов у животных.
4.12.3. Фармакологические свойства химиотерапевтических ЛС находят отражение в их влиянии на процессы естественного самоочищения водных объектов, что требует специального изучения динамики роста и отмирания сапрофитной микрофлоры.
4.12.4. Наибольшие сложности возникают при гигиеническом нормировании препаратов 3 группы. В случае гигиенического нормирования ЛС, являющихся компонентами питания, необходимо учитывать суточную потребность человека в этих веществах.
При планировании исследований по нормированию ряда ЛС в воде следует принимать во внимание особенности поведения вещества в зависимости от пути поступления в организм.
4.12.5. При изучении токсичности ЛС наружного применения (4 группа) наряду с общепринятой программой исследований обязательным дополнительным элементом является углубленное изучение местного раздражающего и кожно-резорбтивного действия.
4.12.6. При обосновании ПДК и ОДУ полупродуктов синтеза лекарственных средств (5 группа) план исследований максимально приближается к общепринятому. Однако и в этом случае полезно учитывать фармакологические свойства конечных продуктов.
4.12.7. Основой для ускоренного нормирования ЛС может служить пока лишь экспресс-эксперимент, предусматривающий проведение подострых опытов с последующим прогнозом пороговых уровней длительного воздействия на основе количественной оценки кумуляции и изоэффективных доз 30-дневного опыта (ПДпэк).
В соответствии с экспериментально установленными ПДпэк и классом опасности по кумуляции (соотношение ЛД50/ПДпэк) рекомендованы коэффициенты запаса для прогноза ПД.
4.12.8. Применение расчетных формул, представленных в (34), возможно лишь для промежуточных продуктов в пределах изученных структурных рядов или при наличии расчетных уравнений для ЛС и их полупродуктов, объединенных общим механизмом действия. При наличии ряда ЛС с общими строением, механизмом действия и обоснованными нормативами допустимо нормирование по аналогии.
С учетом особенностей фармакологического и токсического действия, применения и технологии производства, в отдельных случаях (например, наркотические анальгетики, гормональные препараты, противоопухолевые цитостатики) должно быть принято решение о запрете их сброса в водную среду.
Перечень условных обозначений
|
АОК |
- антителообразующие клетки |
|
в/бр |
- внутрибрюшинно |
|
в/в |
- внутривенно |
|
в/ж |
- внутрижелудочно |
|
ВСТД |
- высшая суточная терапевтическая официально регламентируемая доза |
|
ВФС |
- временная фармакопейная статья |
|
ГЗТ |
- гиперчувствительность замедленного типа |
|
ДА |
- двигательная активность |
|
ЕД50 |
- доза, вызывающая эффект у 50 % животных |
|
КВР |
- коэффициент видовых различий |
|
Кз |
- коэффициент запаса |
|
Ккум |
- коэффициент кумуляции |
|
Ко/к |
- орально-кожный коэффициент |
|
КПЧ |
- коэффициент половой чувствительности |
|
ЛД50 |
- среднесмертельная доза |
|
ЛС |
- лекарственное средство |
|
ЛТ50 |
- среднее время выживания 50 % животных после острого воздействия вещества |
|
МДД |
- минимально действующая (эффективная ) доза, определяемая по специфическому фармакологическому эффекту в эксперименте |
|
МНД |
- максимальная недействующая доза |
|
МНК |
- максимальная недействующая концентрация |
|
МСТД |
- минимальное значение суточной терапевтической дозы |
|
МТД |
- минимально токсическая доза, испытание которой в эксперименте на животных сопровождается патологическими явлениями |
|
МУ |
- методические указания |
|
НСТ-тест |
- тест восстановления нитро-синего тетразолия в формазан |
|
ОБУВ |
- ориентировочно безопасный уровень воздействия |
|
ОДУ |
- ориентировочно допустимый уровень |
|
ПД |
- пороговая доза |
|
ПДВ |
- предельно допустимый выброс |
|
ПДК |
- предельно допустимая концентрация |
|
ПДобщ. |
- пороговая доза общетоксического действия |
|
ПДоднокр. |
- пороговая доза однократного действия |
|
ПДотд. |
- пороговая доза по отдаленным эффектам |
|
ПДпэк |
- пороговая доза подострого эксперимента |
|
ПДС |
- предельно допустимый сброс |
|
ПДхр. |
- пороговая доза хронического эксперимента |
|
ПДэмбр. |
- пороговая доза по эмбриотоксическому действию |
|
П/к |
- подкожно |
|
ПК |
- пороговая концентрация |
|
ПКорг. |
- пороговая концентрация вещества по органолептическому признаку вредности (максимальная концентрация вещества в воде, при которой не обнаруживаются неблагоприятные для населения органолептические свойства воды) |
|
НКсан. |
- пороговая концентрация вещества по общесанитарному признаку вредности (максимальная концентрация, не приводящая к изменению процессов естественного самоочищения воды водных объектов) |
|
РТПХ |
- реакция "трансплантат против хозяина" |
|
ССТД |
- средняя суточная терапевтическая доза. Устанавливается в опытах на животных и корректируется в процессе клинических испытаний (ниже МТД, но выше МДД) |
|
ТД |
- терапевтическая доза |
|
ТИ |
- терапевтический индекс ( показатель широты терапевтического действия, представляет собой отношение ЛД50/ЕД50) |
|
ТСТ |
- тест субхронической токсичности |
|
ФС |
- фармакопейная статья |
|
ЦНС |
- центральная нервная система |
|
CL50 |
- среднесмертельная концентрация в воздухе |
|
ET50 |
- среднее время проявления эффекта (среднее время, за которое проявляется какой-либо эффект у 50 % особей данного вида после острого воздействия |
|
LC0 |
- максимальная концентрация вещества в воде, не вызывающая гибели гидробионтов за определенный период наблюдения |
|
LC50 |
- средняя летальная концентрация, вызывающая гибель 50 % гидробионтов за определенный период наблюдения |
|
LC100 |
- минимальная концентрация вещества в воде, вызывающая гибель всех гидробионтов за определенный период наблюдения |
|
Limac |
- порог острого интегрального (общетоксического) действия |
|
Limac pharm |
- порог острого действия по фармакологическим показателям |
|
Limch |
- порог хронического действия по интегральным (общетоксическим показателям) |
|
Limim |
- порог иммунотропного действия в подостром эксперименте |
|
LT50 |
- среднее время выживания 50 % гидробионтов в ряду концентраций |
|
Zsp |
- зона специфического действия |
|
τ1/2 |
- период полураспада вещества в воде |
______________
* Скорость в/в введения в соответствии с требованиями Государственной Фармакопеи (0,1 мл/с).
Приложение 1
(справочное)
Этапы создания новых ЛС
|
Этап |
Качественные и количественные характеристики ЛС |
Разрабатываемые официальные документы |
|
1. Доклинический |
Химико-фармацевтические Химическое рациональное название по ЮРАС. Синонимы. Товарные наименования, химический класс, эмпирическая и структурная формулы, физико-химические свойства, стабильность, примеси, срок хранения субстанции, готовых лекарственных форм |
Проект временной фармакопейной статьи |
|
|
Фармакологические ЕД50, ТИ, МТД, ССТД, МСТД, ВСТД, механизм действия, фармакологическая группа, список А, список Б, способы введения, биодоступность, фармакокинетика, показания, противопоказания, побочное действие |
Проект инструкции по клиническим испытаниям |
|
|
Токсикологические ЛД50, ЛД16, ЛД84 для 2 - 3 видов животных при 2 - 3 путях введения, КПЧ, КВР, кумулятивные свойства, характер токсического действия при однократном, подостром и хроническом введении 2 - 3 видам животных (включая собак) на уровне ВСТД и выше. Мутагенность, тератогенность, канцерогенность, аллергенность, влияние на репродуктивную функцию, потомство, на иммунную систему; экспериментальная терапия при отравлениях и передозировке |
Рекомендации к инструкции по клиническим испытаниям |
|
2. Клинический |
Коррекция терапевтических доз, принадлежность к спискам А и Б; уточнение механизма действия, способов введения, показаний и противопоказаний; характер и частота побочных эффектов |
Инструкция по медицинскому применению, внесение в Госреестр и Госфармакопею, фармакопейная статья |
Приложение 2
(справочное)
Этапы гигиенической регламентации ЛС в воздухе рабочей зоны
|
Этап |
Содержание исследований |
|
1. Предварительная токсикологическая оценка |
Анализ данных о предполагаемом объеме производства, литературных и отчетных данных о фармакологических характеристиках ЛС (приложение 1). Расчет ОБУВ, принятие решения о направлениях и объеме исследований, виде гигиенического регламента (ОБУВ, ПДК, запрещение контакта). Разработка метода контроля вещества в воздухе |
|
2. Ускоренная токсикологическая оценка |
Острые опыты на животных, дополняющие данные приложения 1. Изучение кумулятивного, кожно-резорбтивного и раздражающего действия. Определение порогов острого действия. Проведение подострого эксперимента. Изучение сенсибилизирующего действия. Расчет порога хронического действия и ОБУВ. Обоснование гигиенического регламента (ОБУВ, ПДК, запрещение контакта), принятие решения о необходимости полной токсикологической оценки |
|
3. Полная токсикологическая оценка |
Хронический эксперимент на животных. Установление порогов хронического общетоксического и специфического действия. Оценка отдаленных последствий. Обоснование ПДК |
|
4. Специальные (дополнительные) исследования |
Разработка биологической ПДК, методов ранней диагностики и терапии отравлений |
|
5. Корректировка медико-технических требований к производству |
Изучение условий труда и состояния здоровья работающих |
Приложение 3
(справочное)
Рекомендуемые фармакологические нагрузки на центральную нервную систему
|
Фармакологическая группа |
Фармакологическое вещество (нагрузка) |
Поведенческие и вегетативные проявления |
|
1. Снотворное |
гексенал |
Снижение рефлекторных реакций и ДА, потенцирование сна, ослабление эффектов апоморфина, ареколина, никотина |
|
апоморфин |
||
|
ареколин |
||
|
никотин |
||
|
2. Антидепрессанты |
гексенал |
Усиление ДА, потенцирование гексеналового сна, усиление и потенцирование апоморфиновой, фенаминовой стереотипии, антагонизм с резерпином |
|
апоморфин |
||
|
фенамин |
||
|
резерпин |
||
|
3. Противосудорожные |
коразол |
Блокада эффектов коразола и тоникоэкстензорной фазы электрошока |
|
электрошок |
||
|
4. Психостимуляторы |
фенамин |
Усиление ДА, гипертермия, тремор, судороги (в больших дозах потенцирование фенаминовой и апоморфиновой стереотипии, потенцирование эффектов ареколина, никотина, коразола |
|
апоморфин |
||
|
ареколин |
||
|
никотин |
||
|
коразол |
||
|
5. Транквилизаторы |
гексенал |
Снижение ДА (в больших дозах), потенцирование эффектов гексенала, блокада реакций страха и агрессии |
|
реакция страха и агрессии |
||
|
6. Нейролептики |
гексенал |
Каталепсия, снижение ДА, гипотермия, блокада апоморфиновой стереотипии, потенцирование эффекта гексенала |
|
апоморфин |
||
|
7. Центральные М- и Н-холиномиметики |
апоморфин |
Потенцирование ареколиновых эффектов, потенцирование эффектов апоморфина, фенамина, никотина |
|
фенамин |
||
|
никотин |
||
|
ареколин |
||
|
8. α, β - адреномиметики |
гексенал |
Потенцирование поведенческих реакций и эффектов апоморфина и фенамина |
|
апоморфин |
||
|
фенамин |
||
|
резерпин |
||
|
9. Антихолинэс-теразные |
апоморфин |
Стимуляция поведенческих реакций, потенцирование эффектов ареколина |
|
фенамин |
||
|
никотин |
||
|
ареколин |
||
|
10. Адреноблокаторы |
гексенал |
Усиление ДА (в малых дозах), снижение (в больших), потенцирование эффекта гексенала, усиление и проявление апоморфиновой и фенаминовой стереотипии |
|
апоморфин |
||
|
фенамин |
||
|
резерпин |
Приложение 4
(справочное)
Рекомендуемые фармакологические нагрузки на сердечно-сосудистую систему
|
Фармакологическая группа |
Фармакологическое вещество (нагрузка) |
Ожидаемые реакции взаимодействия |
|
ЛС, действующие на периферические холинергические процессы |
Атропин - 1,0 п/к; через 10 - 14 сек; в течение 60 мин |
Блокада Н-холинорецепторов, тахикардия, уменьшение вариабельности интервала РР на ЭКГ |
|
Прозерин - 1,0 п/к; через 30 мин; в течение 60 мин |
Холиномиметический эффект - нарушение проводимости миокарда, аритмия |
|
|
ЛС, действующие на периферические адренергические процессы |
Адреналин - 4 мкг/кг, в/бр; через 10 мин.; в течение 60 мин |
Адреномиметический эффект - тахикардия, коронароспазм, снижение высоты зубца Т на ЭКГ, нарушение проводимости |
|
Изадрин - 10 мкг/кг, в/бр; через 10 мин.; в течение 60 мин |
Адреномиметический эффект - тахикардия, коронароспазм, снижение высоты зубца Т на ЭКГ, нарушение проводимости |
|
|
Сосудорасширяющие, спазмолитические ЛС |
Питуитрин - 0,15 ME в/в; через 30 сек.; в течение 15 - 20 мин |
Спазм гладкой мускулатуры артериол, увеличение артериального давления, снижение зубца Т на ЭКГ (коронароспазм) |
|
Ангиотензин - 0,5 мкг/кг в/в; через 1 мин.; в течение 15 - 20 мин |
Спазм гладкой мускулатуры периферических сосудов, повышение артериального давления |
Приложение 5
(справочное)
Схема обоснования ПДК веществ в воде
|
№ |
Название стадии |
Объем исследований |
Полученная информация |
Класс опасности для которого достаточна эта стадия |
|
1 |
2 |
3 |
4 |
5 |
|
1 |
Принятие предварительного решения |
Анализ литературы. Изучение технологии производства и/или применения. Ориентировочный расчет гигиенических показателей по физико-химическим параметрам. ПДК в других объектах и других странах |
Расчетные ЛД50 и МНД. Решение о необходимости разработки ПДК, степень приоритетности вещества |
|
|
2 |
Ускоренная оценка |
Оценка влияния на органолептические свойства воды и санитарный режим водоемов. Выявление способности к трансформации. Острые токсикологические опыты, в том числе для определения видовых, половых и возрастных различий чувствительности к веществу. Расчет параметров хронической токсичности по ЛД50, ЛТ50 и смешанным математическим моделям. Определение класса опасности |
Пкорг, Пксан, ЛД50, ЛТ50, К, Пдоднокр, расчетные ПДхр, МНД; класс опасности, ПДК ОДУ, способность вещества к трансформации, класс опасности по трансформации |
IV - ПДК |
|
III - ОДУ |
||||
|
3 |
Экспресс-эксперимент |
Подострый опыт. Изучение гонадотоксического действия по функциональным показателям. Оценка эмбриотоксичности и мутагенного эффекта в скрининговых опытах. Оценка кожно-резорбтивного действия. Прогноз параметров хроническое токсичности и определение класса опасности вещества. Идентификация продуктов трансформации |
ПДпэк, пороговые дозы отдаленных эффектов, расчетные МНД, класс опасности, ПДК, ОДУ |
III - ПДК |
|
II - ОДУ |
||||
|
4 |
Хронический опыт |
Хронический опыт для изучения общетоксического действия. Изучение мутагенного, гонадотоксического эффектов. Оценка токсичности продуктов трансформации. Расчет коэффициентов запаса, экстраполяция данных с животных на человека |
ПДобщ, МНДобщ, ПДотд, К. Сравнительная токсичность продуктов трансформации. Класс опасности, ПДК. |
I - II |
|
5 |
Специальные исследования |
Углубленное изучение канцерогенного, атеросклеротического, аллергенного эффектов. Дополнительные исследования гонадо-, эмбриотоксического мутагенного эффектов. Обоснование ПДК |
ПДхр по специфическим и отдаленным эффектам, ПДК |
I |
|
6 |
Эпидемиологические исследования |
Связь состояния здоровья и условий водопользования населения с содержанием вещества и/или продуктов его трансформации в воде |
Корректировка ПДК. Оценка эффективности гигиенических водоохранных мероприятий. Оценка эффективности гигиенических мероприятий. |
I - IV |
|
Примечание: II - IV стадии схемы могут применяться как к исходному нормируемому веществу, так и к продуктам его трансформации |
||||
Приложение 6
(справочное)
Классификация опасности веществ при этапном обосновании ПДК (ОДУ) веществ в воде
|
Последовательность оценки опасности веществ |
Критерий |
Класс опасности |
|||
|
Первый (чрезвычайно опасные вещества) |
Второй (высокоопасные вещества) |
Третий (умеренно опасные вещества) |
Четвертый (малоопасные вещества) |
||
|
1 |
МНК/ПКорг. |
|
< 1 |
1 - 10 |
> 10 |
|
2 |
МНК, мг/л |
< 0,001 |
0,001 - 0,1 |
0,11 - 10 |
> 10 |
|
3* |
ЛД50/МНД |
> 106 |
106 → 105 |
105 → 104 |
< 104 |
|
4* |
ПДКобщ./ПДотд |
> 10 |
4 - 10 |
1 - 3 |
0,1 - 1 |
|
5 |
стабильность |
> 30 суток |
1 - 30 суток |
1 - 24 часа |
< 60 мин |
|
______________ * проводится только для веществ, отнесенных к первому-третьему классам опасности. |
|||||
Приложение 7
(справочное)
Оптимальная и минимальная схемы изучения стабильности и трансформации
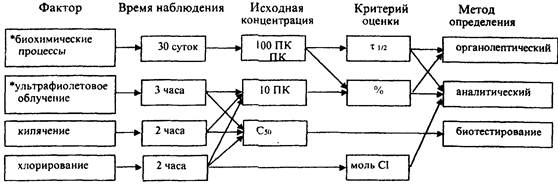
Приложение 8
(справочное)
Гигиеническая классификация веществ по стабильности
|
Класс опасности |
Естественное самоочищение |
При фиксированном времени деструктирующего фактора (УФО, кипячение и т.п.) |
По биоразлагаемости |
Гигиеническая оценка |
|
|
τ1/2 |
% деструкции |
τ индукции активным илом (сут.) |
τ1/2 разложения неадаптированным или адаптированным активным илом (час) |
||
|
1. Чрезвычайно стабильные вещества |
> 30 суток |
< 40 |
> 25 |
> 4,33 |
Класс опасности минус 1. Кз = 10 |
|
2. Стабильные вещества |
1 - 30 суток |
40 - 80 |
3 - 25 |
0,22 - 4,33 |
Кз = 5 |
|
3. Малостабильные вещества |
1 - 24 часа |
81 - 95 |
3 - 10 |
0,22 - 1,5 |
Сравнительная оценка опасности исходного вещества и продуктов трансформации. Нормирование по более опасному соединению |
|
4. Нестабильные вещества |
< 60 мин |
> 95 |
< 3 |
< 0,22 |
Нормируются продукты трансформации |
Приложение 9
(справочное)
Оценка опасности и прогноз пороговой дозы веществ по результатам подострого опыта
|
Классы опасности |
Кумуляция по отношению ЛД50/ПДпэк |
Коэффициент J для расчета ПДхр. по ПДпэк |
||
|
J1 |
J2 |
J3 |
||
|
1. Чрезвычайно опасные вещества |
≥ 10000 |
20 |
100 |
не применяется |
|
2. Высокоопасные вещества |
≥ 1000 |
5 |
10 |
100 |
|
3. Умеренно опасные вещества |
≥ 100 |
3 |
5 |
25 |
|
4. Малоопасные вещества |
≥ 10 |
2 |
3 |
10 |
Приложение 10
(справочное)
Коэффициенты запаса (Кз) для пересчета МВД по величине ПД
|
Класс опасности |
Кз в зависимости от кумуляции |
Кз в зависимости от способности вызывать отдаленные эффекты |
|||
|
ЛД50/ПД |
Кз от ПД общетоксического действия |
Zтр |
Кз от ПД по влиянию на гонады |
Кз от ПД по влиянию на эмбриогенез |
|
|
1. Чрезвычайно опасные вещества |
≥ 105 |
10 |
1 |
10 |
10 |
|
2. Высокоопасные вещества |
105 - 103 |
5 |
0,1 - 1,0 |
5 |
|
|
3. Умеренно опасные вещества |
103 - 102 |
3 |
0,01 - 0,1 |
3 |
|
|
4. Малоопасные вещества |
≤ 102 |
3 |
0,01 |
3 |
|
Приложение 11
(справочное)
Биотестирование лекарственных средств на гидробионтах
11.1. Критерии для постановки исследований
11.1.1. Настоящий раздел МУ определяет методические основы биотестирования ЛС на гидробионтах различных систематических групп для скрининговых исследований при сравнительной оценке токсичности различных ЛС, сопоставлении токсичности изучаемых ЛС и продуктов их трансформации.
11.1.2. Методические указания по биотестированию разработаны для проведения токсикологического контроля различных ЛС.
11.1.3. Биотестирование проводят для определения токсического действия (общего и специфического) испытуемых веществ с выявлением токсикологических параметров острого, подострого и хронического действия и установления нетоксичных концентраций для гидробионтов.
11.1.4. Основными критериями токсического действия на гидробионтов являются показатели выживаемости особей, темпа размножения, роста культуры, интенсивности дыхания и фотосинтеза, изменение фототаксиса хлоропластов, анализ потомства, поведенческие реакции (морфологические, биохимические и физиологические параметры жизнедеятельности гидробионтов).
11.1.5. Для заключения о токсичности изучаемых веществ необходим комплексный подход: анализ результатов экспериментов на группе гидробионтов, обладающих различной чувствительностью к токсикантам.
Изучение токсичности веществ с применением ряда биотестов представляет собой новый комплексный подход к токсикологическому тестированию.
11.1.6. Требования к объектам исследования, способы лабораторного содержания тестовых культур, проведение ряда экспериментов и расчет результатов описаны ранее (29).
11.2. Биотестирование на фитогидробионтах, на одноклеточных протококковых зеленых водорослях сценедесмус - Scenedesmus quadricauda
11.2.1. Сущность метода. Основной метод: степень токсического воздействия изучаемых веществ оценивается по изменению плотности культуры, появлению в ней мертвых клеток в различные интервалы времени воздействия токсиканта. Специфические методы - по изменению интенсивности дыхания с помощью радиоактивной метки (14С) и по изменению продукции фотосинтеза под влиянием вещества (А - Z - тест по Кнеппу).
Приготовление проб для биотестирования, подготовка к эксперименту, проведение основного эксперимента, эксперимента с радиоактивной меткой и А - Z -теста по Кнеппу изложены в (29).
11.2.2. Анализ результатов. В различные интервалы времени - через 1 сут., 3 сут. и так далее (время эксперимента определяют опытным путем в зависимости от токсичности испытуемых веществ: от 1 сут. до 30 сут.) в опытных и контрольных колбах определяют плотность культуры водорослей. Уменьшение или увеличение числа клеток водорослей выражают в процентах от контроля.
Подсчет импульсов мечения углерода (14С) проводят с помощью жидкостного сцинтилляционного спектрометра любой марки, пригодного для обнаружения источников Р-излучений. Показания спектрометра, полученные для трех параллельных проб, усредняют и соотносят к показаниям контроля (100 %). Ингибирование или стимулирование дыхания водорослей выражают в процентах от контроля.
Концентрация вещества, ингибирующего дыхание водорослей более чем на 15 %, считается токсичной для фитогидробионтов.
Расчет А - Z - тест-показателя проводится по формуле:
![]()
где X - изменение продукции фотосинтеза под влиянием вещества, %;
(Охв - Ох) - разница между количеством кислорода в опытных склянках, с водорослями и без водорослей, через 24 ч;
(Окв - Ок) - разница между количеством кислорода в контрольных склянках с водорослями и без водорослей, через 24 ч.
X может быть как положительным, так и отрицательным (при ингибировании фотосинтеза под влиянием вещества). Концентрация вещества, ингибирующая фотосинтез более чем на 15 %, считается токсичной для фитогидробионтов.
11.3. Биотестирование на хлоропластах высшего водного растения ряски Lemna minor
11.3.1. Сущность метода. Метод основывается на оценке изменения под действием токсикантов состояния пигментного комплекса хлоропластов, изменения их фототаксиса (движения хлоропластов по отношению к источнику света). Подсчет хлоропластов с отрицательным фототаксисом проводят под бинокулярным микроскопом при увеличении 10×10.
Подготовка и проведение эксперимента описаны в (29).
11.3.2. Анализ результатов. Процент эпистрофных хлоропластов после 10-минутного воздействия сильного света по отношению к исходному уровню служит показателем повреждения мембран хлоропластов токсикантом.
Достоверность отличия контрольных показателей и опытных вычисляют по критерию t Стьюдента.
11.4. Биотестирование на зоогидробионтах, на ветвистоусых рачках дафниях Daphnia magna
11.4.1. Сущность метода. При биотестировании используют основной метод: кратковременные опыты - 1 - 2 сут., 5 - 7 сут.; дополнительный метод - субхронический опыт - 14 сут; специфический метод - хронический опыт - 21 - 30 сут. При этом оценивают поведение рачков, их рост, число линек, степень наполнения кишечника, время образования и развития яиц, число пометов, количество народившейся молоди.
Наиболее показателен тест выживаемости рачков, темп размножения, анализ плодовитости и роста потомства. По этим параметрам определяют LT50, LC0, LC50, LC10С.
Подготовка и проведение кратковременного эксперимента (острый - 96 ч, подострый - 5 - 7 сут., субхронический - 14 сут.) и хронического эксперимента (21 - 30 сут.) описаны в (29).
11.4.2. Анализ результатов. В остром, подостром и субхроническом эксперименте изменение жизнедеятельности дафний в опыте сравнивают с контролем.
По результатам кратковременных опытов определяют:
LT50 - среднее (медианное) время выживания 50 % особей в ряду концентраций;
LC0 (96 ч) - пороговая концентрация (максимальная недействующая), при которой организмы не гибнут в течение 96 ч наблюдения;
LC50 (96 ч) (14 сут.) - средняя (медианная) летальная концентрация, вызывающая гибель 50 % подопытных рачков в течение 96 ч или 14 сут.
LC100 (96 ч) (14 сут.) - концентрация вещества, при которой гибнут все животные в течение определенного срока наблюдения (96 ч или 14 сут.).
По характеру и интенсивности действия веществ обычно выделяются следующие группы концентраций:
а) концентрации, оказывающие остролетальное действие, т.е. приводящие к массовой гибели организмов за сравнительно короткие сроки (1 - 2 сут.).
б) концентрации, оказывающие хроническое летальное действие или гибель всех или большинства организмов за длительные сроки (до 30 сут.).
в) концентрации, оказывающие сублетальное (угнетающее) действие, не приводящие к гибели организмов;
г) концентрации, оказывающие стимулирующее действие, сопровождающееся или не сопровождающееся патологическими явлениями;
д) недействующие концентрации.
Пограничную концентрацию находят между группами в и г, если стимуляция явно не связана с патологией, и между группами г и д в остальных случаях.
Для определения LC50 используют метод пробитов.
В хроническом эксперименте для определения безвредных концентраций для дафний результаты опытов приводят в следующей форме:
- выживаемость в процентах в течение 21 - 30 сут.;
- плодовитость - количество молоди за 21 - 30 сут. в пересчете на 1 особь в процентах к контролю;
- размеры дафний в процентах к контролю и к размерам исходной генерации.
Следует также, как в кратковременных экспериментах, определить LC0; LC50; LC100; LT50, используя пробит-анализ.
Обработка результатов биотестирования для оценки хронического токсического действия на дафний проводится в соответствии с ГОСТ 8.207-76.
Вывод о наличии или отсутствии хронического токсического действия ЛС на дафний делается на основании расчета достоверности разности между показателями общей численности дафний после 21 - 30 сут. экспозиции в контрольных и тестируемых пробах.
В ряде случаев биотестирование на дафниях позволяет выявить некоторые специфические токсические свойства веществ. Так, стойкое нарушение генеративной функции у дафний при тестировании ЛС позволяет прогнозировать нарушение репродуктивной функции и/или эмбриотропное действие у млекопитающих.
11.5. Биотестирование на инфузориях Tetrahymena pyriformis
Тетерахимена распространена в пресных водах с высоким содержанием органического вещества, в неочищенных сточных водах. Встречается в сооружениях биологической очистки, в активном иле.
11.5.1. Сущность метода. Метод основан на реакции инфузорий на появление в среде токсических веществ. Критериями токсического действия являются выживаемость, изменение плотности культуры, репродукция.
Оценка токсичности производится по результатам острого и хронического действия испытуемого вещества на инфузорий.
За острую токсичность принимается действие тестируемого вещества на инфузорий в течение 6 ч. Показателем токсичности является достоверное различие в количестве выживших инфузорий в тестируемом веществе по сравнению с контролем.
За хроническую токсичность принимается действие тестируемого раствора вещества в течение 48 ч. Показателем токсичности является достоверное снижение количества клеток в тестируемом растворе вещества по сравнению с контролем.
Дополнительный метод включает определение токсикологических параметров LC50, LC100, LT50, а также расчет темпа размножения инфузорий.
Способ лабораторного содержания тетрахимен, проверка чувствительности культуры инфузорий к токсикантам, метрологическая характеристика методики, подготовка к эксперименту, проведение эксперимента с массовой культурой и капельным методом описаны в (29).
11.5.2. Анализ результатов. В опыте с массовой культурой достоверность разности количества инфузорий в опыте и контроле определяют с помощью критерия t Стьюдента.
Для оценки результатов капельного метода в ходе эксперимента регистрируют погибшие особи, отмечают морфологические изменения и поведение инфузорий. Вычисляют процент летальности инфузорий через различные интервалы времени (1 ч, 3 ч, 6 ч, 18 ч, 24 ч). Рассчитывают LT50; LC0; LC50; LC100.
Статистическую обработку проводят с использованием критерия t Стьюдента.
Рост генерации (темп размножения - n) вычисляют по формуле:
![]()
где Nt - число инфузорий в конце опыта;
N0 - число инфузорий в начале опыта.
11.6. Биотестирование на плоских червях турбелляриях, планариях Dugesia lugubris
11.6.1. Сущность метода. Метод основан на оценке реакции планарий при присутствии в среде токсических веществ. По своей токсикологической характеристике планарии относятся к устойчивым (токсобным) гидробионтам, но действие сильных токсикантов вызывает реакцию избегания отравленной среды, паралич двигательной активности и деструкцию тела, которая обычно начинается с головного конца.
Критериями токсического действия являются выживаемость, поведение, морфологические параметры планарий.
В специальном эксперименте изучают темп регенерации головного конца планарий после резекции.
Подготовка к эксперименту и его проведение описаны в (29).
11.6.2. Анализ результатов. Проводят учет и регистрацию морфологического и физиологического состояния планарий: частичная или полная остановка движения, обильное выделение слизи, деструкция и лизис тканей.
Расчет летальности выражают в процентах гибели особей. Полученные данные соотносят с контролем. Вычисляют LC50 по результатам пробит-анализа. Вещества, обладающие раздражающим действием, вызывают реакцию избегания среды с токсикантом.
При проведении специального эксперимента прирост бластемы измеряют в микрометрах. Достоверность различий контрольных и опытных значений определяют по критерию t Стьюдента. Замедление темпа регенерации бластемы под влиянием ЛС позволяет сделать вывод о специфическом цитостатическом действии вещества и прогнозировать аналогичное действие у млекопитающих.
Заключение
Изложенные методы оценки токсичности на гидробионтах позволяют:
- дать сравнительную оценку токсичности различных ЛС;
- сопоставить токсичность изучаемых ЛС и продуктов их трансформации в воде;
- определить степень загрязнения вод веществами, токсичными для гидробионтов;
- определить токсикологические параметры действия изучаемых веществ на гидробионтах для прогноза экологических последствий попадания этих веществ в окружающую среду;
- определить специфическое токсическое действие изучаемых ЛС на тестобъектах с целью прогнозирования для млекопитающих.
Результаты, полученные на гидробионтах, могут использоваться только для прогнозирования и предварительной оценки токсичности при скрининговых исследованиях. Окончательный ответ дает оценка токсичности на млекопитающих.
Библиографические сведения
При подготовке настоящего документа были использованы материалы следующих авторов: к.м.н. О.О. Синицыной и З.В. Шипулиной (НИИ экологии человека и гигиены окружающей среды РАМН), к.м.н. Е.Е. Козеевой (ММА им. И.М. Сеченова), к.б.н. Г.А. Дьяковой (НИИ медицины труда РАМН), д.м.н., профессора Б.А. Кацнельсона (Екатеринбургский медицинский научный центр профилактики и охраны здоровья рабочих промышленных предприятий), д.м.н., профессора Н.М. Василенко (Харьковский НИИ гигиены труда и профзаболеваний), д.м.н., профессора Г.В. Селюжицкого и д.м.н., профессора В.В. Семеновой (Санкт-Петербургский санитарно-гигиенический медицинский институт), к.м.н. М.В. Моисеевой и к.б.н. И.Е. Кричевской (Государственный научно-исследовательский институт антибиотиков и ферментов, г. Санкт-Петербург).
1. Бабаян Э.А., Лепахин В.К., Ульянова Г.А. Политика в области лекарственных средств в СССР//Национальная политика в области лекарственных средств: Европейское региональное бюро ВОЗ. - Копенгаген, 1982.
2. Временные методические указания по обоснованию предельно допустимых концентраций (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест № 4681-88. - М., 1989.
3. Гацура В.В. Методы первичного фармакологического исследования биологически активных веществ. - М., 1974.
4. ГОСТ 12.1.007-76. Система стандартов безопасности труда. Вредные вещества. Классификация и общие требовании безопасности. Изменение № 1 ГОСТ 12.1.007-76. Информационный указатель стандартов. - № 12, 1981.
5. ГОСТ 12.1.016-79. ССБТ. Воздух рабочей зоны. Требования к методикам измерения концентраций вредных веществ.
6. ГОСТ 12.1.005-88. ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны.
7. Жолдакова З.И., Зайцева И.В., Степанова М.Б. Сравнительное изучение способности к трансформации производных антрахинона в водной среде// Гигиена и санитария. - 1988. - № 1. - С. 54 - 65.
8. Жолдакова З.И., Красовский Г.Н., Хамидулина X.X., Рожнов Г.И., Пройнова B. А., Лойко Е.А. Нормирование в воде продуктов химико-фармацевтической промышленности с учетом их фармакологических и гигиенических свойств// Гигиена и санитария. - 1995. - № 3. - С. 6 - 10.
9. Зайцева Н.В., Жолдакова З.И., Степанова М.Б. Расчет пороговых концентраций веществ по влиянию на процессы самоочищения водоемов// Гигиена и санитария. - 1987. - № 3. - С. 14 - 15.
10. Измеров Н.Ф., Саноцкий И.В., Сидоров К.К. Параметры токсикометрии промышленных ядов при однократном воздействии: Справочник. - М., 1977. - С. 195 - 197.
11. Комендатова М.В., Зорян Е.В. Фармакология. - М., 1988. - С. 207.
12. Копанев В.А., Гинзбург З.X., Селинова В.Н. Метод вероятностной оценки токсического эффекта. - Новосибирск, 1988. - С. 18.
13. Красовский Г.Н. Методика "закрытого типа" для установления пороговых концентраций вредных веществ по влиянию на органолептические свойства воды// Вопросы санитарной охраны водоемов и санитарной техники. - Пермь, 1973. - C. 126 - 131.
14. Красовский Г.Н., Дергачева Т.С., Потапова О.Н. Совершенствование методических основ оценки влияния веществ на запах и привкус воды // Гигиена и санитария. - 1988. - № 6. - С. 45 - 47.
15. Красовский Г.Н., Жолдакова З.И. Пешков А.С. и др. Экспресс-экспериментальные методы прогнозирования токсичности веществ в воде на основании схемы этапного нормирования// Гигиеническая оценка вредных веществ в воде: опыт сотрудничества стран членов СЭВ. - М.: Секретариат СЭВ, 1987. - С. 137 - 145.
16. Кудрина В.Н., Жолдакова З.И. О вероятностной оценке эффективных и подпороговых доз в токсикологическом эксперименте// Гигиена и санитария. - 1979. - № 9. - С. 41 - 44.
17. Кудрин Н.А. Фармакология с основами патофизиологии. - М., 1977. - 550 с.
18. Кукес В.Г. Клиническая фармакология. - М., 1991. - 44 с.
19. Лаврецкая Э.Ф. Фармакологическая регуляция психических процессов. - М., 1985. - С. 127 - 130.
20. Лепахин В.К., Белоусов Ю.Б., Моисеев В.С. Клиническая фармакология с международной номенклатурой лекарств. - М., 1988. - 445 с.
21. Лурье Ю.Ю. Унифицированные методы анализа воды. - М., 1971.
22. Машковский М.Д. Лекарственные средства: Пособие по фармакотерапии для врачей. - 11-е изд. - М.: Медицина, 1988.
23. Методические рекомендации по изучению кожно-резорбтивного действия химических соединений при гигиеническом регламентировании их содержания в воде: MP 2377-81// Сост. Красовский Г.Н., Штабский Б.М. и др. - М., 1981. - 17 с.
24. Методические рекомендации по экспериментальному обоснованию гигиенических регламентов химических канцерогенных веществ: MP 3854-85. - М., 1985. - 47 с.
25. Методические указания к постановке исследований для обоснования санитарных стандартов вредных веществ в воздухе рабочей зоны: MУ 2163-80. - М., 1980. - 19 с.
26. Гигиенические критерии для обоснования необходимости разработки ПДК и ОБУВ (ОДУ) вредных веществ в воздухе рабочей зоны, атмосферном воздухе населенных мест, воде водных объектов: ГН 1.1.701-98 - М., 1998. - 14 с.
27. Методические указания по установлению ориентировочных безопасных уровней воздействия вредных веществ в воздухе рабочей зоны МУ 4000-85. - М., 1985. - С. 3 - 5.
28. Методические указания по установлению ориентировочно безопасных уровней воздействия (ОБУВ) загрязняющих веществ в атмосферном воздухе населенных мест: МУ 2630-82. - М., 1982. - С. 3 - 4.
29. Обоснование предельно допустимых концентраций (ПДК) аэрозолей в рабочей зоне: MP 2673-83-М., 1983. - С. 21 - 37.
30. Методические основы биотестирования и определения генетической опасности отходов, поступающих в окружающую среду: МУ РД-64-085-89: Минмедпром., 1989. - 46 с.
31. Методические указания по изучению гонадотоксического действия химических веществ при гигиеническом нормировании в воде водоемов: МУ 2492-81// НИИ ОКГ им. А.Н. Сысина АМН СССР и др. /Сост. Красовский Г.Н. и др. - М., 1981. - 23 с.
32. Методические указания по изучению мутагенной активности химических веществ при обосновании их ПДК в воде: МУ 4110-86// НИИ ОКГ им. А.Н. Сысина АМН СССР и др.// Сост. Красовский Г.Н., Журков В.С. и др. - М., 1986. - 23 с.
33. Методические указания по изучению эмбриотоксического действия химических веществ при гигиеническом обосновании их ПДК в воде водных объектов: МУ 2926-83// НИИ ОКГ им. А.Н. Сысина АМН СССР и др./Сост. Красовский Г.Н. и др. - М., 1984. - 27 с.
34. Методические указания по обоснованию гигиенических нормативов химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования: МУ 2.1.5.720-98. - М., 1998. - 45 с.
35. Методические указания по расчетным и экспресс-экспериментальным методам гигиенической оценки и нормирования химических веществ в воде: МУ 01-19/10-11-92// НИИ ОКГ им. А.Н. Сысина РАМН/ Сост. Красовский Г.Н., Жолдакова З.И. и др. - М., 1992.
36. Постановка исследований для обоснования предельно допустимых концентраций антибиотиков в воздухе рабочей зоны: МУ 5051-89. - М., 1989. - 22 с.
37. Методические указания по экспериментальному изучению процессов трансформации химических веществ при их гигиеническом регламентировании в воде: МУ 2955-84/ Сост. Красовский Г.Н., Штабский Б.М. и др. - М., 1984. - 24 с
38. Оценка воздействия вредных химических соединений на кожные покровы и обоснование предельно допустимых уровней загрязнения кожи: МУ 2102-79. - М., 1980. - 23 с.
39. Постановка экспериментальных исследований по изучению характера комбинированного действия химических веществ с целью разработки профилактических мероприятий: МУ 4050-85. - М., 1987. - 47 с.
40. Методические рекомендации к проведению морфологических исследований при экспериментальном обосновании гигиенических нормативов вредных веществ в воздухе рабочей зоны: MP 2939-83. - М., 1983. - 3 с.
41. Требования к постановке исследований по обоснованию предельно допустимых концентраций промышленных химических аллергенов в воздухе рабочей зоны и атмосферы: МУ 1.1.578-96. - М., 1997. - 23 с.
42. Биологический контроль производственного воздействия вредных веществ: МУ 5205-90. - М., 1990. - 20 с.
43. Методические указания к проведению исследований на производстве при обследовании, проверке и корректировке предельно допустимых концентраций (ПДК) вредных веществ в воздухе рабочей зоны: МУ 3138-84. - М., 1984. - 44 с.
44. Методические указания к постановке исследований по изучению раздражающих свойств и обоснованию предельно допустимых концентраций избирательно действующих раздражающих веществ в воздухе рабочей зоны: МУ 21198-80. - М., 1980. - 14 с.
45. Методические указания по проведению исследований по экспериментальной оценке действия вредных веществ на сердечно-сосудистую систему с целью гигиенического нормирования: МУ 1969-79. - М. 1979. - 16 с.
46. Методические рекомендации по использованию поведенческих реакций животных в токсикологических исследованиях для целей гигиенического нормирования: MP 2166-80. - Киев., 1980. - 47 с.
47. Методы экспериментальною исследования по установлению порогов действия промышленных ядов на генеративную функцию с целью гигиенического нормирования: МУ - М., 1978. - 11 с.
48. Методические рекомендации по экспериментальному изучению иммунотоксических свойств химических факторов окружающей среды. Утв. Пробл. Комис. АМН СССР "Научные основы гигиены окружающей среды" 06.10.89 г. - М., 1989. - 47 с.
49. Новиков С.М., Фурсова Т.Н. Метод количественной оценки кумулятивных свойств вредных веществ//Гигиена и санитария.- 1987. - С. 52 - 55.
50. Новиков С.М., Левченко Н.И., Мельникова Н.И., Фурсова Т.Н. Определение вероятностных значений пороговых уровней воздействия вредных веществ//Гигиена и санитария. - 1989. - № 3. - 4 с.
51. Новиков С.М., Тепикина Л.А., Шашкина Л.Ф., Голубева М.И., Рожнов Г.И. Методические подходы к ускоренному гигиеническому нормированию лекарственных препаратов и полупродуктов их синтеза в атмосферном воздухе//Environment Health. -1997. - № 3. - С. 23 - 25.
52. Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования: ГН 2.1.5.689-98. Ориентировочные допустимые уровни (ОДУ) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования: ГН 2.1.5.690-98 - М.: Минздрав России, 1998. - 172 с.
53. Принципы доклинического испытания безопасности лекарственных веществ// Доклад научной группы. Серия техн. докл. ВОЗ № 341, 1967.
54. Принципы исследования и оценки канцерогенности лекарственных препаратов// Доклад научной группы ВОЗ. Серия техн. докл. ВОЗ № 482, 1971. - 139 с.
55. Руководящие и методические материалы по экспериментальному и клиническому изучению новых лекарственных средств. - М, 1975. - 524 с.
56. Саноцкий И.В., Авилова Г.Г. К вопросу вероятностной оценки действия яда на организм// Гигиена труда и профзаболеваний. - 1976. - № 10. - С. 15 - 19.
57. Соловьев В.Н., Фирсов А.А., Филов В.А. Фармакокинетика: Руководство. - М., 1980. - С. 31 - 40.
58. Токсикометрия химических веществ, загрязняющих окружающую среду// Под ред. А.А. Каспарова, И.В. Саноцкого: Центр международных проектов ГКНТ СССР. - М., 1986 - 425 с.
59. Харкевич Д.А. Фармакология. - М., 1987. - 560 с.
60. Шашкина Л.Ф., Новиков С.М., Рожнов Г.И. Ускоренные методы обоснования гигиенических нормативов лекарственных средств в воздухе рабочей зоны// Гигиена и санитария. - 1993. - № 11. - С. 23 - 26.
61. Штабский Б.М., Гжегоцкий М.И., Гжегоцкий М.Р. и др. К методике определения среднесмертельных доз и концентраций химических веществ// Гигиена и санитария. -1980. - № 10. - С. 49 - 51.
62. Человек. Медико-биологические данные (публикация № 23, МК ПЗ). - М., 1977 - С. 156 - 160.
63. Guideness for drinking water quality. Vol. 1. Recomendations. - WHO. - Geneva., 1984. - 130 p.
|
Главный государственный санитарный врач Российской Федерации, Первый заместитель Министра здравоохранения Российской Федерации |
Г.Г. Онищенко |
СОДЕРЖАНИЕ