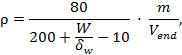МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ,
МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(ISC)
|
МЕЖГОСУДАРСТВЕННЫЙ |
ГОСТ |
Продукция пищевая растительного происхождения
МУЛЬТИМЕТОДЫ
ДЛЯ ГАЗОХРОМАТОГРАФИЧЕСКОГО
ОПРЕДЕЛЕНИЯ ОСТАТКОВ ПЕСТИЦИДОВ
Часть 2
Методы экстракции и очистки
(EN 12393-2:2008, NEQ)
|
|
Москва |
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения,обновления и отмены»
Сведения о стандарте
1 РАЗРАБОТАН Федеральным государственным образовательным учреждением высшего профессионального образования «Московский государственный университет пищевых производств» (ФГБОУ ВПО «МГУПП»)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Росстандарт)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 25 июня 2014 г. № 45)
За принятие проголосовали:
|
Краткое наименование страны по МК (ИСО 3166) 004-97 |
Код страны по МК (ИСО 3166) 004-97 |
Сокращенное наименование национального органа по стандартизации |
|
Армения |
AM |
Минэкономики Республики Армения |
|
Беларусь |
BY |
Госстандарт Республики Беларусь |
|
Казахстан |
KZ |
Госстандарт Республики Казахстан |
|
Киргизия |
KG |
Кыргызстандарт |
|
Россия |
RU |
Росстандарт |
|
Таджикистан |
TJ |
Таджикстандарт |
|
Узбекистан |
UZ |
Узстандарт |
(Поправка).
4 Приказом Федерального агентства по техническому регулированию и метрологии от 19 августа 2014 г. № 894-ст межгосударственный стандарт ГОСТ 32689.2-2014 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2016 г.
5 Настоящий стандарт соответствует региональному стандарту EN 12393-2:2008 Foods of plant origin - Multiresidue methods for the gas chromatographic determination of pesticide residues - Part 2: Methods for extraction and cleanup (Продукция пищевая растительного происхождения. Мультиметоды для газохроматографического определения остатков пестицидов. Часть 2. Методы экстракции и очистки)
Степень соответствия - неэквивалентная (NEQ)
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок - в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Содержание
ГОСТ 32689.2-2014
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
Продукция пищевая растительного происхождения
МУЛЬТИМЕТОДЫ ДЛЯ ГАЗОХРОМАТОГРАФИЧЕСКОГО ОПРЕДЕЛЕНИЯ ОСТАТКОВ ПЕСТИЦИДОВ
Часть 2
Методы экстракции и очистки
Foods of plant origin. Multiresidue methods for the gas chromatographic determination of
pesticide residues.
Part 2. Methods for extraction and cleanup
Дата введения - 2016-01-01
1 Область применения
Настоящий стандарт распространяется на пищевую продукцию растительного происхождения и устанавливает требования к методам экстракции и очистки проб для газохроматографического определения остатков органогалогенных, органофосфорных и (или) органоазотных пестицидов.
Настоящий стандарт содержит описание методов экстракции и очистки проб продукции от экстрагируемых примесей, мешающих проведению определений, установленных ГОСТ 32689.1 (методы L, М, N и Р).
Примечание - Настоящий стандарт рекомендуется применять в целях апробации и накопления дополнительной информации в части его применения.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2603-79 Реактивы. Ацетон. Технические условия
ГОСТ 4171-76 Реактивы. Натрия сульфат 10-водный. Технические условия
ГОСТ 4233-77 Реактивы. Натрий хлористый. Технические условия
ГОСТ 5789-78 Реактивы. Толуол. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 26313-84 Продукты переработки плодов и овощей. Правила приемки, методы отбора проб
ГОСТ 32689.1-2014 Продукция пищевая растительного происхождения. Мультиметоды для газохроматографического определения остатков пестицидов. Часть 1. Общие положения
ГОСТ 32689.3-2014 Продукция пищевая растительного происхождения. Мультиметоды для газохроматографического определения остатков пестицидов. Часть 3. Идентификация и обеспечение правильности результатов
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Краткое описание
В определенных случаях допускаются отступления от установленных настоящим стандартом приборов, условий экстракции и очистки для достижения более хороших результатов. Подобные отклонения документируют и проверяют с точки зрения надежности получаемых результатов.
Экстракцию остатков пестицидов из матрицы пробы с использованием подходящих растворителей проводят с целью полного их экстрагирования и одновременного, по возможности, более полного удаления растворенных побочных примесей, способных воспрепятствовать определению.
В процессе очистки побочные примеси по возможности удаляют из экстракта пробы, в итоге экстрагированные остатки пестицидов остаются в растворе, пригодном для количественного определения.
4 Общее описание методов экстракции и очистки
4.1 Экстракция
Методы экстракции приведены в таблице 1.
|
Метод |
Лабораторная проба Е, г |
Объем растворителя V, см3 |
Соотношение E/V, г/см3 |
|
L |
100 |
Ацетон: 200 |
1/2 |
|
М |
100 |
Ацетон: 200 |
1/2 |
|
N |
100а |
Ацетон: 200 |
1/2 |
|
Р |
50 |
Этилацетат: 100 |
1/2 |
|
а Имеет значение только в том случае, если содержание воды в матрице составляет более 70 %. |
|||
4.2 Очистка
4.2.1 Жидкость-жидкостная очистка
Два способа жидкость-жидкостной очистки [с добавлением воды (методы L, N) и без добавления воды (метод М)] приведены в таблице 2.
Таблица 2 -Жидкость-жидкостная очистка
|
Метод |
Лабораторная проба А, см3 |
Объем добавления воды W, см3 |
Объем растворителя V, см3 |
Соотношение A/W |
|
L |
50 (=20 %) |
250 |
50 |
1/5 |
|
М |
80 |
0 |
200 |
-а |
|
N |
200 |
ха |
100 |
-а |
|
а Зависит от содержания воды в матрице. |
||||
4.2.2 Адсорбционная колоночная хроматография
Адсорбционную колоночную хроматографию в качестве способа очистки применяют в методах L, М и N с различными адсорбирующими средствами: силикагелем, активированным углем, адсорбентом Florisil®*, которые используют по одному или комбинированно.
4.2.3 Хроматография с гелевой фильтрацией с использованием смолы BioBeads® S-X3*
Хроматографию с гелевой фильтрацией с использованием смолы BioBeads® S-X3* применяют в методе N или, при необходимости, методе Р.
_________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
5 Метод L: экстракция с использованием ацетона, жидкость-жидкостная очистка с использованием дихлорметана и очистка на колонке с силикагелем/активированным углем
5.1 Краткое описание
Измельченную лабораторную пробу гомогенизируют в ацетоне, затем гомогенат подвергают фильтрации. Полученный фильтрат разбавляют водой и добавляют дихлорметан. Органическую фазу концентрируют и хроматографируют на колонке с силикагелем/активированным углем. Остатки пестицидов вымывают элюирующей смесью дихлорметана:толуола:ацетона. Элюат концентрируют и подвергают газохроматографическому определению.
5.2 Реактивы и материалы
5.2.1 Все реактивы и материалы должны быть пригодны для определения остатков пестицидов и соответствовать ГОСТ 32689.1 (раздел 4).
5.2.2 Ацетон по ГОСТ 2603.
5.2.3 Дихлорметан, х. ч.
5.2.4 n-Гексан, х. ч.
5.2.5 Толуол по ГОСТ 5789.
5.2.6 Смесь для элюирования: дихлорметан/толуол/ацетон в объемных соотношениях 5:1:1.
5.2.7 Натрия хлорид по ГОСТ 4233, насыщенный раствор.
5.2.8 Натрия сульфат по ГОСТ 4171, прокаленный до температуры 500 °С и выдержанный при этой температуре не менее 4 ч, затем охлажденный и хранящийся в закрытой емкости.
5.2.9 Уголь активированный.
5.2.10 Силикагель 60 для колоночной хроматографии с размером частиц от 63 до 200 мкм (70 - 230 меш).
5.2.11 Адсорбент Celite® 545* (по выбору).
__________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
5.2.12 Вода дистиллированная по ГОСТ 6709.
5.2.13 Допускается применение других реактивов и материалов по качеству не хуже вышеуказанных.
5.3 Оборудование
5.3.1 Обычные лабораторные приборы, соответствующие ГОСТ 32689.1, а также нижеследующие.
5.3.2 Смеситель высокоскоростной (не менее 500 об/мин) или стержень для гомогенизации с подходящей емкостью для смешивания.
5.3.3 Испаритель ротационный с водяной баней с возможностью установки температуры на 40 °С.
5.3.4 Колонка хроматографическая с пористой стеклянной пластинкой и краном из политетрафторэтилена (PTFE) с внутренним диаметром 25 мм и длиной 400 мм.
5.3.5 Цилиндры мерные 2-го класса точности вместимостью 25, 50, 250 см3 любого исполнения по ГОСТ 1770.
5.3.6 Допускается применение другого оборудования с метрологическими и техническими характеристиками не хуже вышеуказанных.
5.4 Подготовка пробы
Отбор и подготовка проб по ГОСТ 26313 и ГОСТ 32689.1. Лабораторные пробы - цельные спелые плоды, корнеплоды и листовые овощи - измельчают ручным способом (например, с помощью ножа) на мелкие кусочки и тщательно перемешивают.
5.5 Подготовка колонки
В колонку (см. 5.3.4) добавляют дихлорметан на высоту приблизительно 1 см. 5 г силикагеля (см. 5.2.10) смешивают с 15 см3 смеси для элюирования (см. 5.2.6) и полученную суспензию выливают в колонку. Жидкость, находящуюся сверху, сливают. Затем 15 г силикагеля и 1 г активированного угля смешивают в стакане вместимостью 50 см3 и медленно добавляют 35 см3 смеси для элюирования.
Примечание - Добавляют не более 35 см3 смеси для элюирования, поскольку в противном случае суспензия при добавлении расслаивается - это приводит к тому, что элюционная смесь очень медленно протекает через колонку.
Предупреждение! Происходит интенсивное выделение тепла!
Суспензию активированного угля/силикагеля со смесью для элюирования подают при постоянном помешивании через воронку, сначала медленно, а затем за одну заливку при открытом кране колонки на уже помещенный в нее силикагель. Для промывки колбы используют элюат, который уже прошел через колонку. Сливают смесь для элюирования до высоты приблизительно 2 см над уровнем адсорбента. Колонку закрывают 5 г сульфата натрия, добавляемого малыми порциями, и предварительно промывают 50 см3 смеси для элюирования.
100 г измельченной лабораторной пробы взвешивают в стакане вместимостью 1 дм3, добавляют 200 см3 ацетона и смесь гомогенизируют в течение 30 с. Если необходимо, дополнительно используют адсорбент Celite® 545* для последующей фильтрации.
________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
Стержень для гомогенизации ополаскивают 50 см3 ацетона, этим же ацетоном в дальнейшем промывают стакан и воронку Бюхнера. Гомогенат фильтруют под вытяжным шкафом через увлажненную фильтровальную бумагу в воронке Бюхнера. Осадок на фильтре промывают 50 см3 ацетона, использованного ранее для ополаскивания.
Фильтрат встряхивают и с помощью мерного цилиндра определяют его объем. Затем берут одну пятую часть полученного фильтрата и сильно встряхивают в течение 2 мин с 250 см3 дистиллированной воды, 25 см3 раствора хлорида натрия (см. 5.2.7) и 50 см3 дихлорметана в делительной воронке вместимостью 1 дм3. Если смесь встряхивается недостаточно сильно, то степень извлечения может существенно снизиться. После встряхивания отделяют дихлорметановый раствор (фазу), а к оставшемуся раствору (фазе) добавляют еще 50 см3 дихлорметана и повторяют встряхивание. Полученные растворы (фазы) дихлорметана объединяют и высушивают в течение 30 мин над 30 г сульфата натрия (см. 5.2.8). Высушенный раствор фильтруют через фильтровальную бумагу. Делительную воронку и фильтровальную бумагу трижды промывают 30 см3 дихлорметана. Фильтрат концентрируют приблизительно до 2 см3 и остаток растворителя удаляют путем поворота колбы в руке. Остаток растворяют в 10 см3 дихлорметана.
5.7 Очистка
Полученный согласно 5.6 экстрагированный раствор дихлорметана количественно переносят в подготовленную колонку и промывают колбу 5 см3 дихлорметана. Уже прошедшую через колонку жидкость, а затем и элюат собирают в круглодонной колбе вместимостью 250 см3. Колонку элюируют посредством 140 см3 смеси для элюирования (см. 5.2.6). Объединенные элюаты концентрируют приблизительно до 30 см3, переносят в круглодонную колбу вместимостью 50 см3 и вновь концентрируют приблизительно до 2 см3. Сначала опорожняют приемник ротационного испарителя. Раствор нельзя выпаривать до сухого состояния. Раствор количественно переносят в градуированную пробирку (колбу) вместимостью 5,0 см3. Колбу промывают n-гексаном, который также сливают в пробирку, объем в которой доводят до 5,0 см3. Полученный раствор используют для определения остатков пестицидов с помощью подходящей газохроматографической системы.
5.8 Межлабораторные испытания
В таблице 3 представлены комбинации матриц/активные вещества пестицидов, которые испытывались в ходе межлабораторных испытаний**.
_________
** В межлабораторных испытаниях использовали активированный уголь и силикагель в соответствии с 5.2.10.
Таблица 3 - Активные вещества пестицидов и матрицы
|
Активные вещества пестицидов |
Морковь |
Картофель |
Савойская капуста |
Шпинат |
Помидоры |
Желтый горох |
|
Бромофос |
+ |
+ |
- |
- |
+ |
- |
|
Бромпропилат |
- |
- |
- |
+ |
+ |
- |
|
Каптан |
- |
- |
- |
- |
+ |
- |
|
Хлорпрофам |
- |
+ |
- |
- |
- |
- |
|
Хлорпирифос |
- |
- |
- |
+ |
+ |
- |
|
Киперметрин |
- |
- |
- |
+ |
- |
- |
|
о,ρ'-ДДЕ |
+ |
- |
- |
- |
- |
- |
|
ρ,ρ'-ДДЕ |
+ |
- |
- |
+ |
- |
- |
|
о,ρ'-ДДТ |
+ |
- |
- |
- |
- |
- |
|
ρ,ρ'-ДДТ |
+ |
- |
- |
- |
+ |
- |
|
Диацинон |
+ |
- |
+ |
- |
- |
+ |
|
Дихлофлуанид |
+ |
- |
- |
- |
- |
- |
|
Дикофол |
- |
- |
- |
+ |
+ |
- |
|
Дилдрин |
+ |
+ |
+ |
+ |
+ |
+ |
|
α-Эндосульфан |
- |
- |
- |
- |
+ |
- |
|
β-Эндосульфан |
- |
- |
- |
+ |
+ |
- |
|
Эндосульфан-сульфат |
- |
- |
- |
+ |
+ |
- |
|
Эндрин |
- |
- |
- |
- |
+ |
- |
|
Этион |
- |
- |
- |
- |
+ |
- |
|
Фенаримол |
- |
- |
- |
+ |
- |
- |
|
Фенитротион |
+ |
- |
+ |
- |
- |
- |
|
Фенпропатрин |
- |
- |
- |
+ |
- |
- |
|
Фольпет |
- |
- |
- |
+ |
- |
- |
|
α-ГХЦГ |
- |
- |
- |
- |
+ |
- |
|
γ-ГЦХГ (линдан) |
+ |
+ |
+ |
+ |
+ |
+ |
|
Гептахлор-эпоксид |
+ |
- |
+ |
- |
- |
- |
|
Ипродион |
- |
- |
- |
+ |
- |
- |
|
Малатион |
- |
- |
- |
+ |
- |
+ |
|
Мекарбам |
- |
- |
- |
+ |
- |
- |
|
Паратион |
+ |
- |
+ |
+ |
+ |
- |
|
Перметрин |
- |
- |
- |
+ |
- |
- |
|
Фосалон |
+ |
- |
- |
+ |
- |
+ |
|
Пиримифос-метил |
- |
+ |
- |
+ |
+ |
+ |
|
Процимидон |
- |
- |
- |
- |
+ |
- |
|
Профам |
- |
+ |
- |
- |
- |
- |
|
Квинтоцен |
- |
- |
- |
+ |
- |
+ |
|
Тетрадифон |
- |
- |
- |
- |
+ |
- |
|
Толклофос-метил |
- |
- |
- |
+ |
- |
- |
|
Винкпозолин |
+ |
+ |
- |
+ |
+ |
- |
5.9 Область применения
Посредством метода L определяют следующие пестициды: алдрин, о,ρ'-ДДТ, флуородифен, форат, аметрин, ρ'-ДДТ, флуванил, фосалон, антрацин, дельтаметрин, фольпет, пиримифосметил, ацинфосэтил, десметрин, фонофос, процимидон, ацинфосметил, диалифос, формотион, профенофос, аципротрин, диазинон, α-ГХЦГ, профлюралин, бифентрин, дихлобенил, β-ГХЦГ, прометрин, бромацил, дихлофентион, гептахлор, пропазин, бромофос, дихлофлуанид, гептахлорэпоксид, профам, бромофосэтил, дихлорвос, гептенофос, пропизамид, бромпропилат, дикофол, иодфенфос, протиофос, бупиримат, дилдрин, ипродион, пиразофос, каптафол, диметахлор, изофенфос, пиретрум, каптан, диметоат, линдан, квиналфос, карбофенотион, диоксатион, малаоксон, квинтоцен, хлорбензид, дисульфотон, малатион, симазин, хлорбензилат, диталимфос, мекарбам, сульфотеп, хлорфензол, α-эндосульфан, металаксил, текназен, хлорфенвинфос, β-эндосульфан, метазахлор, тербацил, хлорфлюренол, эндосульфан-сульфат, метидатион, тербуфос, хлорпрофам, этион, метопротрин, тербутрин, хлорпропилат, этопрофос, метоксихлор, тетрахлорвинфос, хлорпирифос, этримфос, метолахлор, тетрадифон, хлорпирифос-метил, фенамифос, метрибуцин, тетраметрин, хлортал, фенаримол, мевинфос, тетрасул, хлортиофос, фенхлорфос, налед, тионацин, цианазин, фенитротион, нитрофен, толклофос-метил, цианофенфос, фенпропатрин, параоксон, толифлуанид, цианофос, фензон, паратион, триадимефон, цифлутрин, фенсульфотион, паратион-метил, триаллат, λ-цигалотрин, фентион, пендиметалин, триазофос, циперметрин, фенвалерат, перметрин, трихлоронат, ρ, ρ '-ДДТ, флухлоралин, пертан, трифлуралин, о, ρ '-ДДЕ, флуцитринат, фенкаптон, винклозолин, ρ, ρ '-ДДЕ.
6 Метод М: экстракция с использованием ацетона, жидкость-жидкостная очистка с использованием дихлорметана/петролейного эфира и, при необходимости, очистка на адсорбентах (например, Florisil®*)
6.1 Краткое описание
Измельченную лабораторную пробу гомогенизируют в ацетоне, экстракт подвергают фильтрации. В полученный фильтрат добавляют смесь петролейного эфира и дихлорметана, затем в нее добавляют дихлорметан. Органическая фаза может быть впрыснута непосредственно без очистки в газовый хроматограф с подходящим детектором или может быть подвергнута очистке на колонке с адсорбентом (например, Florisil®*). Элюаты концентрируют и испытывают на газовом хроматографе.
_________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
6.2 Реактивы и материалы
6.2.1 Все реактивы и материалы должны быть пригодны для определения остатков пестицидов и соответствовать ГОСТ 32689.1 (раздел 4).
6.2.2 Ацетон по ГОСТ 2603.
6.2.3 Эфир петролейный с температурой кипения от 40 °С до 60 °С.
6.2.4 Натрия хлорид по ГОСТ 4233, прокаленный до температуры 500 °С и выдержанный при этой температуре не менее 4 ч, затем охлажденный и хранящийся в закрытой емкости.
6.2.5 Дихлорметан, х. ч.
6.2.6 Ацетонитрил для ВЭЖХ.
6.2.7 Натрия сульфат по ГОСТ 4171 после отжига при температуре 500 °С и выдержанный при этой температуре не менее 4 ч, затем охлажденный и хранящийся в закрытой емкости.
6.2.8 Адсорбент Florisil®* или аналогичный с размером частиц от 150 до 250 мкм (60 - 100 меш).
__________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
Примечание - Адсорбент выдерживают в течение 5 ч при температуре от 130 °С до 135 °С, затем охлаждают в эксикаторе и хранят в герметично закупоренной емкости. Он сохраняет свою активность в течение четырех дней, но может быть активизирован вновь тем же способом. Активность периодически перепроверяют путем элюирования стандартных веществ согласно описанному способу.
6.2.9 Эфир диэтиловый, не содержащий пероксида, стабилизированный этанолом концентрацией 2 об. %.
6.2.10 Смесь для элюирования А: диэтиловый эфир/петролейный эфир в объемном соотношении 6:94.
6.2.11 Смесь для элюирования Б: диэтиловый эфир/петролейный эфир в объемном соотношении 15:85.
6.2.12 Смесь для элюирования В: диэтиловый эфир/петролейный эфир в объемном соотношении 50:50.
6.2.13 Смесь для элюирования Г: дихлорметан/петролейный эфир в объемном соотношении 20:80.
6.2.14 Смесь для элюирования Д: дихлорметан/петролейный эфир/ацетонитрил в объемном соотношении 50:49, 65:0,35.
6.2.15 Смесь для элюирования Е: дихлорметан/петролейный эфир/ацетонитрил в объемном соотношении 50:48, 5:1,5.
Допускается применение других реактивов и материалов по качеству не хуже вышеуказанных.
6.3 Оборудование
6.3.1 Обычные лабораторные приборы, соответствующие ГОСТ 32689.1, а также нижеследующие.
6.3.2 Смеситель высокоскоростной (не менее 500 об/мин) или стержень для гомогенизации с подходящей емкостью для смешивания.
6.3.3 Колонка хроматографическая с краном из политетрафторэтилена (ПТФЭ) с внутренним диаметром 22 мм и длиной 300 мм.
6.3.4 Испаритель Кудерна-Даниша или аналогичный.
6.3.5 Цилиндры мерные 2-го класса точности вместимостью 25, 50, 250 см3 любого исполнения по ГОСТ 1770.
6.3.6 Допускается применение другого оборудования с метрологическими и техническими характеристиками не хуже вышеуказанных.
6.4 Подготовка пробы
Пробу измельчают на мелкие кусочки и тщательно перемешивают для получения гомогенной лабораторной пробы. Если содержание воды в лабораторной пробе составляет менее 30 % (высушенные фрукты и овощи, концентрированные продукты с массовой долей растворимых сухих веществ более 70 %), то его следует скорректировать путем добавления воды приблизительно до 80 %.
100 г лабораторной пробы (т) помещают в емкость для смешивания (см. 6.3.2), добавляют 200 см3 ацетона и смешивают на высокой скорости в течение 3 мин. Смесь пропускают через воронку Бюхнера, содержащую увлажненную ацетоном фильтровальную бумагу, и фильтруют при пониженном давлении в колбу Бюхнера. Измеряют объем фильтрата.
80 см3 полученного фильтрата переносят в делительную воронку вместимостью 1 дм3, содержащую 100 см3 дихлорметана и 100 см3 петролейного эфира (см. 6.2.3). Смесь встряхивают в течение 3 мин. После разделения фаз нижнюю водную фазу переносят в другую делительную воронку вместимостью 1 дм3. Верхнюю органическую фазу из первой делительной воронки пропускают через воронку длиной 10 см, содержащую промытый тампон стеклянной ваты и слой сульфата натрия (см. 6.2.7) толщиной 3 см, затем собирают ее в круглодонной колбе.
7 г хлорида натрия (см. 6.2.4) добавляют в водную фазу и смесь встряхивают в течение 30 с до растворения хлорида натрия. Добавляют 100 см3 дихлорметана и смесь встряхивают вручную в течение 3 мин. После разделения фаз водную фазу переносят в третью делительную воронку, а органическую фазу снова высушивают над тем же самым сульфатом натрия. К содержимому третьей делительной воронки добавляют 100 см3 дихлорметана, вместе с ним встряхивают в течение 3 мин, органическую фазу отделяют, а водную фазу выбрасывают; органическую фазу высушивают над тем же самым сульфатом натрия. Сульфат натрия промывают 50 см3 дихлорметана, и все органические фазы концентрируют до 2 см3. Добавляют 100 см3 петролейного эфира. Раствор вновь концентрируют до 2 см3, и процесс повторяют до тех пор, пока весь дихлорметан не исчезнет. Добавляют 20 см3 ацетона и раствор снова концентрируют до 2 см3 (Vend).
Этот концентрат может быть непосредственно инжектирован в газовый хроматограф, который оснащен детектором Холла (HECD), азотно-фосфорным детектором (NPD) или пламенно-фотометрическим детектором (FPD). В некоторых случаях рекомендуется проведение очистки согласно методу М1, или методу М2 для определения с использованием детектора электронного захвата (ECD). Для этого лабораторную пробу концентрируют ацетоном до 1 см3 (вместо 2 см3) и разбавляют петролейным эфиром до 10 см3.
6.6 Очистка
В нижнем конце колонки (см. 6.3.3) помещают ватный тампон, после чего последовательно добавляют петролейный эфир (см. 6.2.3) на высоту 20 см, 20 г адсорбента (например, Florisil®*) (см. 6.2.8) и сульфат натрия (см. 6.2.7) на высоту от 1 до 2 см. При этом постукивают по стенке колонки для лучшего заполнения. Затем колонку промывают петролейным эфиром в количестве около 30 см3. Петролейный эфир отбрасывают. Колбу для выпаривания устанавливают под колонкой для сбора элюата. Экстракт, полученный по 6.5, подают и элюируют со скоростью не более 5 см3/мин. Емкость из-под экстракта вторично промывают 5 см3 петролейного эфира, которые также вносят в колонку; затем промывают внутреннюю стенку хроматографической колонки дополнительными малыми порциями петролейного эфира. Экстракт пробы из колонки элюируют 200 см3 элюционной смеси А (см. 6.2.10) со скоростью 5 см3/мин. Затем содержимое колонки элюируют 200 см3 элюционной смеси Б (см. 6.2.11) и в заключение 200 см3 элюционной смеси (см. 6.2.12). Каждый элюат собирают в отдельный сборник.
_________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
Очистку методом М2 проводят в соответствии с 6.6.1 с тем отличием, что экстракт лабораторной пробы из колонки элюируют 200 см3 элюционной смеси Г (см. 6.2.13) со скоростью 5 см3/мин. Затем содержимое колонки элюируют 200 см3 элюционной смеси Д (см. 6.2.14) и в заключение 200 см3 элюционной смеси Е (см. 6.2.15).
6.6.3 Элюаты, полученные по 6.6.1 или 6.6.2, концентрируют до определенного объема (Vend), пригодного для проведения газохроматографического определения с использованием детектора электронного захвата (ECD), и используют для определения остатков пестицидов с помощью подходящей газохроматографической системы.
6.7 Обработка результатов
Эквивалент лабораторной пробы в аналитическом растворе ρ, мг/см3, рассчитывают по формуле
|
|
(1) |
где 80 - объем фильтрата, см3;
200 - объем элюата, см3;
W - объем воды в пробе, см3;
δW - плотность воды, мг/мм3;
10 - уменьшение объема аналитического раствора, см3;
т - масса пробы, г (100 г);
Vend - объем экстрагированного раствора после концентрирования, равный 2 см3.
Если для экстракции используют 200 см3 ацетона, применительно к лабораторным пробам, содержащим воду массовой долей от 80 до 95 %, при расчете принимают во внимание уменьшение объема аналитического раствора, равное 10 см3. Среднее содержание воды в некоторых сельскохозяйственных культурах и продуктах питания приведено в таблице А.1 (приложение А). Содержание воды в большинстве свежих фруктов и овощей может быть принято 85 %.
Примечание - Эквивалент лабораторной пробы в аналитическом растворе для очистки с использованием адсорбента Florisil®* или для непосредственного газохроматографического испытания можно точно рассчитать путем измерения общего объема первоначального ацетонового экстракта.
_________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
7 Метод N: экстракция с использованием ацетона, жидкость-жидкостная очистка с использованием дихлорметана или циклогексана/этилацетата и очистка посредством хроматографии на силикагеле
7.1 Краткое описание
Размельченную лабораторную пробу гомогенизируют в ацетоне. При этом добавляют воду в таком количестве, чтобы с учетом естественного содержания воды в лабораторной пробе соотношение ацетон/вода во время экстракции составило бы в объемных долях 2:1. Гомогенат подвергают фильтрации. Аликвотную долю фильтрата насыщают хлоридом натрия, разбавляют дихлорметаном, при этом избыток воды отделяют. Альтернативно в гомогенат добавляют хлорид натрия и смесь циклогексана и этилацетата, затем смесь интенсивно перемешивают.
Остаток при выпаривании органической фазы очищают посредством гелевой хроматографии на смоле BioBeads® S-X3* (полистирольный гель) со смесью циклогексана и этилацетата в качестве элюционного средства. Фракцию с остатками концентрируют и испытывают непосредственно на газовом хроматографе с фосфорным или азотным детектором. Для испытания с детектором захвата электронов в некоторых случаях может потребоваться дополнительная очистка на малой колонке с силикагелем. На этом этапе очистки пестициды разделяют на несколько фракций, в результате чего появляются дополнительные возможности по идентификации.
Для определения остаточных количеств пестицидов применяют подходящую газохроматографическую систему в соответствии с требованиями ГОСТ 32689.3.
________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
7.2 Реактивы и материалы
7.2.1 Все реактивы должны быть пригодны для определения остатков пестицидов и соответствовать ГОСТ 32689.1 (раздел 4).
7.2.2 Ацетон по ГОСТ 2603.
7.2.3 Дихлорметан, х. ч.
7.2.4 Этилацетат, х. ч.
7.2.5 Циклогексан, х. ч.
7.2.6 Смесь для элюирования (гелевая хроматография): циклогексан/этилацетат в объемном соотношении 1:1.
7.2.7 n-Гексан, х. ч.
7.2.8 Изооктан, х. ч.
7.2.9 Толуол, х. ч.
7.2.10 Вода дистиллированная по ГОСТ 6709, полученная в стеклянных дистилляторах.
7.2.11 Элюент1: n-гексан/толуол в объемном соотношении 65:35.
7.2.12 Элюент 2: толуол.
7.2.13 Элюент 3: толуол/ацетон в объемном соотношении 95:5.
7.2.14 Элюент 4: толуол/ацетон в объемном соотношении 80:20.
7.2.16 Натрия хлорид по ГОСТ 4233 после отжига при температуре 500 °С и выдержанный при этой температуре не менее 4 ч, затем охлажденный и хранящийся в закрытой емкости.
7.2.17 Натрия сульфат по ГОСТ 4171, порошок, после отжига при температуре 500 °С и выдержанный при этой температуре не менее 4 ч, затем охлажденный и хранящийся в закрытой емкости.
7.2.18 Смесь солей: сульфат натрия и хлорид натрия в весовом соотношении 1:1.
7.2.19 Адсорбент Celite® 545*.
__________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
7.2.20 Силикагель 60 для колоночной хроматографии с размером частиц от 63 до 200 мкм (70 - 230 меш), деактивированный с помощью 1,5 см3 воды.
Силикагель выдерживают не менее 5 ч при температуре 130 °С, затем охлаждают в эксикаторе и хранят в герметично закупоренной емкости в эксикаторе. В колбу Эрленмейера вместимостью 300 см3 (с притертой пробкой) к 98,5 г высушенного силикагеля по капле добавляют 1,5 см3 воды из бюретки с постоянным изменением направления. Колбу Эрленмейера сразу же закрывают пробкой, сильно встряхивают в течение 5 мин, пока комочки не перестанут быть заметны, и затем встряхивают на встряхивающем механизме в течение 2 ч. Адсорбент хранят в герметично закрытой емкости.
7.2.21 Вата стеклянная, тщательно промытая ацетоном.
7.2.22 Вата хлопковая, тщательно промытая ацетоном.
7.2.23 Смола BioBeads® S-X3* с размером частиц от 38 до 75 мкм (200 - 400 меш).
__________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
7.2.24 Бумага быстрофильтрующая диаметром 6 и 13,5 см для быстрого фильтрования, тщательно промытая ацетоном.
7.2.25 Допускается применение других реактивов и материалов по качеству не хуже вышеуказанных.
7.3 Оборудование
7.3.1 Обычные лабораторные приборы, соответствующие ГОСТ 32689.1, а также нижеследующие.
7.3.2 Смеситель высокоскоростной (не менее 500 об/мин) или стержень для гомогенизации с подходящей емкостью для смешивания.
7.3.3 Испаритель ротационный с водяной баней.
7.3.4 Прибор для колоночной гельхроматографии, например Autoprep® 1001* или Autoprep® 1002* с колонкой с внутренним диаметром 25 мм, длиной 50 см и с двадцатью тремя пробоотборниками вместимостью 5 см3.
Колонку заполняют смолой BioBeads® S-X3* массой 50 г, в течение ночи проводят промывку элюирующей смесью по 7.2.6, высота заполнения должна быть около 32 см; изготовление колонки - по 7.5.3.2.
__________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
7.3.5 Колонка для хроматографии с внутренним диаметром 7 мм, длиной 230 мм, с вытянутым острием.
7.3.6 Цилиндры мерные 2-го класса точности вместимостью 25, 50, 250 см3 любого исполнения по ГОСТ 1770.
7.3.7 Допускается применение другого оборудования с метрологическими и техническими характеристиками не хуже вышеуказанных.
7.4 Экстракция
7.4.1 Продукция растительного происхождения и другие продукты питания с массовой долей воды более 70 %
Измельченную продукцию в количестве 100 г (т) с содержанием воды х % (=х г/100 г) гомогенизируют в смесителе (см. 7.3.2) с добавлением (100-х) г воды и 200 см3 ацетона в течение 3 мин.
7.4.2 Продукция растительного происхождения с низким содержанием воды
Берут от 10 до 50 г (т) сухих или высушенных продуктов растительного происхождения с содержанием воды х % (=х г/100 г) (например, от 25 до 50 г в случае сушеных фруктов и овощей, от 10 до 20 г в случае пряностей и чая, 50 г в случае злаков). Затем добавляют столько воды, чтобы в общей сложности получилось 100 г.
Добавленное количество воды W, г, рассчитывают по формуле
|
|
(2) |
где 100 - масса анализируемого раствора, г;
m - масса лабораторной пробы, г;
х - содержание воды в 100 г лабораторной пробы, г.
Лабораторную пробу и воду смешивают и оставляют настаиваться в течение 10 - 20 мин. Затем добавляют 200 см3 ацетона и смесь гомогенизируют в течение 3 мин.
7.5.1 Очистка с использованием дихлорметана
Добавляют 10 г адсорбента (например, Celite® 545*) к лабораторной пробе, полученной по 7.4.2, смесь гомогенизируют снова в течение 10 с.
Полученный согласно 7.4.1 или 7.4.2 гомогенат фильтруют в воронке Бюхнера через фильтровальную бумагу (см. 7.2.24) при небольшом разрежении, пока не соберется более 200 см3 фильтрата.
Чтобы избежать потерь, связанных с испарением ацетона, рекомендуется создавать только небольшое разрежение (вакуум). Осадок на фильтре может осушиться не полностью.
Берут 200 см3 собранного фильтрата (VR1), помещают в делительную воронку вместимостью 500 см3. Добавляют 20 г хлорида натрия (см. 7.2.16) и смесь сильно встряхивают в течение 3 мин. Затем добавляют 100 см3 дихлорметана, смесь встряхивают в течение 2 мин, затем на 10 мин оставляют в покое для разделения фаз. Нижнюю водную фазу отбрасывают. Органическую фазу смешивают в колбе с 25 г сульфата натрия (см. 7.2.17), оставляют на 30 мин при периодическом перемешивании и затем фильтруют через воронку с ватным тампоном (см. 7.2.22), покрытым слоем сульфата натрия толщиной 3 см. Фильтрат собирают в круглую колбу вместимостью 500 см3, а разделительную воронку и фильтр дважды промывают 20 см3 этилацетата. Раствор концентрируют в ротационном испарителе (см. 7.3.3) до 2 см3. Последние остатки растворителя удаляют путем подачи слабого потока азота.
___________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
7.5.2 Очистка с использованием циклогексана/этилацетата
Полученный в соответствии с 7.4.1 или 7.4.2 гомогенат смешивают с 35 г хлорида натрия (см. 7.2.16) и точно со 100 см3 элюционной смеси по 7.2.6, затем смесь снова гомогенизируют в течение 1 мин. После того как фазы отчетливо отделились, верхнюю органическую фазу отбирают для дальнейшего использования. При недостаточном или длящемся слишком долго (более 30 мин) разделении фаз смесь подвергают центрифугированию.
Точно 200 см3 (VR1) полученной органической фазы фильтруют через ватный тампон (см. 7.2.22), покрытый сульфатом натрия массой 100 г (см. 7.2.17). Фильтрат собирают в круглодонную колбу вместимостью 500 см3. Цилиндр и стеклянную воронку с ватным тампоном четыре раза промывают 20 см3 элюционной смеси (см. 7.2.6).
Полученный фильтрат концентрируют посредством ротационного испарителя (см. 7.3.3) до влажного остатка (не до сухого состояния).
7.5.3 Очистка посредством гелевой хроматографии
7.5.3.1 Общие указания
Если экстракты достаточно чистые, чтобы обеспечить возможность получения хроматограмм без существенных помех, обусловленных матрицей, очистку гельхроматографией можно не проводить. Однако проведенные межлабораторные испытания (см. 7.7 и 7.8) были получены с использованием очистки с помощью гельхроматографии. Альтернативные типы и размеры хроматографических колонок, отличные от описанной в 7.3.4, могут использоваться, если согласованы условия и если может быть показано, что они приводят к сравнимым результатам.
7.5.3.2 Набивка колонки с фильтрующим гелем
50 г смолы BioBeads® S-X3* оставляют на ночь для замачивания в смеси для элюирования по 7.2.6. Суспензию помещают за одну заливку в колонку вместимостью приблизительно 180 см3. Как только гель (без пузырьков воздуха) осядет до высоты заполнения приблизительно 32 см, вводят поршень, который опускают до геля и закрепляют винтом. Если гель после длительной эксплуатации еще уплотнится, поршень должен быть соответствующим образом переставлен (принимают во внимание инструкции производителя).
_________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
7.5.3.3 Контроль элюционного объема
Перед первым использованием для каждой колонки с гелем контролируют диапазон объема элюирования на нескольких пестицидах и с использованием подходящих сырых экстрактов в соответствии с таблицей 4.
Таблица 4 - Диапазоны объемов элюирования при гелевой хроматографии и очистке пестицидов на колонке с силикагелем
|
Наименование пестицида |
Диапазон объема элюирования, см3 |
Силикагельные элюаты |
||||
|
1 |
2 |
3 |
4 |
5 |
||
|
Ацефат |
115 - 145 |
0 |
0 |
0 |
0 |
5 |
|
Аклонифен |
115 - 145 |
0 |
5 |
0 |
0 |
0 |
|
Алахлор |
125 - 150 |
0 |
0 |
5 |
0 |
0 |
|
Алдрин |
120 - 150 |
5 |
0 |
0 |
0 |
0 |
|
Аметрин |
115 - 190 |
0 |
0 |
1 |
3 |
0 |
|
Амидитион |
115 - 145 |
0 |
0 |
0 |
4 |
3 |
|
Анилазина |
105 - 135 |
0 |
0 |
5 |
0 |
0 |
|
Антрахион |
145 - 185 |
0 |
2 |
4 |
0 |
0 |
|
Антрацин |
110 - 135 |
0 |
0 |
4 |
3 |
0 |
|
Ацинфос-этил |
130 - 160 |
0 |
0 |
5 |
0 |
0 |
|
Ацинфос-метил |
145 - 180 |
0 |
0 |
4 |
0 |
0 |
|
Азоксистробин |
120 - 155 |
0 |
0 |
0 |
5 |
0 |
|
Бенфлуралин |
100 - 130 |
5 |
0 |
0 |
0 |
0 |
|
Бензоилпроп-этил |
125 - 150 |
0 |
3 |
3 |
0 |
0 |
|
Бифенокс |
115 - 150 |
0 |
3 |
3 |
0 |
0 |
|
Бифентрин |
090 - 120 |
0 |
5 |
0 |
0 |
0 |
|
Бинапакрил |
100 - 130 |
0 |
5 |
0 |
0 |
0 |
|
Битертанол |
100 - 130 |
0 |
0 |
0 |
4 |
2 |
|
Боскалид |
105 - 130 |
0 |
0 |
5 |
0 |
0 |
|
Бромацилb |
105 - 140 |
0 |
0 |
0 |
5 |
0 |
|
Бромофос |
120 - 150 |
4 |
2 |
0 |
0 |
0 |
|
Бромофос-этил |
110 - 140 |
5 |
1 |
0 |
0 |
0 |
|
Бромпропилат |
95 - 135 |
0 |
0 |
3 |
3 |
1 |
|
Бромоксинил-октаноат |
120 - 150 |
0 |
5 |
1 |
0 |
0 |
|
Камфехлор (токсафен) |
110 - 150 |
5 |
1 |
0 |
0 |
0 |
|
Каптафолc |
120 - 150 |
0 |
0 |
5 |
0 |
0 |
|
Каптанc |
120 - 150 |
0 |
0 |
5 |
0 |
0 |
|
Карбофенотион |
120 - 140 |
0 |
3 |
0 |
0 |
0 |
|
Карбофенотион-метил |
120 - 160 |
0 |
4 |
0 |
0 |
0 |
|
Хинометионат |
170 - 200 |
0 |
1 |
4 |
0 |
0 |
|
Хлорбензидd |
120 - 155 |
0 |
0 |
1 |
0 |
0 |
|
Хлорбензид-сульфон |
130 - 160 |
0 |
0 |
5 |
0 |
0 |
|
α-Хлордан |
110 - 140 |
5 |
0 |
0 |
0 |
0 |
|
γ-Хлордан |
100 - 130 |
5 |
0 |
0 |
0 |
0 |
|
Хлорфенапир |
85 - 105 |
0 |
5 |
0 |
0 |
0 |
|
Хлорфенпроп-метил |
125 - 150 |
0 |
5 |
0 |
0 |
0 |
|
Хлорфензол |
120 - 150 |
1 |
5 |
0 |
0 |
0 |
|
Хлорфенвинфос |
110 - 140 |
0 |
0 |
4 |
3 |
0 |
|
Хлоридазон |
130 - 155 |
0 |
0 |
0 |
4 |
1 |
|
Хлормефос |
115 - 145 |
3 |
3 |
0 |
0 |
0 |
|
Хлорбензилат |
100 - 135 |
0 |
0 |
4 |
2 |
1 |
|
Хлоронеб |
145 - 170 |
0 |
5 |
0 |
0 |
0 |
|
Хлорпропилат |
100 - 135 |
0 |
0 |
4 |
2 |
0 |
|
Хлорталонил |
125 - 165 |
0 |
5 |
0 |
0 |
0 |
|
Хлортолурон |
115 - 150 |
0 |
0 |
0 |
5 |
2 |
|
Хлороксурон |
130 - 155 |
0 |
0 |
1 |
5 |
0 |
|
Хлорпрофам |
110 - 135 |
0 |
2 |
4 |
0 |
0 |
|
Хлорпирифос |
110 - 140 |
2 |
4 |
0 |
0 |
0 |
|
Хлорпирифос-метил |
120 - 150 |
1 |
4 |
0 |
0 |
0 |
|
Хлортал-диметил |
135 - 160 |
0 |
5 |
1 |
0 |
0 |
|
Хлортиофос |
115 - 155 |
0 |
4 |
0 |
0 |
0 |
|
Клодинафоп-пропаргил |
100 - 125 |
0 |
0 |
5 |
0 |
0 |
|
Кломазон |
115 - 145 |
0 |
0 |
5 |
0 |
0 |
|
Клоквинтоцет-1-мексил |
105 - 130 |
0 |
0 |
2 |
4 |
0 |
|
Кумафос |
135 - 165 |
0 |
0 |
5 |
0 |
0 |
|
Кротоксифос |
105 - 145 |
0 |
0 |
0 |
4 |
0 |
|
Круфомат |
100 - 140 |
0 |
0 |
0 |
3 |
4 |
|
Цианазин |
110 - 135 |
0 |
0 |
0 |
4 |
0 |
|
Цианофенфос |
115 - 145 |
0 |
2 |
4 |
0 |
0 |
|
Цианофос |
115 - 150 |
0 |
0 |
4 |
0 |
0 |
|
Цифлутрин |
090 - 120 |
0 |
5 |
0 |
0 |
0 |
|
λ-Цигалотрин |
090 - 110 |
0 |
5 |
0 |
0 |
0 |
|
Цимоксанилe |
110 - 130 |
0 |
0 |
0 |
5 |
0 |
|
Киперметрин |
100 - 135 |
0 |
5 |
0 |
0 |
0 |
|
Ципродинил |
105 - 135 |
0 |
0 |
5 |
0 |
0 |
|
о.ρ'-ДДД |
110 - 140 |
5 |
0 |
0 |
0 |
0 |
|
ρ,ρ'-ДДД |
100 - 140 |
5 |
0 |
0 |
0 |
0 |
|
о,ρ'-ДДЕ |
120 - 150 |
5 |
0 |
0 |
0 |
0 |
|
ρ,ρ'-ДДЕ |
120 - 150 |
5 |
0 |
0 |
0 |
0 |
|
о,ρ'-ДДТ |
120 - 150 |
5 |
0 |
0 |
0 |
0 |
|
ρ,ρ'-ДДТ |
110 - 140 |
5 |
0 |
0 |
0 |
0 |
|
ДЭФf |
115 - 135 |
0 |
0 |
5 |
1 |
0 |
|
Дельтаметрин |
100 - 135 |
0 |
5 |
0 |
0 |
0 |
|
Деметон-С-метил |
125 - 155 |
0 |
0 |
0 |
0 |
0 |
|
Деметон-С-метил-сульфон |
120 - 160 |
0 |
0 |
0 |
2 |
3 |
|
Деметон-С-сульфонg |
115 - 140 |
0 |
0 |
0 |
3 |
3 |
|
Деметон-С-сульфоксидh |
140 - 170 |
0 |
0 |
0 |
0 |
3 |
|
N-Десетил-пиримифос-метил |
120 - 155 |
0 |
0 |
1 |
5 |
0 |
|
Диалифос |
110 - 140 |
0 |
3 |
3 |
0 |
0 |
|
Диаллат |
120 - 150 |
0 |
4 |
1 |
0 |
0 |
|
Диацинон |
105 - 135 |
0 |
0 |
5 |
0 |
0 |
|
Дихлобенил |
125 - 155 |
1 |
5 |
0 |
0 |
0 |
|
Дихлофентион |
110 - 140 |
3 |
3 |
0 |
0 |
0 |
|
Дихлофлуанидi |
100 - 140 |
0 |
3 |
3 |
0 |
0 |
|
ρ,ρ'-Дихлорбензофенонj |
125 - 155 |
0 |
5 |
0 |
0 |
0 |
|
Дихлорвос |
115 - 140 |
0 |
0 |
1 |
3 |
0 |
|
Диклофоп-метил |
135 - 165 |
0 |
0 |
5 |
0 |
0 |
|
Диклоран |
105 - 145 |
0 |
5 |
0 |
0 |
0 |
|
Дикофолk |
100 - 150 |
2 |
4 |
0 |
0 |
0 |
|
Дикротофос |
130 - 160 |
0 |
0 |
0 |
0 |
5 |
|
Дилдрин |
120 - 150 |
0 |
5 |
0 |
0 |
0 |
|
Диэтофенкарб |
105 - 130 |
0 |
0 |
5 |
0 |
0 |
|
Дифеноконазол |
110 - 140 |
0 |
0 |
0 |
3 |
3 |
|
Дифлуфеникан |
105 - 125 |
0 |
0 |
5 |
0 |
0 |
|
Димефокс |
120 - 155 |
0 |
0 |
0 |
0 |
5 |
|
Диметахлор |
135 - 165 |
0 |
0 |
4 |
2 |
0 |
|
Диметоат |
120 - 150 |
0 |
0 |
0 |
3 |
3 |
|
Динитраминi |
105 - 130 |
4 |
1 |
0 |
0 |
0 |
|
Динобутон |
110 - 140 |
0 |
4 |
2 |
0 |
0 |
|
Динокап |
100 - 120 |
0 |
5 |
0 |
0 |
0 |
|
Диоксатион |
110 - 140 |
0 |
3 |
3 |
1 |
0 |
|
Дифениламин |
130 - 160 |
0 |
5 |
0 |
0 |
0 |
|
Дисульфотонm |
115 - 150 |
0 |
2 |
0 |
0 |
3 |
|
Дисульфотон-сульфон |
110 - 140 |
0 |
0 |
5 |
0 |
0 |
|
Дисульфотон-сульфоксид |
120 - 150 |
0 |
0 |
0 |
0 |
5 |
|
Диталимфос |
120 - 150 |
0 |
0 |
4 |
1 |
0 |
|
Эдифенфос |
130 - 160 |
0 |
0 |
4 |
0 |
0 |
|
α-Эндосульфан |
110 - 150 |
2 |
4 |
0 |
0 |
0 |
|
β-Эндосульфан |
110 - 150 |
0 |
5 |
0 |
0 |
0 |
|
Эндосульфан-сульфат |
100 - 140 |
0 |
5 |
0 |
0 |
0 |
|
Эндрин |
130 - 160 |
0 |
5 |
0 |
0 |
0 |
|
ЭПН |
135 - 160 |
0 |
5 |
0 |
0 |
0 |
|
Этион |
100 - 140 |
0 |
5 |
0 |
0 |
0 |
|
Этофумесат |
110 - 135 |
0 |
0 |
3 |
0 |
0 |
|
Этопрофос |
120 - 155 |
0 |
0 |
4 |
1 |
0 |
|
Этримфос |
105 - 140 |
0 |
0 |
5 |
0 |
0 |
|
Фамофос |
125 - 155 |
0 |
0 |
5 |
0 |
0 |
|
Фенамидон |
105 - 140 |
0 |
0 |
4 |
1 |
0 |
|
Фенамифос |
105 - 140 |
0 |
0 |
0 |
4 |
2 |
|
Фенаримол |
125 - 150 |
0 |
0 |
0 |
4 |
0 |
|
Феназаквин |
105 - 145 |
0 |
0 |
3 |
2 |
0 |
|
Фенхлорфос |
120 - 150 |
4 |
2 |
0 |
0 |
0 |
|
Фенитротион |
120 - 150 |
0 |
4 |
0 |
0 |
0 |
|
Феноксикарб |
120 - 145 |
0 |
0 |
4 |
0 |
0 |
|
Фенпиклонил |
100 - 130 |
0 |
0 |
3 |
3 |
0 |
|
Фенпропатрин |
100 - 120 |
0 |
5 |
1 |
0 |
0 |
|
Фензон |
130 - 160 |
0 |
5 |
0 |
0 |
0 |
|
Фенсульфотион |
120 - 150 |
0 |
0 |
0 |
3 |
3 |
|
Фентион |
130 - 160 |
0 |
3 |
0 |
0 |
0 |
|
Фенвалерат |
105 - 135 |
0 |
4 |
1 |
0 |
0 |
|
Флубензиминi |
085 - 120 |
0 |
5 |
0 |
0 |
0 |
|
Флухлоралин |
100 - 120 |
5 |
1 |
0 |
0 |
0 |
|
Флуцитринат |
090 - 120 |
0 |
5 |
0 |
0 |
0 |
|
Флудиоксонил |
090 - 120 |
0 |
0 |
5 |
0 |
0 |
|
Флуорогликофен-этил |
090 - 115 |
0 |
0 |
5 |
0 |
0 |
|
Флуотримазол |
100 - 140 |
0 |
0 |
4 |
2 |
0 |
|
Флуквинконазол |
095 - 125 |
0 |
0 |
3 |
3 |
0 |
|
Флуртамоне |
085 - 105 |
0 |
0 |
0 |
5 |
0 |
|
Флутриафол |
115 - 135 |
0 |
0 |
0 |
3 |
3 |
|
Флуванилат |
095 - 120 |
0 |
5 |
0 |
0 |
0 |
|
Фольпет |
140 - 180 |
0 |
3 |
4 |
0 |
0 |
|
Фонофос |
120 - 150 |
0 |
4 |
1 |
0 |
0 |
|
Формотион |
120 - 150 |
0 |
0 |
4 |
1 |
0 |
|
Фуберидазолl |
120 - 160 |
0 |
0 |
0 |
5 |
1 |
|
Генит |
135 - 165 |
0 |
5 |
0 |
0 |
0 |
|
α-ГХЦГ |
120 - 150 |
5 |
0 |
0 |
0 |
0 |
|
β-гхцг |
100 - 130 |
5 |
0 |
0 |
0 |
0 |
|
δ-ГХЦГ |
100 - 130 |
5 |
0 |
0 |
0 |
0 |
|
ε-ГХЦГ |
105 - 135 |
5 |
0 |
0 |
0 |
0 |
|
Гептахлор |
110 - 140 |
5 |
0 |
0 |
0 |
0 |
|
Цис-гептахлор-эпоксид |
125 - 155 |
3 |
3 |
0 |
0 |
0 |
|
Транс-гептахлор-эпоксид |
125 - 155 |
3 |
3 |
0 |
0 |
0 |
|
Гептенофос |
120 - 150 |
0 |
0 |
1 |
4 |
0 |
|
Гексахлорбензол |
140 - 165 |
5 |
0 |
0 |
0 |
0 |
|
Имазалилi |
120 - 150 |
0 |
0 |
0 |
0 |
5 |
|
Индоксакарб |
095 - 120 |
0 |
0 |
5 |
0 |
0 |
|
Иодфенфос |
120 - 150 |
4 |
2 |
0 |
0 |
0 |
|
Иоксинил-октаноат |
125 - 155 |
0 |
5 |
1 |
0 |
0 |
|
Ипродион |
115 - 145 |
0 |
0 |
5 |
1 |
0 |
|
Ипроваликарб |
085 - 110 |
0 |
0 |
0 |
5 |
0 |
|
Изобензан |
105 - 140 |
5 |
0 |
0 |
0 |
0 |
|
Изокарбамид |
130 - 165 |
0 |
0 |
0 |
1 |
5 |
|
Изодрин |
120 - 150 |
5 |
0 |
0 |
0 |
0 |
|
Изопропалин |
110 - 135 |
5 |
0 |
0 |
0 |
0 |
|
δ-кето-эндрин |
135 - 165 |
3 |
4 |
0 |
0 |
0 |
|
Крезоксим-метил |
120 - 155 |
0 |
0 |
5 |
0 |
0 |
|
Ленаксил |
130 - 160 |
0 |
0 |
0 |
5 |
0 |
|
Лептофос |
120 - 150 |
5 |
1 |
0 |
0 |
0 |
|
Линдан (γ-ГХЦГ) |
110 - 140 |
5 |
0 |
0 |
0 |
0 |
|
Линурон |
120 - 140 |
0 |
0 |
4 |
1 |
0 |
|
Малаоксон |
110 - 140 |
0 |
0 |
0 |
4 |
0 |
|
Малатион |
110 - 140 |
0 |
0 |
4 |
0 |
0 |
|
МСРА-(2-бутоксиэтил) эфирe |
115 - 145 |
0 |
0 |
5 |
0 |
0 |
|
Мекарбам |
105 - 145 |
0 |
0 |
4 |
0 |
0 |
|
Мефенпир-диэтил |
100 - 130 |
0 |
0 |
5 |
0 |
0 |
|
Мефосфолан |
140 - 170 |
0 |
0 |
0 |
2 |
4 |
|
Мерфосn |
125 - 145 |
5 |
0 |
0 |
0 |
0 |
|
Металаксил |
115 - 150 |
0 |
0 |
0 |
5 |
1 |
|
Метконазол |
085 - 115 |
0 |
0 |
0 |
4 |
1 |
|
Метабензтиазурон |
150 - 180 |
0 |
0 |
0 |
5 |
0 |
|
Метамидофос |
120 - 150 |
0 |
0 |
0 |
0 |
4 |
|
Метидатион |
130 - 165 |
0 |
0 |
4 |
0 |
0 |
|
Метопротрин |
115 - 140 |
0 |
0 |
0 |
4 |
1 |
|
Метоксихлор |
125 - 155 |
0 |
5 |
0 |
0 |
0 |
|
Метолахлор |
130 - 160 |
0 |
0 |
5 |
1 |
0 |
|
Метрибуцин |
125 - 150 |
0 |
0 |
3 |
1 |
0 |
|
Мевинфос |
120 - 150 |
0 |
0 |
0 |
5 |
0 |
|
Мирекс |
130 - 160 |
5 |
0 |
0 |
0 |
0 |
|
Монокротофос |
115 - 140 |
0 |
0 |
0 |
0 |
5 |
|
Монолинурон |
125 - 150 |
0 |
0 |
4 |
2 |
0 |
|
Морфотион |
130 - 170 |
0 |
0 |
0 |
5 |
0 |
|
Наледо |
115 - 155 |
0 |
0 |
4 |
1 |
0 |
|
Напропамид |
135 - 165 |
0 |
0 |
2 |
4 |
0 |
|
Нитралин |
115 - 145 |
0 |
1 |
5 |
0 |
0 |
|
Нитрофен |
135 - 165 |
2 |
5 |
0 |
0 |
0 |
|
Нитротал-изопропил |
105 - 135 |
0 |
1 |
4 |
1 |
0 |
|
Нуаримол |
130 - 155 |
0 |
0 |
0 |
5 |
0 |
|
Октахлордипропилэфир (S421) |
110 - 130 |
5 |
0 |
0 |
0 |
0 |
|
Ометоат |
140 - 160 |
0 |
0 |
0 |
0 |
5 |
|
Оксадиазон |
115 - 145 |
0 |
0 |
5 |
0 |
0 |
|
Оксихлордан (Октахлор-эпоксид) |
100 - 160 |
5 |
0 |
0 |
0 |
0 |
|
Оксидеметон-метилh |
135 - 165 |
0 |
0 |
0 |
0 |
0 |
|
Параоксон |
110 - 140 |
0 |
0 |
1 |
4 |
0 |
|
Параоксон-метил |
140 - 170 |
0 |
0 |
1 |
4 |
1 |
|
Паратион |
110 - 140 |
0 |
4 |
1 |
0 |
0 |
|
Паратион-метил |
120 - 150 |
0 |
4 |
1 |
0 |
0 |
|
Пендиметалин |
125 - 155 |
1 |
5 |
0 |
0 |
0 |
|
Пентахлоранилин |
110 - 140 |
5 |
0 |
0 |
0 |
0 |
|
Метидатион |
130 - 165 |
0 |
0 |
4 |
0 |
0 |
|
Метопротрин |
115 - 140 |
0 |
0 |
0 |
4 |
1 |
|
Пентахлоранизол |
125 - 160 |
5 |
0 |
0 |
0 |
0 |
|
Пентахлорбензол |
125 - 165 |
5 |
0 |
0 |
0 |
0 |
|
Перметрин |
115 - 145 |
0 |
5 |
1 |
0 |
0 |
|
Пертан |
110 - 140 |
5 |
1 |
0 |
0 |
0 |
|
Фенкаптон |
115 - 145 |
3 |
3 |
0 |
0 |
0 |
|
Фенмедифам |
105 - 130 |
0 |
0 |
3 |
3 |
1 |
|
Фентоат |
115 - 150 |
0 |
1 |
4 |
0 |
0 |
|
Форатр |
115 - 145 |
0 |
2 |
0 |
0 |
0 |
|
Фосалон |
110 - 140 |
0 |
0 |
4 |
0 |
0 |
|
Фосфамидон |
110 - 145 |
0 |
0 |
0 |
1 |
5 |
|
Фоксим |
120 - 150 |
0 |
5 |
0 |
0 |
0 |
|
Пикоксистробин |
100 - 130 |
0 |
0 |
5 |
0 |
0 |
|
Пиперонилбутоксидe |
100 - 130 |
0 |
0 |
4 |
1 |
0 |
|
Пиримикарб |
130 - 170 |
0 |
0 |
0 |
5 |
0 |
|
Пиримифос-этил |
100 - 135 |
0 |
0 |
4 |
0 |
0 |
|
Пиримифос-метил |
105 - 145 |
0 |
0 |
4 |
0 |
0 |
|
Процимидон |
120 - 150 |
0 |
0 |
5 |
0 |
0 |
|
Профенофос |
130 - 155 |
0 |
0 |
4 |
1 |
0 |
|
Профлюралин |
100 - 125 |
5 |
0 |
0 |
0 |
0 |
|
Пропахлор |
125 - 150 |
0 |
0 |
5 |
0 |
0 |
|
Пропанил |
105 - 130 |
0 |
0 |
4 |
2 |
0 |
|
Профам |
100 - 180 |
0 |
0 |
5 |
0 |
0 |
|
Пропиконазол |
120 - 150 |
0 |
0 |
0 |
4 |
2 |
|
Пропоксур |
110 - 130 |
0 |
0 |
4 |
2 |
0 |
|
Пропизамид |
095 - 125 |
0 |
0 |
4 |
0 |
0 |
|
Просульфокарб |
120 - 145 |
0 |
2 |
3 |
0 |
0 |
|
Протиофос |
105 - 145 |
5 |
0 |
0 |
0 |
0 |
|
Пиразофос |
110 - 140 |
0 |
0 |
5 |
0 |
0 |
|
Пиретринl |
100 - 130 |
0 |
0 |
5 |
1 |
0 |
|
Пиридабен |
095 - 125 |
0 |
0 |
4 |
0 |
0 |
|
Пирифенокс |
125 - 165 |
0 |
0 |
2 |
4 |
0 |
|
Пирипроксифен |
105 - 135 |
0 |
2 |
3 |
0 |
0 |
|
Квиналфос |
115 - 155 |
0 |
0 |
4 |
0 |
0 |
|
Квинтоцен |
135 - 165 |
0 |
0 |
4 |
0 |
0 |
|
Рабензазолl |
120 - 160 |
0 |
0 |
5 |
0 |
0 |
|
Ресметринe |
100 - 130 |
0 |
5 |
0 |
0 |
0 |
|
Салитион |
125 - 165 |
0 |
5 |
0 |
0 |
0 |
|
Силтиофам |
090 - 120 |
0 |
0 |
5 |
0 |
0 |
|
Симазин |
095 - 135 |
0 |
0 |
2 |
4 |
0 |
|
Спироксаминq |
085 - 105 |
0 |
0 |
0 |
0 |
4 |
|
Стробан-Т |
125 - 160 |
5 |
0 |
0 |
0 |
0 |
|
Сульфотеп |
100 - 130 |
0 |
4 |
1 |
0 |
0 |
|
Сулпрофос |
115 - 155 |
0 |
3 |
0 |
0 |
0 |
|
Тебуфенпирад |
105 - 145 |
0 |
0 |
5 |
0 |
0 |
|
Текназен |
130 - 160 |
5 |
0 |
0 |
0 |
0 |
|
Тербацил |
120 - 145 |
0 |
0 |
0 |
5 |
0 |
|
Тербуфос |
125 - 155 |
0 |
3 |
0 |
0 |
0 |
|
Тербутрин |
115 - 175 |
0 |
0 |
1 |
2 |
0 |
|
2,3,4,5-Тетрахлорнитробензол |
130 - 160 |
5 |
0 |
0 |
0 |
0 |
|
Тетрахлорвинфос |
120 - 140 |
0 |
0 |
4 |
1 |
0 |
|
Тетрадифон |
120 - 150 |
0 |
5 |
0 |
0 |
0 |
|
Тетраметрин |
120 - 150 |
0 |
0 |
5 |
0 |
0 |
|
Тетрасул |
125 - 155 |
5 |
0 |
0 |
0 |
0 |
|
Тионацин |
120 - 150 |
0 |
1 |
4 |
0 |
0 |
|
Толклофос-метил |
130 - 165 |
0 |
5 |
0 |
0 |
0 |
|
Толилфлуанидi |
105 - 135 |
0 |
3 |
3 |
0 |
0 |
|
Триадимефон |
100 - 130 |
0 |
0 |
3 |
3 |
0 |
|
Триадименол |
100 - 130 |
0 |
0 |
0 |
4 |
2 |
|
Триаллат |
120 - 150 |
0 |
5 |
0 |
0 |
0 |
|
Триамифос |
125 - 160 |
0 |
0 |
0 |
0 |
4 |
|
Триазофос |
120 - 140 |
0 |
0 |
4 |
1 |
0 |
|
Триазоксид |
165 - 195 |
0 |
0 |
0 |
5 |
0 |
|
Трихлорфонh |
100 - 140 |
0 |
0 |
0 |
0 |
4 |
|
Трихлоронат |
110 - 140 |
5 |
1 |
0 |
0 |
0 |
|
Трифлоксистробин |
090 - 110 |
0 |
0 |
5 |
0 |
0 |
|
Трифлумизол |
085 - 105 |
0 |
0 |
0 |
5 |
0 |
|
Трифлуралин |
100 - 130 |
5 |
0 |
0 |
0 |
0 |
|
Тритиконазол |
100 - 125 |
0 |
0 |
0 |
4 |
1 |
|
Винклозолин |
100 - 130 |
0 |
4 |
1 |
0 |
0 |
|
Зоксамид |
085 - 125 |
0 |
0 |
5 |
0 |
0 |
|
а Экстракция с добавлением ацетата калия, с добавлением уксусной кислоты при инжекции в газовый хроматограф. b Высота пика зависит от растворителя. c Разделительная колонка газового хроматографа должна быть хорошо кондиционирована. d При очистке на силикагеле наблюдается дополнительный пик с более продолжительным временем удерживания. е Испытано с помощью газового хроматографа с масс-детектором. f Также из мерфоса. g Инжекция стандартного раствора в газовый хроматограф в течение 2 мин после инжекции аналитического раствора. h Повышенный выход за счет элюирования дополнительными 8 см3 ацетона. i Экстракция с добавлением лимонной кислоты и щавелевой кислоты. j Продукт распада дикофола. k Распад до ρ,ρ'-дихлорбензофенона. l Обработку проводят при полном отсутствии света. m При очистке на силикагеле в хроматографе в элюате 5 дополнительно наблюдается дисульфотонсульфоксид. n Частично окисление до ДЕФ. 0 При очистке на силикагеле наблюдаются различные значения выхода продукта. р При очистке на силикагеле частично происходит распад. q Для элюата 5 требуется 12 см3 ацетона для полного элюирования активного вещества. |
||||||
|
Примечание - Силикагельные элюаты: 1 - n-гексан/толуол в объемном соотношении 65:35; 2 - толуол; 3 - толуол:ацетон в объемном соотношении 95:5; 4 - толуол/ацетон в объемном соотношении 80:20; 5 - ацетон. Цифры в таблице означают доли обнаружения в следующих диапазонах: 5 - более 90 %; 4 - приблизительно от 60 % до 90 %; 3 - приблизительно от 30 % до 60 %; 2 - приблизительно от 10 % до 30 %; 1 - менее чем 10 %; 0 - не обнаружено. |
||||||
Для контроля элюирующего объема в петлю для ввода лабораторной пробы инжектируют сырые экстракты или смесь образцов сравнения (по ГОСТ 32689.1) и проводят элюирование согласно 7.5.3.4. С помощью подходящего аналитического метода оценивают, найдены ли полностью использованные пестициды и/или не привели ли отделенные загрязнения к помехам. Аналогичный контроль проводят применительно к колонкам, которые долгое время не эксплуатировались.
Примечание - На некоторых матрицах наблюдались случайные адсорбционные явления некоторых испытуемых веществ на смоле BioBeads®, что может привести к неверным отрицательным или неверным положительным результатам.
7.5.3.4 Очистка сырых экстрактов
Остаток при концентрировании сырого экстракта согласно 7.5.1 или 7.5.2 смешивают точно с 7,5 см3 этилацетата и растворяют при легком помешивании. Для связывания остаточной воды раствор смешивают приблизительно с 5 г смеси солей (см. 7.2.18), снова перемешивают и смешивают точно с 7,5 см3 циклогексана, в результате получают 15,0 см3 (VR2). Смесь встряхивают примерно в течение 20 с, оставляют для осаждения солей, фильтруют и фильтрат вносят в пробоотборник (VR3) хроматографа с гелевой фильтрацией.
Пестициды элюируют смесью по 7.2.6 с гелевой колонки со скоростью потока 5,0 см3/мин. Аппаратные переключатели прибора для гельхроматографии настроены как при контроле объема элюирования. Настройки зависят от определяемых пестицидов. Обычными являются нижеследующие настройки (см. также таблицу 4):
- положение переключателя «Сброс» на 18 мин для сброса 90 см3;
- положение переключателя «Сбор» на 15 мин для сбора 75 см3;
- положение переключателя «Промывка» на 2 мин для промывки колонки 10 см3.
Собранный объем концентрируют в ротационном испарителе до 1 см3 (при медленном вращении и малой глубине погружения колбы) и переносят с помощью пипетки в градуированную пробирку с притертой пробкой. Круглодонную колбу испарителя промывают этилацетатом и концентрированный элюат дополняют до 5,0 см3 (VR4) этилацетатом. Этилацетат должен добавляться обязательно, чтобы остатки полностью перешли в раствор. Для определения остатков отдельных пестицидов прибор может быть настроен на улавливание небольшого объема, если указанные в таблице 4 диапазоны элюирования требуют этого для определенных пестицидов.
7.5.4 Хроматографическая очистка на миниколонке с силикагелем
Колонку по 7.3.5 заполняют в следующей последовательности: тампон стеклянной ваты (см. 7.2.21), 1,0 г дезактивированного силикагеля (см. 7.2.20), слой сульфата натрия толщиной (см. 7.2.17) от 5 до 10 мм, тампон стеклянной ваты. Перед использованием колонку промывают 5 см3 n-гексана, элюат выбрасывают. Как только уровень n-гексана опустится до уровня силикагеля, подают аналитический раствор, как описано в 7.5.4.3.
7.5.4.2 Контроль силикагеля
В предварительно промытую согласно 7.5.4.1 колонку добавляют 1,0 см3 раствора, содержащего из 0,05 мкг/см3 НСВ (гексахпорбензола), 0,10 мкг/см3 линдана, 0,20 мкг/см3 гексахпор-эпоксида, 0,25 мкг/см3 α-эндосульфана, 0,25 мкг/см3 дилдрина и 1,25 мкг/см3 эндосульфансульфата в n-гексане. Если активность силикагеля правильно настроена, при элюировании согласно 7.5.4.3 и при газохроматографическом анализе с детектором электронного захвата пестициды присутствуют в следующих фракциях:
- элюат 1: НСВ (100 %), линдан (100 %), гептахлорэпоксид (частичное количество), α-эндосульфан (частичное количество);
- элюат 2: гептахлорэпоксид (оставшееся количество), α-эндосульфан (оставшееся количество), эндосульфансульфат (от 95 % до 100 %), дилдрин (100 %).
7.5.4.3 Фракционирование аналитического раствора
2,5 см3 (VR5) полученного по 7.5.3.4 раствора переносят с помощью пипетки в круглую колбу с длинным горлышком и смешивают с 5 см3 изооктана. Смесь осторожно концентрируют в ротационном испарителе (при медленном вращении и малой глубине погружения колбы) до 1 см3 (ни в коем случае не до сухого состояния). Если раствор еще сохраняет запах этилацетата, его следует снова смешать с изооктаном и концентрировать.
Полученный путем концентрации раствор с помощью пипетки переносят в предварительно промытую по 7.5.4.1 колонку с силикагелем, пипетку промывают 1 см3 n-гексана, который также помещают в колонку. Колбу промывают 2 см3 элюентом 1 (см. 7.2.11), который помещают в колонку как только n-гексан протечет до верхней поверхности заполнения колонки. С этого момента элюат собирают в градуированную пробирку. Затем повторно элюируют элюентом 1 по 7.2.11 в количестве 6 см3 и в колбу для выпаривания собирают 10 см3 (VEnd) элюата.
Круглодонную колбу, в которой проводилось концентрирование элюата, промывают 2 см3 толуола (элюент 2), и раствор подают в колонку. Элюат собирают во вторую градуированную пробирку, и колонку затем элюируют 6 см3 толуола. Приемник заполняют 10 см3 толуола (VEnd) (элюат 2).
Хроматографию выполняют последовательно аналогичным способом элюентом 3 (см. 7.2.13), элюентом 4 (см. 7.2.14) и элюентом 5 (см. 7.2.15). Колбу промывают каждый раз 2 см3 толуола, колонку элюируют оставшимися 6 см3, и элюат дополняют до 10 см3 (VEnd), при этом получают элюаты 3, 4 и 5. Пример распределения пестицидов по отдельным элюатам приведен в таблице 4.
Аликвотную долю элюатов Vi, полученных по 7.5.4.3, инжектируют в газовый хроматограф, соответствующий требованиям ГОСТ 32689.3. При испытаниях с азотно-фосфорным детектором и с пламенно-фотометрическим детектором аликвотную долю Vi полученного раствора VR4 во многих случаях можно инжектировать в газовый хроматограф.
7.6 Расчет результатов
Массовую долю остатка идентифицированного пестицида R, мг/кг (млн-1), рассчитывают по формуле
|
|
(3) |
где FA - площадь пика, соответствующая Vi,
WST - количество пестицида, инжектированное в составе градуировочного раствора, нг;
FST - площадь пика, соответствующая WST.
Vi - частичный объем VEnd или VR4, использованный для газовой хроматографии (объем пробоотборника), мм3;
т - масса лабораторной пробы, г;
f - фактор рассчитывают по формуле
|
|
(4) |
где VEnd - конечный объем элюата, полученный по 7.5.4.3, см3;
VEx - количество воды и ацетона, добавленных в процессе экстракции по 7.4.1 и 7.4.2 с учетом воды, содержащейся в лабораторной пробе, и вычетом объема контрактации 5 см3 по 7.5.1 или 15 см3 по 7.5.2, см3;
VR2 - объем раствора, полученного по 7.5.3.4 для гелевой хроматографии, см3;
VR4 - объем раствора, полученный после гелевой хроматографии по 7.5.3.4, см3;
VR1 - частичный объем VEx (см. выше), добавленный по 7.5, см3;
VR3 - объем VR2 (см. выше и 7.5.3.4), использованный для гелевой хроматографии (объем пробоотборника/петли пробоотборника), см3;
VR5 - частичный объем VR4 (см. выше и 7.5.3.4), использованный для гелевой хроматографии, см3.
В таблице 5 представлены комбинации матриц и пестицидов, которые испытывали в ходе межлабораторных испытаний.
Таблица 5 -Активные вещества пестицидов и матрицы проб
|
Активное вещество |
Морковь |
Картофель |
Савойская капуста |
Шпинат |
Помидоры |
Огурцы |
Цитрусовые фрукты |
Злаки |
Орехи, авокадо |
Желтый горох |
|
Ацефат |
- |
- |
- |
+ |
- |
- |
- |
- |
|
- |
|
Адонифен |
- |
- |
- |
- |
+ |
- |
+ |
+ |
- |
- |
|
Азоксистробин |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Боскалид |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
|
Бромофос |
+ |
+ |
- |
- |
+ |
- |
- |
- |
- |
- |
|
Бромпропилат |
- |
- |
- |
+ |
+ |
- |
- |
- |
- |
- |
|
Каптан |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Хлорфенапир |
- |
- |
- |
- |
- |
+ |
+ |
+ |
- |
- |
|
Хлорфенпроп-метил |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
|
Хлороталонил |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
|
Хлорпрофам |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
|
Хлорпирифос |
- |
- |
- |
+ |
+ |
- |
- |
- |
- |
- |
|
Клодинафопропаргил |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Кломазон |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Клоквинтоцет-мексил |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Ципродинил |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
о, ρ'-ДЦЕ |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
ρ, р'-ДДЕ |
+ |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
|
о, ρ '-ДДТ |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
ρ, ρ '-ДДТ |
+ |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
|
Диазинон |
+ |
- |
+ |
- |
- |
- |
- |
- |
- |
+ |
|
Дихлофлуанид |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Диклоран |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Дикофол |
- |
- |
- |
+ |
+ |
- |
- |
- |
- |
- |
|
Дилдрин |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
|
Диэтофенкарб |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Дифеноконазол |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Дифлуфеникан |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Дифениламин |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
α-Эндосульфан |
- |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
|
β-Эндосульфан |
- |
- |
- |
+ |
+ |
- |
- |
- |
- |
- |
|
Эндосульфанульфат |
- |
- |
- |
+ |
+ |
- |
- |
- |
- |
- |
|
Эндрин |
- |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
|
Этион |
- |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
|
Этофумесат |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Фенамидон |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
|
Фенаримол |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
|
Феназаквин |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Фенитротион |
+ |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
|
Феноксикарб |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Фенпикпонил |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Фенпропатрин |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
|
Флудиоксонил |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
ρ, ρ'-ДДЕ |
+ |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
|
о, ρ'-ДДТ |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Флуорогликофентил |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Флуквинконазол |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Флуртамон |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
|
Флутриафол |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Фольпет |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
|
НСВ |
+ |
+ |
- |
+ |
+ |
- |
- |
- |
- |
+ |
|
α-ГХЦГ |
- |
- |
- |
|
+ |
- |
- |
- |
- |
- |
|
Линдан (γ-ГЦХГ) |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
- |
+ |
|
Гептахлорпоксид |
+ |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
|
Индоксакарб |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
|
Ипродион |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
|
Ипроваликарб |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
|
Крезоксим-метил |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Малатион |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
+ |
|
Мекарбам |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
|
Мефенпирдиэтил |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Метконазол |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Напропамид |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Нуаримол |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Паратион |
+ |
- |
+ |
+ |
+ |
- |
- |
- |
- |
- |
|
Перметрин |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
|
Фосалон |
+ |
- |
- |
+ |
- |
- |
- |
- |
- |
+ |
|
Пикоксистробин |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
|
Пиримифос-метил |
- |
+ |
- |
+ |
+ |
- |
- |
- |
- |
+ |
|
Процимидон |
- |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
|
Профам |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
|
Просульфокарб |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Пиридабен |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
|
Пирифенокс |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Пирипроксифен |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
|
Квинтоцен |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
+ |
|
Силтиофам |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
|
Спироксамин |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
|
Тебуфенпирад |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Тетрадифон |
- |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
|
Толклофос-метил |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
|
Трифлоксистробин |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
|
Тритиконазол |
- |
- |
- |
- |
+ |
- |
+ |
+ |
+ |
- |
|
Винклозолин |
+ |
+ |
- |
+ |
+ |
- |
- |
- |
- |
- |
|
Зоксамид |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
- |
Пестициды, которые могут быть определены методом N, приведены в таблице 4.
Примечание - Метод испытывали на урожаях следующих сельскохозяйственных культур и продуктах питания: яблоки, злаки, кочанный салат, чай и аналогичные продукты, ананасы, пряности, дыни, помидоры, авокадо, кормовая капуста, виноградное сусло (сок), вино, бананы, огурцы, орехи, виноград, пиво, хмель, паприка, белокочанная капуста, груши, смородина красная, персики, савойская капуста, цветная капуста, какао, продукты переработки слив, цитрусовые фрукты, бобы, морковь, зеленый кофе, сахарная свекла, горох, картофель, шпинат, лук репчатый, земляника, вишня, табак, арахис, кольраби.
8 Метод Р: экстракция с использованием этилацетата и, при необходимости, очистка посредством гелевой хроматографии
8.1 Краткое описание
Измельченную лабораторную пробу гомогенизируют с использованием сульфата натрия в этилацетате, экстракт подвергают фильтрации. Остаток после концентрации аликвотной доли фильтрата непосредственно без очистки инжектируют в газовый хроматограф с азотно-фосфорным детектором или, если необходимо, проводят очистку посредством гелевой хроматографии на смоле BioBeads® S-X3* (полистиролгель) с использованием смеси циклогексана и этилацетата в качестве элюента. Элюат пригоден для определения органофосфорных остатков пестицидов с помощью подходящей газохроматографической системы.
_________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
8.2 Реактивы и материалы
8.2.1 Все реактивы и материалы должны быть пригодны для определения остатков пестицидов и соответствовать ГОСТ 32689.1 (раздел 4).
8.2.2 Этилацетат, х. ч.
8.2.3 Натрия сульфат по ГОСТ 4171 поле отжига при температуре 500 °С и выдержанный при этой температуре не менее 4 ч, затем охлажденный и хранящийся в закрытой емкости.
8.2.4 Циклогексан, х. ч.
8.2.5 Элюент для гелевой хроматографии: циклогексан/этилацетат в объемном соотношении 1:1.
8.2.6 Смола BioBeads® S-X3* с размером частиц от 38 до 75 мкм (200 - 400 меш).
_________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
8.2.7 Допускается применение других реактивов и материалов по качеству не хуже вышеуказанных.
8.3 Оборудование
8.3.1 Обычные лабораторные приборы, соответствующие ГОСТ 32689.1, а также нижеследующие.
8.3.2 Смеситель высокоскоростной (не менее 500 об/мин) или стержень для гомогенизации с подходящей емкостью для смешивания.
8.3.3 Испаритель ротационный с водяной баней.
8.3.4 Прибор для гелевой хроматографии, например Autoprep® 1001 или Autoprep® 1002* с колонкой с внутренним диаметром 25 мм, длиной 50 см и с двадцатью тремя пробоотборниками вместимостью 5 см3; заполнение колонки 50 г смолы BioBeads® S-X3*, в течение ночи проводят уравновешивание в элюционной смеси, высота заполнения приблизительно 32 см; изготовление колонки - по 7.5.3.2.
_________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
8.3.5 Цилиндры мерные 2-го класса точности вместимостью 25, 50, 250 см3 любого исполнения по ГОСТ 1770.
8.3.6 Допускается применение другого оборудования с метрологическими и техническими характеристиками не хуже вышеуказанных.
8.4 Подготовка пробы
Пробу измельчают на мелкие кусочки и тщательно перемешивают для достижения гомогенной лабораторной пробы.
50 г подготовленной лабораторной пробы переносят в емкость для смешивания (см. 8.3.2). К нему добавляют 50 г сульфата натрия (см. 8.2.3) для связывания содержащейся в лабораторной пробе воды и 100 см3 этилацетата. Смесь перемешивают в течение 3 мин. Жидкость фильтруют при пониженном давлении через воронку Бюхнера с внутренним диаметром 90 мм, затем емкость для смешивания и осадок на фильтре тщательно промывают дважды 25 см3 этилацетата. Измеряют объем фильтрата. Четверть раствора (соответствует 12,5 г лабораторной пробы) переносят в круглую колбу и концентрируют в ротационном испарителе (см. 8.3.3) приблизительно до 2,5 см3. Раствор переносят в измерительный цилиндр и добавляют в него этилацетат до объема точно 5 см3. Данный концентрат можно непосредственно впрыскивать в газовый хроматограф с пламенно-фотометрическим детектором или с азотно-фосфорным детектором. При появлении помех рекомендуется проведение очистки посредством гелевой хроматографии.
8.6 Очистка посредством гелевой хроматографии (при необходимости)
8.6.1 Набивка колонки с фильтрующим гелем
50 г смолы BioBeads® S-X3* (см. 8.2.6) оставляют на ночь для уравновешивания в элюате (см. 8.2.5), далее набивку колонки осуществляют по 7.5.3.2.
__________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
8.6.2 Контроль элюционного объема
Перед первым использованием контролируют диапазоны элюирования для каждой колонки с гелем на нескольких пестицидах с использованием подходящих сырых экстрактов. Для этого в пробоотборник инжектируют сырые экстракты или смесь образцов сравнения (по ГОСТ 32689.1) и проводят элюирование согласно 8.6.3. С помощью подходящего аналитического метода проводят оценку, найдены ли полностью использованные пестициды и/или не привели ли отделенные загрязнения к помехам. Аналогичный контроль предпринимают применительно к колонкам, которые долгое время не эксплуатировались.
8.6.3 Очистка сырых экстрактов
5 см3 экстракта по 8.5 смешивают с 5 см3 циклогексана. Смесь встряхивают в течение 20 с, фильтруют через фильтровальную бумагу для быстрого фильтрования и впрыскивают фильтрат в петлю для лабораторной пробы хроматографа с гелевой фильтрацией. Гелевую колонку элюируют элюентом для гелевой хроматографии со скоростью протекания 5,0 см3/мин. Аппаратные переключатели хроматографа с гелевой фильтрацией настраивают как при контроле объема элюирования. Общепринятыми являются настройки по 7.5.3.4.
Собранный объем концентрируют в ротационном испарителе до 1 см3 (при медленном вращении и малой глубине погружения колбы) и переносят с помощью пипетки в градуированную пробирку с притертой пробкой. Круглую колбу испарителя промывают этилацетатом и концентрированный элюат дополняют до объема 5,0 см3. Этилацетат добавляют обязательно, чтобы остатки пестицидов полностью перешли в раствор.
8.7 Межпабораторные испытания
Все комбинации указанных матриц и пестицидов испытывались в ходе межлабораторных испытаний. Матрицы: яблоки, лук-порей, белокочанная капуста. Пестициды: бромофосэтил, хлорфенвинфос, диазинон, мевинфос, паратион.
8.8 Область применения
Посредством метода Р в овощах и фруктах определяют следующие пестициды: ацефат, азинофосэтил, азинофосметил, бромофос, бромофосэтил, карбофенотион, хлорфенвинфос, хлорпирифос, хлорпирифосметил, хлортиофос, кумафос, цианофенфос, деметон-S-метил, деметон-S-метилсульфон, диалифос, диазинон, дихлофентион, дихлорвос, диметоат, диоксатион, дисульфотон, диталимфос, этион, этопрофос, этримфос, фенамифос, фенхлорфос, фенитротион, фенсульфотион, фентион, фонофос, формотион, гептенофос, изофенфос, малатион, меназон, метамидофос, метидатион, мевинфос, моноскрогофос, налед, ометоат, оксидеметонметил, паратион, паратионметилфорат, фозалон, фосфамидон, фосмет, фоксим, пиримифосэтил, пиримифосметил, протоат, пиразофос, сульфотеп, темефос, ТЕРР, тетрахлорвинфос, тиометон, толклофосметил, триамифос, триазофос, трихлорфон, трихлоронат, вамидотион.
Приложение А
(справочное)
Среднее содержание воды в сельскохозяйственных культурах и пищевых продуктах
А.1 Среднее содержание воды в сельскохозяйственных культурах и пищевых продуктах приведено в таблице А.1.
|
Сельскохозяйственные культуры и продукты питания |
Массовая доля воды (среднее содержание), г/100 г |
|
Порошок какао |
5 |
|
Злаки, коренья (зелень), необжаренный кофе, чай, аналогичные чаю продукты |
10 |
|
Бананы, хрен |
75 |
|
Горох, черная смородина, картофель, петрушка, виноград |
80 |
|
Яблоки, ананасы, груши, красная смородина, вишни, апельсины, сливы, шнитт-лук |
85 |
|
Цветная капуста, зеленозерная фасоль, брокколи, земляника, грейпфрут, грюнколь, кольраби, дыни, виноградное сусло, паприка, персики, грибы, свекла красная, краснокочанная капуста, шпинат, белокочанная капуста, лимоны, сахарная свекла (съедобный корень), репчатый лук |
90 |
|
Цикорий, салатный цикорий, огурцы, сельдерей душистый, кочанный салат, редька, ревень, спаржа, помидоры |
95 |
Ключевые слова: пищевая продукция растительного происхождения, мультиметоды, газовая хроматография, масс-спектрометрия, пестициды