|
МЕЖГОСУДАРСТВЕННЫЙ
СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ |
|
|
МЕЖГОСУДАРСТВЕННЫЙ |
ГОСТ |
МИКРОБИОЛОГИЯ ПИЩЕВЫХ
ПРОДУКТОВ
И КОРМОВ ДЛЯ ЖИВОТНЫХ
Методы обнаружения и подсчета бактерий
Campylobacter spp.
Часть 1
(ISO 10272-1:2006, IDT)
|
|
Москва |
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены»
1 ПОДГОТОВЛЕН ОАО «Всероссийский научно-исследовательский институт сертификации» (ОАО «ВНИИС»)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 7 июня 2013 г. № 43)
За принятие проголосовали:
|
Краткое наименование страны |
Код страны |
Сокращенное наименование национального органа |
|
Казахстан |
KZ |
Госстандарт Республики Казахстан |
|
Киргизия |
KG |
Кыргызстандарт |
|
Россия |
RU |
Росстандарт |
|
Таджикистан |
TJ |
Таджикстандарт |
|
Узбекистан |
UZ |
Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 27 июня 2013 г. № 227-ст межгосударственный стандарт ГОСТ ISO 10272-1-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2014 г.
5 Настоящий стандарт идентичен международному стандарту ISO 10272-1:2006 Microbiology of food and animal feeding stuffs - Horizontal method for detection and enumeration of Campylobacter spp. - Part 1: Detection method (Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод обнаружения и подсчета бактерий Campylobacter spp. Часть 1. Метод обнаружения).
Международный стандарт разработан подкомитетом SC 9 «Микробиология» Технического комитета по стандартизации ISO/TC 34 «Пищевые продукты» Международной организации по стандартизации (ISO).
Перевод с английского языка (en).
Официальные экземпляры международного стандарта, на основе которого подготовлен настоящий стандарт, и международных стандартов, на которых даны ссылки, имеются в национальных (государственных) органах по стандартизации указанных выше государств.
Степень соответствия - идентичная (IDT).
Стандарт подготовлен на основе применения ГОСТ Р ИСО 10272-1-2010
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок - в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
ГОСТ ISO 10272-1-2013
МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ
Методы обнаружения и подсчета бактерий Campylobacter spp.
Часть 1
Метод обнаружения
Microbiology of food and animal feeding stuffs. Methods for detection and enumeration of Campylobacter spp.
Part 1. Detection method
Дата введения - 2014-07-01
1 Область применения
Настоящий стандарт устанавливает метод обнаружения Campylobacter spp. и распространяется на продукцию, предназначенную для потребления человеком или кормления животных. Настоящий стандарт может быть использован при оценке окружающей среды при производстве пищевой продукции и обращении с ней.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ISO 6887 (все части) Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination (Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятикратных разведений для микробиологических исследований)
ISO 7218 Microbiology of food and animal feeding stuffs - General requirements and guidance for microbiological examinations (Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации для микробиологических исследований)
ISO 8261 Milk and milk products. General guidance for the preparation of tests samples, initial suspensions and decimal dilutions for microbiological examination (Молоко и молочные продукты. Общие правила приготовления испытуемых проб для анализа, исходных суспензий и десятикратных разведений для микробиологических исследований)
ISO/TS 11133-1 Microbiology of food and animal feeding stuffs - Guidelines on preparation and production of culture media - Part 1: General guidelines on quality assurance for the preparation of culture media in the laboratory (Микробиология пищевых продуктов и кормов для животных. Правила приготовления и производства питательных сред. Часть 1. Общие правила по обеспечению качества приготовления питательных сред в лаборатории)
ISO/TS 11133-2 Microbiology of food and animal feeding stuffs - Guidelines on preparation and production of culture media - Part 2: Practical guidelines on performance testing of culture media (Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству питательных сред. Часть 2: Практические руководящие указания по определению эффективности питательных сред)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 Campylobacter (Campylobacter): Микроорганизмы, образующие характерные колонии на твердой селективной среде, при инкубировании в аэробных условиях при температуре 41,5 °С, но не при температуре 25 °С, и которые обладают характерной подвижностью, биохимическими свойствами и способностью к росту, при условии проведения испытаний в соответствии с настоящим стандартом.
Примечание - Наиболее часто встречающимися видами являются Campylobacter jejuni и Campylobacter coli. Вместе с тем были описаны и другие виды (Campylobacter lari, Campylobacter upsaliensis и некоторые другие).
3.2 обнаружение Campylobacter (detection of Campylobacter): Определение присутствия или отсутствия рассматриваемых микроорганизмов в определенном количестве продукта при условии проведения испытания в соответствии с настоящим стандартом.
4 Сущность метода
Для обнаружения Campylobacter выполняют этапы работ в соответствии с приложением А.
4.2 Обогащение в селективной жидкой среде
Пробу вносят в жидкую обогатительную среду (бульон Болтона) и гомогенизируют.
Инкубируют в аэробных условиях при температуре 37 °С в течение 4 - 6 ч и затем при температуре 41,5 °С в течение (44 ± 4) ч.
4.3 Изоляция и отбор для подтверждения
Культуры, полученные по 4.2, пересевают на две твердые селективные среды (приложение А):
- модифицированный агар с углем, цефоперазоном и дезоксихолатом (агар mCCD);
- любую другую твердую селективную среду, основанную на принципе, отличном от принципа агара mCCD.
Далее их инкубируют при температуре 41,5 °С в аэробных условиях и проверяют после (44 ± 4) ч с целью обнаружения присутствия колоний, которые по своим характеристикам предположительно являются Campylobacter.
Колонии, предположительно являющиеся Campylobacter, пересевают на неселективный колумбийский кровяной агар и затем подтверждают при исследовании под микроскопом и надлежащих биохимических испытаниях , а также испытаниях на рост.
Вид Campylobacter идентифицируют путем специфических биохимических испытаний и испытаний на чувствительность к антибиотикам.
5 Питательные среды и реактивы
Качество подготовки, изготовления и оценки эффективности питательных сред для выращивания Campylobacter по ISO 7218, ISO/TS 11133-1 и ISO/TS 11133-2.
Примечание - Ввиду наличия большого количества питательных сред и реактивов их составы и процедуры приготовления дополнительно приведены в приложении В.
5.2 Жидкая обогатительная среда: бульон Болтона
См. B.1.
5.3 Селективная среда для чашек Петри: модифицированный агар с углем, цефоперазоном и дезоксихолатом (агар mCCD)
См. B.2.
5.4 Среды и реактивы для подтверждения и идентификации
5.4.1 Колумбийский кровяной агар
См. B.3.
См. B.4.
5.4.3 Реактив для обнаружения оксидазы
См. B.5.
5.4.4 Раствор пероксида водорода, 3 % (по объему).
5.4.5 Реактивы для определения гидролиза гиппурата натрия
См. B.6.
5.4.6 Кровяной агар Мюллера-Хинтона
См. B.7.
5.4.7 Диски с налидиксовой кислотой (30 мкг) и цефалотином (30 мкг).
5.4.8 Диски с индоксил ацетатом
См. B.8.
6 Оборудование и стеклянная химическая посуда
Используют микробиологическое лабораторное оборудование по ISO 7218.
6.1 Оборудование для сухой стерилизации (сушильный шкаф) или влажной стерилизации (автоклав) по ISO 7218.
6.2 Сушильный шкаф, ламинарный бокс или термостат, способные функционировать в диапазоне температур от 37 °С до 55 °С.
6.3 Термостат, работающий при температуре (41,5 ± 1) °С.
6.4 Водяные бани, работающие в диапазоне температур (25 ± 1) °С и (37 ± 1) °С, или термостаты, работающие в диапазоне температур (25 ± 1) °С и (37 ± 1) °С.
6.5 Водяная баня, работающая в диапазоне температур 47 °С - 50 °С.
6.6 pH-метр, с точностью 0,1 при 25 °С.
6.7 Пробирки с размерами 18´180 мм и 9´180 мм, пробирки для гемолиза с размерами 13´75 мм, бутылки с нетоксичными металлическими крышками и/или колбы подходящей вместимости с соответствующими крышками.
6.8 Чашки Петри, стеклянные или пластиковые, диаметром 90 - 100 мм.
6.9 Градуированные пипетки с полным сливом, с широким отверстием, номинальной вместимостью 1 и 10 см3, градуированные с делениями 0,1 см3, и пастеровские пипетки.
6.10 Резиновые груши или любая другая система безопасности, которую можно адаптировать к градуированным пипеткам.
6.11 Стерильные петли из проволоки платиново-иридиевой, никелево-хромовой диаметром приблизительно 3 мм или стеклянная или пластиковая палочка.
Никелево-хромовая петля не пригодна для использования в испытании на оксидазу (см. 9.4.6).
6.12 Пинцет, тонкий, с закругленными краями, из нержавеющей стали.
6.13 Микроскоп, предпочтительно с фазовым контрастом (для наблюдения характерной подвижности Campylobacter).
6.14 Надлежащее оборудование для достижения аэробных условий с содержанием кислорода (5 ± 2) %, диоксида углерода (10 ± 3) %, альтернативного водорода ≤ 10 %, с соблюдением баланса азота. Используют подходящие герметичные контейнеры, чтобы удерживать чашки Петри и/или колбы или бутылки вместимостью 350 см3, используемые для обогатительного бульона.
Примечания
1 Необходимые аэробные условия достигаются при использовании имеющихся в продаже газогенераторных комплектов; следует в точности соблюдать производственные инструкции, особенно те из них, которые касаются объема сосуда и вместимости газогенераторного комплекта. В качестве альтернативы используют заполнение сосуда надлежащей газовой смесью перед инкубацией.
2 В качестве альтернативы аэробной инкубации обогатительный бульон можно инкубировать в бутылках с винтовыми крышками или колбах, заполнив их обогатительным бульоном, оставляя свободное пространство менее 2 см и тщательно закупоривая крышками.
7 Отбор проб
В лабораторию направляют представительную пробу. Проба не должна быть повреждена или изменена в процессе транспортирования или хранения.
Отбор проб не является частью метода, установленного в настоящем стандарте. Отбор проб проводят в соответствии с конкретным стандартом на данную продукцию, в случае его отсутствия рекомендуется достижение соглашения заинтересованных сторон по отбору проб конкретного продукта.
Принимая во внимание, что Campylobacter spp. весьма чувствительны к замораживанию, испытуемые пробы не замораживают и хранят при температуре (3 ± 2) °С. Их анализируют в кратчайшие сроки. Также принимают меры по предотвращению высыхания проб.
8 Приготовление испытуемой пробы
Испытуемую пробу приготавливают в соответствии с конкретным стандартом на определенный вид продукции. Если не существует конкретного стандарта, рекомендуется, чтобы заинтересованные стороны достигли соглашения по данному вопросу.
9 Методы проведения испытаний (см. приложение А)
9.1 Пробы, исходная суспензия и разведения
Для приготовления исходной суспензии испытуемую пробу (масса или объем) вводят в девятикратный объем обогатительной среды - бульон Болтона (5.2), с тем чтобы получить соотношение проба/обогатительная среда 1:10 (масса/объем или объем/объем). Гомогенизируют.
Исходную суспензию (9.1) инкубируют в аэробных условиях (6.14) при температуре 37 °С в течение 4 - 6 ч, затем при температуре 41,5 °С в течение (44 ± 4) ч.
9.3.1 Культуру, полученную в обогатительной среде (9.2), пересевают петлей (6.11) на поверхность первой селективной изолирующей среды, агара mCCD (5.3).
Аналогичным образом поступают со второй выбранной селективной изолирующей средой для Campylobacter.
Примечание - Предпочтительно выбрать вторую изолирующую среду, основанную на принципах, отличных от агара mCCD. Примерами изолирующих сред, которые можно использовать, являются агар Skirrow, агар Karmali и агар Preston (см. библиографию).
9.3.2 Посевы (9.3.1) инкубируют при температуре 41,5 °С в аэробных условиях (6.14).
9.3.3 После инкубации в течение (44 ± 4) ч посевы исследуют с целью выявления типичных и/или подозрительных колоний Campylobacter.
Типичные колонии на агаре mCCD имеют сероватый цвет, часто с металлическим блеском, они плоские и влажные и имеют тенденцию к разрастанию. Разрастание колоний менее выражено на более сухих поверхностях агара. Возможно образование других форм колоний.
9.4 Подтверждение вида Campylobacter
Поскольку рассматриваемые бактерии быстро разрушаются на воздухе, необходимо незамедлительно следовать процедурам, описанным в 9.4.2 - 9.4.6.
9.4.2 Отбор колоний для подтверждения
9.4.2.1 Для подтверждения с каждого слоя каждой селективной среды (9.3.1) отбирают по меньшей мере одну колонию, рассматриваемую в качестве типичной или подозрительной колонии Campylobacter, и еще четыре колонии, если первая дала отрицательный результат.
9.4.2.2 Проводят посев каждой из отобранных колоний на слой колумбийского кровяного агара (5.4.1), чтобы дать развиться четко изолированным колониям. Посевы инкубируют в аэробных условиях при температуре 41,5 °С в течение 24 - 48 ч. При исследовании морфологии, подвижности, аэробного роста при температуре 25 °С, аэробного роста при температуре 41,5 °С и присутствия оксидазы следует использовать чистые культуры.
9.4.3 Исследование морфологии и подвижности
9.4.3.1 Одну колонию со слоя колумбийского кровяного агара (9.4.2.2) суспендируют в 1 см3 бульона Бруцелла (5.4.2) и исследуют морфологию и подвижность при помощи микроскопа (6.13).
9.4.3.2 Для дальнейшего исследования сохраняют все культуры (9.4.2.2), в которых обнаружены изогнутые палочки со спиральной «штопорообразной» подвижностью (9.4.3.1).
9.4.4 Исследование аэробного роста при температуре 25 °С
Используя колонии, изолированные по 9.4.2.2, делают посев петлей (6.11) на поверхность слоя колумбийского кровяного агара (5.4.1).
Посев инкубируют при температуре 25 °С в аэробных условиях (6.14) в течение (44 ± 4) ч.
Исследуют посев с целью выявления видимого роста колоний Campylobacter.
9.4.5 Исследование аэробного роста при температуре 41,5 °С
Используя колонии, изолированные по 9.4.2.2, делают посев петлей (6.11) на поверхность слоя колумбийского кровяного агара (5.4.1).
Посев инкубируют при температуре 41,5 °С в аэробных условиях (6.14) в течение (44 ± 4) ч.
Исследуют посев с целью выявления видимого роста колоний Campylobacter.
Используя платиново-иридиевую петлю или стеклянную палочку (6.11), отбирают часть изолированной колонии из каждой отдельной чашки (9.4.2.2) и наносят на фильтровальную бумагу, смоченную реактивом для обнаружения оксидазы (5.4.3). Появление лилового, сиреневого или темно-синего цвета в течение 10 с свидетельствует о положительной реакции. Если используется имеющийся в продаже набор для анализа оксидазы, необходимо следовать инструкциям изготовителя.
Результаты подтверждают, используя положительный и отрицательный контроль. Примерами подходящих контрольных штаммов являются Pseudomonas aeruginosa NCTC* 10662 (положительный контроль) и Escherichia coli NCTC* 9001 (отрицательный контроль).
__________
* Национальная коллекция типовых культур (National collection of type cultures, NCTC).
9.4.7 Интерпретацию Campylobacter spp. проводят по результатам таблицы 1.
Таблица 1 - Характеристики Campylobacter spp.
|
Наименование показателя |
Характеристика |
|
Морфология (9.4.3) |
Малые искривленные бациллы |
|
Подвижность (9.4.3) |
Характерная |
|
Аэробный рост при температуре 25 °С (9.4.4) |
- |
|
Аэробный рост при температуре 41,5 °С (9.4.5) |
- |
|
Оксидаза (9.4.6) |
+ |
Campylobacter spp. присутствует, если по меньшей мере одна колония демонстрирует вышеуказанные характеристики.
9.5 Идентификация вида Campylobacter (альтернативная процедура)
Из Campylobacter spp., произрастающих при температуре 41,5 °С, чаще всего встречаются Campylobacter jejuni и Campylobacter coli. Вместе с тем, были описаны другие виды (Campylobacter lari, Campylobacter upsaliensis и некоторые другие); характеристики, приведенные в таблице 2, позволяют провести их дифференциацию.
Для каждой колонии, отобранной в соответствии с 9.4.2.2, помещают петлю культуры в каплю раствора пероксида водорода (5.4.4) на чистом предметном стекле.
Испытание считается положительным, если в течение 30 с появляются пузырьки.
Результаты подтверждают, используя положительный и отрицательный контроль. Примерами подходящих контрольных штаммов являются Staphylococcus aureus NCTC* 8532 (положительный контроль), Enterococcus faecalis NCTC* 775 (отрицательный контроль).
9.5.3 Определение чувствительности к налидиксовой кислоте и цефалотину
Для каждой колонии, отобранной в соответствии с 9.4.2.2, используют петлю (6.11) с целью приготовления суспензии в бульоне Бруцелла (5.4.2), плотностью 0,5 по шкале МакФарланда.
Суспензию разбавляют в соотношении 1:10 тем же бульоном.
Заливают суспензией поверхность слоя с 5 %-ным кровяным агаром Мюллера-Хинтона (5.4.6).
Выдерживают в течение 5 мин, сливают избыток суспензии. Чашки высушивают в сушильном шкафу (6.2) при температуре 37 °С в течение 10 мин.
Помещают на поверхность агара диск с налидиксовой кислотой и диск с цефалотином (5.4.7).
Чашки инкубируют крышками вниз при температуре 37 °С в течение (22 ± 2) ч в аэробных условиях (6.14).
Результаты бактериального роста интерпретируют следующим образом:
- рост, который наблюдается при контакте с диском, классифицируется как устойчивый;
- при наличии зоны любых размеров, обусловленной ингибированием роста, он классифицируется как чувствительный.
9.5.4 Определение гидролиза гиппурата
Для каждой колонии, отобранной в соответствии с 9.4.2.2, используют петлю (6.11) с большим количеством посева с целью приготовления суспензии в пробирке для гемолиза (6.7), содержащей 0,4 см3 раствора гиппурата натрия (5.4.5), при этом обращают особое внимание, чтобы исключить попадание агара.
Встряхивают с целью тщательного перемешивания и инкубируют в течение 2 ч на водяной бане (6.4) при температуре 37 °С или в течение 4 ч в термостате при температуре 37 °С.
Осторожно добавляют 0,2 см3 раствора нингидрина (5.4.5) на поверхность раствора гиппурата натрия. Избегают встряхивания.
Интерпретацию проводят после дополнительного инкубирования в течение 10 мин на водяной бане (6.4) при температуре 37 °С или в термостате при температуре 37 °С.
Темно-фиолетовый цвет свидетельствует о положительной реакции.
Светло-фиолетовый цвет или отсутствие окраски свидетельствуют об отрицательной реакции.
Результаты подтверждают, используя положительный и отрицательный контроль. Примерами подходящих контрольных штаммов являются Campylobacter jejuni NCTC* 11351 (положительный контроль), Campylobacter coli NCTC* 11366 (отрицательный контроль).
9.5.5 Определение гидролиза индоксилацетата
Помещают колонию, отобранную в соответствии с 9.4.2.2, на диск с индоксилацетатом (5.4.8) и добавляют каплю стерилизованной дистиллированной воды. Для проведения отчетливой реакции требуется полная петля материала колоний.
В случае гидролиза индоксилацетата в течение 5 - 10 мин наблюдается изменение цвета в сторону темно-синего. Отсутствие изменения цвета свидетельствует о том, что гидролиз отсутствовал.
Результаты подтверждают, используя положительный и отрицательный контроль. Примерами подходящих контрольных штаммов являются Campylobacter jejuni NCTC* 11351 (положительный контроль), Campylobacter lari NCTC* 11352 (отрицательный контроль).
__________
* Национальная коллекция типовых культур (National collection of type cultures, NCTC).
Виды Campylobacter, показывающие рост при температуре 41,5 °С, могут быть идентифицированы в соответствии с таблицей 2.
Таблица 2 - Характеристики видов Campylobacter
|
Характеристика |
С. jejuni |
С. coli |
C. lari |
C. upsaliensis |
|
Каталаза (9.5.2) |
+ |
+ |
+ |
- |
|
Налидиксовая кислота (9.5.3) |
Sa |
Sa |
R/Sb |
s |
|
Цефалотин (9.5.3) |
R |
R |
R |
R |
|
Гидролиз гиппурата (9.5.4) |
+ |
- |
- |
- |
|
Гидролиз индоксилацетата(9.5.5) |
+ |
+ |
- |
+ |
|
«+» - положительная реакция; «-» - отрицательная реакция; S - чувствительный рост; R - устойчивый рост. a Было подтверждено увеличение устойчивости к налидиксовой кислоте штаммов С. jejuni и С. coli. b Были отмечены одновременно чувствительные и устойчивые штаммы С. lari. |
||||
10 Обработка результатов
В соответствии с интерпретацией результатов указывают наличие или отсутствие Campylobacter в порции пробы х г или x см3 продукта по ISO 7218.
Приложение А
(обязательное)
Диаграмма методики работы
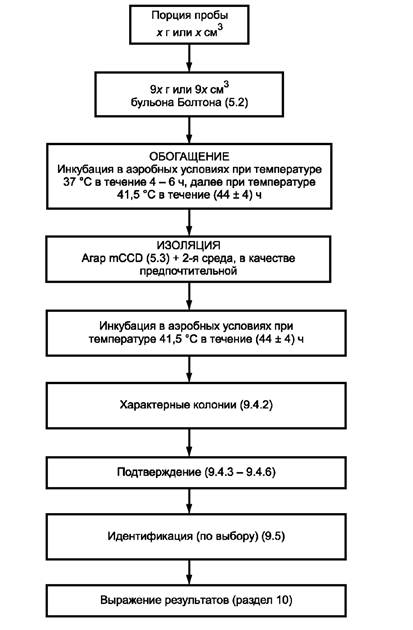
Рисунок А.1
Приложение В
(обязательное)
Состав и приготовление питательных сред и реактивов
продукт ферментативного переваривания животных тканей - 10,0 г;
гидролизат лактальбумина - 5,0 г;
дрожжевой экстракт - 5,0 г;
натрия хлорид - 5,0 г;
натрия пируват - 0,5 г;
натрия пиросульфит - 0,5 г;
натрия карбонат - 0,6 г;
α-кетоглутаровая кислота - 1,0 г;
гемин (раствор в 0,1 %-ном растворе натрия гидроксида) - 0,01 г;
вода - 1000 см3.
B.1.1.2 Приготовление
Базовые компоненты по B.1.1.1 или готовую сухую среду растворяют в 1000 см3 воды при слабом нагреве.
Корректируют pH так, чтобы после стерилизации его значение для готовой среды составляло (7,4 ± 0,2) ед. pH при температуре 25 °С.
Среду разливают в колбы вместимостью 100 - 200 см3. Стерилизуют в автоклаве (6.1) при температуре 121 °С в течение 15 мин.
B.1.2 Стерильная лизированная дефибринированная кровь лошади
Используют кровь лошади, лизированную сапонином или замораживанием и последующим размораживанием.
B.1.3.1 Состав:
цефоперазон - 0,02 г;
ванкомицин - 0,02 г;
триметоприма лактат - 0,02 г;
амфотерицин В - 0,01 г;
этанол/стерильная дистиллированная вода 50/50 (по объему) - 5,0 см.
В. 1.3.2 Приготовление
Компоненты растворяют в смеси этанола и стерильной дистиллированной воды в соотношении 50:50.
B.1.4 Полная среда
B.1.4.1 Состав:
базовая среда (B.1.1) - 1000 см3;
стерильная лизированная дефибринированная кровь лошади (B.1.2) - 50 см3;
раствор антибиотиков (B.1.3) - 5 см3.
B.1.4.2 Приготовление
К базовой среде при температуре от 47 °С до 50 °С в стерильных условиях добавляют кровь, затем раствор антибиотиков и перемешивают. Соблюдая стерильность, среду разливают в пробирки или колбы, чтобы приготовить объем сред, необходимый для испытания. Если обогатительную среду приготавливают заранее, ее надо хранить не более 4 ч при комнатной температуре или в темном месте при температуре (3 ± 2) °С не более семи дней.
B.1.5 Эксплуатационное испытание
Эксплуатационные характеристики бульона Болтона необходимо испытывать в соответствии с методами и критериями, описанными в ИСО 11133-2. Примерами подходящих контрольных штаммов являются Campylobacter jejuni NCTC 11351 или АТСС* 33291 со следующими критериями: > 10 колоний на модифицированном агаре с углем, цефоперазоном и дезоксихолатом (mCCD) после инкубации в аэробных условиях при температуре 41,5 °С в течение (44 ± 4) ч.
_________
* Американская коллекция типовых культур (American Type Culture Collection, АТСС).
B.2 Модифицированный агар с углем, цефоперазоном и дезоксихолатом (агар mCCD)
B.2.1.1 Состав: мясной экстракт- 10,0 г;
продукт ферментативного переваривания животных тканей - 10,0 г;
натрия хлорид - 5,0 г;
древесный уголь - 4,0 г;
продукт ферментативного переваривания казеина - 3,0 г;
дезоксихолат натрия - 1,0 г;
железа сульфат (II) - 0,25 г;
натрия пируват - 0,25 г;
агар - 8,0 - 18,0 г*;
_________
* В зависимости от прочности геля агара.
вода - 1000 см3.
B.2.1.2 Приготовление
Компоненты для базовой среды или сухую базовую среду растворяют в 1000 см3 воды и постепенно доводят до кипения. При необходимости корректируют pH таким образом, чтобы после стерилизации он составлял (7,4 ± 0,2) ед. pH при температуре 25 °С.
Базовую среду разливают в колбы вместимостью 100 - 200 см3. Стерилизуют в автоклаве (6.1) при температуре 121 °С в течение 15 мин.
B.2.2.1 Состав:
цефаперазон - 0,032 г;
амфотерицин В - 0,01 г;
вода - 5 см3.
B.2.2.2 Приготовление
Компоненты растворяют в воде. Стерилизуют фильтрацией.
B.2.3 Полная среда
B.2.3.1 Состав
базовая среда (B.2.1) - 1000 см3;
раствор антибиотиков (B.2.2) - 5 см3.
B.2.3.2 Приготовление
Раствор антибиотиков добавляют к базовой среде, охлажденной до температуры 47 °С - 50 °С, затем тщательно перемешивают. Разливают по 15 см3 полной среды по стерильным чашкам Петри. Дают затвердеть. Непосредственно перед применением тщательно высушивают слои агара, предпочтительно с открытыми крышками и поверхностью агара, направленной вниз в сушильном шкафу (6.2), в течение 30 мин или до того момента, когда поверхность агара не будет содержать видимой влаги. Если они были приготовлены заранее, невысушенные агаровые слои следует хранить не более 4 ч при температуре окружающей среды или в темноте при температуре (3 ± 2) °С не более семи дней.
B.2.4 Эксплуатационное испытание
Определение селективности или производительности - по ИСО 11133-1. Информация об эксплуатационных критериях - в ИСО 11133-2, таблица B.5.
B.3 Колумбийский кровяной агар
B.3.1.1 Состав:
продукт ферментативного переваривания животных тканей - 23,0 г;
крахмал - 1,0 г;
натрия хлорид - 5,0 г;
агар - 8,0 - 18,0 г*;
_________
* В зависимости от прочности геля агара.
вода - 1000 см3.
B.3.1.2 Приготовление
Базовые компоненты или полную сухую базовую среду растворяют в воде нагреванием. При необходимости корректируют pH таким образом, чтобы после стерилизации он составлял (7,3 ± 0,2) ед. pH при температуре 25 °С. Базовую среду распределяют в колбы подходящей вместимости. Стерилизуют в автоклаве (6.1), установленном на температуре 121 °С, в течение 15 мин.
B.3.2 Стерильная дефибринированная баранья кровь
B.3.3 Полная среда
B.3.3.1 Состав:
базовая среда (B.3.1) - 1000,0 см3;
раствор антибиотиков (B.2.2) - 5,0 см3.
B.3.3.2 Приготовление
Кровь в стерильных условиях добавляют к базовой среде, охлажденной до температуры 47 ° - 50 °С, затем перемешивают. Разливают около 15 см3 полной среды по стерильным чашкам Петри. Дают затвердеть. Непосредственно перед применением тщательно высушивают слои агара, предпочтительно с открытыми крышками и поверхностью агара, направленной вниз в сушильном шкафу (6.2), в течение 30 мин или до того момента, когда поверхность агара не будет содержать видимой влаги. Если они были приготовлены заранее, невысушенные агаровые слои следует хранить не более 4 ч при температуре окружающей среды или не более семи дней при температуре (3 ± 2) °С.
B.4.1 Состав:
продукт ферментативного переваривания казеина - 10,0 г;
продукт ферментативного переваривания животных тканей - 10,0 г;
глюкоза - 1,0 г;
дрожжевой экстракт - 2,0 г;
натрия хлорид 0 - 5,0 г;
натрия гидросульфит - 0,1 г;
вода - 1000 см3.
B.4.2 Приготовление
Компоненты для базовой среды или готовую сухую среду растворяют в воде, постепенно нагревая. При необходимости корректируют pH таким образом, чтобы после стерилизации он составлял (7,3 ± 0,2) ед. pH при температуре 25 °С. Базовую среду объемом 10 см3 распределяют в колбы подходящей емкости. Стерилизуют в автоклаве (6.1) при температуре 121 °С в течение 15 мин.
B.5 Реагент для обнаружения оксидазы
B.5.1 Состав:
N,N,N',N'-тетраметил-1,4-фенилендиамина дигидрохпорид - 1,0 г;
вода - 100,0 см3.
B.5.2 Приготовление
Компоненты растворяют в воде непосредственно перед использованием.
B.6 Реагенты для обнаружения гидролиза гиппурата
B.6.1 Раствор гиппурата натрия
B.6.1.1 Состав: натрия гиппурат- 10,0 г;
фосфатно-буферный солевой раствор (PBS):
натрия хлорид - 8,5 г;
динатрия гидрофосфат дигидрат (Na2HPO4∙2Н2O) - 8,98 г;
натрия дигидрофосфат моногидрат (NaH2PO4∙Н2O) - 2,71 г;
вода - 1000,0 см3.
B.6.1.2 Приготовление
Гиппурат натрия растворяют в растворе PBS. Стерилизуют путем фильтрации. Соблюдая стерильность, реагент объемом 0,4 см3 распределяют в малые колбы подходящей вместимостью (6.7). Хранят при температуре 20 °С.
B.6.2 Раствор нингидрина, 3,5 % (масса/объем)
B.6.2.1 Состав:
нингидрин - 1,75 г;
ацетон - 25 см3;
бутанол - 25 см3.
B.6.2.2 Приготовление
Нингидрин растворяют в смеси ацетон/бутанол. Раствор хранят в холодильнике в темноте не более одной недели.
B.7 Кровяной агар Мюллера-Хинтона
B.7.1.1 Состав:
продукт ферментативного переваривания животных тканей - 6,0 г;
продукт ферментативного переваривания казеина - 17,5 г;
крахмал растворимый - 1,5 г;
агар - 8,0 - 18,0 г*;
__________
* В зависимости от прочности геля агара.
вода - 1000 см3.
B.7.1.2 Приготовление
Компоненты для среды или готовую сухую базовую среду растворяют в 1000 см3 воды и постепенно доводят до кипения. При необходимости корректируют pH таким образом, чтобы после стерилизации он составлял (7,3 ± 0,2) ед. pH при температуре 25 °С. Базовую среду разливают в колбы вместимостью 100 - 200 см3. Стерилизуют в автоклаве (6.1) при температуре 121 °С в течение 15 мин.
B.7.2 Стерильная дефибринированная баранья кровь
B.7.3 Полная среда
B.7.3.1 Состав:
базовая среда (B.7.1) - 1000,0 см3;
стерильная дефибринированная баранья кровь (B.7.2) - 50,0 см3.
B.7.3.2 Приготовление
Кровь в стерильных условиях добавляют к базовой среде, охлажденной до температуры 47 °С - 50 °С, постоянно перемешивая. Разливают около 15 см3 полной среды по стерильным чашкам Петри. Дают затвердеть. Непосредственно перед применением тщательно высушивают слои агара, предпочтительно с открытыми крышками и поверхностью агара, направленной вниз в сушильном шкафу (6.2), в течение 30 мин или до того момента, когда поверхность агара не будет содержать видимой влаги. Если они были приготовлены заранее, невысушенные агаровые слои следует хранить не более 4 ч при температуре окружающей среды или не более семи дней при температуре (3 ± 2) °С.
B.8.1 Состав:
индоксилацетат - 0,1 г;
ацетон -1,0 см3.
B.8.2 Приготовление
Индоксилацетат растворяют в ацетоне. Наносят от 25 до 50 мкл данного раствора на чистые бумажные диски (диаметр от 0,6 до 1,2 см). После высушивания при комнатной температуре диски хранят при температуре 4 °С в темных пробирках или бутылках в присутствии силикагеля.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных межгосударственных стандартов ссылочным
международным стандартам
Таблица ДА. 1
|
Обозначение ссылочного |
Степень |
Обозначение и наименование соответствующего |
|
ISO 6887(все части)1) |
- |
* |
|
ISO 7218:2007 |
IDT |
ГОСТ ISO 7218-2011 «Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям» |
|
ISO 8261:2001 |
- |
* |
|
ISO/TS 11133-1:2000 |
IDT |
ГОСТ ISO 11133-1-2011 «Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культуральных сред в лаборатории» |
|
ISO/TS 11133-2:2003 |
IDT |
ГОСТ ISO 11133-2-2011 «Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 2. Практические руководящие указания по эксплуатационным испытаниям культуральных сред» |
|
* Соответствующий межгосударственный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. |
||
|
Примечание - в настоящем стандарте использовано условное обозначение степени соответствия стандарта: - IDT - идентичные стандарты |
||
__________
1) ISO 6887-1:1999, ISO 6887-2:2003, ISO 6887:3-2003, ISO 6887-4/AMD.1:2011, ISO 6887-5:2010.
Библиография
|
[1] |
BAYLIS, C.L. et al. Comparison of three enrichment media for the isolation of Campylobacter spp. from foods. J. Appl. Microbiol. 2000, 89, pp. 884 - 891 |
|
[2] |
BOLTON, F.J. and ROBERTSON, L. A selective medium for isolating Campylobacter jejuni/coli. J. Clin. Pathol. 1982, 35, pp. 462 - 467 |
|
[3] |
BOLTON, F.J. et al. A blood-free selective medium for the isolation of Campylobacter jejuni from faeces. J. Clin. Microbiol. 1984, 19, pp. 169 - 171 |
|
[4] |
BOLTON, F.J. et al. Detection of Campylobacter jejuni and Campylobacter coli in foods by enrichment culture and polymerase chain reaction enzyme-linked immunosorbent assay. J. Food Prot. 2002, 65, pp. 760 - 767 |
|
[5] |
CORRY, J.E.L. et al. (eds). Handbook of culture media for food microbiology. Progress in Industrial Microbiology. Vol. 37. Elsevier, Amsterdam, 2003 |
|
[6] |
HUNT, J.M. et al. Campylobacter. In: Food and Drug Administration Bacteriological Analytical Manual, 8th Edition, AO AC, Arlington Va, USA, 1998 |
|
[7] |
HUTCHINSON, D.N. and BOLTON, F.J. Improved blood-free selective medium for the isolation of Campylobacter jejuni from faecal specimen. J. Clin. Pathol. 1984, 37, pp. 956 - 957 |
|
[8] |
KARMALI, M.A. et al. Evaluation of a blood-free, charcoal-based, selective medium for the isolation of Campylobacter organisms from faeces. J. Clin. Microbiol. 1986, 23, pp. 456 - 459. |
|
[9] |
SKIRROW, M.B. Campylobacter enteritis: a new disease. Brit. Med. J. 1977, 2, pp. 9 - 11 |
Ключевые слова: пищевые продукты, корма, микробиология, метод обнаружения, презумптивные бактерии Campylobacter, культуральные среды, селективные среды, чашки Петри, инкубирование посевов, типичные колонии