Государственное санитарно-эпидемиологическое
нормирование
Российской Федерации
1.2. ГИГИЕНА, ТОКСИКОЛОГИЯ, САНИТАРИЯ
Порядок выявления и идентификации
агрегатов фуллеренов С60 в срезах
тканей
животных и растений методами
аналитической электронной микроскопии
Методические рекомендации
MP 1.2.0044-11
Москва • 2012
1. Разработаны Государственным учебно-научным учреждением «Биологический факультет Московского государственного университета им. М.В. Ломоносова» (М.П. Кирпичников, Г.Б. Онищенко, Б.А. Смирнова, К.В. Шайтан, М.В. Ерохина, О.В. Самсонова, А.С. Шебанова); Учреждением Российской Академии наук «Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова» РАН (А.В. Феофанов); Учреждением Российской Академии медицинских наук «Научно-исследовательский институт питания» РАМН (В.А. Тутельян, И.В. Гмошинский, С.А. Хотимченко, М.М.Г. Гаппаров); Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский институт метрологической службы» (С.А. Кононогов, С.С. Голубев); Учреждением Российской Академии наук «Центр «Биоинженерия» РАН (К.Г. Скрябин).
2. Разработаны в рамках Федеральной целевой программы «Развитие инфраструктуры наноиндустрии в Российской Федерации на 2008 - 2011 годы».
3. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 11 ноября 2011 г.
4. Введены в действие 11 ноября 2011 г.
5. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации Г.Г. Онищенко 11 ноября 2011 г. Дата введения: с момента утверждения |
1.2. ГИГИЕНА, ТОКСИКОЛОГИЯ, САНИТАРИЯ
Порядок выявления и идентификации агрегатов
фуллеренов С60 в срезах тканей животных и растений
методами аналитической электронной микроскопии
Методические рекомендации
MP 1.2.0044-11
I. Область применения
1.1. Настоящие методические рекомендации определяют порядок выявления и идентификации агрегатов фуллерена С60 в срезах тканей животных и растений методами аналитической электронной микроскопии.
1.2. Настоящие методические рекомендации могут использоваться:
• при анализе разрабатываемых новых и уже используемых наноматериалов, содержащих фуллерен С60, с целью оценки их безопасности;
• в целях принятия решений по оценке рисков, связанных с процессами производства и оборота наноматериалов на основе фуллерена С60;
• при проведении экспертизы пищевых продуктов, продукции сельского хозяйства, фармацевтической промышленности, биотехнологического производства;
• при проведении мероприятий по осуществлению надзора (контроля) в процессе производства, переработки и утилизации фуллерена С60.
1.3. Методические рекомендации разработаны с целью обеспечения единства процедур подготовки образцов, проведения измерений и представления результатов в ходе выявления и идентификации агрегатов фуллерена С60 в срезах тканей животных и растений методами аналитической электронной микроскопии.
1.4. Методические рекомендации предназначены для специалистов органов и организаций Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, а также могут быть использованы научно-исследовательскими организациями гигиенического профиля, медицинскими учебными заведениями и иными организациями и учреждениями, проводящими исследования по оценке безопасности наноматериалов и продукции наноиндустрии.
II. Введение
Согласно экспертной оценке ряда аналитических компаний, рынок нанотехнологий и продукции наноиндустрии в Российской Федерации в настоящее время находится на начальном этапе становления. Активно ведутся научные разработки, апробируются возможности коммерциализации результатов, однако присутствие нанотехнологий в промышленном секторе по-прежнему ограничено единичными примерами.
В частности, такая картина характерна для фуллеренов, стабильные объемы производства которых в России в последние нескольких лет держатся на уровне 25 - 30 кг в год (фуллереновой сажи - до 1,5 т в год). В то же время, неуклонное нарастание числа патентов на потенциальное применение фуллеренов в технологических процессах, а также увеличение промышленного спроса на этот вид наноматериалов в мире позволяют прогнозировать быстрый рост объемов производства фуллеренов и содержащей их потребительской продукции.
В структуре потребления фуллерены и технологии с их применением наиболее востребованы в энергетическом секторе (в качестве основы для батарей и топливных элементов, в качестве присадки для топлива и другое), но в последнее время наблюдается увеличение доли потребления фуллеренов в таких отраслях, как медицина и фармацевтика, электроника, трибология и металлургия.
Исходя из очевидных тенденций, в ближайшие годы закономерно ожидать быстрое прогрессирование рынка фуллеренов и в России. Изменение масштабов производства и потребления фуллеренов, создающее условия для их накопления в объектах окружающей среды, и расширение спектра нанотехнологической продукции на их основе приведут к массовому контакту человека с фуллеренами.
Таким образом, существует обоснованная потребность в разработке системы мониторинга наноматериалов этого типа в биотических компонентах экосистем, продукции животноводства, растениеводства и пищевой продукции. Одной из задач настоящих методических рекомендаций является формирование единого методического подхода к выявлению и идентификации агрегатов фуллерена С60 в срезах тканей животных и растений, оптимизированного для выполнения в лабораториях аккредитованных организаций и обеспечивающего получение достоверных результатов с заданными метрологическими характеристиками.
III. Нормативные ссылки
3.1. Федеральный закон от 30 марта 1999 г. № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
3.2. Федеральный закон от 2 января 2000 г. № 29-ФЗ «О качестве и безопасности пищевых продуктов».
3.3. Федеральный закон от 26 июня 2008 г. № 102-ФЗ «Об обеспечении единства измерений».
3.4. Федеральный закон от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании».
3.5. Федеральный закон от 10 января 2002 г. № 7-ФЗ «Об охране окружающей среды».
3.6. Постановление Правительства Российской Федерации от 30 июня 2004 г. № 322 «Об утверждении Положения о Федеральной службе в сфере защиты прав потребителей и благополучия человека».
3.7. Постановление Правительства Российской Федерации от 21 декабря 2000 г. № 987 «О государственном надзоре и контроле в области обеспечения качества и безопасности пищевых продуктов».
3.8. Постановление Правительства Российской Федерации от 21 декабря 2000 г. № 988 «О государственной регистрации новых пищевых продуктов, материалов и изделий».
3.9. Постановление Правительства Российской Федерации от 2 февраля 2006 г. № 60 «Об утверждении Положения о проведении социально-гигиенического мониторинга».
3.10. Постановление Правительства Российской Федерации от 15 сентября 2005 г. № 569 «О Положении об осуществлении государственного санитарно-эпидемиологического надзора в Российской Федерации».
3.11. Приказ Министерства здравоохранения СССР от 12 августа 1977 г. № 755 «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных».
3.12. Приказ Министерства здравоохранения и социального развития Российской Федерации от 23 августа 2010 г. № 708н «Об утверждении Правил лабораторной практики».
3.13. Постановление Главного государственного санитарного врача Российской Федерации от 23 июля 2007 г. № 54 «О надзоре за продукцией, полученной с использованием нанотехнологий и содержащих наноматериалы».
3.14. Постановление Главного государственного санитарного врача Российской Федерации от 31 октября 2007 г. № 79 «Об утверждении Концепции токсикологических исследований, методологии оценки риска, методов идентификации и количественного определения наноматериалов».
3.15. СанПиН 2.6.1.2523-09 «Нормы радиационной безопасности (НРБ-99/2009)».
3.16. ГН 1.2.2633-10 «Гигиенические нормативы содержания приоритетных наноматериалов в объектах окружающей среды».
3.17. СП 2.2.2.1327-03 «Гигиенические требования к организации технологических процессов, производственному оборудованию и рабочему инструменту».
3.18. МУ 1.2.2520-09 «Токсиколого-гигиеническая оценка безопасности наноматериалов».
3.19. МУ 12.2636-10 «Проведение санитарно-эпидемиологической экспертизы продукции, полученной с использованием нанотехнологий и наноматериалов».
3.20. МУ 1.2.2741-10 «Порядок отбора проб для выявления и идентификации наноматериалов в лабораторных животных».
3.21. МУ 1.2.2742-10 «Порядок отбора проб для выявления и идентификации наноматериалов в растениях».
3.22. МУ 1.2.2745-10 «Порядок отбора проб для характеристики действия наноматериалов на лабораторных животных».
3.23. МУ 1.2.2873-11 «Порядок выявления и идентификации наноматериалов в водных беспозвоночных».
3.24. МУ 1.2.2874-11 «Порядок выявления и идентификации наноматериалов в лабораторных животных».
3.25. МУ 1.2.2875-11 «Порядок выявления и идентификации наноматериалов в водоемах».
3.26. МУ 1.2.2876-11 «Порядок выявления и идентификации наноматериалов в растениях».
3.27. МУ 1.2.2877-11 «Порядок выявления и идентификации наноматериалов в рыбах».
3.28. МУ 1.2.2634-10 «Микробиологическая и молекулярно-генетическая оценка воздействия наноматериалов на представителей микробиоценоза».
3.29. МУ 1.2.2635-10 «Медико-биологическая оценка безопасности наноматериалов».
3.30. MP 1.2.2522-09 «Выявление наноматериалов, представляющих потенциальную опасность для здоровья человека».
3.31. MP 1.2.2566-09 «Оценка безопасности наноматериалов in vitro и в модельных системах in vivo».
3.32. MP 1.2.2639-10 «Использование методов количественного определения наноматериалов на предприятиях наноиндустрии».
3.33. MP 1.2.2640-10 «Методы отбора проб, выявления и определения содержания наночастиц и наноматериалов в составе сельскохозяйственной, пищевой продукции и упаковочных материалов».
3.34. MP 1.2.2641-10 «Определение приоритетных видов наноматериалов в объектах окружающей среды, живых организмах и пищевых продуктах».
3.35. MP 1.2.0022-11 «Порядок отбора проб для контроля за наноматериалами».
3.36. MP 1.2.0023-11 «Контроль наноматериалов в пищевой продукции».
3.37. ГОСТ 2603-79 «Реактивы. Ацетон. Технические условия».
3.38. ГОСТ 4328-77 «Реактивы. Натрия гидроокись. Технические условия».
3.39. ГОСТ 6709-72 «Вода дистиллированная. Технические условия».
3.40. ГОСТ 1942-86 «1,2-Дихлорэтан технический. Технические условия».
3.41. ГОСТ 4198-75 «Реактивы. Калий фосфорно-кислый однозамещенный. Технические условия».
3.42. ГОСТ 3118-77 «Реактивы. Кислота соляная. Технические условия».
3.43. ГОСТ 4172-76 «Реактивы. Натрий фосфорно-кислый двузамещенный 12-водный. Технические условия».
3.44. ГОСТ 5833-75 «Реактивы. Сахароза. Технические условия».
3.45. ГОСТ Р 51652-2000 «Спирт этиловый ректификованный из пищевого сырья. Технические условия».
3.46. ГОСТ 24104-2001 «Весы лабораторные. Общие технические требования».
3.47. ГОСТ 27987-88 «Анализаторы жидкости потенциометрические ГСП. Общие технические условия».
3.48. ГОСТ 25336-82 «Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры».
3.49. ГОСТ 1770-74 «Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия».
3.50. ГОСТ 29227-91 «Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования».
3.51. ГОСТ 21240-89 «Скальпели и ножи медицинские. Общие технические требования и методы испытаний».
3.52. ГОСТ 21241-89 «Пинцеты медицинские. Общие технические требования и методы испытаний».
3.53. ГОСТ 26678-85 «Холодильники и морозильники бытовые электрические компрессионные параметрического ряда. Общие технические условия».
3.54. ГОСТ 3-88 «Перчатки хирургические резиновые. Технические условия».
3.55. ГОСТ 2493-75 «Реактивы. Калий фосфорно-кислый двузамещенный 3-водный. Технические условия».
3.56. ГОСТ 4568-95 «Калий хлористый. Технические условия».
3.57. ГОСТ 4233-77 «Реактивы. Натрий хлористый. Технические условия».
3.58. ГОСТ 1625-89 «Формалин технический. Технические условия».
3.59. ГОСТ 4517-87 «Реактивы. Методы приготовления вспомогательных реактивов и растворов, применяемых при анализе».
3.60. ГОСТ 20015-88 «Хлороформ. Технические условия».
3.61. ГОСТ 21239-93 «Инструменты хирургические. Ножницы. Общие требования и методы испытаний».
3.62. ГОСТ 7.32-2001 «Отчет о научно-исследовательской работе. Структура и правила оформления».
3.63. ГОСТ Р ИСО/МЭК 17025-2006 «Общие требования к компетентности испытательных и калибровочных лабораторий».
IV. Общие положения
4.1. Целью выявления и идентификации агрегатов фуллеренов С60 в срезах тканей животных и растений методами аналитической электронной микроскопии является:
• установление возможности проникновения фуллеренов С60 в организмы животных и растения;
• выявление мишеней воздействия фуллеренов С60;
• установление наличия эффектов кумуляции фуллеренов С60 в организмах животных и растениях;
• выявление механизмов действия фуллеренов С60;
• исследования по токсиколого-гигиенической и медико-биологической оценке фуллеренов С60 и продукции, их содержащей;
• санитарно-гигиеническое нормирование содержания фуллеренов С60 в продовольственном сырье и пищевых продуктах растительного и животного происхождения;
• экспертиза продукции наноиндустрии, полученной или содержащей фуллерены С60, производимой на территории Российской Федерации или ввозимой на территорию Российской Федерации;
• государственный надзор (контроль) за использованием фуллеренов С60 и продукции, их содержащей, в процессе разработки, производства, хранения, транспортирования, реализации и утилизации;
• оценка экспозиции человека фуллеренами С60 через пищевые продукты животного и растительного происхождения;
• оценка риска для здоровья населения при поступлении фуллеренов С60 в составе продукции растительного и животного происхождения;
• проверка оценки соответствия продукции наноиндустрии установленным требованиям;
• разработка мероприятий по охране окружающей среды от воздействия фуллеренов С60.
4.2. Отбор проб осуществляется в соответствии с МУ 1.2.2741-10 «Порядок отбора проб для выявления и идентификации наноматериалов в лабораторных животных», МУ 1.2.2742-10 «Порядок отбора проб для выявления и идентификации наноматериалов в растениях», МУ 1.2.2745-10 «Порядок отбора проб для характеристики действия наноматериалов на лабораторных животных», MP 1.2.2640-10 «Методы отбора проб, выявления и определения содержания наночастиц и наноматериалов в составе сельскохозяйственной, пищевой продукции и упаковочных материалах», MP 1.2.0022-11 «Порядок отбора проб для контроля за наноматериалами», МУ 1.2.2740-10 «Порядок отбора проб для выявления, идентификации и характеристики действия наноматериалов в водных беспозвоночных», МУ 1.2.2744-10 «Порядок отбора проб для выявления, идентификации и характеристики действия наноматериалов в рыбах», МУ 1.2.2873-11 «Порядок выявления и идентификации наноматериалов в водных беспозвоночных».
4.3. Технические характеристики электронных микроскопов и вспомогательного лабораторного оборудования, применяемого при выявлении и идентификации агрегатов фуллеренов С60 в срезах тканей животных и растений, представлены в MP 1.2.2639-10 «Использование методов количественного определения наноматериалов на предприятиях наноиндустрии и в контролирующих организациях» и MP 1.2.2641-10 «Определение приоритетных видов наноматериалов в объектах окружающей среды, живых организмах и пищевых продуктах».
4.4. Организация (лаборатория) должна быть аккредитована на проведение работ в области оценки безопасности наноматериалов.
В лаборатории должны соблюдаться правила надлежащей лабораторной практики в соответствии с приказом Министерства здравоохранения и социального развития Российской Федерации от 23 августа 2010 г. № 708н «Об утверждении Правил лабораторной практики».
4.5. В организации (лаборатории), проводящей исследования по выявлению и идентификации агрегатов фуллеренов С60 в срезах тканей животных и растений, должна быть разработана программа по обеспечению качества проводимых исследований. Все производственные операции проводятся в соответствии со Стандартными операционными процедурами (СОП), осуществляемыми в целях обеспечения качества, достоверности и воспроизводимости результатов исследования.
4.6. Организации (лаборатории), проводящие исследования по выявлению и идентификации агрегатов фуллеренов С60 в срезах тканей животных и растений методами аналитической электронной микроскопии, должны быть укомплектованы необходимым оборудованием и средствами измерений, прошедшими поверку (калибровку) в установленном порядке. Эксплуатация оборудования и средств измерений проводится в соответствии с техническим паспортом и инструкцией по применению. Результаты проведения поверки (калибровки) и текущего ремонта оборудования фиксируются в специальном журнале, доступном в любое время сотрудникам, эксплуатирующим оборудование или обеспечивающим его обслуживание. Применяются средства измерений, имеющие сертификат и зарегистрированные в Государственном реестре средств измерений.
4.7. Организации (лаборатории) проводящие исследования по выявлению и идентификации агрегатов фуллеренов С60 в срезах тканей животных и растений методами аналитической электронной микроскопии, должны иметь оборудованные помещения для работы с биологическим материалом (препарирование, пробоподготовка, анализ). Материал, поступивший в лабораторию, должен быть обработан в комнате пробоподготовки. Для обработки материала должны быть установлены ламинарные шкафы, обеспечивающие вертикальный поток воздуха, а также возможность работы без ламинарного потока, и длительную экспозицию облучения внутренних поверхностей ультрафиолетовым светом.
4.8. Организации (лаборатории), проводящие исследования по выявлению и идентификации агрегатов фуллеренов С60 в срезах тканей животных и растений методами аналитической электронной микроскопии, должны иметь оборудование, обеспечивающее безопасность работы с наноматериалами неорганического и биогенного происхождения: ламинарные вытяжные шкафы, перчаточные боксы, снабженные системой вентиляции (НЕРА-фильтры), препятствующие поступлению аэрозоля наноматериалов в воздух производственных помещений и в окружающую среду.
4.9. Организации (лаборатории), проводящие исследования по выявлению и идентификации агрегатов фуллеренов С60 в срезах тканей животных и растений методами аналитической электронной микроскопии, должны иметь помещения для содержания и работы с лабораторными животными (виварий, клиники лабораторных животных), требования к которым изложены в МУ 1.2.2874-11 «Порядок выявления и идентификации наноматериалов в лабораторных животных».
4.10. Документом, подтверждающим результаты проведенных исследований наноматериалов, является отчет о проведенном исследовании. Отчет содержит следующие сведения: название исследования; адрес организации; даты начала и завершения исследований; цель и задачи исследования; характеристика тестируемого наноматериала; перечень исследованных образцов и применяемых стандартов; для животных - вид, линия, пол и возраст используемых животных, состав применяемых рационов, условия содержания животных, метод введения фуллеренов С60, применяемые дозы, длительность и кратность введения; схема проведения исследования; для растений - вид, линия используемых растений, условия выращивания или сбора, методы введения фуллеренов С60, применяемые дозы, длительность введения; схема проведения исследования; перечень использованных средств измерений и вспомогательного оборудования и режимы их работы; методы статистической обработки результатов; результаты исследования, представленные в виде обобщающих таблиц, рисунков с соответствующей статистической обработкой и комментариев к ним; заключение; выводы; список использованных источников.
Оформление отчета о результатах исследования должно соответствовать требованиям ГОСТ 7.32-2001 «Отчет о научно-исследовательской работе. Структура и правила оформления».
Отчет о результатах проведенного исследования составляется ответственным исполнителем, утверждается руководителем организации и скрепляется печатью организации.
4.11. Организация (лаборатория), проводящая исследования по выявлению и идентификации агрегатов фуллеренов С60 в срезах тканей животных и растений методами аналитической электронной микроскопии, должна обеспечить конфиденциальность результатов исследований в рамках принятых ею обязательств и в соответствии с законодательством Российской Федерации.
4.12. Сотрудники, принимающие участие в проведении исследований по выявлению и идентификации агрегатов фуллеренов С60 в срезах тканей животных и растений методами аналитической электронной микроскопии, обязаны соблюдать конфиденциальность в отношении любых данных, полученных в ходе исследования, в соответствии с законодательством Российской Федерации.
V. Методики подготовки проб для выявления и идентификации агрегатов фуллерена С60 в срезах тканей растений
5.1. Реактивы, материалы и оборудование
5.1.1. Реактивы
|
Дигидрофосфат калия водный (KH2PO4´H2O), квалификация хч |
||
|
Гидрофосфат натрия 12-водный (Na2HPO4´12Н2O), квалификация хч |
||
|
Гидроксид натрия (NaOH), квалификация хч |
||
|
Сахароза, квалификация хч |
||
|
Кислота соляная (НСl), квалификация хч |
||
|
Дистиллированная вода |
ГОСТ 6709-79 |
|
|
Глутаровый альдегид (25 %-й водный раствор) |
ТУ 6-02-1273-89 |
|
|
Grade I, специальной очистки для использования в электронной микроскопии |
||
|
Спирт этиловый ректифицированный, 96 %-й первого сорта или высшей очистки |
||
|
Ацетон, квалификация чда |
||
|
Эпоксидная смола ((Ероху Embedding Medium, |
||
|
Эпон® 812) фирмы «Sigma-Aldrich» (США) или аналогичная |
||
|
Додецилянтарный ангидрид фирмы «Sigma-Aldrich» (США) или аналогичный |
||
|
Метилэндиковый ангидрид МЭА-610 фирмы «Sigma-Aldrich» (США) или аналогичный |
||
|
Тридиметиламинофенол (катализатор DMP-30) фирмы «Sigma-Aldrich» (США) или аналогичный |
||
|
Формвар (Formvar® solution) для микроскопии фирмы «Sigma-Aldrich» (США) или аналогичный (в случае самостоятельного приготовления формвара) |
||
|
Дихлорэтан (для приготовления раствора формвара) |
||
|
5.1.2. Материалы |
||
|
Материалы, необходимые для отбора проб, в соответствии с МУ 1.2.2876-11 |
||
|
Пинцет медицинский |
||
|
Ножницы медицинские |
||
|
Скальпель |
||
|
Перчатки хирургические резиновые |
||
|
Бритва фирмы «Ted Pella, Inc.» (США), кат. № 121-1 или аналогичная |
||
|
Контейнеры стеклянные для фиксации материала вместимостью 50 см3 |
||
|
Пенициллиновые флаконы стеклянные с завинчивающейся крышкой вместимостью 10 см3 |
||
|
Чашки Петри стеклянные (диаметром 12 см3) |
||
|
Пробирки стеклянные вместимостью 20 см3 с резиновой пробкой |
||
|
Штативы для пробирок |
||
|
Медицинский шприц объемом 50 - 100 см3 (для удаления воздуха из растений) |
||
|
Цилиндр мерный вместимостью 100 см3 с наименьшей ценой деления 1 см3 |
||
|
Колба мерная стеклянная с притертой крышкой вместимостью 250 см3 |
||
|
Колбы (стеклянные без крышки) вместимостью 100; 250 и 1000 см3 |
||
|
Пипетки стеклянные или пластиковые градуированные вместимостью 5 см3 |
||
|
Наконечники для автоматических дозаторов полистирольные нестерильные вместимостью 200 и 1000 мм3 |
||
|
Система для фильтрации растворов стеклянная вместимостью 1,0 дм3 с вакуумным насосом |
||
|
Мембраны эфирно-целлюлозные толщиной 150 мкм, диаметром 47 мм, с размером пор 0,22 мкм |
||
|
Пинцет для электронно-микроскопических работ 110 мм тип 5 кончик 0,05´0,01 мм (или 115 мм тип 7 кончик 0,10´0,06 мм) ненамагничивающийся Ted Pella |
||
|
Полипропиленовые пробирки для микропроб однократного применения типа «Эппендорф» вместимостью 1,5 и 2,0 см3 |
ТУ 64-2-30-80 |
|
|
Полиэтиленовые капсулы с плоским или коническим дном для заливки образцов, диаметр от 6 мм, выдерживающие нагрев до 75 °C, или полипропиленовые аналогичные капсулы, выдерживающие нагрев до 100 °C, производства ВЕЕМ® Embedding Capsule или аналогичные |
||
|
Контейнеры тефлоновые с размером лунки от 0,5´0,5 см до 1,0´1,0 см для заливки образцов в эпоксидную смолу |
||
|
Электронно-микроскопические бленды (медные), отверстие круглое 1,3 мм или овальное 1´2 мм, или сетки медные круглые с размером отверстий 200 - 450 мкм |
||
|
Специальное стекло для изготовления стеклянных ножей шириной 25 мм, длиной 400 или 200 мм, толщина 6 или 10 мм фирмы Ted Pella, Agar Scientific или аналогичное (если используются стеклянные ножи) |
||
|
Пластиковые одноразовые ванночки для сбора срезов фирмы Ted Pella или аналогичные |
||
|
Палочки для чистки алмазного ножа из сердцевины пробкового дерева фирмы Ted Pella, Agar Scientific или аналогичные (если используется алмазный нож) |
||
|
Стеклянная палочка длиной до 220 см и диаметром 3 - 5 мм |
||
|
Химически чистое отшлифованное стекло для получения формваровой пленки |
||
|
Специальный стеклянный стакан для приготовления и хранения раствора формвара |
||
|
Наклейки для маркировки |
||
|
Фильтровальная бумага |
||
|
5.1.3. Оборудование |
||
|
Вытяжной шкаф, оборудованный фильтром для улавливания наночастиц |
||
|
Холодильник бытовой электрический |
||
|
Центрифуга со скоростью вращения ротора до 12000 об./мин и охлаждением для пробирок вместимостью 1,5 см3 (5415 R «Eppendorf», ФРГ или аналогичная) |
||
|
Весы лабораторные общего назначения 2-го класса точности с погрешностью взвешивания не более 0,001 г |
||
|
Весы лабораторные общего назначения 2-го класса точности с погрешностью взвешивания не более 0,001 г |
||
|
pH-метр с диапазоном измерения pH, ед. pH от 0,0 до 14, дискретность измерения 0,01 или аналогичный |
||
|
Ультрамикротом, обеспечивающий возможность получения ультратонких срезов биологических образцов толщиной 30 - 100 нм, скорость резания 0,01 - 50,0 мм/с, термоподача 40 - 60 нм |
||
|
Прибор для изготовления стеклянных ножей для ультрамикротомов LKB 7800 или аналогичный |
||
|
Алмазные ножи для ультрамикротома |
||
|
Магнитная мешалка с регулируемой частотой вращения магнитного якоря в диапазоне 100 - 1200 об./мин, рассчитанная на объем до 1,0 дм3 |
||
|
Электромешалка со спиральной насадкой низкоскоростная (до 250 об./мин), рассчитанная на объем до 0,5 дм3 |
||
|
Суховоздушный термостат с диапазоном регулируемых температур от 25 до 80 °C и точностью ± 0,4 °C |
||
|
Дистиллятор объем от 4 дм3, производительность от 1 дм3/ч |
||
|
Автоматические дозаторы с переменным объемом дозирования 100 - 1000, 20 - 200 и 2 - 20 мм3 |
||
|
Держатели для прямоугольных и круглых блоков, совместимые с используемым ультрамикротомом, фирма Ted Pella, Agar Scientific или аналогичные |
||
|
Лобзик ручной механический для обработки залитых в эпоксидную смолу образцов |
||
|
Бинокулярная лупа, оснащенная настольным штативом, с линейным полем зрения от 2 до 10 см и диапазоном увеличений 0,6´, 1´, 2´, 4´, 8´ |
||
5.2. Приготовление рабочих растворов и смесей
Рабочие растворы готовят в соответствии с общепринятыми правилами лабораторной практики. pH растворов контролируют при помощи pH-метра. Приготовленные растворы фильтруют через мембранные фильтры с диаметром пор 0,22 мкм. После каждого использования рабочие инструменты подвергают тщательной обработке в ультразвуковой ванне во избежание перекрестной контаминации образцов наночастицами.
5.2.1. Приготовление двукратного раствора Соренсена (0,2 моль/дм3) 0,06 моль/дм3 KH2PO4, 0,14 моль/дм3 Na2HPO4, pH 7,2 - 7,4 с добавлением 30 г/дм3 сахарозы.
Для приготовления вспомогательных 1,0 моль/дм3 растворов на лабораторных весах готовят навески 136 г KH2PO4, 358,2 г Na2HPO4´12Н2O и вносят каждое вещество в отдельную мерную колбу объемом 1000 см3, содержащую 500 см2 дистиллированной воды. Соли растворяют при перемешивании и объемы растворов доводят дистиллированной водой до 1000 см3. Вспомогательные растворы фильтруют и хранят при температуре не более 4 °C в течение 6 месяцев.
Для приготовления двукратного 0,2 моль/дм3 раствора Соренсена с добавлением 30 г/дм3 сахарозы на лабораторных весах готовят навеску 30,0 г сахарозы и помещают в мерную колбу объемом 1000 см3. В колбу с веществом вносят 300 см3 дистиллированной воды, 60 см3 1,0 моль/дм3 раствора KH2PO4, 140 см3 1,0 моль/дм3 раствора Na2HPO4 и растворяют при перемешивании. Объем раствора доводят до 1000 см3 дистиллированной водой, фильтруют и хранят при температуре не более 4 °C в течение 1 месяца.
5.2.2. Приготовление однократного раствора Соренсена (0,1 моль/дм3) 0,03 моль/дм3 KH2PO4, 0,07 моль/дм3 Na2HPO4, pH 7,2 - 7,4, 15 г/дм3 сахарозы.
Для приготовления 100 см3 однократного раствора Соренсена (0,1 моль/дм3) с добавлением 15 г/дм3 сахарозы к 50 см3 двукратного раствора Соренсена с добавлением 30 г/дм3 сахарозы (приготовление описано в пункте 5.2.1) добавляют 50 см3 дистиллированной воды.
5.2.3. Приготовление фиксирующего раствора (0,1 моль/дм3 раствор Соренсена pH 7,2 - 7,4, 2,5 % глутарового альдегида).
Для приготовления 100 см3 фиксирующего раствора в мерную колбу вносят 50 см3 двукратного раствора Соренсена с добавлением 30 г/дм3 сахарозы (по п. 5.2.1), 10 см3 коммерческого препарата глутарового альдегида (25 %-й водный раствор). С помощью pH-метра доводят pH буфера до 7,3 добавлением 1М HCl и далее доводят объем раствора до 100 см3 дистиллированной водой.
Фиксирующий раствор готовят непосредственно перед использованием из расчета 4 см3 на 1 образец.
5.2.4. Приготовление 1 моль/дм3 раствора NaOH pH 14, а также 10, 20, 30, 40, 50, 60, 70, 80 %-х водных растворов этанола проводят, как описано в MP 1.2.2641-10 «Определение приоритетных видов наноматериалов в объектах окружающей среды, пищевых продуктах и живых организмах» (п. 5.1.3.3). Растворы этанола готовят из расчета 2 см3 на образец и хранят в плотно закрытых емкостях при температуре 4 °C в течение 1 месяца.
5.2.5. Приготовление смеси эпоксидных смол
Смесь эпоксидных смол готовят непосредственно перед использованием:
• готовят смесь А (смешивают эпон 812 и додецилянтарный ангидрид в соотношении 5:8 по объему, из расчета 3 см3 на 1 образец);
• готовят смесь Б (смешивают эпон 812 и метилэндиковый ангидрид в соотношении 8:7 по объему, из расчета 3 см3 на 1 образец);
• объединяют смеси А и Б в соотношении 13:15 по объему в стеклянном стакане и перемешивают в течение 20 - 60 мин с помощью электромешалки со спиральной насадкой при скорости вращения 100 - 120 об./мин, добавляют 1 % (по весу) катализатора полимеризации три-диметиламинофенол. Следует отметить, что оптимизация твердости полимерного блока может потребовать экспериментального подбора точных пропорций смолы и катализатора.
5.2.6. Приготовление смесей ацетона и эпоксидной смолы
Ацетон и эпоксидную смолу без добавления катализатора, приготовленную по п. 5.2.5, смешивают в объемных соотношениях 3:1, 1:1, 1:3. Каждую смесь готовят непосредственно перед использованием из расчета 2 см3 на 1 образец.
5.3. Подготовка проб к анализу методами электронной микроскопии
Все работы с использованием органических растворителей (ацетон и его смеси с эпоксидными смолами) ведут в вытяжном шкафу, применяя только стеклянную посуду.
5.3.1. Из образцов ткани растений, фиксированных раствором глутарового альдегида, скальпелем или лезвием вырезают более мелкие участки длиной от 3 до 5 мм, не менее двух из каждой зоны. Полученный набор фрагментов подвергают обработке без применения контрастирующих агентов. При подготовке проб применяют полную процедуру, описанную в пп. 5.3.2 - 5.3.8.
5.3.2. Чтобы минимизировать проникновение в ткани растений пузырьков воздуха, препятствующих эффективному проникновению фиксатора и снижающих качество получаемых образцов, при помощи медицинского шприца вручную откачивают воздух из вырезанных участков. Для этого образцы тканей помещают в медицинский шприц, наполовину заполняют шприц фиксирующим раствором, отверстие шприца зажимают пальцем и, оттягивая поршень вверх, откачивают воздух из образцов. Эту процедуру повторяют несколько раз, и ее цель заключается в устранении пузырей воздуха из тканей растений. Воздушные пузыри препятствуют равномерной пропитке ткани фиксирующим раствором и вызывают формирование полостей, из-за чего ультратонкие срезы крошатся при изготовлении.
После этой процедуры образцы каждого вида от одной объединенной пробы снова помещают в отдельный пенициллиновый флакон или контейнер с фиксирующим раствором. Флаконы маркируют с указанием вида растения, органа (из которого взяты образцы), даты и места сбора. Срок хранения образцов в фиксирующем растворе при температуре 4 °C - не более 12 месяцев. Нельзя допускать замораживания образцов при хранении.
5.3.3. Образцы промывают в буферном растворе Соренсена (pH 7,2 - 7,4) 2 - 4 раза до получения прозрачного смыва.
5.3.4. Проводят обезвоживание образцов в серии растворов этанола возрастающих концентраций. Для этого пробы обрабатывают 2 см3 каждого из спиртовых растворов в следующем порядке:
• 10 %-м этанолом в течение 30 мин при 4 °C (процедуру повторяют 3 - 4 раза, до получения визуально прозрачного водно-спиртового смыва);
• 20 %-м этанолом в течение 30 мин при 4 °C;
• 30 %-м этанолом в течение 30 мин при 4 °C;
• 40 %-м этанолом в течение 30 мин при 4 °C;
• 50 %-м этанолом в течение 30 мин при 4 °C;
• 60 %-м этанолом в течение 30 мин при 4 °C;
• 80 %-м этанолом в течение 30 мин при комнатной температуре;
• 96 %-м этанолом в течение 30 мин при комнатной температуре.
5.3.5. Образцы инкубируют в 100 %-м ацетоне два раза по 60 мин.
5.3.6. Образцы пропитывают смесями ацетона с эпоксидными смолами (приготовленными по п. 5.2.5) в последовательности, которая обеспечивает возрастание концентрации эпоксидных смол:
• из 3 частей ацетона и 1 части смеси эпоксидных смол (п. 5.2.6) - в течение 24 ч;
• из 2 частей ацетона и 2 частей смеси эпоксидных смол - в течение 24 ч;
• из 1 части ацетона и 3 частей смеси эпоксидных смол - в течение 24 ч.
5.3.7. Подготовленные образцы стеклянной палочкой переносят в заливочные контейнеры, заполненные 100 %-й эпоксидной смолой с добавлением катализатора. Для полимеризации смолы контейнеры с образцами инкубируют в термостате при 37 °C в течение 24 ч, затем при 45 °C в течение 24 ч и при 60 °C в течение 24 ч.
5.3.8. Из образцов, заключенных в смолу, при помощи лобзика выпиливают блоки размером 2´2´5 мм. Из эпоксидного блока, закрепленного в держателе, лезвием бритвы формируют усеченную пирамиду, с меньшего основания которой с помощью ультрамикротома, оснащенного стеклянным или алмазным ножом, получают срезы толщиной 40 - 80 нм. Для повышения статистической значимости результатов анализа нарезку пробы организуют в виде 4 - 6 серий, отстоящих друг от друга не менее чем на 100 мкм, по 10 срезов в каждой серии. Случайно выбранные срезы (по 1 - 2 из каждой серии) вылавливают на бленды, покрытые формваровой пленкой, и высушивают не менее 1 ч. Необходимо удостовериться, что на отобранных срезах присутствует ткань.
5.4. Процедура подготовки образцов сравнения порошка С60
При проведении лабораторных исследований для приготовления образца сравнения используют порошок фуллерена С60 высокой степени чистоты (не менее 99,5 %) отечественных или зарубежных производителей. Чистоту образца С60 дополнительно проверяют методом ВЭЖХ согласно MP 1.2.2641-10. При проведении мониторинга содержания С60 в объектах окружающей среды или при выявлении последствий техногенной аварии в качестве образца сравнения можно использовать образец фуллерена С60, производимого на предприятии, в окрестностях которого проводят мероприятия по выявлению С60. Следует учитывать, что при заливке в эпоксидную смолу молекулы фуллерена, как правило, спонтанно агрегируют с образованием наноразмерных агрегатов.
5.4.1. Взвешивают 25 мг сухого порошка фуллерена С60 с погрешностью ± 1 мг и помещают на поверхность жидкой смеси эпоксидных смол (приготовленной согласно п. 5.2.5), налитой в полипропиленовую микропробирку (объем 1,8 - 2 см3) в объеме 1 см3.
5.4.2. Образец центрифугируют 3 мин при ускорении 6000 g, полимеризуют и получают ультратонкие срезы методами, описанными в пп. 5.3.7 - 5.3.8.
5.4.3. Произвольно выбранные срезы (2 - 4) переносят на бленды (или сетки), покрытые формваровой пленкой, и высушивают не менее 1 ч.
5.4.4. Эпоксидные блоки, содержащие агрегаты фуллерена С60, хранятся при температуре 20 °C в течение неограниченного времени.
5.4.5. Бленды (сетки) с ультратонкими срезами порошка фуллерена С60, заключенного в эпоксидную смолу, хранят при температуре 20 °C в специальных контейнерах до 1 г.
VI. Методика подготовки проб для выявления и идентификации агрегатов фуллерена С60 в срезах тканей животных
6.1. Реактивы, материалы и оборудование
6.1.1. Реактивы
|
Хлороформ, чда |
|
|
Диэтиловый эфир (эфир для наркоза стабилизированный, чда) |
ТУ 2600-001-43852015-05 |
|
Дистиллированная вода |
ГОСТ 6709-79 |
|
Глутаровый альдегид (25 %-й водный раствор), Grade I, специальной очистки для использования в электронной микроскопии |
ТУ 6-02-1273-89 |
|
Нейтральный формалин, чда, или приготовленный в соответствии с ГОСТ 4517-87, подраздел 2.158 |
ГОСТ 1625-75 |
|
Дигидрофосфат калия водный (KH2PO4´Н2O), хч |
|
|
Гидрофосфат калия 3-водный (K2HPO4´3Н2O), хч |
|
|
Хлорид натрия NaCl, хч |
|
|
Кислота соляная НСl, хч |
|
|
Тетраоксид осмия (OsO4), ACS фирмы «Sigma-Aldrich» (США) или аналогичный |
|
|
Спирт этиловый ректифицированный, 96 %-й первого сорта или высшей очистки |
|
|
Ацетон, квалификация чда |
|
|
Эпоксидная смола (Ероху Embedding Medium, Эпон® 812) фирмы «Sigma-Aldrich» (США) или аналогичная |
|
|
Додецил янтарный ангидрид фирмы «Sigma-Aldrich» (США) или аналогичный |
|
|
Метилэндиковый ангидрид МЭА-610 фирмы «Sigma-Aldrich» (США) или аналогичный |
|
|
Тридиметиламинофенол (катализатор DMP-30) фирмы «Sigma-Aldrich» (США) или аналогичный |
|
|
Формвар (Formvar® solution) для микроскопии фирмы «Sigma-Aldrich» (США) или аналогичный (в случае самостоятельного приготовления формвара) |
|
|
Дихлорэтан (для приготовления раствора формвара) |
6.1.2. Материалы
|
Перчатки хирургические резиновые |
|
|
Булавки или препаровальные иглы для фиксации животных на препаровальном столике |
|
|
Препаровальный столик (из пробки или пенопласта) |
|
|
Пинцет медицинский |
|
|
Ножницы медицинские |
|
|
Ножницы глазные |
ГОСТ 21239-89 |
|
Скальпель |
|
|
Бритвенное лезвие фирмы «Ted Pella, Inc.» (США), кат. № 121-1 или аналогичная |
|
|
Пенициллиновые флаконы стеклянные или полиэтиленовые с завинчивающейся крышкой вместимостью 10 см3 (для фиксации) |
|
|
Пробирки стеклянные (с пробкой) или полиэтиленовые с завинчивающейся крышкой вместимостью 20 см3 (для фиксации суспензионных образцов) |
|
|
Пенициллиновые флаконы стеклянные вместимостью 10 см3 (для проводки) |
|
|
Чашки Петри стеклянные (диаметром 12 см3) |
|
|
Штативы для пробирок |
|
|
Цилиндр мерный вместимостью 100 см3 с наименьшей ценой деления 1 см3 |
|
|
Колбы (стеклянные без крышки) вместимостью 100, 250 см3 |
|
|
Колба мерная стеклянная с притертой крышкой вместимостью 250 см3 |
|
|
Пипетки стеклянные или пластиковые градуированные вместимостью 5 см3 |
|
|
Наконечники для автоматических дозаторов полистирольные нестерильные вместимостью 200 и 1000 мм3 |
|
|
Система для фильтрации растворов стеклянная вместимостью 1,0 дм3 с вакуумным насосом |
|
|
Мембраны эфирно-целлюлозные толщиной 150 мкм, диаметром 47 мм, с размером пор 0,22 мкм |
|
|
Пинцет для электронно-микроскопических работ 110 мм тип 5 кончик 0,05´0,01 мм (или 115 мм тип 7 кончик 0,10´0,06 мм) ненамагничивающийся Ted Pella |
|
|
Полипропиленовые пробирки для микропроб однократного применения типа «Эппендорф» вместимостью 1,5 и 2,0 см3 |
ТУ 64-2-30-80 |
|
Полиэтиленовые капсулы с плоским или коническим дном для заливки образцов, диаметр от 6 мм, выдерживающие нагрев до 75 °C, или полипропиленовые аналогичные капсулы, выдерживающие нагрев до 100 °C, производства ВЕЕМ® Embedding Capsule или аналогичные |
|
|
Контейнеры тефлоновые с размером лунки от 0,5´0,5 см до 1,0´1,0 см для заливки образцов в эпоксидную смолу |
|
|
Электронно-микроскопические бленды (медные), отверстие круглое 1, 3 мм или овальное 1´2 мм, или сетки медные круглые с размером отверстий 200 - 450 мкм |
|
|
Специальное стекло для изготовления стеклянных ножей шириной 25 мм, длиной 400 или 200 мм, толщина 6 или 10 мм фирмы Ted Pella, Agar Scientific или аналогичное (если используются стеклянные ножи) |
|
|
Пластиковые одноразовые ванночки для сбора срезов фирмы Ted Pella или аналогичные |
|
|
Палочки для чистки алмазного ножа из сердцевины пробкового дерева фирмы Ted Pella, Agar Scientific или аналогичные (если используется алмазный нож) |
|
|
Стеклянная палочка длиной до 220 см и диаметром 3 - 5 мм |
|
|
Химически чистое отшлифованное стекло для получения формваровой пленки |
|
|
Специальный стеклянный стакан для приготовления и хранения раствора формвара |
|
|
Наклейки для маркировки |
|
|
Фильтровальная бумага |
6.1.3. Оборудование
|
Вытяжной шкаф, оборудованный фильтром для улавливания наночастиц |
|
|
Холодильник бытовой электрический |
|
|
Центрифуга со скоростью вращения ротора до 12000 об./мин и охлаждением для микропробирок вместимостью 1,5 см3 (5415 R «Eppendorf», ФРГ или аналогичная) |
|
|
Центрифуга мультифункциональная со скоростью вращения ротора до 5000 об./мин (с бакет-ротором) и 14000 об./мин (с угловым ротором), охлаждением для пробирок вместимостью 20 см3 (5804 R «Eppendorf», ФРГ или аналогичная) (для суспензионных образцов) |
|
|
Весы лабораторные общего назначения 2-го класса точности с погрешностью взвешивания не более 0,001 г |
|
|
pH-метр с диапазоном измерения pH, ед. pH от 0,0 до 14,0, дискретность измерения 0,01 или аналогичный |
|
|
Ультрамикротом, обеспечивающий возможность получения ультратонких срезов биологических образцов толщиной 30 - 100 нм, скорость резания 0,1 - 50 мм/с, термоподача 40 - 60 нм |
|
|
Прибор для изготовления стеклянных ножей для ультрамикротомов LKB 7800 или аналогичный |
|
|
Алмазные ножи для ультрамикротома |
|
|
Магнитная мешалка с регулируемой частотой вращения магнитного якоря в диапазоне 100 - 1200 об//мин, рассчитанная на объем до 1,0 дм3 |
|
|
Электромешалка со спиральной насадкой низкоскоростная (до 250 об//мин), рассчитанная на объем до 0,5 дм3 |
|
|
Суховоздушный термостат с диапазоном регулируемых температур от 25 до 80 °C и точностью ± 0,4 °C |
|
|
Дистиллятор объемом от 4 дм3, производительностью от 1 дм3/ч |
|
|
Автоматические дозаторы с переменным объемом дозирования 100 - 1000 мм3, 20 - 200 мм3 и 2 - 20 мм3 |
|
|
Держатели для прямоугольных и круглых блоков, совместимые с используемым ультрамикротомом, фирма Ted Pella, Agar Scientific или аналогичные |
|
|
Лобзик ручной механический для обработки залитых в эпоксидную смолу образцов |
|
|
Бинокулярная лупа, оснащенная настольным штативом, с линейным полем зрения от 2 до 10 см и диапазоном увеличений 0,6´, 1´, 2´, 4´, 8´ |
|
|
Встряхиватель вибрационный типа «Вортекс» со скоростью вращения до 3000 об./мин (V3 «Elmi Ltd», Латвия или аналогичный) |
|
|
Ламинарный бокс биологической безопасности класс НА |
6.2. Приготовление рабочих растворов и смесей
Рабочие растворы готовят в соответствии с общепринятыми правилами лабораторной практики. pH растворов контролируют при помощи pH-метра. Приготовленные растворы фильтруют через мембранные фильтры с диаметром пор 0,22 мкм. После каждого использования рабочие инструменты подвергают тщательной обработке в ультразвуковой ванне во избежание перекрестной контаминации образцов наночастицами.
6.2.1. Растворы, необходимые для подготовки образцов:
• двукратный фосфатно-солевой буферный раствор (0,2 моль/дм3) pH 7,2 - 7,4 (0,04 моль/дм3 KH2PO4, 0,16 моль/дм3 K2HPO4) с добавлением 1,76 % (масса/объем) NaCl;
• однократный фосфатно-солевой буферный раствор (0,1 моль/дм3) pH 7,2 - 7,4 (0,02 моль/дм3 KH2PO4, 0,08 моль/дм3 K2HPO4) с добавлением 0,88 % (масса/объем) NaCl;
• фиксирующий раствор (2,5 % глутарового альдегида в 0,1 моль/дм3 фосфатно-солевом буферном растворе pH 7,2 - 7,4 с добавлением 2 %-го нейтрального формалина), из расчета 4 см3 на 1 образец;
• водные растворы этанола с концентрацией 50, 60, 70 и 80 %, из расчета 2 см3 на 1 образец;
• 2 %-й водный раствор OsO4;
• 1 %-й раствор OsO4 в 0,1 моль/дм3 фосфатно-солевом буферном растворе pH 7,2 - 7,44 из расчета 2 см3 на 1 образец.
Процедуры приготовления перечисленных растворов детально изложены в MP 1.2.2641-10 «Определение приоритетных видов наноматериалов в объектах окружающей среды, пищевых продуктах и живых организмах» (п. 5.1.3.3). Растворы фильтруют и хранят в плотно закрытых емкостях при температуре 4 °C в течение 1 месяца, за исключением фиксирующего раствора и 1 %-го раствора OsO4 в 0,1 моль/дм3 фосфатно-солевом буферном растворе, которые готовят непосредственно перед использованием.
6.2.2. Приготовление смеси эпоксидных смол
Смесь эпоксидных смол готовят непосредственно перед использованием согласно процедуре, изложенной в п. 5.2.5.
6.2.3. Приготовление смесей ацетона и эпоксидной смолы
Ацетон и смесь эпоксидных смол без добавления катализатора, приготовленную по п. 5.2.5, смешивают в объемных соотношениях 3:1, 1:1, 1:3. Каждую смесь готовят непосредственно перед использованием из расчета 2 см3 на 1 образец.
6.3. Подготовки проб к анализу методом электронной микроскопии
Все работы с использованием органических растворителей (ацетон и его смеси с эпоксидными смолами) ведут в вытяжном шкафу, применяя только стеклянную посуду.
6.3.1. Тяжелые металлы, применяемые для контрастирования клеточных структур при стандартной подготовке биологических образцов для ПЭМ, существенно мешают обнаружению фуллерена С60. Поэтому образцы для детекции фуллерена С60 следует готовить без использования контрастирующих реагентов или с применением только тетраоксида осмия, который не оказывает значительного влияния на результаты анализа. Всю совокупность фиксированных образцов разделяют на две равноценные группы, одну из которых (в дальнейшем - группа № 1) дополнительно фиксируют и контрастируют тетраоксидом осмия, а вторую (группа № 2) подвергают обработке без применения контрастирующих агентов. Таким образом, при подготовке проб группы № 1 применяют полную процедуру, описанную в пп. 6.3.2 - 6.3.9, а при подготовке проб группы № 2 исключают пп. 6.3.3 и 6.3.4.
6.3.2. Каждый образец отмывают от фиксирующего раствора, инкубируя в 2 см3 0,1 моль/дм3 фосфатного солевого раствора pH 7,2 - 7,4 три раза по 5 мин однократно при комнатной температуре.
6.3.3. Образцы группы № 2 дополнительно фиксируют 1 %-м OsO4 в 0,1 моль/дм3 фосфатном солевом растворе pH 7,2 - 7,4 в течение 2 ч.
6.3.4. Образцы промывают в 0,1 моль/дм3 фосфатном солевом растворе pH 7,2 - 7,4 2 - 4 раза до получения прозрачного смыва.
6.3.5. Образцы дегидратируют в серии растворов этанола возрастающих концентраций. Для этого пробы обрабатывают 2 см3 каждого из водно-спиртовых растворов в следующем порядке:
• 50 %-м этанолом холодным (4 °C) отмывают образцы от OsO4 3 - 4 раза по 5 мин до исчезновения потемнения раствора; использование холодного 50 %-го этанола предотвращает выпадение соединения осмия в осадок;
• 60 %-м этанолом в течение 20 мин при 4 °C (2 раза);
• 70 %-м этанолом в течение 12 ч при 4 °C (оставляют на ночь в холодильнике);
• 80 %-м этанолом в течение 20 мин при комнатной температуре;
• 96 %-м этанолом в течение 20 мин при комнатной температуре.
6.3.6. Пробы обрабатывают 100 %-м ацетоном для полного вытеснения этанола (3 раза по 45 мин при комнатной температуре).
6.3.7. Образцы пропитывают смесями ацетона с эпоксидными смолами (приготовленными по п. 5.2.5) в последовательности, которая обеспечивает возрастание концентрации эпоксидных смол:
• из 3 частей ацетона и 1 части смеси эпоксидных смол (п. 5.2.6) - в течение 2 ч при комнатной температуре;
• из 2 частей ацетона и 2 частей смеси эпоксидных смол - в течение 2 ч при комнатной температуре;
• из 1 части ацетона и 3 частей смеси эпоксидных смол - в течение 12 ч при комнатной температуре;
• 100 %-й смесью эпоксидных смол - в течение 2 ч при комнатной температуре.
6.3.8. Подготовленные образцы стеклянной палочкой переносят в заливочные контейнеры (допустимо использование фармацевтических блистеров для таблеток), заполненные 100 %-й смесью эпоксидных смол с добавлением катализатора. Для полимеризации смолы контейнеры с образцами инкубируют в термостате при 37 °C в течение 24 ч, затем при 60 °C в течение 48 ч.
6.3.9. Из образцов, заключенных в смесь эпоксидных смол, при помощи лобзика выпиливают блоки размером 2´2´5 мм. Из эпоксидного блока, закрепленного в держателе, лезвием бритвы формируют усеченную пирамиду, с которой при помощи ультрамикротома, оснащенного стеклянным или алмазным ножом, получают срезы толщиной 40 - 80 нм. Для повышения статистической значимости результатов анализа нарезку пробы организуют в виде 4 - 6 серий, отстоящих друг от друга не менее чем на 100 мкм, по 10 срезов в каждой серии. Случайно выбранные срезы (по 1 - 2 из каждой серии) вылавливают на бленды, покрытые формваровой пленкой, и высушивают не менее 1 ч. Необходимо удостовериться, что на отобранных срезах присутствует ткань.
6.4. Процедура подготовки референсных образцов порошка фуллерена С60
Препараты порошка фуллерена С60, заключенного в эпоксидную смолу, готовят согласно процедуре, описанной в подразделе 5.4.
VII. Методика проведения электронно-микроскопических измерений
7.1. Порядок проведения измерений
Выявление мономеров молекул фуллерена С60, размер которых 0,7 нм, в биологических образцах методами электронной микроскопии не представляется возможным. Однако фуллерен С60 имеет тенденцию накапливаться в клетках и структурах тканей в виде агрегатов. Детекция и идентификация агрегатов фуллерена С60 в срезах тканей растений и животных с применением методов аналитической ПЭМ основаны на том, что агрегаты фуллерена С60 имеют повышенную электронную плотность, выраженные морфологические отличия от биогенных структур, характеристические картину дифракции электронов и спектр ХПЭЭ. Для выявления агрегатов фуллерена С60 следует использовать неконтрастированные образцы (группа № 2). Образцы, контрастированные тетраоксидом осмия (группа № 1), рекомендуется использовать, если помимо выявления агрегатов фуллерена С60 необходимо охарактеризовать их локализацию в тканевых структурах. При этом вначале следует провести выявление агрегатов фуллерена С60 в препаратах проб группы № 2.
Для каждого анализируемого органа или вида ткани проводят измерения не менее чем на 3 срезах, взятых из различных частей образца. Процедура проведения измерения включает в себя:
а) регистрацию изображений, картины электронной дифракции и спектра ХПЭЭ от агрегатов фуллерена С60, получаемых при заливке чистого порошка фуллерена С60 в эпоксидную смолу (образец сравнения), с использованием настроек микроскопа, которые будут применяться при анализе образцов тканей растений или животных;
б) регистрацию обзорных изображений среза тканей растений или животных при увеличениях микроскопа от 6000´ до 20000´ с целью обнаружения электронно-плотных включений, предполагаемых агрегатов фуллерена С60;
в) регистрацию изображений обнаруженных электронно-плотных включений при больших увеличениях микроскопа;
г) измерение электронограмм от обнаруженных электронно-плотных включений;
д) измерение спектров ХПЭЭ от обнаруженных электронно-плотных включений;
е) оценку плотности распределения агрегатов фуллерена С60 в анализируемом срезе.
7.2. Регистрация изображений, картины электронной дифракции и спектра ХПЭЭ от образца сравнения агрегатов фуллерена С60
7.2.1. После проведения стандартных процедур по настройке и юстировке прибора, изложенных в п. 6.1.2 MP 1.2.2639-10, срезы просматривают на средних увеличениях (от 6000´ до 20000´, в зависимости от модели микроскопа и расположения цифровой камеры относительно флуоресцентного экрана). Образец исследуют зигзагообразно, используя принцип систематического случайного выбора:
а) определяют границы среза;
б) намечают воображаемую прямоугольную систему координат, совмещая ее первый квадрант с площадью среза (рис. 1);
в) в пределах среза, вблизи точки отсчета, выбирают первое поле зрения;
г) перемещают поле зрения вдоль выбранной оси системы координат (рис. 1, ОХ);
д) дойдя до края среза, сдвигают перпендикулярно на величину одного поля зрения (рис. 1, OY) и продолжают сканирование в противоположном направлении (рис. 1, ХО);
е) повторяют пункт д) до обнаружения характерных включений, морфологически идентичных агрегатам фуллерена С60 (рис. 2, А).
Рис. 1. Схема зигзагообразного сканирования ультратонкого среза при исследовании на средних увеличениях (XOY - воображаемая прямоугольная система координат; пунктирной линией со стрелками обозначено перемещение поля зрения в границах среза)
7.2.2. Получают изображение поля зрения, выбранного в п. 7.2.1е, в режиме ПЭМ при средних увеличениях.
Рис. 2. ПЭМ-изображения агрегатов фуллерена С60, заключенных в эпоксидную смолу, при увеличениях микроскопа 10000´ (А) и 35000´ (Б). В. Характерная параллельная исчерченность в структуре агрегата фуллерена С60
7.2.3. Получают ПЭМ-изображение найденных включений при увеличении 50000´ - 200000´. Конкретное значение этого параметра выбирают так, чтобы оно обеспечивало возможность различить и охарактеризовать морфометрически элементы агрегата (т.е. размеры проекции изображения самого мелкого в скоплении агрегата на матрицу камеры должны составлять не менее 5´5 пикселей). Предпочтительно, чтобы выбранное увеличение позволяло детектировать характерную, типичную для фуллерена С60, параллельную исчерченность (рис. 2, В), которая объясняется регулярной (квазикристаллической) упаковкой фуллерена С60 в агрегатах и является морфологическим признаком, облегчающим идентификацию специфических включений.
7.2.4. Регистрируют картину электронной дифракции от найденного скопления агрегатов фуллерена С60. Оптимизируют параметры: ускоряющее напряжение, размер апертурной диафрагмы, глубину дифракционной камеры, - добиваясь, чтобы на электронограмме были четко различимы дифракционные кольца. Предпочтительно использовать диаметр диафрагмы, ограничивающий область детекции размером не более 0,5 - 1,0 мкм, что позволяет более селективно регистрировать сигнал от выделенных электронно-плотных частиц. Критерием успешного подбора глубины дифракционной камеры является наличие трех - пяти (или более) дифракционных колец, не сливающихся друг с другом и с центральным рефлексом. Пример электронограммы приведен на рис. 3.
Рис. 3. Типичная электронограмма агрегата фуллерена С60
7.2.5. Регистрируют спектр ХПЭЭ от найденного скопления агрегатов фуллерена С60 в диапазоне 275 - 325 эВ. Затем в максимальной близости к измеренному скоплению находят поле зрения, не содержащее агрегатов фуллерена С60 и, не изменяя настроек прибора, получают спектр ХПЭЭ от этой области.
7.3. Регистрация обзорных изображений среза тканей растений или животных
7.3.1. При проведении обзорного анализа определяют границы среза ткани и в пределах этих границ визуально оценивают наличие включений, аналогичных эталонным. При регистрации обзорных изображений среза ткани применяют процедуру, описанную в п. 7.2.1, со следующими дополнениями:
а) просматривают не менее 50 % площади среза; для ускорения процедуры с сохранением репрезентативности можно рекомендовать просмотр каждого второго или каждого третьего поля зрения вдоль траектории сканирования;
б) регистрируют и сохраняют изображения всех полей зрения, содержащих предполагаемые агрегаты фуллерена С60 (пример такого изображения приведен на рис. 4);
в) определяют масштаб цифрового изображения при используемом увеличении.
Масштаб рассчитывают как отношение L/X, где L - линейный размер поля образца, отображаемый микроскопом на ПЗС камере при выбранном увеличении в нанометрах, X - число пикселей в оцифрованном изображении размером Х´X пикселей. Полученное значение отмечают в протоколе исследования.
7.3.2. На срезах образцов группы № 1, контрастированных тетраоксидом осмия, дополнительно определяют зоны преимущественного накопления в клетках.
7.3.3. Обнаружение включений, аналогичных включениям на образце сравнения, вне границ среза ткани указывает на возможную контаминацию среза наночастицами фуллерена С60 в процессе пробоподготовки или выпадение агрегатов фуллерена С60 из мест их скопления на ультратонком срезе ткани. Если плотность агрегатов фуллерена С60 вне среза ткани в 10 и более раз ниже, чем в пределах самой ткани, результаты анализа считаются значимыми. Если плотность распределения агрегатов фуллерена С60 внутри среза ткани и за ее пределами (в эпоксидной смоле) сравнимы, процедуру пробоподготовки повторяют, используя свежеприготовленные растворы и смеси.
Рис. 4. Изображение агрегатов фуллерена С60 (показаны стрелками) в селезенке, полученное при средних увеличениях электронного микроскопа (препарат контрастирован OsO4)
7.3.4. Если при просмотре всех подготовленных и отобранных для анализа срезов одной пробы (пп. 5.3.8 и 6.3.9) на средних увеличениях не обнаруживают включений, морфологически сходных с включениями, обнаруженными на образце сравнения, или частиц, которые значительно отличаются от эндогенных структур образца, делают заключение, что агрегаты фуллерена С60 в пробе отсутствуют или присутствуют в концентрации ниже предела детекции данным методом. В этом случае анализ ограничивают обзорным сканированием и более детальное исследование, описанное в пп. 7.4 - 7.6, не проводят.
7.3.5. В ходе обзорного анализа могут быть обнаружены включения, морфологически не сходные с изображениями агрегатов фуллерена С60, полученными на образце сравнения, и отличающиеся от биологических структур. В таком случае предполагают, что эти включения имеют экзогенное происхождение и могут представлять собой особые типы агрегатов фуллерена С60, которые формируются под воздействием уникального сочетания физиологических и метаболических факторов, свойственных живому организму, но не образуются при механическом диспергировании порошка фуллерена С60 в эпоксидной смоле. Нетипичные включения анализируют так же, как сходные с эталоном. Их идентичность фуллерену С60 подтверждают или исключают только на основании результатов электронной дифракции и СХПЭЭ (пп. 7.5, 7.6).
7.4. Регистрация изображений электронно-плотных включений при больших увеличениях микроскопа
7.4.1. Для получения детализированных ПЭМ-изображений препарата выбирают области, содержащие один или несколько агрегатов типичной морфологии. Анализируют от 10 до 20 областей, в зависимости от степени вариабельности размера и формы агрегатов. Если в препарате присутствует несколько разновидностей частиц, сходных с агрегатами фуллерена С60, обнаруженных на образце сравнения, выборку формируют из частиц всех найденных типов. К нетипичным включениям (п. 7.3.5) применяют аналогичную процедуру анализа.
7.4.2. Устанавливают увеличение (в диапазоне от 50000´ до 200000´), выбранное при анализе образца сравнения (п. 7.2). Если при заданных настройках ПЭМ удается различить характерную для фуллерена С60 параллельную исчерченность агрегатов (рис. 2, В), при регистрации изображений обращают внимание, чтобы этот признак был хорошо выражен. Пример детализированного изображения агрегата фуллерена С60 в срезе биологической ткани, которое было получено при большом увеличении микроскопа, приведен на рис. 5.
Рис 5. Изображение агрегатов фуллерена С60 (показаны стрелочками) в поздней эндосоме в макрофаге селезенки крысы
7.4.3. При получении цифрового изображения не допускают использования опции автоконтрастирования, так как нормирование на максимальную интенсивность ведет к потере информации об уровне электронной плотности и затрудняет идентификацию агрегатов фуллерена среди эндогенных наноразмерных включений.
7.4.4. Определяют масштаб цифрового изображения при выбранном увеличении микроскопа (п. 7.3.1в). Полученное значение отмечают в протоколе исследования.
7.5. Измерение электронограмм от обнаруженных электронно-плотных включений
7.5.1. Для получения электронограммы с помощью апертурной диафрагмы модуля для регистрации дифракции электронов выделяют область анализируемого скопления (рис. 6). Следует учитывать, что надежность и достоверность идентификации методом электронной дифракции может снижаться, если размер агрегатов меньше 100 - 200 нм. Измерения проводят при ранее оптимизированных настройках прибора (п. 7.2.4).
В качестве критерия, позволяющего идентифицировать агрегаты фуллерена С60 в процессе проведения измерений, рекомендуется оценивать соотношение диаметров характеристических колец и сравнивать их со значениями, установленными для образца сравнения (табл. 1).
Рис 6. А - ПЭМ-изображение крупного агрегата фуллерена С60 в селезенке (препарат контрастирован OsO4);
Б - электронограмма этого агрегата
Таблица 1
Соотношения диаметров (dn/d2) характеристических максимумов 2-го и последующих (n - х) порядков для картины электронной дифракции агрегата фуллерена С60
|
3 |
4 |
5 |
6 |
7 |
8 |
|
|
dn/d2 |
1,3 ± 0,1 |
2,2 ± 0,1 |
2,5 ± 0,2 |
3,3 ± 0,2 |
3,7 ± 0,2 |
4,0 ± 0,2 |
7.5.2. Если в области, ограниченной апертурной диафрагмой, присутствует единичный агрегат небольших размеров, метод электронной дифракции дополняют методом темного поля. Другим основанием для применения метода темного поля является случай, когда в области анализа присутствуют два или несколько отдельно лежащих включения, и при этом часть рефлексов не совпадает с положением характеристических колец.
Для получения изображения методом темного поля в режиме электронной дифракции с помощью апертурной диафрагмы выделяют наиболее яркий рефлекс из тех, которые расположены на линиях характеристических колец. Изменяют режим измерения и получают изображение той же области в темном поле. Совпадение изображений агрегата в режимах темного поля и светлого поля подтверждает, что источником выделенного на электронограмме рефлекса является анализируемое электронно-плотное включение. В случае, если метод применяют для идентификации источников нехарактерных рефлексов, их выделяют с помощью апертурной диафрагмы, а кристаллы, которые выявляют на полученном темнопольном изображении, относят к неспецифическим включениям. Если взаимное расположение электронно-плотных включений позволяет вывести идентифицированные неспецифические включения из области, ограниченной диафрагмой, то рекомендуется сделать это и повторно получить электронограмму от агрегатов фуллерена С60.
7.6. Измерение спектров ХПЭЭ от электронно-плотных включений
Формваровая подложка и область биологического образца, свободная от фуллерена, содержат соединения углерода в высокой концентрации и поэтому имеют в спектре потерь энергии электронов в области 275 - 325 эВ два пика 287 - 288 и 298 эВ. Возможность идентификации фуллерена С60 методом СХПЭЭ в составе биоматериала обусловлена появлением в спектре дополнительного, третьего, пика с максимумом 303 эВ, который сопровождается смещением максимума в области 298 эВ в сторону увеличения потерь энергии на 3 - 5 эВ в зависимости от вклада сигнала фуллерена С60 (рис. 7).
Рис. 7. СХПЭЭ углерода:
1 - спектр формваровой подложки; 2 - спектр углерода в составе биологической ткани на формваровой подложке; 3 - спектр агрегатов фуллерена С60 в биологической ткани
Для получения спектра ХПЭЭ в области характерного пика углерода оператор ограничивает область анализируемых наночастиц при помощи диафрагмы. Выбор области, значительную долю которой занимает поверхность анализируемых наночастиц, существенно повышает отношение характеристичного сигнала пика к фону.
Спектр ХПЭЭ регистрируют в диапазоне потерь энергии 275 - 325 эВ. Оптимальную интенсивность освещения образца электронным лучом подбирают в каждом конкретном измерении, добиваясь условий, при которых не происходит насыщения детектора, плавления и дрейфа подложки. Затем выбирают область в непосредственной близости от скопления, не содержащую экзогенных включений, и, не изменяя настроек прибора, измеряют СХПЭЭ этой области. Полученный спектр является внутренним контролем, который позволяет оценить вклад сигнала от биологического матрикса в спектр ХПЭЭ анализируемого агрегата. В качестве оперативной оценки наличия дополнительного, характерного для фуллерена С60, пика в спектре углерода рекомендуется использовать эмпирический критерий R (формула 1):
R = (I306 - I288)/(I298 - I288), где (1)
I288, I298, I306 - значения интенсивности сигнала при величине потерь энергии 288, 298 и 306 эВ соответственно. Для биологической ткани, не содержащей фуллерен С60, R < 0,85 (при уровне значимости 0,01). Для агрегатов С60, занимающих более 5 % площади, ограниченной апертурной диафрагмой при измерении СХПЭЭ, значение R > 0,94 (при уровне значимости 0,01). Значение R возрастает с увеличением площади, занимаемой С60 в выбранной для анализа зоне, и может превышать 1,0. Поэтому достоверность оценки зависит от соотношения размера агрегата и площади образца, выделяемой апертурной диафрагмой.
7.7. Оценка плотности и равномерности распределения агрегатов фуллерена С60 в образце
Оператор намечает линию, проходящую через весь срез, и вдоль этой линии измеряет 30 равномерно отстоящих друг от друга изображений в режиме ПЭМ при увеличении, выбранном в п. 7.2.3. При этом визуально на люминесцентном экране обнаруживают включения, сходные по морфологическим признакам с агрегатами С60, и получают изображения полей, содержащих такие включения. В целях оптимизации процедуры изображения полей, не содержащих агрегаты С60, не регистрируют, но ведут их учет и отмечают эти данные в протоколе исследования.
Существует альтернативный способ оценки плотности и однородности распределения детектируемых наночастиц, применимый в случае, если программное обеспечение предусматривает возможность виртуального разбиения площади среза на квадратные зоны и автоматизированного перехода от зоны к зоне. Тогда в каждой зоне (всего не менее 30) анализируют 1 - 2 области (например, центральную или угловые); получают изображения областей, содержащих агрегаты С60, и учитывают число пустых областей.
Измерения этого типа рекомендуется проводить на срезах неконтрастированного материала. Распознавание агрегатов фуллерена на ПЭМ-изображениях выполняют на основании следующих морфологических особенностей:
• повышенная, на фоне биологического матрикса, электронная плотность: агрегаты С60 выделяются на фоне цитоплазмы клеток более темными сегментами;
• морфология агрегата, в частности, неоднородность структуры и полигональность;
• параллельная исчерченность.
Для повышения достоверности идентификации обнаруженные электронно-плотные включения дополнительно анализируют методами электронной дифракции (п. 7.5) или СХПЭЭ (п. 7.6).
VIII. Методика обработки и анализа полученных данных
8.1. Преобразование изображений и спектров в форму, удобную для анализа
Файлы с полученными изображениями и электронограммами конвертируют из внутреннего формата программного обеспечения к прибору в общедоступные форматы (*.jpeg или *.tiff, 8-битный), не допуская изменения исходного динамического диапазона в результате автоматического нормирования на максимальную интенсивность и изменения дискретности оцифровки за счет объединения нескольких соседних пикселей (элементов изображения) в один элемент. Сохраняемые изображения должны содержать метку масштаба. Спектры СХПЭЭ конвертируют в форматы *.xls или *.txt
8.2. Программное обеспечение для анализа изображений, электронограмм и спектров
Для обработки и анализа изображений, полученных в режимах ПЭМ и электронной дифракции, рекомендуется использовать специализированное программное обеспечение электронного микроскопа и/или свободно распространяемый комплекс программ ImageJ (Национальный институт здоровья США, rsb.info.nih.gov/ij/). Для обработки и анализа спектров ХПЭЭ рекомендуется использовать специализированную программу, входящую в комплект электронного микроскопа и/или программы, предназначенные для работы с электронными таблицами.
8.3. Анализ детальных изображений агрегатов фуллерена
Распознавание агрегатов фуллерена на изображениях срезов основано на сравнении их с изображениями, полученными для образца сравнения. Анализируют следующие параметры:
• морфологические признаки;
• уровень электронной плотности (оценивают визуально по изображениям, полученным без применения функции автоконтрастирования).
Для оценки количественных морфологических параметров (размер и форм-фактор) определяют линейные размеры агрегата вдоль наиболее короткой и наиболее длинной осей. Форм-фактор F рассчитывают по формуле (2).
a - размер наиболее длинной оси;
b - размер наиболее короткой оси.
Дают качественное описание морфологии агрегатов, субъективно классифицируя их по взаимоисключающим категориям, например, «симметричный»/«асимметричный», «структурно однородный»/«структурно неоднородный», «компактный»/рыхлый». При анализе изображений индивидуальных частиц в составе агрегата, полученных при больших увеличениях (100000´ - 200000´), отмечают наличие характерной для фуллерена С60 параллельной исчерченности.
8.4. Анализ электронограмм
Критерием идентичности обнаруженных электронно-плотных включений и агрегатов фуллерена С60 является совпадение подавляющего большинства рефлексов на электронограмме образца и электронограмме, полученной от образца сравнения. Для сравнения электронограмм их совмещают средствами используемого графического редактора, сохраняя равенство масштаба.
Количественно электронограмму анализируемой частицы характеризуют, рассчитывая соотношение диаметров дифракционного максимума n-го и 2-го порядков (dn/d2), и сравнивают полученные значения со значениями, полученными для образца сравнения (табл. 1).
8.5. Анализ спектра ХПЭЭ
8.5.1. Анализ формы спектра ХПЭЭ
В спектре ХПЭЭ анализируют область 275 - 325 эВ. Наличие двух пиков 287 - 288 и 298 эВ (рис. 7) интерпретируют как сигнал от биоматериала и формваровой подложки. Смещение максимума пика в область 303 эВ указывает на присутствие в образце агрегатов фуллерена С60. Смещение обнаруживают путем наложения спектров ХПЭЭ (диапазон 275 - 325 эВ), измеренных от соседних зон, содержащих и не содержащих электронно-плотные включения. Для надежного выявления сдвига пика углерода выполняют следующее:
• минимумы по интенсивности в сравниваемых спектрах сдвигают к нулю; максимумы выравнивают по интенсивности путем умножения одного из спектров на расчетный коэффициент;
• отнормированные таким образом спектры накладывают друг на друга на экране компьютера и сравнивают форму спектров в области 295 - 310 эВ.
В качестве количественного критерия присутствия сигнала С60 в спектре используют параметр R (формула 1). Значение R > 0,94 расценивают как подтверждение наличия характеристического пика С60.
8.5.2. Метод сравнения интегральных интенсивностей
В качестве дополнительного метода идентификации агрегатов С60 в биологических пробах, основанного на повышении концентрации углерода в зоне скопления С60, используют сравнение интегральных интенсивностей сигнала в спектрах ХПЭЭ в диапазоне 282 - 313 эВ анализируемой зоны и пяти контрольных зон, расположенных в непосредственной близости от агрегата, но не содержащих электронно-плотные включения. Поскольку измеряемая интенсивность сигнала существенно зависит от толщины образца, сравнение полученных значений является информативным только в том случае, если градиент толщины среза и вариабельность плотности биологических структур в зоне измерений незначительны. Для того чтобы оценить применимость метода, определяют стандартное отклонение s средней интенсивности сигнала в контрольных зонах, в общем случае - по формуле 3:
Ii - интегральная интенсивность сигнала в спектре ХПЭЭ в диапазоне 282 - 313 эВ для i-й контрольной зоны (i = {1, 2, ... п});
Iср - среднее значение интегральной интенсивности сигнала в спектрах ХПЭЭ в диапазоне 282 - 313 эВ для всех контрольных зон, n - число контрольных зон. Формула 3' представляет собой частный случай формулы 3 при п = 5.
По формуле 4 вычисляют величину s':
![]() (4)
(4)
Метод сравнения интегральных интенсивностей применяют при условии, что s' £ 5 %. Вычисляют разность D = Ia - Iср, где Ia - интегральная интенсивность сигнала в спектрах ХПЭЭ в диапазоне 282 - 313 эВ от анализируемой зоны.
Если D ³ 2s, возрастание сигнала углерода в зоне локализации электронно-плотного включения считают значимым и расценивают как доказательство его углеродного состава. Выявление повышенной концентрации углерода в анализируемой области в совокупности с получением характерной картины электронной дифракции (рис. 3) является достаточным основанием для идентификации включения как агрегата С60.
Если -2s < D < 2s, различия в интегральной интенсивности не расценивают как значимые. Решение об отнесении электронно-плотного включения к агрегатам С60 принимают на основании данных электронной дифракции и наличия характерного пика 303 эВ в СХПЭЭ углерода. Результаты, полученные методом сравнения интегральных интенсивностей, в этом случае не учитывают.
8.6. Анализ плотности и равномерности распределения агрегатов фуллерена в образце
В серии изображений систематически расположенных областей среза (не менее 30) подсчитывают число агрегатов фуллерена М. При этом в сумму включают только частицы, идентичность которых была подтверждена методами электронной дифракции или СХПЭЭ. Двумерную плотность распределения агрегатов D определяют по формуле (5).
N - общее число изображений, как содержащих, так и не содержащих агрегаты;
S - площадь образца на изображении, мкм2.
Равномерность распределения агрегатов фуллерена характеризуют величиной дисперсии s2 среднего количества наночастиц на одном изображении (формула 6).
Мi - количество агрегатов С60 в i-м изображении. Суммирование по i ведут по всем N полученным изображениям (как содержащим, так и не содержащим фуллерены).
IX. Представление полученных данных
Для включений, идентифицированных как агрегаты фуллерена С60, составляют матрицу данных, столбцы которой содержат информацию о срезе, в котором была обнаружена каждая частица, ее морфометрических характеристиках (размер, форма, форм-фактор), результатах анализа методами электронной дифракции и спектроскопии ХПЭЭ. Пример фрагмента матрицы данных приведен в виде табл. 2. В случае анализа срезов, контрастированных тетраоксидом осмия, также указывают компартмент, в котором выявлена частица.
Таблица 2
Матрица данных по результатам анализа локализации агрегатов фуллерена С60 в ткани печени мыши
|
№ среза |
Средний размер, нм1 |
Форм-фактор2 |
Форма |
Локализация3 |
Электронная дифракция4 |
СХПЭЭ5 |
|
|
74 |
2 |
156 |
3,17 |
двусторонне-симметричная |
ПЭ |
+ |
+ |
|
1 - среднее размеров, измеренных вдоль наиболее длинной и наиболее короткой осей; 2 - соотношение размеров, измеренных вдоль наиболее длинной и наиболее короткой осей; 3 - клеточный компартмент, в котором обнаружена наночастица (Вне - внеклеточная зона, ПМ - плазматическая мембрана, Я - ядро, М - митохондрии, ЭПР - эндоплазматический ретикулум, ЛС - лизосома, ПЭ - поздняя эндосома и так далее); 4 - наличие (+) или отсутствие (-) совпадения электронограммы с электронограммой от образца сравнения; 5 - наличие (+) или отсутствие (-) характерного пика фуллерена С60 в спектре ХПЭЭ |
|||||||
Если выборка значений количественных показателей из матрицы данных превышает n = 30, проводят их статистический анализ. Для выборки строят гистограмму распределения по значениям, проводят проверку на нормальность распределения, вычисляют среднее и среднее квадратичное отклонение. Для описательных признаков (например, «форма» в табл. 2) рассчитывают долю (%) каждого варианта в общей структуре признака и представляют результат в виде круговой диаграммы.
Результаты анализа представляют в виде письменного заключения о выявлении агрегатов фуллерена С60 в тканях животного или растительного организма, оформленного в виде текстового документа с таблицами, рисунками и графиками.
Результат считают отрицательным, если агрегаты фуллерена не выявлены ни в одном из срезов исследуемого образца и достоверно идентифицированы в референсных срезах (образцы сравнения, заключенные в эпоксидную смолу). В этом случае представляют репрезентативные микрофотографии образца и эталона. Если агрегаты фуллерена достоверно обнаружены и идентифицированы в образцах группы № 1 и группы № 2, в отчете представляют следующие данные (отдельно по каждому типу образца, например, для каждого вида ткани, извлеченного при аутопсии животного):
• репрезентативные изображения наночастиц, измеренные методом просвечивающей электронной микроскопии, в неконтрастированных и в контрастированных срезах;
• гистограмму распределения агрегатов по размерам, средний размер, его среднее квадратичное отклонение, а также сопоставление с соответствующими данными для образца сравнения;
• гистограмму распределения агрегатов фуллерена по форм-фактору, среднее значение и среднее квадратичное отклонение форм-фактора, а также сопоставление этих данных с соответствующими данными для образца сравнения;
• репрезентативные картины дифракции электронов и результаты их сопоставления с электронограммой стандартного образца;
• диаграммы распределения агрегатов фуллерена по качественным категориям (форма, внутриклеточная локализация). В случае бинарного признака указывают только долю (%) встречаемости каждого из двух возможных вариантов;
• репрезентативные спектры ХПЭЭ, содержащие характерный дополнительный пик С60 в области края поглощения углерода;
• оценку плотности и равномерности распределения агрегатов фуллерена С60 в образце в виде значений двумерной плотности (формула 5, частиц/мкм2) и дисперсии среднего количества агрегатов на поле зрения (формула 6);
• любую дополнительную информацию, полученную при анализе образца, которая представляется важной для интерпретации приведенных данных (на усмотрение составителя отчета, в виде примечания).
Если агрегаты фуллерена выявлены в образцах одной из двух групп одной пробы и не детектированы в другой, предполагают контаминацию срезов или иные нарушения технологии пробоподготовки. В этом случае исследование повторяют, заменив все рабочие растворы и усилив контроль качества обработки инструментов.
Приложение 1
Обозначения и сокращения
С60 - нативный фуллерен С60, его производные и гомологи
ПЗС - прибор с зарядовой связью
ПЭМ - просвечивающая электронная микроскопия
ХПЭЭ - характеристические потери энергии электронов
СХПЭЭ - спектр характеристических потерь энергии электронов
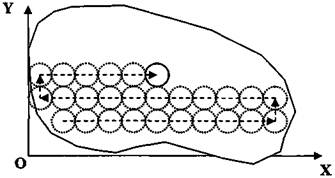






 (3
(3 где (6
где (6