Государственное санитарно-эпидемиологическое
нормирование
Российской Федерации
4.2.
МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы определения бактерий
рода Campylobacter в пищевых продуктах
Методические указания
МУК 4.2.2321-08
Москва 2008
1. Разработаны: Государственным учреждением Научно-исследовательским институтом питания Российской Академии медицинских наук (В.А. Тутельян, С.А. Хотимченко, С.А. Шевелева, Н.Р. Ефимочкина, Ж.Н. Шурышева), Федеральным Государственным учреждением науки Государственным научным центром прикладной микробиологии и биотехнологии Роспотребнадзора (И.А. Дятлов, М.В. Храмов), Федеральным Государственным учреждением науки «Федеральный Научный Центр гигиены им. Ф.Ф. Эрисмана» Роспотребнадзора (Г.М. Трухина), Управлением Роспотребнадзора по г. Москве (Н.Н. Филатов, И.И. Пискарева). ФГУЗ «Центр гигиены и эпидемиологии в г. Москве» (О.В. Захарова, Н.Я. Салова).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека. Протокол от 06.12.2007 № 3.
3. Утверждены и введены в действие Главным государственным санитарным врачом Российской Федерации, Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека Г.Г. Онищенко 24.01.2008.
4. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель
Федеральной службы ___________________ Г.Г. Онищенко 24 января 2008 г. Дата введения: с момента утверждения. |
4.2.
МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы
определения бактерий рода Campylobacter
в пищевых продуктах
Методические указания
МУК 4.2.2321-08
1. Общие положения и область применения
1.1. Настоящие методические указания устанавливают порядок контроля и методы определения бактерий рода Campylobacter - возбудителей пищевых токсикоинфекций и острых кишечных заболеваний в пищевых продуктах при осуществлении государственного санитарно-эпидемиологического надзора, а также при санитарно-эпидемиологическом расследовании вспышек пищевых отравлений и инфекций с пищевым путем передачи.
Проведение контроля на бактерии рода Campylobacter позволит оценить степень загрязненности пищевой продукции и получить реальную картину ситуации в Российской Федерации, дать оценку эффективности принимаемых мер в целях обеспечения ее безопасности в плане новых и вновь возникающих возбудителей инфекций с пищевым путем передачи для здоровья и жизни человека.
1.2. Методические указания предназначены для органов и организаций Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, осуществляющих контроль качества и безопасности продовольственного сырья и пищевых продуктов, в т.ч. импортируемых в Российскую Федерацию, а также лабораторную диагностику заболеваний с пищевым путем передачи. Методические указания могут быть использованы другими лабораторными центрами, осуществляющими контроль качества и безопасности пищевых продуктов и аккредитованными в установленном порядке.
2. Сущность метода
Метод определения бактерий рода Campylobacter основан на высеве определенных количеств продукта в жидкие селективные среды, содержащие антибиотики и аэротолерантные добавки с последующим пересевом на поверхность твердых селективных сред, инкубировании посевов, выявлении в этих посевах бактерий, способных расти и образовывать типичные колонии на поверхности селективного агара, с последующим выделением чистой культуры. Все этапы инкубации посевов осуществляются в микроаэрофильных условиях. Идентификация чистых культур проводится по совокупности морфологических, биохимических и других признаков, определяющих принадлежность к видам бактерий рода Campylobacter.
3. Аппаратура, материалы, лабораторная посуда,
реактивы и питательные среды
3.1. Аппаратура и инструментарий
|
Анализатор потенциометрический, погрешность измерений pH ± 0,01 |
|
|
Шкаф сушильный стерилизационный ШСС-80 П или других марок, позволяющий поддерживать температуру (160 ± 5) °С |
ТУ 9452-010-00141798-2002 |
|
Термостат, позволяющий поддерживать рабочую температуру 37 °С с отклонением от заданной ±1 °С |
ТУ 9452-002-00141798-97 |
|
Термостат, позволяющий поддерживать рабочую температуру 42 °С с отклонением от заданной ±1 °С |
ТУ 9452-002-00141798-97 |
|
Баня водяная с подогревом |
|
|
Весы лабораторные общего назначения, 2 и 4 класса точности, с наибольшим пределом взвешивания 200 г |
|
|
Микроскоп биологический МБИ-1, МБИ-2, МБИ-3, МБР-1, МБР-3, МБС |
ТУ 9443-076-07502348-96 |
|
Стерилизаторы паровые медицинские или аналогичные |
ГОСТ Р 500444-92 |
|
Дистиллятор, обеспечивающий качество дистиллированной воды в соответствии с ГОСТ 6709-90 |
ТУ 4952-007-33142130-2000 |
|
Облучатель бактерицидный настенный ОБН-150 или других видов |
ТУ 16-535-84 |
|
Холодильник бытовой электрический с морозильной камерой |
|
|
Пинцет медицинский |
|
|
Ножницы медицинские |
ГОСТ 21239-89 |
|
Скальпель хирургический, 15 см |
|
|
Штативы для пробирок |
|
|
Часы механические сигнальные |
|
|
Электроплитка |
|
|
Универсальная лабораторная центрифуга (20000 х g) с охлаждением типа SIGMA 2-16K |
|
|
Стационарный анаэробный инкубатор или СO2-инкубатор (Flow Lab.) |
|
|
Или система для анаэробного культивирования с манометром (анаэростат) (HiMedia LE 001) Отсасыватель хирургический типа ХО-450-1 ТУ АО «Элема» (г. Новосибирск) или стерильные газонепроницаемые пакеты для контейнеров-анаэростатов HiMedia LE 010 Зажимы для контейнеров анаэростатов HiMedia LE 011 |
ТУ РЯГК 941624.001 |
|
Контейнеры для анаэробного культивирования HiMedia LE 007, LE 008 или LE 009 Гомогенизатор перистальтического типа «Микс-2», «Стомайкер» или других наименований AES Lab., Cat.N AES АР 1066 |
|
3.2. Лабораторная посуда и материалы
|
Бумага фильтровальная лабораторная |
ГОСТ 120260-76 |
|
Бутылки стеклянные для химических реактивов |
|
|
Кастрюли эмалированные |
|
|
Марля медицинская |
ГОСТ 9412-77 |
|
Колбы плоскодонные конические или круглые разной вместимости |
|
|
Флаконы стеклянные |
ТУ 64-2-281-84 |
|
Воронки стеклянные |
|
|
Вата медицинская гигроскопическая |
|
|
Пипетки емкостью 1, 2, 5, и 10 см3 |
|
|
Пробирки типов П1, П2 |
|
|
Стекла предметные для микропрепаратов |
|
|
Спиртовки лабораторные стеклянные |
|
|
Термометр ртутный с диапазоном измерения от 0 до 100 °С (цена деления шкалы 1 °С) |
|
|
Термоконтейнер (сумка-холодильник) |
|
|
Петли бактериологические |
|
|
Чашки биологические (Петри) |
|
|
Маркеры по стеклу |
|
|
Газогенераторные пакеты для кампилобактерий объемом 3,5 литра HiMedia LE 002 D |
|
|
Смесь газов: кислорода (О2) - 5 %, двуокиси углерода (СO2) - 10 %, азота (N2) - 85 % в баллонах |
ТУ 6-16-2956-92 |
|
Обхваты резиновые |
|
Допускается использование другой аппаратуры, инструментария, лабораторной посуды и материалов аналогичного назначения для проведения исследований в соответствии с данным документом. Аппаратура, инструментарий, лабораторная посуда и материалы импортного производства должны иметь разрешение уполномоченных органов Российской Федерации на их применение.
3.3. Реактивы и питательные среды
3.3.1. Реактивы, компоненты сред
|
Натрий гиппурат (содержание основного вещества 99 %) Acros 41170 |
|
|
Нингидрин (содержание основного вещества 99 %) Riedel-de Наеn 33437 |
|
|
Раствор перекиси водорода 3 %-й водный |
|
|
Дистиллированная вода |
ГОСТ 6709-90 |
|
Диски для выявления оксидазы HiMedia DD018 |
|
|
Натрий фосфорнокислый двухзамещенный |
|
|
Na2HPO4 (безводный), чда |
ГОСТ 4193-75 |
|
Натрий фосфорнокислый однозамещенный гидрат NaHPO4⋅Н2O |
|
|
Натрия хлорид |
|
|
Набор реактивов для окраски по Граму |
|
|
Масло иммерсионное для микроскопии |
ГОСТ 31739-78 |
|
Спирт этиловый ректификованный |
|
|
Агар-агар микробиологический |
|
|
Пептон |
|
|
Мясной экстракт |
|
|
Кровь баранья дефибринированная стерильная ЗАО «Эколаб», Россия |
|
|
Натрий пировинограднокислый, ч |
ТУ 6-09-08-990-75 |
|
Железо (II) сернокислое |
ГОСТ 4148-66 |
|
Натрий метабисульфит |
ГОСТ 10.575-76 |
|
Или ростовая (аэротолерантная) добавка для кампилобактерий следующего состава: натрия пируват - 125,0 мг, натрия метабисульфит - 125,0 мг, железа (II) сульфат - 125,0 мг HiMedia FD 009 |
|
|
Добавка антибиотиков для кампилобактерий-I (по Блэйзер-Вонг): полимиксин В - 1250 ME, ванкомицин - 5,0 мг, триметоприм - 2,5 мг, амфотерицин В - 1,0 мг, цефалотин - 7,5 мг HiMedia FD006 |
|
|
Добавка антибиотиков для кампилобактерий-II (по Бутцлеру), модифицированная, следующего состава: бацитрацин - 12500 ME, колистина сульфат - 5000 ЕД, амфотерицин В - 5,0 мг, цефазолина натриевая соль - 7,5 мг, новобиоцин - 2,5 мг HiMedia FD165 |
|
|
Добавка антибиотиков модифицированная-III (по Дойлу): ванкомицин - 7,50 мг, триметоприма лактат - 2,50 мг, амфотерицин В - 5,00 мг, полимиксина В сульфат - 10000 ME HiMedia FD 159 |
|
|
Добавка антибиотиков для кампилобакгерий-IV (по Престону) модифицированная: полимиксина В сульфат - 2500 ME, рифампицин - 5,00 мг, триметоприма лактат - 5,00 мг, амфотерицин В - 5,00 мг HiMedia FD158 |
|
|
Добавка антибиотиков для кампилобактерий-V: цефоперазон - 16,00 мг HiMedia FD067 |
|
|
Добавка антибиотиков для селективного выделения термофильных кампилобактерий (CAT): цефоперазон - 4,0 мг, тейкопланин - 2,0 мг, амфотерицин В - 5,0 мг HiMedia FD145 Селективная добавка антибиотиков для кампилобакагара: полимиксин В - 1 мг, рифампицин - 5 мг, амфотерицин В - 1,5 мг, ристомицин - 5 мг, ФГУН ГНЦ ПМБ (Оболенск) |
ТУ 9398-057-7895326-2007 |
|
Диски с цефалотином (Ch 30) HiMedia SD050 |
|
|
Диски с налидиксовой кислотой (Na 30) HiMedia SD050 |
|
|
Тетраметил-пара-фенилендиамин (гидрохлорид) (C10H16N2⋅2HCl) |
ТУ 6-09-1903-77 |
|
Ацетон |
|
|
Спирт бутиловый нормальный, чда |
ГОСТ 6006-51 |
|
Кислота соляная, хч |
|
|
Натрия гидроокись, чда |
|
3.3.2.1. Обогащающие бульоны |
|
|
Основа бульона для накопления кампилобактерий (Престона) HiMedia М899 |
|
|
Основа бульона для накопления кампилобактерий (Дойла) HiMedia М 916 |
|
|
Основа бульона для бруцелл HiMedia М 348 |
|
|
3.3.2.2. Агаровые среды |
|
|
Основа агара Престон HiMedia М 939 |
|
|
Основа угольного селективного агара для кампилобактерий HiMedia М 887 |
|
|
Основа колумбийского кровяного агара HiMedia М 144 BD BBL™ |
|
|
Основа агара Мюллера-Хинтона HiMedia М 173 BD BBL™ |
|
|
Кампилобакагар |
ТУ 9398-057-7895326-2007 |
|
«Питательные среды», ФГУН ГНЦ ПМБ (Оболенск) |
|
|
Трехсахарный железосодержащий агар (ТСА) HiMediaM 021/M 0211 |
|
|
Или среда № 13 Трехсахарный железосодержащий агар ФГУН ГНЦ ПМБ (Оболенск) |
ТУ 9398-013-7895326-2006 |
Допускается использование других коммерческих питательных сред и диагностических препаратов аналогичного состава и назначения для проведения исследований в соответствии с данным документом. Питательные среды и диагностические препараты импортного производства должны иметь разрешение уполномоченных органов Российской Федерации на их применение. При их приготовлении следует руководствоваться рекомендациями изготовителя.
|
3.3.2.3. Тест-системы биохимические для видовой идентификации |
|
|
API CAMPY, BioMerieux (или тест-системы аналогичного назначения других изготовителей, обеспечивающие выполнение видовой идентификации кампилобактерий) |
|
3.4. Тест-штаммы микроорганизмов
|
Тест-штаммы Campylobacter jejuni, Campylobacter coli, Campylobacter lari, типичные по культуральным, морфологическим и биохимическим свойствам, паспортизированные и депонированные в установленном порядке, ФГУН ГНЦ ПМБ (Оболенск) |
|
Штаммы необходимо сохранять в лиофильно высушенном виде. При регулярном использовании допускается сохранять в полужидком агаре для бруцелл в пробирках с плотно притертыми пробками, в защищенном от света месте, при температуре (5 ± 1) °С с еженедельным пересевом.
4. Подготовка к анализу
4.1. Приготовление растворов и реактивов
4.1.1. Изотонический раствор хлорида натрия
Натрия хлорид - 85,0 г
Дистиллированная вода - 1,0 л
Растворить натрия хлорид в дистиллированной воде, стерилизовать автоклавированием при температуре 121 °С в течение 15 мин.
4.1.2. Реактив для обнаружения оксидазы
Тетраметил-пара-фенилендиамин (гидрохлорид) - 0,1 г
Стерильная дистиллированная вода - 10 мл
Растворить тетраметил-пара-фенилендиамин (гидрохлорид) в дистиллированной воде, использовать непосредственно после приготовления.
4.1.3.
Фосфатный буферный раствор для приготовления
раствора гиппурата натрия
Двухзамещенный фосфорнокислый натрий Na2HPO4 (безводный) - 12,0 г
Однозамещенный фосфорнокислый натрий NaHPO4⋅Н2O - 2,2 г
Натрия хлорид - 85,0 г
Дистиллированная вода - 1,0 л
Растворить ингредиенты в небольшом объеме дистиллированной воды в колбе. После растворения довести объем дистиллированной водой до 1,0 литра. В случае необходимости довести pH до 7,4 - 7,5 с помощью 0,1 н НСl или 0,1 н NaOH. Стерилизовать автоклавированием при температуре 121 °С в течение 15 мин.
4.1.4. Раствор гиппурата натрия
Натрий гиппурат (содержание основного вещества 99 %) - 10,0 г
Фосфатный буферный раствор - 1,0 л
Растворить гиппурат натрия в стерильном буферном растворе. Разлить в пробирки по 0,4 мл. Хранить при температуре минус 20 °С не более 1 месяца. Перед использованием разморозить при комнатной температуре.
4.1.5. Раствор нингидрина
Нингидрин (содержание основного вещества 99 %) - 10,0 г
Ацетон - 25 мл
Бутиловый спирт - 25 мл
Растворить нингидрин в смеси ацетона и бутилового спирта. Хранить в защищенном от света месте при температуре (5 ± 1) °С не более 3 месяцев.
4.1.6. Аэротолерантная добавка
Натрий пировинограднокислый - 6,25 г
Железо (II) сернокислое - 6,25 г
Натрий метабисульфит - 6,25 г
Стерильная дистиллированная вода - 100 мл
Растворить натрий пировинограднокислый в 10 - 20 мл стерильной дистиллированной воды, после растворения довести объем воды до 100 мл. Добавить железо (II) сернокислое и натрия метабисульфит. Разлить в пробирки по 4 мл. Хранить в защищенном от света месте при температуре минус 20 °С не более 1 месяца. Раствор чрезвычайно чувствителен к воздействию света, после добавления в питательные среды рекомендуется сохранять их в защищенном от света месте.
4.1.7.
Приготовление растворов и реактивов
для окраски препаратов по Грому
Производят согласно требованиям ГОСТ 10444.1 или в соответствии с инструкцией по применению.
4.2. Приготовление питательных сред
Селективность сред для выделения бактерий рода Campylobacter по отношению к сопутствующей микрофлоре достигается путем включения в их состав антибиотиков: цефоперазона, колистина, амфотерицина В, ванкомицина, триметоприма, полимиксина и других. С целью повышения аэротолерантности и снижения окислительно-восстановительного потенциала сред, в них добавляют дефибринированную баранью кровь в количестве не менее 7 % к объему или древесный уголь, а также восстанавливающие агенты: натрия пируват, натрия метабисульфит, железо (II) сульфат.
Так как бактерии рода Campylobacter являются микроаэрофильными микроорганизмами, крайне важно предотвращать попадание кислорода в питательные среды для их культивирования, для чего необходимо соблюдать следующие правила:
- предпочтительней использовать свежеприготовленные среды, срок хранения питательных сред не должен превышать двух недель в условиях холодильника;
- перемешивание компонентов готовых сред (при растворении добавок антибиотиков, перемешивание крови), самих сред после добавления в них компонентов проводить способом, исключающим попадание в них пузырьков воздуха;
- подсушивание поверхности чашек перед посевом в термостате осуществлять с закрытыми крышками, при температуре 42 °С в течение 2 - 3 часов.
Среды промышленного изготовления, поименованные в п. 3.3.2, готовятся согласно прилагаемым инструкциям или прописям на этикетках. Допускается применение сред лабораторного приготовления по п.п. 4.2.1.1, 4.2.2.1 из отдельных компонентов.
4.2.1. Приготовление бульонов
4.2.1.1. Селективный бульон (Престона) для накопления кампилобактерий.
Состав основы среды:
|
Ингредиенты |
Количество, г |
|
Пептон |
10,0 |
|
Мясной экстракт |
10,0 |
|
Натрия хлорид |
5,0 |
|
Агар |
1,0 |
|
Вода |
1000,0 |
Растворить основные компоненты в дистиллированной воде. При необходимости подогреть до кипения для полного растворения частиц. В случае необходимости установить pH 7,5 ± 0,2 с помощью 0,1 н НСl или 0,1 н NaOH. Стерилизовать автоклавированием при температуре 121 °С в течение 15 мин. Остудить до 45 - 50 °С Приготовление полной среды:
Перед использованием в 1000 мл бульона асептически добавить: 70 мл стерильной дефибринированной крови барана; растворенное в 50 %-ном растворе ацетона содержимое двух флакончиков с добавкой антибиотиков для кампилобактерий IV (по Престону) или I (по Блэйзер-Вонг) или растворенное в 50 %-ном растворе этанола содержимое двух флакончиков с добавкой антибиотиков II (по Бутцлеру) и растворенное в стерильной дистиллированной воде содержимое двух флакончиков ростовой добавки для кампилобактерий или 4 мл аэротолерантной добавки по п. 4.1.6, тщательно перемешать и разлить среду в соответствующие емкости в количествах, необходимых для проведения исследования.
4.2.1.2. Селективный бульон (Дойла) для накопления кампилобактерий.
Состав основы среды
|
Ингредиенты |
Количество, г/л |
|
Гидролизат казеина |
10,0 |
|
Пептический перевар животной ткани |
10,0 |
|
Дрожжевой экстракт |
2,0 |
|
Глюкоза |
1,0 |
|
Натрия хлорид |
5,0 |
|
Натрия бисульфит |
0,1 |
|
Натрия сукцинат |
3,0 |
|
L-цистеина гидрохлорид |
0,1 |
|
pH (при 25 °С) 7,0 ± 0,2 |
|
Используют готовую основу среды промышленного изготовления указанного состава.
Приготовление осуществляют согласно прописи на этикетке. Растворить сухую основу порошка в дистиллированной воде. При необходимости подогреть до кипения для полного растворения частиц. Стерилизовать автоклавированием при температуре 121 °С в течение 15 мин. Остудить до температуры 45 °С.
Приготовление полной среды:
Перед использованием в 500 мл бульона асептически добавить 35 мл стерильной дефибринированной крови барана, а также растворенное в 50 %-ном растворе этанола содержимое 1 флакончика с добавкой антибиотиков модифицированной III (по Дойлу). Тщательно перемешать и разлить в соответствующие емкости в количествах, необходимых для проведения исследования.
4.2.1.3. Бульон для бруцелл (неселективный)
Состав основы среды:
|
Ингредиенты |
Количество, г/л |
|
Гидролизат казеина |
10,0 |
|
Пептический перевар животной ткани |
10,0 |
|
Дрожжевой экстракт |
2,0 |
|
Глюкоза |
1,0 |
|
Натрия хлорид |
5,0 |
|
Натрия бисульфит |
0,1 |
|
pH (при 25 °С) 7,0 ± 0,2 |
|
Используют готовую основу среды промышленного изготовления указанного состава.
Приготовление осуществляют согласно прописи на этикетке. Растворить порошок сухой основы в дистиллированной воде. При необходимости подогреть до кипения для полного растворения частиц. Стерилизовать автоклавированием при температуре 121 °С в течение 15 мин. Разлить по пробиркам из расчета 10 мл на 1 пробирку.
4.2.2. Приготовление агаровых сред.
4.2.2.1. Селективный агар Престона.
Состав основы среды:
|
Ингредиенты |
Количество, г |
|
Пептон |
10,0 |
|
Мясной экстракт |
10,0 |
|
Натрия хлорид |
5,0 |
|
Агар-агар |
12,0 |
|
Вода |
1000,0 |
|
pH (при 25 °С) 7,5 ± 0,2 |
|
Растворить основные компоненты в дистиллированной воде. При необходимости довести до кипения для полного растворения частиц. В случае необходимости установить pH 7,5 ± 0,2 с помощью 0,1 н НСl или 0,1 н NaOH. Стерилизовать автоклавированием при температуре 121 °С в течение 15 мин. Остудить до 45 - 50 °С.
Приготовление полной среды:
Перед использованием в 1000 мл расплавленного и остуженного до 45 - 50 °С агара асептически добавить: 70 мл стерильной дефибринированной крови барана; растворенное в 50 %-ном растворе ацетона содержимое двух флакончиков с добавкой антибиотиков для кампилобактерий IV (по Престону) или I (по Блэйзер-Вонг), или растворенное в 50 %-ном растворе этанола содержимое двух флакончиков с селективной добавкой для кампилобактерий II (по Бутцлер) и растворенное в воде содержимое двух флакончиков ростовой добавки для кампилобактерий или 4 мл аэротолерантной добавки по п. 4.1.6, тщательно перемешать и разлить среду в стерильные чашки Петри слоем толщиной 4 - 5 мм.
4.2.2.2. Угольный селективный агар для кампилобактерий.
Состав основы среды:
|
Ингредиенты |
Количество, г/л |
|
Гидролизат казеина |
3,0 |
|
Пептический перевар животной ткани |
10,0 |
|
Мясной экстракт |
10,0 |
|
Натрия хлорид |
5,0 |
|
Железа сульфат |
0,25 |
|
Натрия пируват |
0,25 |
|
Уголь древесный бактериологический |
4,0 |
|
Агар-агар |
12,0 |
|
pH (при 25 °С) 7,0 ± 0,2 |
|
Используют готовую основу среды промышленного изготовления указанного состава.
Приготовление осуществляют согласно прописи на этикетке. Растворить порошок сухой основы в дистиллированной воде. Подогреть до кипения для полного растворения частиц. Стерилизовать автоклавированием при температуре 121 °С в течение 15 мин. Остудить до 45 - 50 °С.
Приготовление полной среды:
в 500 мл расплавленного и остуженного до 45 - 50 °С агара асептически добавить растворенное в 2 мл стерильной дистиллированной воды содержимое 1 флакончика с добавкой антибиотиков CAT или растворенное в 2 мл стерильной дистиллированной воды содержимое 1 флакончика с добавкой антибиотиков-V. Тщательно перемешать и разлить в стерильные чашки Петри слоем толщиной 4 - 5 мм.
Состав основы среды:
|
Ингредиенты |
Количество, г/л |
|
Панкреатический гидролизат казеина |
5,0 |
|
Кислотный гидролизат казеина |
20,0 |
|
Агар |
15,0 ± 3,0 |
|
Натрий углекислый |
0,1 - 0,4 |
Используют готовую основу среды промышленного изготовления указанного состава.
Приготовление осуществляют согласно прописи на этикетке. Растворить порошкообразную сухую основу в дистиллированной воде. Подогреть до кипения для полного растворения частиц. Стерилизовать автоклавированием при температуре 121 °С в течение 15 мин. Остудить до 45 - 50 °С.
Приготовление полной среды:
перед использованием в 1000 мл расплавленного и остуженного до 45 - 50 °С агара асептически добавить 70 мл стерильной дефибринированной крови барана. Содержимое флакона с селективной добавкой антибиотиков для кампилобакагара растворить в 1,5 мл стерильной дистиллированной воды с добавлением 5 - 7 капель 96 %-ного этилового спирта. Полученную смесь антибиотиков в количестве двух флаконов добавить в агар, тщательно перемешать и разлить в стерильные чашки Петри слоем толщиной 4 - 5 мм.
4.2.2.4. Полужидкий бульон для бруцелл (неселективный).
Состав основы бульона:
|
Ингредиенты |
Количество, г/л |
|
Гидролизат казеина |
10,0 |
|
Пептический перевар животной ткани |
10,0 |
|
Дрожжевой экстракт |
2,0 |
|
Глюкоза |
1,0 |
|
Натрия хлорид |
5,0 |
|
Натрия бисульфит |
0,1 |
|
pH (при 25 °С) 7,0 ± 0,2 |
|
К готовой основе среды промышленного изготовления указанного состава добавить агар из расчета 2,0 г/л среды, далее приготовление осуществлять согласно прописи на этикетке. Растворить порошкообразную сухую основу в дистиллированной воде. Довести до кипения для полного растворения частиц, тщательно перемешать, разлить по пробиркам из расчета 5 мл на 1 пробирку. Стерилизовать автоклавированием при температуре 121 °С в течение 15 мин.
4.2.2.5. Колумбийский кровяной агар (неселективный).
Состав основы среды:
|
Ингредиенты |
Количество, г/л |
|
Пептон (специальный) |
23,0 |
|
Крахмал кукурузный |
1,0 |
|
Натрия хлорид |
5,0 |
|
Агар-агар |
15,0 |
|
pH (при 25 °С) 7,3 ± 0,2 |
|
Используют готовую основу среды промышленного изготовления указанного состава.
Приготовление осуществляют согласно прописи на этикетке. Растворить порошкообразную сухую основу в дистиллированной воде. Подогреть до кипения для полного растворения частиц. Стерилизовать автоклавированием при температуре 121 °С в течение 15 мин. Остудить до 40 - 50 °С и асептически внести 70 мл стерильной дефибринированной крови барана, тщательно перемешать и разлить в стерильные чашки Петри слоем 4 - 5 мм.
4.2.2.6. Агар Мюллера-Хинтона.
Состав основы среды:
|
Ингредиенты |
Количество, г/л |
|
Мясной настой |
300,0 |
|
Гидролизат казеина |
17,5 |
|
Крахмал |
1,5 |
|
Агар-агар |
17,0 |
|
pH (при 25 °С) 7,3 ± 0,2 |
|
Используют готовую основу среды промышленного изготовления указанного состава.
Приготовление осуществляют согласно прописи на этикетке. Растворить порошкообразную сухую основу в дистиллированной воде. Подогреть до кипения для полного растворения частиц. Стерилизовать автоклавированием при температуре 121 °С в течение 15 мин. Остудить до 45 - 50 °С. Добавить 70 мл стерильной дефибринированной крови барана, тщательно перемешать и разлить в стерильные чашки Петри.
4.2.2.7. Трехсахарный железосодержащий агар (для идентификации).
Допускается использование двух модификаций среды: ТСА и среды № 13.
Состав сред:
|
Ингредиенты, г/л |
Среды: |
|
|
№ 13 |
ТСА |
|
|
Пептический перевар животной ткани |
10,0 |
20,0 |
|
Гидролизат казеина |
10,0 |
- |
|
Дрожжевой экстракт |
3,0 |
3,0 |
|
Мясной экстракт |
3,0 |
3,0 |
|
Лактоза |
10,0 |
10,0 |
|
Сахароза |
10,0 |
10,0 |
|
Глюкоза |
1,0 |
1,0 |
|
Натрия хлорид |
5,0 |
5,0 |
|
Железа сульфат |
0,2 |
- |
|
Железа (III) цитрат |
- |
0,3 |
|
Натрия тиосульфат |
0,3 |
- |
|
Натрия тиосульфат (⋅5Н2O) |
- |
0,3 |
|
Феноловый красный |
0,024 |
0,024 |
|
Агар-агар |
12,0 |
12,0 |
|
pH (при 25 °С) 7,4 ± 0,2 |
|
|
Используют готовые основы сред промышленного изготовления с указанным составом.
Приготовление осуществляют согласно прописям на этикетках. Растворить порошкообразную сухую основу в дистиллированной воде. Подогреть до кипения для полного растворения частиц. Тщательно перемешать и разлить в пробирки для тестирования. Стерилизовать автоклавированием при температуре 121 °С в течение 15 мин. Остудить среду в наклонном положении при комнатной температуре для формирования скоса и столбика высотой 2,5 см.
5. Отбор и подготовка проб пищевых продуктов для анализа
5.1. Общие положения по отбору и подготовке проб
Отбор и подготовку проб продукции производят в соответствии с ГОСТ 26668-85 «Методы отбора проб для микробиологических анализов», ГОСТ 26669-85 «Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов», МУК 4.2.577-96 «Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов», ГОСТ Р 51446-99 (ИСО 7218-96), а также в соответствии с действующими ГОСТ и НД на конкретные виды продуктов.
Масса или объем отбираемых проб должны быть достаточными для проведения исследования и минимально вдвое превышать размер аналитического(их) образца(ов).
Учитывая, что кампилобактерии чрезвычайно чувствительны к воздействию факторов окружающей среды, таких как высушивание, снижение pH, нагревание, воздействие УФ лучей и длительное хранение, при отборе проб пищевых продуктов на наличие бактерий рода Campylobacter необходимо соблюдать следующие правила:
- отбор проб и их доставку в лабораторию для исследования проводят в максимально короткие сроки, по возможности не более 1 часа;
- отбор проб твердых пищевых продуктов осуществляют в стерильные газонепроницаемые пакеты, удаляют избыток воздуха, герметизируют путем перекручивания свободных краев пакета и фиксации при помощи обхвата. Пробы жидких продуктов отбирают в герметично закрывающуюся стерильную стеклянную посуду;
- доставку проб в лабораторию осуществляют в термоконтейнере с охлаждающими вкладышами (сумке-холодильнике);
- до проведения анализа пробы сохраняют в защищенном от света месте, при температуре (5 ± 1) °С. Пробы замороженных продуктов размораживают в защищенном от света месте при температуре (5 ± 1) °С в течение не более 18 ч, или в течение 1 ч при температуре (19 ± 1) °С;
- после вскрытия упаковки пробы подвергают исследованию немедленно, приготовление объединенной пробы, навесок продукта и посев осуществляют в максимально короткие сроки. Для приготовления объединенной пробы продукт измельчают, но активное перемешивание измельченной пробы не рекомендуется.
5.2. Отбор и
подготовка проб мяса птицы и птицепродуктов, мяса,
мясных полуфабрикатов, колбасных изделий и других мясопродуктов
Отбор и подготовку проб мяса птицы и птицепродуктов, мяса, мясных полуфабрикатов, колбасных изделий и других мясопродуктов проводят по ГОСТ Р 50396.0-92 «Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы отбора проб и подготовка к микробиологическим исследованиям».
Отбор и подготовку проб мяса, субпродуктов, мясных полуфабрикатов, колбасных изделий и других мясных продуктов проводят по ГОСТ 21237 «Мясо. Методы бактериологического анализа», ГОСТ 4288 «Изделия кулинарные и полуфабрикаты из рубленного мяса», ГОСТ 9958, ГОСТ 9792 «Колбасные изделия и продукты из свинины, баранины, говядины и мяса других видов убойных животных и птиц».
Отобранные образцы измельчают в перистальтическом гомогенизаторе или вручную в фарфоровой ступке, доводят до однородной консистенции по ГОСТ 26669-85, из измельченной суспензии составляют навеску необходимой массы.
5.3. Отбор и подготовка проб молока, молочных
продуктов,
сыров, мороженого
Отбор и подготовку проб проводят согласно ГОСТ 9225-84 «Молоко и молочные продукты. Методы микробиологического анализа».
Кисломолочные продукты, сыр, творог, творожные изделия и пастообразные продукты тщательно измельчают и подвергают нейтрализации; масло сливочное и мороженое растапливают при температуре не выше 45 °С до сметанообразной консистенции, после чего от пробы отбирают навеску не менее 50 г, которую центрифугируют при 20000 х g (с охлаждением) в течение 40 мин. Удаляют супернатант и слой жира, исследованию подвергают седимент (осадок).
6. Создание микроаэрофильных условий культивирования
Оптимальная газовая среда для культивирования бактерий рода Campylobacter имеет состав: двуокись углерода (СO2) - 10 %, кислород (O2) - 5 %, азот (N2) - 85 %. Для ее создания можно использовать следующие способы.
6.1. С использованием газовой смеси вышеуказанного состава заводского изготовления.
6.1.1. Вариант 1. Посевы помещают в систему для анаэробного культивирования (анаэростат), закрывают, откачивают воздух до уровня, соответствующего отметкам минус 0,9 - 1,0 атмосфера по шкале манометра. Процедуру откачивания содержимого и заполнения пространства газовой смесью необходимо повторить дважды, после чего анаэростат помещают в термостат с температурой (42 ± 1) °С.
6.1.2. Вариант 2. Посевы помещают в контейнеры для анаэробного культивирования определенного объема, затем в стерильные газонепроницаемые пакеты. Пакеты заполняют газовой смесью, вручную вытесняют избыток смеси из пакета. Заполнение-вытеснение повторяют дважды, заканчивают заполнением, после чего пакет герметизируют, перекручивая свободные края с последующей фиксацией их специальным зажимом или резиновым обхватом и помещают в термостат с температурой (42 ± 1) °С.
6.2. С использованием газогенераторных пакетов для кампилобактерий, которые после вскрытия помещают либо в анаэростат, либо в газонепроницаемые пакеты. Газогенераторные пакеты рассчитаны на определенный объем анаэростата (газонепроницаемых пакетов), что необходимо учитывать при их применении. Инкубирование посевов проводят при температуре (42 ± 1) °С.
6.3. Культивирование посевов допускается осуществлять также в анаэробном инкубаторе или СO2-инкубаторе, позволяющем поддерживать температуру (42 ± 1) °С.
7. Проведение анализа
7.1. Качественное определение
Метод определения бактерий рода Campylobacter предусматривает определение их наличия или отсутствия в навеске (порции) пищевых продуктов определенной массы или объема (10, 25 или 50 г (см3), для чего необходимое количество подготовленной пробы вносят в 9-кратный объем обогащающего бульона по п.п. 4.2.1.1 или 4.2.1.2 (при исследовании жидких молочных продуктов супернатант, приготовленный согласно п. 5.3, предварительно растворяют в 10 мл обогащающего бульона и добавляют к 90 мл обогащающего бульона). Полученное раз-ведение предварительно инкубируют в течение 4 ч при 37 °С, а в случае посевов замороженных продуктов или продуктов, которые хранились более 10 дней, - в течение 3 ч при температуре 32 °С, потом 2 ч при температуре 37 °С. Затем посевы продолжают инкубировать в течение 18 - 24 ч при температуре 42 °С. После этого делают пересев петлей на поверхность агара по п.п. 4.2.1.1, 4.2.2.2 или 4.2.2.3 и вновь инкубируют, при температуре 42 °С. Длительность инкубации посевов может составлять до 48 ч, при необходимом ежесуточном контроле роста культуры. Инкубация на всех этапах осуществляется в микроаэрофильных условиях.
Основные этапы исследования пищевых продуктов для качественного определения бактерий рода Campylobacter представлены в табл. 1.
Схема процедуры качественного определения кампилобактерий
|
№№ этапа |
Название этапа |
Суть процедуры |
|
1 |
Приготовление навески |
Асептическое взвешивание или отмеривание необходимого объема пробы |
|
2 |
Посев |
В 9-кратный объем жидкой среды - обогащающего бульона, инкубация в микроаэрофильных условиях |
|
3 |
Предварительное обогащение (в микроаэрофильных условиях) |
3.1. для продуктов замороженных и хранившихся более 10 дней - 3 ч при 32 °С, затем 2 ч при 37 °С; 3.2. для прочих продуктов - 4 ч при 37 °С |
|
4 |
Обогащение (в микроаэрофильных условиях) |
Изменение температуры инкубации на 42 °С - термостатирование в течение 18 - 24 ч |
|
5 |
Пересев |
Инокуляция на поверхность селективного агара и инкубация в микроаэрофильных условиях 24 - 48 ч при 42 °С |
|
6 |
Подтверждение |
Идентификация выросших колоний до рода и выдача предварительного ответа |
|
7 |
Учет результатов |
Идентификация колоний до вида и выдача окончательного ответа |
7.2. Количественное определение
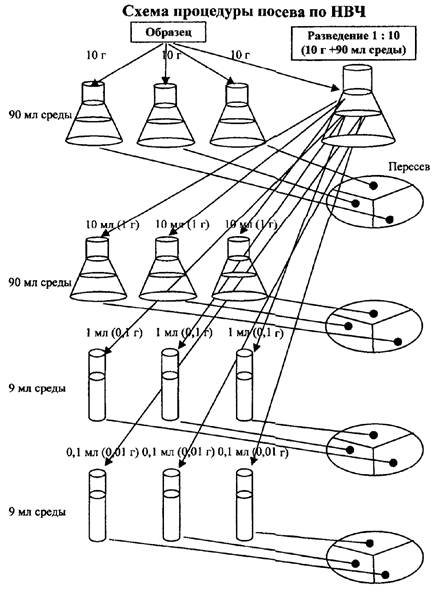
При количественном анализе общая масса (объем) навески должна быть не менее 100 г (см3).
Из подготовленной по п. 5.2 пробы отбирают 4 навески (порции) продукта массой 10 г (см3) каждая для анализа. Производят посев каждой из трех навесок (порций) в 90 мл обогащающего бульона, осторожно перемешивают. Перемешивание продукта производят способом, исключающим попадание пузырьков воздуха. Перемешивание пипеткой путем вдувания и выдувания воздуха не допускается.
Из четвертой навески (порции) массой (объемом) 10 г (см3) готовят разведение 1:10, для посевов десятикратно убывающих количеств продукта - 1,0, 0,1 и ниже. Для этого из колбы с полученным разведением 1:10 переносят последовательно по 10 мл в три колбы с 90 мл и по 1 мл в три пробирки с 9 мл обогащающего бульона. При необходимости (при предполагаемом высоком содержании кампилобактерий в продукте) производят посев по 0,1 мл из разведения 1:10 в три пробирки с 9 мл обогащающего бульона. Производят перемешивание вышеупомянутым способом. Для каждого разведения используют новую стерильную пипетку.
Соотношение между количеством высеваемого продукта или его разведения с питательной средой должно составлять не менее 1:9.
Таким образом, от каждого из испытуемых образцов должно быть засеяно не менее трех масс (объемов) продукта в трехкратной повторности: 10 г (см3)×3; 1 г (см3)×3; 0,1 г (см3)×3; а при необходимости - четвертая в количестве 0,01 г (см3)×3 раза.
Допускается использовать для посева только разведения продукта, при этом засеянные массы будут составлять 1 г (см3) (трехкратно); 0,1 г (трехкратно); 0,01 г (трехкратно).
Дальнейший анализ всех исследуемых масс (объемов) проводят по схеме качественного определения кампилобактерий (см. табл. 1, этапы 3 - 7), при этом пересев каждой из засеянных колб (пробирок) на плотные среды допускается осуществлять на одну чашку Петри с делением на 3 сектора. Схема процедуры посева приведена в прилож. 1.
8. Отбор колоний и идентификация выделенных культур
Манипуляции по отбору колоний для исследования и их пересев необходимо проводить в максимально короткие сроки.
Кампилобактерии при росте в микроаэрофильных условиях на поверхности селективного агара образуют мелкие округлые колонии или колонии средних размеров, неправильной формы, как бы растекающиеся по ходу штриха, серые или полупрозрачные с сероватым оттенком, гладкие, влажные, блестящие (в жидких и полужидких средах кампилобактерии дают гомогенное помутнение или голубовато-серую пленку).
Отбирают 5 типичных или подозрительных на принадлежность к Campylobacter spp. изолированных колоний (если число таких колоний менее пяти, то отбирают все колонии), суспендируя каждую из колоний в 1 мл бульона для бруцелл или любой жидкой среды без антибиотиков и крови.
Идентификацию осуществляют в два этапа: для подтверждения принадлежности к роду (I) и определения вида (II) кампилобактерий.
8.1. Определение принадлежности к роду Campylobacter
8.1.1. Окраска по Грому. Бактерии рода Campylobacter - грамотрицательные мелкие, тонкие палочки с одним или более завитками. В мазке имеют вид запятой, буквы S, либо галочки при соединении двух клеток. В стареющих культурах (через 48 - 72 ч инкубации на твердой среде) могут обнаруживаться кокковидные клетки.
8.1.2. Подвижность. Определяют при микроскопии раздавленной капли с помощью фазово-контрастного устройства. Не следует разводить образец в дистиллированной воде, т.к. кампилобактерии теряют в ней подвижность, разводить необходимо изотоническим раствором хлорида натрия или любой жидкой средой без антибиотиков и крови. Кампилобактерии, взятые с агара, имеют волнообразную подвижность, из бульона - спиралевидную. До 10 % штаммов могут быть неподвижны.
Обнаружение в пересевах на твердой селективной среде колоний с типичными культуральными свойствами, в которых обнаруживаются клетки с типичной для кампилобактерий морфологией, обладающие подвижностью, позволяет дать предварительный ответ о наличии бактерий рода Campylobacter в исследуемой пробе на 3 - 4 сутки от начала исследования (I этап).
Для выдачи окончательного ответа необходимо проведение тестов идентификации, которые включают в себя подтверждение принадлежности к роду и определение принадлежности к термотолерантным видам Campylobacter: на способность к росту при температуре (+)25 °С, наличие каталазы, оксид азы, способности гидролизовывать гиппурат, утилизировать углеводы и продуцировать сероводород при росте на трехсахарном агаре с солями железа, а также определение чувствительности к налидиксовой кислоте и цефалотину (II этап).
Колонии, в которых обнаружены типичные клетки кампилобактерий, пересевают петлей из взвеси в бульоне для бруцелл на поверхность кровяного Колумбийского агара для получения чистой культуры и инкубируют при 42 °С в течение 24 - 48 ч в микроаэрофильной атмосфере.
8.2. Подтверждающие тесты родовой и видовой идентификации
8.2.1. Рост при 25 °С. Для определения способности к росту при температуре 25 °С исследуемую культуру засевают петлей в пробирку с бульоном для бруцелл, инкубируют при температуре 25 °С в микроаэрофильных условиях, в течение 3 - 5 сут. Учет проводят по наличию или отсутствию видимого роста. Термофильные бактерии рода Campylobacter не способны к росту при температуре 25 °С.
8.2.2. Тест на оксидазу. Постановку реакции можно осуществлять двумя нижеописанными способами:
1. Полоску фильтровальной бумаги смачивают 2 - 3 каплями оксидазного реагента. На обработанную реактивом полоску платиновой петлей наносят исследуемую культуру. При появлении сиреневой, фиолетовой или глубокой синей окраски в течение 10 с реакцию считают положительной.
2. Используют готовые бумажные диски, пропитанные оксидазным реагентом. Учет результатов реакции проводят согласно инструкции изготовителя.
Бактерии рода Campylobacter оксидазоположительны. Не рекомендуется проводить постановку данной реакции с колониями, выращенными на угольном агаре, т.к. они могут не давать характерной окраски (сиреневой, фиолетовой или синей).
8.2.3. Тест на каталазу. В каплю перекиси водорода на чистом предметном стекле вносят петлю исследуемой культуры. Появление пузырьков воздуха свидетельствует о положительной реакции. Бактерии рода Campylobacter каталазоположительны, за исключением редко встречающегося вида С. upsaliensis.
8.2.4. Гидролиз гиппурата. В пробирку с 0,4 мл раствора гиппурата вносят полную петлю исследуемой чистой культуры. Для исследования берут только хорошо изолированные колонии. Для полного смешивания инкубируют на водяной бане при температуре 37 °С в обычной атмосфере. Через 2 ч добавляют 0,2 мл нингидринового реактива, перемешивают и дополнительно инкубируют на водяной бане в течение 10 мин. О положительной реакции свидетельствует появление фиолетового или темно-синего окрашивания. К гидролизу гиппурата способны Campylobacter jejuni, представители других видов рода Campylobacter не ферментируют гиппурат.
8.2.5. Утилизация глюкозы, лактозы, сахарозы и продукция сероводорода (H2S). Способность выделенных бактерий утилизировать сахара и продуцировать сероводород изучают по росту на скошенном столбике трехсахарного железосодержащего агара. Обильно засевают чистой культурой исследуемого микроорганизма поверхность скошенной части ТСА с последующим уколом в столбик среды. Инкубирование осуществляют в микроаэробных условиях при температуре 42 °С в течение 24 ч и продолжают, если необходимо, до 5 дней. Учет результатов проводят по наличию изменения цвета поверхности скошенной части ТСА и цвета столбика среды в пробирке, формированию газа в среде. При неспособности к утилизации сахаров и продукции H2S, цвет поверхности скошенной части ТСА и самого столбика остается неизменным, пузырьки газа и расслоение среды отсутствуют. Появление желтого окрашивания столбика, либо поверхности скошенной части ТСА свидетельствует об утилизации одного из сахаров, газообразования - об утилизации глюкозы, а появление черного окрашивания в толще столбика - о формировании H2S. Бактерии рода Campylobacter не утилизируют углеводы. Продуцировать сероводород могут штаммы вида С. coli (11 - 89 % случаев).
8.2.6. Определение чувствительности к налидиксовой кислоте и цефалотину. Двухсуточную агаровую культуру Campylobacter spp. суспендируют в стерильном физиологическом растворе и стандартизуют по оптическому стандарту мутности на 10 ед. Полученную бактериальную взвесь, содержащую 109 КОЕ/мл, в количестве 1 мл наносят на поверхность агара Мюллера-Хинтона с добавлением 7 % крови барана, равномерно распределяют покачиванием, избыток взвеси отсасывают пастеровской пипеткой. Чашки подсушивают при комнатной температуре в течение 10 - 15 мин. На поверхность инокулированной чашки накладывают диски с цефалотином и налидиксовой кислотой. Чашки инкубируют в микроаэробных условиях при температуре 37 °С в течение 48 - 72 ч. Рост в контакте с диском расценивается как устойчивость, наличие зоны задержки роста любых размеров - как чувствительность. Бактерии рода Campylobacter устойчивы к цефалотину (за исключением видов С. hyointestinalis и С. upsaliensis) и к налидиксовой кислоте (за исключением С. coli и С. upsaliensis). Среди С. jejuni могут быть штаммы как устойчивые, так и чувствительные к налидиксовой кислоте.
8.2.7. Обобщение результатов идентификации
При обобщении результатов идентификации и подтверждении выделенных бактерий к термотолерантным видам Campylobacter spp. пользуются табл. 2.
Свойства бактерий рода Campylobacter
|
Признак |
Вид |
С. jejuni |
С. coli |
C. lari |
C. hyointestinalis |
C. upsaliensis |
|
Рост при 25 °С |
- |
- |
- |
V |
- |
|
|
Гидролиз гиппурата |
+ |
- |
- |
- |
- |
|
|
Продукция H2S |
- |
V |
- |
(+)(1) |
- |
|
|
Продукция каталазы |
+ |
+ |
+ |
+ |
- |
|
|
Продукция оксидазы |
+ |
+ |
+ |
+ |
+ |
|
|
Устойчивость: к налидиксовой кислоте |
S(2) |
S |
R |
R |
S |
|
|
к цефалотину |
R |
R |
R |
S |
S |
|
|
Обозначения: «+» - штаммы положительны в 90 % и более случаев; «-» - штаммы отрицательны в 90% и более случаев; «V» - штаммы положительны от 11 до 89 % случаев; «S» - все штаммы чувствительны; «R» - все штаммы устойчивы; (1) - слабое образование H2S в ТСА за срок менее 3 дней; (2) - есть сообщения о штаммах, устойчивых к налидиксовой кислоте |
||||||
Если бактерии с указанными характеристиками присутствуют по меньшей мере в одной из изученных колоний, считают, что термотолерантные виды Campylobacter в анализируемом образце обнаружены.
Для видовой дифференциации выделенных культур кампилобактерий допускается использовать биохимические тест-системы API CAMPY либо другие аналогичного назначения, имеющие разрешение уполномоченных органов Российской Федерации на их применение. При их использовании следует руководствоваться рекомендациями изготовителя.
8.3. Учет результатов и выдача ответа.
8.3.1. Учет результатов и выдача ответа при качественном определении. Результат оценивают по каждой исследованной пробе продукта определенной массы или объема (10, 25 или 50 г (см3) отдельно. Предварительный ответ выдается с учетом идентификационных тестов по п. 8.1. Окончательный - с учетом идентификационных тестов по п. 8.2. Если в результате проведенного исследования бактерии рода Campylobacter обнаружены, то результат выражают следующим образом: «Бактерии рода Campylobacter обнаружены в 10, 25 или 50 г (см3) продукта». Если не обнаружены: «Бактерии рода Campylobacter не обнаружены в 10,25 или 50 г (см3) продукта».
При необходимости в ответе указывается вид бактерий рода Campylobacter
8.3.2. Учет результатов и выдача ответа при количественном определении. Результат оценивают по каждой исследованной пробе продукта отдельно. Регистрируют число положительных результатов в колбах и пробирках с посевами трех последовательно убывающих масс (объемов) продукта, в которых подтверждено наличие бактерий рода Campylobacter при пересеве на твердые питательные среды и последующей идентификации. В зависимости от получаемой комбинации положительных и отрицательных результатов для каждого значения массы (объема) продукта составляют трехзначное число (индекс), по которому, используя табл., приведенную в прилож. 2, находят наиболее вероятное число (НВЧ) кампилобактерий, соответствующее их содержанию в 1 г (см3) продукта.
Для окончательного определения НВЧ бактерий рода Campylobacter в анализируемом образце учитывают значение первой выбранной для расчета индекса НВЧ массы (объема) продукта с подтвержденным наличием кампилобактерий. Так, в случае, если расчет ведется от посева массы (объема) 10 г (см3)(×3) продукта, количество кампилобактерий в 1 г (см3) образца рассчитывается путем деления числа НВЧ, взятого из таблицы соответственно установленному индексу, на 10. В случае, когда в качестве первого значения для расчета выбрана масса (объем) 1 г (см3)(×3), количество кампилобактерий в 1 г (см3) образца эквивалентно числу НВЧ по таблице.
ПРИМЕР: Кампилобактерий обнаружены в трех повторностях при посеве 1 г (то есть по 10 мл из разведения 1:10), в трех повторностях при посеве 0,1 г (по 1 мл из разведения 1:10) и в одной - при посеве 0,01 г (по 0,1 мл из разведения 1:10).
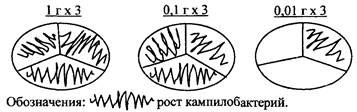
Результат по числу секторов с подтвержденным ростом бактерий рода Campylobacter из трех выбранных масс записывается как индекс 3:3:1, что соответствует НВЧ, равному 46 (табл., прилож. 2). Соответственно, наиболее вероятное число бактерий рода Campylobacter составляет 46 КОЕ в 1 г продукта.
Если НВЧ менее чем 0,3 КОЕ в 1 г (см3) (индекс 0:0:0) в случае, когда в качестве первого значения для расчета выбрана масса (объем) 1 г (см3)(×3), то результат должен выражаться следующим образом: «Менее 1 КОЕ в 1 г (см3)». В случае, когда в качестве первого значения для расчета выбрана масса (объем) 10 г (см3)(×3), то число НВЧ должно быть поделено на 10, и результат должен выражаться как «Менее 0,1 КОЕ в 1 г (см3)».
Если НВЧ составляет величину более чем 110 КОЕ/г (см3) (индекс 3:3:3), исследование целесообразно повторить, используя более высокие разведения образца, в которых исходная концентрация продукта будет в 10 или 100 раз ниже, чем в первоначально выбранном значении.
При необходимости ответа о количестве в пищевом продукте кампилобактерий определенного вида обязательно проведение исследований и учет результатов по п. 8.2.
9. Требования безопасности
Выявление и определение бактерий рода Campylobacter в пищевых продуктах проводят в соответствии с СанПиН 1.2.731-99 «Безопасность работы с микроорганизмами III - IV групп патогенности и гельминтами».
Библиографические данные
1. ГОСТ 26668-85 «Методы отбора проб для микробиологических анализов».
2. ГОСТ 26669-85 «Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов».
3. ГОСТ Р 50396.0 «Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы отбора проб и подготовка к микробиологическим исследованиям».
4. ГОСТ 21237-75 «Мясо. Методы бактериологического анализа».
5. ГОСТ 4288-76 «Изделия кулинарные и полуфабрикаты из рубленого мяса. Правила приемки и методы испытания».
6. ГОСТ 9958-81 «Изделия колбасные и продукты из мяса. Методы бактериологического анализа».
7. ГОСТ 9792-73 «Колбасные изделия и продукты из свинины, баранины, говядины и мяса других видов убойных животных и птиц. Правила приемки и методы отбора проб».
8. ГОСТ 9225-84 «Молоко и молочные продукты. Методы микробиологического анализа».
9. ГОСТ Р 51446-99 (ИСО 7218-96) «Продукты пищевые. Общие правила микробиологических исследований».
10. СанПиН 1.2.731-99 «Безопасность работы с микроорганизмами III - IV групп патогенности и гельминтами».
11. Пособие для врачей ЦНИИ эпидемиологии. Микробиологическая диагностика заболеваний, вызванных микроаэрофильными изогнутыми бактериями. - М., 2002. - 42 с.
12. ISO 10272:1995 (Е) «Microbiology of food and animal feeding stuffs-Horizontal method for detection of thermotolerant Campylobacter» c дополнениями 1996 и 1997 гг. 17 стр.
13. FDA/CFSAN Bacteriological Analytical Manual. Chapter 7. «Isolation of Campylobacter Species from Food and Water», 2001, 20 p.
Приложение 1
Схема процедуры посева по НВЧ
Приложение 2
Таблица
Таблица для расчета наиболее вероятного числа
микроорганизмов
(по ГОСТ
Р 51446-99)
|
Число секторов с подтвержденным ростом Campylobacter spp. (из трех выбранных значений массы (объема) |
НВЧ КОЕ/г (см3) |
Действительное число микроорганизмов в 1 г (см3) с вероятностью |
|||||
|
95 % |
99 % |
||||||
|
1,0 |
0,1 |
0,01 |
от |
до |
от |
до |
|
|
0 |
0 |
0 |
< 0,30 |
0,00 |
0,94 |
0,00 |
1,40 |
|
0 |
0 |
1 |
0,30 |
0,01 |
0,95 |
0,00 |
1,40 |
|
0 |
1 |
0 |
0,30 |
0,01 |
1,00 |
00 |
1,60 |
|
0 |
1 |
1 |
0,61 |
0,12 |
1,7 |
0,05 |
2,50 |
|
0 |
2 |
0 |
0,62 |
0,12 |
1,70 |
0,05 |
2,50 |
|
0 |
3 |
0 |
0,94 |
0,35 |
3,3 |
0,18 |
4,60 |
|
1 |
0 |
0 |
0,36 |
0,02 |
1,70 |
0,05 |
2,50 |
|
1 |
0 |
1 |
0,72 |
0,12 |
1,70 |
0,05 |
2,50 |
|
1 |
0 |
2 |
1,1 |
0,4 |
3,5 |
0,2 |
4,6 |
|
1 |
1 |
0 |
0,74 |
0,13 |
2,00 |
0,06 |
2,7 |
|
1 |
1 |
1 |
1,1 |
0,4 |
3,5 |
0,2 |
4,6 |
|
1 |
2 |
0 |
1,1 |
0,4 |
3,5 |
0,2 |
4,6 |
|
1 |
2 |
1 |
1,5 |
0,5 |
3,8 |
0,2 |
5,2 |
|
1 |
3 |
0 |
1,6 |
0,5 |
3,8 |
0,2 |
5,2 |
|
2 |
0 |
0 |
0,92 |
0,15 |
3,50 |
0,07 |
4,60 |
|
2 |
0 |
1 |
1,4 |
0,4 |
3,5 |
0,2 |
4,6 |
|
2 |
0 |
2 |
2,0 |
0,5 |
3,8 |
0,2 |
5,2 |
|
2 |
1 |
0 |
1,5 |
0,4 |
3,8 |
0,2 |
5,2 |
|
2 |
1 |
1 |
2,0 |
0,5 |
3,8 |
0,2 |
5,2 |
|
2 |
1 |
1 |
2,0 |
0,5 |
3,8 |
0,2 |
5,2 |
|
2 |
1 |
2 |
2,7 |
0,9 |
9,4 |
0,5 |
14,2 |
|
2 |
2 |
0 |
2,1 |
0,5 |
4,0 |
0,2 |
5,6 |
|
2 |
2 |
1 |
2,8 |
0,9 |
9,4 |
0,5 |
14,2 |
|
2 |
2 |
2 |
3,5 |
0,9 |
9,4 |
0,5 |
14,2 |
|
2 |
3 |
0 |
2,9 |
0,9 |
9,4 |
0,5 |
14,2 |
|
2 |
3 |
1 |
3,6 |
0,9 |
9,4 |
0,5 |
14,2 |
|
3 |
0 |
0 |
2,3 |
0,5 |
9,4 |
0,3 |
14,2 |
|
3 |
0 |
1 |
3,8 |
0,9 |
10,4 |
0,5 |
15,7 |
|
3 |
0 |
2 |
6,4 |
1,6 |
18,1 |
1,0 |
25,0 |
|
3 |
1 |
0 |
4,3 |
0,9 |
18,1 |
0,5 |
25,0 |
|
3 |
1 |
1 |
7,5 |
1,7 |
19,9 |
1,1 |
27,0 |
|
3 |
1 |
2 |
12 |
3 |
36 |
2 |
44 |
|
3 |
1 |
3 |
16 |
3 |
38 |
2 |
52 |
|
3 |
2 |
0 |
9,3 |
1,8 |
36,0 |
1,2 |
43,0 |
|
3 |
2 |
1 |
15 |
3 |
38 |
2 |
52 |
|
3 |
2 |
2 |
21 |
3 |
40 |
2 |
56 |
|
3 |
2 |
3 |
29 |
9 |
99 |
5 |
152 |
|
3 |
3 |
0 |
24 |
4 |
99 |
5 |
152 |
|
3 |
3 |
1 |
46 |
9 |
198 |
5 |
283 |
|
3 |
3 |
2 |
110 |
20 |
400 |
10 |
570 |
|
3 |
3 |
3 |
> 110 |
|
|
|
|