РОССИЙСКОЕ
АКЦИОНЕРНОЕ ОБЩЕСТВО ЭНЕРГЕТИКИ
И ЭЛЕКТРИФИКАЦИИ «ЕЭС РОССИИ»
ДЕПАРТАМЕНТ НАУКИ И ТЕХНИКИ
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ
СОДЕРЖАНИЯ НАТРИЯ
В ТЕХНОЛОГИЧЕСКИХ ВОДАХ ТЭС
ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ
С ПОМОЩЬЮ ЛАБОРАТОРНЫХ
ИОНОМЕРОВ
РД 34.37.528-94
![]()
ОРГРЭС
Москва 1995
РАЗРАБОТАНО Акционерным обществом «Фирма по наладке, совершенствованию технологии и эксплуатации электростанций и сетей ОРГРЭС»
ИСПОЛНИТЕЛИ Р.Л. МЕДВЕДЕВА, И.В. НИКИТИНА (ВХЦ); А.Г. АЖИКИН, В.И. ЧУБАТЫЙ, Л.В. СОЛОВЬЕВА, С.А. СПОРЫХИН, В.И. ОСИПОВА (ЦИТМ)
УТВЕРЖДЕНО Департаментом науки и техники РАО «ЕЭС России» 14.04.94 г.
Первый заместитель начальника А.П. БЕРСЕНЕВ
|
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ |
РД 34.37.528-94 |
Срок действия установлен
с 01.01.94 г.
до 01.01.99 г.
1. НАЗНАЧЕНИЕ И ОБЛАСТЬ ПРИМЕНЕНИЯ
1.1. Методика устанавливает порядок определения содержания натрия в технологических водах ТЭС (далее по тексту - в водах), требования к методу и средствам измерений, алгоритмы подготовки, проведения измерений и обработки результатов определения.
1.2. Методика обеспечивает получение достоверных характеристик погрешности определения содержания натрия при принятой доверительной вероятности и способы их выражения.
1.3. Результаты определения содержания натрия используются. Для контроля за качеством технологических вод тепловых электростанций, которое регламентируется «Правилами технической эксплуатации электрических станций и сетей» (М. Энергоатомиздат, 1989).
2. СРЕДСТВА ИЗМЕРЕНИЙ, ВСПОМОГАТЕЛЬНЫЕ УСТРОЙСТВА, ПОСУДА, РЕАКТИВЫ И РАСТВОРЫ
2.1. Иономер лабораторный И-130
Диапазон измерений в режиме измерении электродвижущей силы (ЭДС) от минус 2000 до плюс 2000 мВ.
Пределы допустимых значений основной абсолютной погрешности
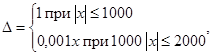
где х - значение измеряемой величины, мВ.
Возможно использование другого прибора, метрологические характеристики которого не хуже, чем у указанного мономера.
2.2. Весы лабораторные аналитические ВЛР-200.
Диапазон измерения 0 ÷ 200 г.
Класс точности 2. Цена деления 1 мг.
2.3. Термометр, лабораторный ТЛ-2. Цена деления 1 °С.
2.4. Натрий-селективный электрод ЭС-10-07 (ТУ-25-0519.072-86). Электрод предназначен для измерения активной концентрации ионов натрия в водных растворах. Потенциал электрода в растворе хлористого натрия с массовой долей натрия 0,1 моль/дм3 при температуре 25 °С относительно хлор серебряно го электрода равен (90 ± 20) мВ.
Присутствие ионов кальция и магния не мешает определению натрия, если массовая доля их не превышает массовой доли ионов натрия соответственно в 10 и 500 раз.
Ионы водорода мешают работе Na-селективного электрода. Для нормальной работы электрода концентрация ионов натрия должны превышать концентрацию ионов водорода в 103 - 104 раз, поэтому при изменении малых количеств ионов № необходимо поддерживать рН контролируемой воды в пределах 10,3 ± 0,5, что осуществляется насыщением анализируемой воды парами аммиака.
Для приведения в рабочее состояние новый электрод следует замочить в 0,1 моль/дм3 растворе хлористого натрия в течение 2 мес. Нельзя допускать высыхания электрода. Между анализами его следует оставлять, в ячейке или полиэтиленовом стакане с обессоленной водой, а на длительный срок - в 0,1 моль/дм3 растворе хлористого натрия.
2.5. Вспомогательный хлорсеребряный электрод ЭВЛ-1, МЗ (ТУ 25.05.2181-77).
2.6. Проточная ячейка, изготовленная из органического стекла.
2.7. Устройство для подщелачивания пробы аммиачным паром, состоящее из полиэтиленовой банки вместимостью 0,5 л с плотно закрытой крышкой и силиконового шланга, средняя часть которого находится внутри сосуда, а концы выведены наружу через отверстия в пробке. Банка заполнена 25 %-ным раствором аммиака.
2.8. Колбы мерные:
тип 2-1900-2 (ГОСТ 1770-74); тип 2-500-2 (ГОСТ 1770-74).
Пипетки:
тип 6-2-50 (ГОСТ 1770-74).
2.9. Вода обессоленная (ОСТ 34-70-953.2-88) с удельной электрической проводимостью не более 0,1 мкСм/см.
2.10. Для приготовления стандартного раствора используется фиксанал 0,1 и NaCl ОСЧ МРТУ 6-09-292-70. Массовая концентрация натрия в этом растворе составляет 2,3 г/дм3. (При отсутствии фиксанала используется хлорид натрия ХЧ ГОСТ 4233-77). Навеска 5,85 г хлористого натрия, предварительно высушенного в течение 1 - 2 ч при температуре 110 °С, растворяется в обессоленной воде, переносится в мерную колбу вместимостью 1 л и доводится до метки. Этот раствор содержит 2,3 г/дм3 натрия. Из основного раствора последующим разбавлением готовятся растворы меньших концентраций. Все растворы готовятся на обессоленной воде.
3. МЕТОД ИЗМЕРЕНИЙ
3.1. Метод основан на измерении ЭДС электрохимической ячейки, в которую помещается дистиллированная вода или анализируемый раствор и электродная система, состоящая из измерительного (Na-селективного) электрода и электрода сравнения. Электродвижущая сила, развиваемая электродной системой, прямо пропорциональна определяемой величине pNa.
Зависимость потенциала электрода от активности потенциал-образующих ионов в растворе может быть выражена уравнением Нернста
![]() (1)
(1)
где а - активная концентрация потенциал образующих ионов, г-ион/дм3;
Е0 - нормальный или стандартный электродный потенциал, численно равный Е при а = 1;
R - универсальная газовая постоянная, равная 8,314 Дж/(град ∙ моль);
Т - абсолютная температура, К;
n - число электронов, переносимых в процессе реакции, или заряд потенциалобразующего иона;
F - число Фарадея, равное 96500 Кл.
В сильно разбавленных водных растворах, т.е. в водах типа конденсата, активность ионов практически равна их концентрации. В этом случае, приняв температуру анализируемого раствора (25 ± 1) °С и выразив постоянные R и F через их численные значения, а натуральные логарифмы через десятичные, можно получить упрощенное выражение уравнения Нернста
где С - концентрация потенциалобразующих ионов, т.е. натрия.
Таким образом, ЭДС электродной системы в анализируемом растворе связана с концентрацией ионов натрия логарифмической зависимостью. Для удобства используется величина
![]() (3)
(3)
где CNa - концентрация ионов натрия, моль/дм3.
3.2. Метод позволяет контролировать содержание ионов натрия в воде в диапазоне концентраций от 0,7 до 2,3 ∙ 106 мкг/дм3.
3.3 Продолжительность определения в единичной пробе при готовых калибровочных растворах и настроенной аппаратуре составляет 3 - 5 мин.
Температура контролируемого раствора в ячейке (25 ± 1) °С.
4. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
4.1. Работа с иономером должна проводиться в соответствии с инструкцией по эксплуатации.
4.2. При приготовлении и использовании растворов стандартных образцов следует выполнять требования безопасности в соответствии с ГОСТ 12.1.005-76 и ГОСТ 12.1.007-76.
4.3. При заполнении сосуда с концентрированным аммиаком следует соблюдать требования техники безопасности в соответствии с «Правилами техники безопасности при эксплуатации тепломеханического оборудования электростанций и тепловых сетей» (М.: Энергоатомиздат, 1985).
5. ТРЕБОВАНИЯ К КВАЛИФИКАЦИИ ПЕРСОНАЛА
К выполнению определений допускаются лица, имеющие среднее образование и практический опыт работы в химической лаборатории не менее 3 мес.
6. ПОДГОТОВКА К ВЫПОЛНЕНИЮ ОПРЕДЕЛЕНИЯ
6.1. Проба воды отбирается непосредственно перед определением в плотно закрытые полиэтиленовые банки, предварительно промытые анализируемой водой, вместимостью не менее 0,5 л. Температура пробы при определении концентрации натрия должна быть (25 ± 1) °С.
6.2. Подготовить к работе иономер в соответствии с заводской инструкцией, включить шкалу - мВ. Следует помнить, что потенциал электрода имеет как положительное, так и отрицательное значение в зависимости от концентрации ионов натрия.
6.3. Проверка работоспособности электрода осуществляется следующим образом.
Определение рабочих характеристик электроде (потенциала и крутизны электродной функции), а также работу с растворами с массовой концентрацией натрия более 2 ∙ 103 мкг/дм3 можно проводить в статических условиях. Ионселективный и вспомогательный электроды помещаются в полиэтиленовый стакан, заполненный 0,1 М раствором хлористого натрия, определяется потенциал ион-селективностью электрода, который, согласно паспортным данным, должен составлять (90 ± 20) мВ.
Для определения крутизны электродной функции данного электрода Ке определяются потенциалы электрода в растворах хлористого натрия концентраций 0,01 М, 0,001 М и 0,0001 М. Из предыдущих значений потенциалов вычитаются последующие:
Е0,1М - Е0,01М = K1;
Е0,01М - Е0,001М = K2;
Е0,001М - Е0,0001М = K3;
За Ке принимается среднее значение из трех полученных данных:
![]() (4)
(4)
Согласно уравнению (2), разность этих потенциалов при изменении знамения pNa на 1 должна составлять 0,59 мВ. Реально это значение может отличаться от теоретического на 3 - 7 мВ, но оно должно быть постоянным на всех диапазонах. Затем диапазоны разбиваются на отрезки, например 0,05pNa, эти значения рассчитываются, логарифмируются и сводятся в таблицу. Эта таблица может быть продлена до значений pNa = 7,5, поскольку крутизна электродной функции данной электродной системы остается постоянной на всех диапазонах pNa, а приготовление сильно разбавленных растворов с концентрацией 10-6 - 10-5 г/дм3 может привести к значительной ошибке разбавления.
7. ВЫПОЛНЕНИЕ ОПРЕДЕЛЕНИЯ
7.1. Собирается установка в соответствии с рисунком (соединяется устройство для подготовки пробы с проточной ячейкой), и вся система заполняется обессоленной водой. Электроды промываются обессоленной водой и помещаются в проточную ячейку. Первым на пути движения пробы ставится ион-селективный электрод.
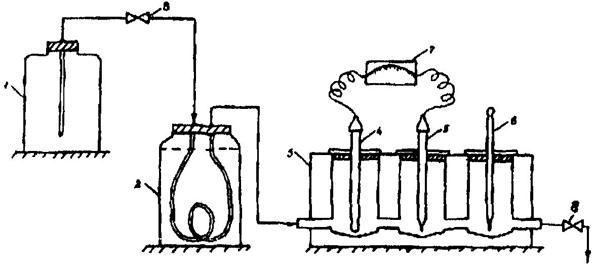
Установка для определения содержания натрия потенциометрическим методом:
1 - сосуд с обессоленной водой или анализируемой пробой; 2 - сосуд для подщелачивания пробы парами аммиака; 3 - проточная ячейка; 4 - измерительный электрод; 5 - электрод сравнения; 6 - термометр; 7 - иономер; 8 - зажим
7.2. Устанавливается скорость протока обессоленной воды 40 - 50 мл/мин. Проверяется на Выходе значение рН и при необходимости регулируется до 10,3 ± 0,5 длиной погружения в аммиак силиконовой трубки или скоростью пропуска пробы.
Пропускается обессоленная вода, насыщенная аммиаком, через проточную ячейку до тех пор, пока ячейка и электроды не отмоются от следов натрия и стрелка гальванометра не остановится на 250 - 270 мВ.
7.3. Отсоединяется сосуд с обессоленной водой и присоединяется сосуд с анализируемой пробой. Температура пробы должна быть (25 ± 1) °С.
Время установления показаний мономера при малых концентрациях иона натрия 0,5 - 1 мин. Отсчет производится через 20 - 30 с после остановки стрелки гальванометра.
8. РАСЧЕТ СОДЕРЖАНИЯ НАТРИЯ В ПРОБЕ
8.1. Определяется величина pNa анализируемого раствора по формуле
![]() (5)
(5)
где Е - потенциал электрода в растворе 0,1 М NaCl, мВ;
Е1 - потенциал электрода в анализируемом растворе, мВ;
Kе - крутизна электродной функции данного электрода, мВ.
8.2. После получения значения pNa по табл. 2 находится содержание натрия в мкг/дм3.
8.3. Можно определить концентрацию ионов натрия по калибровочной кривой. Для этого необходимо определить потенциалы электрода в стандартных растворах с известной концентрацией натрия. По данным измерений строится калибровочный график Е (мВ) - pNa, затем измеряется потенциал электрода в контролируемом растворе и графически определяется значение pNa неизвестного раствора.
9. АЛГОРИТМ ОБРАБОТКИ РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ ПРИ ОПРЕДЕЛЕНИИ ПОГРЕШНОСТИ ИЗМЕРЕНИЙ КОНЦЕНТРАЦИИ НАТРИЯ
9.1. Доверительная вероятность Р при проведении эксперимента принимается равной 0,95.
9.2. Количество наблюдений содержания натрия для каждой концентрации определяется по формуле
![]() (6)
(6)
При Р = 0,95 п = 40.
Результаты наблюдении помещены в табл. 1.
9.3. Оценивается погрешность определений.
9.3.1. Определяется систематическая составляющая погрешности
![]() (7)
(7)
где Сi - i-й результат определения содержания натрия (i = 1, ..., 40);
Сд - действительное содержание натрия.
9.3.2. Определяется среднеквадратическое отклонение случайной составляющей погрешности
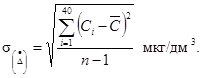 (8)
(8)
9.3.3. Определяются границы, в которых с вероятностью Р = 0,95 находится погрешность измерений
![]() (9)
(9)
где Δl(h) - нижняя (верхняя) граница погрешности измерений;
iр - коэффициент, зависящий от заданной вероятности и числа наблюдений.
При Р = 0,95 и n = 40iр = 1,96.
9.3.4. Определяются границы, в которых с вероятностью Р = 0,95 находится результат измерения:
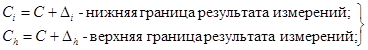 (10)
(10)
Таблица 1
Результат измерения содержания натрия в стандартных растворах
|
Нижняя граница (наименьшее значение), мкг/дм3 |
Верхняя граница (наибольшее значение), мкг/дм3 |
|
|
0,7 - 10 |
Сi = 0,36 + 0,983С |
Сh = 0,46 + 1,26С |
|
10 ÷ 2,3 ∙ 104 |
Сi = 0,76 + 0,943С |
Сh = 0,18 + 1,29С |
|
2,3 ∙ 104 ÷ 2,3 ∙ 107 |
Сi = 2150 + 0,85С |
Сh = 4697 + 1,085С |
Примечание. С - значение концентрации натрия, определенное по табл. 2.
Таблица 2
Пересчет pNa в массовую концентрацию Na
|
мкг/дм3 |
pNa |
мкг/дм3 |
pNa |
мкг/дм3 |
|
|
7,50 |
0,73 |
5,95 |
25,81 |
4,40 |
915,65 |
|
7,45 |
0,82 |
5,90 |
28,96 |
4,35 |
1027,37 |
|
7,40 |
0,92 |
5,85 |
32,49 |
4,30 |
1152,73 |
|
7,35 |
1,03 |
5,80 |
36,45 |
4,25 |
1293,39 |
|
7,30 |
1,15 |
5,75 |
40,90 |
4,20 |
1451,20 |
|
7,25 |
1,29 |
5,70 |
45,89 |
4,15 |
1628,28 |
|
7,20 |
1,45 |
5,65 |
51,49 |
4,10 |
1826,95 |
|
7,15 |
1,63 |
5,60 |
57,77 |
4,05 |
2049,88 |
|
7,10 |
1,83 |
5,55 |
64,82 |
4,00 |
2300,00 |
|
7,05 |
2,05 |
5,50 |
72,73 |
3,95 |
2580,64 |
|
7,00 |
2,30 |
5,45 |
81,61 |
3,90 |
2895,53 |
|
6,95 |
2,58 |
5,40 |
91,56 |
3,85 |
3248,84 |
|
6,90 |
2,90 |
5,35 |
102,74 |
3,80 |
3645,25 |
|
6,85 |
3,25 |
5,30 |
115,27 |
3,75 |
4090,04 |
|
6,80 |
3,65 |
5,25 |
129,34 |
3,70 |
4589,10 |
|
6,75 |
4,09 |
5,20 |
145,12 |
3,65 |
5149,06 |
|
6,70 |
4,59 |
5,15 |
162,83 |
3,60 |
5777,34 |
|
6,65 |
5,15 |
5,10 |
182,70 |
3,55 |
6482,28 |
|
6,60 |
5,78 |
5,05 |
204,99 |
3,50 |
7273,24 |
|
6,55 |
6,48 |
5,00 |
230,00 |
3,45 |
8160,71 |
|
6,50 |
7,27 |
4,95 |
258,06 |
3,40 |
9156,46 |
|
6,45 |
8,16 |
4,90 |
289,55 |
3,35 |
10273,72 |
|
6,40 |
9,16 |
4,85 |
324,88 |
3,30 |
11527,31 |
|
6,35 |
10,27 |
4,80 |
364,53 |
3,25 |
12933,85 |
|
6,30 |
11,53 |
4,75 |
409,00 |
3,20 |
14512,02 |
|
6,25 |
12,93 |
4,70 |
458,91 |
3,15 |
16282,75 |
|
6,20 |
14,51 |
4,65 |
514,91 |
3,10 |
18269,55 |
|
6,15 |
16,28 |
4,60 |
577,73 |
3,05 |
20498,77 |
|
6,10 |
18,27 |
4,55 |
648,23 |
3,00 |
23000,00 |
|
6,05 |
20,50 |
4,50 |
727,32 |
2,95 |
25806,42 |
|
6,00 |
23,00 |
4,45 |
816,07 |
2,90 |
28955,28 |
|
2,85 |
32488,36 |
2,20 |
145120,19 |
1,55 |
648228,07 |
|
2,80 |
36452,54 |
2,15 |
162827,53 |
1,50 |
727323,86 |
|
2,75 |
40900,43 |
2,10 |
182695,49 |
1,45 |
816070,80 |
|
2,70 |
45891,03 |
2,05 |
204987,72 |
1,40 |
915646,49 |
|
2,65 |
51490,59 |
2,00 |
230000,00 |
1,35 |
1027372,26 |
|
2,60 |
57773,39 |
1,95 |
258064,24 |
1,30 |
1152730,64 |
|
2,55 |
64822,81 |
1,90 |
289552,84 |
1,25 |
1293385,05 |
|
2,50 |
72732,39 |
1,85 |
324883,64 |
1,20 |
1451201,89 |
|
2,45 |
81607,08 |
1,80 |
364525,43 |
1,15 |
1628275,30 |
|
2,40 |
91564,65 |
1,75 |
409004,26 |
1,10 |
1826954,94 |
|
2,35 |
102737,23 |
1,70 |
458910,33 |
1,05 |
2049877,16 |
|
2,30 |
115273,06 |
1,65 |
514905,86 |
1,00 |
2300000,00 |
|
2,25 |
129338,50 |
1,60 |
577733,88 |
10. НОРМЫ ПОГРЕШНОСТИ ИЗМЕРЕНИЙ. ФОРМЫ ПРЕДСТАВЛЕНИЯ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ СОДЕРЖАНИЯ НАТРИЯ
10.1. Нормы погрешности измерений содержания натрия в водах в нормативно-технических документах не установлены.
10.2. Результат измерения, согласно МИ 1317-86, представляется в следующей форме:
Сi до Сh; Р.
где Сi, Сh - нижняя и верхняя границы, в пределах которых находится результат измерения с заданной доверительной вероятностью, мкг/дм3;
Р - доверительная вероятность, с которой результат измерения находится в пределах нижней и верхней границ, принимается равной 0,95.
10.3. Результат измерения содержания натрия для различных концентраций определяется по табл. 1 с доверительной вероятностью 0,95.
СОДЕРЖАНИЕ