|
|
  ГОСТ ISO 10993-1-2021 ГОСТ ISO 10993-1-2021
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента риска
| Обозначение: |   ГОСТ ISO 10993-1-2021 ГОСТ ISO 10993-1-2021 |
| Статус: | действует |
| Название рус.: | Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента риска | | Название англ.: | Medical devices. Biological evaluation of medical devices. Part 1. Evaluation and testing within a risk management process | | Дата актуализации текста: | 01.01.2022 | | Дата актуализации описания: | 01.07.2023 | | Дата регистрации: | 22.10.2021 | | Дата издания: | 01.12.2021 | | Дата введения: | 01.03.2022 | | Взамен: | ГОСТ ISO 10993-1-2011 | | Аутентичен стандартам: | ISO 10993-1:2018 | | Нормативные ссылки: | ISO 10993-2:2006;ISO 10993-3;ISO 10993-4;ISO 10993-5;ISO 10993-6;ISO 10993-7;ISO 10993-9;ISO 10993-10;ISO 10993-11:2017;ISO 10993-12;ISO 10993-13;ISO 10993-14;ISO 10993-15;ISO 10993-16;ISO 10993-17;ISO 10993-18;ISO/TS 10993-20;ISO 14971:2019 | | Область применения: | Настоящий стандарт распространяется на медицинские изделия (МИ) и устанавливает: - основные положения оценки биологического действия МИ как части процесса менеджмента риска; - классификацию МИ на основе характера и продолжительности контакта с организмом человека; - требования к анализу информации из различных источников; - определение разрывов/пробелов в существующем наборе данных на основе анализа риска (GAP-анализ); - определение дополнительных наборов данных, необходимых для анализа биологической безопасности МИ; - общие требования к исследованиям МИ. Настоящий стандарт распространяется на материалы и МИ прямого или опосредованного контакта: - с организмом пациента при клиническом применении; - организмом пользователя, если МИ предназначено для защиты (например, хирургические перчатки, маски и другие). Настоящий стандарт распространяется на все типы МИ, включая активные, неактивные, имплантируемые и не имплантируемые МИ. Настоящий стандарт содержит руководство по оценке биологической опасности в результате: - рисков, таких как изменения МИ с течением времени, как часть общей оценки биологической безопасности; - поломки МИ или его компонента, что приводит к воздействию на организм новых по своим свойствам материалов. В других стандартах серии ISO 10993 установлены требования к оценке биологического действия МИ при проведении конкретных исследований. В стандартах на конкретные МИ или продукты установлены методы испытаний. Настоящий стандарт не распространяется на опасности, связанные с бактериями, плесенью, дрожжами, вирусами, агентами трансмиссивной губчатой энцефалопатии (TSE) и другими патогенами | |
| Расположен в: |
|
            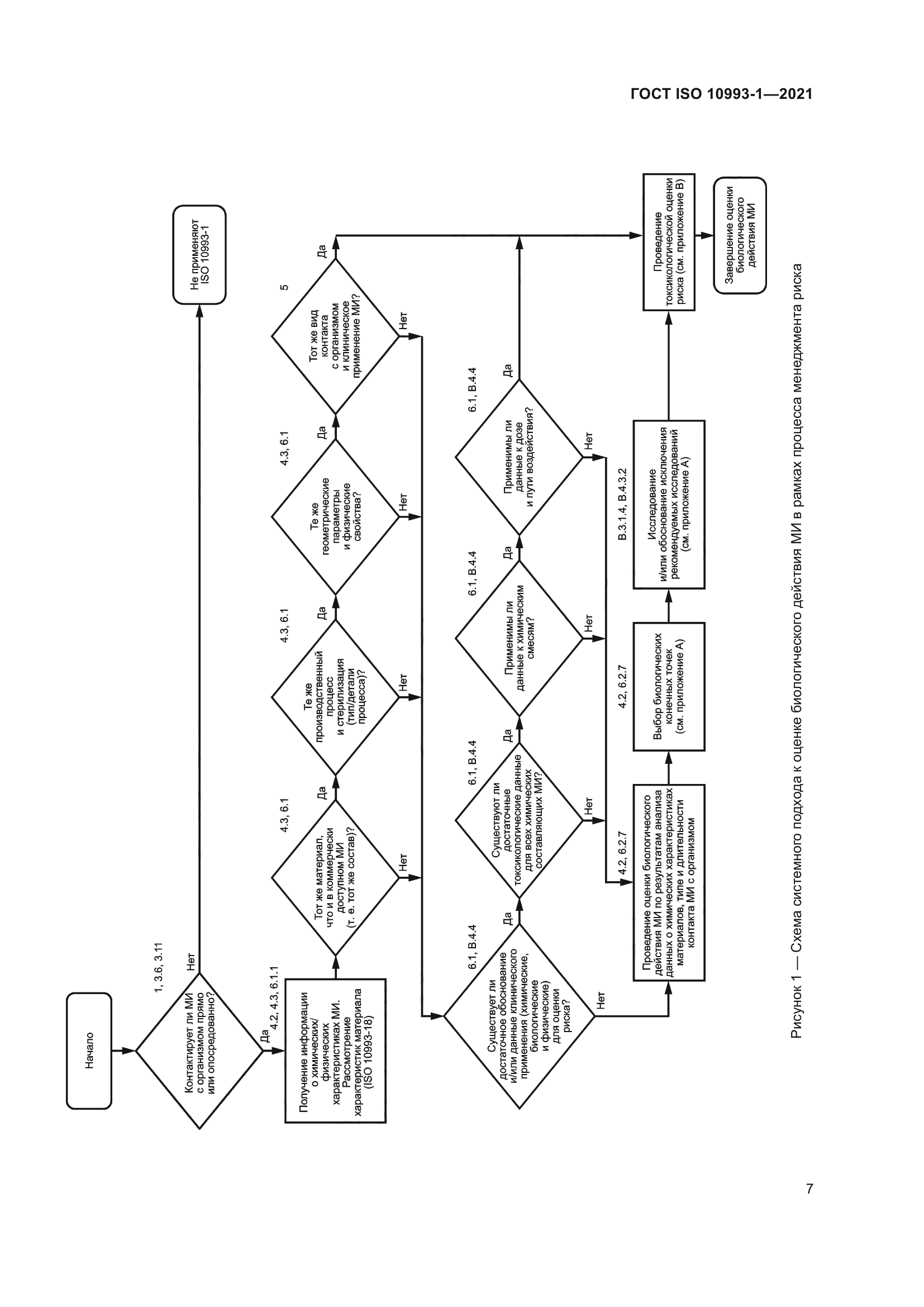           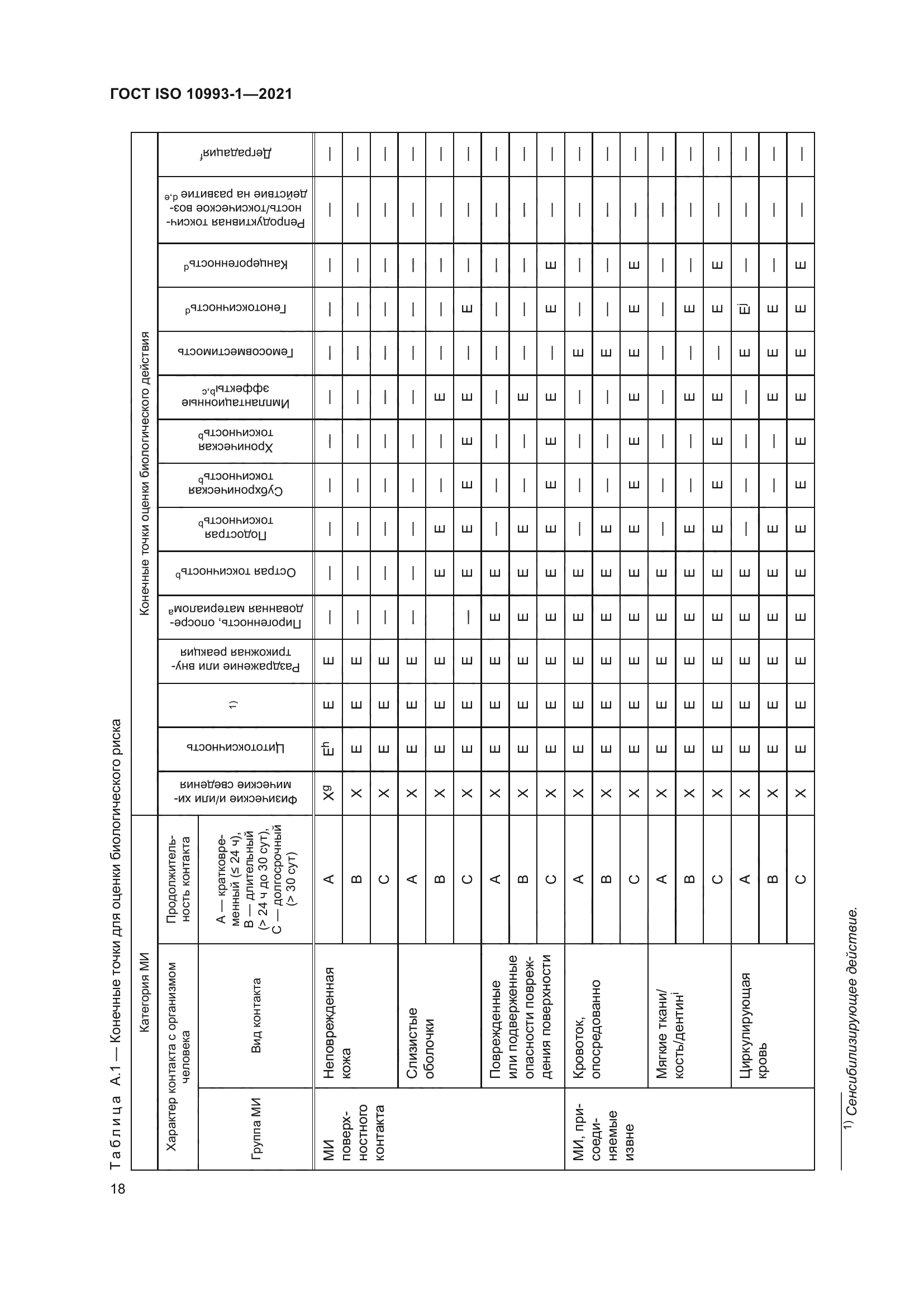 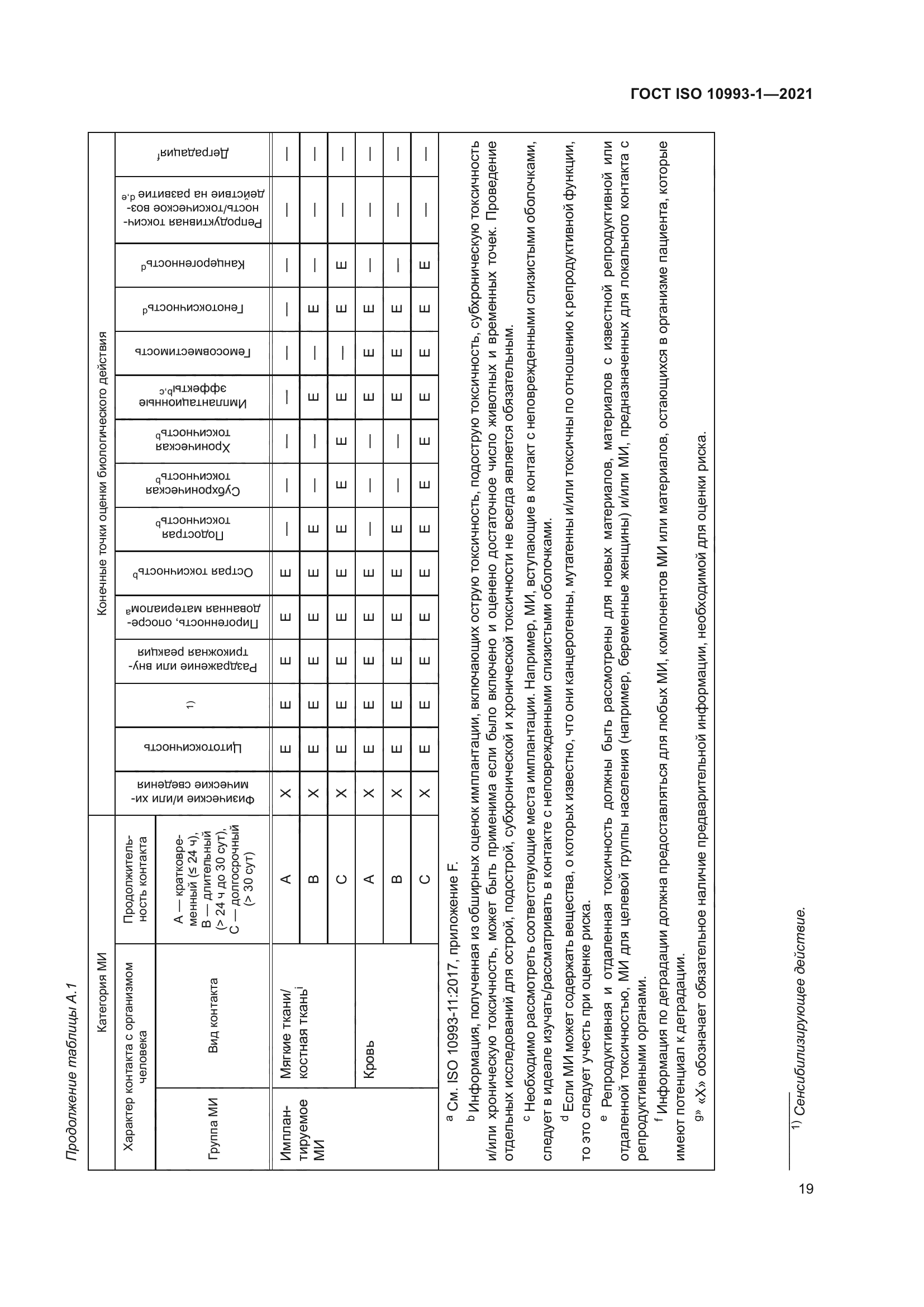     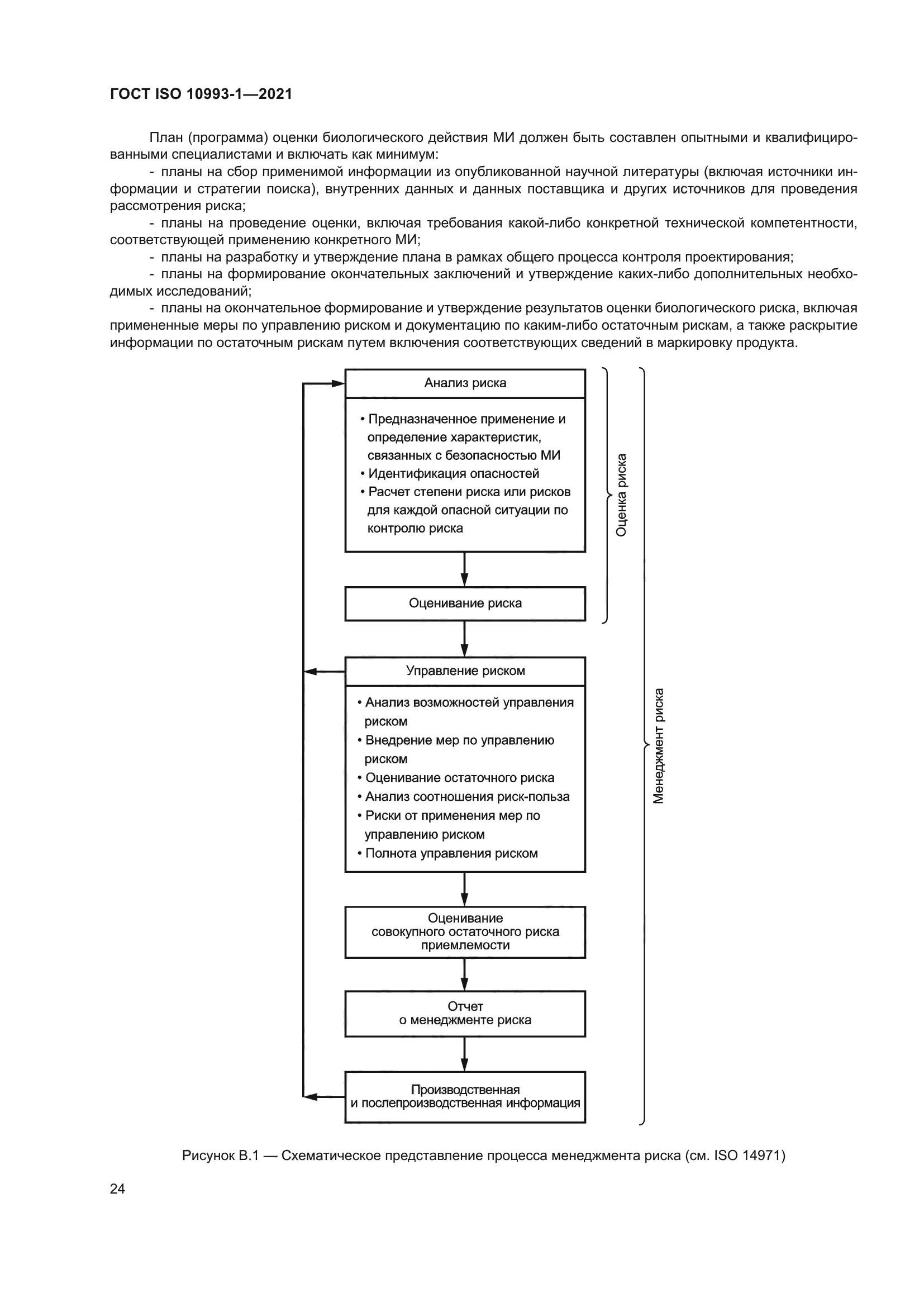              
|
|

 ГОСТ ISO 10993-1-2021
ГОСТ ISO 10993-1-2021










































