МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ,
МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(ISC)
|
МЕЖГОСУДАРСТВЕННЫЙ |
ГОСТ |
АНОДНЫЕ ЗАЗЕМЛЕНИЯ УСТАНОВОК
ЭЛЕКТРОХИМИЧЕСКОЙ ЗАЩИТЫ
ОТ КОРРОЗИИ ПОДЗЕМНЫХ МЕТАЛЛИЧЕСКИХ
СООРУЖЕНИЙ
Методы определения биокоррозионной
агрессивности грунтов и их влияния на подземные
металлические сооружения
|
|
Москва Стандартинформ 2020 |
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены в ГОСТ 1.0 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 РАЗРАБОТАН Обществом с ограниченной ответственностью «Люмэкс-маркетинг» (ООО «Люмэкс-маркетинг») и Институтом микробиологии и вирусологии им. Д.К. Заболотного Национальной академии наук Украины (ИМВ ИАН Украины)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 336 «Заземлители и заземляющие устройства различного назначения»
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 30 октября 2019 г. № 123-П)
За принятие проголосовали:
|
Краткое наименование страны по МК |
Код страны по МК |
Сокращенное наименование национального органа |
|
Беларусь |
BY |
Госстандарт Республики Беларусь |
|
Киргизия |
KG |
Кыргызстандарт |
|
Россия |
RU |
Росстандарт |
|
Таджикистан |
TJ |
Таджикстандарт |
|
Узбекистан |
UZ |
Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 26 ноября 2019 г. № 1249-ст межгосударственный стандарт ГОСТ 34597-2019 введен в действие в качестве национального стандарта Российской Федерации с 1 июня 2020 года
5 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге «Межгосударственные стандарты»
Содержание
Введение
Коррозия подземных сооружений является многофакторным сложным процессом, в который значительный вклад вносят микроорганизмы. Многолетние микробиологические исследования подземных сооружений в разных климатических зонах подтвердили, что крупномасштабные сооружения - мощный техногенный фактор, стимулирующий процессы биокоррозии (микробной коррозии) [1]. Наиболее существенным агентом, влияющим на процессы коррозии металла в подземной среде, являются бактерии цикла серы - сульфатредуцирующие и ацидофобные тионовые, с деятельностью которых связано возникновение коррозионноопасных ситуаций. Действие микробиологического фактора может существенно сокращать срок эксплуатации и службы подземных металлических сооружений и привести к их преждевременному выходу из строя и замене.
Одним из применяемых и надежных способов защиты подземных металлических сооружений от коррозии является электрохимическая защита. Однако данный способ оказывается малоэффективным при возникновении очагов биокоррозии. Более того, электрический ток от электроустановок может способствовать появлению и усилению биокоррозионных ячеек.
В настоящем стандарте установлены критерии биокоррозионной агрессивности и современные микробиологические, молекулярные и физико-химические методы определения возбудителей биокоррозии - коррозионноопасных бактерий. Среди современных методов новыми являются молекулярные. Для обнаружения коррозионноопасных бактерий в настоящем стандарте предлагается использование молекулярных методов, основанных на полимеразной цепной реакции (ПЦР), а именно ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени, разработанных в течение последних десятилетий и теперь доступных для экспресс-анализа образцов грунта, прилегающего к подземным сооружениям.
Внедрение стандарта позволит прогнозировать биокоррозионную ситуацию на подземных сооружениях, выбирать эффективные методы противокоррозионной защиты при их проектировании, что позволит увеличить срок службы и надежность эксплуатации подземных металлических сооружений, сократит число аварий, расходы на техническую эксплуатацию и ремонт.
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
|
АНОДНЫЕ ЗАЗЕМЛЕНИЯ УСТАНОВОК ЭЛЕКТРОХИМИЧЕСКОЙ ЗАЩИТЫ ОТ
КОРРОЗИИ Методы определения биокоррозионной
агрессивности грунтов и их влияния на подземные Anodic earthing of the
electrochemical protective installations against corrosion of underground
metal constructions. |
Дата введения - 2020-06-01
1 Область применения
Настоящий стандарт устанавливает методы оценки биокоррозионной агрессивности грунтов, а также методы определения коррозионноопасных микроорганизмов в грунтах, прилегающих к поверхности подземных металлических сооружений.
Настоящий стандарт используют для определения, мониторинга и прогнозирования появления очагов биокоррозионных повреждений наружной поверхности подземных (в том числе подводных с заглублением в дно) стальных сооружений, проложенных ниже уровня поверхности земли или в обваловании, выполненных из углеродистых и низколегированных сталей (далее - сооружения): трубопроводов, транспортирующих природный газ (газопроводы магистральные и распределительные), нефть, нефтепродукты, и отводов от них; резервуаров (в том числе траншейного типа); водопроводов; трубопроводов тепловых сетей; свай, шпунтов, колонн и других несущих стальных подземных конструкций, железобетонных и чугунных сооружений, морских и прибрежных сооружений.
Настоящий стандарт не распространяется на следующие сооружения: железобетонные и чугунные сооружения, сооружения специального оборонного и космического назначения, морские и прибрежные сооружения, в том числе, трубопроводы; сооружения атомных, приливных, гидроэлектрических станций и плотин; коммуникации, прокладываемые в зданиях; кабели в металлической оболочке; трубопроводы тепловых сетей с пенополиуретановой тепловой изоляцией и трубой-оболочкой из жесткого полиэтилена (конструкция «труба в трубе»), имеющие действующую систему оперативного дистанционного контроля состояния изоляции трубопроводов.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 9.602 Единая система защиты от коррозии и старения. Сооружения подземные. Общие требования к защите от коррозии
ГОСТ 12.1.008 Система стандартов безопасности труда. Биологическая безопасность. Общие требования
ГОСТ 17.4.4.02 Почвы. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа
ГОСТ OIML R 76-1 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ 1770 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2053 Реактивы. Натрий сернистый 9-водный. Технические условия
ГОСТ 3118 Реактивы. Кислота соляная. Технические условия
ГОСТ 3773 Реактивы. Аммоний хлористый. Технические условия
ГОСТ 3776 Реактивы. Хрома (VI) оксид. Технические условия
ГОСТ 4148 Реактивы. Железо (II) сернокислое 7-водное. Технические условия
ГОСТ 4198 Реактивы. Калий фосфорнокислый однозамещенный. Технические условия
ГОСТ 4201 Реактивы. Натрий углекислый кислый. Технические условия
ГОСТ 4204 Реактивы. Кислота серная. Технические условия
ГОСТ 4209 Реактивы. Магний хлористый 6-водный. Технические условия
ГОСТ 4523 Реактивы. Магний сернокислый 7-водный. Технические условия
ГОСТ 5839 Реактивы. Натрий щавелевокислый. Технические условия
ГОСТ 6709 Вода дистиллированная. Технические условия
ГОСТ ISO 7886-1 Шприцы инъекционные однократного применения стерильные. Часть 1. Шприцы для ручного использования
ГОСТ 9147 Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ ISO 11464 Качество почвы. Предварительная подготовка проб для физико-химического анализа
ГОСТ 11773 Реактивы. Натрий фосфорно-кислый двузамещенный. Технические условия
ГОСТ 12026 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 12071 Грунты. Отбор, упаковка, транспортирование и хранение образцов
ГОСТ 12302 Пакеты из полимерных пленок и комбинированных материалов. Общие технические условия
ГОСТ 14919 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
ГОСТ 16317 Приборы холодильные электрические бытовые. Общие технические условия
ГОСТ 18300 Спирт этиловый ректификованный технический. Технические условия1)
__________
1) В Российской Федерации действует ГОСТ Р 55878-2013 «Спирт этиловый технический гидролизный ректификованный. Технические условия».
ГОСТ 19126 Инструменты медицинские металлические. Общие технические условия
ГОСТ 21204 Горелки газовые промышленные. Общие технические требования
ГОСТ 21240 Скальпели и ножи медицинские. Общие технические требования и методы испытаний
ГОСТ ISO 22119 Микробиология пищевых продуктов и кормов для животных. Полимеразная цепная реакция (ПЦР) в режиме реального времени для определения патогенных микроорганизмов в пищевых продуктах. Общие требования и определения
ГОСТ 25100 Грунты. Классификация
ГОСТ 25336 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25644 Средства моющие синтетические порошкообразные. Общие технические требования
ГОСТ 25812 Трубопроводы стальные магистральные. Общие требования к защите от коррозии2)
__________
2) В Российской Федерации действует ГОСТ Р 51164-98 «Трубопроводы стальные магистральные. Общие требования к защите от коррозии»
ГОСТ 27068 Реактивы. Натрий серноватистокислый (натрия тиосульфат) 5-водный. Технические условия
ГОСТ 28268 Почвы. Методы определения влажности, максимальной гигроскопической влажности и влажности устойчивого завядания растении
ГОСТ 29169 (ИСО 648-77) Посуда лабораторная стеклянная. Пипетки с одной отметкой
ГОСТ 29227 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов и классификаторов на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации (www.easc.by) или по указателям национальных стандартов, издаваемым в государствах, указанных в предисловии, или на официальных сайтах соответствующих национальных органов по стандартизации. Если на документ дана недатированная ссылка, то следует использовать документ, действующий на текущий момент, с учетом всех внесенных в него изменений. Если заменен ссылочный документ, на который дана датированная ссылка, то следует использовать указанную версию этого документа. Если после принятия настоящего стандарта в ссылочный документ, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение применяется без учета данного изменения. Если ссылочный документ отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по ГОСТ 9.602, ГОСТ 25100, а также следующие термины с соответствующими определениями:
3.1 Термины, относящиеся к биокоррозионной агрессивности грунтов
3.1.1 биокоррозия (микробная коррозия): Коррозия, которая индуцируется микроорганизмами и проявляется в виде локальных повреждений металла - язв, питтингов.
3.1.2 биокоррозионная агрессивность: Свойство грунта вызывать коррозионное разрушение металла подземных металлических сооружений под действием коррозионноопасных микроорганизмов и/или их продуктов жизнедеятельности.
3.1.3 микробные метаболиты: Газообразные и водорастворимые продукты жизнедеятельности микроорганизмов.
3.1.4 грунтовый воздух: Газовая фаза грунта, находящаяся в непрерывном взаимодействии с твердой и жидкой фазами грунта.
3.1.5 инкубация: Выращивание микроорганизмов на питательных средах в оптимальных условиях.
3.2 Термины, относящиеся к амплификации ДНК в режиме реального времени
3.2.1
|
полимеразная цепная реакция, ПЦР: Ферментативная реакция, сочетающая в себе амплификацию специфичных сегментов ДНК в процессе денатурации, отжиг специфичных праймеров и синтез ДНК с обнаружением специфичных ПЦР продуктов в течение процесса амплификации. [ГОСТ ISO 22119, пункт 3.1] |
3.2.2 микрочип: Пластина из инертного материала с высокой теплопроводностью, содержащая на своей поверхности ячейки или микрореакторы, в каждой из которых проходят индивидуальные реакции ПЦР в реальном времени.
3.2.3 положительный контроль ПЦР: Реакционная смесь, содержащая определенную массу целевой ДНК или определенное число ее копий.
3.2.4 отрицательный контроль ПЦР: Реакционная смесь с не содержащей ДНК водой и без каких-либо ингибиторов ПЦР.
4 Средства измерений, вспомогательное оборудование, устройства, реактивы и материалы
Для проведения исследований применяют следующие средства измерений, вспомогательные устройства, реактивы и материалы:
4.1 Весы лабораторные специального класса точности с пределом допускаемой погрешности взвешивания ±0,0001 г.
4.2 Весы неавтоматического действия высокого класса точности с пределом допускаемой погрешности взвешивания ±0,01 г по ГОСТ OIML R 76-1.
4.3 Дозаторы пипеточные механические или электронные переменного объема (0,5 - 10), (10 - 100), (100 - 1000) и (1000 - 5000) мкл со сменными наконечниками.
4.4 Колбы мерные 2-го класса точности исполнений 2 или 2а по ГОСТ 1770 вместимостью 25, 50, 100, 1000 см3.
4.5 Цилиндры мерные 2-го класса точности вместимостью 50, 100, 1000 см3 любого исполнения по ГОСТ 1770.
4.6 Пипетки градуированные 2-го класса точности вместимостью 1, 2, 5, 10, 25 см3 типа 1, 2 или 3 любого исполнения по ГОСТ 29227.
4.7 Пипетки с одной отметкой 2-го класса точности вместимостью 5, 10, 20, 25 см3 любого исполнения по ГОСТ 29169.
4.8 Секундомер механический или электронный с ценой деления секундной шкалы 0,2 с по нормативно-технической документации, действующей на территории страны, принявшей стандарт.
4.9 Пробоотборник грунтов ручной ППР-1000 или ППР-300.
4.10 Пакеты полиэтиленовые по ГОСТ 12302.
4.11 Перемешивающее устройство с регулируемой частотой вращения (качания) до 120 циклов в минуту (2 с-1) по нормативно-технической документации, действующей на территории страны, принявшей стандарт.
4.12 Диспергатор ультразвуковой низкочастотный (рабочие частоты от 22 до 44 кГц) с номинальной потребляемой электрической мощностью, не более 1000 Вт по нормативно-технической документации, действующей на территории страны, принявшей стандарт.
4.13 Центрифуга лабораторная с частотой вращения не менее 5000 оборотов в минуту (83 с-1) по нормативно-технической документации, действующей на территории страны, принявшей стандарт.
4.14 Холодильник бытовой любой марки по ГОСТ 16317.
4.15 Водяная баня по нормативно-технической документации, действующей на территории страны, принявшей стандарт.
4.16 Автоклав паровой для стерилизации по нормативно-технической документации, действующей на территории страны, принявшей стандарт.
4.17 Шпатели металлические по ГОСТ 19126.
4.18 Плитка электрическая закрытого типа по ГОСТ 14919.
4.19 Штативы для пробирок и микропробирок по нормативно-технической документации, действующей на территории страны, принявшей стандарт.
4.20 Шприцы медицинские одноразовые по ГОСТ ISO 7886-1.
4.21 Стаканы вместимостью 100, 250, 1000 см3 любого исполнения по ГОСТ 25336.
4.22 Колбы конические вместимостью 50, 100, 250, 500, 1000 см3 типа Кн любого исполнения из термически стойкого стекла по ГОСТ 25336.
4.23 Ступка фарфоровая с пестиком по ГОСТ 9147.
4.24 Бумага индикаторная универсальная для диапазона pH от 1 до 10 по нормативно-технической документации, действующей на территории страны, принявшей стандарт.
4.25 Фильтры обеззоленные «синяя лента» по нормативно-технической документации, действующей на территории страны, принявшей стандарт.
4.26 Бумага фильтровальная по ГОСТ 12026.
4.27 Скальпель металлический по ГОСТ 21240.
4.28 Вода дистиллированная по ГОСТ 6709.
4.29 Кислота соляная по ГОСТ 3118, ч.д.а.
4.30 Спирт этиловый ректификованный по ГОСТ 18300.
Примечание - Допускается применять другие средства измерений с метрологическими характеристиками не хуже указанных в настоящем стандарте, вспомогательное оборудование и материалы с техническими характеристиками не хуже указанных в настоящем стандарте, а также химические реактивы более высокой квалификации.
5 Биокоррозия и ее влияние на подземные металлические сооружения
5.1 Виды коррозионных воздействий на наружные поверхности подземных стальных конструкций оценивают по ГОСТ 9.602.
5.2 Коррозионная активность по отношению к металлу трубопровода характеризуется значением скорости коррозии металла в среде и значением удельного электрического сопротивления грунта и оценивается по ГОСТ 9.602. Скорость коррозии металла определяют по ГОСТ 25812 и [2]. Удельное электрическое сопротивление грунта определяют по ГОСТ 9.602.
5.3 Критерии биокоррозионной агрессивности грунтов (KА) устанавливают на основании комплекса микробиологических и физико-химических показателей грунтов в соответствии с [1]: содержанию в них сульфатредуцирующих и тионовых бактерий, массовой доли железа и общей серы, а также удельного электрического сопротивления по формуле
|
|
(1) |
где ТСРБ - количество клеток сульфатредуцирующих бактерий в расчете на 1 г грунта (см. раздел 6);
ТТБ - количество клеток тионовых бактерий в расчете на 1 г грунта (см. раздел 6);
Feобщ - массовая доля общего железа в грунте (см. раздел 7), %;
Sобщ - массовая доля общей серы в грунте (см. раздел 8), %;
ρ - удельное объемное электрическое сопротивление, Ом·м.
Количество сульфатредуцирующих и тионовых бактерий устанавливают в соответствии с разделом 8, массовую долю общего железа и общей серы - с использованием методов анализа почв и грунтов в соответствии с [3] и [4].
5.4 Если грунты, на которых происходит строительство и эксплуатация подземных сооружений, относятся к умеренно агрессивным, агрессивным или сильно агрессивным, то проектировщикам и службам эксплуатации следует обеспечить регулярный контроль оперативного состояния процессов биокоррозии в грунтах, используя методы в соответствии с разделами 9 - 10, проектной и (или) эксплуатационной документацией.
6 Условия проведения испытаний
Все испытания грунтов в лабораторных условиях, если это не оговорено особо, проводят при следующих условиях:
- температура окружающей среды (20 ± 5) °С;
- атмосферное давление от 84 до 106,7 кПа;
- относительная влажность воздуха не более 80%.
7 Отбор и хранение проб
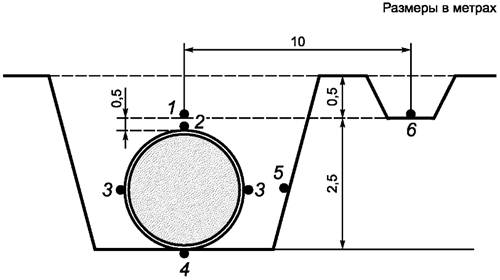
7.1 Отбор проб грунтов - по ГОСТ 12071 с учетом схем, приведенных на рисунках А.1 и А.2 (приложение А).
7.2 Транспортирование и хранение отобранных проб - по ГОСТ 12071.
7.3 Подготовка проб для химических анализов по ГОСТ ISO 11464 и ГОСТ 17.4.4.02.
7.4 Подготовка проб для бактериологического анализа по ГОСТ 17.4.4.02.
8 Метод определения коррозионноопасных бактерий в грунтах
8.1 Сущность метода
Метод основан на определении количества коррозионноопасных микроорганизмов, а именно сульфатредуцирующих и тионовых бактерий в грунтах, прилегающих к подземным сооружениям, микробиологическим методом посева на питательные среды и сравнении полученных результатов опытных образцов грунта с контрольными.
8.2 Отбор и транспортирование проб - в соответствии с разделом 6
8.3 Средства измерений, вспомогательное оборудование, химические реактивы и материалы - в соответствии с разделом 4 и приведенным в настоящем разделе:
- термостаты электрические для выращивания бактерий с автоматическим терморегулятором до 50 °С и термометром с ценой деления 0,2 °С по нормативно-технической документации, действующей на территории страны, принявшей стандарт;
- горелка газовая по ГОСТ 21204;
- лампы бактерицидные ртутно-кварцевые по нормативно-технической документации, действующей на территории страны, принявшей стандарт;
- пробки резиновые для отверстий диаметром от 3 до 160 мм;
- пробирки типа П-20 и П-40 по ГОСТ 25336;
- калий фосфорнокислый однозамещенный по ГОСТ 4198, х.ч.;
- аммоний хлористый по ГОСТ 3773, х.ч.;
- кальций сернокислый по нормативно-технической документации, действующей на территории страны, принявшей стандарт, ч.д.а.;
- магний сернокислый по ГОСТ 4523, х.ч.;
- кальций молочнокислый по нормативно-технической документации, действующей на территории страны, принявшей стандарт, х.ч.;
- дрожжевой экстракт по нормативно-технической документации, действующей на территории страны, принявшей стандарт;
- железо (II) сернокислое 7-водное по ГОСТ 4148, ч.д.а.;
- натрий углекислый кислый по ГОСТ 4201, х.ч.;
- натрий серноватистокислый (натрия тиосульфат) 5-водный по ГОСТ 27068, ч.д.а.;
- натрий фосфорнокислый двузамещенный по ГОСТ 11773, ч.д.а.;
- магний хлористый 6-водный по ГОСТ 4209, ч.д.а.;
- натрий сернистый 9-водный по ГОСТ 2053, ч.д.а.;
- кислота серная по ГОСТ 4204, ч.д.а.
8.4 Проведение исследований
8.4.1 Все микробиологические исследования проводят с соблюдением требований биологической безопасности по ГОСТ 12.1.008 в специально оборудованном биологическом боксе микробиологической безопасности.
8.4.2 Подготавливают грунтовую суспензию, для чего 10 г грунта добавляют к 90 см3 водопроводной воды, предварительно простерилизованной в автоклаве при давлении 1,5 атм и температуре 127 °С в течение 30 мин.
8.4.3 Грунтовую суспензию взбалтывают в течение 30 мин на аппарате для встряхивания с частотой (100 ± 20) об/мин.
8.4.4 Количество бактерий в пробах грунта определяют методом десятикратных предельных разведений при посеве грунтовой суспензии на соответствующие жидкие питательные среды (приложение Б). При этом количество сульфатредуцирующих бактерий определяют в питательной среде Постгейта В по В.2. (приложение В), а количество ацидофобных тионовых бактерий определяют в питательной среде Бейеринка по В.3 (приложение В).
9 Экспресс-метод определения коррозионноопасных бактерий в грунтах
9.1 Сущность метода
Метод основан на определении в пробах грунтов, прилегающих к подземным сооружениям, ДНК сульфатредуцирующих бактерий путем амплификации специфического фрагмента ДНК данных микроорганизмов методом ПЦР с гибридизационно-флуоресцентной детекцией продуктов амплификации в режиме реального времени. В качестве положительного контроля ПЦР берется ДНК бактерий - ДБГ.
Выявление ДНК сульфатредуцирующих бактерий методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией включает в себя три этапа:
- выделение ДНК из проб грунта;
- амплификация специфического фрагмента ДНК данных микроорганизмов (гена α-субъединицы диссимиляционной сульфитредуктазы (dsrA));
- гибридизационно-флуоресцентная детекция продуктов амплификации, которая производится непосредственно в ходе ПЦР.
Второй и третий этапы производятся в микрочипе при помощи микрочипового амплификатора с системой детекции флуоресцентного сигнала в режиме «реального времени». Микрочип для выявления ДНК сульфатредуцирующих бактерий представляет собой пластину, выполненную из кремния или алюминия, с присоединенной пластиковой подложкой (рисунок Г.1, приложение Г). В пластине расположены микрореакторы, внутри которых находится иммобилизованная тест-система для проведения реакции ПЦР с гибридизационно-флуоресцентной детекцией продуктов амплификации в режиме реального времени. Микрочип покрыт защитной пленкой.
9.2 Отбор, транспортировка и хранение проб - в соответствии с разделом 6 и с учетом нижеследующих требований.
Хранение проб в лаборатории осуществляется при температуре минус 70 °С в течение 1 года. Допускается хранение проб грунта при температуре минус 20 °С не более месяца или при температуре от 2 °С до 8 °С не более суток.
Допускается лишь однократное замораживание-оттаивание материала.
9.3 Средства измерений, химические реактивы и материалы - в соответствии с разделом 4 и приведенным в настоящем разделе:
- микроцентрифуга настольная для пробирок конических полипропиленовых с крышкой объемом 1,5 - 2 см3 с максимальным ускорением не менее 11000 g;
- аппарат для встряхивания типа «Вортекс» или микроцентрифуга-типа «Вортекс» (максимальное ускорение 450 g) с адаптером для горизонтального встряхивания;
- ламинарный бокс или бокс для ПЦР со встроенной системой УФ-облучения по нормативно-технической документации, действующей на территории страны, принявшей стандарт;
- микрочиповый амплификатор нуклеиновых кислот в режиме реального времени, работающий по каналам FAM (возбуждение в диапазоне от 480 до 500 нм, регистрация в диапазоне от 510 до 540 нм) и ROX (возбуждение в диапазоне от 560 до 590 нм, регистрация в диапазоне от 610 до 660 нм) с пределами обнаружения по каждому из каналов не выше 0,01 пмоль/мкл, например, «АриаДНА»1);
__________
1) Эта информация приведена исключительно для удобства пользователя настоящего стандарта и не является поддержкой указанного продукта. Могут быть использованы иные устройства, обеспечивающие проведение исследований в соответствии с установленными в настоящем стандарте требованиями.
- микрочипы для выявления ДНК сульфатредуцирующих бактерий в комплекте с буферным раствором и герметизирующей жидкостью;
- наборы для выделения ДНК из образцов почв, например, «DNeasy PowerSoil Kit» производства «QIAGEN», США2).
__________
2) Эта информация приведена исключительно для удобства пользователя настоящего стандарта и не является поддержкой указанного продукта. Могут быть использованы иные наборы, обеспечивающие проведение исследований в соответствии с установленными в настоящем стандарте требованиями.
- пробирки микроцентрифужные конические полипропиленовые с крышкой типа Эппендорф вместимостью 0,6; 1,5 и 2 см3.
- наконечники одноразовые с фильтром к механическим и электронным дозаторам.
9.4 Требования к организации работ
Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности, осуществляется в соответствии с требованиями [5], [6].
9.5 Выделение ДНК из проб грунта
Выделение ДНК проб грунта проводят в соответствии с инструкцией к используемому набору.
Срок хранения образцов ДНК, выделенной из проб грунта, - 1 год при температуре минус 20 °С.
9.6 Подготовка образцов выделенной ДНК для анализа
Отбирают и маркируют необходимое количество микропробирок по числу анализируемых проб, включая контрольный образец.
В микропробирках смешивают образцы выделенной ДНК с буферным раствором, входящим в комплект микрочипов, в объемном соотношении, рекомендованном изготовителем комплекта. Для каждого образца используют отдельный одноразовый наконечник с фильтром. Для приготовления контрольного образца смешивают деионизованную воду с буферным раствором в таком же соотношении.
9.7 Подготовка микрочипа и внесение в него исследуемых образцов ДНК
Перед использованием микрочипа проверяют его целостность, отсутствие трещин и сколов в реакционной зоне и на рабочей поверхности микрочипа, удаляют защитную пленку, вставляют микрочип в картридж, покрывают реакционную зону микрочипа герметизирующей жидкостью.
Приготовленные по 9.6 образцы ДНК вводят в соответствующие микрореакторы в объеме, рекомендованном изготовителем микрочипов, под слой герметизирующей жидкости. Для каждого образца используют отдельный одноразовый наконечник с фильтром.
9.8 Проведение амплификации с гибридизационно-флуоресцентной детекцией в режиме «реального времени»
Управление амплификатором, в том числе и проведение анализа образцов, осуществляют при помощи специализированного программного обеспечения. Задают программу температурного режима амплификации в соответствии с таблицей 1. Детекцию флуоресцентного сигнала проводят по двум каналам (см. 9.3).
Таблица 1 - Параметры температурного режима при проведении ПЦР
|
Этап |
Температура, °С |
Время, с |
Число циклов |
|
1 |
94 |
180 |
1 |
|
2 |
94 |
1 |
45 |
|
56 |
30* |
||
|
* - Стадия, на которой производится детекция сигнала. |
|||
9.9 Обработка и интерпретация результатов исследований
9.9.1 Анализ результатов проводят с помощью программного обеспечения амплификатора. Анализируют кривые накопления флуоресцентного сигнала по каналу FAM.
9.9.2 Результат ПЦР-исследования считается достоверным, если получены правильные результаты для положительного и отрицательного контролей ПЦР, а именно:
- для положительного контроля ПЦР на кривой накопления флуоресцентного сигнала по каналу FAM наблюдается экспоненциальная фаза ПЦР по ГОСТ ISO 22119 (кривая 1 на рисунке Д.1, приложение Д);
- для отрицательного контроля ПЦР на кривой накопления флуоресцентного сигнала по каналу FAM отсутствует экспоненциальная фаза ПЦР по ГОСТ ISO 22119 (кривая 2 на рисунке Д.1, приложение Д).
9.9.3 Результаты ПЦР-исследования интерпретируют следующим образом:
- ДНК коррозионноопасных сульфатредуцирующих бактерий обнаружена, если для данной пробы на кривой накопления флуоресцентного сигнала по каналу FAM наблюдается экспоненциальная фаза ПЦР по ГОСТ ISO 22119;
- ДНК коррозионноопасных сульфатредуцирующих бактерий не обнаружена, если для данной пробы на кривой накопления флуоресцентного сигнала по каналу FAM отсутствует экспоненциальная фаза ПЦР по ГОСТ ISO 22119.
10 Метод определения наличия биокоррозии и способствующих ей факторов по данным исследований водных вытяжек грунтов
10.1 Сущность метода
Метод измерений основан на извлечении определяемых компонентов - коррозионноопасных метаболитов бактерий - дистиллированной водой из проб грунтов, прилегающих к подземным сооружениям, дальнейшем разделении и количественном определении методом капиллярного электрофореза. Метод предусматривает две схемы испытаний, которые различаются условиями электрофоретического определения и перечнем определяемых компонентов.
Схема испытаний № 1 - предназначена для определения органических и неорганических анионов.
Схема испытаний № 2 - предназначена для определения катионов согласно перечню, приведенному в таблице 2.
Таблица 2 - Диапазоны измерений массовой доли компонентов
|
Наименование иона |
Диапазон измерений, млн-1 |
|
Хлорид-ионы |
от 3 до 20000 вкл. |
|
Сульфат-ионы |
от 3 до 20000 вкл. |
|
Оксалат-ионы |
от 3 до 100 вкл. |
|
Нитрат-ионы |
от 3 до 10000 вкл. |
|
Фторид-ионы |
от 1 до 100 вкл. |
|
Формиат-ионы |
от 1 до 500 вкл. |
|
Фосфат-ионы |
от 3 до 5000 вкл. |
|
Ацетат-ионы |
от 3 до 1000 вкл. |
|
Аммоний |
от 2 до 20000 вкл. |
|
Калий |
от 2 до 20000 вкл. |
|
Натрий |
от 2 до 20000 вкл. |
|
Магний |
от 1 до 10000 вкл. |
|
Кальций |
от 2 до 10000 вкл. |
10.2 Отбор и первичная подготовка проб - в соответствии с разделом 6.
10.3 Средства измерений, стандартные образцы, химические реактивы и материалы
Применяют средства измерений, стандартные образцы, реактивы и материалы, перечисленные в разделе 4, а также приведенные ниже:
- система капиллярного электрофореза, оснащенная кварцевым капилляром с общей длиной не менее 60 см и внутренним диаметром 75 мкм, с фотометрическим детектором, позволяющим проводить измерения в диапазоне длин волн от 200 до 380 нм, работающая под управлением компьютера, на котором установлено специализированное программное обеспечение для управления работой системы, сбора и обработки информации, например, система капиллярного электрофореза «Капель» с программным обеспечением «Эльфоран»1);
__________
1) Эта информация приведена исключительно для удобства пользователя настоящего стандарта и не является поддержкой указанного продукта. Могут быть использованы иные устройства, обеспечивающие проведение исследований в соответствии с установленными в настоящем стандарте требованиями.
- пробирки для центрифугирования, пластиковые, вместимостью от 10 до 20 см3;
- сосуды с завинчивающимися крышками (далее - виалы) для хранения растворов вместимостью от 10 до 20 см3;
- микропробирки одноразовые типа Эппендорф вместимостью 1,5 см3;
- фильтры целлюлозно-ацетатные, размер пор 0,2 мкм, диаметр 25 мм по нормативно-технической документации, действующей на территории страны, принявшей стандарт;
- держатель для фильтров целлюлозно-ацетатных по нормативно-технической документации, действующей на территории страны, принявшей стандарт;
- хрома (VI) оксид по ГОСТ 3776, ч.д.а.;
- цетилтриметиламмония гидроксид (гексадецилтриметиламмония гидроксид) (далее - ЦТА-ОН), водный раствор с массовой долей 10%;
- диэтаноламин, массовая доля основного вещества не менее 98% (реактив хранят в морозильной камере);
- стандартные образцы состава водных растворов ионов и погрешностью аттестованного значения не более ±2%:
- хлорид-, сульфат-, нитрат-, фторид-ионов, уксусной кислоты, аммония, калия, натрия, магния, кальция массовой концентрации 1 г/дм3;
- формиат-ионов массовой концентрации 66 мг/дм3;
- фосфат-ионов массовой концентрации 0,5 г/дм3;
- натрий щавелевокислый по ГОСТ 5839, ч.д.а. или х.ч.;
- винная кислота, массовая доля основного вещества не менее 99 %;
- бензимидазол, массовая доля основного вещества не менее 98 %;
- 18-краун-6, массовая доля основного вещества не менее 99 % (реактив хранят при температуре от 2 °С до 8 °С).
10.4 Приготовление вспомогательных растворов
10.4.1 Общие положения
Все растворы готовят на свежей дистиллированной воде по ГОСТ 6709.
Проверку качества дистиллированной воды проводят по 10.7.1. Если дистиллированная вода не соответствует требованиям чистоты, то растворы готовят на бидистиллированной или деионизованной воде.
10.4.2 Раствор гидроксида натрия для промывки капилляра
В стакан из термостойкого стекла помещают 2 г гидроксида натрия и растворяют в 100 см3 дистиллированной воды.
Срок хранения раствора в посуде из полиэтилена - 6 месяцев.
10.4.3 Раствор соляной кислоты для промывки капилляра
В стакан из термостойкого стекла помещают 100 см3 дистиллированной воды, затем приливают 8 см3 концентрированной соляной кислоты и перемешивают.
Срок хранения раствора не ограничен.
10.4.4 Раствор оксида хрома (VI) молярной концентрации 0,05 моль/дм3
В мерную колбу вместимостью 100 см3 помещают (0,50 ± 0,01) г оксида хрома (VI), растворяют в 50 - 60 см3 дистиллированной воды, затем доводят до метки дистиллированной водой.
Срок хранения раствора в стеклянной емкости с притертой пробкой или плотно закрытом полиэтиленовом сосуде - 1 год.
Примечание - Оксид хрома (VI) является весьма гигроскопичным веществом, которое нельзя обезводить высушиванием. В случае длительного хранения препарата следует предварительно определить содержание основного вещества по ГОСТ 3776.
10.4.5 Раствор диэтаноламина (ДЭА) молярной концентрации 0,10 моль/дм3
В мерную колбу вместимостью 25 см3 помещают (0,263 ± 0,001) г диэтаноламина, предварительно замороженного до кристаллического состояния, растворяют в дистиллированной воде и доводят до метки дистиллированной водой.
Срок хранения раствора в условиях, исключающих поглощение диоксида углерода из воздуха - 2 недели.
Примечание - Диэтаноламин следует хранить в морозильной камере холодильника.
10.4.6 Раствор цетилтриметиламмония гидроксида (ЦТА-ОН) молярной концентрации 0,010 моль/дм3
В мерную колбу вместимостью 25 см3, содержащую 4 - 5 см3 дистиллированной воды, помещают 0,75 см3 10 % раствора ЦТА-ОН. Объем раствора в колбе доводят до метки дистиллированной водой и тщательно перемешивают.
Срок хранения в условиях, исключающих поглощение углекислого газа из воздуха - 6 месяцев.
10.4.7 Фоновый электролит № 1 (схема испытаний № 1)
В чистый сухой стакан вместимостью 50 см3 помещают 2,0 см3 раствора оксида хрома (VI) по 10.4.4, 3,0 см3 ДЭА по 10.4.5 и 2,0 см3 дистиллированной воды, тщательно перемешивают. Добавляют 3,0 см3 ЦТА-ОН по 10.4.6 и перемешивают. Полученный раствор фильтруют через мембранный фильтр в сосуд с закрывающейся крышкой.
Срок хранения раствора - 7 суток.
Примечания
1 Запрещается изменять порядок добавления реагентов.
2 Из-за поглощения фоновым электролитом диоксида углерода из воздуха может уменьшаться значение pH в растворе, и при pH < 8,7 возможно образование осадка гидрохромата цетилтриметиламмония. В этом случае необходимо приготовить новый раствор диэтаноламина и затем - новую порцию фонового электролита.
10.4.8 Раствор смеси бензимидазола и винной кислоты молярной концентрации 40 ммоль/дм3 и 10 ммоль/дм3 соответственно
В мерную колбу вместимостью 100 см3 помещают (0,472 ± 0,002) г бензимидазола и (0,150 ± 0,001) г винной кислоты, добавляют приблизительно 50 см3 воды, выдерживают на кипящей водяной бане до полного растворения. Охлаждают раствор до комнатной температуры, затем доводят до метки дистиллированной водой и тщательно перемешивают.
Срок хранения раствора - 6 месяцев.
10.4.9 Раствор 18-краун-6 молярной концентрации 10 ммоль/дм3
В мерную колбу вместимостью 50 см3 помещают (0,132 ± 0,001) г 18-краун-6, растворяют в дистиллированной воде, разбавляют дистиллированной водой до метки и тщательно перемешивают.
Срок хранения раствора в холодильнике при температуре от 2 °С до 8 °С - 6 месяцев.
Примечание - Исходный реактив 18-краун-6 следует хранить в холодильнике при температуре от 2 °С до 8 °С.
10.4.10 Фоновый электролит № 2 (схема испытаний № 2)
В сухом сосуде смешивают 5,0 см3 раствора смеси бензимидазола и винной кислоты по 10.4.8, 2,0 см3 раствора 18-краун-6 по 10.4.9 и 3,0 см3 дистиллированной воды. Сразу после смешивания раствор фильтруют через целлюлозно-ацетатный фильтр в сухой сосуд с завинчивающейся крышкой.
Срок хранения раствора - 7 суток.
10.5 Приготовление градуировочных и контрольных растворов
10.5.1 Запасный раствор оксалат-ионов, массовая концентрация 1000 мг/дм3
В мерную колбу вместимостью 25 см3 вносят (0,0380 ± 0,0002) г натрия щавелевокислого, доводят до метки дистиллированной водой и тщательно перемешивают.
Срок хранения раствора в холодильнике при температуре от 2 °С до 8 °С - 3 месяца.
10.5.2 Запасный раствор формиат-ионов, массовая концентрация 1320 мг/дм3
В мерную колбу вместимостью 50 см3 вносят всю таблетку ГСО состава формиат-иона, доводят до метки дистиллированной водой и тщательно перемешивают.
Срок хранения раствора в холодильнике при температуре от 2 °С до 8 °С - 1 месяц.
10.5.3 Приготовление градуировочного раствора № 1 (схема испытаний № 1)
В мерную колбу вместимостью 50 см3 помещают по 2,5 см3 стандартных образцов состава раствора хлорид-, сульфат-, нитрат-, фосфат- ионов, по 1,25 см3 стандартных образцов состава раствора уксусной кислоты и запасного раствора оксалат-ионов по 10.5.1, 0,4 см3 запасного раствора формиат- ионов по 10.5.2, 0,25 см3 стандартных образцов состава раствора фторид-ионов, доводят до метки дистиллированной водой и тщательно перемешивают.
Состав градуировочного раствора №1 приведен в таблице 3.
Срок хранения раствора в холодильнике при температуре от 2 °С до 8 °С - 2 недели.
10.5.4 Приготовление градуировочного раствора № 2 (схема испытаний № 1)
В мерную колбу вместимостью 25 см3 помещают 5,0 см3 градуировочного раствора № 1 по 10.5.3, доводят до метки дистиллированной водой и тщательно перемешивают.
Состав градуировочного раствора № 2 приведен в таблице 3.
Срок хранения раствора в холодильнике при температуре от 2 °С до 8 °С - 3 дня.
Примечание - Приготовление градуировочных растворов №№ 2 и 3 (см. 10.5.5) проводят только после проверки чистоты дистиллированной воды по 10.7.1.
10.5.5 Приготовление градуировочного раствора № 3 (схема испытаний № 1)
В мерную колбу вместимостью 25 см3 помещают 5,0 см3 градуировочного раствора № 2 по 10.5.4, доводят до метки дистиллированной водой и тщательно перемешивают.
Состав градуировочного раствора № 3 приведен в таблице 4.
Срок хранения раствора - 1 день.
10.5.6 Приготовление контрольного раствора (схема испытаний № 1)
В чистый сухой сосуд с плотно завинчивающейся крышкой объемом не менее 10 см3 помещают 5 см3 градуировочного раствора №1 по 10.5.3 и 5 см3 дистиллированной воды, затем перемешивают. Состав контрольного раствора приведен в таблице 3.
Срок хранения раствора в холодильнике при температуре от 2 °С до 8 °С - 7 суток.
Таблица 3 - Состав градуировочных и контрольного растворов (схема испытаний № 1)
|
Анион |
Массовая концентрация, мг/дм3 |
|||
|
Градуировочный раствор |
Контрольный раствор |
|||
|
№ 1 |
№ 2 |
№ 3 |
||
|
Хлорид-ионы |
50 |
10 |
2,0 |
25 |
|
Сульфат-ионы |
50 |
10 |
2,0 |
25 |
|
Оксалат-ионы |
25 |
5,0 |
1,0 |
12,5 |
|
Нитрат-ионы |
50 |
10 |
2,0 |
25 |
|
Фторид-ионы |
5,0 |
1,0 |
0,2 |
2,5 |
|
Формиат-ионы |
10,6 |
2,1 |
0,4 |
5,3 |
|
Фосфат-ионы |
25 |
5,0 |
1,0 |
12,5 |
|
Ацетат-ионы |
24,6 |
4,9 |
1,0 |
12,3 |
10.5.7 Приготовление градуировочного раствора № 1 (схема испытаний № 2)
В мерную колбу вместимостью 100 см3 помещают по 5,0 см3 стандартного образца состава раствора катионов аммония, калия, натрия, кальция; 2,5 см3 стандартного образца состава раствора ионов магния, доводят до метки дистиллированной водой и перемешивают.
Состав градуировочного раствора № 1 приведен в таблице 4.
Срок хранения раствора в холодильнике при температуре от 2 °С до 8 °С - 3 месяца.
10.5.8 Приготовление градуировочного раствора № 2 (схема испытаний № 2)
В мерную колбу вместимостью 25 см3 помещают 2,5 см3 градуировочного раствора №1 по 10.5.7, доводят до метки дистиллированной водой и тщательно перемешивают.
Состав градуировочного раствора № 2 приведен в таблице 4.
Срок хранения раствора в холодильнике при температуре от 2 °С до 8 °С - 3 недели.
Примечание - Приготовление градуировочных растворов №№ 2 и 3 (см. 10.5.8) проводят только после проверки чистоты дистиллированной воды по 10.7.1.
10.5.9 Приготовление градуировочного раствора № 3 (схема испытаний № 2)
В мерную колбу вместимостью 25 см3 помещают 2,5 см3 градуировочного раствора № 2 по 10.5.8, доводят до метки дистиллированной водой и тщательно перемешивают.
Состав градуировочного раствора № 3 приведен в таблице 4.
Срок хранения раствора в холодильнике при температуре от 2 °С до 8 °С - 1 неделя.
10.5.10 Приготовление контрольного раствора (схема испытаний № 2)
В мерную колбу вместимостью 25 см3 вносят 5,0 см3 градуировочного раствора № 1 по 10.5.7, разбавляют до метки дистиллированной водой и перемешивают.
Состав контрольного раствора приведен в таблице 4.
Срок хранения раствора в холодильнике при температуре от 2 °С до 8 °С - 1 месяц.
Таблица 4 - Состав градуировочных и контрольного растворов (схема испытаний № 2)
|
Катион |
Массовая концентрация, мг/дм3 |
|||
|
Градуировочные растворы |
Контрольный раствор |
|||
|
№1 |
№2 |
№3 |
||
|
Аммоний |
50 |
5,0 |
0,5 |
10 |
|
Калий |
50 |
5,0 |
0,5 |
10 |
|
Натрий |
50 |
5,0 |
0,5 |
10 |
|
Магний |
25 |
2,5 |
0,25 |
5 |
|
Кальций |
50 |
5,0 |
0,5 |
10 |
10.6 Подготовка системы капиллярного электрофореза и капилляра к работе
Подготовку системы капиллярного электрофореза к работе проводят в соответствии с руководством по ее эксплуатации.
Перед началом работы рекомендуется промыть капилляр по следующей схеме:
- 3 минуты дистиллированной водой;
- 3 минуты раствором соляной кислоты по 10.4.3;
- 2 минуты дистиллированной водой;
- 3 минуты раствором гидроксида натрия по 10.4.2;
- 2 минуты дистиллированной водой;
- 3 минуты свежей порцией дистиллированной воды;
- 10 минут фоновым электролитом по 10.4.7 или 10.4.10 в зависимости от применяемой схемы испытаний.
Затем проверяют состояние капилляра, анализируя контрольный раствор по 10.5.6 или 10.5.10 в зависимости от применяемой схемы испытаний. При этом в первую очередь обращают внимание на стабильность времен миграции.
Непосредственно перед анализом капилляр промывают фоновым электролитом по 10.4.7 или 10.4.10 (в зависимости от применяемой схемы испытаний) в течение 3 минут.
После каждого анализа капилляр промывают фоновым электролитом по 10.4.7 (при использовании схемы испытаний № 1) или дистиллированной водой (при использовании схемы испытаний № 2) не менее 2 минут.
При работе с пробами грунтов на электрофореграмме может наблюдаться дрейф базовой линии и появление ступеней, что связано с возможным мешающим влиянием матричных компонентов или примесей. В этом случае рекомендуется:
- увеличить время промывки между анализами;
- при появлении ступеней заменять свежими порциями фоновой электролит в пробирках, как на входе, так и на выходе;
- промыть капилляр по следующей схеме:
- 3 минуты дистиллированной водой;
- 3 минуты раствором гидроксида натрия по 10.4.2;
- 2 минуты дистиллированной водой;
- 3 минуты свежей порцией дистиллированной воды.
В конце рабочего дня капилляр промывают по следующей схеме:
- 2 минуты дистиллированной водой;
- 5 минут раствором гидроксида натрия по 10.4.2;
- 5 минут дистиллированной водой и оставляют в воде, подняв пробирки с водой на входе и выходе.
10.7 Градуировка системы капиллярного электрофореза
10.7.1 Проверка чистоты дистиллированной воды
Проводят предварительную градуировку системы с использованием градуировочного раствора № 1 по 10.5.3 или 10.5.7. Для этого регистрируют две электрофореграммы градуировочного раствора № 1 в условиях анализа, указанных в 10.7.2 (согласно применяемой схеме испытаний) и обрабатывают по процедуре градуировки в соответствии с руководством пользователя программного обеспечения.
Затем регистрируют две электрофореграммы дистиллированной воды в условиях анализа, указанных в 10.7.2. Качество дистиллированной воды признается удовлетворительным, если на полученных электрофореграммах не обнаружены пики определяемых компонентов.
Примечание - На всех электрофореграммах, зарегистрированных в условиях схемы испытаний № 1, всегда присутствует пик гидрокарбоната, который может быть как положительным, так и отрицательным. Его наличие не является признаком неудовлетворительного качества дистиллированной воды.
Если на полученных электрофореграммах дистиллированной воды наблюдаются положительные пики, соответствующие временам миграции определяемых компонентов, то это указывает на загрязнение дистиллированной воды. В этом случае следует принять меры к устранению загрязнений, например, использовать бидистиллированную воду, чистоту которой также следует проверить. Если на этих же местах наблюдаются обратные пики, то следует проверить чистоту посуды, используемой для анализа, и (или) выявить загрязненные реактивы.
Примечание - Допускается использовать дистиллированную воду, если на электрофореграмме обнаружены положительные пики хлорид- и/или сульфат-ионов, но массовая концентрация каждого из ионов не превышает 0,2 мг/дм3.
10.7.2 Проведение градуировки системы капиллярного электрофореза
Для проведения градуировки системы анализируют градуировочные растворы № 1, № 2, № 3 по 10.5.3 - 10.5.5 или по 10.5.7 - 10.5.9, регистрируя по две электрофореграммы каждого раствора в условиях, указанных в таблице 5.
Непосредственно перед анализом все растворы центрифугируют с частотой вращения 5000 об/мин в течение 5 мин.
Через 5 - 7 анализов пробирки на входе и выходе следует заново заполнять свежими порциями фонового электролита.
Таблица 5 - Условия анализа градуировочных растворов
|
Параметр |
Значение |
|
|
Схема испытаний № 1 |
Схема испытаний № 2 |
|
|
Определяемые
компоненты |
Хлорид-,
сульфат-, оксалат-, нитрат-, |
Аммоний,
калий, натрий, магний, |
|
Капилляр |
Общая длина 60 см, внутренний диаметр 75 мкм |
|
|
Температура, °С |
20 |
|
|
Длина волны, нм |
254 |
267 (254*) |
|
Ввод пробы |
30 мбар, 5 с |
|
|
Напряжение, кВ |
Минус 25 |
25 |
|
Время анализа, мин |
От 4 до 5 |
От 4,5 до 6 |
|
Фоновый электролит |
Раствор по 10.4.7 |
Раствор по 10.4.10 |
|
* Для модификаций системы капиллярного электрофореза с детектором, работающим на постоянной длине волны. |
||
Примеры электрофореграмм градуировочных растворов и проб приведены в приложении E.
На полученных электрофореграммах проверяют правильность автоматической разметки пиков и, если необходимо, корректируют ее. Обрабатывают электрофореграммы согласно процедуре градуировки в соответствии с руководством пользователя программного обеспечения, используемого для сбора и обработки данных, и устанавливают градуировочную характеристику в виде линейной зависимости площади пика соответствующего аниона от его массовой концентрации.
Градуировочная характеристика признается приемлемой при выполнении следующих условий:
- коэффициент корреляции, рассчитанный программой, превышает 0,99;
- относительное отклонение массовой концентрации компонента в каждой точке градуировочной характеристики, вычисленное программой от фактического значения, не превышает ±8 %.
В противном случае находят и устраняют причины неудовлетворительных результатов, после чего градуировку системы повторяют.
Градуировку системы повторяют в следующих случаях:
- при отрицательных результатах контроля стабильности градуировочной характеристики (см. 10.7.3);
- при замене капилляра;
- при изменении одного из условий проведения анализа (температуры, напряжения, времени и давления при вводе пробы).
10.7.3 Контроль стабильности градуировочной характеристики
Контроль стабильности градуировочной характеристики проводят в начале рабочего дня перед измерениями рабочих проб.
Для этого используют приготовленный контрольный раствор по 10.5.6 или 10.5.10, который анализируют не менее двух раз в условиях, соответствующих анализу градуировочных смесей (см. 10.7.2). Градуировочную характеристику признают стабильной, если при каждом вводе отклонение измеренного значения массовой концентрации компонента от заданного значения не превышает ±11 %.
При неудовлетворительных результатах контроля промывают капилляр и дважды анализируют контрольный раствор по 10.7.2. При повторных отклонениях, превышающих указанные нормативы, повторно градуируют систему.
10.8 Проведение испытаний
10.8.1 Подготовка водной вытяжки
В плоскодонные конические колбы вместимостью 100 см3 помещают по (5,0 ± 0,02) г воздушно-сухих проб, и приливают по 25 см3 дистиллированной воды.
Перемешивают, закрывают пробками и встряхивают в течение 30 минут на перемешивающем устройстве.
Полученные вытяжки подготавливают по одному из вариантов:
- фильтруют в герметично закрывающуюся виалу через фильтр «синяя лента» или через одноразовый мембранный фильтр (размер пор 0,2 мкм), отбрасывая первые 2 см3;
- центрифугируют в течение 5 минут со скоростью вращения 5000 об/мин и переносят надосадочную жидкость в герметично закрывающуюся виалу.
Объем полученного фильтрата (центрифугата) должен составлять не менее 1,5 см3.
Полученные водные вытяжки следует проанализировать в день приготовления. Не допускается хранение водной вытяжки над осадком.
10.8.2 Анализ водных вытяжек
В сухую одноразовую пробирку типа Эппендорф помещают от 0,5 до 1,0 см3 подготовленной по 10.8.1 водной вытяжки, центрифугируют в течение 5 минут при 5000 об/мин и анализируют в условиях, указанных в 10.7.2.
По окончании анализа проверяют правильность автоматической разметки пиков, удаляют лишние пики. Используя программное обеспечение, проводят идентификацию анионов по совпадению времен миграции компонентов в пробе и контрольном растворе при ширине окна идентификации 5%.
Если анализируемые анионы обнаружены, то определяют их массовые концентрации с использованием градуировочной характеристики, установленной по 10.7.2.
Если измеренные значения массовой концентрации одного или нескольких анионов превышают верхний предел диапазона градуировочной характеристики, то водную вытяжку разбавляют дистиллированной водой так, чтобы массовая концентрация компонента в разбавленной пробе находилась в середине диапазона градуировочной характеристики, и повторяют регистрацию электрофореграммы. Коэффициент разбавления вычисляют по формуле
|
|
(2) |
где Vк - объем колбы, см3;
Va - объем аликвоты пробы, см3.
10.9 Обработка результатов испытаний
Массовую долю водорастворимых форм компонентов в пробе (млн-1) рассчитывают по формуле
|
|
(3) |
где X - массовая доля компонента в пробе, млн-1;
С - измеренное значение массовой концентрации компонента (см. 10.8.2), мг/дм3;
V - объем дистиллированной воды, взятый для получения водной вытяжки, см3;
m - масса воздушно-сухой пробы, г;
Q - коэффициент разбавления пробы дистиллированной водой по 10.8.2, если пробу не разбавляли, то Q = 1.
10.10 Интерпретация результатов испытаний
10.10.1 Маркерами биокоррозии являются анионы органических кислот, например ацетат- и формиат-ионы, а также ионы аммония, хлорид- и сульфат-ионы. Повышенное содержание маркерных ионов в водных вытяжках проб грунтов, отобранных вблизи подземных сооружений, по сравнению с контрольными может указывать на протекание процессов биокоррозии.
10.10.2 Определение ионного состава водной вытяжки позволяет оценить уровень электропроводности грунтов и на этой основе сделать заключения о степени биокоррозионной агрессивности грунтов.
Приложение А
(справочное)
Отбор проб грунта во время шурфовки подземных сооружений
|
Точки отбора проб на торцевой (А) и боковой (Б) поверхностях
трубопровода: Рисунок А.1. - Схема отбора проб грунта при шурфовке трубопровода |
|
Точки отбора проб на торцевой (А) и боковой (Б)
поверхностях резервуара: Рисунок А.2. - Схема отбора проб грунта при шурфовке резервуаров |
Приложение Б
(справочное)
Определение количества клеток бактерий в грунте методом десятикратных
граничных разведений
Б.1 Определение количества сульфатредуцирующих бактерий
Стерильную питательную среду Постгейта В, приготовленную по приложению B, разливают стерильной градуированной пипеткой по 18 см3 в стерильные сухие бактериологические пробирки. Объем бактериологических пробирок 20 (±2) см3. Объем среды -до заполнения пробирки 1 - 2 см3. На каждой пробирке пишут порядковый номер, отвечающий номеру разведения, начиная с цифры 2. Первое разведение получают в колбе с 10 навеской грунта и 90 см3 стерильной водопроводной воды (1:10). Потом переносят стерильной пипеткой 2 см3 грунтовой суспензии из колбы в первую пробирку с 18 см3 среды. Получают второе разведение - 1:100. Суспензию из этого разведения тщательно перемешивают, закрыв пробирку стерильной резиновой пробкой. Далее другой стерильной пипеткой отбирают 2 см3 полученного разведения и переносят в следующую пробирку, получая третье разведение - 1:1000. Аналогичным способом далее готовят последующие разведения. Степень разведения определяют, исходя из количества бактерий в пробе грунта и, соответственно, число разведений тем больше, чем больше бактерий в исследуемом грунте. Во все пробирки после получения разведений добавляют стерильную питательную среду для вытеснения воздуха из пробирки и герметично закрывают стерильными резиновыми пробками. Пробирки устанавливают в штатив, который помещают в термостат при температуре (28 ± 2) °С и инкубируют не менее 20 суток. Параллельно с посеянными пробирками в термостат ставят пробирки со стерильной питательной средой (контроль среды).
Б.2 Определение количества автотрофных ацидофобных тионовых бактерий
Стерильную питательную среду Бейеринка согласно приложению B разливают стерильной пипеткой по 13,5 см3 в стерильные сухие бактериологические пробирки. Затем переносят стерильной пипеткой 1,5 см3 почвенной суспензии в первую пробирку с 15 см3 питательной среды. Получают второе разведение - 1:100. Полученную суспензию тщательно перемешивают с помощью другой стерильной пипетки, набирая в пипетку и выпуская из нее полученную суспензию. Эту процедуру повторяют трижды, что обеспечивает перемешивание суспензии и уменьшает адсорбцию клеток на стенках пипетки. Затем этой же пипеткой набирают 1,5 см3 полученного разведения и переносят его в другую пробирку, получая третье разведение - 1:1000. Степень разведения обуславливается возможным количеством бактерий в пробе грунта. Контролем среды является пробирка со стерильной средой Бейеринка. Пробирки нумеруют, помещают в термостат при температуре (28 ± 2) °С и выдерживают не более чем 7 суток.
Б.3 Обработка результатов
После инкубации пробирок в термостате наличие роста сульфатредуцирующих бактерий определяют визуально по почернению среды и наличию черного осадка вследствие образования сульфида железа.
Порядковый номер пробирки, в которой еще наблюдается рост бактерий, отвечает порядку численности бактерий в 1 см3 грунтовой суспензии.
Количество бактерий А (клеток/г АСГ1)) в 1 г грунта определяют по формуле
|
|
(Б.1) |
где Квл. - коэффициент влажности;
Тбак. - количество бактерий в 1 см3 исходной грунтовой суспензии.
Коэффициент влажности (Квл., %) рассчитывают по формуле
__________
1) В пересчете на абсолютно сухой грунт (АСГ).
|
|
(Б.2) |
где Р - относительная влажность грунта, %.
Относительную влажность грунта определяют по ГОСТ 28268.
Б.4 Оформление результатов
Результаты посева и расчетов заносят в протокол, в котором указывают
- место отбора образцов почв;
- глубина укладки подземного сооружения;
- погодные условия при отборе образцов почв;
- дата проведения отбора проб и проведения определений;
- визуальные наблюдения (окраска, запах);
- количество бактерий (А) в 1 г почв (исследуемого и контрольного);
- коэффициент влажности почв (Квл.);
- обозначение настоящего стандарта;
- фамилия, инициалы лица, проводившего определения.
Приложение В
(справочное)
Приготовление питательных сред
В.1 Общие требования
Для приготовления питательных сред применяют химически чистые реактивы. Реактивы взвешивают с погрешностью, не превышающей ±0,01 г.
Все работы с питательными средами проводят с соблюдением правил стерильности над пламенем газовой горелки.
В.2 Приготовление среды Постгейта В для выращивания сульфатредуцирующих бактерий
В.2.1. Приготовление основного раствора среды Постгейта В
В состав основной среды Постгейта В входят следующие реактивы:
|
калий фосфорнокислый однозамещенный (KН2РO4) |
…..…..0,5 г |
|
аммоний хлористый (NH4Cl) |
…..…..1,0 г |
|
кальций сернокислый 2-водный (CaSO4·2Н2О) |
…..…..1,0 г |
|
магний сернокислый 7-водный (MgSO4·7Н2O) |
…..…..2,0 г |
|
кальций молочнокислый 5-водный (С6Н10О6Са·5Н2O) |
…..…..3,5 г |
|
водопроводная вода |
…..988 см3 |
Допускается замена кальция молочнокислого на натрий молочнокислый (3,5 г).
В.2.2. Приготовление добавок
Добавки к основной среде Постгейта В готовят каждую отдельно. В стерильный основной раствор перед посевом вносят добавки (на 1 дм3 среды):
- дрожжевой экстракт: готовят в виде 10%-го раствора и добавляют 10 см3 (массовая концентрация компонента в приготовленной среде 1 г/дм3);
- железо сернокислое закисное 7-водное (FeSO4·7H2O): готовят в виде 5 %-ного раствора в 1 - 2 %-ном растворе соляной или серной кислоты и добавляют 10 см3 (массовая концентрация компонента в приготовленной среде 0,5 г/дм3);
- натрий углекислый кислый (NaHCO3) готовят в виде 10 %-ного водного раствора, который используют для установления pH среды в интервале от 7,2 до 7,5.
Раствор натрия сульфида готовят следующим образом: 1 %-ный раствор сульфида натрия в 1 %-ном растворе натрия углекислого кислого разливают в стеклянные ампулы объемом 2 см3, ампулы запаивают и стерилизуют автоклавированием при давлении 0,5 атм и температуре 112,5 °С в течение 20 мин. Перед посевом ампулы вскрывают и приливают 1 - 2 см2 раствора в основную среду до появления темно-серой окраски среды.
В.3 Приготовление среды Бейеринкадля культивирования тионовых бактерий
В состав среды Бейеринка входят следующие реактивы:
|
натрий серноватистокислый 5-водный (Na2S2O3·5Н2O) |
….…..5,0 г |
|
хлористый аммоний (NH4Cl) |
….…..0,1 г |
|
натрий углекислый кислый (NaHCO3) |
….…..1,0 г |
|
натрий фосфорнокислый двузамещенный 12-водный (Na2HPO4·12H2O) |
….…..0,2 г |
|
хлористый магний 6-водный (МgСl2·6Н2O) |
….…..0,1 г |
|
железо сернокислое закисное 7-водное (FeSO4·7Н2O) |
…..0,005 г |
|
водопроводная вода |
...1000 см3 |
Значение pH готовой среды устанавливают при помощи концентрированной серной кислоты в пределах 7,0 - 7,2.
Натрий серноватистокислый и натрий углекислый кислый готовят и стерилизуют отдельно.
Натрий серноватистокислый готовят в виде 50 %-ного водного раствора и вносят в стерильную среду 10 см3 (массовая концентрация компонента в приготовленной среде 5 г/дм3).
Натрий углекислый кислый готовят в виде 10 %-ного раствора и вносят в стерильную среду 10 см3 (массовая концентрация компонента в приготовленной среде 1 г/дм3).
В.4 Стерилизация посуды и питательных сред
В.4.1 Посуду моют водой при температуре (60 ± 10) °С с использованием моющего средства по ГОСТ 25644 и затем промывают дистиллированной водой.
В.4.2 Посуду, подготовленную по В.4.1, заворачивают в бумагу, предварительно закрыв колбы, пробирки, пипетки ватными пробками, и стерилизуют в сухожаровом шкафу при температуре (160 ± 2) °С в течение (150 ± 5) мин.
В.4.3 Стерильную посуду хранят в бумаге в сухом помещении в отдельном шкафу не более 10 суток.
В.4.4 Питательные среды разливают в стерильные колбы, приготовленные в соответствии с В.4.1, В.4.2, В.4.3, закрывают ватно-марлевыми пробками и стерилизуют в автоклаве при 1,5 атм и температуре 127 °С в течение 30 мин.
В.4.5 Добавки к питательным средам стерилизуют отдельно при 0,5 атм и температуре 112,5 °С в течение 20 мин.
В.4.6 Не допускается смачивание краев колб и ватно-марлевых пробок.
Приложение Г
(справочное)
Схема строения микрочипа и картриджа для проведения ПЦР
в режиме реального времени
|
а) б) Рисунок Г.1 - Схема микрочипа а) и картриджа б) |
Приложение Д
(справочное)
Пример графиков накопления флуоресцентного сигнала по каналу FAM
|
1 - кривая накопления флуоресцентного сигнала по
каналу FAM для положительного контроля ПЦР; Рисунок Д.1 -Примеры ПЦР-кривых |
Приложение Е
(справочное)
Примеры электрофореграмм
Примеры электрофореграмм приведены на рисунках Е.1, Е.2, Е.3, Е.4
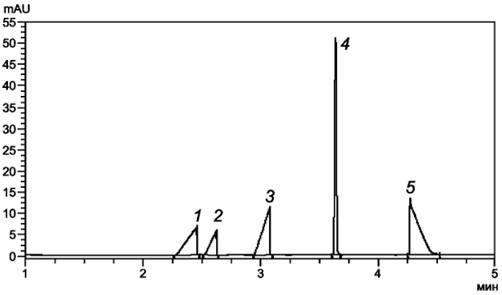
|
1 -
хлорид-ионы; 2 - сульфат-ионы; 3 - оксалат-ионы; 4 -
нитрат-ионы; 5 - фторид-ионы; Рисунок Е.1 - Электрофореграмма градуировочного раствора (схема испытаний № 1) |
|
Найдено, млн-1: 1 -
хлорид-ионы - 6,1; 2 - сульфат-ионы - 62; 3 - оксалат-ионы -
28; 4 - нитрат-ионы - 30; 5 - фторид-ионы - 1,4; Рисунок Е.2 - Электрофореграмма подготовленной пробы (схема испытаний № 1) |
|
1 - аммоний; 2 - калий; 3 - натрий; 4 - магний; 5 - кальций Рисунок Е.3 - Электрофореграмма градуировочного раствора (схема испытаний № 2) |
|
Найдено, млн-1: 1 - аммоний - 8,1; 2 - калий - 13,0; 3 - натрий - 5,6; 4 - магний - 12,4; 5 - кальций - 29,0 Рисунок Е.4 - Электрофореграмма подготовленной пробы (схема испытаний № 2) |
Библиография
|
[1] |
Андреюк Е.И., Козлова И.П., Коптева Ж.П., Пиляшенко-Новохатний А.И., Занина В.В., Пуриш Л.М.. Микробная коррозия подземных сооружений - К.: Наукова книга, 2005, 258 с. |
|
|
[2] |
ДСТУ 3291-95 |
Единая система защиты от коррозии и старения. Методы оценки коррозионной активности грунтов и выявления наличия микробной коррозии на поверхности подземных металлических сооружений. |
|
[3] |
Аринушкина Е.В. Руководство по химическому анализу почв. М., Издательство МГУ, 1970, 488 с. |
|
|
[4] |
ПНД
Ф 16.1:2:2.2:3.37-2002 |
Методика измерений валового содержания серы в почвах, грунтах, донных отложениях и отходах турбидиметрическим методом. М., 2011 |
|
[5] |
«Безопасность работы с микроорганизмами 1-11 групп патогенности (опасности)» |
|
|
[6] |
«Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности» |
|
|
Ключевые слова: анодное заземление, биокоррозия, биокоррозионная агрессивность, тионовые бактерии, сульфатредуцирующие бактерии, подземные сооружения, ген диссимиляционной сульфитредуктазы, ПЦР в режиме реального времени, метаболиты, капиллярный электрофорез |