Государственное санитарно-эпидемиологическое
нормирование
Российской Федерации
Федеральная служба по надзору в сфере защиты прав
потребителей
и благополучия человека
3.1.2. ЭПИДЕМИОЛОГИЯ. ПРОФИЛАКТИКА ИНФЕКЦИОННЫХ
ЗАБОЛЕВАНИЙ. ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Генетический мониторинг циркуляции вирусов
кори и краснухи
Методические рекомендации
МР 3.1.2.0135-18
Москва 2019
1. Разработаны ФБУН «Московский научно-исследовательский институт эпидемиологии и микробиологии им. Г.Н. Габричевского» (С.В. Шульга, О.В. Цвиркун, Н. Т. Тихонова, Т.С. Чехляева, А.Г. Герасимова, Т.А. Мамаева, М.А. Наумова).
2. Утверждены руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации А.Ю. Поповой 8 ноября 2018 г.
3. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель Федеральной службы ________________________ А.Ю. Попова 8 ноября 2018 г. Дата введения: с момента утверждения |
3.1.2.
ЭПИДЕМИОЛОГИЯ. ПРОФИЛАКТИКА ИНФЕКЦИОННЫХ
ЗАБОЛЕВАНИЙ. ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Генетический мониторинг циркуляции вирусов
кори и краснухи
Методические рекомендации
МР 3.1.2.0135-18
I. Область применения
1.1. Настоящие методические рекомендации (далее - МР) содержат теоретические принципы и практические рекомендации по мониторингу циркуляции вирусов кори и краснухи, анализу и интерпретации полученных данных, их использованию в качестве доказательства элиминации кори и краснухи.
1.2. МР предназначены для специалистов органов и организаций Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, а также научных и медицинских организаций.
II. Общие положения
2.1. Глобальный стратегический план Всемирной организации здравоохранения (далее - ВОЗ) по кори и краснухе на 2012 - 2020 гг. предполагает достижение элиминации кори в 5 из 6 регионов ВОЗ и краснухи - в 2 регионах (Панамериканский, Европейский) [1]. В Российской Федерации реализуется программа «Элиминация кори и краснухи в Российской Федерации (2016 - 2020 гг.)», в соответствии с которой планируется достижение элиминации кори и краснухи к 2020 г. с последующей ее верификацией (подтверждением).
Усиление системы эпидемиологического надзора - одна из ключевых стратегий достижения элиминации кори/краснухи [2 - 4]. Организованный в масштабе страны индивидуальный учет больных с проведением эпидемиологического расследования, лабораторной верификацией и генетическим типированием случаев заболевания, подозрительных на корь/краснуху, позволяет обеспечить высокую достоверность данных эпидемиологического надзора.
2.2. Генетическое типирование вирусов позволяет определять эндемичные для конкретной страны генотипы, осуществлять мониторинг циркуляции вирусов на региональном и глобальном уровнях, идентифицировать импортированные случаи инфекции (генотипы вируса), определять их географическое происхождение, документировать прекращение циркуляции ранее эндемичных генотипов, демонстрируя прогресс в контроле инфекции и достижении ее элиминации, подтверждать (верифицировать) достижение и поддержание фазы элиминации [4, 5].
По критериям ВОЗ, демонстрация отсутствия циркуляции какого-либо из генетических вариантов вируса на протяжении не менее 12 месяцев при условии генотипирования не менее 80 % вспышек (цепочек циркуляции) на определенной территории является необходимым для подтверждения достижения элиминации инфекции [2, 4]. Отсутствие эндемичной циркуляции вируса на протяжении не менее 36 месяцев рассматривается в качестве одного из ключевых показателей, используемых в верификации элиминации.
Генотип вирусов кори и краснухи не имеет значения с точки зрения диагностики заболеваний и лечения пациентов, не требует изменения тактики противоэпидемических мероприятий и мероприятий в очагах, по необходимости генотипирование может быть проведено ретроспективно при наличии соответствующих клинических образцов.
2.3. Верификация элиминации требует совершенствования подходов к генетическому мониторингу циркуляции вирусов кори/краснухи, интеграции эпидемиологических и лабораторных (генетических) данных.
III. Генотипирование вируса кори, методология,
номенклатура генотипов, географическое распространение
3.1. Вирус кори является представителем семейства Paramyxoviridae, рода Morbillivirus. Вирусные частицы сферической формы имеют размер 120 - 250 нм. Вирион состоит из свернутого во вторичную шарообразную структуру нуклеокапсида, построенного по спиральному типу симметрии и внешней липидной оболочки, имеющей происхождение из клетки хозяина.
Геном вируса представлен одноцепочечной несегментированной РНК негативной полярности длиной около 16000 нт. Шесть не перекрывающихся структурных генов расположены линейно и кодируют 6 структурных белков: нуклеопротеин (N), фосфопротеин (Р), матриксный белок (М), фузионный белок (F), гемагглютинин (Н), полимераза («большой» белок L) и два неструктурных белка - С и V. Геномная РНК служит матрицей для синтеза антигеномной РНК позитивной полярности, которая, в свою очередь, является матрицей для транскрипции вирусных белков и синтеза геномной РНК в процессе репликации. Несмотря на то, что вирус кори представлен единственным серотипом, его генетическое разнообразие позволяет выделять различные генетические варианты и группировать их по происхождению и истории циркуляции, что находит свое практическое применение в мониторинге циркуляции вируса.
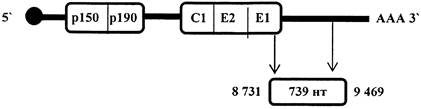
Для генетического типирования вируса кори используются данные сравнительного анализа нуклеотидных последовательностей (рис. 1) СООН - концевого фрагмента N-гена (450 нт, 1126 - 1575 нт) и полноразмерной последовательности Н-гена (1 854 нт) [6 - 12]. Указанные гены являются наиболее вариабельными структурными генами вируса.
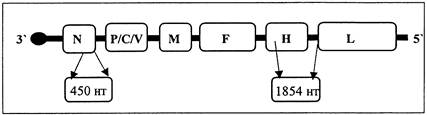
Рис. 1. Схема структурной организации генома вируса
кори и положение
«окон секвенирования», используемых для типирования вируса (гены N, Н)
Для типирования вируса достаточно анализа СООН - концевого фрагмента N-гена, для эталонных штаммов новых генотипов необходим дополнительно анализ нуклеотидной последовательности гена Н.
3.2. Генотип - оперативная таксономическая единица, определяемая на основании различий нуклеотидных последовательностей у разных штаммов вируса. Генотип включает родственные штаммы, отличающиеся на нуклеотидном уровне от ближайшего штамма другого генотипа не менее чем на 2,5 % для СООН - концевого фрагмента N-гена и 2 % - для Н-гена. Некоторые генотипы характеризуются гетерогенностью, превышающей 2,5 % для 450 нт N-гена [9], для других отличие последовательностей Н-гена составляет менее 2 %. Отказ от выделения новых генотипов в первом случае и отнесение родственных вирусов к разным генотипам во втором обусловлены необходимостью адаптации номенклатуры генотипов к задачам мониторинга географического распространения и циркуляции вирусов кори. Современный подход в разработке номенклатуры генотипов вируса кори предполагает таким образом учет как филогенетических взаимоотношений, так и географии циркуляции разных штаммов вируса, что позволяет использовать данные типирования в эпидемиологическом надзоре за коревой инфекцией.
3.3. Номенклатура генотипов вируса кори предусматривает единый подход в наименовании штаммов как описано ниже:
- MVi - изолят вируса, полученный на культуре клеток, MVs - нуклеотидная последовательность СООН - концевого фрагмента N-гена вируса, полученная из клинического материала;
- город/регион, в котором выделен штамм;
- страна, обозначенная трехбуквенным кодом, принятым в ВОЗ;
- порядковый номер эпидемиологической недели, в которую выделен штамм (от 1 до 53), календарный год;
- порядковый номер штамма в том случае, если в течение недели выделено более 1 штамма;
- генотип, к которому относится штамм;
- в случае выделения вируса от пациентов с энцефалитом телец включения или подострым склерозирующим панэнцефалитом в наименование штамма может быть добавлено необходимое обозначение («МГОЕ» или «SSPE» соответственно).
Например, изолят MVi/Moscow.RUS/51.12[D8] выделен на 51-й эпидемиологической неделе 2012 г. в Российской Федерации, г. Москве и принадлежит к генотипу D8.
3.4. Номенклатура генотипов вируса кори включает 24 генотипа, представляющих 8 филогенетических клад (групп). Для всех генотипов описаны эталонные штаммы вируса, как правило, исторически изолированные первыми либо отражающие гетерогенность штаммов генотипа, циркулирующих в последнее время. Краткая характеристика генотипов вируса кори представлена в табл. 1.
Таблица 1
Характеристика генотипов вируса кори
|
Клада (группа) |
Генотип |
Референс-штамм |
Номер в GenBank |
Первая изоляция генотипа/страна, регион эндемичной циркуляции |
Последняя изоляция, год |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
А |
А |
MVi/Maryland.USA/0.54 |
U01987 |
США, 1954 г./Предположительно глобальное распространение в довакцинальную эру |
2008 |
|
В |
В1 |
MVi/Yaounde.CMR/12.83 |
U01998 |
Камерун, 1983 г. |
1983 |
|
B |
В2 |
МVi/Libreville.GAB/0.84 |
U01994 |
Габон, 1984/Западная, Центральная Африка |
2011 |
|
В3 |
MVi/New York.USA/0.94 |
L46753 |
Гамбия, 1991/Западная, Центральная Африка, Российская Федерация 2017 - 2018 |
Активный |
|
|
MVi/Ibadan.NGA/0.97/1 |
AJ232203 |
||||
|
С |
С1 |
MVi/Tokyo.JPN/0.84 |
AY043459 |
Сев. Ирландия, 1956/Япония 1983 - 1985, Испания 1979 - 1981 |
1992 |
|
С2 |
MVi/MarylancL.USA/0.77 |
M89921 |
США, 1977/Западная Европа 1990 - 2004, Марокко 1998 - 2004 |
2004 |
|
|
MVi/Erlangen.DEU/0.90 |
X84872 |
|
|
||
|
D |
D1 |
MVi/Bristol.GBR/0.74 |
D01005 |
Великобритания, 1960/Великобритания 1960, 1969, 1974; Австралия 1973 - 1981, Ирландия 1983, 1986 |
1986 |
|
D2 |
MVi/Johannesburg.ZAF/0.88/1 |
U64582 |
Южная Африка 1986/Южная Африка 1986 - 1989, Замбия 1992, 2001 - 2002 |
2005 |
|
|
D3 |
MVi/Illinois.USA/0.89/1 |
U01977 |
США, 1987/Япония 1987, 1997 - 1998, 2000 - 2001, Филиппины 2000 - 2004 |
2004 |
|
|
D4 |
MVi/Montreal.CAN/0.89 |
U01976 |
Южная Африка, 1978/Южная Азия (Индия, Пакистан, Иран), Восточная Африка (Эфиопия, Кения), Южная Африка, Зимбабве Намибия. Российская Федерация 1999 - 2003, 2011 - 2013 |
Активный |
|
|
D5 |
MVi/Palau.PLW/0.93 |
L46758 |
Южная Африка, 1978/Япония 1991, 1997 - 2008, Таиланд 1993, 1998 - 2008, Камбоджа 2000 - 2001 |
2009 |
|
|
MVi/Bangkok.THA/12.93/1 |
AF079555 |
||||
|
D6 |
MVi/New Jersey.USA/0.94/1 |
L46750 |
Великобритания, 1990/Европейский регион ВОЗ 1990 - 2007, Латинская Америка 1996 - 1998, Российская Федерация 2003 - 2007 |
2007 |
|
|
D7 |
MVi/Victoria.AUS/16.85 |
AF243450 |
Великобритания, 1980/Австралия 1985 - 1988, 2000, Великобритания 1980, 1982, 2002 - 2003, Германия 2000 - 2001, Франция, Испания 2001-2003, Ирландия 2002 - 2003 |
2007 |
|
|
MVi/Illinois.USA 50.99 |
AY037020 |
||||
|
D8 |
MVi/Manchester.GBR/30.94 |
AF280803 |
Великобритания 1994/Индия, Непал, Российская Федерация 2013 - 2018 |
Активный |
|
|
D9 |
MVi/Victoria.AUS/12.99 |
AF481485 |
Австралия 199/Индонезия, Малайзия, Таиланд 2008 - 2013 |
Активный |
|
|
D10 |
MVi/Kampala.UGА/51.00/1 |
AY923185 |
Уганда, 2000/Уганда |
2005 |
|
|
D11 |
MVi/Menglian.Yunnan.CHN/47.09 |
GU440571 |
Австралия 2001/Мьянма (предположительно) |
2010 |
|
|
Е |
Е |
MVi/Goettingen. DEU/0.71 |
X84879 |
США, 1970/Нет данных |
1987 |
|
F |
F |
MVs/Madrid. ESP/0.94 [SSPE] |
X84865 |
Испания, 1970/Нет данных |
1994 |
|
G |
G1 |
MVi/Berkeley.USA/0.83 |
U01974 |
США, 1983/Нет данных |
1983 |
|
G2 |
MVi/Amsterdam.NLD/49.97 |
AF171232 |
Нидерланды 1997/Индонезия, Малайзия |
2004 |
|
|
G3 |
MVi/Gresik.IDN/18.02 |
AY184217 |
Австралия, 1999/Восточный Тимор, Индонезия |
Активный |
|
|
Н |
Н1 |
MVi/Hunan.CHN/0.93/7 |
AF045212 |
Тайвань, 1992/Китай |
Активный |
|
Н2 |
MVi/Beijing.CHN/0.94/1 |
AF045217 |
Китай 1994/Вьетнам |
2003 |
|
|
Примечания: 1. Вымершие («инактивированные») генотипы выделены в таблице курсивом. 2. Под обозначением «активный» в таблице подразумевается циркулирующий в настоящее время генотип вируса. 3. Жирным шрифтом с подчеркиванием в таблице выделены данные по эндемичной циркуляции генотипов в Российской Федерации. |
|||||
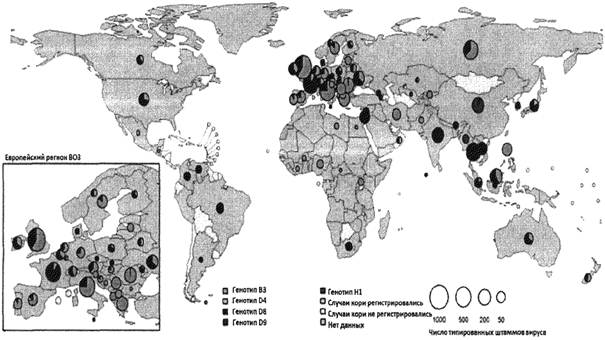
Часть генотипов не изолировалась на протяжении более 10 лет и считаются вымершими («инактивированными»). По данным мониторинга, в период с августа 2017 г. по июль 2018 г. в мире циркулировали генотипы D8, В3, H1, D9, D4 (рис. 2).
В последние годы наблюдается глобализация циркуляции некоторых генотипов вируса кори (В3, D8), что обусловлено миграцией населения в мировом масштабе, ростом пассажиропотока международных перевозок, в первую очередь авиационных, расширением географии туризма и международной торговли, участием граждан разных стран в спортивных, культурных и политических мероприятиях.
В этой связи для описания разнообразия генетических вариантов вируса в пределах генотипа в номенклатуру было включено понятие «наименованный штамм» («named strain») [12, 13].
Наименованный штамм представляет собой репрезентативный вариант вируса кори для группы штаммов с идентичными нуклеотидными последовательностями 450 нт N-гена (допускается наличие не более одной нуклеотидной замены), характеризующихся продолжительной (не менее 2 лет) циркуляцией и относительно широкой географией распространения (как минимум несколько стран). Такая группа штаммов определяется как уникальная генетическая линия, отличающаяся от других линий в пределах генотипа. Описанный подход позволяет осуществлять мониторинг не только генотипов вируса, но и генетических вариантов в пределах одного генотипа.
3.5. Все вакцинные штаммы вируса кори принадлежат к генотипу А. [14 - 16]. Прототипные «дикие» штаммы соответствующих вакцинных штаммов были независимо изолированы в середине прошлого века в нескольких странах (США, Советский Союз, Китай, Япония), что позволило ряду исследователей предположить широкое географическое распространение генотипа А в довакцинальную эру. Однако после широкого внедрения программ вакцинации штаммы генотипа А очень редко изолировались в мире, не описано ни одной вспышки кори, связанной с их циркуляцией. Эпизодическое обнаружение штаммов генотипа А связано с выделением вируса из клинических образцов недавно привитых коревой вакциной пациентов либо обусловлено лабораторной контаминацией. «Дикие» штаммы генотипа А в мире в настоящее время не циркулируют.
3.6. Антигенные различия между штаммами вируса кори - представителями разных генотипов минимальны, все известные генотипы вируса принадлежат к одному серотипу [14, 16]. Коревые вакцины, производящиеся с использованием вакцинных штаммов генотипа А, эффективны в отношении всех известных генотипов (генетических вариантов) вируса, их применение в вакцинопрофилактике позволяет добиваться устойчивого контроля кори и ее элиминации.
Рис. 2.
Глобальное распространение генотипов вируса кори (август 2017 г. - июль
2018 г.), база генетических данных вируса кори MeaNS1 (далее - база
данных MeaNS).
Данные для стран Центральной и Западной Европы представлены на выноске
________
1 www.who-measles.org - международная база генетических данных вируса кори MeaNS
3.7. ВОЗ в сотрудничестве со специалистами Агентства защиты здоровья (Лондон, Великобритания) была создана специализированная международная база генетических данных вируса кори MeaNS [13, 17]. База данных предоставляет пользователям наиболее полную информацию по генотипам вируса кори, циркулировавшим в мире с момента изоляции первых штаммов, возможность типирования, филогенетического анализа, поиска идентичных/родственных штаммов, анализа (в том числе ретроспективного) данных генетического мониторинга по странам и регионам ВОЗ, а также эпидемиологические данные, демонстрирующие импортирование/экспортирование генетических вариантов вируса в глобальном масштабе.
IV. Генотипирование вируса краснухи, методология,
номенклатура генотипов, географическое распространение
4.1. Вирус краснухи является членом семейства Togaviridae и единственным представителем рода Rubivirus. Вирион содержит РНК, окруженную капсидом и липопротеидной оболочкой. Капсид образован капсидным белком (С), липопротеидная оболочка содержит два гликопротеина - Е1 и Е2. Геном вируса представлен одноцепочечной РНК позитивной полярности протяженностью 9700 нт и помимо структурных белков (С, Е1 и Е2) кодирует два неструктурных белка Р150 и Р90. Как и вирус кори, вирус краснухи серологически монотипичен, однако его генетическое разнообразие позволяет выделять генетические генотипы и варианты.
С 2004 года действует утвержденный ВОЗ протокол генотипирования диких штаммов вируса краснухи [18]. Для рутинного молекулярно-генетического анализа используется «окно секвенирования», включающее 739 нуклеотидов (8731 - 9469 нт) гена, кодирующего белок Е1 (рис. 3).
4.2. Номенклатура генотипов вируса краснухи предусматривает единый подход в наименовании штаммов как описано ниже [18, 19]:
- RVi - изолят вируса, полученный на культуре клеток, RVs - нуклеотидная последовательность 739 нуклеотидов гена вируса Е1, полученная из клинического материала;
- город/регион, в котором выделен штамм;
- страна, обозначенная трехбуквенным кодом, принятым в ВОЗ;
- порядковый номер эпидемиологической недели, в которую выделен штамм (от 1 до 53), календарный год;
- порядковый номер штамма в том случае, если в течение недели выделено более 1 штамма;
- генотип, к которому относится штамм;
- в случае выделения вируса от пациентов с синдромом врожденной краснухи (далее - СВК) в название штамма добавляется обозначение «CRS».
Рис. 3. Схема структурной организации генома вируса
краснухи и
положение «окна секвенирования» гена Е1
Например, изолят RVi/Ryazan.RUS/09.08[1H] выделен на 9-й эпидемиологической неделе 2008 г. в Российской Федерации, г. Рязани, принадлежит к генотипу 1Н.
4.3. Номенклатура генотипов вируса краснухи включает 2 группы (1-го и 2-го, 10-го и 3-го генотипа соответственно), всего описано 13 генотипов вируса [18, 19]. Для всех генотипов описаны эталонные штаммы, как правило, исторически изолированные первыми. Краткая характеристика генотипов вируса краснухи представлена в табл. 2. Некоторые генотипы не изолировались достаточно давно и считаются вымершими.
Таблица 2
Характеристика генотипов вируса краснухи
|
Генотип |
Референс-штаммы |
Номер последовательности в GenBank |
Первая изоляция генотипа/Исторически длительная циркуляция (более 12 мес.) |
Длительная циркуляция (более 12 мес.) в 2014 - 2016 гг. |
|
1 |
2 |
3 |
4 |
5 |
|
1А |
RVi/Brussel.BEL/0.63/(VAC) |
AF188704 |
США, 1961 г./1961 - 1999 гг. - США, Бразилия, Великобритания, Бельгия; 2000 г. - Монголия (6 мес.) |
С 2000 г. штаммы генотипа не изолировались |
|
RVi/New Jersey.USA/0.61/(VAC) |
M30776 |
|||
|
RVi/Pennsylvania.USA/0.64/ (VAC) |
JF727653 |
|||
|
RVi/Toyama.JPN/0.67/ |
AB047330 |
|||
|
1В |
RVi/Tiberias.ISR/0.88/ |
AY968209 |
Япония, 1967 г./1967 - 2001 гг. Япония, Чехия, Великобритания, Италия, США. С 2002 г. по 2008 г. - ЮАР и Конго |
С 2008 г. штаммы генотипа не изолировались |
|
RVi/BeneBerak.ISR/0.79/ |
AY968208 |
|||
|
1C |
RVi/Califomia.USA/0.91/ |
AY968212 |
США, 1986 г./1986 - 2000 гг. - США, Панама, Эквадор, Гондурас. С 2002 г. по 2005 г. - Перу, Чили |
С 2005 г. штаммы генотипа не изолировались |
|
RVi/Panama City.PAN/0.99/ |
AY968217 |
|||
|
1D |
RVi/Tokyo.JPN/0.90/ |
AY968214 |
Япония, 1976 г./С 1987 г. по 1995 г. - Япония; США (1987 г.), Новая Зеландия (1991 г.), Корея (1996 г.), Австралия (1999 г.) |
С 1999 г. штаммы генотипа не изолировались (признан вымершим) |
|
RVi/Saitama.JPN/0.94/ |
AY968216 |
|||
|
1Е |
RVi/Shandong.CHN/0.02/ |
AY968210 |
Франция, 1995 г./Франция (1997 - 2005 гг.), Германия (2000 - 2001 гг.), Беларусь (2004 - 2006 гг.), Российская Федерация (2005 - 2008 гг.. 2010 - 2012. 2014 г.), Япония (2011 - 2012 гг.), Монголия (2012 - 2013 гг.) |
Австралия (2012 - 2016 гг.), Китай (2006 - 2016 гг.) |
|
RVi/Kuala Lumpur.MYS/0.01/ |
AY968221 |
|||
|
1F |
RVi/Shandong.CHN/0.00/ |
AY968213 |
Китай, 1999 г./Китай (1999 - 2002 гг.) |
С 2002 г. штаммы генотипа не изолировались (признан вымершим) |
|
RVi/Anhui.CHN/0.00/ |
AY968215 |
|||
|
1G |
RViKampala.UGA/20.01/ |
EF588978 |
Великобритания, 1999 г./Италия (1993 - 1995 гг.), Беларусь(2004 - 2005 гг.), Кот-д’Ивуар (2008 г.), Великобритания (1993 г., 2005 г. - импортированный из Российской Федерации), Германия (1995 г., 2005 г.), Франция (1998 г.), Эфиопия (2004 г.), Судан (2005 г.), США (2005 г. - импортированный из Кот-д’Ивуара), Канада (2005 г. - импортированный из Голландии), Российская Федерация (2006, 2008 г.) |
Нет (в 2016 г. эпизодически выделялся в Италии, США) |
|
RVi/Ontario.CAN/27.05/ |
EF588970 |
|||
|
RVi/Kimasi/GHА/0.05/ |
|
|||
|
1Н |
RVi/Minsk.BLR/28.05/2 |
AM258953 |
Италия, 1991 г./Франция (1995 г.), Турция (2001 г.), Российская Федерация (2004 - 2010 гг., 2017 г.), Беларусь (2005 г.), Казахстан (2008 - 2009 гг.) |
Нет данных, эпизодически Турция (2016 г.), Российская Федерация (2017 г. - 1 штамм) |
|
RVi/Ryazan.RUS/09.08 |
HG326276 |
|||
|
1I |
RVi/Milan.ITA/46.92/ |
AY161360 |
Великобритания, 1986 г./Италия (1991 - 1992 гг.) |
С 1994 г. штаммы генотипа не изолировались (признан вымершим) |
|
RVi/London.GBR/0.86/ |
AF039122 |
|||
|
1J |
RVi/Kagoshima.JPN/22.04/ |
AB285129 |
Япония, 1997 г./Япония (2002 - 2004 гг.), Испания (2005 г.), Бразилия (2005 г.), Япония и Китай (2010 г., импортированный из Филиппин) |
Нет (в 2014 - 2015 гг. эпизодически выделялся в США и Канаде - импортированный из Филиппин) |
|
RVi/Miyazaki.JPN/10.01/ |
AB285130 |
|||
|
2А |
RVi/Beijing.CHN/0.79/ |
AY258322 |
Китай, 1979 г. |
С 1980 г. дикие штаммы генотипа не выделялись |
|
RVi/Beijing.CHN/0.80/VAC |
AY258323 |
|||
|
2В |
RVi/TelAviv.ISR/0.68/ |
AY968219 |
Израиль, 1968 г./Бразилия (2006 - 2008 гг.), Румыния (2011 - 2012 гг.), Франция (2012 г), Российская Федерация (2009 - 2016 гг., эпизодическая изоляция, повторное импортирование вируса) |
Таиланд (2011 - гг.), Япония (2011 - 2016 гг.), Малайзия (2014 г.), Китай (2014 - 2016 гг.), Индия (2015 - 2016 гг.) |
|
RVi/Washington.USА/16.00/ |
AY968220 |
|||
|
RVi/Anhui.CHN/0.00/2 |
AY968218 |
|||
|
2С |
RVi/Moscow.RUS/0.67/ |
DQ388279 |
Впервые выделен в Российской Федерации в 1967 г. |
Нет (в группу входят только эталонные штаммы генотипа) |
|
RVi/Moscow.RUS/0.97/ |
DQ085340 |
|||
|
Примечание. Жирным шрифтом с подчеркиванием в таблице выделены данные по изоляции генотипов в Российской Федерации. |
||||
4.4. Почти все вакцинные штаммы относятся к генотипу 1А. Так как данный генотип включает также ряд диких штаммов и является гетерогенным, он имеет статус «предварительного», в будущем возможен пересмотр его статуса по мере накопления данных.
4.5. Особенности биологии вируса, трудности его изоляции на культуре клеток и типирования, небольшое число стран, в которых осуществляется генетический мониторинг циркуляции вируса, обусловливают ограниченность данных по генотипам вируса краснухи, циркулирующим в мире. Так, в 2015 г. из 106 стран - членов ВОЗ, регистрировавших случаи краснухи, только 11 предоставили информацию о генотипах циркулирующих вирусов [20]. Таким образом, доступные данные не отражают в полной мере генетическое разнообразие и географию циркуляции вируса краснухи.
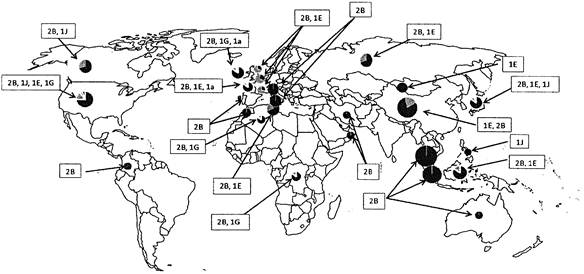
Данные мониторинга глобальной циркуляции вируса в период 2010 - 2015 гг. демонстрируют активную циркуляцию 5 генотипов (рис. 4). Наиболее часто изолировались штаммы генотипа 2В, представленные двумя основными группами вируса африканского либо азиатского происхождения. Генотип 2В в настоящее время характеризуется глобальным распространением. Вторым по частоте изоляции является генотип 1Е, эндемичный для Китая.
4.6. Вирус краснухи представлен единственным серотипом, краснушные вакцины вне зависимости от генотипа вакцинного штамма эффективны в отношении всех описанных на сегодняшний день генетических вариантов вируса краснухи «дикого» типа.
4.7. ВОЗ в сотрудничестве со специалистами Агентства защиты здоровья (Лондон, Великобритания) была создана специализированная международная база генетических данных вируса краснухи RubeNS1 (далее - база данных RubeNS) [12, 13, 19]. База данных предоставляет пользователям наиболее полную информацию по генотипам вируса краснухи, возможность типирования, филогенетического анализа, поиска идентичных/родственных штаммов, анализа (в том числе ретроспективного) данных генетического мониторинга по странам и регионам ВОЗ, а также эпидемиологические данные, демонстрирующие импортирование/экспортирование генетических вариантов вируса в глобальном масштабе.
________
1 www.who-rubella.org - международная база генетических данных вируса краснухи RubeNS.
Рис. 4. Географическое распространение генотипов вируса
краснухи, 2010 - 2015 гг.
(база данных RubeNS) Для регионов с двумя и более циркулирующими генотипами
данные представлены в порядке убывания числа штаммов соответствующего генотипа
V. Организация работ по генотипированию вирусов
5.1. Сбор клинических образцов для генотипирования осуществляется специалистами медицинских организаций, выявившими случай кори/краснухи. Образцы собираются в максимально ранние сроки от начала заболевания.
5.2. Порядок сбора, подготовки, хранения и транспортирования клинических образцов изложен в прилож. 1 к МР.
5.3. Полнота и достоверность исследования обеспечивается сбором клинических образцов от достаточного количества случаев инфекции. Выбор случаев заболевания, подлежащих генотипированию, проводится таким образом, чтобы обеспечить возможность генотипирования не менее 80 % вспышек (цепочек передачи) инфекции, а также всех импортированных и завозных случаев.
При вспышечной заболеваемости нецелесообразно осуществлять сбор клинических образцов для исследования от всех случаев инфекции, ассоциированных с конкретной вспышкой. Необходимо организовать сбор клинических образцов от первых 5 - 10 случаев при каждой вспышке, всего не более 10 случаев от вспышки на протяжении 1 месяца.
При продолжительности вспышки более 1 месяца рекомендуется осуществлять сбор образцов не чаще 1 раза в месяц от 2 - 3 последних зарегистрированных случаев.
Генотипированию подлежат 100 % импортированных случаев (при невозможности сбора клинических образцов в регламентируемые сроки от импортированного случая образцы должны быть собраны от нескольких случаев, связанных с импортированным).
Генотипированию подлежат 100 % завозных (из других субъектов Российской Федерации) случаев (при невозможности сбора клинических образцов в регламентируемые сроки от завозного случая образцы должны быть собраны от нескольких случаев, связанных с завозным).
При регистрации единичных случаев заболевания («спорадическая» заболеваемость, менее 1 случая/млн населения) генетическому типированию подлежат 100 % зарегистрированных случаев.
5.4. При импортировании коревой/краснушной инфекции может наблюдаться социркуляция нескольких генетических вариантов вируса. Для дифференцирования вспышек, регистрируемых в одно и то же время на одной территории, но вызванных разными генетическими вариантами вирусов, целесообразно генотипировать дополнительно случаи инфекции (группы связанных случаев), для которых не установлена эпидемиологическая связь с ранее генотипированными.
VI. Использование результатов генотипирования
вирусов
кори и краснухи в эпидемиологическом расследовании
6.1. Использование данных генотипирования вирусов кори и краснухи на практике позволяет ретроспективно уточнить результаты эпидемиологического расследования случая кори/краснухи и откорректировать эпидемиологические связи в цепочках вторичного распространения инфекции.
6.2. На основании эпидемиологического расследования осуществляется окончательная классификация случая: «местный», «завозной» с другой территории Российской Федерации, «импортированный» (завозной с территории другого государства), «связанный с завозным/импортированным» случаем.
6.3. На первом этапе эпидемиологического расследования необходимо определить степень распространения инфекции и классифицировать случай кори/краснухи. Вспышкой считается 5 и более случаев, во время вспышки могут формироваться разные по интенсивности очаги (например, по месту работы, учебы, месту жительства), цепочки и единичные с неустановленными эпидемиологическими связями случаи.
При анализе принято выделять случаи, связанные цепочкой передачи инфекции от импортированного/завозного случая. Нередко цепочка ограничивается первым поколением воспроизводства инфекции (случаи заболевания в результате контакта с больным, прибывшим с территории другого государства или другого субъекта Российской Федерации). Эти случаи классифицируются как «связанные с импортированным/завозным». Все последующие вторичные случаи заражения от случая, связанного с завозным, расцениваются как «местные».
Необходимо учитывать, что географическое происхождение генотипов вирусов кори/краснухи не всегда совпадает со страной импортирования и не дает основания классифицировать случай как импортированный. В случаях выявления генотипа/подтипа, ранее на территории страны не встречавшегося, необходимо изменить классификацию «местный» на «связанный с импортированным». При этом следует помнить, что результаты генотипирования вирусов кори/краснухи не влияют на тактику лечения пациентов, сроки и объём проводимых противоэпидемических мероприятий.
Нередко при импортировании коревой/краснушной инфекции может наблюдаться социркуляция нескольких генетических вариантов вирусов. Для дифференцирования эпидемиологических связей между случаями, регистрируемыми в одно и то же время на одной территории, но вызванными разными генетическими вариантами вируса, целесообразно генотипировать дополнительно случаи инфекции (группы связанных случаев), для которых не установлена эпидемиологическая связь с ранее генотипированными случаями.
Напротив, выявление одного и того же генотипа и подтипа вируса у единичных случаев кори/краснухи при условии, что цепочка передачи инфекции ограничена одним инкубационным периодом, позволяет объединить эти случаи в одну вспышку (цепочку).
Примеры:
1) на территории первого административного уровня зарегистрированы случаи кори: в городе - 5 случаев (вспышка), в селе Б - 4 случая (групповая заболеваемость), а также 6 единичных, не связанных между собой, случаев кори в селе А. Интервал регистрации даты сыпи у заболевших в городе, в селе А и в селе Б составил 7 - 18 дней, т. е. не превышал инкубационный период (21 день). Источник инфекции и предполагаемое место заражения первого заболевшего установить не удалось.
До получения результатов генотипирования при эпидемиологическом расследовании установлено формирование двух очагов кори - в городе и селе Б, а также 6 очагов в селе А. Выделение одного и того же генотипа и подтипа (например, D4 Manchester) вируса на разных этапах регистрации случаев кори при учете возможного наличия пропущенных случаев позволили объединить все случаи в одну вспышку с 15 заболевшими.
Выявление разных генотипов или подтипов вируса кори/краснухи в пределах одной территории любого административного уровня позволяет откорректировать установленные эпидемиологические связи и количество сформированных очагов.
2) на основании оперативного эпидемиологического расследования были установлены эпидемиологические связи с предполагаемым источником ши местом заражения, что давало основание предположить о наличии вспышки кори с 8 заболевшими. Источник инфицирования у первого заболевшего установить не удалось. Во время вспышки были зарегистрированы: семейный очаг с 2 случаями, очаг с вторичным распространением по месту учебы и по месту работы. Ретроспективный анализ с учетом данных молекулярно-генетического типирования (выявление на разных сроках распространении инфекции у двух пациентов генотипа D4 и у двух - генотипа D8) дал основание разделить вспышку на два очага по 4 заболевших (групповая заболеваемость), обусловленных социркуляцией двух генотипов (D4 и D8) на одной территории.
6.4. Генотипирование штаммов вируса кори/краснухи необходимо в случае, когда при вакцинации по эпидемическим показаниям контактных в очагах инфекции выявляются среди привитых лица с клинической симптоматикой кори/краснухи, что требует дифференцирования инфекции и поствакцинальной реакции. Указанные случаи должны регистрироваться как случаи кори/краснухи, отмена диагноза допускается только в случае выявления в клинических образцах пациентов вакцинных штаммов вируса кори (генотип А) или вируса краснухи (генотип 1А) соответственно.
6.5. Анализ заболеваемости, проведенный по неделям/месяцам года и циркулирующим генетическим вариантам вируса кори/краснухи в масштабах страны позволяет определить продолжительность циркуляции каждого генетического варианта вируса, а также выявить факт прерывания их циркуляции, подтверждая достижение элиминации инфекции.
Пример: анализ циркулирующих генотипов вируса кори/краснухи по месяцам или по неделям календарного года в каком-либо регионе может проводиться в разрезе территорий более мелкого административного уровня (табл. 3). При этом необходимо выделять импортированные случаи. В упрощённом примере анализа рассмотрены только случаи, классифицированные как «местные» и «импортированные».
Представленные данные свидетельствуют о непрерывной циркуляции генотипа D6 в течение года (интервал между случаями, охарактеризованными генотипированием, не превышал 21 день) на территории одного из субъектов Российской Федерации, что позволяет говорить об эндемичной передаче вируса кори.
Таблица 3
Пример анализа циркуляции генотипов вируса кори по месяцам
и
территориям субрегионального уровня
|
Территории |
Месяц года, генотип вируса |
|||||||||||
|
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
IX |
X |
XI |
XII |
|
|
Район А |
|
G3 |
|
|
D6 |
|
D6 |
|
|
|
D6 |
|
|
Район Б |
|
|
D6 |
|
|
|
D4 |
|
|
|
|
|
|
Город В |
|
|
|
|
|
H1 |
|
|
D6 |
|
|
|
|
Район Г |
|
D6 |
|
|
|
|
|
D6 |
|
|
|
D6 |
|
Район Д |
D6 |
|
|
D6 |
|
D6 |
|
|
|
D6 |
|
D8 |
|
Генотипы, местные случаи |
D6 |
D6 |
D6 |
D6 |
D6 |
D6 |
D6 |
D6 |
D6 |
D6 |
D6 |
D6 |
|
Генотипы, импортированные случаи/страна |
|
G3/Малайзия |
|
|
|
H1/Китай |
D4/Бирма |
|
|
|
|
D8/Индия |
6.6. Регистрация на определенной географической территории, на которой ранее была достигнута элиминация инфекции, непрерывной, по данным эпидемиологического расследования и лабораторным данным, передачи вирусов кори/краснухи в течение 12 месяцев и более свидетельствует о возобновлении их эндемичной циркуляции.
Приложение 1
Рекомендуемый порядок сбора, подготовки,
транспортирования
и хранения клинических образцов
1. Общая информация
1.1. Краткое описание
Для генотипирования вирусов кори/краснухи в качестве клинических образцов используются носоглоточные соскобы/смывы и моча. Вирусы (вирусная РНК) могут быть выделены также из других клинических образцов (цельная кровь, сыворотка крови, слюна, биоптат), однако для целей генотипирования их использование не является оптимальным.
1.2. Информация по биологической безопасности
Клинические образцы потенциально могут содержать широкое разнообразие возбудителей инфекционных заболеваний. Все манипуляции необходимо проводить с соблюдением правил работы с инфицированными материалами. Всегда следует надевать перчатки, при работе вне бокса биологической защиты - использовать защитные очки.
1.3. Материалы и оборудование
Градуированные центрифужные пластиковые пробирки с завинчивающейся крышкой объемом 15 и 50 мл.
Пробирки типа «Эппендорф» объемом 1,5 - 2,0 мл.
Пластиковые криопробирки с завинчивающейся крышкой объемом 2 мл.
Пластиковые контейнеры объемом 50 мл для сбора мочи.
Набор для взятия носоглоточных соскобов (стерильный зонд - тампон в пробирке).
Транспортная среда для выделения вирусов, состав:
- основной раствор Хенкса pH 7,4 с ХЕПЕС-буфером;
- бычий сывороточный альбумин;
- раствор антибиотиков;
- 0,4 %-й раствор фенолового красного.
Приготовление транспортной среды: растворить 2,0 г бычьего сывороточного альбумина в 100 мл дистиллированной воды для получения 2 %-го раствора. Добавить к 80 мл дистиллированной воды 10 мл раствора Хенкса, 10 мл 2 %-го раствора бычьего сывороточного альбумина и 0,2 мл раствора фенолового красного. Стерилизовать фильтрованием. Добавить 1 мл раствора антибиотиков.
Приготовление раствора антибиотиков: растворить 106 ЕД бензил-пенициллина натриевой (калиевой) соли и 1,0 г стрептомицина сульфата в 100 мл стерильного фосфатного буферного раствора. Разлить во флаконы по 5 мл и хранить при -20 °С. Добавить 1 мл этого раствора к 100 мл питательной среды позволяет получить рабочий раствор с концентрацией 100 ЕД пенициллина и 100 мкг стрептомицина в 1 мл раствора.
Примечание: альтернативно может быть использована коммерческая транспортная среда для хранения вирусов. При отсутствии транспортной среды допускается использование питательной среды для культур клеток (например, DMEM, RPMI, ИГЛА) с антибиотиками и 2 %-го раствора бычьего сывороточного альбумина. В случае отсутствия указанных сред, если образец может быть доставлен в лабораторию в течение 48 часов с момента сбора, допускается использование в качестве транспортной среды буферированного физиологического раствора с антибиотиками.
Рефрижераторная центрифуга.
1.4. Информация, требующая внимания
Вероятность выделения вируса наиболее высока при исследовании образцов, собранных в первые 3 суток с момента появления сыпи, не следует задерживать сбор образцов. Исследование разных образцов (моча, соскоб) от одного пациента повышает вероятность выделения вируса.
В случае если клинические образцы могут быть доставлены в тестирующую лабораторию в течение 48 часов с момента забора при условии хранения и транспортирования при 0 °С (на тающем льду), замораживать образцы нецелесообразно.
При более продолжительном времени транспортирования образцы должны быть заморожены при температуре не выше -70 °С (сухой лед/хладоэлементы). Замораживание и хранение вируссодержащих образцов при температуре -20 °С не является оптимальным с точки зрения сохранения жизнеспособности вируса и не рекомендуется, может быть использовано на время транспортирования образцов только при отсутствии возможности соблюдения оптимальных условий.
Для изоляции вируса кори и экстракции РНК вируса образцы должны быть собраны не позже 7 дня с даты появления сыпи. Допускается сбор образцов в более поздние сроки (до 2 недель) при отсутствии другой возможности генотипирования случая кори.
Для изоляции вируса краснухи и экстракции РНК вируса образцы должны быть собраны не позже 5 дня с даты появления сыпи при постнатальной краснухе и в течение 1 года жизни ребенка при подозрении на СВК.
Каждый образец должен быть промаркирован (фамилия, инициалы пациента и/или идентификационный номер). Оптимально использовать для хранения и транспортирования образцов криопробирки для замораживания с завинчивающейся крышкой (2,0 - 2,5 мл), допустимо - пробирки типа «Эппендорф» (1,5 - 2,0 мл). При использовании пробирок типа «Эппендорф» необходимо обеспечить их герметичность, для чего целесообразно применять пробирки со специальной защелкой либо герметизировать с помощью пленки.
Все манипуляции с клиническими образцами следует проводить в условиях максимально возможной стерильности. Работать необходимо с охлажденными до 2 - 8 °С образцами, не допуская их нагревания и воздействия прямого солнечного света.
В сопроводительных документах необходимо предоставить следующие сведения:
- эпидемиологический номер случая (при наличии);
- фамилия, имя, отчество пациента;
- пол;
- дата рождения;
- адрес места жительства (фактический);
- дата заболевания;
- дата появления сыпи;
- предварительный клинический диагноз (генотипированию подлежат случаи инфекции, подозрительные на корь, краснуху, СВК);
- тип образца;
- дата сбора образца;
- дата отправки образца в лабораторию;
- учреждение, направляющее образцы на исследование;
- контактные данные сотрудника, направившего образцы на исследование (фамилия, имя, отчество, телефон, адрес электронной почты (при наличии).
2. Сбор, подготовка, хранение клинических образцов
2.1.
Порядок взятия мочи для выделения вируса кори и
экстракции РНК вируса кори
Порядок взятия мочи для выделения вируса кори и экстракции РНК вируса кори осуществляется по следующей схеме:
1. Соберите не менее 50 мл мочи в стерильную емкость. Предпочтительно собирать первую утреннюю порцию. У детей в возрасте до 1 г допустимо использование меньшего количества мочи, но не менее 10 мл.
2. Охладите образец до 4 °С. Цельную мочу не замораживать!
3. Осадите клеточную фракцию путем центрифугирования при 4 °С 1500 об./мин в течение 5 мин.
4. Удалите надосадочную жидкость в емкость с дезраствором.
5. Растворите осадок в 1 мл транспортной среды.
6. Перенесите полученный образец в стерильную пробирку типа «Эппендорф» или пластиковую пробирку с завинчивающейся крышкой для замораживания образцов.
7. Образец необходимо доставить в лабораторию для исследования при 2 - 8 °С (оптимально при 0 °С, на тающем льду) в течение 48 часов.
8. В случае отсутствия возможности для доставки образца в указанные сроки заморозьте и храните образец при температуре не выше -20 °С (оптимально при -70 °С). Замороженный образец необходимо доставить в лабораторию для исследования при -70 °С (сухой лед, замороженные хладоэлементы).
2.2.
Порядок взятия носоглоточных соскобов и смывов
для выделения вируса кори и экстракции РНК вируса
Для выделения вируса кори и экстракции РНК вируса кори может быть использован носоглоточный смыв или соскоб (предпочтительнее). Концентрация вируса наиболее максимальна в области лимфоидных образований (язычная, небные, носоглоточная миндалины), соответственно целесообразно забирать соскоб из указанных участков слизистой полости рта и глотки.
Носоглоточный соскоб:
1. Стерильным ватным тампоном с усилием (чтобы собрать достаточное количество клеток) протереть слизистую оболочку полости рта и ротоглотки пациента в области лимфоидных образований (язычная, небные, носоглоточная миндалины).
2. Тампон поместить в стерильную пробирку с крышкой, содержащую 2 мл транспортной среды.
3. Образец необходимо доставить в лабораторию для исследования при 2 - 8 °С (оптимально при 0 °С, на тающем льду) в течение 48 часов.
4. В случае отсутствия возможности для доставки образца в указанные сроки, пробирку с тампоном энергично встряхнуть, чтобы смыть клетки, после чего извлечь тампон.
5. Осадить клеточную фракцию путем центрифугирования при 4 °С 1500 об./мин в течение 5 мин.
6. Удалить надосадочную жидкость в емкость с дезраствором.
7. Растворить осадок в 1 мл транспортной среды.
8. Заморозить и хранить образцы при температуре не выше -20 °С (оптимально при -70 °С). Замороженный образец необходимо доставить в лабораторию для исследования при -70 °С (сухой лед, замороженные хладоэлементы).
Не собирайте носоглоточные соскобы в пробирки с гелевой средой, указанные пробирки предназначены для бактериологических исследований и для тестирования на корь/краснуху непригодны.
Носоглоточный смыв:
1. Предложить пациенту прополоскать горло 3 - 5 мл физиологического раствора.
2. Собрать промывные воды в стерильную пробирку.
3. Осадить клеточную фракцию путем центрифугирования при 4 °С 1500 об./мин в течение 5 мин.
4. Удалить надосадочную жидкость в емкость с дезраствором.
5. Растворить осадок в 1 мл транспортной среды.
6. Образцы необходимо доставить в лабораторию для исследования при 2 - 8 °С (оптимально при 0 °С, на тающем льду) в течение 48 часов.
7. В случае отсутствия возможности для доставки образцов в указанные сроки заморозить и хранить образцы при температуре не выше -20 °С (оптимально при -70 °С). Замороженный образец необходимо доставить в лабораторию для исследования при -70 °С (сухой лед, замороженные хладоэлементы).
3. Транспортирование образцов
Собранные образцы необходимо поместить в отдельные пластиковые пакеты с замком с небольшим количеством ваты для адсорбции влаги. Не допускается упаковка клинических образцов от разных пациентов в один пакет. Несколько клинических образцов от одного пациента могут быть упакованы в один пакет большего размера.
Для транспортирования образцов необходимо использовать термоконтейнеры или термосы, обеспечивающие необходимый температурный режим. Замороженные/охлажденные (до 0 °С (тающий лед) или 2 - 8 °С) хладоэлементы (можно использовать лед в герметичных пластиковых пакетах или бутылках) следует поместить на дно и по бокам контейнера, внутрь положить образцы, сверху поместить дополнительные хладоэлементы.
Образцы для выделения вируса и экстракции РНК можно транспортировать при температуре 0 - 8 °С (время транспортирования не более 48 часов с момента забора), используя хладоэлементы, охлажденные до соответствующей температуры, или в замороженном состоянии (-70 °С, сухой лед, замороженные хладоэлементы) в герметичных укупорках во избежание воздействия на образцы углекислоты. Размораживание образцов в процессе транспортирования недопустимо.
Под крышку контейнера поместить сопроводительные документы (письмо с указанием вида и количества образцов, времени и даты отправки, направления на исследование).
При одновременной отправке замороженных и хранящихся при 0 - 8 °С образцов использовать отдельные контейнеры с хладоэлементами, обеспечивающими соответствующий температурный режим.
Приложение 2
Для целей настоящих МР используются следующие термины и определения:
- элиминация болезни (корь/краснуха) - отсутствие эндемичных случаев кори или краснухи на определенной географической территории в течение не менее 12 месяцев при наличии хорошо функционирующей системы эпиднадзора;
- верификация (подтверждение) элиминации - элиминация может быть подтверждена при отсутствии эндемичных случаев кори или краснухи в стране в течение не менее чем 36 месяцев;
- искоренение инфекции (эрадикация) - глобальное отсутствие передачи вирусов кори или краснухи при наличии хорошо функционирующей системы эпиднадзора;
- эндемичная передача вируса - продолжительная передача местных или завозных вирусов кори или краснухи, которая сохраняется на определенной географической территории в течение не менее 12 месяцев;
- возобновление эндемичной передачи - ситуация, при которой эпидемиологические и лабораторные данные свидетельствуют о наличии продолжительной передачи завозных вирусов кори/краснухи, которая сохраняется в течение 12 месяцев и более на определенной географической территории, где ранее была достигнута элиминация инфекции;
- цепочка передачи инфекции - два или большее количество случаев кори или краснухи, которые наблюдаются в одно время и связаны по эпидемиологическим и/или вирусологическим характеристикам;
- эндемичный случай - лабораторно подтвержденный, эпидемиологически связанный или клинически подтвержденный случай кори или краснухи, возникший в результате эндемичной передачи вируса кори или краснухи;
- импортированный случай - случай заболевания у человека, имевшего контакт с источником инфекции за пределами данной страны за 7 - 21 день до появления сыпи, на что указывают эпидемиологические и/или вирусологические данные;
- случай, связанный с импортированным - случай местного заражения корью или краснухой как часть цепочки передачи инфекции от импортированного случая, на что указывают эпидемиологические и/или вирусологические данные (примечание: если случаи, связанные с импортированным случаем, продолжают регистрироваться в течение 12 месяцев или дольше, то такие случаи уже не классифицируют как связанные с завозным случаем, а считают эндемичными);
- завозной случай - случай заболевания у человека, имевшего контакт с источником инфекции за пределами данного субъекта федерации (но в пределах Российской Федерации) за 7 - 21 день до появления сыпи, на что указывают эпидемиологические и/или вирусологические данные;
- случай, связанный с завозным - случай местного заражения корью или краснухой как часть цепочки передачи инфекции от завозного случая, на что указывают эпидемиологические и/или вирусологические данные (примечание: если случаи, связанные с завозным случаем, продолжают регистрироваться в течение 12 месяцев или дольше, то такие случаи уже не классифицируют как связанные с завозным случаем, а считают эндемичными).
Нормативные и методические документы
1. Федеральный закон от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
2. СП 3.1/3.2.3146-13 «Общие требования по профилактике инфекционных и паразитарных болезней».
3. СП 3.1.2952-11 «Профилактика кори, краснухи и эпидемического паротита».
4. Приказ Минздрава России № 117 от 21.03.2003 «О реализации «Программы ликвидации кори в Российской Федерации к 2010 году».
5. МУ 3.1.2.1177-02 «Эпидемиологический надзор за корью, краснухой и эпидемическим паротитом».
6. МУ 3.1.2.2356-08 «Эпидемиологический надзор за врожденной краснухой».
7. Программа «Элиминация кори и краснухи в Российской Федерации (2016 - 2020 гг.)», утвержденная Роспотребнадзором 28.12.2015; Минздравом России 31.12.2015.
Библиографические данные
5. Rota Р.А. Measles. Pathogenesis and control. Chapter 7, Molecular Epidemiology of Measles Virus/P.A. Rota, D.A. Featherstone, W.J. Bellini//Curr Top Microbiol Immunol. 2009. № 330:1. P. 129 - 150.
12. Measles virus nomenclature update: 2012//Wkly Epidemiol Rec. 2012. V. 87. № 9. P. 73 - 80.
19. Rubella virus nomenclature update: 2013//Wkly Epidemiol. Rec. - 2013. № 32. P. 337 - 348.