МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ,
МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(ISC)
|
Межгосударственный |
ГОСТ |
Биологическая безопасность
СЫРЬЕ И ПРОДУКТЫ ПИЩЕВЫЕ
Метод идентификации генно-модифицированных
организмов (ГМО)
растительного происхождения с применением
биологического микрочипа
|
|
Москва Стандартинформ 2017 |
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены в ГОСТ 1.0-2015 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2015 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 РАЗРАБОТАН Федеральным государственным бюджетным учреждением науки Институтом физиологии растений им. К.А. Тимирязева Российской академии наук (ИФР РАН) и Федеральным государственным бюджетным учреждением науки Институтом молекулярной биологии им. В.А. Энгельгардта Российской академии наук (ИМБ РАН)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 1 июня 2017 г. № 51)
За принятие проголосовали:
|
Краткое наименование
страны |
Код страны |
Сокращенное
наименование национального органа |
|
Армения |
AM |
Минэкономики Республики Армения |
|
Беларусь |
BY |
Госстандарт Республики Беларусь |
|
Казахстан |
KZ |
Госстандарт Республики Казахстан |
|
Киргизия |
KG |
Кыргызстандарт |
|
Россия |
RU |
Росстандарт |
|
Таджикистан |
TJ |
Таджикстандарт |
|
Узбекистан |
UZ |
Узстандарт |
|
Украина |
UA |
Минэкономразвития Украины |
(Поправка).
4 Приказом Федерального агентства по техническому регулированию и метрологии от 4 августа 2017 г. № 805-ст межгосударственный стандарт ГОСТ 34150-2017 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2019 г.
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе «Национальные стандарты», а текст изменений и поправок - в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Содержание
ГОСТ 34150-2017
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
Биологическая безопасность
СЫРЬЕ И ПРОДУКТЫ ПИЩЕВЫЕ
Метод идентификации генно-модифицированных
организмов (ГМО)
растительного происхождения с применением биологического микрочипа
Biological safety. Raw and
food-stuffs. Method for the identification of genetically modified organisms
(GMO) of plant
origin by using biological microchip
Дата введения - 2019-01-01
1 Область применения
Настоящий стандарт распространяется на продукты растительного происхождения, готовые пищевые продукты с содержанием растительных компонентов (колбасы, пельмени, молочные продукты и др.), пищевое сырье, посевной и посадочный материал, цветы (далее - продукт) и устанавливает метод идентификации генно-модифицированных организмов (ГМО) и генно-модифицированных источников (ГМИ) растительного происхождения с применением биологического микрочипа.
Метод одновременно устанавливает наличие или отсутствие в анализируемой пробе не менее десяти различных трансгенных последовательностей ДНК. Чувствительность метода - не менее 10-9 г (1 нг, ~ 103 геном-эквивалентов тотальной растительной ДНК/1 мм3 пробы).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.1.019-79* Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
* В Российской Федерации действует ГОСТ Р 12.1.019-2009.
ГОСТ 12.4.009-83 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 12.4.021-75 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
ГОСТ OIML R 76-1-2011 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 3118-77 Кислота соляная. Технические условия
ГОСТ 3164-78 Масло вазелиновое медицинское. Технические условия
ГОСТ 4233-77 Натрий хлористый. Технические условия
ГОСТ 4328-77 Натрия гидроокись. Технические условия
ГОСТ 5962-2013 Спирт этиловый ректификованный из пищевого сырья. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 9805-84 Спирт изопропиловый. Технические условия
ГОСТ 10652-73 Реактивы. Сольдинатриевая этилендиамин-N, N, N', N'- тетрауксусной кислоты 2-водная (трилон Б). Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 20015-88 Хлороформ. Технические условия
ГОСТ 21400-75 Стекло химико-лабораторное. Технические требования. Методы испытаний
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 26678-85 Холодильники и морозильники бытовые электрические компрессионные параметрического ряда. Общие технические условия
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины, определения и сокращения
3.1 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1.1 биологическая безопасность: Защищенность человека, общества и окружающей среды от негативного воздействия токсических, аллергенных, канцерогенных, мутагенных биологических веществ и соединений, содержащихся в природных или генно-модифицированных биологических объектах и полученных из них продуктах.
3.1.2 генно-модифицированные источники; ГМИ: Сырье и пищевые продукты (компоненты), используемые человеком в натуральном или переработанном виде, полученные из генно-модифицированных организмов (ГМО) или содержащие их в своем составе.
3.1.3 генно-модифицированный организм; ГМО: Организм, генетический материал которого изменен с применением методов генной инженерии.
3.1.4 генная инженерия: Совокупность приемов, методов и технологий, в том числе технологий получения рекомбинантных нуклеиновых кислот, по выделению генов из организма, осуществлению манипуляций с генами и введению их в другие организмы.
3.1.5 биологический микрочип: Микроматрица с ячейками, в которых иммобилизован набор олигонуклеотидов.
3.1.6 праймер: Последовательность однотяжевой ДНК длиной до 25 нуклеотидов, применяемая для проведения асимметричной мультиплексной полимеразной цепной реакции.
3.1.7 асимметричная мультиплексная полимеразная цепная реакция; амПЦР: Полимеразная цепная реакция, где в одной пробирке с участием нескольких пар праймеров одновременно амплифицируются разные последовательности анализируемой ДНК, причем количество одного из праймеров каждой пары в несколько раз превышает количество другого праймера.
3.1.8 олигонуклеотид: Природное или синтетическое олигомерное соединение, состоящее из немногих остатков нуклеотидов, соединенных фосфодиэфирной связью.
3.1.9 иммобилизованный олигонуклеотидный зонд: Химически синтезированная одноцепочечная молекула ДНК, содержащая около 20 пар оснований, ковалентно закрепленная на каком-либо носителе.
3.1.10 генетическая детерминанта трансгенности: Генетические элементы, используемые в конструкциях, применяемых при создании ГМО (промоторы, терминаторы, репортерные гены и др.).
3.1.11 гибридизационная картина: Результат идентификации содержания генетических элементов обычных для генно-модифицированных организмов (ГМО) или полученных из них продуктов.
3.2 Сокращения
ДНК - дезоксирибонуклеиновая кислота;
дАТФ - дезоксиаденозинтрифосфат;
дГТФ - дезоксигуанозинтрифосфат;
дУТФ - дезоксиуридинтрифосфат;
дЦТФ - дезоксицитидинтрифосфат;
«ПР-1» и «ПР-2» - водные растворы праймеров.
4 Сущность метода
Метод основан на асимметричной мультиплексной полимеразной цепной реакции (амПЦР) с последующей гибридизацией продуктов этой амПЦР на биологическом микрочипе.
5 Средства измерений, вспомогательное оборудование, посуда, реактивы и материалы
5.1 Универсальный аппаратно-программный комплекс (УАПК) для анализа биологических микрочипов с компьютерной программой для анализа полученных результатов.
5.2 Хлороформ по ГОСТ 20015, х.ч.
5.3 Амплификатор ДНК четырехканальный под микроцентрифужные пробирки вместимостью 0,2 или 0,5 см3 со следующими техническими характеристиками:
- число независимых термоблоков...............................................................4 шт;
- число пробирок по 0,5 см3 в термоблоке.................................................10 шт;
- рабочий объем реакционной смеси.................................................10 - 50 мм3;
- диапазон регулирования температуры.....................................от 4°С до 99 °С;
- точность поддержания температуры......................................................±0,3 °С;
- динамическая ошибка регулирования....................................................±0,3 °С;
- время выполнения цикла (92 °С - 1 с, 72 °С - 1 с) при 15 мм2...................64 с;
- количество программ........................................................................................28.
5.5 Весы неавтоматического действия по ГОСТ OIML R 6-1 с пределом допускаемой погрешности однократного взвешивания ±0,001 г.
5.6 Камера морозильная по ГОСТ 26678, обеспечивающая температуру минус 20 °С.
5.7 Холодильник бытовой электрический по ГОСТ 26678.
5.9 Мешалка магнитная с подогревом.
5.10 Аппарат для встряхивания с частотой вращения не менее 1500 мин-1.
5.11 рН-метр любого типа в комплекте с комбинированным стеклянным электродом, погрешностью измерений ±0,1 ед. рН.
5.12 Микродозаторы с переменным объемом дозирования:
- 0,5 - 10,0 мм3 (шаг - 0,1 мм3, точность ±2,5 % - 10,0 %, воспроизводимость 3 % - 7 %);
- 5,0 - 50,0 мм3 (шаг - 0,5 мм3, точность ±2,0 % - 5,0 %, воспроизводимость 2,5 % - 5 %);
- 20,0 - 200,0 мм3 (шаг - 1,0 мм3, точность ±1,5 % - 2,0 %, воспроизводимость 2 % - 3 %);
- 100 - 1000 мм3 (шаг - 5 мм3, точность ±1,0 % - 1,5 %, воспроизводимость 1 % - 2 %).
5.13 Штативы под микроцентрифужные пробирки на 30 и 80 шт.
5.14 Наконечники с фильтром для микродозаторов вместимостью 10,20,200 и 1000 мм3.
5.15 Пробирки микроцентрифужные типа Эппендорф вместимостью 0,2, 0,5 и 1,5 см3 стерильные.
5.16 Пестик или палочка стеклянные по ГОСТ 21400 для микроцентрифужных пробирок вместимостью 1,5 см3.
5.17 Цилиндры стеклянные мерные лабораторные 1-25, 1-100, 1-250 и 1-1000 по ГОСТ 1770.
5.18 Колбы конические Кн-3-100-34, Кн-3-250-34 по ГОСТ 25336.
5.19 Колбы мерные 1-100, 1-250, 1-500 по ГОСТ 1770.
5.20 Емкость щелочеустойчивая пластиковая плотно закрывающаяся.
5.21 Пипетки стеклянные градуированные по ГОСТ 29227.
5.22 Бумага фильтровальная лабораторная по ГОСТ 12026.
5.23 Натрия гидроокись по ГОСТ 4328, х. ч.
5.24 Кислота соляная концентрированная по ГОСТ 3118, х. ч.
5.25 Натрий хлористый по ГОСТ 4233, х. ч.
5.26 Этилендиаминтетрауксусной кислоты динатриевая соль дигидрат (ЭДТА) по ГОСТ 10652, ч.д. а.
5.27 Трис(оксиметил)аминометан (ТРИС), массовой долей основного вещества не менее 98 %.
5.28 Спирт этиловый ректификованный по ГОСТ 5962.
5.29 Спирт изопропиловый по ГОСТ 9805, х. ч.
5.30 Масло вазелиновое по ГОСТ 3164.
5.31 Цетилтриметиламмоний бромид (ЦТАБ), массовой долей основного вещества не менее 98 %.
5.32 Вода дистиллированная по ГОСТ 6709.
5.33 Вода особо чистая стерильная, не содержащая ДНК, РНК и дезоксирибонуклеаз.
5.34 Фермент термостабильный HotTaq-полимераза для ПЦР с «горячим стартом» и оптимумом активности при температуре 70 °С - 72 °С.
5.35 ПЦР буфер десятикратный (10´; 12,1 г в 1 дм3Трис-НСl, рН 8,8; 37,28 г в 1 дм3 KCI, 5 % Твин-20, 50 % формамид; 142,83 мг в 1 дм3 MgCI2).
5.37 Баня водяная, оснащенная терморегулятором, для поддержания и контроля температуры в диапазоне от 25 °С до 100 °С с погрешностью ±2 °С.
5.39 Раствор флуоресцентного субстрата (ФС).
5.40 Раствор заведомо трансгенной ДНК (около 100 нг/мм3 или 106 копий/мм3).
5.41 Раствор заведомо нетрансгенной ДНК (около 100 нг/мм3 или 106 копий/мм3).
*В скобках указан номер гена (Accession №) в Международном банке генов Национального центра биотехнологической информации (NCBI, National Centerfor Biotechnology Information, https://www.ncbi.nlm.nih.gov/) и расположение ампликона в пределах гена, цифры - номера нуклеотидов от N'-конца гена.
- праймеры для амплификации фрагмента гена RBCL, кодирующего большую субъединицу рибулозы-1,5-бифосфаткарбоксилазы/оксигеназы (Асс. № Z95552, поз. 160 - 720);
- праймеры для амплификации фрагмента гена лектина LE1 (Асс. № К00821М30884, поз. 1080 - 1720);
- праймеры для амплификации фрагмента гена IVR1, кодирующего бета-фруктозидазу (Асс. № U16123, поз. 300 - 1090);
- праймеры для амплификации фрагмента 35S-промотора вируса мозаики цветной капусты (Асс. № FM 177585, поз. 3560 - 3870);
- праймеры для амплификации фрагмента 35S-терминатора вируса мозаики цветной капусты (Асс. № FM177585, поз. 1260 - 1590);
- праймеры для амплификации фрагмента 35S-промотора каулимовируса мозаики норичника (FMV, Acc. № X06166, поз. 6260 - 6630);
- праймеры для амплификации фрагмента терминатора гена белка теплового шока пшеницы (Асс. № Х58279, поз. 10 - 210);
- праймеры для амплификации фрагмента маркерного гена BAR, определяющего устойчивость к фосфинотрицину (Асс. № AY310901, поз. 380 - 920);
- праймеры для амплификации фрагмента терминатора nos из агробактерии Agrobacterium tumefaciens: (Асс. № FM 177585, поз. 10 - 370).
*В скобках указан номер гена (Accession №) в Международном банке генов Национального центра биотехнологической информации (NCBI, National Centerfor Biotechnology Information, https://www.ncbi.nlm.nih.gov/) и расположение ампликона в пределах гена, цифры - номера нуклеотидов от N'-конца гена.
- праймеры для амплификации фрагмента гена фосфорилазы УДФ-глюкозы (UDP-GP) (Асс. № D00667, поз. 50 - 310);
- праймеры для амплификации фрагмента гена фосфат-синтазы риса (SPS) (Асс. № U33175, поз. 5910 - 6250);
- праймеры для амплификации фрагмента маркерного гена nptll транспозона Tn5 бактериального происхождения (Асс. № EU886197, поз. 9792 - 10145);
- праймеры для амплификации фрагмента терминатора ocs из агробактерии Agrobacterium tumefaciens (Асе. № AJ311872, поз. 5050 - 5240);
- праймеры для амплификации фрагмента терминатора гена RBCS гороха (Асс. № FM 177582.1, поз. 5782 - 5920);
- праймеры для амплификации фрагмента промотора гена актина риса АСТ1 (Асс. № S44221, поз. 12 - 380);
- праймеры для амплификации фрагмента маркерного гена gus из бактерии Escherichia coli (Асс. № EU503042, поз. 2770 - 3140).
Обозначение и назначение олигонуклеотидных зондов, иммобилизованных на биологическом микрочипе приведены в таблице 1.
|
Наименование олигонуклеотида |
Детектируемая мишень |
Назначение олигонуклеотида |
|
pIDNA (rbcL) |
ген RBCL |
Зонд для идентификации ДНК растительного происхождения в анализируемой пробе |
|
GM/ST1(RBCL) |
ген RBCL |
Видоспецифичный зонд для идентификации ДНК сои и/или картофеля |
|
ZM1(RBCL) |
ген RBCL |
Видоспецифичный зонд для идентификации ДНК кукурузы |
|
OS 1 (RBCL) |
ген RBCL |
Видоспецифичный зонд для идентификации ДНК риса |
|
STh(RBCL) |
ген RBCL |
Видоспецифичный зонд для идентификации ДНК картофеля |
|
GM2(RBCL) |
ген RBCL |
Видоспецифичный зонд для идентификации ДНК сои |
|
ZM/OS2(RBCL) |
ген RBCL |
Видоспецифичный зонд для идентификации ДНК кукурузы и/или риса |
|
ST2(RBCL) |
ген RBCL |
Видоспецифичный зонд для идентификации ДНК картофеля |
|
Le1(Gm) |
ген лектина (LE1) |
Специфичный зонд для идентификации ДНК сои |
|
Zein(Zm) |
ген IVR1 |
Специфичный зонд для идентификации ДНК кукурузы |
|
UDP-GP (St) |
ген фосфорилазы УДФ-глюкозы |
Специфичный зонд для идентификации ДНК картофеля |
|
SPS (Os) |
ген фосфат-синтазы риса |
Специфичный зонд для идентификации ДНК риса |
|
nptll |
ген npt |
Специфичный зонд для идентификации маркерного гена nptll из транспозона Тп5 |
|
35S_p CAMV |
промотор 35S |
Специфичный зонд для идентификации 35S промотора вируса мозаики цветной капусты |
|
35S_p FMV |
промотор FMV |
Специфичный зонд для идентификации 35S FMV промотора каулимовируса мозаики норичника |
|
Act1_p |
ген актина АСТ1 |
Специфичный зонд для идентификации промотора гена актина риса |
|
Gus |
ген gus |
Специфичный зонд для идентификации маркерного гена gus |
|
nos_t |
терминатор nos |
Специфичный зонд для идентификации терминатора nos из агробактерии Agrobacterium tumefaciens |
|
35S_t CAMV |
терминатор 35S |
Специфичный зонд для идентификации 35S терминатора вируса мозаики цветной капусты |
|
rbcSt |
Терминатор гена RBCS |
Специфичный зонд для идентификации терминатора гена RBCS гороха |
|
Ocs_t |
Терминатор Ocs |
Специфичный зонд для идентификации терминатора ocs из агробактерии Agrobacterium tumefaciens |
|
Bar |
ген BAR |
Специфичный зонд для идентификации маркерного гена BAR |
5.44 Описание биологического микрочипа
На рисунке 1 показана схема биологического микрочипа с иммобилизованными олигонуклеотидами, назначение которых приведено в таблице 1 (название олигонуклеотида соответствует изображенному на рисунке 1).
Рисунок
1 - Схема биологического микрочипа для идентификации генно-модифицированных
источников
растительного происхождения
Биологический микрочип представляет собой пластиковую подложку, выполненную по размерам предметного стекла по ГОСТ 9284, на поверхности которой в определенном порядке расположена 31 ячейка полиакриламидного геля в форме полусферы диаметром 100 мкм (обозначены кружками на рисунке 1).
22 из них содержат индивидуальный ковалентно иммобилизованный олигонуклеотид (перечень и назначение олигонуклеотидов приведены в таблице 1). Пять ячеек с индексом «0» не содержат перечисленных индивидуальных ковалентно иммобилизованных олигонуклеотидов и выполняют роль отрицательного контроля гибридизации. Четыре ячейки с индексом «М», содержат ковалентно связанный флуоресцентный краситель и предназначены для автоматического вычисления интенсивности флуоресценции ячеек биологического микрочипа после гибридизации.
Поверхность биологического микрочипа должна быть закрыта специальной составной крышкой с отверстиями, которая вместе с подложкой образует гибридизационную камеру, предназначенную для проведения реакции гибридизации анализируемых ПЦР-продуктов с иммобилизованными на биологическом микрочипе олигонуклеотидами, и исключающую возможность испарения реакционной смеси в процессе гибридизации.
Диагностическая специфичность при идентификации растительной ДНК сои, картофеля, кукурузы, риса составляет не менее 95 %.
Допускается применение других средств измерений с метрологическими характеристиками, а также вспомогательного оборудования, посуды, реактивов и материалов с техническими характеристиками не хуже указанных выше.
6 Отбор проб
Отбор проб проводят по нормативным документам, действующим на территории стран, принявших стандарт и устанавливающих порядок отбора проб для однородных групп продуктов (пищевого сырья, готовых пищевых продуктов с содержанием растительных компонентов, посевного и посадочного материала, цветов).
7 Подготовка к проведению анализа
7.1 Приготовление растворов
7.1.1 Приготовление раствора NaOH концентрации 40 г/дм3
8 стеклянную колбу по ГОСТ 1770 вместимостью 100 см3 помещают 4,0 г сухой гидроокиси натрия по ГОСТ 4328 и растворяют в 100 см3 особо чистой стерильной воды (см. 5.30). После охлаждения раствора до комнатной температуры его переливают в специальную щелочеустойчивую пластиковую плотно закрывающуюся емкость.
Срок хранения при комнатной температуре - не более одного года.
7.1.2 Приготовление раствора ЭДТА концентрации 74,4 г/дм3
В стеклянную колбу вместимостью 100 см3 по ГОСТ 25336 помещают 7,44 г ЭДТА (см. 5.26), растворяют в 80 см3 особо чистой стерильной воды при интенсивном перемешивании на магнитной мешалке. Затем раствором, приготовленным по 7.1.1 доводят рН раствора до 8,0 ед. рН. Полученный раствор переливают в мерную колбу по ГОСТ 1770 вместимостью 100 см3 и особо чистой стерильной водой доводят объем этого раствора до метки.
Срок хранения в холодильнике (см. 5.7) при температуре 4 °С - 5°С – не более 6 мес.
7.1.3 Приготовление 70 %-ного раствора этилового спирта
В мерную колбу по ГОСТ 1770 вместимостью 200 см3 вносят 140 см3 96 %-ного этилового спирта высокой степени очистки по ГОСТ 5962, добавляют 52 см3 особо чистой стерильной воды до метки и перемешивают.
Срок хранения в холодильнике при температуре 4 °С - 5°С – не более 6 мес.
7.1.4 Приготовление раствора Трис-гидрохлорида массовой концентрации 242,2 г/дм3
В колбу по ГОСТ 25336 вместимостью 100 см3 помещают 24,22 г трис(оксиметил)аминометана (см. 5.27) и растворяют приблизительно в 80 см3 особо чистой стерильной воды. Концентрированной соляной кислотой по ГОСТ 3118 доводят рН раствора до 7,5 ед. рН, затем переливают в мерную колбу и доводят объем - до 100 см3 особо чистой стерильной водой.
Срок хранения при комнатной температуре - не более 6 мес.
7.1.5 Приготовление раствора NaCI массовой концентрации 146,2 г/дм3
В колбу по ГОСТ 25336 вместимостью 100 см3 помещают 14,62 г хлористого натрия по ГОСТ 4233, растворяют в 70 - 80 см3 особо чистой стерильной воды, затем полученный раствор переносят в мерную колбу вместимостью 100 см3 и особо чистой стерильной водой доводят объем раствора до метки.
Срок хранения при комнатной температуре - не более одного года.
7.1.6 Приготовление ЦТАБ-буфера
В колбу по ГОСТ 25336 вместимостью 100 см3 помещают 2,0 г цетилтриметиламмония бромида (см. 5.31), добавляют 5 см3 раствора Трис-HCI, приготовленного по 7.1.4, 56 см3 раствора NaCI, приготовленного по 7.1.5, и 10 см3 раствора ЭДТА, приготовленного по 7.1.2. Раствор переносят в мерную колбу и объем раствора доводят до 100 см3 особо чистой стерильной водой. Перемешивают на магнитной мешалке до полного растворения соли.
Срок хранения при комнатной температуре - не более одного года.
7.1.7 Приготовление ЦТАБ-раствора
В стеклянную колбу вместимостью 100 см3 помещают 0,5 г цетилтриметиламмония бромида (см. 5.31), добавляют 1,6 см3 раствора NaCI, приготовленного по 7.1.5. Раствор переносят в мерную колбу и объем раствора доводят до 100 см3 особо чистой стерильной водой.
Срок хранения в холодильнике при температуре 4 °С - 5 °С - не более одного месяца, в морозильной камере (см. 5.6) при температуре минус 20 °С - не более одного года.
7.1.8 Приготовление разведенного раствора NaCI
В мерную колбу по ГОСТ 1770 вместимостью 100 см3 вносят 48 см3 раствора NaCI, приготовленного по 7.1.5, доводят объем раствора до метки особо чистой стерильной водой. Срок хранения при комнатной температуре - не более 6 мес.
7.1.9 Раствор Taq-полимеразы (см. 5.34) хранят при температуре минус 20 °С не более шести месяцев. Не допускается хранение раствора Taq-полимеразы ниже температуры минус 23 °С.
7.2 Приготовление пробы для анализа (выделение ДНК)
7.2.1 Две параллельные пробы анализируемого продукта массой около 100 мг каждая помещают в две чистые стерильные микроцентрифужные пробирки (см. 5.15) вместимостью 1,5 см3, добавляют по 500 мм3 ЦТАБ-буфера, приготовленного по 7.1.6, перемешивают на аппарате для встряхивания (см. 5.10) в течение 2 мин и выдерживают 15 - 20 мин при температуре 65 °С в термостате для микропробирок.
7.2.2 Микроцентрифужные пробирки со смесью, приготовленной по 7.2.1, центрифугируют при комнатной температуре в настольной центрифуге (см. 5.8) при частоте вращения 13000 мин-1 в течение 10 мин.
7.2.3 Надосадочную жидкость, полученную по 7.2.2, отбирают микродозатором (обычно по 500 мм3) и переносят в чистые микроцентрифужные пробирки, добавляют равный объем хлороформа по ГОСТ 20015. Содержимое перемешивают на аппарате для встряхивания в течение 2 мин и центрифугируют 10 мин при частоте вращения 13000 мин-1.
7.2.4 Верхнюю жидкую фазу из смеси, полученной по 7.2.3, аккуратно отбирают микродозатором в чистые микроцентрифужные пробирки, не захватывая промежуточную или нижнюю фазу. В пробирки добавляют два объема ЦТАБ-раствора, приготовленного по 7.1.7, аккуратно перемешивают, переворачивая пробирки вручную, и выдерживают 60 мин при комнатной температуре.
7.2.5 Смесь, полученную по 7.2.4, центрифугируют 5 мин при частоте вращения 13000 мин-1. Надосадочную жидкость тщательно удаляют микродозатором, а осадок растворяют в 350 - 600 мм3 (в зависимости от объема осадка) разведенного раствора NaCI, приготовленного по 7.1.8, добавляют равный объем хлороформа по ГОСТ 20015, перемешивают на аппарате для встряхивания в течение 30 си центрифугируют 10 мин при частоте вращения 13000 мин-1.
7.2.6 Надосадочную жидкость, полученную по 7.2.5, отбирают микродозатором и переносят в чистые микроцентрифужные пробирки, добавляют равный объем изопропилового спирта (см. 5.29), аккуратно перемешивают содержимое пробирок вручную и выдерживают в течение 1 ч при комнатной температуре.
7.2.7 Смесь, полученную по 7.2.6, центрифугируют 10 мин при частоте вращения 13000 мин-1, надосадочную жидкость аккуратно сливают, а к осадку ДНК добавляют 1 см3 70 %-ного этилового спирта, приготовленного по 7.1.3 и охлажденного до температуры 0 °С - 4 °С, перемешивают и центрифугируют 5 мин при частоте вращения 13000 мин-1.
7.2.9 Осадок ДНК, полученный по 7.2.8, перерастворяют в 40 - 50 мм3 особо чистой стерильной воды. Полученный раствор ДНК используют для проведения амПЦР.
Срок хранения раствора ДНК в морозильной камере при температуре минус 20 °С - до одного года.
7.3 Подготовка асимметричной мультиплексной ПЦР
7.3.1 Приготовление реакционной смеси для амПЦР
Готовят две микроцентрифужные пробирки вместимостью по 1,5 см3 и маркируют их «М1» и «М2».
В пробирку «М1» микродозатором вносят (из расчета на каждую анализируемую пробу): 2,5 мм310´ реакционного буфера для ПЦР (см. 5.35), 2,5 мм3 смеси дезоксирибонуклеозидтрифосфатов (см. 5.38), 2 мм3 фермента Taq-полимеразы (см. 5.34), концентрацией 5 Ед. акт/мм3 (срок хранения Taq-полимеразы после разведения при температуре от 2 °С до 8 °С - не более 2 ч), 1 мм3 флуоресцентного субстрата ФС (см. 5.39), а также 1 мм3 водного раствора праймеров «ПР-1» (см. 5.42).
В пробирку «М2» микродозатором вносят (из расчета на каждую анализируемую пробу): 2,5 мм310´ реакционного буфера для ПЦР (см. 5.35); 2,5 мм3 смеси дезоксирибонуклеозидтрифосфатов (см. 5.38), 2 мм3 фермента Taq-полимеразы (см. 5.34), концентрацией 5 Ед. акт/мм3, 1 мм3 флуоресцентного субстрата ФС (см. 5.39), а также 1 мм3 водного раствора праймеров «ПР-2» (см. 5.43).
Смесь разбавляют особо чистой стерильной водой до объема 20 мм3 (из расчета на одну анализируемую пробу) и осторожно перемешивают в течение 3 - 5 с на аппарате для встряхивания, не допуская образования пены. Общий объем реакционных смесей в микропробирках «М1» и «М2» для амПЦР готовят с учетом числа анализируемых проб и двух контрольных проб: положительный контроль [заведомо трансгенная ДНК (см. 5.40)] и отрицательный контроль [заведомо нетрансгенная ДНК (см. 5.41)].
7.3.1.2 Реакционную смесь для амПЦР, полученную по 7.3.1.1, осаждают кратковременным (10 - 15 с) центрифугированием на настольной центрифуге при частоте вращения 1500 - 3000 мин-1 и сразу же используют для проведения анализа.
7.3.2 Все этапы амПЦР должен проводить квалифицированный, специально обученный персонал. Для проведения амПЦР допускается использовать только стерильную лабораторную посуду и новые стерильные микроцентрифужные пробирки.
При проведении амПЦР каждую микроцентрифужную пробирку открывают только перед отбором или внесением анализируемой пробы, а по окончании манипуляции сразу же закрывают. Запрещается открывать одновременно несколько микроцентрифужных пробирок с анализируемыми пробами поставлять их открытыми длительное время. Каждую анализируемую пробу отбирают микродозатором с новым стерильным наконечником с фильтром.
8 Проведение анализа
8.1 Проведение асимметричной мультиплексной ПЦР
8.1.1 Для каждой анализируемой пробы готовят две чистых микроцентрифужных пробирки вместимостью 0,2 или 0,5 см3, маркируя их «N1» и «N2», где N - номер анализируемой пробы.
8.1.2 Реакционные смеси для амПЦР «М1» и «М2», полученные по 7.3.1.1 - 7.3.1.2, микродозатором вносят в микроцентрифужные пробирки по 20 мм3 в каждую таким образом, чтобы смесь «М1» была распределена по пробиркам с индексом «N.,», а смесь «М2» - по пробиркам с индексом «N2».
8.1.3 Анализируемую ДНК пробы N, выделенную по 7.2, вносят микродозатором по 5 мм3 в микроцентрифужные пробирки с реакционной смесью для амПЦР (см. 8.1.2), маркированные, соответственно, «N1» и «N2». При использовании амплификатора ДНК без подогрева крышки в каждую микроцентрифужную пробирку с реакционной смесью вносят по 30 мм3 вазелинового масла для предохранения реакционной смеси от испарения водной фазы при амПЦР. В этом случае анализируемую ДНК вносят под слой масла, в результате чего образуются водная и масляная фазы.
8.1.4 В две другие микроцентрифужные пробирки микродозатором вносят по 5 мм3 раствора заведомо трансгенной ДНК (положительный контроль).
8.1.6 Все микроцентрифужные пробирки со смесями, подготовленными по 8.1.3 - 8.1.5, помещают в амплификатор ДНК и проводят амПЦР по программе, указанной в таблице 2.
Таблица 2
|
Шаг программы |
Температура, °С |
Время инкубации |
Число циклов |
|
1 |
95 |
12 мин |
1 |
|
2 |
95 |
30 с |
55 |
|
51 |
30 с |
||
|
72 |
30 с |
||
|
3 |
72 |
10 мин |
1 |
8.2 Гибридизация на биологическом микрочипе
8.2.1 Для проведения этапа гибридизации готовят N+2 микроцентрифужных пробирки вместимостью 0,5 или 1,5 см3 (N - количество анализируемых проб, две другие пробирки - для анализа положительного и отрицательного контроля).
8.2.2 В необходимое количество микроцентрифужных пробирок микродозатором вносят по 18 мм3 гибридизационного буфера (см. 5.36). К гибридизационному буферу в пробирку «N» добавляют по 9 мм3 водной фазы ПЦР-смесей из пробирок «N.,» и «N2», полученных в результате проведения амПЦР (см. 8.1.6) и перемешивают в течение 20 - 30 с на аппарате для встряхивания (см. 5.10) с частотой вращения не менее 1500 мин-1 для получения гибридизационной смеси.
8.2.3 Из каждой микроцентрифужной пробирки микродозатором отбирают по 34 мм3 гибридизационной смеси (для каждого биологического микрочипа), полученной по 8.2.2. Смесь вносят через любое из двух отверстий гибридизационной камеры, после чего оба отверстия закрывают крышкой. Гибридизацию проводят в термостате (см. 5.4) при температуре 37 °С. Минимальное время гибридизации составляет 3 ч. Допускается гибридизация в течение ночи, но не более 16 - 18 ч.
8.2.4 После окончания гибридизации крышку реакционной камеры открывают и микродозатором отбирают гибридизационную смесь из камеры микрочипа. В любое из двух отверстий камеры вносят 34 мм3 дистиллированной воды по ГОСТ 6709, предварительно нагретой до температуры 37 °С. Воду выдерживают в реакционной камере биологического микрочипа в течение 1 мин, затем отбирают микродозатором и отбрасывают. Процедуру повторяют, послечего составную крышку отсоединяют от подложки. Подложку последовательно промывают дистиллированной водой по ГОСТ 6709, этиловым спиртом (см. 5.28), снова дистиллированной водой и высушивают при комнатной температуре.
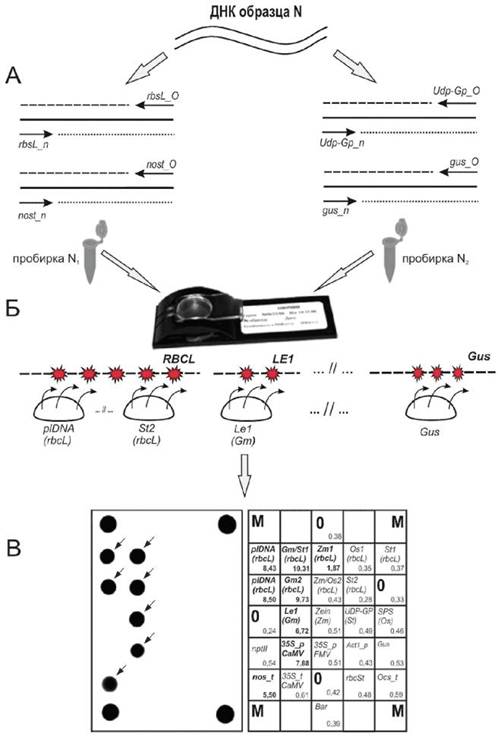
Схема метода идентификации генно-модифицированных источников (ГМИ) растительного происхождения приведена в приложении А.
9 Обработка результатов анализа
9.1 Результаты гибридизации регистрируют с помощью УАПК. Инсталляция и эксплуатация комплекса осуществляется в соответствии с руководством по эксплуатации УАПК.
9.2 Проводят запуск программного обеспечения*, поставляемого вместе с комплексом УАПК. При запуске на мониторе появляется схема биочипа с указанием отдельных ячеек и обозначением находящихся в них зондов. Названия зондов соответствуют указанным в таблице 1 и на рисунке 1.
* «imageware.exe» - пример доступного программного обеспечения, пригодного для использования с описываемым методом. Данная информация приведена для удобства пользователей настоящего стандарта и не служит рекомендацией или одобрением конкретного типа оборудования.
9.3 Биологический микрочип после проведения гибридизации, промывки, удаления гибридизационной камеры, ополаскивания и высушивания помещают в держатель УАПК «лицевой» стороной (содержащей гелевые ячейки) вверх.
9.4 Нажимают пиктограмму с надписью «Пуск» в верхней части диалогового окна «Снимок». При этом происходит возбуждение флуоресценции ячеек биочипа лазерами с длиной волны 640 нм, захват флуоресцентного изображения, его обработка и выдача отчета о присутствии в анализируемой пробе ДНК растительного происхождения, идентификации видоспецифичной ДНК (соя, кукуруза, картофель, рис) и наличии/отсутствии генетических элементов, используемых как детерминанты трансгенности. Применение УАПК для анализа биологических микрочипов позволяет автоматизировать все этапы регистрации и интерпретации результатов и получать заключение о наличии/отсутствии ДНК растительного происхождения в анализируемой пробе, а также о наличии/отсутствии генетических детерминант трансгенности.
9.5 Анализ биологических микрочипов с прогибридизованными ПЦР-продуктами, полученными при амплификации ДНК, выделенной из различных анализируемых проб, начинают с регистрации и интерпретации гибридизационных картин положительного (заведомо трансгенной ДНК) и отрицательного контроля (заведомо нетрансгенной ДНК).
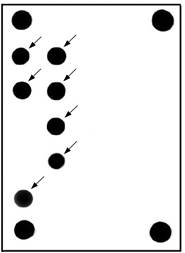
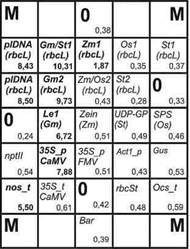
9.6 Результат анализа ДНК сои, содержащей трансгенные элементы, с использованием гибридизации на биочипе, представлен в приложении Б. Пример оформления протокола результатов испытания приведет в приложении В.
9.7 Если при использовании заведомо нетрансгенной ДНК регистрируют сигнал в ячейках, содержащих олигонуклеотиды, комплементарные последовательностям фрагментов векторных конструкций и маркерных генов, это свидетельствует о получении ложноположительного результата. При этом результаты анализа остальных анализируемых проб не учитываются. Причиной может быть загрязнение (контаминация) ГМИ реактивов и/или оборудования. В этом случае необходимо обработать поверхности лабораторных столов и оборудования раствором соляной кислоты по ГОСТ 3118 (0,1 моль/дм3), заменить реактивы на свежеприготовленные и повторить анализ. В случае отсутствия сигналов в ячейках, содержащих зонды, специфичные к различным генетическим детерминантам трансгенности, при использовании заведомо нетрансгенной ДНК, делают заключение об отсутствии контаминации и проводят анализ проб ДНК согласно разделу 8.
9.8 Отсутствие флуоресцентных сигналов в ячейках, содержащих олигонуклеотиды, специфичные к гену RBCL, при использовании нетрансгенной растительной ДНК свидетельствует о получении ложноотрицательного результата. При этом результаты анализа остальных анализируемых проб не учитываются. Причиной могут быть потеря активности одного из компонентов реакционной смеси для амПЦР или несоблюдение условий проведения амПЦР и/или гибридизации на биологическом микрочипе. В этом случае необходимо заменить реактивы на свежеприготовленные и повторить анализ. Наличие сигнала в ячейках, содержащих олигонуклеотиды, специфичные к ДНК растительного происхождения, при использовании заведомо нетрансгенной ДНК, свидетельствует об эффективно проведенной амПЦР и гибридизации на биочипе. При этом анализ проб ДНК проводят далее согласно разделу 8.
10 Требования безопасности
10.1 Условия безопасного проведения работ
При выполнении измерений необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007, требования пожарной безопасности - по ГОСТ 12.1.004, требования электробезопасности при работе с электроустановками - по ГОСТ 12.1.019 и в соответствии с требованиями, изложенными в инструкциях по эксплуатации оборудования.
10.2 Помещение, в котором проводятся работы, должно быть оборудовано общей приточно-вытяжной вентиляцией по ГОСТ 12.4.021, оснащено средствами пожаротушения по ГОСТ 12.4.009. Содержание вредных веществ в воздухе рабочей зоны не должно превышать норм, установленных ГОСТ 12.1.005.
10.3 Требования к квалификации персонала
К проведению измерений, обработке и оформлению результатов измерений допускаются специалисты имеющие специальное образование, опыт работы с данным оборудованием, освоившие настоящий метод и прошедшие инструктаж по технике безопасности при работе в лаборатории.
Приложение А
(справочное)
А.1 Схема метода идентификации генно-модифицированных источников растительного происхождения с использованием биологического микрочипа приведена на рисунке А.1.
|
A - мультиплексная асимметричная амплификация ДНК образца «N» в двух независимых пробирках «N1» и «N2» с уникальным набором праймеров для получения преимущественно одноцепочечных флуоресцентно меченных фрагментов; Б - гибридизация ПЦР-продуктов, полученных в независимых пробирках «N1» и «N2» со специфическими олигонуклеотидами, иммобилизованными на биологическом микрочипе; В - регистрация и интерпретация флуоресцентной картины гибридизации на биологическом микрочипе. В анализируемой пробе содержится ДНК генно-модифицированной сои. |
Рисунок А.1
Приложение
Б
(обязательное)
Б.1 Флуоресцентная картина гибридизации, полученная в результате анализа ДНК генно-модифицирован-ной сои и распределение нормированных сигналов ячеек биологического микрочипа приведена на рисунке Б.1.
|
Б |
В |
|
|
|
|
|
|
А - схема биологического микрочипа для идентификации генно-модифицированного источника растительного происхождения. Б - гибридизационная картина на биологическом микрочипе флуоресцентных продуктов амПЦР анализируемой ДНК сои, содержащей 35S-промотор, терминатор nos. Стрелками обозначены ячейки, в которых образовались совершенные гибридизационные дуплексы. В - распределение нормированных сигналов ячеек биологического микрочипа. Жирным шрифтом выделены ячейки, в которых образовались совершенные гибридизационные дуплексы. |
||
Рисунок Б.1
Приложение
В
(рекомендуемое)
Пример оформления протокола испытания
Наименование испытательной лаборатории (Центра)
ПРОТОКОЛ ИСПЫТАНИЙ
|
|
№_____от «_____»_____201_____г. Даты: поступления на испытание «_____«_____201_____г. конца испытаний «_____«_____201_____г. |
|
|
Продукция: Котлеты «Любительские» Производитель сырья или продукции: ООО «Вымпел» Заказчик: ООО «Биотест-М» Отбор проб проведен по нормативным документам, действующим на территории государства, принявшего стандарт* (в соответствии с нормативным документом на соответствующую однородную группу сырья или продукции) * В Российской Федерации действует ГОСТ Р 51447-99 «Мясо и мясные продукты. Методы отбора проб». Акт отбора проб и техническое задание на испытания №_____от «_____»_____20_____ Испытания проведены на основании требований ГОСТ ... Номер образца: 6/кс, 7/кс, 8/кс и 9/кс Характеристика испытуемого образца (маркировка, вид и состояние упаковки, этикетки, штриховка): Маркировка на упаковке, информирующая о наличии в продукте ГМИ в образцах № 6/кс, 7/кси 8/кс отсутствует, а в образце № 9/кс присутствует. Маркировка: _____________-________________ Годен до:_____________-________________ Штриховой код (при наличии)_____________-________________ Результаты испытаний: Таблица 1 - Нетрансгенные последовательности
Результат анализа: - в образцах 6/кс, 7/кс, 8 к/с и 9/кс обнаружены растительные компоненты: - в образце 6/кс и 7/кс обнаружено присутствие ДНК сои; - в образцах 8/кс и 9/кс обнаружено присутствие ДНК картофеля. Таблица 2 - Трансгенные последовательности
Результат анализа: - в образцах 7/кс и 9/кс обнаружены следующие трансгенные компоненты: - в образце 7/кс обнаружен гомолог гена nptll; промотор 35S СаМУи терминатор nos; - в образце 9/кс обнаружены промотор 35S СаМУи терминатор nos; - в образцах 6/кс и 8/кс трансгенные компоненты не обнаружены. - маркировка на упаковке, информирующая о наличии в продукте ГМО, в образце 7/кс отсутствует, а в образце 9/кс присутствует. Вывод: Все образцы содержат растительную ДНК, образец 6/кс содержит нетрансгенную ДНК сои; образец 7/кс содержит трансгенную ДНК сои; образец 8/кс содержит нетрансгенную ДНК картофеля; образец 9/кс содержит трансгенную ДНК картофеля. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Исполнители: |
|
|
Иванов И.И. |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
подпись |
|
Фамилия, инициалы |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Петров П.П. |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
подпись |
|
Фамилия, инициалы |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Руководитель испытательной лаборатории |
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
подпись |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
МП |
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Фамилия, инициалы |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Заключение распространяется на образец, представленный на испытания в лабораторию (Центр).
Ключевые слова: идентификация, сырье и продукты пищевые, генно-модифицированные организмы (ГМО), генно-модифицированные источники (ГМИ), асимметричная мультиплексная полимеразная цепная реакция, биологический микрочип, гибридизация, праймер, олигонукпеотиды, последовательность ДНК, нетрансгенная ДНК, трансгенная ДНК, интенсивность флуоресценции