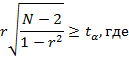Государственное санитарно-эпидемиологическое
нормирование
Российской Федерации
1.2.
ОБЩИЕ ВОПРОСЫ. ГИГИЕНА,
ТОКСИКОЛОГИЯ, САНИТАРИЯ
Установление максимально допустимой
концентрации химических веществ
(неметаболизированных) в крови
по критериям риска для здоровья
при многосредовой экспозиции
Методические рекомендации
МР 1.2.0074-13
Москва 2013
1. Разработаны Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Г.Г. Онищенко, Т.Ю. Завистяева, И.В. Брагина), Федеральным бюджетным учреждением науки «Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения» (Н.В. Зайцева, М.А. Землянова, И.В. Май, Д.А. Кирьянов, Т.С. Уланова, О.Ю. Устинова).
2. Утверждены руководителем Федеральной службы но надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 20 августа 2013 г.
3. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель
Федеральной службы ____________________ Г.Г. Онищенко 20 августа 2013 г. Дата введения: с момента утверждения |
1.2.
ОБЩИЕ ВОПРОСЫ.
ГИГИЕНА, ТОКСИКОЛОГИЯ, САНИТАРИЯ
Установление максимально допустимой
концентрации химических веществ
(неметаболизированных) в крови по критериям риска
для здоровья при многосредовой экспозиции
Методические рекомендации
МР 1.2.0074-13
1. Общие положения
1.1. Проведение исследований осуществляется по запросу органов и организаций Роспотребнадзора научно-исследовательскими организациями, а также иными научно-исследовательскими или лечебно-профилактическими учреждениями, привлекаемыми в соответствии с п. 6.4 постановления Правительства Российской Федерации от 30.06.2004 № 322 «Об утверждении Положения о Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека», аккредитованными в установленном порядке для проведения работ по оценке риска для здоровья населения, исследований биологических объектов, материалов и сред, а также имеющих лицензию на осуществление медицинской деятельности.
1.2. Планирование и проведение исследований осуществляется с обязательным соблюдением принципов надлежащей лабораторной практики (Principles of good Laboratory practice) в соответствии с Национальным стандартом Российской Федерации ГОСТ Р 53434-09.
1.2.1. Установление максимально допустимой концентрации (МДК) химических веществ (неметаболизированных) в крови проводится по предварительно разработанному плану, утвержденному датированной подписью ответственным исполнителем исследования, с ведением протокола и составлением отчета, в который заносятся все результаты исследований.
1.2.2. Результаты исследований заносятся в протокол. Протокол исследования утверждается руководителем организации, проводящей исследования, и включает: цель и задачи исследования; описание испытуемого объекта, для которого разрабатывается МДК в крови, с указанием кода или наименования (по номенклатуре Международного союза теоретической и прикладной химии (IUPAC), регистрационный номер справочной службы по химической литературе Американского химического общества (CAS); физические, химические, биологические характеристики; референтные уровни содержания в крови, критические органы и системы; схему исследования и ее обоснование; методы отбора крови; метод количественного определения исследуемого объекта, для которой обосновывается МДК в крови с метрологической характеристикой анализа; методы исследования воздействия объекта на организм; результаты исследований, результаты статистической обработки полученных данных; заключение.
1.3. Требования к используемому оборудованию.
1.3.1. Измерительное оборудование должно соответствовать требованиям ИСО 10012:2003 «Системы менеджмента измерений. Требования к измерительным процессам и измерительному оборудованию».
1.3.2. Эксплуатация оборудования проводится в соответствии с техническим паспортом и руководством пользователя. Выполнение измерительных процессов должно проводиться при нормальных значениях климатических факторов внешней среды в соответствии с ГОСТ 15150-69 «Исполнение для различных климатических районов».
1.4. Требования к используемым реактивам и тест-системам.
Используемые реактивы и тест-системы должны иметь государственный сертификат соответствия и гарантированный срок использования. Исследования на тест-системах должны проводиться строго по инструкции производителя или специально разработанным стандартным операционным процедурам и исключать воздействие внешних факторов, способных повлиять на качество выполнения исследований.
1.5. Требования к оформлению отчета.
1.5.1. Отчет о проведенном исследовании является основным документом, подтверждающим результаты установления МДК химических веществ в крови по критериям риска для здоровья при многосредовой хронической экспозиции. Отчет должен содержать разделы: название исследования, название и адрес организации, даты начала и завершения исследований, цель и задачи исследования, схему проведения лабораторных исследований, перечень использованного оборудования, методы статистической обработки результатов, результаты исследования, представленные в виде обобщающих таблиц и графиков с соответствующей статистической обработкой и комментариями к ним, заключение. Отчет составляется ответственным исполнителем, утверждается руководителем организации и скрепляется печатью организации.
1.5.2. Отчет о результатах проведенного исследования составляется ответственным исполнителем, утверждается руководителем организации и скрепляется печатью организации.
1.6. Система обеспечения качества лабораторных исследований.
1.6.1. Лабораторные исследования проводятся в соответствии с требованиями ГОСТ Р ИСО 15189-09 «Лаборатории медицинские. Частные требования к качеству и компетентности».
1.6.2. Контроль качества проведенных лабораторных исследований является обязательным для организаций, осуществляющих разработку МДК химических веществ в крови, и обеспечивается:
- на уровне субъектов Российской Федерации - межлабораторным контролем качества, осуществляемым Федеральной системой внешней оценки качества на основе обработки результатов исследований, проведенных исследовательской лабораторией организации, стандартных образцов (контрольных материалов), рассылаемых центром внешнего контроля качества клинических лабораторных исследований;
- на уровне исследовательской лаборатории организации, в которой осуществляется исследование, - внутрилабораторным контролем качества на основе повседневного (в каждой аналитической серии) проведения исследования проб контрольных материалов в соответствии с «Руководством по качеству клинических лабораторных исследований» данной лаборатории (прилож. 1 к приказу Минздравсоцразвития Российской Федерации от 7.02.2000 № 45 «О системе мер по повышению качества клинических лабораторных исследований в учреждениях здравоохранения Российской Федерации»).
1.7. Требования к контрольным материалам и стандартным образцам.
Для контроля качества проводимых количественных лабораторных исследований используются стандартные образцы, контрольные материалы в стабилизированной форме. Каждый стандартный образец и контрольный материал должен иметь паспорт с указанием типа матрицы, диапазонов значений определяемых показателей в соответствии с методом анализа, срока годности материала, условий хранения.
1.8. Стандартные операционные процедуры.
1.8.1. В целях обеспечения качества, достоверности и воспроизводимости результатов исследования осуществляется соблюдение стандартных операционных процедур, которые разрабатываются организацией, аккредитованной в установленном порядке на проведение исследований биологических объектов, материалов и сред, и утверждаются руководителем организации. Отклонения от стандартных операционных процедур должны быть документально оформлены и утверждены руководителем исследования.
1.8.2. Стандартные операционные процедуры разрабатываются на все производственные этапы, включая: отбор образцов проб биологического материала; маркировку, поступление в лабораторию, регистрацию; преаналитическую и аналитическую обработку проб, регистрацию результатов исследования; условия хранения исследуемых проб; хранение и аттестацию контрольных материалов и стандартных образцов; обслуживание и поверку измерительных приборов и оборудования; приготовление реактивов, ведение записей в лабораторных журналах; обслуживание помещений; обезвреживание и утилизацию отходов биоматериала и реагентов; осуществление программы по обеспечению качества исследований.
1.9. Меры конфиденциальности.
Организация, проводящая исследования, и сотрудники, принимающие участие в проведении исследований, обязаны соблюдать конфиденциальность в отношении любых данных, полученных в ходе исследования, в соответствии с законодательством Российской Федерации.
1.10. Требования к медико-биологическим исследованиям с участием людей в качестве субъекта.
1.10.1. Биомедицинские исследования с участием людей в качестве субъекта должны быть выполнены в соответствии с обязательным соблюдением этических принципов медико-биологических исследований, изложенных в Хельсинкской Декларации 1975 г. с дополнениями 1983 г., Национальным стандартом Российской Федерации ГОСТ Р 52379-05 «Надлежащая клиническая практика» (ICH Е6 GCP), утвержденным приказом Федерального агентства по техническому регулированию и метрологии № 232-ст от 27.09.2005.
1.10.2. В организации, осуществляющей исследования по установлению МДК химических веществ в крови, для проведения этической экспертизы биомедицинских исследований с привлечением человека по приказу руководителя организации должен быть создан независимый этический комитет (НЭК). НЭК должен иметь в своем составе достаточное число лиц, суммарно обладающих необходимым опытом и квалификацией, для оценки научных, медицинских и этических аспектов предлагаемого исследования.
1.10.3. Участие здоровых испытуемых в медико-биологических исследованиях по установлению МДК химических веществ в крови является добровольным. Доброволец (волонтер) или его законный представитель имеет право отказаться от участия в проводимых исследованиях на любой его стадии. Добровольцы, включенные в исследование, или их законные представители подписывают письменное информированное согласие, один экземпляр которого выдается добровольцу или его законному представителю (прилож. 3).
1.10.4. Для проведения исследований выделяются сотрудники, контролирующие состояние здоровья добровольцев, соблюдение режима, организацию питания, отбор образцов биологических сред и их обработку, оказывающие при необходимости экстренную медицинскую помощь. В состав исследовательской группы обязательно должны входить врач-исследователь (1 - 2), процедурная и медицинская сестра (1 - 2), врач клинической лабораторной диагностики (1 - 2), фельдшер-лаборант (1 - 2), химик-аналитик (2 - 3), специалист-биохимик (1 - 2), специалист-иммунолог (1 - 2), научный сотрудник-исследователь (2 - 3), специалист по математическому моделированию и статистической обработке результатов исследований (1 - 2).
2. Область применения
2.1. Настоящие методические рекомендации устанавливают алгоритм, требования и методы обоснования максимально допустимых концентраций химических веществ (неметаболизированных) в крови по критериям риска для здоровья при хронической многосредовой экспозиции в целях повышения эффективности планирования контрольно-надзорных мероприятий за объектами внешней среды и принятия управленческих решений по обеспечению санитарно-эпидемиологической безопасности населения и защиты прав потребителей.
2.2. Методические рекомендации разработаны с целью обеспечения единой, научно-обоснованной стандартизированной системы установления химических веществ в крови по критериям риска для здоровья при хронической многосредовой экспозиции.
3. Основная часть
3.1. Термины и определения
Маркер экспозиции - экзогенное химическое вещество или его метаболит, количество которого определяется в биологических средах организма.
Маркер эффекта - показатель, количественно характеризующий биохимическое, физиологическое, поведенческое или иное изменение в организме, от степени выраженности которого определяется фактическое или потенциальное нарушение здоровья или развитие болезни.
Неблагоприятный (вредный) эффект - изменения в морфологии, физиологии, росте, развитии или продолжительности жизни организма, популяции, проявляющиеся в ухудшении функциональной способности или способности компенсировать дополнительный стресс, или в увеличении чувствительности к другим воздействиям факторов окружающей среды.
Приемлемый риск - уровень риска развития неблагоприятного эффекта, который не требует дополнительных мер по его снижению и оцениваемый как независимый, незначительный по отношению к рискам, существующим в повседневной деятельности и жизни населения.
Референтная концентрация - суточное воздействие химического вещества в течение всей жизни, которое устанавливается с учетом всех имеющихся современных научных данных и, вероятно, не приводит к возникновению неприемлемого риска для здоровья чувствительных групп населения.
Среда обитания человека - совокупность объектов, явлений и факторов окружающей среды, определяющая условия жизнедеятельности человека.
Среднесуточная доза/концентрация - потенциальная суточная доза/концентрация, усредненная весь период воздействия химического вещества.
Экспозиция (уровень воздействия) - контакт организма (рецептора) с химическим, физическим или биологическим агентом.
Предельно допустимая концентрация - максимальное количество вредного вещества в единице объёма (воздуха, воды или других жидкостей) или веса (например, пищевых продуктов), которое при ежедневном воздействии в течение неограниченно продолжительного времени не вызывает в организме каких-либо патологических отклонений, а также неблагоприятных наследственных изменений у потомства.
Максимально допустимая концентрация химических веществ (неметаболизированных) в крови - максимально допустимая концентрация химических веществ в единице объема крови, обусловленная многосредовой хронической экспозицией, которая при ежедневном воздействии в течение неограниченно продолжительного времени не вызывает достоверного (р ≤ 0,05) изменения ответных реакций организма, установленных по критериям риска для здоровья.
3.2. Объекты исследования
Объектом исследования являются химические вещества (неметаболизированные), оказывающие вредное воздействие на население при различных условиях хронической экспозиции (поступление химического агента в организм различными путями из различных объектов среды обитания - атмосферного воздуха, питьевой воды, пищевых продуктов, почвы и т.д.). Исследуемые вредные вещества должны иметь гигиенические нормативы содержания в воздействующих средах, утвержденные в соответствии с действующими правилами Российской Федерации.
Информация, необходимая для принятия решения о необходимости установления МДК химического вещества в крови:
3.2.1. Наличие аналитического метода определения массовой концентрации нормируемого химического вещества в крови человека с достаточной чувствительностью и точностью.
3.2.2. Распространенность в среде обитания и вероятность воздействия на население: объем вещества, поступающего в объекты среды обитания (атмосферный воздух, питьевая вода, вода открытых водоемов, почва, пищевые продукты).
Основные источники информации:
- об объеме поступления в атмосферный воздух от учтенных стационарных источников: ежегодные формы федерального государственного статистического наблюдения 2-ТП (воздух) «Сведения об охране атмосферного воздуха»; об объеме выбросов химического вещества от автотранспорта (официальная ежегодная отчетность о выбросах автотранспорта по населенным пунктам отсутствует, но в отдельных регионах такая информация приводится в сводном томе ПДВ);
- об объеме промышленных сбросов в поверхностные и подземные водоисточники: ежегодные формы федерального государственного статистического наблюдения 2-ТП (водхоз) «Сведения об использовании воды», обобщенные в соответствии с СанПиН 2.1.5.980-00 «Гигиенические требования к охране поверхностных вод» и СП 2.1.5.1059-01 «Гигиенические требования к охране подземных вод от загрязнения»;
- об объеме поступления с промышленными отходами в почву: ежегодные формы федерального государственного статистического наблюдения 2-ТП (отходы); «Сведения об образовании, использовании, обезвреживании, транспортировании и размещении отходов производства и потребления», обобщенные в соответствии ГОСТ 17.4.1.02-83 «Почвы. Общие требования к контролю и охране от загрязнения», СП 2.1.7.1038-01 «Гигиенические требования к устройству и содержанию полигонов для твердых бытовых отходов».
3.2.3. Качество объектов среды обитания по фактическим концентрациям нормируемого химического вещества.
Основные источники информации:
- о качестве атмосферного воздуха: результаты санитарно-химических мониторинговых исследований (протоколы лабораторных испытаний, отчетные формы), представляемые в Федеральную службу по надзору в сфере защиты прав потребителей и благополучия человека, обобщенные в соответствии с требованиями ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест»;
- о качестве питьевой воды: результаты санитарно-химических мониторинговых исследований (протоколы лабораторных испытаний, отчетные формы), представляемые в Федеральную службу по надзору в сфере защиты прав потребителей и благополучия человека, обобщенные в соответствии с требованиями СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества»;
- о качестве почвы: результаты санитарно-химических мониторинговых исследований (протоколы лабораторных испытаний, отчетные формы), представляемые в Федеральную службу по надзору в сфере защиты прав потребителей и благополучия человека, обобщенные в соответствии с требованиями ГН 2.1.7.2041-06 «Предельно допустимые концентрации (ПДК) химических веществ в почве»;
- о качестве пищевых продуктов: результаты санитарно-химических мониторинговых исследований (протоколы лабораторных испытаний, отчетные формы), представляемые в Федеральную службу по надзору в сфере защиты прав потребителей и благополучия человека, обобщенные в соответствии с требованиями СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов».
Математическое моделирование распространения нормируемого соединения в приземном слое атмосферы проводится на основании «Методического пособия по выполнению сводных расчетов загрязнения атмосферного воздуха выбросами промышленных предприятий и автотранспорта города (региона) и их применению при нормировании выбросов». (М., 1999).
Расчеты выполняются с использованием унифицированной программы расчета загрязнения атмосферы (УПРЗА), реализующей алгоритм методического документа ОНД-86 «Методика расчета концентраций в атмосферном воздухе вредных веществ, содержащихся в выбросах предприятий» (например, «Эколог», версия 3.0 и «Эколог-средние», моделирующие разовое и осреднённое по времени распределение загрязняющих веществ). Математическое моделирование распространения загрязнений производится по регулярной расчетной сетке, которая должна охватывать всю изучаемую территорию (город, район, участок и пр.). Плотность сетки (шаг расчетов по оси абсцисс и оси ординат) определяется рекомендациями ОНД-86 и техническими возможностями компьютерных средств. Приземные концентрации для каждой точки определяются для условий разных направлений ветра, соответствующих 8-румбовой розе ветров со средневзвешенной скоростью ветра 4 м/с, и для штилевых условий (0,5 м/с). При расчете рассеивания загрязнений учитываются эффекты суммарного действия и потенцирования. Константа целесообразности проведения расчетов задается уровнем 0,01.
Полученные расчетные концентрации анализируются методами пространственно-временного анализа в среде ГИС (например, ARC/View, версия 3.2.). Расчеты рассеивания позволяют оценить уровень загрязнения приземного слоя атмосферы и определить зону влияния источника. Зоной влияния источника считается территория, на которой достигаются приземные концентрации выше 0,05ПДКс.с., 0,1RfCcr (референтная концентрация хронического ингаляционного воздействия). Источником информации о значениях референтных концентраций является «Руководство по оценке риска для здоровья населения при воздействии химических веществ, загрязняющих среду обитания» Р 2.1.10.1920-04.
3.2.5. Численность населения, потенциально подверженного хронической многосредовой экспозиции нормируемого химического вещества в условиях населенных мест.
3.2.6. Информация по количественной зависимости «химическая структура - биологическая активность».
3.2.7. Физико-химические свойства вещества, определяющие особенности его поведения в окружающей среде:
- агрегатное состояние (при 20 °С, 760 мм рт. ст.);
- температура плавления, кипения;
- плотность;
- растворимость в воде, кислотах, биологических средах (крови);
- степень ионизации (электролитная диссоциация) молекул в заряженных катионах и анионах при конкретном pH (константа диссоциации - рКа), полярность.
3.2.8. Область применения.
3.2.9. Длительность персистирования в объектах окружающей среды, способность к межсредовым переходам и пространственному распространению.
3.2.10. Возможность комплексного поступления тяжелого вещества в организм человека из окружающей среды одновременно несколькими путями.
3.2.11. Биологическая роль в организме: эссенциальная, условно-эссенциальная, неустановленная роль, отсутствие биологической роли (ксенобиотик).
3.2.12. Сведения об опасности для здоровья человека:
- возможность острого и/или хронического воздействия;
- характер токсического действия (местное раздражающее, рефлекторное, рефлекторно-резорбтивное, резорбтивное);
- наличие специфических неканцерогенных токсических эффектов действия (раздражающего, сенсибилизирующего, нейротоксического, гематоксического, кардиоваскулярного, нефротоксического, гепатотоксического и т.д.) (прилож. 4);
- наличие одновременно нескольких токсических эффектов (системный эффект);
- особенности абсорбции (резорбции) вещества из места поступления в системный кровоток (в виде ионов, коллоидных частиц), коэффициент резорбции (kрез);
- особенности распределения в организме, проникновение через внутренние барьеры в организме (гематоэнцефалический, гематоплацентарный, гистогематический);
- способность к кумуляции в биологических средах.
3.2.13. Отнесение к отечественным и международным перечням приоритетных опасных и особо регулируемых химических веществ.
3.2.14. Существующие гигиенические нормативы содержания в объектах среды обитания, референтные уровни в биологических средах (крови).
Информация, необходимая для принятия решения об исключении химического вещества из перечня для разработки МДК в крови:
3.2.15. Низкая распространенность в среде обитания и низкая вероятность воздействия на человека: малый объем производства (до 1 т/год), выброса или сброса (менее 1 кг/год); моделируемые концентрации металлов, поступающих преимущественно с атмосферным воздухом, стабильно ниже 0,1RfCcr.
3.2.16. Концентрация в объектах среды обитания (атмосферный воздух, вода источников хозяйственно-питьевого водоснабжения, почва) ниже естественных фоновых уровней.
3.2.17. Исключительно эссенциальная роль в организме, и концентрация в объектах среды обитания находится в пределах рекомендуемого суточного потребления.
3.2.18. Доза/концентрация вещества при хроническом воздействии существенно ниже референтных (безопасных) уровней воздействия: величина коэффициента опасности (HQ) меньше 0,1; канцерогенный риск меньше 10-6.
3.2.19. Вещество идентифицируется в одной или двух средах, в незначительном числе проб (менее 5 %).
3.2.20. Малая численность населения, потенциально подверженного воздействию (менее 100 человек) в условиях населенных мест.
3.2.21. Специфические физико-химические свойства, исключающие поступление вещества в организм, резорбцию во внутренние среды и оказание токсического эффекта: высокая молекулярная масса (более 5000 Д) при отсутствии растворимости в воде, высокая степень разрушения (гидролиза) в объектах среды обитания.
3.2.22. Низкая устойчивость (персистентность) в объектах среды обитания (атмосферном воздухе, воде поверхностных водоемов, грунтовых водах, почве, донных отложениях - 1 - 3 суток).
3.2.23. Отсутствие общей и специфической токсичности, подозрений в отношении канцерогенности для человека.
3.2.24. Чрезвычайная опасность вещества, исключающая попадание в организм в силу запрета на национальном уровне на производство, использование, поступление в объекты среды обитания (атмосферный воздух, вода водных объектов централизованных источников хозяйственно-питьевого и культурно-бытового водопользования, почва, пищевые продукты).
3.3. Формирование выборки лиц для исследования
при установлении МДК химических веществ в крови
3.3.1. В исследование в качестве испытуемых включаются наиболее чувствительные к внешнесредовой экспозиции химических факторов субпопуляции населения, находящиеся под воздействием исследуемого химического вещества.
Наиболее чувствительной субпопуляцией является детский контингент, что обусловлено:
- анатомо-физиологическими особенностями органов и систем;
- несовершенством нейро-эндокринной регуляции в силу роста и развития центральной нервной и эндокринной систем;
- возрастными особенностями вентиляции легких, процессов всасывания в желудочно-кишечном тракте, проницаемости барьерных структур.
Выборка лиц для исследования (основная и контрольная группа) формируется специалистами (1 - 2 врачами и 1 - 2 медицинскими сестрами, входящими в состав исследовательской группы) организации, осуществляющей исследование.
3.3.2. Перечень критериев, в соответствии с которыми осуществляется отбор детей для исследования.
Биологические критерии:
- единая этническая и расовая принадлежность;
- возрастная группа - возраст 6 - 10 лет, как наиболее стабильный период развития детского организма;
- половой состав - лица обоего пола для исключения влияния анатомо-физиологических особенностей;
- весо-ростовые показатели не выходят за пределы ±15 % по весоростовому индексу Кетле;
- физиологическое течение беременности и родов у матери;
- отсутствие пренатальной гипотрофии плода, развития патологических перинатальных состояний;
- отсутствие отягощенного наследственного анамнеза у родственников 1-й и 2-й линии;
- отсутствие профессиональных вредностей у родственников 1-й линии в течение 3 лет, предшествовавших рождению ребенка;
- отсутствие девиантного поведения.
Гигиенические критерии:
- проживание и посещение детских дошкольных и школьных образовательных учреждений, расположенных в зоне экспозиции (расчетный индекс опасности (НI) больше 1) исследуемого химического вещества, поступающего в объекты окружающей среды;
- срок проживания в зоне экспозиции не менее 1 года;
- возможность формирования суммарной средней суточной дозы при хронической экспозиции одновременно из разных сред (учитываются транспортирующие среды, межсредовые переходы, все воздействующие среды) различными путями (пероральный, ингаляционный, накожный) одновременно;
- отсутствие зон электромагнитного, шумового, радиационного, биологического и других видов воздействия;
- удовлетворительная природно-геохимическая ситуация;
- отсутствие повышенной и пониженной гелионагрузки, умеренное воздействие климатических факторов.
Социально-бытовые критерии:
- соответствие жилищных условий действующим гигиеническим нормативам (площадь, воздушно-тепловой режим, коммунальные и санитарные условия, освещенность);
- средний уровень материальной обеспеченности относительно душевого прожиточного минимума;
- рациональный и сбалансированный режим питания;
- рациональная организация режима дня;
- соответствие условий в посещаемых ДДУ и ДОУ действующим санитарно-гигиеническим требованиям;
- отсутствие высокой специализированной учебной нагрузки (школы с углубленным предметным обучением, спортивные школы).
Специальные критерии:
- отсутствие очагов хронической инфекции;
- отсутствие острых инфекционных заболеваний не менее, чем в течение 4 недель до начала исследования;
- индекс инфекционности - 0,2 - 0,5;
- отсутствие приема лекарственных препаратов, оказывающих выраженное влияние на гемодинамику, функцию печени и др. (барбитураты, омепразол, циметидин и т.д.), менее чем за 30 дней до начала исследования.
3.3.3. Выборка детей для проведения сравнительного анализа (контрольная группа) осуществляется по критериям, представленным в п. 3.3.2.
Группы (основная и контрольная) должны быть сопоставимы по количеству, полу и возрасту.
3.3.4. Объем выборки для исследования.
Объем выборки для исследования устанавливается по принципу достаточности для обеспечения статистической значимости исследования.
Объем выборки рассчитывается, исходя из необходимого условия наличия зависимости между сравниваемыми признаками, а именно, достоверности коэффициента корреляции с заданным уровнем значимости α = 0,05.
Условие достоверности коэффициента корреляции определяется по формуле:
|
|
(1) |
N - объем выборки;
r - коэффициент корреляции;
tα - квантиль распределения Стьюдента порядка α.
В результате преобразования соотношение можно представить в следующем виде:
|
|
(2) |
При уровне значимости α = 0,05 квантиль распределения Стьюдента стремится к значению 1,96.
Задавая конкретное значение коэффициента корреляции по соотношению определяется минимальный объем выборки, позволяющий оценивать зависимость между анализируемыми показателями. Для оценки корреляционных зависимостей низкой степени выраженности (коэффициент корреляции не ниже 0,15) объем выборки должен включать не менее 169 исследуемых.
4. Специальная часть.
Алгоритм проведения исследований по установлению МДК
химических веществ в крови по критериям риска
для здоровья при многосредовой экспозиции
4.1. На первом этапе исследований определяется химическое вещество, подлежащее установлению МДК в крови детей. Для этого выполняется анализ данных, сформированных в соответствии с пп. 3.3.1 - 3.3.4.
4.2. На втором этапе осуществляется отбор детей, потенциально подверженных (основная группа) и неподверженных (контрольная группа) экспозиции исследуемого вещества (в соответствии с требованиями, представленными в разделе 3.4 настоящих методических рекомендаций) для изучения ответных реакций организма.
4.3. На третьем этапе осуществляется количественная оценка хронической экспозиции исследуемого вещества при поступлении в организм различными путями (пероральным, ингаляционным, накожным) в результате контакта с различными объектами внешней среды (вода, воздух, почва, продукты питания).
Оценка хронической экспозиции исследуемого вещества включает:
- идентификацию маршрутов воздействия, источников загрязнения, потенциальных путей распространения и точек воздействия;
- оценку воздействующих концентраций по результатам мониторинговых наблюдений качества объектов окружающей среды и/или результатов моделирования распространения исследуемого вещества. Оценивается среднегодовая концентрация (и ее верхние 95 %-е доверительные границы), установленная по среднесуточным концентрациям. Для расчета, как правило, используются данные 3-летних наблюдений, но не менее чем за 1 год;
- моделирование распространения исследуемого вещества в атмосферном воздухе в соответствии с п. 3.2.4;
- расчет поступления исследуемого вещества в организм при конкретных путях воздействия.
4.3.1. Расчет суммарной средней суточной дозы, усредненной на годовую экспозицию, при различных путях поступления (ингаляционном, пероральном с питьевой водой, продуктами питания) исследуемого вещества в организм осуществляется с помощью стандартных значений факторов экспозиции и конкретных значений массы тела и возраста детей, входящих в основную и контрольную группу. Расчет выполняется по формулам, представленным в «Руководстве по оценке риска для здоровья населения при воздействии химических веществ, загрязняющих среду обитания» Р 2.1.10.1920-04, прилож. 3 [1].
4.3.2. Проводится сравнительный анализ среднесуточных доз исследуемого вещества для детей основной и контрольной групп. При этом устанавливается вклад каждого пути поступления в суммарную среднюю суточную дозу, определяется ведущий путь поступления и приоритетная среда экспозиции, поражаемые органы и системы при каждом пути поступления и при комплексном поступлении одновременно несколькими путями.
4.4. На четвертом этапе исследований выполняется количественная оценка содержания исследуемого вещества в крови детей основной и контрольной групп в течение 1 года (4-кратное исследование - 1 раз в 3 месяца).
4.4.1. Порядок забора и хранения проб биологического материала (кровь) для исследования:
- забор крови осуществляется процедурной медицинской сестрой, входящей в исследовательскую группу (п. 1.10.4), в специально оборудованном, медицинском кабинете в соответствии с требованиями СП 1.3.2322-08 «Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней»;
- забор крови производится из локтевой вены (венозная) утром (натощак) в вакутейнер, содержащий антикоагулянт гепарин (зеленая крышка). Необходимо осторожно перемешать кровь с антикоагулянтом во избежание образования сгустков (не встряхивая). Проба маркируется с указанием идентификационного номера;
- объем крови, отобранной для количественной оценки содержания химического вещества, соответствует требованиям метода определения;
- пробы крови хранятся при температуре 0 - 4 °С в течение 3 - 5 суток, либо замораживаются (до -18 °С) и хранятся 10 - 20 дней.
4.4.2. Химико-аналитическое исследование проб крови проводится в соответствии с действующими нормативно-методическими документами, утвержденными органами государственного санитарно-эпидемиологического нормирования Российской Федерации:
- МУК 4.1.765-99 «Газохроматографический метод количественного определения ароматических (бензол, толуол, этилбензол, о-, м-, п-ксилол) углеводородов в биосредах (кровь)»;
- МУК 4.1.767-99 «Газохроматографический метод количественного определения ароматических аминосоединений (анилин, N-метиланилин, о-толуидин, N,N-диметиланилин, N-этиланилин, N,N-диэтиланилин) в биосредах (кровь)»;
- МУК 4.1.770-99 «Количественное определение формальдегида в крови методом высокоэффективной жидкостной хроматографии»;
- МУК 4.1.772-99 «Газохроматографическое определение концентраций метилового, этилового, изопропилового, пропилового, изобутилового и бутилового спиртов в крови»;
- МУК 4.1.777-99 «Определение содержания цинка, никеля, меди и хрома в крови методом атомной абсорбции»;
- МУК 4.1.2103-06 «Определение массовой концентрации ванадия в пробах крови методом атомно-адсорбционной спектрометрии с электротермической атомизацией»;
- МУК 4.1.2106-06 «Определение массовой концентрации марганца, свинца, магния в пробах крови методом атомно-адсорбционной спектрометрии»;
- МУК 4.1.2108-06 «Определение массовой концентрации фенола в биосредах (кровь) газохроматографическим методом»;
- МУК 4.1.2111-06 «Измерение массовой концентрации формальдегида, ацетальдегида, пропионового альдегида, масляного альдегида и ацетона в пробах крови методом высокоэффективной жидкостной хроматографии»;
- МУК 4.1.2112-06 «Определение массовой концентрации хлороформа, 1,2-дихлорэтана, тетрахлорметана, хлорбензола в биосредах (кровь) газохроматографическим методом»;
- МУК 4.1.2115-06 «Определение массовой концентрации хлороформа, 1,2-дихлорэтана, тетрахлорметана в биосредах (кровь) методом газохроматографического анализа равновесного пара»;
- МУК 4.1.2116-06 «Измерение массовой концентрации стирола в пробах крови методом высокоэффективной жидкостной хроматографии»;
- МУК 4.1.2106-06 «Определение массовой концентрации марганца, свинца, магния в пробах крови методом атомно-адсорбционной спектрометрии».
4.4.3. Полученная величина концентрации исследуемого вещества в крови (за исключением ксенобиотиков) детей основной и контрольной групп (М ± m) сопоставляется с референтной концентрацией, рекомендованной по результатам исследований ведущих отечественных и зарубежных центров [2]. Сравнение количественных величин в случае нормального распределения показателей проводится с использованием двухвыборочного критерия Стъюдента (t) с уровнем значимости 0,05.
Критерием адекватности выбора неэкспонированной группы детей (контрольной) является отсутствие достоверных различий концентрации исследуемого вещества в крови с референтным уровнем (или фоновым региональным уровнем в случае геохимически обусловленных территориальных особенностей содержания в объектах среды обитания).
Критерием адекватности выбора экспонированной группы детей (основной) является наличие достоверных различий средней концентрации исследуемого вещества в их крови и крови детей контрольной группы.
4.4.4. Информация о полученных значениях концентрации вещества в крови по каждому наблюдению (основной и контрольной группы) фиксируется в твердых копиях и на электронных носителях в виде информационной базы данных.
4.5. На пятом этапе проводится обоснование маркера экспозиции. Для обоснования маркера экспозиции должна быть установлена связь между экспозицией (средней годовой концентрацией вещества в приоритетной среде воздействия) и средней годовой концентрацией вещества в крови. Критерием обоснования маркера экспозиции является наличие достоверной связи с экспозицией.
Связь устанавливается методом математического моделирования зависимости концентрации анализируемого вещества в крови детей (основная и контрольная группа) от концентрации (или средней суточной дозы) при различных путях поступления в организм, в первую очередь, ведущем.
Математическая модель, описывающая анализируемую зависимость в условиях низких доз/концентраций, представляет собой линейное уравнение вида:
|
x = b1D + b0, где |
(3) |
D - средняя годовая концентрация (или доза) исследуемого вещества, мг/м3, мг/дм3 (или мг/(кг⋅день);
х - средняя годовая концентрация исследуемого вещества в крови, мг/дм3;
b0, b1 - параметры модели, характеризующие начальный уровень концентрации вещества в крови и скорость абсорбции.
Расчет параметров модели и проверку адекватности осуществляют стандартной процедурой линейного регрессионного анализа. Для проверки статистических гипотез относительно коэффициентов регрессии в случае нормального распределения показателей используется критерий Стьюдента. Проверка адекватности осуществляется при помощи дисперсионного анализа с использованием критерия Фишера с уровнем значимости 0,05.
При установлении адекватной модели, отражающей исследуемую зависимость, концентрация вещества в крови принимается в качестве маркера хронической экспозиции.
4.6. На шестом этапе проводится исследование и количественная оценка ответных реакций организма на хроническую экспозицию исследуемого химического вещества.
Ответные реакции организма на хроническую экспозицию исследуемого вещества могут быть выявлены в виде:
- повышенной заболеваемости поражаемых органов и систем экспонированной группы детей относительно неэкспонированной группы детей;
- отклонения гематологических, биохимических, иммунологических показателей относительно возрастной физиологической нормы и показателей контрольной группы.
Анализ заболеваемости проводится по данным обращаемости за медицинской помощью в поликлинику по месту проживания за период, предшествующий исследованию (не менее 1 года).
Перечень лабораторных тестов должен включать показатели, характеризующие специфические и неспецифические ответные реакции организма с учетом риска заболевания критических органов и систем при возможных путях поступления исследуемого вещества.
4.6.1. Исследование лабораторных показателей проводится с использованием современных методов. Примерный перечень ожидаемых видов нарушений здоровья, гематологических, биохимических, иммунологических показателей ответных реакций и методов их исследования в зависимости от фактора экспозиции и путей поступления, представлен в прилож. 5, 6.
4.6.2. Порядок забора, подготовки и хранения проб биологического материала (цельной крови, сыворотки крови, мочи, слюны, желчи) для лабораторного исследования.
4.6.2.1. Забор крови осуществляется процедурной медицинской сестрой в специально оборудованном медицинском кабинете в соответствии с требованиями СП 1.3.2322-08 «Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней». Забор крови производится из локтевой вены (венозная) утром (натощак) в вакутейнер, содержащий гепарин (зеленая крышка) для получения плазмы крови; в вакутейнер без антикоагулянта (сиреневая крышка) - для получения сыворотки крови. Необходимо осторожно перемешать кровь с антикоагулянтом во избежание образования сгустков (не встряхивая). Проба маркируется с указанием идентификационного номера. Пробы крови хранятся при температуре 0 - 4 °С в течение 3 - 5 суток либо замораживаются (до -18 °С) и хранятся 10 - 20 дней.
4.6.2.2. Порядок получения сыворотки крови.
После забора крови необходимо осторожно однократно перевернуть пробирку для более полного контакта крови с активатором свертывания. Процесс свертывания крови происходит в течение 20 - 30 мин или 7 - 10 мин для пробирок с оранжевой крышкой при комнатной температуре и вертикальном положении пробирки. После окончания свертывания крови центрифугировать пробирку со свернувшейся кровью не менее 10 мин с ускорением 1500 G (примерно 3000 об./мин) для максимального выдавливания сыворотки из сгустка. При необходимости допускается центрифугирование с ускорением 4000 G с крышечкой и до 1200 G без крышечки.
После центрифугирования и полной ретракции сгустка сыворотка располагается над сгустком, но в контакте с ним. Сохраняется опасность загрязнения сыворотки составляющими сгустка при неосторожном обращении с пробиркой (встряхивание, опрокидывание и пр.).
Для лучшего очищения сыворотки и более полного разграничения сыворотки и сгустка применяются специальные пробирки, содержащие биологически инертный олефиновый гель. Последний представляет собой тиксотропный кополимер, изменяющий свою вязкость в зависимости от приложенной к нему силы центрифугирования, поэтому после центрифугирования гель в виде тонкой полоски занимает промежуточное положение и служит разделительным барьером. Стабильность такого барьера гарантирована в течение 5 - 7 дней при хранении пробирки с кровью при комнатной температуре.
Оптимальный срок сохранности образца крови в данных пробирках составляет при комнатной температуре 6 ч, при хранении в условиях холодильника (4 °С) - 24 ч. Повторное центрифугирование пробирок, особенно с гелем, не допускается.
4.6.2.3. Сбор мочи осуществляется (утренняя порция) в контейнер для сбора мочи объемом не менее 50 см3. Проба маркируется с указанием идентификационного номера. Срок хранения в условиях холодильника (4 °С) 2 ч.
4.6.2.4. Сбор слюны осуществляется с помощью стерильного тампона, состоящего из абсорбирующего материала (хлопка), в стерильную сухую пробирку согласно ГОСТ Р 53079.4-08. Проба маркируется с указанием идентификационного номера. Пробы слюны хранятся в условиях морозильной камеры (замораживаются до -18 °С) до 20 - 30 дней.
4.6.2.5. Сбор желчи осуществляют при выполнении процедуры дуоденального зондирования. Желчь собирают в ряд пробирок в течение 5 мин. Для анализа исследуют порцию В и С. Пробы маркируются с указанием идентификационного номера.
4.6.3. Порядок проведения исследований, требования к квалификации персонала, оснащению средствами измерений и вспомогательным оборудованием, применяемые методики должны соответствовать требованиям нормативных правовых и методических документов по проведению лабораторных исследований у человека, утвержденных в установленном порядке, действующих на территории Российской Федерации.
4.6.4. Информация о полученных значениях исследованных лабораторных показателей ответных реакций у детей основной и контрольной групп фиксируется в твердых копиях и на электронных носителях в виде информационной базы данных.
4.6.5. Оценка отклонений показателей ответных реакций организма детей основной группы проводится при сравнительном анализе со значением показателя в контрольной группе; детей контрольной группы - с возрастной физиологической нормой. Сравнение количественных величин в случае нормального распределения показателей проводится с использованием двухвыборочного критерия Стъюдента (t) с уровнем значимости 0,05.
4.7. На седьмом этапе проводится обоснование маркеров эффекта при хроническом воздействии исследуемого химического вещества.
4.7.1. Обоснование маркеров эффекта проводится на основании установления и оценки зависимости вероятности отклонения исследуемых лабораторных показателей ответных реакций у детей основной группы относительно аналогичного показателя у детей контрольной группы от концентрации исследуемого вещества в крови.
4.7.2. Для установления данной зависимости необходимо последовательное выполнение следующих шагов.
Шаг 1. Формирование таблицы данных согласованных значений концентрации вещества в крови и лабораторного показателя ответных реакций для каждого наблюдения.
Шаг 2. Расчет вероятности отклонения лабораторного показателя от аналогичного показателя в контрольной группе в зависимости от концентрации вещества в крови.
Шаг 3. Оценка параметров математической модели.
Шаг 4. Экспертная оценка установленных зависимостей.
4.7.3. Формирование таблицы данных согласованных значений концентраций исследуемого вещества в крови и значений лабораторных показателей ответных реакций для каждого наблюдения (1 … n) производится по шаблону, представленному в табл. 1.
Шаблон таблицы согласованных данных по каждому наблюдению
|
Номер наблюдения |
Концентрация исследуемого вещества в крови |
Значение лабораторного показателя ответной реакции организма |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
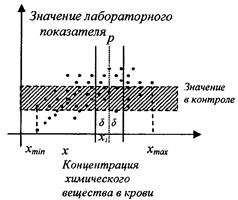
4.7.4. Расчет вероятности отклонения лабораторного показателя от показателя в контроле в зависимости от концентрации вещества в крови для каждого наблюдения в таблице данных проводится с использованием технологии «скользящего окна». Для этого для каждого значения концентрации исследуемого вещества в крови (хi) производится расчет вероятности отклонения лабораторного показателя от значения в контроле (pi), вычисленной для диапазона («скользящего окна»):
|
xi - δ < x ≤ xi + δ, где |
(4) |
δ - ширина «скользящего окна», которая определяется из соотношения:
|
|
(5) |
N - общее число исследований для всей совокупности.
Оценка вероятности отклонения лабораторного показателя от контроля производится по классической формуле вероятности:
|
|
(6) |
mi - число исследований по i-му лабораторному показателю, отклоняющихся от значения в контроле для диапазона xi - δ < x ≤ xi + δ;
ni - общее число исследований по i-му лабораторному показателю для диапазона xi - δ < x ≤ xi + δ.
Графическая иллюстрация процесса оценки вероятности отклонения лабораторного показателя от значения в контроле с использованием скользящего окна» представлена на рис. 1.
Рис. 1. Графическая иллюстрация технологии оценки
вероятности
отклонения лабораторного показателя от значения в контроле
4.7.5. Оценка параметров зависимости вероятности отклонения лабораторного показателя относительно контроля от концентрации исследуемого вещества в крови проводится методом построения логистической регрессионной модели:
|
|
(7) |
р - вероятность отклонения лабораторного показателя от значения в контроле;
х - концентрация исследуемого вещества в крови, мг/дм3;
b0, b1 - параметры математической модели.
Для построения модели из таблицы данных используется информация по концентрациям вещества в крови по каждому наблюдению и соответствующим им значениям вероятностей.
Определение параметров математической модели (b0, b1) производится методом наименьших квадратов с применением пакетов программ по статистическому анализу данных (Statistica, SPSS, SAS и др.).
4.7.6. Оценка обоснованности использования лабораторного показателя в качестве маркера эффекта при повышении концентрации исследуемого вещества в крови проводится на основании проверки адекватности модели наблюдаемым данным и экспертной оценки полученной зависимости. Оценка адекватности модели проводится на основе однофакторного дисперсионного анализа по критерию Фишера. При построении математических моделей осуществляется определение 95 %-х доверительных границ.
Лабораторный показатель будет являться маркером эффекта при воздействии маркера экспозиции при наличии установленной достоверно значимой зависимости (требование адекватности модели), величине коэффициента корреляции не меньше, чем 0,3 и положительной экспертной оценки полученной зависимости. На основании полученных зависимостей устанавливается перечень маркеров эффектов, который используется в дальнейшем для установления недействующих (реперных) уровней содержания вещества в крови.
4.8. На восьмом этапе проводится расчет реперных концентраций исследуемого вещества в крови для каждого маркера эффекта при хронической многосредовой экспозиции. Расчет реперной концентрации исследуемого вещества в крови детей включает последовательное выполнение следующих шагов:
Шаг 1. Формирование таблицы данных согласованных значений концентрации вещества в крови и маркеров эффекта для каждого наблюдения.
Формирование таблицы данных согласованных значений концентраций исследуемого вещества в крови и значений маркеров эффекта для каждого наблюдения (1 … n) производится по шаблону, представленному в табл. 2.
Шаблон таблицы согласованных данных по каждому наблюдению
|
Номер наблюдения |
Концентрация исследуемого вещества в крови |
Значение маркера эффекта |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
Шаг 2. Расчет показателя отношения шансов для каждой концентрации химического вещества в крови.
Показатель отношения шансов (OR) позволяет оценить наличие и силу связи между маркером экспозиции и маркером эффекта. В качестве критерия наличия связи принимается условие OR ≥ 1 [3]. Отношение шансов рассчитывается по стандартной формуле с использованием алгоритма, представленного в табл. 3:
|
ORm = а:b/(с:d) = ad/(bc), где |
(8) |
а - количество наблюдений с повышенным содержанием исследуемого химического вещества в крови и наличием отклонения лабораторного показателя от физиологической нормы (группа наблюдений);
b - количество наблюдений с повышенным содержанием исследуемого химического вещества в крови и отсутствием отклонения лабораторного показателя (группа наблюдений);
с - количество наблюдений с отсутствием повышенного содержания исследуемого химического вещества в крови и наличием отклонения лабораторного показателя от физиологической нормы (контрольная группа);
d - количество наблюдений с отсутствием повышенного содержания исследуемого химического вещества в крови и отсутствием отклонения лабораторного показателя (контрольная группа).
Алгоритм вычисления показателя отношения шансов
|
Концентрация вещества в крови относительно верхней границы допустимого уровня в крови |
Отклонение лабораторного показателя |
Сумма |
|
|
есть |
нет |
||
|
Есть повышенная концентрация в крови (группа наблюдения) |
а |
b |
а + b |
|
Нет повышенной концентрации в крови (контрольная группа) |
с |
d |
с + d |
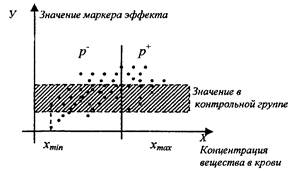
Для расчета показателя отношения шансов для каждого наблюдения в таблице данных производится условное деление выборки на две части: ниже текущего уровня концентрации исследуемого вещества в крови и выше текущего уровня концентрации исследуемого вещества в крови (хi) соответственно [xmin, хi] и [хi, хmax]. Для обоих интервалов рассчитывается величина, характеризующая вероятность отклонения маркера эффекта от значения в контроле (pi- и рi+ соответственно) как отношение числа наблюдений, отличающихся от контроля, к общему числу наблюдений. Схематично технология деления выборки на две части представлена на рис. 2.
Рис. 2. Схема представления выборочных данных из двух частей
Отношение шансов для каждой концентрации исследуемого вещества в крови определяется из соотношения:
|
|
(9) |
i - индекс, отражающий номер наблюдения.
Достоверность рассчитанного показателя отношения шансов оценивается по 95 %-му доверительному интервалу (DI), в пределах которого находится истинное значение показателя отношения шансов. Связь является достоверно установленной при нижней границе доверительного интервала больше 1 (единица - это критерий отсутствия различий между сравниваемыми группами).
Шаг 3. Построение модели зависимости показателя отношения шансов от концентрации исследуемого вещества в крови и оценка ее параметров.
Оценка параметров зависимости показателя отношения шансов от концентрации исследуемого вещества в крови проводится методом построения регрессионной модели в виде экспоненциальной функции:
|
|
(10) |
а0, a1 - параметры модели, определяемые методом регрессионного анализа.
Построение модели осуществляется на основании данных о концентрации исследуемого вещества в крови с годовым периодом осреднения и соответствующем значении отношения шансов отклонения маркера эффекта относительно значения показателя в контроле по каждому наблюдению.
Определение параметров математической модели (а0, a1) производится методом наименьших квадратов с применением пакетов программ по статистическому анализу данных (Statistica, SPSS, SAS и др.). Проверка адекватности модели осуществляется дисперсионным анализом с использованием критерия Фишера с уровнем значимости 0,05.
Шаг 4. Расчет реперного уровня содержания исследуемого вещества в крови.
Расчет реперной концентрации исследуемого вещества в крови (х0) для каждого маркера эффекта проводится исходя из условия OR = 1, по формуле:
|
|
(11) |
Оценка адекватности модели проводится на основе однофакторного дисперсионного анализа по критерию Фишера. При построении математических моделей осуществляется определение 95 %-х доверительных границ точечных оценок реперных концентраций исследуемого вещества в крови. При этом в качестве реперной концентрации исследуемого вещества в крови принимается значение верхней 95 %-й доверительной границы дом каждого маркера эффекта.
Для определения максимально допустимой концентрации исследуемого вещества в крови детей используется принцип «лимитирующего показателя», то есть из имеющегося ряда 95 %-х верхних доверительных границ реперных среднегодовых концентраций вещества в крови для каждого маркера эффекта определяется наименьшая, которая рекомендуется в качестве максимально допустимой концентрации для условий многосредовой хронической экспозиции:
|
|
(12) |
х0j - значение максимально допустимого уровня содержания исследуемого вещества в крови (мг/дм3) по отношению к j-му маркеру эффекта.
Данная концентрация может быть рекомендована в качестве максимально допустимой концентрации химического вещества в крови при многосредовой хронической экспозиции.
Библиографические данные
1. Р 2.1.10.1920-04 «Руководство по оценке риска для здоровья населения при воздействии химических веществ, загрязняющих среду обитания».
2. Клиническое руководство по лабораторным тестам/Под ред. проф. Норберта У. Тица/Перевод с англ.; Под ред. В.В. Меньшикова. М.: ЮНИМЕД-пресс, 2003. 960 с.
3. Флетчер Р., Флетчер С., Вагнер Э. Клиническая эпидемиология. Основы доказательной медицины. М.: Медиа Сфера, 1998. 352 с.
Приложение 1
(справочное)
Список использованных сокращений
Rfccr - референтная концентрация для хронического ингаляционного воздействия, мг/м3
GLP - надлежащая лабораторная практика Таможенного союза
НЭК - независимый этический комитет
МДК - максимально допустимая концентрация
СанПиН - санитарно-эпидемиологические правила и нормативы
ФСВОК - федеральная система внешней оценки качества
ГИС - геоинформационная система
ПДВ - предельно допустимый выброс
ОНД - основной нормативный документ
МКБ-10 - международная классификация болезней 10-го пересмотра
Приложение 2
Список нормативных правовых и методических документов
- Федеральный закон от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
- Федеральный закон от 26.06.2008 № 102-ФЗ «Об обеспечении единства измерений».
- Федеральный закон от 27.12.2002 № 184-ФЗ «О техническом регулировании».
- Постановление Правительства Российской Федерации от 30.06.2004 № 322 (с изменениями) «Об утверждении Положения о Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека».
- Постановление Правительства Российской Федерации от 2.02.2006 № 60 «Об утверждении Положения о проведении социально-гигиенического мониторинга».
- Постановление Главного государственного санитарного врача Российской Федерации от 10.11.1997 № 25 и Главного государственного инспектора Российской Федерации по охране природы от 10.11.1997 № 03-19/24-3483 «Об использовании методологии оценки риска для управления качеством окружающей среды и здоровьем населения в Российской Федерации».
- Приказ Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 19.07.2007 № 224 «О санитарно-эпидемиологических экспертизах, обследованиях, исследованиях, испытаниях и токсикологических, гигиенических и иных видах оценок» (зарегистрирован Минюстом России 20.07.2007 № 9866).
Приложение 3
|
Я _______________________________________________________________________ (фамилия, имя, отчество - полностью) года рождения, проживающий(ая) по адресу: ____________________________________ Паспорт: (серия, номер) _________________, выдан: ______________________________ являюсь законным представителем (мать, отец, усыновитель, опекун, попечитель) ребенка: ___________________________________________________________________ (Ф., И., O. ребенка полностью, год рождения) Я, согласно моей воли, информирован (информирована) о целях, характере и возможных неблагоприятных эффектах проводимых процедур, возможности непреднамеренного причинения вреда здоровью, а также о том, что предстоит представляемому делать во время их проведения. Я имел возможность обсудить с врачом-исследователем все интересующие меня вопросы и получил удовлетворяющие меня ответы. Добровольно даю свое согласие на проведение представляемому, в соответствии с планом исследований, необходимых диагностических процедур: анализа крови общего, биохимического и иммунологического, прицельного химико-аналитического исследования крови, биохимического анализа мочи. Необходимость других методов обследования будет мне разъяснена дополнительно. Я добровольно соглашаюсь на участие представляемого в исследовании по обоснованию ПДК химических веществ в крови, извещен, что имею право отказаться или в любой момент прекратить участие представляемого в данном исследовании. В случае моего решения о прекращении участия представляемого в исследовании я обязуюсь информировать об этом врача-исследователя для того, чтобы предоставить ему возможность оценить состояние представляемого и дать необходимые рекомендации. Я согласен (согласна) выполнять инструкции, добросовестно сотрудничать с врачом-исследователем и немедленно сообщать ему о любого рода изменениях здоровья представляемого. Я извещен (извещена), что информация, полученная в ходе исследования, является конфиденциальной. Я согласен (согласна) с тем, чтобы она использовалась в полной мере и передавалась в регуляторные органы и официальные медицинские инстанции. Я ознакомлен (ознакомлена) и согласен (согласна) со всеми пунктами настоящего документа, положения которого мне разъяснены, мною поняты и добровольно даю свое согласие на обследование и оказание медицинской помощи при необходимости в предложенном объеме. «__» _____________ 20__ года. Подпись пациента/законного представителя ___________________________________ Расписался в моем присутствии: Врач ___________________________________ (подпись) Должность, Ф., И., О. ________________________________________________________ |
Приложение 4
(справочное)
|
№ 1 |
Металл |
Путь поступления |
Поражаемые органы и системы |
Токсический эффект |
|
1 |
2 |
3 |
4 |
5 |
|
1 |
Свинец |
Ингаляционный Пероральный |
ЦНС, вегетативная нервная система |
- нарушение скорости проведения нервных импульсов через синапсы, замедление деятельности холинэргических рецепторов мозга в результате накопления свинца в сером веществе и базальных ганглиях |
|
Система крови, красный костный мозг |
- угнетение костно-мозгового кроветворения; - нарушение биосинтеза порфиринов и гема на стадии включения железа в порфириновое кольцо |
|||
|
Эндокринная система |
- повышение глюкокортикоидной и понижение минералокортикоидной функции коры надпочечников; - прямое цитотоксическое действие на тиреоциты щитовидной железы; - нарушение регуляторной функции гипоталамо-гипофизарной системы и системы «гипофиз - щитовидная железа», обусловленное торможением выработки тиролиберина в гипоталамусе либо тиреотропина - в гипофизе; - нарушение функции инкреторного аппарата поджелудочной железы; - нарушение регуляторной функции в системе «гипофиз-гонады» |
|||
|
Костная система |
- угнетение процесса ремоделирования, что приводит к деминерализации костной ткани в результате конкурентного взаимодействия свинца и кальция, и детерминированное свинцом нарушение метаболизма витамина D |
|||
|
Ингаляционный |
Почки |
- образование внутриядерных включений в почечных канальцах |
||
|
Сердечно-сосудистая система |
- нарушение электропроводимости миокарда |
|||
|
Иммунная система |
- супрессия функции иммунокомпетентных клеток; - дисбаланс цитокинов, подавление антителогенеза (IgM и IgG) |
|||
|
Пероральный |
Желудочно-кишечный тракт |
- нарушение секреторной и резорбтивной функции желудка и двенадцатиперстной кишки в результате угнетения гуморальных регуляторных механизмов, обеспечивающих секрецию бикарбонатов и соляной кислоты; - снижения всасывания ксилозы в кишечнике; - нарушение инкреторной функции поджелудочной железы (снижение секреции инсулина) |
||
|
2 |
Марганец |
Ингаляционный Пероральный |
ЦНС, вегетативная нервная система |
- нарушает синаптическую проводимость; - изменяет активность ферментов нервных клеток-моноаминоксидаз |
|
Эндокринная система |
- прямое цитотоксическое действие на тиреоциты щитовидной железы; - нарушение регуляции синтеза ДГЭАС корой надпочечников |
|||
|
Желудочно-кишечный тракт |
- нарушение секреторной функции желудка |
|||
|
Ингаляционный |
Органы дыхания |
- сенсибилизация |
||
|
Пероральный |
Система крови |
- угнетение костно-мозгового кроветворения |
||
|
Костная система |
- угнетение биосинтеза и минерализации костей вследствие активации щелочной фосфатазы и угнетения процессов резорбции; - избыточная оссификация метафизарных отделов, увеличение размеров костных трабекул |
|||
|
Почки |
- нарушение канальцевой реабсорбции и секреции |
|||
|
3 |
Хром (VI) |
Ингаляционный |
Органы дыхания |
- сенсибилизация |
|
Пероральный |
Желудочно-кишечный тракт |
- цитотоксическое действие на гепатоциты, эпителиоциты желудка и двенадцатиперстной кишки; - угнетение кислотообразующей функции при незначительном изменении пепсинообразования, моторной функций желудка |
||
|
Ингаляционный Пероральный |
Эндокринная система |
- струмогенный эффект с усилением гормонообразовательной функции и увеличением массы щитовидной железы; - нарушение обмена йода вследствие блокирования тирозинйодиназы и Т4-монодейодиназы |
||
|
4 |
Никель |
Ингаляционный |
Органы дыхания |
- сенсибилизация; - замедление двигательной активности ресничек мерцательных клеток респираторного эпителия; - угнетение лизоцимсинтетической функции трахеобронхиальными слизистыми железами и альвеолярными макрофагами |
|
Иммунная система |
- супрессия ЕК-активности и Т-клеточного ответа |
|||
|
Ингаляционный Пероральный |
Система крови |
- угнетение костно-мозгового кроветворения |
||
|
Эндокринная система |
- нарушение гормональной активности щитовидной железы вследствие замещения цинка в металлоферментах, необходимых для синтеза трийодтиронина; - цитотоксическое повреждение тиреоцитов щитовидной железы |
|||
|
Пероральный |
Печень |
- угнетение синтеза РНК, ДНК, белоксинтетической функции печени |
||
|
Сердечно-сосудистая система |
- кардиовазотоксический эффект |
|||
|
Желудочно-кишечный тракт |
- цитотоксическое действие на эпителиоциты ворсин ЖКТ |
|||
|
5 |
Кобальт |
Ингаляционный |
Органы дыхания |
- воспалительный процесс в легких |
|
Сердечно-сосудистая система |
- нарушение метаболизма миокарда, вазотоксический эффект |
|||
|
Пероральный |
Система крови |
- угнетение костно-мозгового кроветворения |
||
|
Эндокринная система |
- нарушение каталитических процессов в щитовидной железе в результате блокирования тирозиниодиназы, поглощения и окисления неорганического йода; - нарушение инкреторной функции поджелудочной железы |
|||
|
6 |
Медь |
Ингаляционный |
Органы дыхания |
- воспалительный процесс в бронхах |
|
Сердечно-сосудистая система |
- кардиовазотоксическое действие |
|||
|
ЦНС |
- угнетение процесса миелинизации нервных волокон |
|||
|
Пероральный |
Печень |
- снижение белоксинтезирующей функции печени |
||
|
Ингаляционный Пероральный |
Система крови |
- угнетение костномозгового кроветворения, так как происходит вакуолизация эритроидных и миелоидных клеток костного мозга; - снижение осмотической резистентности эритроцитов, всасывания железа |
||
|
7 |
Кадмий |
Ингаляционный Пероральный |
Почки |
- дисфункция почечных канальцев и клубочков с замедлением канальцевой реабсорбции |
|
Эндокринная система |
- увеличение кортиколибериновой активности гипоталомических экстрактов в системе «гипофизкора надпочечников» |
|||
|
Ингаляционный |
Органы дыхания |
- сенсибилизация |
||
|
Сердечно-сосудистая система |
- нарушение гемодинамики |
|||
|
Костная система |
- активация процесса резорбции костной ткани вследствие нарушения метаболизма Са2+ и фосфоинозитидного обмена ионизированной формой (Cd2+) |
|||
|
Иммунная система |
- супрессия клеточного и гуморального звена иммунитета клеток в результате функционального антагонизма с цинком, оказывающим стимулирующее действие |
|||
|
8 |
Ванадий |
Ингаляционный |
Органы дыхания |
- сенсибилизация |
|
Сердечно-сосудистая система |
- кардиовазотоксический эффект |
|||
|
Система крови |
- супрессия гемопоэза |
|||
|
Пероральный |
Печень |
- снижение белоксинтезирующей функции печени |
||
|
Почки |
- дисфункция почечных канальцев и канальцевой реабсорбции |
|||
|
9 |
Бензол |
Ингаляционный Пероральный |
Система крови, красный костный мозг |
- угнетение костно-мозгового кроветворения - цитопения |
|
ЦНС |
- нейродистрофический эффект |
|||
|
Пероральный |
Эндокринная система |
- нарушение регуляторной функции гипоталамо-гипофизарной системы |
||
|
Ингаляционный |
Иммунная система |
- супрессия клеточного звена иммунитета (Т-клеточная и В-клеточная лимфопения, снижение фагоцитарной активности) |
||
|
Сердечно-сосудистая система |
- кардиовазотоксический эффект; - нейродистрофические изменения миокарда |
|||
|
Система репродукции |
- нарушение менструальной функции, бесплодие |
|||
|
16 |
Формальдегид |
Ингаляционный |
Органы дыхания |
- сенсибилизирующий эффект |
|
Орган зрения (глаза) |
- раздражение слизистой оболочки, нарушение функции сетчатки и зрительных бугров |
|||
|
Иммунная система |
- антигенная стимуляция, образование специфических антител (IgM, IgG, IgE) к формальдегиду, увеличение содержания Т-клеток памяти |
|||
|
Пероральный |
Желудочно-кишечный тракт |
- цитотоксический эффект на слизистую желудка и ДПК |
||
|
Печень |
- нарушение белоксинтезирующей функции |
|||
|
Почки |
- нарушение экскреторной функции |
Приложение 5
|
Химический фактор |
Путь поступления |
Поражаемые и органы и системы |
Ожидаемые виды нарушений здоровья |
Код по МКБ-10 |
Лабораторные показатели ответных реакций организма |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Марганец, хром+6, ванадий, бериллий, никель, кобальт |
Ингаляционный |
Органы дыхания |
Болезни органов дыхания, в том числе: |
X. |
- иммуноглобулин Е специфический к марганцу в сыворотке крови; - иммуноглобулин Е специфический к хрому в сыворотке крови; - иммуноглобулин Е специфический к никелю в сыворотке крови; - иммуноглобулин Е специфический к кобальту в сыворотке крови; - иммуноглобулин G специфический к ванадию в сыворотке крови; - иммуноглобулин Е общий в сыворотке крови; - эозинофильно-лимфоцитарный индекс крови; - эозинофилы (абсолютное число) в крови; - лейкоформула, СОЭ в крови |
|
- аллергический ринит неуточненный; |
J30.4 |
||||
|
- хронический ринит, назофарингит и фарингит; |
J31 |
||||
|
- хронические болезни миндалин и аденоидов, в том числе: |
J35 |
||||
|
- гипертрофия миндалин; |
J35.1 |
||||
|
- гипертрофия аденоидов; |
J35.2 |
||||
|
- хронический ларинготрахеит; |
J37.1 |
||||
|
- болезнь верхних дыхательных путей неуточненная; |
J38.9 |
||||
|
- другая уточненная хроническая обструктивная легочная болезнь; |
J44.8 |
||||
|
- бронхиальная астма с преобладанием аллергического компонента |
J45.0 |
||||
|
Цинк, медь, мышьяк, кадмий |
Ингаляционный |
Органы дыхания |
Болезни органов дыхания, в том числе: |
X. |
- лейкоциты, нейтрофилы, моноциты, лимфоциты, СОЭ в крови; - популяции и субпопуляции лимфоцитов (CD3+, CD4+, CD8+, CD16+, CD 19+, CD56+) в крови; - иммуноглобулины А, М, G в сыворотке крови; - фагоцитарная активность нейтрофилов в крови |
|
- хронический ринит, назофарингит и фарингит; |
J31 |
||||
|
- хронические болезни миндалин и аденоидов; |
J35 |
||||
|
- хронический ларинготрахеит; |
J37.1 |
||||
|
- болезнь верхних дыхательных путей неуточненная; |
J38.9 |
||||
|
- бронхит, не уточненный как острый или хронический; |
J40 |
||||
|
- простой хронический бронхит; - хронический бронхит неутомленный |
J41 |
||||
|
J42 |
|||||
|
Никель, хром, медь, ванадий |
Пероральный |
Печень |
Болезни органов пищеварения, в том числе: |
XI. |
- альбумин, α-, β-, γ-глобулины, С-реактивный белок в сыворотке крови; - холестерин, липопротеиды высокой (ЛПВП) и низкой (ЛПНП) плотности, триглицериды в сыворотке крови; - АЛТ, ACT, ЛДГ3, γ-глутаминтрансфераза, цитохром Р450, щелочная фосфатаза в сыворотке крови; - малоновый диальдегид, гидроперекиси липидов, альфафетопротеин в сыворотке крови; - общая антиоксидантная активность, супероксиддисмутаза, глутатионпероксидаза в сыворотке крови |
|
- токсическое поражение печени с холестазом; |
К71 |
||||
|
- печеночная недостаточность; |
К72 |
||||
|
- хронический гепатит; |
К73 |
||||
|
- фиброз и цирроз печени; |
К74 |
||||
|
- другие воспалительные болезни печени; |
К75 |
||||
|
- другие болезни печени |
К76 |
||||
|
Медь, никель, бериллий, мышьяк, ванадий, |
Пероральный |
Желудочно-кишечный тракт |
Болезни органов пищеварения, в том числе: |
XI. |
- секреторный иммуноглобулин А в слюне; - щелочная фосфатаза в сыворотке крови; - С-реактивный белок в желудочном соке; - дифениламиновая проба в желудочном соке; - малоновый диальдегид в желудочном соке, сыворотке крови; - гидроперекиси липидов в сыворотке крови; - общая антиоксидантная активность плазмы крови; - лейкоформула, плазматические клетки в крови |
|
- хронический гастрит; |
К29.5 |
||||
|
- дуоденит; |
К29.8 |
||||
|
- гастродуоденит неуточненный; |
К29.9 |
||||
|
- диспепсия; |
К30 |
||||
|
- другие уточненные болезни желчевыводящих путей; |
К83.8 |
||||
|
- болезнь желчевыводящих путей неуточненная |
К83.9 |
||||
|
Марганец, алюминий, свинец, ртуть, мышьяк |
Пероральный |
ЦНС |
Болезни нервной системы, в том числе: |
VI. |
кортизол, адреналин в сыворотке крови; ацетилхолин в сыворотке крови; ТТГ в сыворотке крови; калий, натрий в сыворотке крови, калий/натриевый коэффициент |
|
- астено-невротический синдром; |
R45.0 |
||||
|
- недомогание и утомляемость; |
R53 |
||||
|
- полиневропатия, вызванная другими токсичными веществами; |
G62.2 |
||||
|
- полиневропатия неуточненная; |
G62.9 |
||||
|
- неврозоподобный синдром; |
G93.8 |
||||
|
- токсическая энцефалопатия |
G92 |
||||
|
Свинец, никель |
Ингаляционный |
Система крови, кроветворения |
Болезни крови, кроветворных органов в том числе: |
III. |
- гемоглобин, эритроциты, гематокрит, ретикулоциты в крови; - среднее содержание гемоглобина в эритроците, средний объем эритроцита в крови; - железо, общая и неполная железосвязывающая способность сыворотки крови; - ферритин, трансферрин в сыворотке крови; - копропорфирин, дельта-аминолевулиновая кислота в моче |
|
- другие железодефицитные анемии; |
D50.8 |
||||
|
- другие железодефицитные анемии неуточненные; |
D50.9 |
||||
|
- апластическая анемия, вызванная другими внешними агентами; |
D61.2 |
||||
|
- другие уточненные анемии; |
D64.8 |
||||
|
- анемия неуточненная |
D64.9 |
||||
|
Свинец, ртуть |
Пероральный |
Эндокринная система |
Болезни эндокринной системы, в том числе: |
IV. |
- ТТГ, Т4своб, антитела к тиреопероксидазе, тиреоглобулину в сыворотке крови; - йод в моче |
|
- болезни щитовидной железы, связанные с йодной недостаточностью, и сходные состояния; |
Е01 |
||||
|
- субклинический гипотиреоз вследствие йодной недостаточности; |
Е02 |
||||
|
- другие формы гипотиреоза; |
Е03 |
||||
|
- нетоксический зоб |
Е04.9 |
||||
|
Свинец, хром+6, марганец, кадмий |
Ингаляционный |
Эндокринная система |
Болезни эндокринной системы, в том числе: |
IV. |
- общий белок, глюкоза в сыворотке крови; - холестерин общий, липопротеиды ЛПВП, ЛПНП в сыворотке крови; - ТТГ, Т4своб, а/т к тиреопероксидазе, а/т к тиреоглобулину в сыворотке крови; - йод в моче; - СТГ в сыворотке крови |
|
- белково-энергетическая недостаточность; |
Е46.0 |
||||
|
- избыток массы тела; |
Е67.8 |
||||
|
- низкорослость; |
Е34.3 |
||||
|
- высокорослость; |
Е34.4 |
||||
|
- болезни щитовидной железы, связанные с йодной недостаточностью, и сходные состояния; |
Е01 |
||||
|
- субклинический гипотиреоз вследствие йодной недостаточности; |
Е02 |
||||
|
- другие формы гипотиреоза; |
Е03 |
||||
|
- нетоксический зоб неуточненный |
Е04.9 |
||||
|
Мышьяк, никель |
Ингаляционный |
Сердечно-сосудистая система |
Болезни системы кровообращения, в том числе: |
IX. |
- ЛДГ4-5 в сыворотке крови; - калий, натрий в сыворотке крови, калий/натрий коэффициент; - кортизол в сыворотке крови; - гидроперекиси липидов, малоновый диальдегид, супероксиддисмутаза, глутатионпероксидаза в сыворотке крови |
|
- болезни, характеризующиеся повышенным кровяным давлением; |
110-15 |
||||
|
- сердечно-сосудистая болезнь неуточненная; |
151.6 |
||||
|
- кардиодистрофия; |
151.0 |
||||
|
- болезнь сердца неуточненная |
151.9 |
||||
|
Свинец, ртуть, кадмий, ванадий, молибден |
Пероральный |
Мочевыводящая система |
Болезни мочеполовой системы, в том числе: |
XIV. |
- гидроперекиси липидов в сыворотке крови; - креатинин, мочевина в сыворотке крови; - общий белок, альбумин, α-, β-, γ-глобулины в сыворотке крови; - креатинин в моче; - бета-2-микроглобулин в сыворотке крови; - почечный эпителий в моче; - удельный вес, лейкоциты, белок, эритроциты в моче |
|
- хронический нефротический синдром; |
N03 |
||||
|
- нефротический синдром неуточненный; |
N05 |
||||
|
- болезни почки и мочеточника неуточненные; |
N28.9 |
||||
|
- хронический пиелонефрит |
N11.9 |
||||
|
Никель, ванадий |
Ингаляционный |
Орган зрения (глаза) |
Болезни глаза и его придаточного аппарата, в том числе: |
VII. |
- эозинофилы в соскобе с конъюнктивы; - иммуноглобулин Е общий в сыворотке крови |
|
- хронический конъюнктивит; |
Н10.4 |
||||
|
- склерит; |
Н15 |
||||
|
- кератит |
Н16 |
||||
|
Формальдегид, ацетальдегид |
Ингаляционный |
Органы дыхания |
Болезни органов дыхания, в том числе: |
X. |
- формальдегидстимулированные цитокины ИЛ-4, 6, 10; - иммуноглобулин Е, G специфический к формальдегиду в сыворотке крови |
|
- бронхиальная астма с преобладанием аллергического компонента |
J45.0 |
||||
|
Толуол, ксилол, фенол, фториды неорганические |
Ингаляционный |
Органы дыхания |
Болезни органов дыхания, в том числе: |
X. |
- лейкоциты, нейтрофилы, моноциты, лимфоциты, СОЭ в крови; - популяции и субпопуляции лимфоцитов (CD3+, CD4+, CD8+, CD16+, CD19+, CD56+) в крови; - иммуноглобулины А, М, G; - фагоцитарная активность нейтрофилов в крови |
|
- хронический ринит, назофарингит и фарингит; |
J31 |
||||
|
- хронические болезни миндалин и аденоидов; |
J35 |
||||
|
- хронический ларинготрахеит; |
J37.1 |
||||
|
- болезнь верхних дыхательных путей неуточненная |
J38.9 |
||||
|
Этилбензол, толуол, ксилол, стирол |
Пероральный |
Печень |
Болезни органов пищеварения, в том числе: |
XI. |
- альбумин, α-, β-, γ-глобулины, С-реактивный белок в сыворотке крови; - холестерин, липопротеиды высокой (ЛПВП) и низкой (ЛПНП) плотности, триглицериды в сыворотка крови; - АЛТ, ACT, ЛДГ3, γ-глутаминтрансфераза, цитохром Р450, щелочная фосфатаза в сыворотке крови; - малоновый диальдегид, гидроперекиси липидов, альфафетопротеин в сыворотке крови; - общая антиоксидантная активность, супероксиддисмутаза, глутатионпероксидаза в сыворотке крови |
|
- токсическое поражение печени с холестазом; |
К71 |
||||
|
- печеночная недостаточность; |
К72 |
||||
|
- хронический гепатит; |
К73 |
||||
|
- фиброз и цирроз печени; |
К74 |
||||
|
- другие воспалительные болезни печени; |
К75 |
||||
|
- другие болезни печени |
К76 |
||||
|
Хлороформ, 1,2-дихлорэтан, тетрахлорметан, хлорбензол |
Ингаляционный Пероральный |
Печень |
Болезни органов пищеварения, в том числе: |
XI. |
- альбумин, α-, β-, γ-глобулины, С-реактивный белок в сыворотке крови; - холестерин, липопротеиды высокой (ЛПВП) и низкой (ЛПНП) плотности, - триглицериды в сыворотка крови; - АЛТ, ACT, ЛДГ3, γ-глутаминтрансфераза, цитохром Р450, щелочная фосфатаза в сыворотке крови; - малоновый диальдегид, гидроперекиси липидов в сыворотке крови; - общая антиоксидантная активность, су- пероксиддисмутаза, глутатионпероксидаза в сыворотке крови |
|
- токсическое поражение печени с холестазом; |
К71 |
||||
|
- печеночная недостаточность; |
К72 |
||||
|
- хронический гепатит; |
К73 |
||||
|
- фиброз и цирроз печени; |
К74 |
||||
|
- другие воспалительные болезни печени; |
К75 |
Приложение 6
Методы исследования лабораторных показателей
ответных реакций организма
|
Показатель |
Принцип метода |
Тип метода |
|
1 |
2 |
3 |
|
Биохимические показатели |
||
|
Сыворотка крови |
||
|
Общий белок |
Унифицированный метод по биуретовой реакции |
Фотометрический |
|
Альбумин |
Унифицированный метод по реакции с бромкрезоловым зеленым |
Фотометрический |
|
Глюкоза |
Глюкозооксидазный метод |
Ферментативный колориметрический |
|
Холестерин общий |
Реакция ферментативного гидролиза |
Ферментативный колориметрический |
|
Белковые фракции (альбумин, α-, β-, γ-глобулин) |
Реакция фракционирования на основе зарядов белков |
Агарозный гель-электрофорез |
|
Липопротеиды ЛПВП |
Реакция ферментативного гидролиза с использованием холестеролоксидазы |
Ферментативный колориметрический |
|
Липопротеиды ЛПНП |
Реакция ферментативного гидролиза с использованием холестериноксидазы |
Ферментативный колориметрический |
|
Триглицериды |
Реакция ферментативного гидролиза с использованием холестериноксидазы |
Ферментативный колориметрический |
|
Билирубин общий |
Унифицированный метод по реакции с диазотированной сульфаниловой кислотой |
Фотометрический |
|
Билирубин прямой |
Унифицированный метод по реакции с диазотированной сульфаниловой кислотой |
Фотометрический |
|
Кальций общий |
Унифицированный метод по цветной реакции с о-крезолфталеинкомплексоном |
Фотоколориметрический |
|
Аланинаминотрансфераза |
Унифицированный метод по реакции с НАД-Н |
Кинетический фотометрический |
|
Аспартатаминотрансфераза |
Унифицированный метод по реакции с НАД-Н |
Кинетический фотометрический |
|
Щелочная фосфатаза |
Унифицированный метод по реакции гидролиза n-нитрофенилфосфата |
Кинетический фотометрический |
|
Мочевина |
Уреазный метод по реакции с фенолгипохлоритом |
Ферментативный колориметрический |
|
Креатинин |
Унифицированный метод по цветной реакции Яффе |
Фотометрический |
|
С-реактивный белок |
Реакция иммунопреципитации |
Турбидиметрия |
|
Трансферрин |
Реакция с антителами к трансферрину |
Иммунотурбидиметрия |
|
Железо сывороточное |
Цветная реакция с Ференом S |
Фотометрический |
|
Общая железосвязывающая способность |
Цветная реакция с Ференом S после удаления избытка солей железа |
Фотометрический |
|
Малоновый диальдегид |
Реакция с тиобарбитуровой кислотой |
Фотометрический |
|
Общая антиоксидантная активность |
Реакция е тиобарбитуровой кислотой |
Фотометрический |
|
Хлориды |
Унифицированный меркуриметрический метод |
Фотометрический |
|
Фосфор |
Унифицированный метод по реакции восстановления фосфорномолибденовой гетерополикислоты |
Фотометрический |
|
Желчь |
||
|
С-реактивный белок |
С-реактивный белок |
С-реактивный белок |
|
Дифениламиновая проба |
Дифениламиновая проба |
Дифениламиновая проба |
|
Цельная кровь |
||
|
Калий |
Метод потенциометрии |
Ион селективный |
|
Натрий |
Метод потенциометрии |
Ион селективный |
|
Кальций ионизированный |
Метод потенциометрии |
Ион селективный |
|
Моча |
||
|
Дельта-аминолевулиновая кислота |
Унифицированный метод по реакции n-диметиламинобензальдегидом |
Фотометрический |
|
Йод |
Церий-арсенитовый метод |
Фотометрический |
|
Иммуноферментные показатели |
||
|
Сыворотка крови |
||
|
Кортизол |
Твёрдофазный анализ |
Фотометрический |
|
ТТГ |
Твёрдофазный анализ |
Фотометрический |
|
Антитела к ТПО |
Твёрдофазный анализ |
Фотометрический |
|
Тироксин свободный |
Твёрдофазный анализ |
Фотометрический |
|
Карцино-эмбриональный антиген |
Твёрдофазный анализ |
Фотометрический |
|
Гидроперекиси липидов |
Твердофазный «сэндвич» иммуноферментный анализ |
Фотометрический |
|
Глутатионпероксидаза |
Твёрдофазный «сэндвич» иммуноферментный анализ |
Фотометрический |
|
Супероксидцисмутаза |
Твёрдофазный «сэндвич» иммуноферментный анализ |
Фотометрический |
|
Паратгормон |
Твёрдофазный анализ |
Фотометрический |
|
Ферритин |
Твёрдофазный анализ |
Фотометрический |
|
β-2-микроглобулин |
Твёрдофазный анализ |
Фотометрический |
|
Иммунологические показатели |
||
|
Плазма крови |
||
|
Т-лимфоциты |
Проточная цитометрия |
Иммунофлюоресценции |
|
В-лимфоциты |
Проточная цитометрия |
Иммунофлюоресценции |
|
Фагоцитарное число |
Реакция поглотительной способности фагоцитов |
Световая микроскопия |
|
Фагоцитарный индекс |
Реакция поглотительной способности фагоцитов |
Световая микроскопия |
|
Абсолютный фагоцитоз |
Реакция поглотительной способности фагоцитов |
Световая микроскопия |
|
Сыворотка крови |
||
|
Иммуноглобулины А, М, G, Е общий |
Твёрдофазный иммуноферментный анализ |
Фотометрический |
|
Иммуноглобулин Е специфический к промышленным аллергенам |
Аллергосорбентный тест |
Фотометрический |
|
Слюна |
||
|
Секреторный иммуноглобулин А |
Твёрдофазный иммуноферментный анализ |
Фотометрический |
|
Гематологические показатели |
||
|
Цельная кровь |
||
|
Гемоглобин (Нb) |
Реакция лизиса эритроцитов и образования цианидсодержащего пигмента |
Фотометрический |
|
Эритроциты (RBC) |
Метод Культера подсчета количества и размера клеток |
Импедансометрический |
|
Гематокрит (Ht) |
Расчетный Ht = RBC×MCV |
- |
|
Среднее содержание гемоглобина в эритроците (МСН) |
Расчетный МСН = Hb/RBC×10 |
- |
|
Средняя концентрация гемоглобина в эритроците (МСНС) |
Расчетный МСНС = Hb/Ht×100 |
- |
|
Средний объем одного эритроцита (MCV) |
Расчетный MCV = Ht×10/RBC |
- |
|
Лейкоциты, эозинофилы, нейтрофилы, лимфоциты, моноциты, плазматические клетки, базофилы |
Метод Культера (импедансометрии) подсчета количества и размера клеток |
Импедансометрический |
|
Ретикулоциты |
Унифицированный метод подсчета после окраски с бриллиантовым крезиловым синим |
Световая микроскопия |
|
Эозинофильно-лимфоцитарный индекс (ЭЛИ) |
Расчетный ЭЛИ = отн. число эозинофилов/отн. число лимфоцитов |
|
|
Скорость оседания эритроцитов |
Унифицированный микрометод Панченкова |
- |
|
Длительность кровотечения |
Унифицированная реакция по Дуке |
- |
|
Свертываемость крови |
- |
- |
Приложение 7
Примерный перечень измерительного и вспомогательного
оборудования, материалов и реактивов
1. Измерительные приборы и вспомогательное оборудование
|
Весы лабораторные общего назначения |
|
|
pH-метр лабораторный, погрешность измерения ±0,05рН или аналогичный |
|
|
Цитофлюориметр - лазерный с возможностью одновременной детекции 4 различных флюорохромов или аналогичный |
|
|
Анализатор гематологический |
|
|
Анализатор лабораторный иммунологический |
|
|
Центрифуга лабораторная со скоростью вращения ротора до 3000 об/мин для пробирок вместимостью 15 см3 |
|
|
Встряхиватель вибрационный типа вортекс со скоростью вращения до 30 об./мин |
|
|
Шейкер планшетный термостатируемый |
|
|
Термостат-встряхиватель |
|
|
Холодильник лабораторный с морозильной камерой от 2 - 14 до -26 - 30 °С |
|
|
Облучатель-рециркулятор медицинский бактерицидный ОБН-150 или аналогичный |
|
|
Аппарат для получения деионизированной воды |
ОСТ 11-029.003-80 |
|
Дистиллятор |
|
|
Шкаф сушильный |
|
|
Микроскоп лабораторный |
|
|
Регулируемые автоматические дозаторы 1-канальные (10 - 100, 100 - 1000, 500 - 5000 мкл), погрешность ±1 мкл |
|
|
Регулируемые автоматические дозаторы 8-канальные (5 - 50, 50 - 300 мкл), погрешность ±1 мкл |
|
|
Автоматический биохимический анализатор |
|
|
Автоматический аппликатор |
|
|
Насос для работы с пластиковыми и стеклянными пипетками |
|
|
Пипетка стеклянная к СОЭ-метру ПС/СОЭ-01 |
|
|
Фотоэлектроколориметр |
|
|
Плитка электрическая |
|
|
Термостат электрический суховоздушный, поддерживающий рабочую температуру 28 - 45 °С с отклонением от заданной на 1 °С |
ТУ 64-1-1382-83 |
|
Анализатор электролитов крови |
|
2. Материалы и реактивы
2.1. Лабораторная посуда и вспомогательные материалы
|
Пробирки стеклянные круглодонные химические П 1-14-120 |
|
|
Пробирки пластиковые с делениями и винтовой крышкой объемом 15 см3 |
|
|
Пробирки пластиковые конические объемом 10 см3 |
|
|
Стеклянные стаканы химические объемом 50, 500 см3 |
|
|
Пипетки стеклянные объемом 10 см3 |
|
|
Воронки стеклянные диаметром 55 мм |
|
|
Лабораторные штативы |
ТУ 64-1-2669-73 |
|
Колбы плоскодонные конические объемом 50, 250 см3 |
|
|
Пробирки стеклянные центрифужные конические |
|
|
Микроцентрифужные пробирки (объемом 1,5 см3) |
|
|
Наконечники пластиковые объемом 10 - 300, 200 - 1000, 1000 - 5000 мкл |
|
|
Перчатки резиновые |
|
|
Фильтры бумажные, диаметр 15 см |
|
|
Пробирки пластиковые 0,5 см3 |
|
|
Мультиячеистые кюветы, пластиковые |
|
|
Пробирки вакуумные пластиковые с EDTA K 3 объемом 2, 5 см3 |
|
|
Пробирки вакуумные пластиковые Improve без коагулянта объемом 9 см3 |
|
|
Пробирки вакуумные пластиковые объемом 4 м3 |
|
|
Контейнер для сбора биологического материала с завинчивающейся крышкой объемом 100 см3 |
|
|
Капилляры |
ТУ 9398-014-076-09-129-203 |
2.2. Реактивы
2.2.1. Тест-системы для биохимического анализа
для определения показателей в сыворотке крови
|
Общий белок, альбумин |
|
|
Общий холестерин, липопротеиды высокой и низкой плотности |
|
|
Глюкоза |
|
|
Общий кальций, ионизированный кальций, фосфор |
|
|
АЛАТ, АСАТ, γ-глутатионтрансаминаза, щелочная фосфатаза |
|
|
Креатинин, мочевина |
|
|
Железо, общая железосвязывающая способность |
|
|
Хлориды |
|
|
Общий и прямой билирубин |
|
|
С-реактивный белок |
|
|
Трансферрин |
|
|
Ферритин |
|
2.2.2.
Тест-системы для ИФА
для определения показателей в сыворотке крови
|
Супероксиддисмутаза, глутатионпероксидаза, гидроперекиси липидов |
|
2.2.3.
Тест-системы для ИФА
для определения показателей в сыворотке крови
|
ТТГ, Т4 свободный |
|
|
Кортизол |
|
|
Карциноэмбриональный антиген |
|
|
Иммуноглобулин Е общий, иммуноглобулин Е специфический к марганцу, иммуноглобулин Е (или G) специфический к промышленным аллергенам (марганцу, хрому, никелю, ванадию и др.) |
|
2.2.4. Химические реактивы
|
Тиобарбитуровая кислота, чда |
|
|
Натрий фосфорно-кислый однозамещенный, чда |
|
|
Натрия гидроокись, чда |
|
|
Уксусная кислота ледяная, хч |
|
|
Натрия ацетат трехводный, чда |
|
|
п-Диметиламинобензальдегид, чда |
ТУ 6-09-3272-77 |
|
Хлорная кислота, хч |
ТУ 6-09-2878-84 |
|
Уголь активный, древесный |
|
|
Ацетилацетон, ч |
|
|
Железо серно-кислое, чда |
|
|
Трихлоруксусная кислота, ч |
|
|
ТРИС-буфер |
|
|
5-аминолевулиновой кислоты гидрохлорид, ч |
|
|
Дифениламин, чда |
ГОСТ 5825-70 |
|
Натрий лимонно-кислый, чда |
|
|
Серная кислота, хч |
|
|
Фиксатор |
|
|
Изотонический разбавитель, промывающий раствор |
|
|
Лизирующий раствор для гемоглобина, лейкоцитов |
|
|
Раствор бриллиантового крезилового синего для окраски ретикулоцитов |
|
|
Масло иммерсионное терпеновое |
|
|
Набор реактивов для иммунофенотипирования |
|
|
Т- и В-лимфоцитов (CD3, CD4, CD19) |
|
|
Набор реактивов «Сыворотки диагностические моноспецифические против иммуноглобулинов человека A, М, G, сухие» |
|
|
Формалинизированные эритроциты барана |
|
|
Фильтры обеззоленные |
|
|
Стандартный образец состава раствора ионов марганца (2+), хрома (6+), никеля (2+), свинца (2+) |
|