Государственное санитарно-эпидемиологическое
нормирование
Российской Федерации
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение
остаточных количеств
пестицидов в сельскохозяйственном
сырье, пищевых продуктах и
объектах окружающей среды
Сборник
методических указаний
по методам контроля
МУК
4.1.2907-11; 4.1.2923 - 4.1.2925-11;
4.1.2938-11
Москва • 2011
1. Разработаны сотрудниками ГНУ Всероссийского НИИ защиты растений Россельхозакадемии.
2. Рекомендованы к утверждению Комиссией по санитарно-эпидемиологическому нормированию Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 2.06.2011 № 1).
3. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 12 июля 2011 г.
4. Введены в действие с момента утверждения.
5. Введены впервые.
СОДЕРЖАНИЕ
|
|
УТВЕРЖДАЮ Руководитель
Федеральной службы Г.Г. Онищенко 12 июля 2011 г. Дата введения: с момента утверждения |
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение остаточных количеств имидаклоприда
в моркови, луке, горохе, зерне и соломе риса, зерне и
масле сои, ягодах и соке винограда методом
высокоэффективной жидкостной хроматографии
Методические указания
МУК 4.1.2923-11
Настоящий документ устанавливает методику измерения массовых концентраций имидаклоприда в моркови, луке, зерне гороха, зерне риса и сои, ягодах и соке винограда в диапазоне концентраций 0,01 - 0,1 мг/кг, в масле сои в диапазоне 0,02 - 0,2 мг/кг, в соломе риса в диапазоне 0,04 - 0,4 мг/кг.
Действующее вещество: имидаклоприд.
Структурная формула:
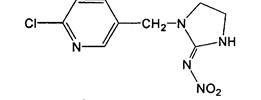
1-(6-хлор-3-пиридилметил)-N-нитроимидазолидин-2-илиденамин (IUPAC)
1-[(6-хлор-3-пиридинил)метил]-N-нитро-2-имидазолидинимин (СА)
Брутто формула: C9H10ClN5O2.
Мол. масса: 255,7.
Химически чистый имидаклоприд представляет собой бесцветные кристаллы со слабым характерным запахом. Температура плавления 144 °С, давление паров 4×10-7 мРа (20 °С), 9×10-7 мРа (25 °С). Коэффициент распределения в системе н-октанол-вода Kow lgP = 0,57 (21 °С). Растворимость (г/дм3) при 20 °С: в воде - 0,61; дихлорметане - 55; изопропаноле - 1,2; толуоле - 0,68; н-гексане < 0,1. Стабилен к гидролизу при рН 5 - 11.
Острая пероральная токсичность LD50 для крыс - 450 мг/кг. Острая дермальная токсичность (24 ч) для крыс LD50 > 5000 мг/кг. Не ирритант для кожи и глаз (кролики). Острая ингаляционная токсичность LC50 (4 ч) для крыс > 5323 мг/м3, 69 мг/м3 воздуха (аэрозоль). LC50 (96 ч) для рыб - 211 (237) мг/дм3. Группа токсичности по ЕРА и ВОЗ - II. Мутагенной и тератогенной активности в стандартных тестах не обнаружено.
Область применения: имидаклоприд - системный инсектицид и инсекто-протравитель группы неоникотиноидов. Эффективно уничтожает листовую тлю, белокрылку, минеров, трипсов, колорадского жука, долгоносиков на хлопчатнике, рисе, картофеле, кукурузе, сахарной свекле, овощных культурах, цитрусовых, косточковых и семечковых плодовых в течение вегетационного периода. Может использоваться для обработки, как почвы, так и надземных органов растений.
В России гигиенические нормативы для имидаклоприда в моркови, луке, зерне гороха, зерне риса, зерне и масле сои, ягодах и соке винограда не установлены.
1. Метрологическая характеристика метода
При соблюдении всех регламентированных условий проведения анализа в точном соответствии с данной методикой погрешность (и ее составляющие) результатов измерений при доверительной вероятности Р = 0,95 не превышает значений, приведенных в табл. 1, для соответствующих диапазонов концентраций.
Метрологические параметры
|
Диапазон измерений, массовая концентрация, мг/кг |
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости), σr, % |
Показатель промежуточной прецизионности (относительное среднеквадратическое отклонение в условиях вариации факторов «время», «оператор» в одной лаборатории), σRл, % |
Показатель воспроизводимости (относительное среднеквадратическое отклонение воспроизводимости), σR, % |
Показатель точности* (границы относительной погрешности при вероятности Р = 0,95), ±δ, % |
|
1 |
2 |
3 |
4 |
5 |
|
Виноград ягоды от 0,01 до 0,1 вкл. |
7 |
9 |
11 |
22 |
|
Виноград сок от 0,01 до 0,1 вкл. |
6 |
7 |
9 |
18 |
|
Лук от 0,01 до 0,1 вкл. |
6 |
7 |
9 |
17 |
|
Морковь корнеплоды от 0,01 до 0,1 вкл. |
5 |
7 |
8 |
16 |
|
Зерно гороха от 0,01 до 0,1 вкл. |
6 |
7 |
9 |
17 |
|
Зерно риса от 0,01 до 0,1 вкл. |
5 |
7 |
8 |
16 |
|
Солома риса от 0,04 до 0,4 вкл. |
6 |
7 |
9 |
17 |
|
Зерно сои от 0,04 до 0,4 вкл. |
6 |
7 |
9 |
18 |
|
Масло сои от 0,02 до 0,2 вкл. |
6,5 |
8 |
8 |
15 |
|
* Соответствует расширенной неопределенности Uотн при коэффициенте охвата k = 2 |
||||
Полнота извлечения вещества, стандартное отклонение, доверительный интервал среднего результата для n = 20, Р = 0,95
|
Объект анализа |
Предел обнаружения, мг/кг |
Диапазон измеряемых концентраций, мг/кг |
Среднее значение определения, % |
Стандартное отклонение S, % |
Доверительный интервал среднего результата, ± % |
|
Виноград ягоды |
0,01 |
0,01 - 0,1 |
88,9 |
9,24 |
3,77 |
|
Виноград сок |
0,01 |
0,01 - 0,1 |
90,4 |
5,01 |
2,05 |
|
Лук |
0,01 |
0,01 - 0,1 |
89,8 |
3,97 |
1,62 |
|
Морковь корнеплоды |
0,01 |
0,01 - 0,1 |
84,1 |
2,16 |
0,88 |
|
Зерно гороха |
0,01 |
0,01 - 0,1 |
92,6 |
3,25 |
1,33 |
|
Зерно риса |
0,01 |
0,01 - 0,1 |
95,4 |
2,24 |
0,91 |
|
Солома риса |
0,04 |
0,04 - 0,4 |
88,3 |
3,55 |
1,45 |
|
Зерно сои |
0,01 |
0,01 - 0,1 |
91,7 |
4,90 |
2,00 |
|
Масло сои |
0,02 |
0,02 - 0,2 |
88,7 |
1,75 |
0,72 |
2. Метод измерения
Методика основана на определении имидаклоприда методом ВЭЖХ с использованием УФ-детектора после его жидкостной экстракции из твердых образцов, масла сои и виноградного сока с последующей очисткой экстрактов на концентрирующих патронах, заполненных силикагелем.
Идентификация имидаклоприда проводится по времени удерживания, количественное определение методом абсолютной калибровки.
Избирательность метода обеспечивается сочетанием условий подготовки проб и хроматографирования.
3. Средства измерений, реактивы, вспомогательные устройства и материалы
3.1. Средства измерений
|
Жидкостный хроматограф «Альянс» фирмы «Waters» с УФ-детектором (Waters 2487) с дегазатором и автоматическим пробоотборником |
|
|
Весы аналитические BЛA-200 |
|
|
Колбы мерные на 25, 50, 100 и 1000 см3 |
|
|
Микродозаторы Ленпипет переменного объема от 200 до 1000 мм3 и от 1 до 5 см3, вид климатического исполнения УХЛЧ.2 |
|
|
Пипетки градуированные объемом 1, 2, 5 и 10 см3 |
|
|
рН-метр универсальный ЭВ-74 |
ГОСТ 22261-76 |
|
Цилиндры мерные на 50, 100, 500 и 1000 см3 |
ГОСТ 1774-74 |
Допускается использование средств измерения с аналогичными или лучшими характеристиками.
3.2. Реактивы
|
Ацетон, осч |
ТУ 6-09-3513-86 |
|
Ацетонитрил для ВЭЖХ, сорт 1 или хч |
ТУ 6-09-3534-87 |
|
Вода дистиллированная, деионизированная, бидистиллированная |
ГОСТ 6709-79 |
|
Изопропиловый спирт |
ТУ 2632-015-11291058-95 |
|
Имидаклоприд, аналитический стандарт с содержанием д.в. 99,9 % (Sigma-Aldrich) |
|
|
Метилен хлористый |
ТУ 2631-019-44493179-98 |
|
н-Гексан, хч, свежеперегнанный |
ТУ 2631-003-05807999-98 |
|
Натрия гидроксид, хч |
|
|
Натрий сернокислый безводный, ч, свежепрокаленный |
|
|
Этиловый эфир уксусной кислоты, чда |
Допускается использование реактивов квалификацией не ниже указанных.
3.3. Вспомогательные устройства и материалы
|
Аналитическая колонка Symmetry С18 или Sun Fire С18 (250×4,6) мм, 5 мкм (Waters, USA) |
|
|
Бидистиллятор |
|
|
Ванна ультразвуковая УЗВ-1.3 |
|
|
Воронки делительные объемом 250 и 500 см3 |
|
|
Воронки лабораторные В-75-110 |
|
|
Гомогенизатор |
МРТУ 42-1505-63 |
|
Колбы плоскодонные на шлифах КШ 250 29/32 ТС |
|
|
Колбы-концентраторы емкостью 100 и 250 см3 |
|
|
Мельница ножевая РМ-120 и лабораторная зерновая ЛМЗ |
ТУ 1 -01 -0593-79 |
|
Насос водоструйный |
ГОСТ 10696-75 |
|
Патроны концентрирующие Диапак силикагель (Биохиммак) 0,4 г |
|
|
Предколонка Waters SunFire C18 (20×4,6) мм, 5 мкм (Waters, USA) |
|
|
Ротационный испаритель вакуумный Buchi R-205 (Швейцария) |
|
|
Стаканы химические объемом 100,200 и 500 см3 |
|
|
Фильтры бумажные «красная лента» |
ТУ 6.091678-86 |
Допускается использование другого вспомогательного оборудования с техническими характеристиками не хуже указанных.
4. Требования безопасности
4.1. При проведении работы необходимо соблюдать требования техники безопасности, установленные для работ с токсичными, едкими, легковоспламеняющимися веществами (ГОСТ 12.1.005, 12.1.007). Организация обучения работников безопасности труда по ГОСТ 12.0.004.
При выполнении измерений с использованием жидкостного хроматографа и работе с электроустановками соблюдать правила электробезопасности в соответствии с ГОСТ 12.1.019-79 и инструкциями по эксплуатации приборов.
4.2. Помещение лаборатории должно быть оборудовано приточно-вытяжной вентиляцией, соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91 и иметь средства пожаротушения по ГОСТ 12.4.009. Содержание вредных веществ в воздухе не должно превышать норм, установленных ГН 2.2.5.1313-03 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны».
5. Требования к квалификации операторов
Измерения в соответствии с настоящей методикой может выполнять специалист-химик, имеющий опыт работы методом высокоэффективной жидкостной хроматографии, ознакомленный с руководством по эксплуатации хроматографа, освоивший данную методику и подтвердивший экспериментально соответствие получаемых результатов нормативам контроля погрешности измерений по п. 13.
6. Условия измерений
При выполнении измерений выполняют следующие условия:
• процессы приготовления растворов и подготовки проб к анализу проводят при температуре воздуха (20 ± 5) °С и относительной влажности не более 80 %;
• выполнение измерений на жидкостном хроматографе проводят в условиях, рекомендованных технической документацией к прибору.
7. Подготовка к определению
7.1. Кондиционирование колонки
Перед началом анализа колонку (Symmetry С-18) кондиционируют в потоке подвижной фазы (1 см3/мин) до стабилизации нулевой линии в течение 1 - 2 ч.
7.2. Приготовление растворов
7.2.1. Приготовление 50 %-го раствора ацетона: в мерную колбу емкостью 1 л помещают 500 мл ацетона и доводят объем до метки дистиллированной водой.
7.2.2. Приготовление 1 М раствора NaOH: 40 г едкого натра помещают в мерную колбу емкостью 1000 см3, растворяют при перемешивании в 600 см3 дистиллированной воды и доводят объем раствора до метки.
7.2.3. Приготовление 0,025 М раствора NaOH: 25 см3 1 М раствора едкого натра помещают в мерную колбу емкостью 1000 см3 и доводят объем раствора до метки дистиллированной водой.
7.2.4. Приготовление подвижной фазы: в мерную колбу вместимостью 1 дм3 помещают 200 см3 ацетонитрила и доводят объем до метки водой для ВЭЖХ.
7.2.5. Приготовление элюента № 1: в колбе на 1000 см3 смешивают 600 см3 н-гексана и 400 см3 этилацетата.
7.3. Приготовление основного и градуировочных растворов
7.3.1. Основной раствор с концентрацией 0,1 мг/см3: точную навеску имидаклоприда (50 ± 0,1) мг помещают в мерную колбу вместимостью 100 см3, растворяют в ацетонитриле и доводят до метки тем же растворителем.
7.3.2. Градуировочные растворы с концентрациями 0,1, 0,2, 0,5, 1,0 и 2,0 мкг/см3 готовят методом последовательного разбавления по объему, используя раствор подвижной фазы.
Основной раствор можно хранить в холодильнике при температуре 0 - 4 °С в течение 1 недели, градуировочные растворы - в течение суток.
При изучении полноты определения для внесения в матрицу используют ацетонитрильные растворы имидаклоприда с концентрациями 1,0 и 10,0 мкг/см3, которые готовят из основного стандартного раствора с концентрацией 0,1 мг/см3 методом последовательного разбавления ацетонитрилом.
Растворы для внесения в масло готовят из стандартного раствора с концентрацией 0,1 мг/см3 методом последовательного разбавления по объему изопропиловым спиртом.
7.4. Построение градуировочного графика
Для установления градуировочной характеристики (площадь пика - концентрация имидаклоприда в растворе) в хроматограф вводят по 20 мм3 градуировочных растворов (не менее 3 параллельных измерений для каждой концентрации, не менее 4 точек по диапазону измеряемых концентраций). Затем измеряют площади пиков и строят график зависимости среднего значения площади пика от концентрации имидаклоприда в градуировочном растворе.
Методом наименьших квадратов рассчитывают градуировочный коэффициент (K) в уравнении линейной регрессии:
С = KS, где
S - площадь пика градуировочного раствора.
Градуировку признают удовлетворительной, если значение коэффициента линейной корреляции оказывается не ниже 0,99.
Градуировочную характеристику необходимо проверять при замене реактивов, хроматографической колонки или элементов хроматографической системы, а также при отрицательном результате контроля градуировочного коэффициента.
Градуировочную зависимость признают стабильной при выполнении следующего условия:
![]()
где С - аттестованное значение массовой концентрации имидаклоприда в градуировочном растворе;
СК - результат контрольного измерения массовой концентрации имидаклоприда в градуировочном растворе;
λконтр. - норматив контроля градуировочного коэффициента, % (λконтр. = 10 % при Р = 0,95).
7.5. Подготовка концентрирующего патрона Диапак-силикагель для очистки экстракта
Концентрирующий патрон Диапак-силикагель промывают 5 см3 гексана со скоростью потока не более 2 см3/мин.
8. Отбор проб и хранение
Отбор проб моркови производится в соответствии с ГОСТ 1721-85 «Морковь столовая свежая заготовляемая и поставляемая»; отбор проб лука - по ГОСТ 1723-86 «Лук репчатый свежий, заготовляемый и поставляемый» и ГОСТ 27166-86 «Лук репчатый свежий реализуемый»; отбор проб гороха - по ГОСТ 28674-90 «Горох. Требования по заготовке и поставке»; отбор проб риса - по ГОСТ 6293-90 «Требования при заготовке и поставках»; отбор проб сои - по ГОСТ 10852-86. «Семена масличные. Правила приемки и методы отбора проб»; отбор проб винограда - по ГОСТ 25896-83 «Виноград свежий столовый. Технические условия».
Для длительного хранения аналитические пробы моркови, лука и ягод винограда помещают в морозильную камеру с температурой -18 °С и хранят в закрытой полиэтиленовой таре. Пробы виноградного сока хранят до анализа в морозильной камере при температуре не выше -18 °С в течение месяца, в холодильнике при температуре 0 - 4 °С в стеклянной таре с притертой пробкой в течение недели.
Пробы зерна риса, сои, гороха подсушивают до стандартной влажности и хранят в закрытой стеклянной или полиэтиленовой таре при комнатной температуре. Сухие образцы могут храниться в течение года. Перед анализом пробы зерна доводят до стандартной влажности и измельчают. Пробы соевого масла хранят в холодильнике при 0 - 4 °С в закрытой стеклянной таре не более 2 месяцев.
9. Проведение определения
Навеску, массой (20 ± 0,1) г измельченных проб растительного происхождения (лук, морковь, ягоды, зерно) или (5 ± 0,05) г соломы риса помещают в коническую колбу емкостью 100 мл и экстрагируют имидаклоприд 50 см3 50 %-го водного ацетона на ультразвуковой установке в течение 15 мин. Суспензию фильтруют через бумажный фильтр «красная лента». Экстракцию повторяют еще 40 см3 50 %-го водного ацетона. Объединенные экстракты упаривают на роторном испарителе при температуре 40 °С до водного остатка.
Водный остаток доводят до объема 100 см3 дистиллированной водой. Пробу помещают в делительную воронку емкостью 500 см3 и промывают 30 см3 гексана, встряхивая смесь в течение 1 - 2 мин (верхний органический слой отбрасывают). Водную фазу экстрагируют трижды хлористым метиленом порциями по 30 см3, встряхивая смесь каждый раз в течение 2 - 3 мин и собирая нижний органический слой. Объединенный органический экстракт промывают в делительной воронке 25 см3 0,025 М раствора NaOH, встряхивая смесь в течение 1 - 2 мин и собирая нижний органический слой. Полученный экстракт пропускают через слой безводного сульфата натрия (2 г), осушитель промывают 10 - 15 см3 хлористого метилена. После этого экстракт выпаривают досуха на ротационном испарителе при температуре не выше 40 °С. Дальнейшую очистку экстракта проводят на патроне по п. 9.4.
9.2. Определение имидаклоприда в соке винограда
Перед проведением анализа пробу сока массой (20 ± 0,1) г доводят до объема 100 см3 дистиллированной водой. Пробу помещают в делительную воронку емкостью 500 см3 и промывают 30 см3 гексана, встряхивая смесь в течение 1 - 2 мин (верхний органический слой отбрасывают). Водную фазу экстрагируют трижды хлористым метиленом порциями по 30 см3, встряхивая смесь каждый раз в течение 2 - 3 мин и собирая нижний органический слой. Объединенный хлористометиленовый экстракт пропускают через слой безводного сульфата натрия (2 г), осушитель промывают 10 - 15 см3 хлористого метилена. После этого объединенный экстракт выпаривают досуха на ротационном испарителе при температуре не выше 40 °С. Дальнейшую очистку экстракта проводят на патроне по п. 9.4.
9.3. Определение имидаклоприда в зерне и масле сои
Навеску измельченного зерна массой (20 ± 0,1) г помещают в коническую колбу емкостью 100 см3 и экстрагируют имидаклоприд 40 см3 ацетонитрила на ультразвуковой установке в течение 15 мин. Суспензию фильтруют через бумажный фильтр «красная лента». Экстракцию повторяют дважды порциями по 30 см3.
Навеску масла массой (10 ± 0,1) г помещают в делительную воронку емкостью 250 см3 и экстрагируют имидаклоприд трижды ацетонитрилом порциями по 30 см3, встряхивая смесь каждый раз в течение 2 - 3 мин и собирая нижний органический слой.
Объединенные экстракты семян или масла промывают гексаном в делительных воронках дважды по 25 см3, встряхивая смесь каждый раз в течение 1 - 2 мин и собирая нижний органический слой.
После этого экстракты выпаривают досуха на ротационном испарителе при температуре не выше 40 °С. Дальнейшую очистку экстрактов проводят на патроне по п. 9.4.
9.4. Очистка на концентрирующем патроне Диапак-силикагель
Сухой остаток в колбе, полученный при упаривании очищенных по п.п. 9.1 - 9.3 экстрактов растительных материалов количественно переносят двумя порциями смеси гексан - этилацетат (60:40, по объему) по 2 см3 каждая в подготовленный концентрирующий патрон Диапак-силикагель (п. 7.5). Промывают патрон 5 см3 элюента № 1, который отбрасывают. Имидаклоприд элюируют с 10 см3 этилацетата со скоростью 2 см3/мин. Полученный раствор выпаривают досуха на вакуумном ротационном испарителе при температуре не выше 40 °С. Сухой остаток растворяют в 2 см3 подвижной фазы для ВЭЖХ и 20 мм3 раствора вводят в жидкостный хроматограф.
9.5. Условия хроматографирования
Жидкостный хроматограф «Альянс» фирмы «Waters» с УФ-детектором (Waters 2487), снабженный дегазатором, автоматическим пробоотборником и термостатом колонки. Аналитическая колонка Symmetry С18 или Sun Fire C18 (250×4,6) мм, 5 мкм (Waters, USA). Предколонка SunFire С18 (250×4,6) мм, 5 мкм (Waters, USA) для защиты аналитической колонки. Температура колонки (30 ± 1) °С. Подвижная фаза: ацетонитрил-вода в объемном соотношении 20:80. Скорость потока элюента: 1 см3/мин. Рабочая длина волны 268 нм. Объем вводимой пробы 20 мм3. Время удерживания имидаклоприда (12,0 ± 0,2) мин. Линейный диапазон детектирования 0,1 - 2,0 мкг/см3.
10. Обработка результатов анализа
Количественное определение проводят методом абсолютной калибровки. Содержание имидаклоприда X (мг/кг) вычисляют по формуле:
![]()
где Sx - площадь пика имидаклоприда на хроматограмме испытуемого образца, (AU∙с);
K - градуировочный коэффициент, найденный на стадии построения соответствующей градуировочной зависимости;
V - объем пробы, подготовленной для хроматографического анализа, см3;
Р - навеска анализируемого образца, г;
f - полнота извлечения имидаклоприда, приведенная в табл. 2, (%).
Содержание остаточных количеств имидаклоприда в образце вычисляют как среднее из двух параллельных определений.
Образцы, дающие пики большие, чем стандартный раствор имидаклоприда с концентрацией 1,0 мкг/см3, разбавляют подвижной фазой для ВЭЖХ.
11. Проверка приемлемости результатов параллельных определений
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, расхождение между которыми не превышает предела повторяемости (1):
![]()
где X1 и Х2 - результаты параллельных определений, мг/кг (мг/дм3);
r - значение предела повторяемости (r = 2,8σr).
При невыполнении условия (1) выясняют причины превышения предела повторяемости, устраняют их и вновь выполняют анализ.
12. Оформление результатов
Результат анализа представляют в виде:
(Х ± Δ) при вероятности Р = 0,95, где
X - среднее арифметическое результатов определений, признанных приемлемыми, мг/кг (мг/дм3);
Δ - граница абсолютной погрешности, мг/кг (мг/дм3).
![]()
где δ - граница относительной погрешности методики (показатель точности в соответствии с диапазоном концентраций), %.
В случае если содержание компонента менее нижней границы диапазона определяемых концентраций, результат анализа представляют в виде:
содержание вещества в пробе «менее нижней границы определения» (например, для зерна риса, сои, гороха, корнеплодов моркови, лука, ягод и сока винограда менее 0,01 мг/кг*, где * - 0,01 мг/кг - предел обнаружения).
13. Контроль качества результатов измерений
Оперативный контроль погрешности и воспроизводимости измерений осуществляется в соответствии с ГОСТ Р ИСО 5725-1-6-2002 «Точность (правильность и прецизионность) методов и результатов измерений».
13.1. Стабильность результатов измерений контролируют перед проведением измерений, анализируя один из градуировочных растворов.
13.2. Плановый внутрилабораторный оперативный контроль процедуры выполнения анализа проводится с применением метода добавок.
Величина добавки Cд должна удовлетворять условию:
Cд = Δл,x + Δл,x' где
±Δл,x (±Δл,x') - характеристика погрешности (абсолютная погрешность) результатов анализа, соответствующая содержанию компонента в испытуемом образце (расчетному значению содержания компонента в образце с добавкой, соответственно), мг/кг; при этом:
Δл = ±0,84∙Δ, где
Δ - граница абсолютной погрешности, мг/кг:
![]()
где δ - граница относительной погрешности методики (показатель точности в соответствии с диапазоном концентраций), %.
Результат контроля процедуры Kк рассчитывают по формуле:
Kк = Х' - Х - Сд, где
Х', X, Сд - среднее арифметическое результатов параллельных определений (признанных приемлемыми по п. 11) содержания компонента в образце с добавкой, испытуемом образце, концентрация добавки, соответственно, мг/кг (мг/дм3).
Норматив контроля K рассчитывают по формуле:
Проводят сопоставление результата контроля процедуры (Kк) с нормативом контроля (K).
Если результат контроля процедуры удовлетворяет условию
|
|Kк| ≤ K, |
(2) |
процедуру анализа признают удовлетворительной.
При невыполнении условия (2) процедуру контроля повторяют. При повторном невыполнении условия (2) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры к их устранению.
13.3. Проверка приемлемости результатов измерений, полученных в условиях воспроизводимости:
Расхождение между результатами измерений, выполненных в двух разных лабораториях, не должно превышать предела воспроизводимости (R):
|
|
(3) |
где Х1 и Х2 - результаты измерений в двух разных лабораториях, мг/кг (мг/дм3);
R - предел воспроизводимости (в соответствии с диапазоном концентраций), %.
14. Разработчики
Долженко В.И., Цибульская И.А., Черменская Т.Д., Ковров Н.Г. (ГНУ Всероссийский научно-исследовательский институт защиты растений, Санкт-Петербург).
Методика прошла метрологическую экспертизу (Свидетельство об аттестации №01.5.04.678) и внесена в Федеральный реестр (ФР.1.31.2011.10035).