4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ.
ПИЩЕВЫЕ ПРОДУКТЫ И ПИЩЕВЫЕ ДОБАВКИ
Метод идентификации
генно-инженерно-модифицированных
организмов (ГМО)
растительного происхождения с применением
ферментного анализа на биологическом микрочипе
Методические указания
МУ 4.2.2008-05
1. Разработаны: ГУ НИИ питания РАМН (В.А. Тутельян - руководитель, Е.Ю. Сорокина, О.Н. Чернышева, Н.А. Кашина); ФГУЗ «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора (Т.В. Воронцова, Т.Н. Потапова); Инновационной корпорацией «Биозащита» (И.В. Панкин).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека.
3. Утверждены и введены в действие Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации, Г.Г. Онищенко 17 октября 2005 г.
4. Введены впервые.
УТВЕРЖДАЮ
Руководитель Федеральной службы
по надзору в сфере защиты прав
потребителей и благополучия человека,
Главный государственный санитарный врач
Российской Федерации
Г.Г. Онищенко
17 октября 2005 г.
Дата введения: с момента утверждения
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ. ПИЩЕВЫЕ ПРОДУКТЫ И ПИЩЕВЫЕ ДОБАВКИ
Метод идентификации генно-инженерно-модифицированных организмов (ГМО) растительного происхождения с применением ферментного анализа на биологическом микрочипе
Методические указания
МУ 4.2.2008-05
1. Область применения
1.1. Настоящие методические указания подготовлены для идентификации генно-инженерно-модифицированных организмов (далее - ГМО) растительного происхождения в пищевых продуктах с применением ферментного анализа на биологическом микрочипе и его последующей обработки на аппаратно-программном комплексе «ДЕГМИГЕН-001».
1.2. Методические указания разработаны в соответствии с Федеральным законом от 30.03.99 № 52-ФЗ (в редакции от 09.05.05 № 45-ФЗ) «О санитарно-эпидемиологическом благополучии населения», Законом Российской Федерации от 07.02.92 № 2300-1 (в редакции от 21.12.04 № 171-ФЗ) «О защите прав потребителей», постановлением Правительства Российской Федерации от 30.06.04 № 322 «Об утверждении Положения о Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека», постановлением Правительства Российской Федерации от 15.09.05 № 569 «О Положении об осуществлении государственного санитарно-эпидемиологического надзора в Российской Федерации», постановлением Правительства Российской Федерации от 24.07.00 № 554 (в редакции от 15.09.05 № 569) «Об утверждении Положения о государственном санитарно-эпидемиологическом нормировании».
1.3. Методические указания предназначены для органов и учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, осуществляющих контроль качества и безопасности продовольственного сырья и пищевых продуктов, а также других испытательных лабораторий, аккредитованных в порядке, установленном Правительством Российской Федерации.
1.4. Методические указания разработаны для одновременного определения в одном лабораторном испытании пяти различных маркеров рекомбинантной ДНК при проведении скрининга с целью выявления ГМО растительного происхождения в пищевых продуктах, в т.ч., в продовольственном сырье.
2. Общие положения
Методические указания содержат описание метода определения ГМО растительного происхождения в пищевых продуктах с помощью набора реагентов для выявления и идентификации ГМО растительного происхождения с применением ферментного анализа на биологическом микрочипе. Метод основан на идентификации рекомбинантной ДНК с использованием метода асимметричной мультиплексной полимеразной цепной реакции (далее - амПЦР) и последующей гибридизации продуктов амПЦР с применением ферментного анализа на биологическом микрочипе. Метод одновременно устанавливает наличие или отсутствие в анализируемой пробе не менее пяти различных рекомбинантных последовательностей ДНК: трех регуляторных (35 S, nos и ocs) и двух селективных (gus, nptII). Идентификация этих последовательностей позволяет проводить предварительную проверку пищевых продуктов на наличие ГМО растительного происхождения. Чувствительность метода не менее 10-12 г (1пг) ДНК.
3. Аппаратура, материалы, лабораторная посуда, реактивы
3.1. Аппаратура и инструменты
|
ТУ 9642-001-4648062-98 |
|
|
Комплекс аппаратно-программный для анализа биологических микрочипов типа «ДЕГМИГЕН-001» |
ТУ 9443-001-02699501-03 |
|
Компьютерная программа «Arra» для анализа изображений, полученных с помощью комплекса «ДЕГМИГЕН-001» |
ТУ 4320-002-71321417-04 |
|
Биологический микрочип с иммобилизованными олигонуклеотидами (прилож. 1А) |
|
|
Термостат суховоздушный типа ТВ3-25 с рабочей температурой 42 °С, рабочий диапазон от 20 до 60 °С точность поддержания температуры ±1 °С |
ТУ 42-61961 |
|
Весы лабораторные общего назначения 2-го класса точности с пределом допускаемой абсолютной погрешности однократного взвешивания не более ±0,0001 г |
ГОСТ 24104-01 |
|
Термостат типа «TERMO 24-15» под пробирки типа «Эппендорф» вместимостью 0,5 и 1,5 мл, диапазон температур от 15 до 120 °С, количество гнезд - не менее 20 каждого типа, точность поддержания температуры - 0,2 °С, разность температур между соседними ячейками - не более 0,5 |
|
|
Камера морозильная, обеспечивающая температуру минус 20 °С |
|
|
Холодильник бытовой |
|
|
Микроцентрифуга настольная типа «Эппендорф» с частотой вращения не менее 13000 мин-1 |
|
|
Аппарат для встряхивания типа «Вортекс», скорость вращения 250 - 3000 мин-1 |
|
|
Дистиллятор, обеспечивающий качество дистиллированной воды |
|
|
Микродозаторы с переменным объемом дозирования: 0,5 - 10,0 мм3 (шаг - 0,1 мм3, точность ±2,5 - 10,0 %, воспроизводимость 3 - 7 %); 0,5 - 50,0 мм3 (шаг - 0,5 мм3, точность ±2,0 - 5,0 %, воспроизводимость 2,5 - 5 %); 20,0 - 200,0 мм3 (шаг - 1,0 мм3, точность ±1,5 - 2,0 %, воспроизводимость 2 - 3 %); 100 - 1000 мм3 (шаг - 5 мм , точность ±1,0 - 1,5 %, воспроизводимость 1 - 2 %); 2000 - 10000 мм3 (шаг - 10 мм3, воспроизводимость 1 - 2 %) |
|
|
Облучатель бактерицидный настенный ОБН-150 или других видов |
ТУ 16-535-84 |
|
Примечание. Допускается использование другой аппаратуры и инструментов с аналогичными техническими характеристиками, разрешенных для применения в установленном порядке. |
|
3.2. Лабораторная посуда и материалы
|
Воронки стеклянные |
|
|
Колбы стеклянные мерные плоскодонные конические, вместимостью 25, 50, 100, 200, 1000 см3 |
|
|
Чашки Петри |
|
|
Цилиндры стеклянные мерные лабораторные, вместимостью 25, 100, 1000 см3 |
|
|
Пробирки микроцентрифужные типа «Эппендорф», вместимостью 0,2; 0,5; 1,5 см3 |
|
|
Наконечники с фильтром для дозаторов с переменным объёмом дозирования до 10; 20; 200; 1000; 10000 мм3 |
|
3.3. Реактивы и реагенты
|
|
|||
|
Натрия гидроокись |
|||
|
Этилендиаминтетрауксусная кислота (ЭДТА), хч |
ТУ 6-09-11-1721-83 |
||
|
Альбумин бычий сывороточный сухой (БСА). Корпорация «Сигма Алдрич» (Sigma), кат. № В 4287 |
|
||
|
Спирт этиловый ректификованный |
ГОСТ Р 51652-00 |
||
|
Вода дистиллированная |
|||
|
Вода деионизованная |
ОСТ 11.029.003-80 |
||
|
3 %-й раствор пероксида водорода |
|
||
|
Примечание. Допускается использование других реактивов с аналогичными техническими характеристиками; препараты импортного производства должны иметь международный сертификат качества ИСО 9000 или EN 29000. |
|||
|
Набор реагентов для выявления и идентификации ГМО растительного происхождения на биологическом микрочипе состоит из набора для выделения ДНК, набора для проведения амПЦР и набора для ДНК гибридизации и ферментного анализа. Наборы рассчитаны на 100 реакций |
|
||
|
Набор реагентов для пробоподготовки (бисер - 30 г, лизирующий реагент - 60 см3 (2 флакона), сорбент - 2 см3 (2 пробирки), солевой буфер (10-кратный) - 10 см3, экстракционный раствор - 10 см3) |
ТУ 2643-003-71321417-04 |
||
|
Порядок приготовления рабочего раствора солевого буфера описан в п. 4.1. Остальные реагенты готовы к использованию. |
|||
|
Набор реагентов для амПЦР (включает в себя: сухие смеси реагентов (100 пробирок, каждая пробирка содержит Taq ДНК полимеразу, дезоксинуклеозидтрифосфаты и хлорид магния с конечными концентрациями, соответственно, 1 ед, 200 мкМ и 2,5 мМ, а также оптимизированную буферную систему для проведения одной стандартной ПЦР); растворитель; минеральное масло; «+» контроль амплификации - 1 пробирка, 0,5 см3, праймеры на 35S-промотор вируса мозаики цветной капусты: |
ТУ 2643-003-71321417-04 |
||
|
• 35S_п 5¢ CGG CTA CTC CAA GAA TAT CAA AGA TAC AGT TTC AGA AGA |
(39 н.о.); |
||
|
• 35S_о* 5¢ CCA ТТТ ТСС ТТТ ТТТ ATT GTC СТТ TCG ATG AAG TGA CAG А |
(40 и.о.); |
||
|
праймеры на маркерный ген gus из бактерии Escherichia coli: |
|||
|
• gus_ 5¢ ACC GTA CCT CGC ATT ACC CTT ACG CTG AAG AGA |
(33 н.о.); |
||
|
• gus_o* 5¢ TGC CCG CTT CGA AAC CAA TGC CTA AAG AGA |
(30 н.о.); |
||
|
• праймеры на терминатор nos из агробактерии Agrobacterium tumefaciens: |
|||
|
• nos_п 5¢ GGA CAA GCC GTT TTA CGT TTG GAA CTG ACA GA |
(32 н.о.); |
||
|
• nos_o* 5¢ GCC TGA CGT ATG TGC TTA GCT CAT TAA ACT CCA GA |
(35 н.о.); |
||
|
праймеры на маркерный ген nptII из транспазона Tn5 бактериального происхождения: |
|||
|
• npt_п 5¢ GTG ACC CAT GGC GAT GCC TGC TTG С |
(25 н.о.); |
||
|
• npt_o* 5¢ ACC CAG CCG GCC ACA GTC GAT GAA TCC AGA |
(30 н.о.); |
||
|
праймеры на промотор ocs из агробактерии Agrobacterium tumefaciens: |
|||
|
• ocs_п 5¢ AAA AAG TGG CAG AAC CGG TCA AAC СТА AAA GA |
(32 н.о.); |
||
|
• ocs_o* 5¢ CGT TAT TAG TTC GCC GCT CGG TGT GTC GTA GA |
(32 н.о.). |
||
|
Праймеры расфасованы в 10 пробирках по 0,5 см3. |
|||
|
Примечание: 35S_п; gus_п; nos_п; nptII_п; ocs_п - обозначают прямые праймеры; 35S_o*; gus_o*; nos_o*; nptII_o*; ocs_o* - обозначают обратные праймеры меченные биотином; н.о. - нуклеотидные остатки. |
|||
|
Набор реагентов для ДНК гибридизации и ферментного анализа: 20 х SSC - 50 см3; диаминобензидин (ДАБ) - 100 таблеток; конъюгат пероксидазы хрена со стрептавидином - 0,1 см3 с концентрацией 1 мг/см3, 1 пробирка |
ТУ 2643-003-71321417-О4 |
||
|
Примечание. Срок годности набора реагентов - 12 месяцев со дня изготовления. Основную часть реагентов, упакованную в картонную коробку, хранят в сухом тёмном месте при температуре от 2 до 8 °С. В отдельных пластиковых пакетах при температуре -20 °С хранят праймеры, положительный контроль и конъюгат стрептавидин-пероксидазы. |
|||
4. Подготовка к анализу. Приготовление растворов
4.1. Приготовление 0,5 М ЭДТА (рН 8,0)
В мерной колбе на 100 см3 растворить 18,62 г этилендиаминтетрауксусной кислоты (молекулярный вес 372,2) в 80 см3 дистиллированной воды. Раствором 30 %-й гидроокиси довести pH раствора до 8,0 дистиллированной водой - объем раствора до метки, перемешать. Хранить в колбе с притертой пробкой при комнатной температуре до года.
4.2. Приготовление 10 %-го раствора SDS
Растворить 10 г SDS в 90 см3 дистиллированной воды. Хранить при комнатной температуре не более 1 года.
4.3. Приготовление рабочего раствора солевого буфера
Содержимое флакона с 10-кратным солевым буфером (10 см3) (из набора реагентов) перенести из флакона в цилиндр, довести бидистиллированной водой до отметки 100 см3 и 96 %-м этиловым спиртом до отметки 300 см3 и перемешать. Рабочий раствор солевого буфера следует хранить в герметично закрытой посуде при температуре 4 °С.
5. Отбор и подготовка проб пищевых продуктов для анализа
Отбор проб проводят по государственным стандартам, устанавливающим порядок отбора проб для однородных групп пищевой продукции: ГОСТ 5904-82, 9163-90, 12292-00, 10852-86,12430-66, 13979-86, 26313-84, 22617.0-77, 27668-88, 26312-84, 9792-73, 7631-85, 12036-85, 51447-99, 135869.3-86, 13440-89, 17109-88, 19341-73, 26809-86, 27668-88, 27853-88, 28741-90, 29142-91, 13634-90, 15877-70, 17110-71, 17109-88, ГОСТ Р 50436-92, 50437-92, 51926-02, ГОСТ Р ИСО 2170-97.
6. Проведение анализа. Выделение ДНК
6.1. В одноразовые центрифужные пробирки типа «Эппендорф» на 1,5 см3 внести 300 мг бисера и 70 - 80 мг анализируемого материала. Добавить 0,5 мл 5 мМ Na2-соль ЭДТА и термостатировать при 65 °С в течение 30 - 60 мин. Время инкубации составляет 30 мин для процессированных продуктов (мука, чипсы, детское питание и др.) и до 60 мин для зерна. Через каждые 10 - 15 мин гомогенизировать пробу срезанным наконечником (для каждой пробы использовать индивидуальный наконечник).
6.2. К содержимому пробирки добавить 400 мм3 лизирующего реагента из набора реагентов и перемешать на вортексе до максимально однородного состояния. Пробу термостатировать при 65 °C 60 - 120 мин.
6.3. После термостатирования пробу, при необходимости, еще раз гомогенизировать, добавить 500 мм бидистиллированной воды и перемешать на вортексе.
6.4. Центрифугировать пробу 1 мин при 5000 g (12000 об./мин). Прозрачный супернатант перенести в чистую пробирку.
6.5. Добавить 20 мм3 сорбента из набора реагентов (перед использованием сорбент следует интенсивно встряхнуть на вортексе). Пробирку поместить на ротатор и перемешивать на вортексе 10 мин (10 - 20 об./мин).
6.6. Центрифугировать пробу 10 с при 5000 g.
6.7. Осторожно, не задевая осадка, удалить супернатант. К осадку добавить 200 мм3 лизирующего реагента из набора реагентов и перемешать на вортексе до однородного состояния. Центрифугировать пробу 10 с при 5000 g.
6.8. Удалить супернатант. К осадку добавить 1 см3 рабочего раствора солевого буфера из набора реагентов, перемешать содержимое пробирки переворачиванием 5 - 10 раз. Центрифугировать пробу 10 с при 5000 g.
6.9. Удалить супернатант, не задевая, осадка.
6.10. К осадку добавить 1 см3 рабочего раствора солевого буфера, перемешать на вортексе, центрифугировать пробу 10 с при 5000 g и осторожно удалить супернатант.
6.11. Повторить предыдущий пункт ещё раз.
6.12. Подсушить осадок при 65 °C в течение 4 - 5 мин.
6.13. К осадку добавить 50 мм3 экстракционного раствора из набора реагентов. Отбор раствора из исходного флакона проводить при постоянном помешивании, не допуская выпадения в осадок гранул ионообменной смолы.
6.14. Суспендировать содержимое пробирки на вортексе 5 - 10 с до гомогенного состояния, затем термостатировать 10 мин при 65 °С.
6.15. Еще раз суспендировать пробу на вортексе, центрифугировать 1 мин при 5000 g.
6.16. Супернатант, содержащий очищенную ДНК, перенести в чистую пробирку и хранить при - 20 °С до проведения ПЦР анализа. При отборе раствора ДНК необходимо избегать захвата осадка, содержащего сорбент.
Примечание. Кроме описанного выше сорбционного метода выделения ДНК, возможно использование метода выделения, с помощью СТАВ (гексадецилтриметиламмониум бромид), описанного в методических указаниях по определению генетически модифицированных источников в продуктах питания растительного происхождения методом полимеразной цепной реакции (МУК 4.2.1902-04 «Определение генетически модифицированных источников (ГМИ) растительного происхождения методом полимеразной цепной реакции»).
7. Амплификация
7.1. Перед проведением реакции вынуть из холодильника необходимое количество микропробирок с сухими реагентами из набора реагентов. Промаркировать соответствующим образом: «-» контроль», «исследуемые пробы», «+» контроль».
7.2. Добавить во все пробирки по 5 мм3 праймеров.
7.3. Добавить во все пробирки по 10 мм3 растворителя.
7.4. В пробирку, которая служит отрицательным контролем, добавить 5 мм3 бидистиллированной воды. В опытные пробирки добавить по 5 мм3 исследуемой ДНК. В пробирку с положительным контролем добавить 5 мм3 раствора контрольной ДНК.
7.5. Добавить во все пробирки по 20 мм3 минерального масла (масло не используется в случае, если амплификатор имеет термостатируемую крышку).
7.6. Подготовленные для проведения реакции пробирки перенести в термоблок программируемого термостата и запустить программу амплификации в соответствии с режимами, приведенными в табл. 1.
Программа проведения амПЦР
|
Температура, °C |
Время инкубации, с |
Количество циклов |
|
|
1 |
94 |
180 |
1 |
|
2 |
94 |
30 |
42 |
|
3 |
62,5 |
30 |
|
|
4 |
72 |
180 |
1 |
Примечание. Для пипетирования жидкостей без примесей рекомбинантной ДНК (праймеры, растворитель, вода), необходимо иметь отдельный комплект микродозаторов, не используемых при пробоподготовке или работах с ДНК-содержащими препаратами. При подготовке смесей для проведения амПЦР каждую пробирку открывают только перед отбором или внесением проб, а по окончании манипуляции сразу же закрывают. Запрещается открывать одновременно несколько микропробирок с пробами и оставлять их открытыми на длительное время.
7.7. После завершения реакции микропробирки необходимо передать в помещение, в котором будет проводиться гибридизация. Отбор пробы для гибридизации проводится из-под слоя минерального масла в случае его использования.
7.8. Подготовка проб для амПЦР и их гибридизации с применением ферментного анализа на биологическом микрочипе в одном помещении не допускается. Реакционные смеси после амплификации содержат в высоких концентрациях фрагменты ДНК, контаминация которыми помещений, оборудования и реактивов может привести к получению ложноположительных результатов.
8. Проведение ДНК-гибридизации
8.1. Приготовить рабочие разведения раствора 20 ´ SSC (3М NaCl, 0,3 М цитрат натрия, pH 7,4): 2 ´ SSC, 0,1 % SDS; 0,1 ´ SSC; 0,1 ´ SSC, 0,1 % SDS; 0,01 ´ SSC. Для приготовления 100 см3 раствора можно воспользоваться табл. 2.
Приготовление рабочих растворов SSC
|
20 ´ SSC |
10 %-й SDS |
H2O дист. |
|
|
2 ´ SSC, 0,1 % SDS |
10 см3 |
1 см3 |
89 см3 |
|
0,1 ´ SSC |
0,5 см3 |
- |
99,5 см3 |
|
0,1 ´ SSC, 0,1 % SDS |
0,5 см3 |
1см3 |
98,5 см3 |
|
0,01 ´ SSC |
0,05 см3 |
- |
99,95 см3 |
8.2. Микропробирки с продуктами амплификации ДНК центрифугировать 1 - 2 с для сбора пробы на дне пробирки и держать далее только в вертикальном положении. Добавить в каждую микропробирку 5 мм 20 ´ SSC и 0,2 мм 10 % SDS, перемешать и центрифугировать 1 - 2 с. Распределить полученную смесь по поверхности микрочипа, содержащей зоны иммобилизованных олигонуклеотидов.
8.3. Поместить микрочип во влажную камеру (например, в чашку Петри со смоченным дистиллированной водой бумажным фильтром) и поставить на 1 ч в воздушный термостат с температурой 42 °С.
8.4. По окончании реакции капли смыть буфером 2 ´ SSC, 0,1 % SDS и затем тщательно промыть чип следующими растворами:
• 2 ´ SSC, 0,l % SDS - 1 paз 5 мин;
• 0,1 ´ SSC, 0,1 % SDS - 2 раза по 5 мин;
• 0,1 ´ SSC - 5 раз по 1 мин;
• 0,01 ´ SSC в течение 10 с.
9. Проведение ферментного анализа
9.1. Исходный стрептавидин-пероксидазный конъюгат разбавить в 200 раз буфером 1 ´ SSC, содержащим 1 % BSA (бычий сывороточный альбумин), из расчёта 25 мм3 на микрочип. Например, необходимо проанализировать 5 микрочипов. Для этого потребуется 25 ´ 5 = 125 мм3 раствора конъюгата. Готовят с небольшим избытком, 150 мм3 раствора. Для этого 1,5 мг BSA растворяют в 150 мм3 1 SSC, а затем добавляют 0,75 мм3 исходного конъюгата.
9.2. Нанести 25 - 30 мм3 разведенного конъюгата на рабочую зону микрочипа и поместить его на 30 мин во влажную камеру при комнатной температуре.
9.3. Смыть конъюгат раствором 1 ´ SSC.
9.4. Залить микрочип раствором 2 ´ SSC и промыть 5 мин.
9.5. Промыть микрочип раствором 1 ´ SSC.
9.6. Непосредственно перед применением приготовить раствор субстрата - диаминобензидина (ДАБ). Для этого растворить таблетку ДАБ в 1 см3 буфера 0,1 ´ SSC, добавить 30 мм3 3 %-го раствора пероксида водорода и перемешать. Раствор использовать немедленно.
9.7. Залить рабочую зону микрочипа раствором субстрата и выдержать от 2 до 10 минут при комнатной температуре. В случае положительной реакции появляются коричневые пятна окисленного субстрата.
9.8. Промыть микрочип дистиллированной водой, встряхнуть капли воды и поместить в термостат 42 °C на 5 - 10 мин. После сушки микрочип с окрашенными зонами необходимо хранить в тёмном месте.
10. Сканирование биологических микрочипов
10.1. В соответствии с руководством по эксплуатации, поставляемым в комплекте с аппаратно-программным комплексом «ДЕГМИГЕН-001», подготовить сканер микрочипов к работе.
10.2. Поместить микрочип в рамку для сканирования, зафиксировать его и закрыть рамку.
10.3. Запустить программу сканирования, функционирующую в диалоговом режиме, дождаться появления на мониторе приглашения к сканированию и только после этого вставить рамку с микрочипом в приемное окно детектора.
10.4. После завершения сканирования микрочипа необходимо сохранить изображение (прилож. 1Б), присвоив файлу соответствующее имя.
10.5. Для завершения работы с программой сканирования следует нажать в диалоговом окне клавишу «ВЫХОД».
11. Анализ изображений биочипов
11.1. Запустить программу обработки изображения микрочипа «Arra».
11.2. Ввести оцифрованное изображение в программу, для этого нужно выбрать опцию меню «Файл», и затем открыть изображение. В появившемся диалоговом окне выбрать формат, в котором представлены изображения, и выбрать в списке нужный файл, после чего изображение появится в основном окне программы.
11.3. Провести операцию разметки матрицы, чтобы совместить центры измерительных зондов с центрами пятен решетки в изображении, для этого выбрать опцию меню «Анализ» и затем «Разметка матрицы». Разметка начинается с рисования прямоугольника, боковые стороны которого проходят через центры узлов крайних столбцов. Для этого нужно щелкнуть левой кнопкой мыши в центре левого верхнего пятна/ячейки. Затем, держа кнопку нажатой, переместить правую нижнюю вершину появившегося прямоугольника в центр нижнего правого узла.
11.4. В результате предварительной разметки на экране появится четырехугольник с внутренними линиями, расположенными равномерно, в соответствии с заданным числом столбцов матрицы.
11.5. Чтобы завершить разметку и закрыть диалоговое окно, нужно нажать клавишу «Принять».
11.6. После завершения базовой разметки проводят автоматическую коррекцию положения зондов. Для этого в меню выбирается опция «Настройки/Автоматическая подстройка».
11.7. Для анализа результатов нужно выбрать опцию меню «Анализ» - «Показать результаты».
11.8. По окончании измерений программа предоставляет возможность подготовки и распечатки протокола испытаний (прилож. 2). Для этого нужно выбрать опцию меню «Файл» и затем «Заполнить протокол». После этого появится окно с формой для заполнения. После того как она будет заполнена, нажать кнопку «Выход».
12. Интерпретация результатов
12.1. Появление регистрируемого компьютерной программой Arra оптического сигнала в одной, нескольких или во всех пяти зонах гибридизации, содержащих иммобилизованные олигонуклеотиды, указывает на присутствие рекомбинантной ДНК, свидетельствующей о наличии ГМО растительного происхождения в анализируемом образце (пробе).
12.2. Отсутствие регистрируемого оптического сигнала во всех пяти гибридизационных зонах, содержащих иммобилизованные олигонуклеотиды, указывает на неимение рекомбинантной ДНК, что свидетельствует о том, что анализируемый образец (проба) не имеет ГМО растительного происхождения.
12.3. Появление оптического сигнала в зоне гибридизации при использовании отрицательного контроля амплификации свидетельствует о получении ложноположительного результата. Причиной может быть загрязнение реактивов и/или оборудования. В этом случае необходимо обработать поверхности лабораторных столов и оборудования раствором 1Н соляной кислоты, заменить реактивы на свежеприготовленные и повторить анализ.
12.4. Отсутствие оптического сигнала при использовании положительного контроля амплификации, свидетельствует о получении ложноотрицательного результата. Причиной могут быть потеря активности одного из компонентов реакционной смеси для амПЦР и/или гибридизации с применением ферментного анализа на биологическом микрочипе. В этом случае необходимо заменить реактивы на свежеприготовленные и повторить анализ.
13. Организация рабочих мест
Организация рабочих мест для проведения исследований, описанных в настоящих методических указаниях, проводится в соответствии с МУК 4.2.1902-04 «Определение генетически модифицированных источников (ГМИ) растительного происхождения методом полимеразной цепной реакции».
Нормативные ссылки
1. Федеральный закон «О санитарно-эпидемиологическом благополучии населения» от 30.03.99 № 52-ФЗ (в редакции от 09.05.05 № 45-ФЗ) .
2. Закон Российской Федерации «О защите прав потребителей» от 07.02.92 № 2300-1 (в редакции от 21.12.04 № 171).
3. Постановление Правительства Российской Федерации «Об утверждении Положения о государственном санитарно-эпидемиологическом нормировании» от 24.07.00 № 554 (в редакции от 15.09.05 № 569).
4. Постановление Правительства Российской Федерации «О Положении об осуществлении государственного санитарно-эпидемиологического надзора в Российской Федерации» от 15.09.05 № 569.
5. Постановление Правительства Российской Федерации «Об утверждении Положения о Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека» от 30.06.04 № 322.
6. Постановление Главного государственного санитарного врача Российской Федерации «О порядке проведения санитарно-эпидемиологической экспертизы пищевой продукции, полученной из генетически модифицированных источников» от 08.11.00 № 14.
7. Постановление Главного государственного санитарного врача Российской Федерации «Об усилении надзора за пищевыми продуктами, полученными из ГМИ» от 31.12.04 № 13.
8. СанПиН 2.3.2.1078-01 «Продовольственное сырье и пищевые продукты. Гигиенические требования безопасности и пищевой ценности пищевых продуктов».
9. ГОСТ 5904-82 «Изделия кондитерские. Правила приемки, методы отбора и подготовки проб».
10. ГОСТ 9163-90 «Консервы мясные и мясорастительные. Сосиски. Технические условия».
11. ГОСТ 12292-00 «Консервы рыбные с растительными гарнирами. Технические условия».
12. ГОСТ 10852-86 «Семена масличные. Правила приемки и методы отбора проб».
13. ГОСТ 12430-66 «Продукция сельскохозяйственная. Методы отбора проб при карантинном досмотре и экспертизе».
14. ГОСТ 26313-84 «Продукты переработки плодов и овощей. Правила приемки, методы отбора проб».
15. ГОСТ 22617.0-77 «Семена сахарной свеклы. Правила приемки и методы отбора проб».
16. ГОСТ 27668-88 «Мука и отруби. Приемка и методы отбора проб».
17. ГОСТ 26312.1-84 «Крупа. Правила приемки и методы отбора проб».
18. ГОСТ 9792-73 «Колбасные изделия и продукты из свинины, баранины, говядины и мяса других видов убойных животных и птиц. Правила приемки и методы отбора проб».
19. ГОСТ 7631-85 «Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Правила приемки, органолептические методы оценки качества, методы отбора проб для лабораторных испытаний».
20. ГОСТ 12036-85 «Семена сельскохозяйственных культур. Правила приемки и методы отбора проб».
21. ГОСТ Р 51447-99 «Мясо и мясные продукты. Методы отбора проб».
22. ГОСТ 17109-88 «Соя. Требования при заготовках и поставках».
23. ГОСТ 19341-73 «Консервы рыбные. Печень рыб с растительными добавками. Технические условия».
24. ГОСТ 26809-86 «Молоко и молочные продукты. Правила приемки, методы отбора и подготовка проб к анализу».
25. ГОСТ 27853-88 «Овощи соленые и квашеные, плоды и ягоды моченые. Приемка, отбор проб».
26. ГОСТ 28741-90 «Продукты питания из картофеля. Приемка, подготовка проб и методы испытаний».
27. ГОСТ 29142-91 «Семена масличных культур. Отбор проб».
28. ГОСТ 13634-90 «Кукуруза. Требования при заготовках и поставках».
29. ГОСТ 15877-70 «Кукуруза сахарная консервированная. Технические условия».
30. ГОСТ 17110-71 «Соя (промышленное сырье). Требования при поставках. Технические условия».
31. ГОСТ Р 50436-92 «Зерновые. Отбор проб зерна».
32. ГОСТ Р 50437-92 «Бобовые культуры в мешках. Отбор проб».
33. ГОСТ Р 51926-2002 «Консервы. Икра овощная. Технические условия».
34. ГОСТ ИСО 2170-97 «Зерновые и бобовые. Отбор проб молотых продуктов».
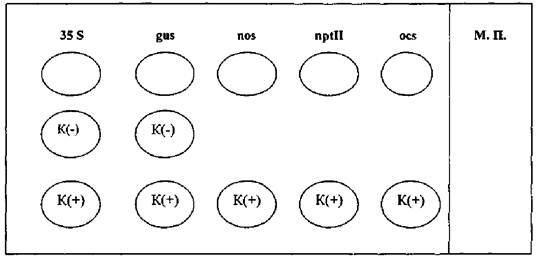
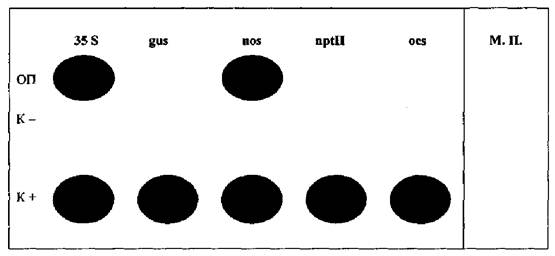
Приложение 1
Пример гибридизационной картины продуктов амПЦР на биологическом микрочипе
А
Б
А - схема негелевого биологического микрочипа для идентификации ГМИ растительного происхождения;
Б - гибридизационная картина на экране компьютера, полученная в результате анализа генетически модифицированной сои, содержащей промотор 35S и терминатор nos.
Приложение 2
Форма протокола испытаний по идентификации генно-инженерно-модифицированных организмов (ГМО) растительного происхождения с применением ферментного анализа на биологическом микрочипе
ПРОТОКОЛ ИСПЫТАНИЙ
Серия АБ № 0000000
№________от «____»________________200___г.
|
Продукция _________________________________________________________________ |
|||||||||||||||||
|
Производитель сырья или продукции __________________________________________ |
|||||||||||||||||
|
Предъявитель сырья или продукции ___________________________________________ |
|||||||||||||||||
|
Отбор проб произведен в соответствии с нормативным документом на соответствующую группу сырья или продукции _________________________________ |
|||||||||||||||||
|
Акт отбора проб и техническое задание на испытания № _____ от __________________ |
|||||||||||||||||
|
Испытания проведены на основании требований |
|||||||||||||||||
|
Номер образца _____________________________________________________________ |
|||||||||||||||||
|
Характеристика испытуемого образца (маркировка, вид и состояние упаковки, этикетки, штрих кода) |
|||||||||||||||||
|
в образцах № __________ отсутствует, а в образце № _________ присутствует |
|||||||||||||||||
|
Маркировка: _______________________________________________________________ |
|||||||||||||||||
|
Годен до _________________ Штриховой код ___________________________________ |
|||||||||||||||||
|
Результаты испытаний
Результаты анализа _________________________________________________________ __________________________________________________________________________ __________________________________________________________________________ __________________________________________________________________________ |
|||||||||||||||||
|
Исполнители: |
|||||||||||||||||
|
___________________ ___________________ |
|||||||||||||||||
|
подпись подпись |
|||||||||||||||||
|
___________________ ___________________ |
|||||||||||||||||
|
подпись подпись |
|||||||||||||||||
|
Руководитель испытательной лаборатории ____________________________________ |
|||||||||||||||||
|
подпись |
|||||||||||||||||
|
м. п. _____________________________________ |
|||||||||||||||||
|
Фамилия, инициалы |
|||||||||||||||||
|
Заключение распространяется на образец, представленный на испытания. |
|||||||||||||||||
СОДЕРЖАНИЕ