4.2. МЕТОДЫ
КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ
И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ.
ПИЩЕВЫЕ ПРОДУКТЫ И ПИЩЕВЫЕ ДОБАВКИ
Определение генетически модифицированных
источников (ГМИ) растительного происхождения
методом полимеразной цепной реакции
Методические указания
МУ 4.2.1902-04
1. Разработаны: ГУ НИИ питания РАМН (В. А. Тутельян - руководитель, Е. Ю. Сорокина, О. Н. Чернышева, О. В. Анисимова); Департаментом Госсанэпиднадзора Минздрава России (А. И. Петухов); Федеральным центром Госсанэпиднадзора Минздрава России (Е. Н. Беляев, И. В. Брагина, Т. В. Воронцова, Т. Н. Потапова, Т. Ф. Авдеенко, С. Ю. Терехова, М. В. Зароченцев); Центром Госсанэпиднадзора в г. Москве (Н. Н. Филатов, И. И. Пискарева, Н. Я. Салова, Е. В. Сизых); Московской медицинской академией им. Сеченова Минздрава России (Б. П. Суханов); Центром «Биоинженерия» РАН (К. Г. Скрябин, Д. Б. Дорохов, Б. Б. Кузнецов, Ю. Е. Асадова); МГУ прикладной биотехнологии Минобразования России (И. А. Рогов, Н. Г. Кроха, А. Ф. Валихов).
2. Утверждены Главным государственным санитарным врачом Российской Федерации и введены в действие 06.03.04.
3. Введены впервые.
Содержание
|
УТВЕРЖДАЮ |
||
|
Главный государственный санитарный |
||
|
Г. Г. Онищенко |
||
|
6 марта 2004 г. |
||
|
Дата введения: с момента утверждения |
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ
И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ.
ПИЩЕВЫЕ ПРОДУКТЫ И ПИЩЕВЫЕ ДОБАВКИ
Определение генетически модифицированных
источников (ГМИ) растительного происхождения
методом полимеразной цепной реакции
Методические
указания
МУ 4.2.1902-04
1. Введение
1.1. Настоящие методические указания устанавливают методы идентификации ГМИ растительного происхождения в пищевой продукции.
1.2. Методические указания предназначены для применения в лабораториях учреждений санитарно-эпидемиологической службы Российской Федерации, осуществляющей контроль за качеством продовольственного сырья и пищевых продуктов, в т. ч. импортируемых в Российскую Федерацию, гигиеническую оценку и выдачу санитарно-эпидемиологических заключений, в лабораториях других организаций, аккредитованных в установленном порядке на право проведения контроля безопасности пищевой продукции и продовольственного сырья.
1.3. Методические указания являются обязательными при контроле пищевых продуктов на наличие генетически модифицированных источников и применяются на этапах поставки на производство, гигиенической экспертизы, государственной регистрации, закупки, ввоза в страну и реализации.
1.4. Методические указания разработаны с целью обеспечения единого методического подхода для идентификации генетически модифицированных источников в пищевых продуктах, продовольственном сырье, пищевых и биологически активных добавках к пище.
2. Область применения
Методические указания содержат описание методов определения ГМИ растительного происхождения в пищевых продуктах, основанных на идентификации рекомбинантной ДНК с использованием метода полимеразной цепной реакции (ПЦР). Описаны скрининговые методы, направленные на выявление регуляторных последовательностей: промотора 35S из вируса мозаики цветной капусты и терминатора NOS из Agrobactetium tumefaciens. Идентификация этих регуляторных последовательностей позволяет проводить предварительную проверку пищевой продукции на наличие ГМИ, но не определяет примененную генетическую конструкцию или конкретную линию растения (трансформационное событие), а также не может применяться при проведении количественного анализа содержания ГМИ. Окончательная идентификация ГМИ, разрешенных для реализации населению и использованию в пищевой промышленности в Российской Федерации, проводится с применением протоколов исследований для конкретных трансформационных событий, которые представляются разработчиком в Департамент Госсанэпиднадзора Минздрава России при проведении санитарно-эпидемиологической экспертизы. В методических указаниях описаны методы идентификации генетических конструкций для наиболее часто встречаемых на мировом и внутреннем продовольственных рынках генетически модифицированных растений.
Методы, применяемые при отборе проб пищевых продуктов, выделения ДНК для проведения анализов, проведения электрофореза, документирования и анализа получаемых данных, а также вопросы организации рабочего места, являются обязательными к исполнению при проведении как скрининговых, так и идентификационных анализов.
С целью выявления наличия сои и кукурузы как традиционных, так и генно-модифицированных сортов в исследуемом пищевом продукте, а также проверки качества выделяемых из исследуемых образцов препаратов ДНК приведены методы идентификации последовательностей ДНК, специфичных для всех линий сои и кукурузы.
Все представленные методы являются качественными и состоят из следующих этапов: выделение ДНК из пищевого продукта, амплификация целевой ДНК с соответствующими праймерами, электрофорез продуктов амплификации в агарозном геле, документирование и анализ результатов.
3. Аппаратура, материалы, лабораторная посуда, реактивы
3.1. Аппаратура и инструменты
|
Амплификатор типа «Терцик МС-2» со скоростью нагрева/охлаждения активного элемента не менее 1,5 °С/с |
|
|
Прибор для горизонтального электрофореза типа «Mini-Sub Cell GT System» с комплектом кювет и гребенок |
|
|
Источник напряжения типа «Power Рас 300» с диапазоном регулируемого напряжения 50 - 300 В |
|
|
Видеосистема типа «Gel Doc
2000™», предназначенная для ввода в компьютер, анализа и документирования |
|
|
Холодильник бытовой электрический |
|
|
Камера морозильная, обеспечивающая температуру минус 20 °С |
|
|
Микроцентрифуга настольная типа Эппендорф (частота вращения не менее 13 000 мин-1) |
|
|
Термостат типа «TERMO 24-15» под пробирки типа Эппендорф вместимостью 0,5 и 1,5 мл, диапазон температур от 15 до 120 °С, количество гнезд - не менее 20 каждого типа, точность поддержания температуры - 0,2 °С, разность температур между соседними ячейками - не более 0,5 °С |
|
|
Аппарат для встряхивания типа «Вортекс», скорость вращения 250 - 3000 мин-1 |
|
|
Печь микроволновая (мощностью не менее 400 W) |
|
|
Весы лабораторные общего назначения 2-го класса точности с наибольшим пределом взвешивания 200 г |
|
|
Анализатор потенциометрический, погрешность измерений рН ± 0,01 |
|
|
Стерилизаторы паровые медицинские или аналогичные |
ГОСТ 19569-89Е |
|
Дистиллятор, обеспечивающий качество дистиллированной воды |
|
|
Гомогенизатор перистальтического типа «Стомайкер» или других моделей |
|
|
Облучатель бактерицидный настенный ОБН-150 или других видов |
ТУ 16-535-84 |
|
Дозаторы с переменным объёмом дозирования: |
|
|
0,2 - 2,0 мкл с шагом 0,01 мкл, с точностью ± 1,2 %; |
|
|
0,5 - 10,0 мкл с шагом 0,01 мкл, с точностью ± 0,8 %; |
|
|
2 - 20 мкл с шагом 0,01 мкл, с точностью ± 0,8 %; |
|
|
20 - 200 мкл с шагом 0,1 мкл, с точностью ± 0,6 %; |
|
|
100 - 1 000 мкл с шагом 1 мкл, с точностью ± 3 %; |
|
|
2 - 10 мл с шагом 0,1 мл, с точностью ± 0,5 %. |
|
|
Пинцет медицинский |
Допускается использование другой аппаратуры и инструментов с техническими характеристиками, не хуже указанных выше, отечественного и зарубежного производства, разрешенных для применения в установленном порядке.
3.2. Лабораторная посуда и материалы
|
Бумага фильтровальная лабораторная |
|
|
Воронки стеклянные |
|
|
Колбы стеклянные мерные плоскодонные конические, вместимостью 25, 50, 100, 200, 1000 мл |
|
|
Цилиндры стеклянные мерные лабораторные, вместимостью 25, 100, 1000 мл |
|
|
Пробирки микроцентрифужные типа Эппендорф, вместимостью 0,2; 0,5; 1,5 мл |
|
|
Наконечники с фильтром для дозаторов с переменным объёмом дозирования до: 10; 20; 200; 1000 мм3; 10 см3 |
3.3. Реактивы
|
Кислота соляная, хч |
|
|
Кислота борная, хч |
|
|
Натрия гидроокись, чда |
|
|
Натрий хлористый, хч |
|
|
Этилендиаминтетрауксусная кислота (ЭДТА), хч |
ТУ 6-09-11-1721-83 |
|
Гексадецилтриметиламмониум бромид (СТАВ). |
|
|
Корпорация «Сигма Алдрич» (Sigma), кат. № Н 5882 |
|
|
Трис (оксиметил) аминометан, хч |
ТУ 6-09-4292-76 |
|
Альбумин бычий сывороточный сухой (БСА). |
|
|
Корпорация «Сигма Алдрич» (Sigma), кат. № В 4287 |
|
|
Этидий бромистый, хч |
ТУ 6-09-13-452-75 |
|
Спирт этиловый ректификованный |
|
|
Спирт изопропиловый, хч |
ТУ 6-09-402-85 |
|
Масло вазелиновое медицинское |
|
|
Хлороформ, хч |
|
|
Вода дистиллированная |
|
|
Вода деионизированная |
ОСТ 11.029.003-80 |
|
2-меркаптоэтанол, хч |
ТУ 6-09-08-1024-81 |
|
Термостабильный фермент Taq-полимераза,
оптимум работы в области 70 - 72 °С. Корпорация «Сигма Алдрич» |
|
|
Буфер для ПЦР с MgCl2. Корпорация «Сигма Алдрич» (Sigma), кат. № Р 2192 |
|
|
Агароза для электрофореза (тип П). Корпорация «Сигма Алдрич» (Sigma), кат. № А. 6877 |
|
|
Маркер молекулярной массы ДНК. Корпорация «Сигма Алдрич» (Sigma), кат. № Р 1473 |
|
|
Стандартный образец состава генетически немодифицированного источника пищи растительного происхождения Certified Reference Material IRMM № 410R SB-0). Корпорация «Сигма Алдрич» (Fluka), кат. № 53198 |
|
|
Стандартный образец состава генетически модифицированного источника пищи растительного происхождения (Certified Reference Material IRMM № 410R SB-5). Корпорация «Сигма Алдрич» (Fluka), кат. № 44386 |
|
|
Нуклеотиды: |
|
|
- 2'- дезоксиаденозин-5'трифосфорной кислоты тетранатриевая соль, тригидрат (АТФ). Корпорация «Сигма Алдрич» (Sigma), кат. № Д 4788 |
|
|
- 2'- дезоксицитидин-5'трифосфорной кислоты тетранатриевая соль, тригидрат (ЦТФ). Корпорация «Сигма Алдрич» (Sigma), кат. № Д 4913 |
|
|
- 2'-дезоксигуанозин-5'трифосфорной кислоты тетранатриевая соль, тригидрат (ГТФ). Корпорация «Сигма Алдрич» (Sigma), кат. № Д 5038 |
|
|
- 2'- дезокситимидин - 5'трифосфорной кислоты тетранатриевая соль, тригидрат (ТТФ). Корпорация «Сигма Алдрич» (Sigma), кат. № Т 9656 |
|
|
Праймеры на промотор 35S, терминатор NOS, сою линии 40-3-2, кукурузу линий MON 810 и Bt 176, ген cry III (картофель), ген лектина (соя), ген зеина (кукуруза). ЗАО «Синтол» (Россия) http://www.syntol.ru |
Допускается использование других реактивов с техническими характеристиками, не хуже указанных выше, препараты импортного производства должны иметь международный сертификат качества ИСО 9 000 или EN 29 000.
4. Подготовка к анализу
4.1. Приготовление растворов
Приготовление 1М ТРИС-HCl (рН 7,5)
В мерной колбе на 100 мл растворить 12,11 г Трис (оксиметил) аминометана (молекулярный вес 121) в 80 мл дистиллированной воды, довести рН концентрированной соляной кислотой до 7,5, затем довести объем раствора до метки деионизованной водой, перемешать, хранить при температуре - 20 °С не более года.
Приготовление 5M NaCl
Растворить 29,22 г натрия хлористого (молекулярный вес 58,5) в 100 мл дистиллированной воды, перемешать, хранить в колбе с притертой пробкой при комнатной температуре до 1 года.
Приготовление 30 %-ной NaOH
Растворить 3 г натрия гидроокиси (молекулярный вес 40) в 7 мл дистиллированной воды.
Приготовление 0,5 М ЭДТА (рН 8,0)
В мерной колбе на 100 мл растворить 18,62 г этилендиаминтетрауксусной кислоты (молекулярный вес 372,2) в 80 мл дистиллированной воды. Раствором 30 %-ной натрия гидроокиси довести рН раствора до 8,0, дистиллированной водой - объем раствора до метки, перемешать. Хранить в колбе с притертой пробкой при комнатной температуре до 1 года.
Приготовленные растворы автоклавировать при 1 атм., 121 °С 15 - 20 мин или фильтровать через мембраны Millipore 0,4 мкм.
Приготовление хлороформа, насыщенного водой
Смешать 100 мл хлороформа с 20 мл деионизированной воды и оставить на 24 ч для насыщения. Срок хранения при температуре от 4 до 5 °С - не более 6 мес.
Приготовление 70 %-ного раствора этилового ректификованного спирта
Смешать 70 мл 96 %-ного этилового ректификованного спирта с 26 мл деионизированной воды. Срок хранения при температуре от 4 до 5 °С - не более 2 мес.
Приготовление раствора БСА (20 мкг/мл)
Растворить 0,002 г сухого альбумина бычьего сывороточного в 1 мл деионизированной воды, 10 мкл полученного раствора смешать с 990 мкл деионизированной воды.
Срок хранения в морозильной камере при температуре минус 20 °С - не более 6 мес.
Приготовление лизирующего буфера (2 %-ного «СТАВ»)
Растворить 0,5 г гексадецилтриметиламмония бромида в 10 мл деионизированной воды (при плохом растворении подогреть на водяной бане), добавить 2,5 мл 1 М Трис - НСl, 7 мл 5 М NaC, 1 мл 0,5 М ЭДТА, доводят объем раствора деионизированной водой до 25 мл, перемешивают. Срок хранения при температуре от 4 до 5 °С - не более 6 мес., допустимо образование осадка.
Перед использованием раствор выдерживают при комнатной температуре или подогревают в термостате при температуре 65 °С до полного растворения осадка.
Непосредственно перед использованием в приготовленный лизирующий буфер вносят меркаптоэтанол из расчета 4 мм3 на 1 см3 лизирующего буфера и перемешивают.
При проведении
электрофореза использовать один
из нижеперечисленных буферов
Приготовление1x TBE буфера для электрофореза
В мерной колбе на 1 000 мл растворить 10,8 г Трис (оксиметил) аминометана, 5,5 г борной кислоты и 0,92 г этилендиаминтетрауксусной кислоты, довести дистиллированной водой до метки, перемешать до полного растворения. Срок хранения 1х раствора - 10 дней, обычно готовят 10х и перед употреблением разбавляют до 1х, используют максимум три раза.
Приготовление1x TAE буфера для электрофореза
В мерную колбу вместимостью 1000 мл внести 242 г Трис-основания, 57,1 мл ледяной уксусной кислоты, 10 мл 0,5 М ЭДТА, долить деионизованной водой до метки. Полученный 50х раствор перед употреблением развести в 50 раз. Использовать для проведения электрофореза не более двух раз.
Приготовление раствора бромистого этидия - С21Н20N3Вr (10 мг/мл)
Растворить 1 г бромистого этидия в 100 мл дистиллированной воды. Срок хранения в посуде темного стекла - обязательно при температуре от 4 до 5 °С - не более 12 мес.
Приготовление 2 %-ного агарозного геля см. п. 8
Допускается хранение готового геля в 1х буфере для электрофореза в холодильнике при температуре от 4 до 5 °С - не более 2 сут.
5. Отбор и подготовка проб пищевых продуктов для анализа
Отбор проб проводят по государственным стандартам, устанавливающим порядок отбора проб для однородных групп пищевой продукции: ГОСТ 5904-82, 9163-90, 12292-00, 10852-86, 12430-66, 13979-86, 26313-84, 22617.0-77, 27668-88, 26312.1-84, 9792-73, 7631-85, 12036-85, 51447-99, 135869.3-86, 13440-89, 17109-88, 19341-73, 26809-86, 27668-88, 27853-88, 28741-90, 29142-91, 13634-90, 15877-70, 17110-71, ГОСТ Р 50436-92, 50437-92, 51926-02, ГОСТ Р ИСО 2170-97.
6. Проведение анализа. Выделение ДНК
6.1.
Метод выделения ДНК с помощью СТАВ
(гексадецилтриметиламмониум бромид)
Подготовка пробы (раствора ДНК).
• Навеску исследуемого продукта массой 70 - 80 мг поместить в микроцентрифужную пробирку типа Эппендорф вместимостью 1,5 мл.
• Добавить 200 мкл - лизирующего буфера с меркаптоэтанолом, тщательно растереть пробу в пробирке пестиком
• Добавить еще 600 мкл лизирующего буфера с меркаптоэтанолом, перемешать на аппарате для встряхивания типа «Вортекс».
• Инкубировать при 65 °С 40 - 60 мин, перемешать на аппарате для встряхивания, центрифугировать 7 мин на настольной микроцентрифуге типа Эппендорф при частоте вращения 13000 об./мин.
• Перенести супернатант в чистую пробирку типа Эппендорф вместимостью 1,5 мл.
• Добавить 400 мкл хлороформа, предварительно насыщенного водой.
• Перемешать на аппарате для встряхивания типа «Вортекс» до образования суспензии.
• Центрифугировать 7 мин при частоте вращения 12 000 об./мин.
• Перенести верхнюю фракцию в чистую пробирку типа Эппендорф вместимостью 1,5 мл, не захватывая слой хлороформа. Экстракцию хлороформом повторить.
• Центрифугировать 7 мин при частоте вращения 12 000 об./мин.
• Перенести верхнюю фракцию в чистую пробирку типа Эппендорф вместимостью 1,5 мл, не захватывая слой хлороформа.
• Добавить 600 мкл изопропилового спирта, взятого из морозильной камеры (минус 20 °С), перемешать.
• Поместить пробирку в морозильную камеру (минус 20 °С) на 30 мин, не менее. В морозильной камере можно оставить на ночь.
• Центрифугировать 6 мин при частоте вращения 12000 об./мин.
• Тщательно удалить верхний слой.
• Осадок промыть 200 мкл 70 %-ного этилового спирта (2 - 3 раза), каждый раз перемешивая на аппарате для встряхивания типа «Вортекс», центрифугировать 6 мин при частоте вращения 12 000 об./мин (суспендированный в 70 %-ном этаноле образец можно оставить на ночь в морозильной камере при минус 20 °С).
• Последний раз тщательно до последней капли удалить спирт.
• Подсушить осадок 5 мин при 65 °С для удаления капель спирта.
• Растворить осадок в 50 - 100 мкл деионизированной воды, осторожно встряхивая.
• Полученный раствор ДНК готов для проведения ПЦР, хранить при минус 20 °С (допустимо неполное растворение осадка).
7. Амплификация
Общие требования к постановке идентификационной ПЦР.
При проведении идентификации ГМИ обязательно готовят следующие пробы:
• ДНК-матрица положительного контроля с праймерами к соответствующей трансгенной конструкции;
• ДНК-матрица положительного контроля с праймерами к специфичному для вида пищевого продукта гену (лектин - для сои; зеин - для кукурузы; фосфоенолпируват карбоксилазы - для картофеля);
• ДНК-матрица отрицательного контроля с праймерами к соответствующей трансгенной конструкции;
• ДНК-матрица отрицательного контроля с праймерами к специфичному для вида пищевого продукта гену (лектин - для сои; зеин - для кукурузы; фосфоенолпируват карбоксилазы - для картофеля);
• исследуемые образцы ДНК пищевого продукта с праймерами к соответствующей трансгенной конструкции;
• исследуемые образцы ДНК пищевого продукта с праймерами к специфичному для вида пищевого зерна гену (лектин - для сои; зеин - для кукурузы; фосфоенолпируват карбоксилазы - для картофеля);
• безматричные контроли ПЦР для всех праймерных систем, участвующих в анализе.
7.1. Метод идентификации промотора 35S [1]
Праймеры для идентификации промотора 35S:
1 - GCT ССТ АСА ААТ GCC АТС А
2 - GAT AGT GGG ATT GTG CGT СА
Реакционная смесь для проведения полимеразной цепной реакции, рассчитанная на 10 проб, представлена в табл. 1.
В пробирку типа Эппендорф вносятся на холоде следующие реактивы:
|
№ |
Реактивы |
Объем реакционной смеси 25 мкл |
Объем реакционной смеси 50 мкл |
|
1 |
Деионизированная вода |
169 мкл |
338 мкл |
|
2 |
Буфер для полимеразной цепной реакции с MgCl2 (10х) |
29 мкл |
58 мкл |
|
3 |
Раствор БСА (20 мкг/мл) |
29 мкл |
58 мкл |
|
4 |
Смесь нуклеотидов (4 млМ) |
14 мкл |
28 мкл |
|
5 |
Праймер 1 (20 мкМ) |
7 мкл |
14 мкл |
|
6 |
Праймер 2 (20 мкМ) |
7 мкл |
14 мкл |
|
7 |
Taq-полимераза (5 ед./мкл) |
1,5 мкл |
3,0 мкл |
Примечание: реакционную смесь готовят на необходимое количество проб, но не меньше чем на 5.
Подготовка к проведению амплификации
• Реакционную смесь разлить в пробирки для проведения ПЦР по 24,5 мкл в каждую, если объем реакционной смеси 25,0 мкл, или по 49,0 мкл в каждую, если объем реакционной смеси 50,0 мкл.
• В каждую пробирку с 24,5 мкл добавить 0,5 мкл раствора ДНК, в каждую пробирку с 49,0 мкл добавить 1,0 мкл раствора ДНК.
• Смесь перемешать, центрифугировать (30 с при 3000 об./мин).
• При использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла.
Условия амплификации представлены в табл. 2.
|
Стадия |
Тип амплификатора* |
|
|
Gene Amp 2700; Био-Рад; Терцик МС-2, АМПЛИ-4 |
Trio |
|
|
Денатурация |
3 мин/94 °С |
3 мин/94 °С |
|
Амплификация |
20 с/94 °С |
30 с/95 °С |
|
Количество циклов амплификации |
40 |
40 |
|
Конечное удлинение |
3 мин/72 °С |
3 мин/72 °С |
|
Фаза остывания |
1 мин/4 °С |
1 мин/4 °С |
|
Скорость нагрева |
0,77 °С/с |
1°С/с |
|
Скорость остывания |
3,15 °С/с |
1°С/с |
|
* В табл. 2 указаны типы амплификаторов, на которых проводились испытания. Для других амплификаторов необходимо подбирать условия проведения амплификации индивидуально. |
||
После проведения амплификации пробы готовы для проведения электрофореза в агарозном геле. Схема проведения электрофореза п. 8.
Продукт амплификации - 195 пар нуклеотидов, прилож. 1.
7.2. Метод идентификации терминатора NOS [1]
Праймеры для идентификации терминатора NOS:
1 - GAA ТСС TGT TGC CGG TCT TG
2 - ТТА ТСС TAG ТТТ GCG CGC ТА
Реакционная смесь для проведения полимеразной цепной реакции, рассчитанная на 10 проб, представлена в табл. 3.
В пробирку типа Эппендорф вносятся на холоде следующие реактивы:
|
№ |
Реактивы |
Объем реакционной смеси 25 мкл |
Объем реакционной смеси 50 мкл |
|
1 |
Деионизированная вода |
169 мкл |
338 мкл |
|
2 |
Буфер для полимеразной цепной реакции с MgCl2 (10x) |
29 мкл |
58 мкл |
|
3 |
Раствор БСА (20 мкг/мл) |
29 мкл |
58 мкл |
|
4 |
Смесь нуклеотидов (4 млМ) |
14 мкл |
28 мкл |
|
5 |
Праймер 1 (20 мкМ) |
7 мкл |
14 мкл |
|
6 |
Праймер 2 (20 мкМ) |
7 мкл |
14 мкл |
|
7 |
Taq-полимераза (5 ед./мкл) |
1,5 мкл |
3,0 мкл |
Примечание: реакционную смесь готовят на необходимое количество проб, но не меньше чем на 5.
Подготовка к проведению амплификации
• Реакционную смесь разлить в пробирки для проведения ПЦР по 24,5 мкл в каждую, если объем реакционной смеси 25,0 мкл, или по 49,0 мкл в каждую, если объем реакционной смеси 50,0 мкл.
• В каждую пробирку с 24,5 мкл добавить 0,5 мкл раствора ДНК, в каждую пробирку с 49,0 мкл добавить 1,0 мкл раствора ДНК.
• Смесь перемешать, центрифугировать (30 с при 3 000 об./мин).
• При использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла.
Условия амплификации представлены в табл. 4.
|
Стадия |
Тип амплификатора* |
|
|
Gene Amp 2700; Био-Рад; Терцик МС-2, АМПЛИ-4 |
Trio |
|
|
Денатурация |
3 мин/94 °С |
3 мин/94 °С |
|
Амплификация |
20 с/94 °С |
30 с/95 °С |
|
Количество циклов амплификации |
40 |
40 |
|
Конечное удлинение |
3 мин/72 °С |
3 мин/72 °С |
|
Фаза остывания |
1 мин/4 °С |
1 мин/4 °С |
|
Скорость нагрева |
0,77 °С/с |
1°С/с |
|
Скорость остывания |
3,15 °С/с |
1°С/с |
|
* В таблице указаны типы амплификаторов, на которых проводились испытания. Для других амплификаторов необходимо подбирать условия проведения амплификации индивидуально. |
||
После проведения амплификации пробы готовы для проведения электрофореза в агарозном геле. Схема проведения электрофореза п. 8.
Продукт амплификации - 180 пар нуклеотидов, прилож. 2.
7.3.
Метод идентификации сои линии 40-3-2, устойчивой
к глифосату [2]
Полимеразная цепная реакция проводится гнездовым методом с двумя раундами амплификации
Первый раунд. Оба раунда проводятся в течение одного рабочего дня. Внешние праймеры:
1 - CCA CTG ACG ТАА GGG ATG ACG
2 - CAT GAA GGA CCG GTG GGA GAT
Реакционная смесь для проведения полимеразной цепной реакции, рассчитанная на 10 проб, представлена в табл. 5.
В пробирку типа Эппендорф вносятся на холоде следующие реактивы:
|
№ |
Реактивы |
Объем реакционной смеси 25 мкл |
Объем реакционной смеси 50 мкл |
|
1 |
Деионизированная вода |
188,7 мкл |
377,5 мкл |
|
2 |
Буфер для полимеразной цепной реакции с MgCl2 (10х) |
25 мкл |
50 мкл |
|
3 |
Смесь нуклеотидов (4 млМ) |
12,5 мкл |
25 мкл |
|
4 |
Праймер 1 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
5 |
Праймер 2 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
6 |
Taq-полимераза (5 ед./мкл) |
1,3 мкл |
2,5 мкл |
Примечание: реакционную смесь готовят на необходимое количество проб, но не меньше чем на 5.
Подготовка к проведению амплификации
• Приготовленные реакционные смеси перемешать на вортексе и центрифугировать 30 с при 3000 об./мин.
• Реакционную смесь разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, если объем реакционной смеси 25,0 мкл, или по 48,0 мкл в каждую, если объем реакционной смеси 50,0 мкл.
• В каждую пробирку с 24,0 мкл добавить 1,0 мкл раствора ДНК, в каждую пробирку с 48,0 мкл добавить 2,0 мкл раствора ДНК.
• Смесь перемешать, центрифугировать (30 с при 3 000 об./мин).
• При использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла.
Условия амплификации представлены в табл. 6.
|
Стадия |
Тип амплификатора* |
|
Gene Amp 2700; Био-Рад; Терцик МС-2, АМПЛИ-4, Trio |
|
|
Денатурация |
3 мин/ 95 °С |
|
Амплификация |
30 с/95 °С |
|
Количество циклов амплификации |
25 |
|
Конечное удлинение |
3 мин/72 °С |
|
Фаза остывания |
4 °С |
|
* В таблице указаны типы амплификаторов, на которых проводились испытания. Для других амплификаторов необходимо подбирать условия проведения амплификации индивидуально. |
|
После проведения амплификации пробы поместить на холод.
Хранение не более одного часа в холодильнике до проведения 2-го раунда.
Второй раунд.
Внутренние праймеры:
3 - АТС ССА СТА ТСС ТТС GCA AGA
4 - TGG GGT TTA TGG AAA TTG GAA
Реакционная смесь для проведения полимеразной цепной реакции, рассчитанная на 10 проб, представлена в табл. 7.
В пробирку типа Эппендорф вносятся на холоде следующие реактивы:
|
№ |
Реактивы |
Объем реакционной смеси 25 мкл |
Объем реакционной смеси 50 мкл |
|
1 |
Деионизированная вода |
193,7 мкл |
387,5 мкл |
|
2 |
Буфер для полимеразной цепной реакции с MgCl2 (10x) |
25 мкл |
50 мкл |
|
3 |
Смесь нуклеотидов (4 млМ) |
12,5 мкл |
25 мкл |
|
4 |
Праймер 1 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
5 |
Праймер 2 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
6 |
Taq-полимераза (5 ед./мкл) |
1,3 мкл |
2,5 мкл |
Примечание: реакционную смесь готовят на необходимое количество проб, но не меньше чем на 5.
Подготовка к проведению амплификации
• Приготовленные реакционные смеси перемешать на вортексе и центрифугировать 30 с при 3000 об./мин.
• Реакционную смесь разлить в пробирки для проведения ПЦР по 24,5 мкл в каждую, если объем реакционной смеси 25,0 мкл, или по 49,0 мкл в каждую, если объем реакционной смеси 50,0 мкл.
• В каждую пробирку с 24,5 мкл добавить 0,5 мкл раствора ДНК, в каждую пробирку с 49,0 мкл добавить 1,0 мкл продукта амплификации после 1-го раунда.
• Смесь перемешать, центрифугировать (30 с при 3000 об./мин).
• При использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла.
Условия амплификации представлены в табл. 8.
|
Стадия |
Тип амплификатора* |
|
Gene Amp 2700; Био-Рад; Терцик МС-2, АМПЛИ-4, Trio |
|
|
Денатурация |
3 мин/ 95 °С |
|
Амплификация |
30 с/95 °С |
|
Количество циклов амплификации |
35 |
|
Конечное удлинение |
3 мин/72 °С |
|
Фаза остывания |
4 °С |
|
* В таблице указаны типы амплификаторов, на которых проводились испытания. Для других амплификаторов необходимо подбирать условия проведения амплификации индивидуально. |
|
После проведения амплификации пробы поместить на холод.
Хранение не более одного часа в холодильнике до проведениия 2-го раунда.
Схема проведения электрофореза п. 8.
Продукт амплификации - 169 пар нуклеотидов, прилож. 3.
7.4.
Метод идентификации кукурузы линии MON 810,
устойчивой к стеблевому мотыльку [3]
Полимеразная цепная реакция проводится гнездовым методом с двумя раундами амплификации.
Первый раунд. Внешние праймеры:
1 - ТАТ СТС САС TGA CGT AAG GGA TGA С
2 - TGC ССТ АТА АСА ССА АСА TGT GCT Т
Реакционная смесь для проведения полимеразной цепной реакции, рассчитанная на 10 проб, представлена в табл. 9.
В пробирку типа Эппендорф вносятся на холоде следующие реактивы:
|
№ |
Реактивы |
Объем реакционной смеси 25 мкл |
Объем реакционной смеси 50 мкл |
|
1 |
Деионизированная вода |
188,7 мкл |
377,5 мкл |
|
2 |
Буфер для полимеразной цепной реакции с MgCl2 (10x) |
25 мкл |
50 мкл |
|
3 |
Смесь нуклеотидов (4 млМ) |
12,5 мкл |
25 мкл |
|
4 |
Праймер 1 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
5 |
Праймер 2 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
6 |
Taq-полимераза (5 ед./мкл) |
1,3 мкл |
2,5 мкл |
Примечание: реакционную смесь готовят на необходимое количество проб, но не меньше чем на 5.
Подготовка к проведению амплификации
• Приготовленные реакционные смеси перемешать на вортексе и центрифугировать 30 с при 3000 об./мин.
• Реакционную смесь разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, если объем реакционной смеси 25,0 мкл, или по 48,0 мкл в каждую, если объем реакционной смеси 50,0 мкл.
• В каждую пробирку с 24,0 мкл добавить 1,0 мкл раствора ДНК, в каждую пробирку с 48,0 мкл добавить 2,0 мкл раствора ДНК.
• Смесь перемешать, центрифугировать (30 с при 3 000 об./мин).
• При использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла.
Условия амплификации представлены в табл. 10.
|
Стадия |
Тип амплификатора* |
|
Gene Amp 2700; Био-Рад; Терцик МС-2, АМПЛИ-4, Trio |
|
|
Денатурация |
3 мин/ 95 °С |
|
Амплификация |
45 с/95 °С |
|
Количество циклов амплификации |
35 |
|
Конечное удлинение |
3 мин/72 °С |
|
Фаза остывания |
4 °С |
|
* В таблице указаны типы амплификаторов, на которых проводились испытания. Для других амплификаторов необходимо подбирать условия проведения амплификации индивидуально. |
|
После проведения амплификации пробы поместить на холод. Хранение не более одного часа в холодильнике до проведения 2-го раунда. Второй раунд. Внутренние праймеры:
3 - ACT АТС СТТ CGC AAG АСС СТТ ССТС
4 - GCA TTC AGA GAA ACG TGG CAG ТАА С
Реакционная смесь для проведения полимеразной цепной реакции, рассчитанная на 10 проб, представлена в табл. 11.
В пробирку типа Эппендорф вносятся на холоде следующие реактивы:
|
№ |
Реактивы |
Объем реакционной смеси 25 мкл |
Объем реакционной смеси 50 мкл |
|
1 |
Деионизированная вода |
193,7 мкл |
387,5 мкл |
|
2 |
Буфер для полимеразной цепной реакции с MgCl2 (10х) |
25 мкл |
50 мкл |
|
3 |
Смесь нуклеотидов (4 млМ) |
12,5 мкл |
25 мкл |
|
4 |
Праймер 1 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
5 |
Праймер 2 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
6 |
Taq-полимераза (5 ед./мкл) |
1,3 мкл |
2,5 мкл |
Примечание: реакционную смесь готовят на необходимое количество проб, но не меньше чем на 5.
Подготовка к проведению амплификации
• Приготовленные реакционные смеси перемешать на вортексе и центрифугировать 30 с при 3000 об./мин.
• Реакционную смесь разлить в пробирки для проведения ПЦР по 24,5 мкл в каждую, если объем реакционной смеси 25,0 мкл, или по 49,0 мкл в каждую, если объем реакционной смеси 50,0 мкл.
• В каждую пробирку с 24,5. мкл добавить 0,5 мкл раствора ДНК, в каждую пробирку с 49,0 мкл добавить 1,0 мкл продукта амплификации после 1-го раунда.
• Смесь перемешать, центрифугировать (30 с при 3000 об./мин).
• При использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла.
Условия амплификации представлены в табл. 12.
|
Стадия |
Тип амплификатора* |
|
Gene Amp 2700; Био-Рад; Терцик МС-2, АМПЛИ-4, Trio |
|
|
Денатурация |
3 мин/95 °С |
|
Амплификация |
45 с/95 °С |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °С |
|
Фаза остывания |
4 °С |
|
* В таблице указаны типы амплификаторов, на которых проводились испытания. Для других амплификаторов необходимо подбирать условия проведения амплификации индивидуально. |
|
После проведения амплификации пробы поместить на холод. Хранение не более одного часа в холодильнике до проведения 2-го раунда. После проведения амплификации пробы готовы для проведения электрофореза в агарозном геле.
Схема проведения электрофореза п. 8.
Продукт амплификации - 149 пар нуклеотидов, прилож. 4.
7.5.
Метод идентификации кукурузы линии Bt-176,
устойчивой к стеблевому мотыльку [4]
Полимеразная цепная реакция проводится гнездовым методом с двумя раундами амплификации.
Первый раунд. Внешние праймеры:
1 - CGG ССС CGA GTT САС СТТ
2 - CTG CTG GGG ATG ATG TTG TTG
Реакционная смесь для проведения полимеразной цепной реакции, рассчитанная на 10 проб, представлена в табл. 13.
В пробирку типа Эппендорф вносятся на холоде следующие реактивы:
|
№ |
Реактивы |
Объем реакционной смеси 25 мкл |
Объем реакционной смеси 50 мкл |
|
1 |
2 |
3 |
4 |
|
1 |
Деионизированная вода |
188,7 мкл |
377,5 мкл |
|
2 |
Буфер для полимеразной цепной реакции с MgCl2 (10х) |
25 мкл |
50 мкл |
|
3 |
Смесь нуклеотидов (4 млМ) |
12,5 мкл |
25 мкл |
|
4 |
Праймер 1 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
5 |
Праймер 2 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
6 |
Taq-полимераза (5 ед./мкл) |
1,3 мкл |
2,5 мкл |
Примечание: реакционную смесь готовят на необходимое количество проб, но не меньше чем на 5.
Подготовка к проведению амплификации
• Приготовленные реакционные смеси перемешать на вортексе и центрифугировать 30 с при 3000 об./мин.
• Реакционную смесь разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, если объем реакционной смеси 25,0 мкл, или по 48,0 мкл в каждую, если объем реакционной смеси 50,0 мкл.
• В каждую пробирку с 24,0 мкл добавить 1,0 мкл раствора ДНК, в каждую пробирку с 48,0 мкл добавить 2,0 мкл раствора ДНК.
• Смесь перемешать, центрифугировать (30 с при 3 000 об./мин).
• При использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла.
Условия амплификации представлены в табл. 14.
|
Стадия |
Тип амплификатора* |
|
Gene Amp 2700; Био-Рад; Терцик МС-2, АМПЛИ-4, Trio |
|
|
Денатурация |
3 мин/ 95 °С |
|
Амплификация |
40 с/95 °С |
|
Количество циклов амплификации |
25 |
|
Конечное удлинение |
3 мин/72 °С |
|
Фаза остывания |
4 °С |
|
* В таблице указаны типы амплификаторов, на которых проводились испытания. Для других амплификаторов необходимо подбирать условия проведения амплификации индивидуально. |
|
После проведения амплификации пробы поместить на холод. Хранение не более одного часа в холодильнике до проведения 2-го раунда.
Второй раунд. Внутренние праймеры:
3 - CCG САС ССТ GAG CAG САС
4 - GGT GGC ACG TTG TTG TTC TGA
Реакционная смесь для проведения полимеразной цепной реакции, рассчитанная на 10 проб, представлена в табл. 15.
В пробирку типа Эппендорф вносятся на холоде следующие реактивы:
|
№ |
Реактивы |
Объем реакционной смеси 25 мкл |
Объем реакционной смеси 50 мкл |
|
1 |
Деионизированная вода |
193,7 мкл |
387,5 мкл |
|
2 |
Буфер для полимеразной цепной реакции с MgCl2 (10х) |
25 мкл |
50 мкл |
|
3 |
Смесь нуклеотидов (4 млМ) |
12,5 мкл |
25 мкл |
|
4 |
Праймер 1 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
5 |
Праймер 2 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
6 |
Taq-полимераза (5 ед./мкл) |
1,3 мкл |
2,5 мкл |
Примечание: реакционную смесь готовят на необходимое количество проб, но не меньше чем на 5.
Подготовка к проведению амплификации
• Приготовленные реакционные смеси перемешать на вортексе и центрифугировать 30 с при 3000 об./мин.
• Реакционную смесь разлить в пробирки для проведения ПЦР по 24,5 мкл в каждую, если объем реакционной смеси 25,0 мкл, или по 49,0 мкл в каждую, если объем реакционной смеси 50,0 мкл.
• В каждую пробирку с 24,5 мкл добавить 0,5 мкл раствора ДНК, в каждую пробирку с 49,0 мкл добавить 1,0 мкл продукта амплификации после 1-го раунда.
• Смесь перемешать, центрифугировать (30 с при 3000 об./мин).
• При использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла.
Условия амплификации представлены в табл. 16.
|
Стадия |
Тип амплификатора* |
|
Gene Amp 2700; Био-Рад; Терцик МС-2, АМПЛИ-4, Trio |
|
|
Денатурация |
3 мин/ 95 °С |
|
Амплификация |
40 с/95 °С |
|
Количество циклов амплификации |
35 |
|
Конечное удлинение |
3 мин/72 °С |
|
Фаза остывания |
4 °С |
|
* В таблице указаны типы амплификаторов, на которых проводились испытания. Для других амплификаторов необходимо подбирать условия проведения амплификации индивидуально. |
|
После проведения амплификации пробы поместить на холод. Хранение не более одного часа в холодильнике до проведения 2-го раунда. После проведения амплификации пробы готовы для проведения электрофореза в агарозном геле.
Схема проведения электрофореза п. 8.
Продукт амплификации - 189 пар нуклеотидов, прилож. 5.
7.6. Идентификация картофеля,
устойчивого
к колорадскому жуку (ген cry III A) [5]
Полимеразная цепная реакция проводится гнездовым методом с двумя раундами амплификации.
Первый раунд. Внешние праймеры:
1 - СТА ССА СТА AGG ATG ТТА ТСС
2 - ATG САС ТС A CGT AGT ССТ СС
Реакционная смесь для проведения полимеразной цепной реакции, рассчитанная на 10 проб, представлена в табл. 17.
В пробирку типа Эппендорф вносятся на холоде следующие реактивы:
|
№ |
Реактивы |
Объем реакционной смеси 25 мкл |
Объем реакционной смеси 50 мкл |
|
1 |
Деионизированная вода |
161,3 мкл |
322,6 мкл |
|
2 |
Буфер для полимеразной цепной реакции с MgCl2 (10x) |
33 мкл |
66 мкл |
|
3 |
Раствор БСА (20 мкг/мл) |
33 мкл |
66 мкл |
|
4 |
Смесь нуклеотидов (10 млМ) |
6,2 мкл |
12,4 мкл |
|
5 |
Праймер 1 (20 мкМ) |
2,5 мкл |
5,0 мкл |
|
6 |
Праймер 2 (20 мкМ) |
2,5 мкл |
5,0 мкл |
|
7 |
Taq-полимераза (5 ед./мкл) |
1,5 мкл |
3,0 мкл |
Примечание: реакционную смесь готовят на необходимое количество проб, но не меньше чем на 5.
Подготовка к проведению амплификации
• Приготовленные реакционные смеси перемешать на вортексе и центрифугировать 30 с при 3 000 об./мин.
• Реакционную смесь разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, если объем реакционной смеси 25,0 мкл, или по 48,0 мкл в каждую, если объем реакционной смеси 50,0 мкл.
• В каждую пробирку с 24,0 мкл добавить 1,0 мкл раствора ДНК, в каждую пробирку с 48,0 мкл добавить 2,0 мкл раствора ДНК.
• Смесь перемешать, центрифугировать (30 с при 3 000 об./мин).
• При использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла.
Условия амплификации представлены в табл. 18.
|
Стадия |
Тип амплификатора* |
|
Gene Amp 2700; Био-Рад; Терцик МС-2, АМПЛИ-4, Trio |
|
|
Денатурация |
2 мин/98 °С |
|
Амплификация |
30 с/95 °С |
|
Количество циклов амплификации |
20 |
|
Конечное удлинение |
3 мин/72 °С |
|
Фаза остывания |
4 °С |
|
* В таблице указаны типы амплификаторов, на которых проводились испытания. Для других амплификаторов необходимо подбирать условия проведения амплификации индивидуально. |
|
После проведения амплификации пробы поместить на холод. Хранение не более одного часа в холодильнике до проведения 2-го раунда.
Второй раунд.
Внутренние праймеры:
1 - СТА ССА СТА AGG ATG ТТА ТСС
3 - TTG TAT AGA AGC TCA CGA GG
Реакционная смесь для проведения полимеразной цепной реакции, рассчитанная на 10 проб, представлена в табл. 19.
В пробирку типа Эппендорф вносятся на холоде следующие реактивы:
|
№ |
Реактивы |
Объем реакционной смеси 25 мкл |
Объем реакционной смеси 50 мкл |
|
1 |
Деионизированная вода |
164,8 мкл |
329,6 мкл |
|
2 |
Буфер для полимеразной цепной реакции с MgCl2 (10х) |
33 мкл |
66 мкл |
|
3 |
Раствор БСА (20 мкг/мл) |
33 мкл |
66 мкл |
|
4 |
Смесь нуклеотидов (10 млМ) |
6,2 мкл |
12,4 мкл |
|
5 |
Праймер 1 (20 мкМ) |
2,5 мкл |
5,0 мкл |
|
6 |
Праймер 2 (20 мкМ) |
2,5 мкл |
5,0 мкл |
|
7 |
Taq-полимераза (5 ед./мкл) |
1,5 мкл |
3,0 мкл |
Примечание: реакционную смесь готовят на необходимое количество проб, но не меньше чем на 5.
Подготовка к проведению амплификации
• Приготовленные реакционные смеси перемешать на вортексе и центрифугировать 30 с при 3 000 об./мин.
• Реакционную смесь разлить в пробирки для проведения ПЦР по 24,5 мкл в каждую, если объем реакционной смеси 25,0 мкл, или по 49,0 мкл в каждую, если объем реакционной смеси 50,0 мкл.
• В каждую пробирку с 24,5 мкл добавить 0,5 мкл раствора ДНК, в каждую пробирку с 49,0 мкл добавить 1,0 мкл продукта амплификации после 1-го раунда.
• Смесь перемешать, центрифугировать (30 с при 3000 об./мин).
• При использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла
Условия амплификации представлены в табл. 20.
|
Стадия |
Тип амплификатора* |
|
Gene Amp 2400; Био-Рад; Терцик МС-2, АМПЛИ-4, Trio |
|
|
Денатурация |
2 мин/ 98 °С |
|
Амплификация |
30 с/95 °С |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °С |
|
Фаза остывания |
4 °С |
|
*В таблице указаны типы амплификаторов, на которых проводились испытания. Для других амплификаторов необходимо подбирать условия проведения амплификации индивидуально. |
|
После проведения амплификации пробы поместить на холод.
Хранение не более одного часа в холодильнике до проведения 2-го раунда.
Схема проведения электрофореза п. 8.
Продукт амплификации - 102 пары нуклеотидов, прилож. 6.
7.7. Идентификация ДНК сои: ген лектина [2]
Праймеры:
1 - GCC СТС ТАС ТСС АСС ССС АТС С
2 - GCC CAT CTG CAA GCC TTT TTG TG
Реакционная смесь для проведения полимеразной цепной реакции, рассчитанная на 10 проб, представлена в табл. 21.
В пробирку типа Эппендорф вносятся на холоде следующие реактивы:
|
№ |
Реактивы |
Объем реакционной смеси 25 мкл |
Объем реакционной смеси 50 мкл |
|
1 |
Деионизированная вода |
193,7 мкл |
387,5 мкл |
|
2 |
Буфер для полимеразной цепной реакции с MgCl2 (10х) |
25 мкл |
50 мкл |
|
3 |
Смесь нуклеотидов (4 млМ) |
12,5 мкл |
25 мкл |
|
4 |
Праймер 1 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
5 |
Праймер 2 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
6 |
Taq-полимераза (5 ед./мкл) |
1,3 мкл |
2,5 мкл |
Примечание: реакционную смесь готовят на необходимое количество проб, но не меньше чем на 5.
Подготовка к проведению амплификации
• Приготовленные реакционные смеси перемешать на вортексе и центрифугировать 30 с при 3000 об./мин.
• Реакционную смесь разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, если объем реакционной смеси 25,0 мкл, или по 48,0 мкл в каждую, если объем реакционной смеси 50,0 мкл.
• В каждую пробирку с 24,0 мкл добавить 1,0 мкл раствора ДНК, в каждую пробирку с 48,0 мкл добавить 2,0 мкл раствора ДНК.
• Смесь перемешать, центрифугировать (30 с при 3000 об./мин).
• При использования амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла.
Условия амплификации представлены в табл. 22.
|
Стадия |
Тип амплификатора* |
|
Gene Amp 2700; Био-Рад; Терцик МС-2, АМПЛИ-4, Trio |
|
|
Денатурация |
3 мин/95 °С |
|
Амплификация |
30 с/95 °С |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
3 мин/72 °С |
|
Фаза остывания |
4 °С |
|
* В таблице указаны типы амплификаторов, на которых проводились испытания. Для других амплификаторов необходимо подбирать условия проведения амплификации индивидуально. |
|
После проведения амплификации пробы поместить на холод. Хранение не более одного часа в холодильнике до проведения 2-го раунда. После проведения амплификации пробы готовы для проведения электрофореза в агарозном геле.
Схема проведения электрофореза п. 8.
Продукт амплификации - 118 пар нуклеотидов, прилож. 7.
7.8. Идентификация ДНК кукурузы: ген зеина [3]
Праймеры:
1 - TGC TTG CAT TGT TCG СТС ТСС TAG
2 - GTC GCA GTG АСА TTG TGG CAT
Реакционная смесь для проведения полимеразной цепной реакции, рассчитанная на 10 проб, представлена в табл. 23.
В пробирку типа Эппендорф вносятся на холоде следующие реактивы:
|
№ |
Реактивы |
Объем реакционной смеси 25 мкл |
Объем реакционной смеси 50 мкл |
|
1 |
Деионизированная вода |
193,7 мкл |
387,5 мкл |
|
2 |
Буфер для полимеразной цепной реакции с MgCl2 (10х) |
25 мкл |
50 мкл |
|
3 |
Смесь нуклеотидов (4 млМ) |
12,5 мкл |
25 мкл |
|
4 |
Праймер 1 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
5 |
Праймер 2 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
6 |
Taq-полимераза (5 ед./мкл) |
1,3 мкл |
2,5 мкл |
Примечание: реакционную смесь готовят на необходимое количество проб, но не меньше чем на 5.
Подготовка к проведению амплификации
• Приготовленные реакционные смеси перемешать на вортексе и центрифугировать 30 с при 3000 об./мин.
• Реакционную смесь разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, если объем реакционной смеси 25,0 мкл, или по 48,0 мкл в каждую, если объем реакционной смеси 50,0 мкл.
• В каждую пробирку с 24,0 мкл добавить 1,0 мкл раствора ДНК, в каждую пробирку с 48,0 мкл добавить 2,0 мкл раствора ДНК.
• Смесь перемешать, центрифугировать (30 с при 3000 об./мин).
• При использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла.
Условия амплификации представлены в табл. 24.
|
Стадия |
Тип амплификатора* |
|
Gene Amp 2700; Био-Рад; Терцик МС-2, АМПЛИ-4, Trio |
|
|
Денатурация |
3 мин/95 °С |
|
Амплификация |
1 мин/94 °С |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
7 мин/72 °С |
|
Фаза остывания |
4 °С |
|
* В таблице указаны типы амплификаторов, на которых проводились испытания. Для других амплификаторов необходимо подбирать условия проведения амплификации индивидуально. |
|
После проведения амплификации пробы поместить на холод. Хранение не более одного часа в холодильнике до проведения 2-го раунда. После проведения амплификации пробы готовы для проведения электрофореза в агарозном геле.
Схема проведения электрофореза п. 8.
Продукт амплификации - 329 пар нуклеотидов, прилож. 8.
7.9. Идентификация ДНК картофеля: ген фосфоенолпируват карбоксилазы
Праймеры:
1 - GTC ТСС TTG GCT CAT TTT ATG С
2 - САА GTT AGC TGC CAT TCT GGC С
Реакционная смесь для проведения полимеразной цепной реакции, рассчитанная на 10 проб, представлена в табл. 25.
В пробирку типа Эппендорф вносятся на холоде следующие реактивы:
|
№ |
Реактивы |
Объем реакционной смеси 25 мкл |
Объем реакционной смеси 50 мкл |
|
1 |
Деионизированная вода |
188,7 мкл |
377,5 мкл |
|
2 |
Буфер для полимеразной цепной реакции с MgCl2(10х) |
25 мкл |
50 мкл |
|
3 |
Смесь нуклеотидов (4 млМ) |
12,5 мкл |
25 мкл |
|
4 |
Праймер 1 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
5 |
Праймер 2 (20 мкМ) |
6,25 мкл |
12,5 мкл |
|
6 |
Taq-полимераза (5 ед./мкл) |
1,3 мкл |
2,5 мкл |
Примечание: реакционную смесь готовят на необходимое количество проб, но не меньше чем на 5.
Подготовка к проведению амплификации
• Приготовленные реакционные смеси перемешать на вортексе и центрифугировать 30 с при 3000 об./мин.
• Реакционную смесь разлить в пробирки для проведения ПЦР по 24,0 мкл в каждую, если объем реакционной смеси 25,0 мкл, или по 48,0 мкл в каждую, если объем реакционной смеси 50,0 мкл.
• В каждую пробирку с 24,0 мкл добавить 1,0 мкл раствора ДНК, в каждую пробирку с 48,0 мкл добавить 2,0 мкл раствора ДНК.
• Смесь перемешать, центрифугировать (30 с при 3000 об./мин).
• При использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла.
Условия амплификации представлены в табл. 26.
|
Стадия |
Тип амплификатора* |
|
Gene Amp 2700; Био-Рад; Терцик МС-2, АМПЛИ-4, Trio |
|
|
Денатурация |
3 мин/95 °С |
|
Амплификация |
1 мин/94 °С |
|
Количество циклов амплификации |
40 |
|
Конечное удлинение |
7 мин/72 °С |
|
Фаза остывания |
4 °С |
|
* В таблице указаны типы амплификаторов, на которых проводились испытания. Для других амплификаторов необходимо подбирать условия проведения амплификации индивидуально. |
|
После проведения амплификации пробы поместить на холод. Хранение не более одного часа в холодильнике до проведения 2-го раунда. После проведения амплификации пробы готовы для проведения электрофореза в агарозном геле.
Схема проведения электрофореза п. 8.
Продукт амплификации - 1 149 пар нуклеотидов.
8. Проведение электрофореза в агарозном геле
Приготовление агарозного геля
• Для приготовления 2 %-ной агарозы необходимо к 1 г агарозы добавить 50 мл 1х буфера ТВЕ и тщательно перемешать.
• Полученный раствор поместить в микроволновую печь (на 2 - 5 мин, в зависимости от мощности печи - следить за интенсивностью кипения суспензии!!) или прокипятить на водяной бане 15 мин до полного растворения агарозы.
• Расплавленную агарозу охладить до 56 °С и добавить 5 мкл бромистого этидия (концентрация 10 мг/мл), тщательно перемешать.
• Расплавленную агарозу с бромистым этидием разлить в подготовленную форму. Толщина геля 0,5 - 0,7 см.
• Через 30 - 40 мин удалить гребенку. Готовый гель можно использовать сразу, можно хранить в 1х буфере в холодильнике при 4 °С.
Проведение электрофореза
• Смешать в отдельной пробирке 2 мкл буфера для нанесения и 10 мкл реакционной смеси. Внести смесь в лунки геля. (Можно использовать соотношение буфер/реакционная смесь - 2/8.) В одну из лунок (чаще в крайнюю) внести маркер молекулярной массы (можно 100 Вр).
• Поместить заполненный гель в камеру для электрофореза, заполненную буфером 1х ТБЕ. Толщина слоя буфера над поверхностью геля ~ 2 - 3 мм.
• В режиме постоянного напряжения 100 V электрофорез длится примерно 70 - 90 мин.
• Гель (без формы) поместить на фильтр трансиллюминатора и посмотреть в проходящем ультрафиолетовом свете.
• Документировать результат фореза - либо на фотопленку «Микрат Изопан» (изопанхроматическая фотопленка чувствительностью 3 ед. ГОСТ, фотографическая широта 10, разрешение - 300 линий/мм), либо при помощи гельдокументирующей системы. Фотокопия геля должна быть приложена к отчету по идентификации (при цифровой съемке - распечатывается на принтере с разрешением не менее 300 dpi).
9.
Источники появления ложных положительных
сигналов при проведении ПЦР-диагностики и их предотвращение [6]
Наиболее мощные источники загрязнений (в порядке вклада):
• загрязнение продуктами предыдущих реакций;
• плазмиды, фаги, космиды и прочие векторы, особенно если они используются в качестве зондов при гибридизации;
• положительный контроль (клонированная ДНК или сырье);
• перекрестное загрязнение образцов;
• загрязнение из других источников при взятии образцов (возможно даже загрязнение от перчаток);
• загрязнение препарата полимеразы бактериальной ДНК (важно при получении ПЦР продуктов консервативных областей генов 16S рРНК, к примеру).
|
Стадии анализа |
Источники загрязнений |
|
|
Окружающая среда |
Источник материала |
Ошибки при выборе источника |
|
Сбор образцов |
Посуда, шпатели, перчатки |
|
|
Фиксация образцов |
Загрязненные реактивы для фиксации |
|
|
Транспортирование образцов |
Техника, резервуары |
|
|
Лаборатория |
Приготовление образцов |
Ошибки персонала, загрязнение положительным контролем (материалом) |
|
Выделение ДНК |
Загрязнения продуктами предыдущих ПЦР |
|
|
Постановка ПЦР |
Положительные контроли, векторы, реактивы |
|
|
Анализ продуктов ПЦР |
Ошибки персонала |
|
Применение более чувствительных методик проведения ПЦР (таких как Hot-Start, nested-PCR) существенно повышает чувствительность ПЦР к посторонним загрязнениям.
Следует отметить, что хотя большинство причин ложных положительных сигналов (ЛПС) являются следствием внутрилабораторных причин, не стоит сбрасывать со счетов и загрязнения, происходящие вне лаборатории - во время сбора образцов, их первичной обработки (фасовка, упаковка, транспортирование), поскольку именно на этой стадии наиболее сложно обеспечить стерильные условия работы.
Для повышения точности анализа необходимо постоянно использовать в работе отрицательные контроли, эксперименты должны выполняться не менее, чем в двух повторностях (исследовать от одного образца продукта сразу две пробы). В случае получения постоянных положительных сигналов на отрицательных контролях все исходные реактивы подлежат немедленной замене.
Возможные причины возникновения ЛПС, не связанные с внешними источниками:
• наличие амплифицируемой ДНК при проведении ПЦР с обратной транскрипцией (важно при определении вироида и РНК-содержащих вирусов);
• амплифицирование сходных последовательностей, с которыми связываются праймеры - псевдогенов и гомологов (здесь важен этап конструирования праймеров);
• неспецифическая амплификация (правильный подбор условий проведения ПЦР).
Предотвращение появления ложно положительных сигналов (ЛПС)
1. Этапы приема, регистрации проб и выделения ДНК, приготовление реакционных смесей и амплификации, детекции продуктов амплификации должны размещаться в разных помещениях. Выделение ДНК и приготовление реакционных смесей следует проводить в ПЦР-боксах.
2. Приготовление реакционных смесей для проведения ПЦР (без ДНК-матриц), т. н. «master-mix» следует готовить в отдельном помещении. Подготовка ПЦР-смесей при массовом анализе проводится либо в начале рабочего дня тем персоналом, который в дальнейшем будет проводить обработку образцов и выделение ДНК, либо отдельными людьми, в чью задачу входит только приготовление «master-mix» (второе предпочтительнее). В любом случае помещение для подготовки «master-mix» должно быть оборудовано отдельными наборами пипеток, необходимой посудой, стерильными перчатками, лабораторной одеждой и обувью, а также морозильниками для хранения основных запасов олигонуклеотидов, термополимеразы, буферов и трифосфатов, предварительно разлитыми на отдельные аликвоты объемом не более недельной потребности.
3. Планирование проведения анализа должно предусматривать минимизацию ручной обработки реакционных смесей.
4. Вскрытие пробирок с продуктами ПЦР разрешается только в пост-ПЦР помещении. Запрещается выход персонала из пост-ПЦР помещений в лабораторной одежде и перенос отработанных материалов (одноразового пластика, гелей, перчаток, буферных растворов, мелкого лабораторного оборудования - электрофоретических камер, лабораторного стекла (колбы для плавления агарозы), автоматических пипеток и пр.) без тщательной упаковки в герметичные пластиковые мешки. Это относится и к случаям перемещения оборудования для проведения необходимого ремонта или замены.
Правила работы для персонала
1. Работы на этапе детекции продуктов амплификации проводят сотрудники, не занятые на других этапах ПЦР-исследований.
2. На каждом этапе ПЦР-исследования необходимо использовать индивидуальный набор соответствующего лабораторного оборудования, расходных материалов и одежды. Одноразовые перчатки подлежат смене при каждой новой операции. Работа без перчаток запрещена.
3. Запрещается перемещать личные вещи, лабораторные журналы, лабораторную одежду и канцелярские принадлежности между зонами лаборатории.
Работа с оборудованием
1. Миницентрифуги, вортексы, штативы для пробирок, автоматические пипетки, термостаты и маркерные карандаши являются принадлежностями определенного рабочего места и перемещению с места на место не подлежат.
2. Агарозные и полиакриламидные гели должны быть собраны в закрывающиеся контейнеры для дальнейшей утилизации.
3. Сменные наконечники для пипеток и полипропиленовые пробирки разрешается использовать только из заводской упаковки. Автоклавирование одноразового пластика не производится.
4. Для того, чтобы избежать аэрозольного загрязнения пипеток, использовать только наконечники с антиаэрозольными барьерными вставками.
Работа с реактивами
1. Серийные аликвоты реагентов должны быть пронумерованы и занесены в специальный журнал с указанием номера партии реактивов, из которой произведено аликвотирование, даты приготовления аликвот и лица, производившего разлив реагентов.
2. Перед работой с ДНК или перед переносом приготовленных к проведению реакции ПЦР смесей все исходные реагенты должны быть убраны в морозильную камеру, предназначенную для рабочих реактивов. Запрещается возвращать частично использованные реактивы в холодильник для хранения аликвот, равно как и в холодильник для хранения исходных растворов в промышленных упаковках.
3. Степень рабочего разведения для каждого типа положительного контроля определяется отдельно. Одновременно запрещается готовить разведения положительных и отрицательных контролей на одном и том же рабочем месте. При добавлении ДНК в готовые реакционные смеси первым следует добавлять отрицательный контроль (контроли), далее - исследуемый материал, а положительный контроль - в последнюю очередь.
10. Организация рабочих мест
Общие требования
1. Исследования по идентификации ГМИ растительного происхождения могут проводиться на базе лабораторий, проводящих исследования методом ПЦР с патогенными биологическими агентами. В таком случае должно быть предусмотрено лишь разграничение исследований во времени. При организации исследований по идентификации ГМИ необходимо предусмотреть наличие вспомогательных помещений (комнаты ведения учетной документации; раздевалки для сотрудников, комнаты приема пищи, туалеты, подсобные помещения), которые могут быть общими с другими подразделениями учреждения. Курение и прием пищи на рабочих местах строго запрещен. Для приема пищи выделяется отдельное помещение, вход в которое в лабораторной одежде запрещен.
2. Для сотрудников лаборатории должна быть предусмотрена спецодежда: медицинский халат, шапочка, перчатки и сменная обувь. При работе в помещении детекции продуктов амплификации следует надевать бахилы.
3. Пробирки с продуктами ПЦР и использованные наконечники к микродозаторам подвергаются первичной обработке растворами, вызывающими деградацию ДНК.
4. По окончании работ обрабатывают рабочие поверхности растворами, вызывающими деградацию ДНК (например 0,2 %-ный раствор ДП-2Т или аналогичный ему). Перед началом работ рабочую поверхность столов дополнительно обрабатывают 70 %-ным этиловым спиртом. Ежемесячно проводят профилактическую обработку рабочей поверхности столов и штативов lN соляной кислотой.
Во всех помещениях лаборатории ежедневно должна проводиться влажная уборка. Для каждого этапа проведения исследований должен быть выделен индивидуальный набор уборочного инвентаря. Уборочный инвентарь запрещается использовать для уборки других помещений.
Нормативные ссылки
1. Федеральный закон № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» от 30 марта 1999 г.
2. Федеральный закон № 2-ФЗ «О внесении изменений и дополнений в Закон Российской Федерации «О защите прав потребителей» и Кодекс РСФСР об административных правонарушениях» от 9 января 1996 г. (ред. от 30.12.01).
3. Федеральный закон № 29-ФЗ «О качестве и безопасности пищевых продуктов» от 02.01.00.
4. Федеральный закон № 86-ФЗ «О государственном регулировании в области генно-инженерной деятельности» от 05.06.96 (ред. от 12.07.00).
5. Федеральный закон № 96-ФЗ «О внесении изменений и дополнений в Федеральный закон о государственном регулировании в области генно-инженерной деятельности» от 21.06.00.
6. «Основы законодательства Российской Федерации об охране здоровья граждан» от 22 июля 1993 г. № 5487-1 (ред. от 30.06.03).
7. Положение о государственном санитарно-эпидемиологическом нормировании, утвержденное постановлением Правительства Российской Федерации № 554 от 24.07.00.
8. Положение о Государственной санитарно-эпидемиологической службе Российской Федерации, утвержденное постановлением Правительства Российской Федерации № 554 от 24.07.00.
9. Постановление Главного государственного санитарного врача Российской Федерации № 7 от 6 апреля 1999 г. «О порядке гигиенической оценки и регистрации пищевой продукции, полученной из генетически модифицированных источников».
10. Постановление Главного государственного санитарного врача Российской Федерации № 149 от 16.09.03 «О проведении микробиологической и молекулярно-генетической экспертизы генетически модифицированных микроорганизмов, используемых в производстве пищевых продуктов».
11. Гигиенические требования к безопасности и пищевой ценности пищевых продуктов. СанПиН 2.3.2.1078-01.
12. Постановление Главного государственного санитарного врача Российской Федерации от 08.11.00 № 14 «О порядке проведения санитарно-эпидемиологической экспертизы пищевой продукции, полученной из генетически модифицированных источников».
13. Приказ № 325 МЗ РФ от 15.08.01 (ред. от 18.03.02) «О санитарно-эпидемиологической экспертизе продукции» (зарегистрированный в МЮ РФ 19.10.01 № 2978).
Библиографические данные
1. Lipp М., Brodman P., Pietsch et al IUPAC Collaborative Trial Study of a Method to detect Genetically Modified Soy Beans and Maize in Dried Powder // Journal of АОAC International-1999. V. 82. № 4. P. 923-929.
2. Meyer R., Jaccaud E. Detection of genetically modified soya in processed food products: development and validation of a PCR assay for the specific detection of Glyphosate-Tolerant Soybeans. Proceedings of the EURO FOOD CHEM IX Conference, Interlaken, Switzerland, 1997/- Event № 220 (1). H. 23 - 28.
3. Zimmermann A., Liniger M., Luthy J. et al A sensitive detection method for genetically modified MaisGard TM corn using a nested- PCR system. Lebensm.-Wiss.U.-Technol. 1998. №31. P. 664 - 667.
4. Studer E., Dahinden I., Luthy J., Hubner P. Nachweis des gentechnisch veranderten «Maximizer» Mais mittels der Polymerase-Kettenreaktion (PCR) // Mitteilungen aus dem Ge-biet der Lebensmittel und Hygiene. 1997, 88, 515 - 524.
5. Jaccaud E., Honne M., Meyer R. Assessment of Screening Methods for the Identification of Genetically Modified Potatoes in Raw Materials and Finished Progucts//J.Agric. Food Chem. 2003, 51, 550 - 557.
6. Yap E.P.H., Lo Y.-M.O., K. A. Fleming K. A., McGee J.O'D. False-positives and Contamination in PCR. In: PCR Technology, Current Innovations. Ed. G.Griffin, A.M. Griffm, CRC Press, 1994).
Приложение 1
(обязательное)
Пример представления данных
электрофореза
по результатам идентификации рекомбинантной ДНК
(мишень - промотор 35S), продукт ПЦР - 195 пар нуклеотидов
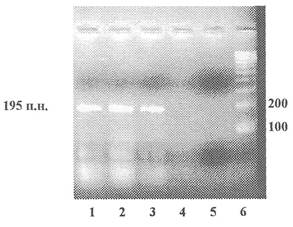
1 - Продукты ПЦР, полученные на препаратах ДНК из семян сои линии 40-3-2 (содержит промотор 35S)
2 - Продукты ПЦР, полученные на препаратах ДНК из концентрата белка семян сои линии 40-3-2 (содержит промотор 35S)
3 - Продукты ПЦР, полученные на препаратах ДНК из изолята белка семян сои линии 40-3-2 (содержит промотор 35S)
4 - Продукты ПЦР, полученные на препаратах ДНК из семян нетрансгенной сои
5 - Обязательный контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК
6 - Маркер молекулярной массы ДНК
Приложение 2
(обязательное)
Пример представления данных
электрофореза
по результатам идентификации рекомбинантной ДНК
(мишень - терминатор NOS), продукт ПЦР - 180 пар нуклеотидов
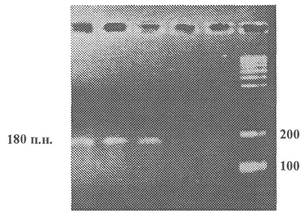
1 - Продукты ПЦР, полученные на препаратах ДНК из семян сои линии 40-3-2 (содержит терминатор NOS)
2 - Продукты ПЦР, полученные на препаратах ДНК из концентрата белка семян сои линии 40-3-2 (содержит терминатор NOS)
3 - Продукты ПЦР, полученные на препаратах ДНК из изолята белка семян сои линии 40-3-2 (содержит терминатор NOS)
4 - Продукты ПЦР, полученные на препаратах ДНК из семян нетрансгенной сои
5 - Обязательный контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК
6 - Маркер молекулярной массы ДНК
Приложение 3
(обязательное)
Пример представления данных
электрофореза
по результатам идентификации рекомбинантной ДНК,
характерной для генетической конструкции сои линии 40-3-2,
определяющей устойчивость к глифосату
продукт ПЦР - 169 пар нуклеотидов
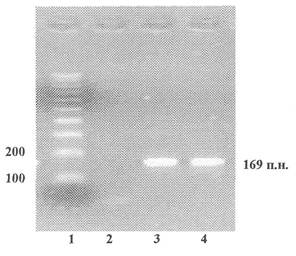
1 - Маркер молекулярной массы
2 - Продукты ПЦР, полученные на препаратах ДНК из семян нетрансгенной сои
3 - Продукты ПЦР, полученные на препаратах ДНК из семян сои линии 40-3-2
4 - Продукты ПЦР, полученные на препаратах ДНК из концентрата белка семян сои линии 40-3-2
Приложение 4
(обязательное)
Пример представления данных
электрофореза
по результатам идентификации рекомбинантной ДНК,
характерной для генетической конструкции кукурузы линии MON 810,
устойчивой к стеблевому мотыльку продукт ПЦР - 149 пар нуклеотидов
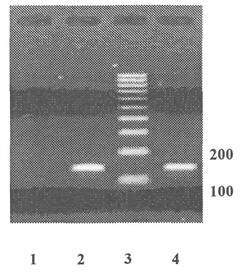
1 - Продукты ПЦР, полученные на препаратах ДНК из семян нетрансгенной кукурузы
2 - Продукты ПЦР, полученные на препаратах ДНК из кукурузы линии M0N 810
3 - Маркер молекулярной массы
4 - Продукты ПЦР, полученные на препаратах ДНК из кукурузы линии MON 810
Приложение 5
(обязательное)
Пример представления данных
электрофореза
по результатам идентификации рекомбинантной ДНК,
характерной для генетической конструкции кукурузы линии Bt-176
продукт ПЦР - 189 пар нуклеотидов
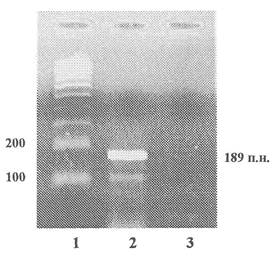
1 - Маркер молекулярной массы
2 - Продукты ПЦР, полученные на препаратах ДНК из кукурузы линии Bt-176
3 - Продукты ПЦР, полученные на препаратах ДНК из семян нетрансгенной кукурузы
Приложение 6
(обязательное)
Пример представления данных
электрофореза
по результатам идентификации рекомбинантной ДНК,
характерной для генетической конструкции картофеля, устойчивого
к колорадскому жуку продукт ПЦР - 102 пары нуклеотидов
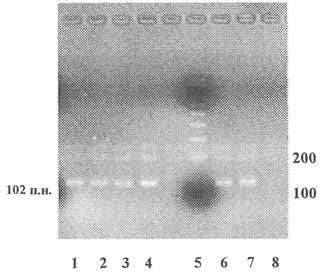
1 - 4; 6, 7 - Продукты ПНР, полученные на препаратах ДНК из сортов картофеля, устойчивого к колорадскому жуку (ген cry III A)
5 - Маркер молекулярной массы
8 - Продукты ПЦР, полученные на препаратах ДНК из клубней нетрансгенного картофеля
Приложение 7
(обязательное)
Пример представления данных
электрофореза
по результатам идентификации ДНК сои (ген лектин)
продукт ПЦР - 118 пар нуклеотидов
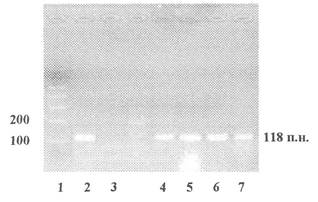
1 - Маркер молекулярной массы
2 - Продукты ПЦР, полученные на препаратах ДНК из семян нетрансгенной сои
3 - Контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК
4 - 7 - Продукты ПЦР, полученные на препаратах ДНК из продуктов переработки сои
Приложение 8
(обязательное)
Пример представления данных
электрофореза
по результатам идентификации ДНК кукурузы (ген зеин)
продукт ПЦР - 329 пар нуклеотидов
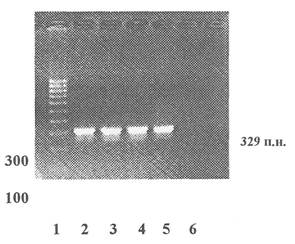
1 - Маркер молекулярной массы
2 - 5 - Продукты ПЦР, полученные на препаратах ДНК из семян нетрансгенной кукурузы
6 - Контроль качества реакционной смеси - ПЦР в отсутствие матричной ДНК
Приложение 9
(необязательное)
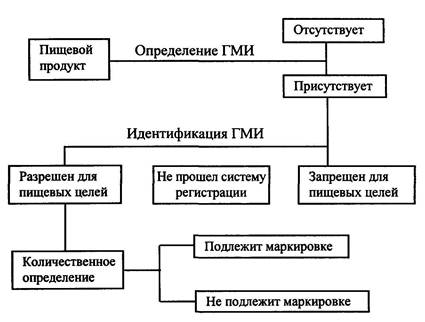
Схема идентификации ГМИ в пищевых продуктах
Приложение 10
(необязательное)
Метод выделения ДНК с
применением технологии Wizard, Promega
с применением набора реактивов Promega
Подготовка пробы (раствора ДНК).
• Навеску исследуемого продукта массой 150 - 200 мг поместить в микроцентрифужную пробирку типа Эппендорф вместимостью 1,5 мл.
• Добавить 300 мкл буфера I, тщательно растереть пробу в пробирке пестиком до гомогенного состояния.
• Добавить 500 мкл буфера II, перемешать на аппарате для встряхивания типа «Вортекс».
• Инкубировать при 65 °С 40 - 60 мин, перемешать на аппарате для встряхивания, охладить до комнатной температуры.
• Добавить 500 мкл буфера III, перемешать на аппарате для встряхивания типа «Вортекс» в течение 2 мин.
• Центрифугировать 7 мин на настольной микроцентрифуге типа Эппендорф при частоте вращения 13000 об./мин.
• Перенести 1000 мкл супернатанта в чистую пробирку типа Эппендорф вместимостью 1,5 мл.
• Добавить 500 мкл смолы Wizard MaxiPreps.
• Перемешать на аппарате для встряхивания типа «Вортекс».
• При помощи стерильного шприца емкостью 2 мл прокачать смесь через микроцентрифужную колонку.
• Новым стерильным шприцем емкостью 2 мл прокачать через микроцентрифужную колонку 2 мл промывочного буфера.
• Поместить микроколонку в микроцентрифужную пробирку типа Эппендорф вместимостью 1,5 мл.
• Центрифугировать 1 мин при частоте вращения 12000 об./мин.
• Поместить микроколонку в чистую микроцентрифужную пробирку типа Эппендорф вместимостью 1,5 мл.
• Добавить в колонку 100 мкл деионизованной воды.
• Центрифугировать 1 мин при частоте вращения 12000 об./мин.
• Полученный раствор ДНК готов для проведения ПЦР, хранить при минус 20 °С.