ГОСУДАРСТВЕННОЕ САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКОЕ НОРМИРОВАНИЕ РОССИЙСКОЙ ФЕДЕРАЦИИ
4.3. МЕТОДЫ КОНТРОЛЯ. ФИЗИЧЕСКИЕ ФАКТОРЫ
САНИТАРНО-ВИРУСОЛОГИЧЕСКИЙ КОНТРОЛЬ
ЭФФЕКТИВНОСТИ ОБЕЗЗАРАЖИВАНИЯ
ПИТЬЕВЫХ И СТОЧНЫХ ВОД УФ-ОБЛУЧЕНИЕМ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
МУК 4.3.2030-05
МОСКВА - 2006
1. Разработаны: ГУ НИИ экологии человека и гигиены окружающей среды им. А.Н. Сысина РАМН (А.Е. Недачин, Р.А. Дмитриева, Т.В. Доскина, Д.В. Лаврова, А.Г. Санамян); ГУ Центральный НИИ эпидемиологии Роспотребнадзора (Г.А. Шипулин); Московской медицинской академией им. И.М. Сеченова (М.В. Богданов).
Методические указания подготовлены с учетом замечаний и предложений Главного эксперта Комиссии по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека член-корр. РАМН Л.В. Урываева.
2. Рекомендованы к утверждению Комиссией по государственному санитарно-гигиеническому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека 6 октября 2005 г. (протокол № 3).
3. Утверждены и введены в действие Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 2005 г.
4. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации Г.Г. Онищенко 18 ноября 2005 г. Дата введения: с момента утверждения |
4.3. МЕТОДЫ КОНТРОЛЯ. ФИЗИЧЕСКИЕ ФАКТОРЫ
Санитарно-вирусологический контроль эффективности обеззараживания питьевых и сточных вод УФ-облучением
Методические указания
МУК 4.3.2030-05
1. Область применения
1.1. Методические указания устанавливают требования к организации и осуществлению санитарно-эпидемиологического надзора обеззараживания питьевых и сточных вод УФ-облучением в отношении вирусного загрязнения.
1.2. Методические указания предназначены для органов и учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, осуществляющих государственный санитарно-эпидемиологический надзор (контроль) за обеззараживанием питьевых и сточных вод, а также могут использоваться организациями, деятельность которых связана с проектированием и эксплуатацией УФ-установок.
2. Основные положения
2.1. Вода является важнейшим фактором риска в распространении вирусных инфекций. Более ста различных вирусов, которые с выделениями больных попадают в водные объекты, могут вызывать у человека заболевания разной тяжести - полиомиелит, гепатиты А и Е, серозные менингиты, миокардиты, гастроэнтериты и др. (прилож. 5).
2.2. Значительное количество вспышек кишечных вирусных инфекций, в т.ч. ротавирусных, гепатитов А и Е, обусловлено употреблением недостаточно очищенной или загрязненной воды.
2.3. Концентрация кишечных вирусов в воде колеблется в зависимости от эпидемической обстановки, эффективности очистки и обеззараживания сточных вод и может варьировать от тысяч до десятков тысяч вирионов в литре неочищенной сточной воды и от сотен до тысяч в литре воды поверхностных водоемов в сезон подъема заболеваемости кишечными вирусными инфекциями. В воде водных объектов вирусы могут длительно сохранять свою инфекционную активность (прилож. 5).
2.4. Сроки выживания вирусов в воде зависят от таких факторов, как температура, pH воды, присутствие органических веществ и др. В сильно загрязненных и очень чистых водах длительность сохранения инфекционной активности кишечных вирусов увеличивается. В силу высокой устойчивости в водных объектах, кишечные вирусы могут распространяться на значительные расстояния от источников загрязнения.
2.5. Присутствие вирусов в питьевой воде является чрезвычайно высоким фактором риска, поскольку попадание одной или нескольких вирусных частиц в кишечник человека способно вызвать заболевание.
2.6. При наличии неорганизованных сбросов бытовых сточных вод вирусы обнаруживаются в подземных водоисточниках, в воде которых выживаемость и инфекционная активность энтеровирусов выше по сравнению с поверхностными водоемами.
2.7. Эпидемические вспышки кишечных вирусных инфекций могут наблюдаться в любое время года, однако для большинства инфекций характерна определенная сезонность. Для вирусного гепатита А рост заболеваемости начинается в июле-августе и достигает максимума в октябре-ноябре с последующим снижением в первой половине очередного года. Сезонность вирусного гепатита Е выражена нечетко, вспышки и спорадические случаи могут возникать постоянно в течение года.
2.8. Широкое распространение на всех территориях имеет ротавирусная инфекция. Эпидемический процесс при ротавирусной инфекции характеризуется выраженной зимне-весенней сезонностью, высокой контагиозностью и очаговостью, локальностью домашних очагов, наличием бессимптомного выделения вируса.
2.9. Циркуляция энтеровирусов среди населения имеет выраженную летне-осеннюю сезонность, что коррелирует с их содержанием в сточных водах. Так, максимальное количество штаммов энтеровирусов (32 - 60 %) определяется в августе, сентябре и октябре, минимальное (до 10 %) - в весенние месяцы (апрель - май).
2.10. Этапы осветления и обесцвечивания воды на водопроводных сооружениях централизованных систем питьевого водоснабжения не обеспечивают полного удаления вирусов. Эффект задержки ДНК-содержащих колифагов составляет 97 - 99 %, а полиовируса - 83 - 93 % в сравнении с концентрацией в исходной воде. В этой связи необходимо обеззараживание питьевой воды, обеспечивающее 100 %-ю инактивацию вирусов.
2.11. Частота выделения вирусов из неочищенных сточных вод может составлять 90 - 100 % от количества исследованных проб при концентрации колифагов до 10000 БОЕ/100 мл исследуемой воды. После механической очистки частота выделения вирусов может незначительно возрастать за счет дезагрегирования крупных конгломератов и реадсорбции вирусов.
2.12. После этапа биологической очистки на станциях аэрации частота выделения энтеровирусов обычно снижается до 40 %, при этом вирусы удаляются на 75 % и ДНК-содержащие колифаги - на 90 %.
2.13. Этап доочистки на песчаных фильтрах позволяет снизить количество вирусов и колифагов на 98 %, что определяет необходимость обеззараживания сточных вод даже после глубокой очистки до нормативных показателей, регламентируемых СанПиН 2.1.5.980-00 «Гигиенические требования к охране поверхностных вод» (количество колифагов в очищенной и обеззараженной сточной воде при отведении в поверхностные водоемы не должно превышать 100 БОЕ/100 мл).
3. Технологические и гигиенические критерии использования УФ-облучения для обеззараживания питьевых и сточных вод
3.1. Для обеззараживания природных и сточных вод используют биологически активную область спектра УФ-облучения с длиной волны от 205 до 315 нм, называемую бактерицидным излучением.
3.2. Максимум вирулицидного действия приходится на область спектра 250 - 270 нм. Наибольший коэффициент полезного действия в области коротковолнового излучения имеют лампы низкого давления. В лампах этого типа до 95 % электрической энергии преобразуется в излучение с длиной волны 254 нм.
3.3. Механизм обеззараживания УФ-облучения основан на повреждении молекул ДНК и РНК вирусов. Фотохимическое воздействие предполагает разрыв или изменение химических связей органической молекулы в результате поглощения энергии фотона. Имеют место также вторичные процессы, в основе которых лежит образование в воде под действием УФ-облучения свободных радикалов, которые усиливают вирулицидный эффект.
3.4. Степень инактивации микроорганизмов под действием УФ-облучения пропорциональна интенсивности излучения (мВт/см2) и времени облучения (с). Произведение интенсивности излучения и времени называется дозой облучения (мДж/см2) и является мерой вирулицидной энергии.
3.5. Основными факторами, влияющими на эффективность обеззараживания природных и сточных вод УФ-облучением, являются:
• чувствительность различных вирусов к действию УФ-облучения;
• мощность лампы;
• степень поглощения УФ-облучения водной средой;
• уровень взвешенных веществ в обеззараживаемой воде.
3.6. Различные виды вирусов при одинаковых условиях облучения различают по степени чувствительности к УФ-облучению. Дозы облучения, необходимые для инактивации отдельных видов вирусов на 99,0 - 99,9 %, приведены в прилож. 6.
3.7. Лампы низкого давления имеют электрическую мощность 2 - 200 вт и рабочую температуру 40 - 150 °С. В лампах этого типа 30 - 95 % электрической энергии преобразуется в биоцидное излучение с длиной волны 254 нм. Срок службы ламп низкого давления составляет до 15 тыс. ч.
3.8. Лампы высокого давления обладают широким спектром излучения, имеют мощность 50 - 10000 вт при рабочей температуре 600 - 800 °С. Они характеризуются относительно низким коэффициентом полезного действия в биоцидном диапазоне (5 - 10 % от потребляемой электрической энергии).
3.9. Проникновение ультрафиолетовых лучей в воду сопровождается их поглощением как самой водой, так и веществами, находящимися в растворенном и взвешенном состоянии. Степень поглощения определяется физико-химическими свойствами обрабатываемой воды, а также толщиной её слоя. Коэффициенты поглощения УФ природными и сточными водами колеблются в пределах от 0,2 до 0,7. Коэффициенты поглощения УФ питьевой водой, полученной из подземных источников водоснабжения, имеют значения 0,05 - 0,20, а из поверхностных - 0,15 - 0,30. Наибольшее влияние на интенсивность поглощения биоцидной энергии оказывают цветность, мутность воды и содержание в ней железа.
3.10. С целью достижения гигиенической надежности, наименьших эксплуатационных и экономических затрат, обеззараживание питьевых, природных и сточных вод необходимо проводить при соответствии их качества параметрам, представленным в табл. 1. В случае превышения допустимых характеристик воды, представленных в табл. 1, хотя бы по одному из показателей, требуется проведение дополнительных санитарно-вирусологических исследований с целью обеспечения эффективного обеззараживания воды в отношении вирусов и выявления величины рабочей дозы облучения для конкретных условий. Необходимую дозу облучения рекомендуется определять по степени инактивации колифагов как индикаторов вирусного загрязнения.
Таблица 1
Дозы УФ-облучения в зависимости от качества обрабатываемой воды
|
Показатели |
Допустимые уровни |
Доза УФ-облучения |
|
|
Вода из подземных источников I класса (по ГОСТ 2161-84), питьевая вода |
16 мДж/см2 |
||
|
1 |
Мутность, мг/дм3 |
1,5 |
|
|
2 |
Цветность, градусы |
20,0 |
|
|
3 |
Железо, мг/дм3 |
0,3 |
|
|
4 |
Марганец, мг/дм3 |
0,1 |
|
|
5 |
Колифаги, БОЕ/100 мл* |
10,0 |
|
|
Вода из подземных источников II, III класса (по ГОСТ 2161-84) и поверхностных источников |
25 мДж/см2 |
||
|
1 |
Мутность, мг/дм3 |
30,0 |
|
|
2 |
Цветность, градусы |
50,0 |
|
|
3 |
Железо, мг/дм3 |
5,0 |
|
|
4 |
Марганец, мг/дм3 |
1,5 |
|
|
5 |
Колифаги, БОЕ/100 мл* |
100,0 |
|
|
Бытовые и городские сточные воды |
30 мДж/см2 |
||
|
1 |
Взвешенные вещества, мг/дм3 |
10,0 |
|
|
2 |
БПК5, мг O2/дм3 |
10,0 |
|
|
3 |
ХПК, мг O2/дм3 |
50,0 |
|
|
4 |
Колифаги, БОЕ/ 100 мл* |
104 |
|
|
* колифаги выделяют без концентрирования. |
|||
3.11. Выбор дозы УФ-облучения определяют характером и качеством воды, поступающей для обеззараживания: не менее 16 мДж/см2 для воды из подземных источников I класса и питьевых вод; не менее 25 мДж/см2 для воды из подземных источников II, III класса и поверхностных источников; не менее 30 мДж/см2 для бытовых и городских сточных вод; не менее 40 мДж/см2 для любого типа вод при неблагоприятной эпидемической ситуации. Под неблагоприятной эпидемической ситуацией подразумевают систематическое обнаружение колифагов в питьевой воде и энтеровирусов в источнике и питьевой воде и (или) наличие водных вспышек энтеровирусных заболеваний.
3.12. При УФ-облучении воды не существует проблемы передозировки. Повышение дозы не приводит к гигиенически значимым неблагоприятным изменениям свойств воды и образованию побочных продуктов.
3.13. В случае ухудшения эпидемической ситуации, возникновения угрозы появления в источнике водоснабжения высокой концентрации энтеровирусов либо другой чрезвычайной ситуации, доза УФ-облучения может быть увеличена за счет снижения объема обрабатываемой воды, проходящей через единицу времени через УФ-оборудование путем включения в работу резервного оборудования или снижения общего расхода воды. Доза УФ-облучения должна находиться в прямой зависимости от расхода обрабатываемой воды.
3.14. Совместное применение УФ-облучения и хлора при подготовке питьевой воды повышает надежность обеззараживания в отношении вирусов.
3.15. Технические и технологические требования к оборудованию, применяемому для обеззараживания природных и питьевых вод, должны соответствовать МУ 2.1.4.719-98 «Санитарный надзор за применением УФ-излучения в технологии подготовки питьевой воды» и применяемым для обеззараживания сточных вод МУ 2.1.5.732-99 «Санитарно-эпидемиологический надзор за обеззараживанием сточных вод УФ-излучением».
4. Контроль эффективности обеззараживания воды УФ-облучением в отношении вирусного загрязнения
4.1. Контроль эффективности УФ-облучения для обеззараживания воды осуществляют при ее использовании населением в питьевых, хозяйственно-бытовых и рекреационных целях, сбросе очищенной сточной воды в поверхностные водоемы. При этом необходимо учитывать, что содержание и частота выделения кишечных вирусов из водных объектов и питьевой воды может значительно различаться, что определяется:
• сезонностью распространения различных групп вирусов в течение года;
• санитарно-гигиенической и эпидемической ситуацией (наличие «факторов предшественников») в верхних участках водотока;
• изменением или нарушением технологии очистки и обеззараживания питьевых и сточных вод;
• авариями на водопроводных или канализационных очистных станциях;
• возникновением вспышки или эпидемии вирусных инфекций водного происхождения на данной территории.
4.2. Индикатором вирусного загрязнения воды являются колифаги. Несоответствие характеристик обеззараженной воды допустимым уровням колифагов свидетельствует о возможном присутствии энтеровирусов в данной пробе. В этом случае организуют повторный отбор и анализ проб до и после обеззараживания УФ-облучением. При наличии колифагов в трехкратно последовательно отобранных пробах после УФ-облучения воду анализируют на наличие энтеровирусов.
4.3. Объемы воды для определения эффективности обеззараживания должны соответствовать критериям эпидемиологической безопасности по вирусологическим показателям (прилож. 2).
4.4. В системе государственного санитарно-эпидемиологического надзора используют следующие виды санитарно-вирусологического контроля: производственный, плановый и внеплановый.
4.4.1. Производственный санитарно-вирусологический контроль выполняют организации, в ведении которых находятся очистные и водопроводные сооружения. При отсутствии в организации производственной лаборатории, исследования осуществляют на договорной основе лабораториями, аккредитованными в установленном законодательством Российской Федерации порядке.
Программа производственного лабораторного контроля за эффективностью обеззараживания воды УФ-облучением должна быть согласована с территориальным управлением Роспотребнадзора. При разработке программы следует использовать рекомендации, представленные в прилож. 4.
Производственный санитарно-вирусологический контроль эффективности УФ-установок проводят:
• на этапе пуско-наладочных работ при внедрении на станциях очистки питьевых и сточных вод обеззараживания с использованием УФ-установок - на наличие и уровень колифагов в воде до и после установки;
• в процессе эксплуатации УФ-установок в соответствии с рабочей программой (рекомендуемая частота отбора проб в соответствии с прилож. 4) - на наличие колифагов;
• при превышении норматива мутности для питьевой воды - на наличие колифагов;
• при превышении норматива колифагов в трех последовательно отобранных пробах воды - на наличие энтеровирусов.
4.4.2. Плановый санитарно-вирусологический контроль осуществляют органы и учреждения Роспотребнадзора в соответствии с разработанной рабочей программой. Периодичность контроля определяют задачами региональных планов и корректируют в зависимости от эпидемической ситуации на территории.
4.4.3. Внеплановый санитарно-вирусологический контроль проводят органы и учреждения Роспотребнадзора в случае внезапных или непредвиденных изменений санитарно-эпидемической ситуации на контролируемой территории: аварий или нарушений в системах водоснабжения и канализации, в результате которых может произойти массивное микробное загрязнение поверхностных и подземных водоисточников, а также питьевой воды; по санитарно-эпидемиологическим показаниям при вспышках и подъеме заболеваемости кишечными вирусными инфекциями, уровень которых превышает средние сезонные показатели; в период эпидемического риска. Кратность и точки отбора проб, объемы исследуемой воды определяют эпидемиолог и врач по коммунальной гигиене.
5. Комплексная схема санитарно-вирусологического контроля воды при использовании для обеззараживания УФ-облучения
5.1. Санитарно-вирусологическую оценку воды водных объектов проводят по косвенным показателям вирусного загрязнения - ДНК- и РНК-содержащим колифагам, РНК или ДНК вирусов, определяемых методом ОТ-ПЦР, а также прямому обнаружению возбудителей кишечных вирусных инфекций культуральным методом.
5.2. Современные стандартные методы индикации колифагов позволяют выделять их:
из сточных вод при посеве 1 мл из исследуемой пробы или последовательных десятикратных разведений;
из поверхностных и питьевых вод при посеве от 10 до 100 мл в соответствии с нормативно-методическими документами.
5.3. Для прямого обнаружения энтеровирусов в воде, в которой они могут содержаться в незначительных количествах, требуется применение методов концентрирования вирусов из больших объемов воды в связи с тем, что нижний предел чувствительности используемых культур тканей составляет не менее 1 инфекционной вирусной частицы в 1 мл воды.
5.4. Отбор проб воды производят в специально предназначенную для этих целей одноразовую посуду или стерильные емкости многократного применения, изготовленные из материалов, не влияющих на жизнедеятельность вирусов с плотно закрывающимися пробками (силиконовыми, резиновыми или из других материалов) и защитным колпачком (из алюминиевой фольги или плотной бумаги). Емкость открывают непосредственно перед отбором, удаляя пробку вместе со стерильным колпачком. Во время отбора пробка и края емкости не должны чего-либо касаться.
5.5. При исследовании воды из распределительных сетей отбор проб из крана производят после его предварительной стерилизации обжиганием и последующего спуска воды не менее 10 мин при полностью открытом кране. При отборе пробы напор воды может быть уменьшен. Пробу отбирают непосредственно из крана без резиновых шлангов, водораспределительных сеток и других насадок. Если через кран вода течет постоянно, отбор проб производят без предварительного обжига, не изменяя напора воды и существующей конструкции (при наличии силиконовых или резиновых шлангов). После наполнения емкость закрывают стерильной пробкой и колпачком.
5.6. Отобранную пробу маркируют и сопровождают актом отбора проб воды с указанием места, даты, времени забора и другой необходимой информации.
К исследованию проб воды необходимо приступить сразу же после доставки их в лабораторию.
При исследовании воды на наличие вирусов проводят их концентрирование из соответствующих объемов, а на наличие колифагов - прямое определение сразу после доставки проб в лабораторию.
5.7. Для концентрирования вирусов используют методы, изложенные в МУК 4.2.2029-05 «Санитарно-вирусологический контроль водных объектов». Полученные после концентрирования элюаты до заражения культуры ткани или для исследования методами ОТ-ПЦР и ПЦР можно хранить при 4 °C не более 3 суток или при -20 °C - в течение года. При многократных исследованиях элюаты делят на несколько порций, чтобы избежать повторного замораживания.
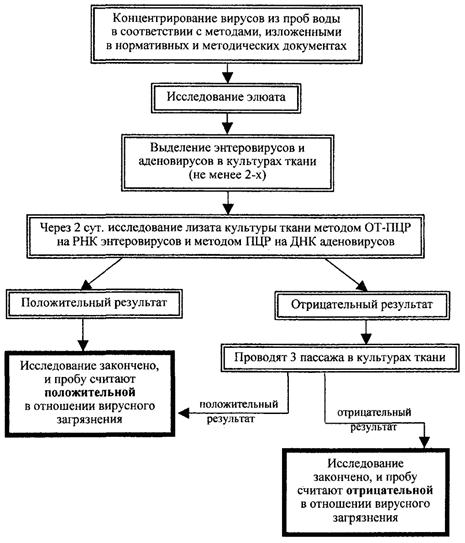
5.8. Исследование проб воды поверхностных и подземных водоисточников и сточных вод до обеззараживания УФ-облучением проводят по схеме, указанной в прилож. 3 путем анализа воды методом ОТ-ПЦР для обнаружения РНК энтеровирусов, ротавирусов и вируса гепатита А (ВГА) и методом ПЦР - для обнаружения ДНК аденовирусов. Полученный результат оценивают как предварительный, требующий подтверждения путем биологического исследования пробы (определение «жизнеспособности» вируса) в культуре ткани, после чего лизаты двух типов зараженных клеток (через двое суток после заражения) вновь подвергают анализу методами ОТ-ПЦР или ПЦР. При отрицательном результате проводят три последовательных «слепых» пассажа на культуре ткани.
5.9. Пробы воды до УФ-обеззараживания считают положительными при наличии:
РНК энтеровирусов, обнаруженной методами ОТ-ПЦР и ДНК аденовирусов - методом ПЦР в лизатах культур тканей через двое суток после заражения;
ЦПД на культурах тканей в одном из трех последовательных пассажей.
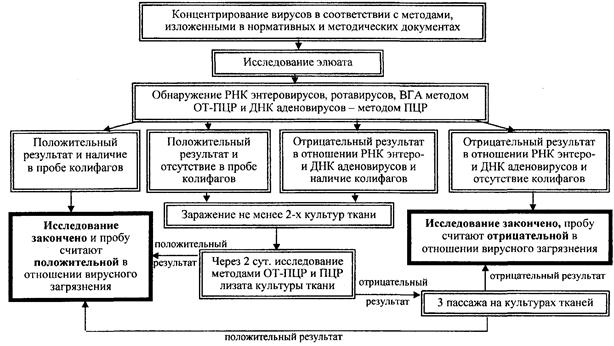
5.10. Анализ проб воды после УФ-облучения проводят по схеме, указанной в прилож. 6. Пробы воды исследуют на наличие колифагов, методом ОТ-ПЦР на наличие РНК энтеровирусов, ротавирусов и ВГА и методом ПЦР на наличие ДНК аденовирусов. Полученный на этом этапе результат считают положительным, если в пробе содержатся колифаги и РНК энтеровирусов или ротавирусов или ВГА или ДНК аденовирусов. При отсутствии в пробе колифагов и наличии РНК или ДНК вирусов или при наличии колифагов и отсутствии РНК и ДНК вирусов проводят заражение не менее двух видов культур тканей и через двое суток после заражения проводят исследование методом ОТ-ПЦР лизата зараженных культур с целью обнаружения «жизнеспособных» энтеровирусов. При отрицательных результатах анализа проводят три последовательных «слепых» пассажа с целью выделения энтеро- или аденовирусов.
6. Библиографические данные
1. Федеральный закон от 30 марта 1999 г. № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
2. Федеральный закон от 19 декабря 1991 г. № 96-ФЗ «Об охране окружающей среды».
3. Федеральный закон от 25 сентября 1998 г. № 158-ФЗ «О лицензировании отдельных видов деятельности».
4. Водный кодекс Российской Федерации от 16 ноября 1995 г. № 167-ФЗ.
5. «Положение о Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека», утвержденное постановлением Правительства Российской Федерации от 30 июня 2004 г. № 322.
6. СанПиН 2.1.4.1074-01 «Вода питьевая. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества».
7. СанПиН 2.1.5.980-00 «Гигиенические требования к охране поверхностных вод».
8. СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников».
9. СанПиН 2.1.2.1188-03 «Плавательные бассейны. Гигиенические требования к устройству, эксплуатации и качеству воды. Контроль качества».
10. ГОСТ 2761-84 «Вода питьевая».
11. МУ 2.1.4.719-98 «Санитарный надзор за применением ультрафиолетового излучения в технологии подготовки питьевой воды».
12. МУ 2.1.5.732-99 «Санитарно-эпидемиологический надзор за обеззараживанием сточных вод УФ-излучением».
13. МУ 4.2.1018-01 «Методы санитарно-микробиологического анализа питьевой воды».
14. МУ 2.1.5.800-99 «Организация госсанэпиднадзора за обеззараживанием сточных вод».
15. МУ 1.3.1888-04 «Организация работы при исследовании методом ПЦР материала, инфицированного патогенными биологическими агентами III - IV групп патогенности».
16. МУК 4.2.1884-04 «Санитарно-микробиологический и санитарно-паразитологический анализ воды поверхностных водных объектов».
17. МУК 4.2.2029-05 «Санитарно-вирусологический контроль водных объектов».
18. MP «Метод сбора и концентрирования кишечных вирусов из воды с помощью водопроницаемых пакетов с адсорбентом», 2000.
19. «Методические рекомендации по проведению работ в диагностических лабораториях, использующих метод полимеразной цепной реакции», утв. Государственным комитетом санитарно-эпидемиологического надзора Российской Федерации 22 июня 1995 г.
20. Инструкция по использованию полимеразной цепной реакции для выявления энтеровирусного загрязнения воды. Минск, 2001.
21. Методики по санитарно-вирусологическому контролю питьевой воды и оценке её эпидемической безопасности от 18 мая 1999 г. № 136-9811, Минск.
22. Инструкция по осуществлению санитарно-вирусологического мониторинга питьевых вод в Республике Беларусь от 11 ноября 2000 г. № 138-0010, Минск.
23. Рекомендации по надзору за вирусом полиомиелита в окружающей среде. Женева, 2003.
Список сокращений
УФ-облучение - ультрафиолетовое облучение;
ДНК - дезоксирибонуклеиновая кислота;
РНК - рибонуклеиновая кислота;
мДж/см2 - миллиджоуль на см2;
ПЦР - полимеразная цепная реакция;
ОТ-ПЦР - полимеразная цепная реакция с этапом обратной транскрипции;
ФМНЦ - фильтрующая мембрана из нитроцеллюлозы;
ММК - мембрана микропористая капроновая;
ВГА - вирус гепатита А;
БОЕ - бляшкообразующая единица;
БПК - биохимическое потребление кислорода;
ХПК - химическое потребление кислорода;
ЦПД - цитопатическое действие.
Приложение 1
(обязательное)
Вирусологические критерии эпидемиологической безопасности воды различных водных объектов
|
№ |
Водные объекты |
Нормативные и методические документы |
Нормативные уровни вирусологических показателей |
|
|
колифаги в БОЕ* |
отсутст. вирусов в объемах вод** |
|||
|
1 |
Вода питьевая: |
|||
|
- водопроводная |
отсутствие в 100 мл |
10 л |
||
|
- из нецентрализованных источников |
отсутствие в 100 мл |
10 л |
||
|
2 |
Вода бассейнов |
отсутствие в 100 мл |
10 л |
|
|
3 |
Вода подземных водоисточников |
отсутствие в 100 мл (1,2 классы), не более 10 БОЕ/100 мл (3 класс) |
10 л |
|
|
4 |
Вода поверхностных водоисточников |
не более 10 БОЕ/100 мл (1, 2 классы), не более 50 БОЕ/100 мл (3 класс) |
10 л |
|
|
5 |
Сточные воды: - неочищенные |
не более 100 БОЕ/1000 мл |
1 л |
|
|
- очищенные |
не более 100 БОЕ/100 мл |
1 л |
||
|
- очищенные и обеззараженные |
По предписанию должностных лиц, осуществляющих государственный санитарно-эпидемиологический надзор |
не более 100 БОЕ/100 мл |
1 л |
|
|
* Выделение колифагов из указанных объемов проводят без предварительного концентрирования. ** Для титрования энтеровирусов используют элюаты после концентрирования исследуемого объема воды одним из методов в соответствии с методическими указаниями МУК 4.2.1884-04 «Санитарно-микробиологический и санитарно-паразитологический анализ воды поверхностных водных объектов». |
||||
Приложение 2
(обязательное)
Схема вирусологического контроля воды поверхностных и подземных водоисточников и сточных вод до обеззараживания УФ-облучением
Приложение 3
(обязательное)
Схема вирусологического контроля воды после обеззараживания УФ-обработкой
Приложение 4
(рекомендуемое)
Периодичность производственного санитарно-вирусологического контроля при обеззараживании УФ-облучением питьевой и сточной воды
|
Вид водного объекта |
Периодичность исследований на наличие: |
|
|
колифагов |
энтеровирусов |
|
|
Вода: |
||
|
- питьевая; |
1 раз в сутки; |
1 раз в квартал; |
|
- из подземных источников |
1 раз в сутки; |
1 раз в квартал; |
|
- плавательных бассейнов |
2 раза в месяц |
1 раз в квартал |
|
Вода поверхностных источников водоснабжения; рекреационные воды. |
1 раз в неделю |
1 раз в квартал |
|
Сточные воды: - после очистки и обеззараживания при сбросе в водоём: |
||
|
а) > 100 тм3/сут. |
1 раз в неделю; |
1 раз в квартал; |
|
б) < 100 тм3/сут. |
1 раз в неделю |
1 раз в квартал |
Приложение 5
(справочное)
Заболевания, вызываемые вирусами, выделяемыми из водных объектов
|
Группа вирусов |
Количество типов |
Заболевания и симптомы, вызываемые вирусами |
Максимальные сроки сохранения инфекционной активности вирусов в воде (питьевой, поверхностных водоисточников, в сточных водах) |
|
|
Энтеровирусы |
Полиовирусы |
3 |
Полиомиелит, менингит, лихорадки |
Более 3-х месяцев |
|
Вирусы Коксаки А |
24 |
Менингит, плевродиния, герпетическая ангина, заболевания органов дыхания |
До года |
|
|
Вирусы Коксаки В |
6 |
Менингит, миокардит, врожденные пороки сердца, заболевания органов дыхания |
До 3-х месяцев |
|
|
Вирусы ECHO |
34 |
Менингит, диарея, полиомиелитные заболевания, заболевания органов дыхания |
Не менее 6 месяцев |
|
|
Энтеровирусы 68-71 |
4 |
Менингит, энцефалит, геморрагический конъюнктивит, заболевания органов дыхания |
Более 3-х месяцев |
|
|
Вирус гепатита А |
1 |
Гепатит |
До 10 месяцев |
|
|
Вирус гепатита Е |
1 |
Гепатит |
Нет данных |
|
|
Ротавирусы |
1 |
Гастроэнтериты |
Более месяца |
|
|
Реовирусы |
3 |
Гастроэнтериты, менингиты, энцефалиты |
6 - 12 месяцев |
|
|
Аденовирусы |
> 32 |
Гастроэнтериты, конъюнктивит, заболевания органов дыхания |
Более 2-х месяцев |
|
|
Коронавирусы |
3 |
Гастроэнтериты, заболевания органов дыхания |
Нет данных |
|
|
Калицивирусы |
2 |
Гастроэнтериты |
Нет данных |
|
|
Вирусы группы Норволк |
1 |
Гастроэнтериты |
Нет данных |
|
|
Астровирусы |
1 |
Гастроэнтериты |
Нет данных |
|
Приложение 6
(справочное)
Доза УФ-облучения, необходимая для инактивации на 99,0 - 99,9 % различных видов вирусов (данные литературы)
|
№ |
Вид вирусов |
Доза облучения, мДж/см2 |
|
1 |
Аденовирус III типа |
4,5 |
|
2 |
Колифаги |
6,6 - 8,1 - 25 |
|
3 |
Коксаки |
6,3 |
|
4 |
Вирус гепатита А |
8,0 - 11,0 |
|
5 |
Полиовирус |
16 - 25 |