

 ГОСТ Р 56894-2016
ГОСТ Р 56894-2016
Сводный комплект технической документации для демонстрации соответствия общим принципам обеспечения безопасности и основных функциональных характеристик медицинских изделий для диагностики in vitro
| Обозначение: |   ГОСТ Р 56894-2016 ГОСТ Р 56894-2016 |
| Обозначение англ: |   GOST R 56894-2016 GOST R 56894-2016 |
| Статус: | введен впервые |
| Название рус.: | Сводный комплект технической документации для демонстрации соответствия общим принципам обеспечения безопасности и основных функциональных характеристик медицинских изделий для диагностики in vitro |
| Название англ.: | Summary technical documentation for demonstrating conformity to the essential principles of safety and performance of in vitro diagnostic medical devices |
| Дата добавления в базу: | 01.02.2017 |
| Дата актуализации: | 01.01.2021 |
| Дата введения: | 01.03.2017 |
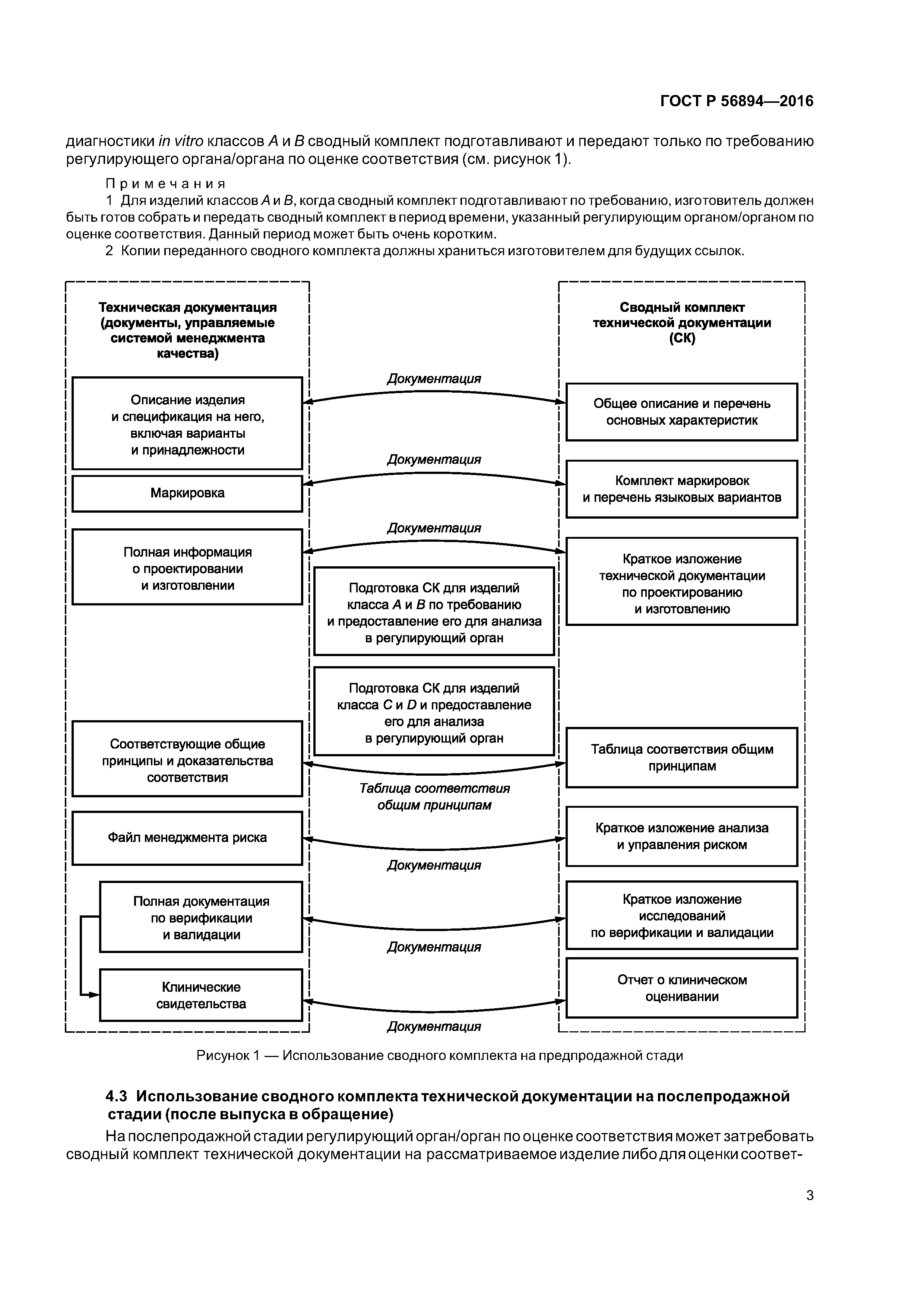
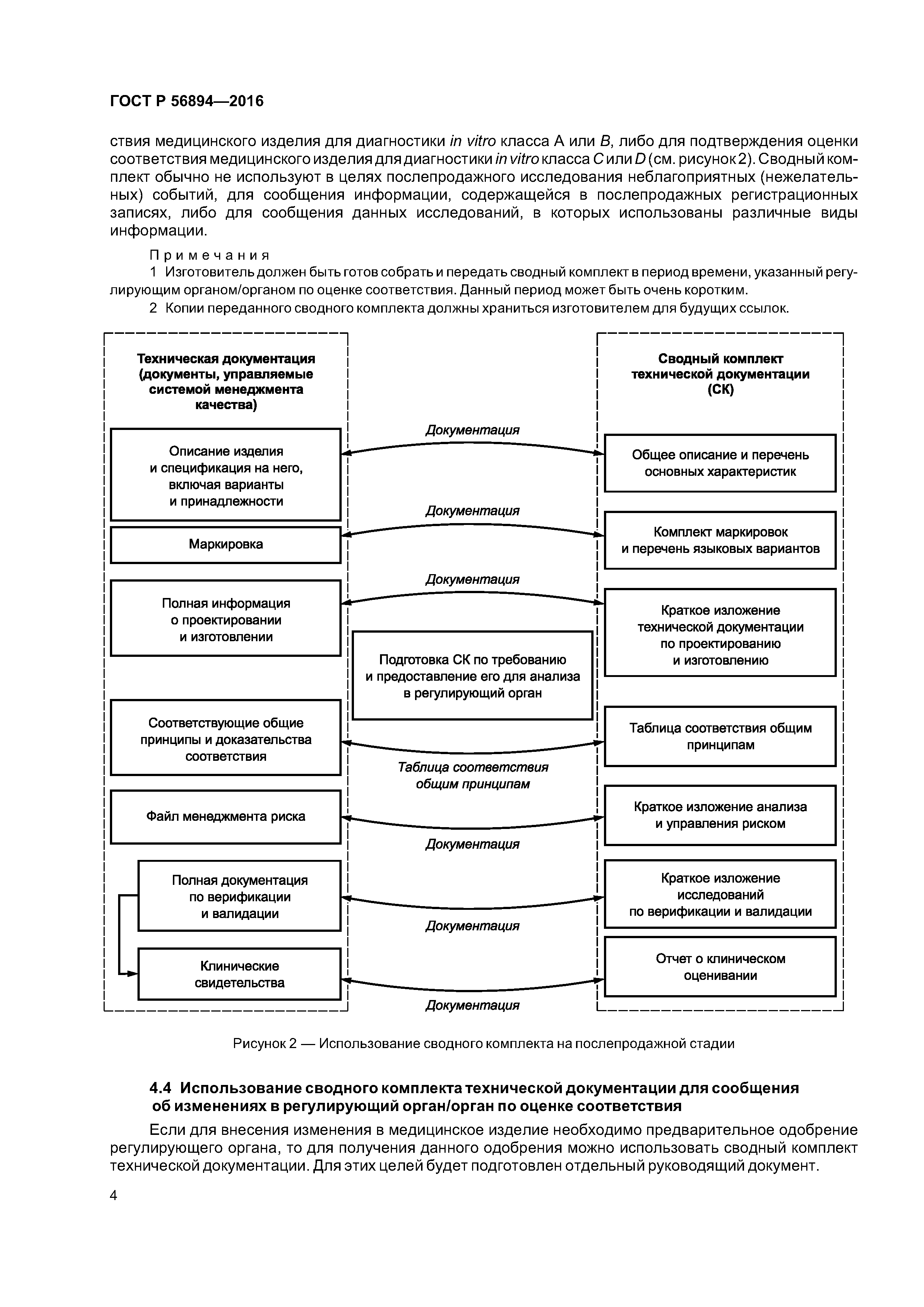
| Область применения: | Стандарт представляет собой руководство для информационного наполнения сводного комплекта технической документации, который необходимо собрать и предоставить в регулирующий орган или орган по оценке соответствия для предпродажного анализа и использования на послепродажной стадии, с тем, чтобы оценить соответствие рассматриваемого изделия для диагностики in vitro общим принципам обеспечения безопасности и основных функциональных характеристик медицинских изделий для диагностики in vitro. Стандарт применим к медицинским изделиям для диагностики in vitro. |
| Оглавление: | 1 Область применения 2 Нормативные ссылки 3 Термины и определения 4 Подготовка и использование сводного комплекта технической документации 4.1 Подготовка 4.2 Использование сводного комплекта технической документации на предпродажной стадии (до выпуска в обращение) 4.3 Использование сводного комплекта технической документации на послепродажной стадии (после выпуска в обращение) 4.4 Использование сводного комплекта технической документации для сообщения об изменениях в регулирующий орган/орган по оценке соответствия 5 Описание изделия и его технических характеристик, включая варианты (конфигурации) и принадлежности 5.1 Описание изделия 5.2 Ссылка на подобные и предыдущие варианты изделия, а также историю изделия 6 Таблица соответствия общим принципам 7 Основные результаты анализа и управления риском 8 Информация по проектированию и производству 8.1 Проектирование изделия 8.2 Производственные процессы 8.3 Производственные площадки 9 Деятельность по верификации и валидации 9.1 Аналитические характеристики 9.2 Клинические характеристики 9.3 Стабильность (за исключением стабильности образцов) 9.4 Верификация и валидация программного обеспечения 10 Маркировка 11 Формат сводного комплекта технической документации 12 Декларация о соответствии Приложение А (справочное) Таблица соответствия общим принципам Приложение ДА (справочное) Сведения о соответствии ссылочных международных документов национальным стандартам Российской Федерации |
| Разработан: | ООО МЕДИТЕСТ |
| Утверждён: | 17.03.2016 Росстандарт (158-ст) |
| Издан: | Стандартинформ (2016 г. ) |
| Расположен в: | |
| Нормативные ссылки: |


















 Федеральный закон 162-ФЗ «О стандартизации в Российской Федерации»
Федеральный закон 162-ФЗ «О стандартизации в Российской Федерации»