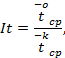|
ГОССТАНДАРТ России |
ГОСКОМСАНЭПИДНАДЗОР России |
Технический комитет по стандартизации ТК 343 «Качество воды»
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
по применению методов биотестирования для оценки качества воды в
системах хозяйственно-питьевого водоснабжения
МР № ЦОС ПВ Р 005-95
Москва 1995 г.
Документ разработан авторским коллективом в составе:
Рахманин Ю.А., Ческис А.Б. (руководители разработки), Еськов А.П., Кирьянова Л.А., Михайлова Р.И., Плитман С.И., Роговец А.И., Тулакина Н.В., Русанова Н.А., Донерьян Л.Г., Пожаров А.В.
В приложениях использованы материалы Методического руководства по биотестированию воды РД 118-02-90 и методических документов по применению прибора «БИОТЕСТЕР», а так же «Методики контроля токсичности медицинских изделий однократного применения, стерилизованных радиационным или газовым методом» (МЗ СССР, 1991 г.).
Представлен: Техническим комитетом по стандартизации ТК-343 «Качество воды»
Внесён: Управлением стандартизации и сертификации пищевой, лёгкой промышленности и сельскохозяйственного производства Госстандарта России
Утверждён: Заместителем Председателя Госстандарта России 12.10.95 г. для издания и распространения в качестве методического справочного пособия.
Зарегистрирован: Центральным органом по сертификации питьевой воды, материалов, технологических процессов и оборудования, применяемых в хозяйственно-питьевом водоснабжении № ЦОС ПВ Р 005-95
СОДЕРЖАНИЕ
ОБЩИЕ ПОЛОЖЕНИЯ
В условиях постоянно нарастающего антропогенного загрязнения источников водоснабжения обеспечение безопасности и безвредности питьевой воды, поставляемой населению предприятиями водоснабжения, в значительной мере зависит от полноты, достоверности и оперативности контроля качества воды во всех технологических звеньях системы: в контрольных створах водных объектов, в местах водозаборов, в ёмкостях чистой воды после ее очистки и обеззараживания, в распределительной водопроводной сети у потребителей. При этом число нормируемых и контролируемых параметров качества, в совокупности определяющих безопасность и безвредность воды, увеличилось за последнее десятилетие более, чем в два раза и в соответствии с рекомендациями Всемирной Организации Здравоохранения (ВОЗ) включает более 100 нормативов. Высокая токсичность и соответственно низкие значения предельно-допустимых концентраций (ПДК) для ряда тяжелых металлов и большинства органических токсикантов существенно усложняют процедуры аналитического химического контроля, требуют продолжительного времени и весьма значительных материальных затрат на проведение комплексного контроля качества воды. Кроме того, проведение даже полного анализа качества воды по всем установленным в нормативных документах индивидуальным показателям не дает возможность определить их комплексное воздействие на организм человека, а принятие системы суммирования относительных концентраций не отражает в полной мере механизм совокупного воздействия токсикантов на степень опасности потребляемой человеком воды.
В связи с этим наряду с традиционными методами для контроля качества воды в системах хозяйственно-питьевого водоснабжения могут применяться методы биологического тестирования, основанные на оценке степени опасности боды источников водоснабжения и питьевой воды по реакции специально подготовленных живых организмов-тест-объектов.
Особенность информации, получаемой с помощью методов биотестирования, состоит в интегральном характере восприятия и отражения всех токсических воздействий, обусловленных совокупностью содержащихся в воде токсикантов и комплексных факторов их совместного присутствия.
При этом применение различных методов биотестирования должно быть ограничено определенными условиями в отношении целей контроля, места отбора проб воды, степени оперативности и т.п., в зависимости от специфических характеристик каждого конкретного метода. Возможно комплексное использование различных биотестов, взаимно дополняющих друг друга по чувствительности к различным группам токсикантов.
Во всех случаях использование методов биотестирования не может заменить аналитический физико-химический контроль, установленный действующими нормативными документами, однако биотесты могут существенно дополнить его результаты оценкой комплексного воздействия содержащихся в воде токсикантов, повысить оперативность обнаружения опасных уровней загрязнения источников питьевого водоснабжения для принятия экстренных мер по вводу резервных мощностей очистки или предупреждения потребителей, а также в ряде случае позволить увеличить периодичность отбора проб для физико-химического контроля и соответственно снизить затраты на контроль при подтверждаемом биотестами сохранении стабильных показателей уровня безопасности исходной воды в источнике водоснабжения.
Настоящий документ устанавливает общие методические рекомендации по применению различных методов биотестирования в централизованных системах хозяйственно-питьевого водоснабжения для решения конкретных задач по контролю качества воды в источниках водоснабжения и очищенной воды, подаваемой потребителям в сочетании с традиционными методами физико-химического контроля.
Методические рекомендации предназначены для использования предприятиями водоснабжения и водоотведения в целях совершенствования систем контроля качества воды, повышения его надежности и оперативности, а также могут быть использованы органами Госкомсанэпиднадзора России при выполнении надзорных функций за качеством воды источников водоснабжения и качеством питьевой воды для повышения достоверности оценки безопасности (безвредности) контролируемой воды в отношении комплексного воздействия находящихся в ней токсикантов.
ХАРАКТЕРИСТИКА МЕТОДОВ БИОТЕСТИРОВАНИЯ, ИСПОЛЬЗУЕМЫХ ДЛЯ КОНТРОЛЯ КАЧЕСТВА ВОДЫ В СИСТЕМАХ ХОЗЯЙСТВЕННО-ПИТЬЕВОГО ВОДОСНАБЖЕНИЯ
Основными характеристиками методов биотестирования, определяющими цели и условия их возможного использования в системах хозяйственно-питьевого водоснабжения, являются:
- вид тест-объекта;
- контролируемый параметр тест-объекта (тест-реакция);
- процедуры измерения тест-реакции;
- оценочные нормативы для определения степени опасности контролируемой среды (воды) для человека по замеренным параметрам тест-реакции.
В качестве тест-объектов в современных методах биотестирования для контроля безопасности (безвредности) воды могут быть использованы рыбы, ракообразные (дафнии и др.), инфузории, зародышевые организмы, водоросли, ферменты, бактерии и др.
Основные требования к тест-объектам состоят в их доступности, простоте и удобстве культивирования или хранения для использования, достаточной чувствительности к содержащимся в воде токсикантам, опасным для человека.
Тест-реакция тест-объекта при воздействии токсикантов или других неблагоприятных факторов окружающей среды может выражаться в гибели тест-объектов (выживаемости), снижении интенсивности размножения, снижении подвижности или других поведенческих характеристик, типичных для данного тест-объекта, а также в подавлении некоторых биохимических процессов, протекающих в клетках и ферментных системах.
Основные требования к тест-реакциям при выборе методов биотестирования для практического использования состоят в наличии ясно выраженной зависимости фиксируемых отклонений от нормы от концентраций токсикантов в воде, а также в возможности наблюдения и регистрации количественных значений тест-реакций с необходимой точностью и достоверностью при использовании доступных средств контроля.
Основные требования к процедурам измерения тест-реакций при использовании методов биотестирования для контроля качества воды в системах водоснабжения состоят в возможности получения требуемого «отклика» на появление в воде опасных токсикантов в максимально сжатые сроки. Это, как правило, требует использования специальных контролирующих устройств с элементами автоматизации, обеспечивающими преобразование регистрируемых тест-реакций в нормируемые величины характеристик токсичности воды.
Методы биотестирования, в которых процедуры измерения тест-реакции рассчитаны на длительный период наблюдения, могут найти ограниченное применение на стадии обследования и выбора источника водоснабжения для хозяйственно-питьевых целей или при наблюдении за источниками водоснабжения с заведомо стабильным качеством воды.
Оценочные нормативы при использовании методов биотестирования должны позволять на основе полученных результатов замеров сделать заключение о степени опасности воды и о принятии при превышении допустимых норм опасности (токсичности) воды необходимых мер по предотвращению возможной угрозы здоровью населения, потребляющего питьевую воду из данной системы водоснабжения.
В настоящее время в действующих нормативных документах отсутствуют утвержденные нормированные величины предельно-допустимых комплексных токсических воздействий, измеряемых с помощью методов биотестирования.
В связи с этим для каждого конкретного метода биотестирования в результате специальных исследований устанавливают корреляционные связи фиксируемых значений тест-реакций с возможным токсическим воздействием на теплокровных животных или с концентрациями конкретных токсикантов и на этом основании вводят определенные оценочные значения степени токсичности (опасности) контролируемой воды в зависимости от фиксируемых результатов измерений при биотестировании.
При этом следует иметь в виду, что эти оценочные значения не являются критериями опасности или безопасности воды при использовании ее человеком для питьевых целей в течение длительного времени; они могут только указывать на вероятность наличия или отсутствия в воде опасных концентраций токсических загрязнений, что должно подтверждаться результатами соответствующего химического контроля, на основании которого с учетом действующих ПДК делается заключение о соответствии питьевой воды установленным требованиям и ее пригодности для использования людьми.
Вместе с тем, в сравнительном плане при оценке, например, различных технологий очистки воды, обеспечивающих ее соответствие нормативным требованиям по отдельным видам токсикантов, предпочтение должно отдаваться тем методам, которые обеспечивают более высокий уровень безопасности, определяемый методами биотестирования.
В таблице 1 .приведены основные характеристики методов биотестирования, рекомендуемых для использования в целях контроля качества воды в системах хозяйственно-питьевого водоснабжения. Описание методов приведено в справочных приложениях, нумерация которых соответствует номерам тест-объектов в таблице 1.
|
Тест-объект |
Тест-реакция |
Способ измерения тест-реакции |
Норматив (индекс токсичности) |
|
1. Клеточный тест-объект (гранулированная сперма быка) |
Изменение показателей подвижности тест-объекта |
Подсчет числа флуктуаций интенсивности рассеянного излучения, вызванного прохождением тест-объекта через оптический зонд, с использованием автоматической контрольной системы |
Допустимые значения индекса токсичности It (отношение определяемых значений, характеризующих подвижность тест-объекта в опытном и контрольном растворах): It = (70 - 130) % |
|
2. Инфузории парамеции |
Реакция хемотаксиса - число инфузорий, направленно перемещающихся в зоне анализа |
Измерение приборами серии «Биотестер» (например, «Биотестер-2»), обеспечивающими регистрацию тест-реакций с выдачей данных в условных единицах токсичности. |
Допустимые значения индекса токсичности Т (допустимая степень загрязнения): Т = (0 - 0,25); высокая степень загрязнения: Т > 0,71 |
|
3. Инфузории тетрахимена-периформис |
Изменение выживаемости и интенсивности размножения |
Визуальная оценка (подсчет) под микроскопом количества тест-объектов через определенные промежутки времени (15 мин, 1 час, 6 час, 24 часа, 48 часов). |
Острое токсическое действие - гибель 100 % инфузорий в течение 6 часов. Хроническое токсическое действие при коэффициенте токсичности К (снижение числа тест-объектов по сравнению с контролем за 48 часов.) K < 0,5 и K > 1 |
|
4. Штамм бактерий Е-колли |
Изменение уровня дегидрогеназной активности микроорганизмов (подавление актив. фермента) |
Определение времени обесцвечивания метиленового-синего, как косвенного показателя активности фермента дегидрогеназы. |
Признак отсутствия токсичности - отклонение времени обесцвечивания от контрольной пробы меньше, чем на 15 %. |
|
5. Ракообразные (дафнии, цеиодафнии) |
Изменение показателей выживаемости и плодовитости |
Визуальная оценка (подсчёт) количества тест-объектов через определенные промежутки времени в сопоставлении с контрольными пробами. |
Острое токсическое действие - гибель более 50 % ракообразных за 96 часов. Хроническое токсическое действие - достоверное снижение по сравнению с контролем тест-объектов в течение 20 суток. |
|
6. Водоросли (сценедесмус, хлорелла) |
Снижение интенсивности размножения (прироста клеток водорослей) |
Визуальная оценка (подсчет) прироста числа клеток в сопоставлении с контрольным опытом. |
Показатель токсического действия - достоверное снижение коэффициента прироста числа клеток по сравнению с контролем через 96 часов (острое токсическое действие) и через 14 суток (хроническое токсическое действие) |
|
7. Рыбы (гуппи, данио) |
Снижение выживаемости |
Визуальная оценка (подсчет) среднего количества тест- объектов, выживших в тестируемой воде в сопоставлении с контрольным опытом |
Острое токсическое действие - гибель 50 % и более рыб за 96 часов. Хроническое токсическое действие - достоверное снижение выживаемости рыб за 30 суток по сравнению с контрольным опытом |
Наряду с перечисленными в таблице 1 практическое применение для оценки качества воды в системах хозяйственно-питьевого водоснабжения находят специальные методы, в частности, для определения суммарной мутагенной активности с использованием биологических тест-систем после проведения соответствующей подготовки. При анализах питьевой воды такая подготовка включает операции экстракции, концентрирования и стерилизации. Для оценки мутагенного потенциала полученных экстрактов наиболее часто применяется тест Эймса (сальмонелла / микросомы) и тесты на индукцию цитогенетических нарушений (хромосомные аберрации, микроядра, сестринские хроматидные обмены). Описание указанных процедур содержится в «Методических указаниях по экспериментальной оценке суммарной мутагенной активности загрязнений воздуха и воды» (Минздрав СССР, М., 1990). Сложность реализации указанных методов обуславливает возможность их применения в специальных лабораториях НИИ, имеющих необходимое оборудование и квалифицированный персонал.
В частности, указанные исследования систематически проводятся в НИИ экологии человека и гигиены окружающей среды им. А.Н. Сысина РАМН.
ОБЩИЕ ПРАВИЛА ПРИМЕНЕНИЯ МЕТОДОВ БИОТЕСТИРОВАНИЯ ДЛЯ КОНТРОЛЯ КАЧЕСТВА ВОДЫ В ЦЕНТРАЛИЗОВАННЫХ СИСТЕМАХ ХОЗЯЙСТВЕННО-ПИТЬЕВОГО ВОДОСНАБЖЕНИЯ
Контроль качества воды в централизованных системах хозяйственно-питьевого водоснабжения включает отбор и анализ проб воды в следующих основных элементах технологической схемы:
- в источнике водоснабжения перед водозабором;
- на промежуточных стадиях процесса водоподготовки (технологический контроль);
- в емкости чистой воды и (или) из трубопроводов перед подачей в водопроводную распределительную сеть;
- в водопроводной сети из распределительных колонок или кранов. Кроме того, в крупных системах водоснабжения силами предприятия водоснабжения проводится контроль поверхностных источников водоснабжения путем отбора проб в различных створах. как правило, в пределах зоны санитарной охраны.
С учетом специфики методов биотестирования, связанной с чувствительностью большинства тест-объектов к дезинфектантам, используемым в процессе водоподготовки, а также особенностей отдельных методов биотестирования в отношении сроков получения результатов (возможности реализации экспресс-контроля) и степени универсальности по выявлению различных видов токсикантов в табл. 2 изложены рекомендации по предпочтительному использованию различных видов биотестов для контроля качества воды в различных объектах и различных контрольных точках систем водоснабжения.
|
Объект контроля |
Контрольные точки |
Задачи, для решения которых рекомендуется использовать методы биотестирования |
Рекомендуемые методы биотестирования (№№ методов по табл. 1) |
|
Вода в источнике водоснабжения |
Контрольные створы в пределах зон санитарной охраны |
1. Подтверждение отсутствия острого и хронического токсического действия совокупности токсикантов, содержащихся в воде источника водоснабжения при выборе источника по ГОСТ 2761-84 и СанПиН 4630-88 |
3, 5 - 7 |
|
То же |
То же |
2. Непрерывный оперативный «Алярмконтроль» для своевременного обнаружения внезапного появления в источнике водоснабжения опасных концентраций токсикантов, наличие которых требует принятия специальных мер по дополнительному химическому контролю, очистке воды и (или) предупреждению населения. |
1, 2 |
|
То же |
То же |
3. Периодический контроль для определения степени опасности воды по совокупному действию находящихся в ней токсикантов. |
1, 4 |
|
То же |
зона водозабора |
4. Непрерывный оперативный автоматизированный «Алярмконтроль» |
1, 2 |
|
То же |
То же |
5. Периодический контроль для подтверждения соответствия исходной воды общим требованиям безопасности |
1 - 4 |
|
Питьевая вода |
ёмкости чистой воды и контрольные точки перед входом в систему распределения |
6. Периодический контроль после дехлорирования по общему токсическому действию токсикантов, которые могут образовываться в процессе очистки и обеззараживания воды (продукты дезинфекции - галогенорганические соединения и др.) |
1 - 4 |
|
То же |
водоотборные устройства в сети водоснабжения |
7. Периодический контроль проб воды для подтверждения отсутствия токсичного воздействия питьевой воды после прохождения по трубопроводам водопроводной системы. |
1 - 4 |
|
Материалы, используемые в оборудовании, изделиях и процессах |
|
8. Подтверждение отсутствия токсического эффекта в результате взаимодействия материалов с водой для выдачи разрешений на применение материалов (веществ) в сфере питьевого водоснабжения |
1 |
В дополнение к рекомендациям, изложенным в табл. 2, следует учитывать некоторые изложенные ниже особенности методов биотестирования, связанные с их чувствительностью к отдельным группам токсикантов и возможностями сопоставления фиксируемых результатов тест-реакций с данными стандартизованных методов химико-аналитического контроля.
Для клеточного тест-объекта (гранулированная сперма быка) экспериментально установлены корреляционные зависимости измеряемой тест-реакции от уровня токсикометрических параметров (DL50 - половинная смертельная доза для крыс) и концентраций широкого круга органических токсикантов (хлорированные углеводороды, фенолы, акриламид, формальдегид и др.), которые, в частности, могут попадать в воду при контактах с полимерными материалами и изделиями. Определены предельные значения индекса токсичности, при которых отсутствует реакция лабораторных животных на совокупность различных токсикантов, находящихся в воде в определенных концентрациях. На этой основе данный метод одобрен Минздравом России для оценки полимерных материалов, используемых в медицинской технике. Установлена также чувствительность тест-объекта к тяжелым металлам (ртуть, свинец, кадмий).
Для методов биотестирования с использованием инфузорий установлены данные, характеризующие содержание в воде и концентрации ряда органических и неорганических компонентов, при которых фиксируется тест-реакция, отражающая острое токсическое действие указанных компонентов. На этой основе данный метод может быть рекомендован, в частности, для контроля за качеством воды в водных объектах (источниках водоснабжения), в которых могут содержаться токсичные соединения металлов (ртуть, хром, кадмий, никель, медь, цинк) и органические соединения (хлороформ, бензол, акриламид, вниилацетат, метилметакрилат и др.).
При применении в качестве тест-объекта ферментных систем (оценка угнетения дегидрогеназы) выявлена достаточно высокая чувствительность тест-реакций на присутствие в воде повышенных концентраций ионов тяжелых металлов (ртуть, свинец, медь, кадмий), а также ряда органических соединений (фенолы, резорцин, гидрохинон и др.). Специфической особенностью при использовании ферментных тест-систем вместо живых организмов является отсутствие достаточной чувствительности к дыхательным ядам (цианиды), канцерогенам типа бензапирена, а также к некоторым анионам (нитриты, нитраты).
Использование ракообразных, водорослей и рыб в системах биотестирования для определения острого и хронического токсического действия контролируемой воды с соответствующей продолжительностью экспериментов характеризует общий уровень загрязнения воды токсичными компонентами и наличие неблагоприятных факторов, влияющих на жизненные функции организмов. В отношении чувствительности к отдельным токсикантам эти методы относительно менее специфичны по сравнению с применением, например, инфузорий, однако фиксируемые тест-реакции могут проявляться при опасных концентрациях в воде тяжелых металлов (ртуть, хром и др.), фенолов и их производных, отдельных высокотоксичных пестицидов и т.п.
При сопоставлении чувствительности методов биотестирования с методами аналитического химического определения отдельных химических веществ в пробах контролируемой воды отмечается, как правило, невозможность фиксации тест-реакций при низких концентрациях загрязнений воды на уровне ПДК, которые количественно определяются химическими методами.
Реально фиксируемые с необходимой достоверностью тест-реакции при наличии в воде индивидуальных токсикантов для типовых методов биотестирования в режимах экспресс-контроля наблюдаются при концентрациях, существенно превышающих ПДК.
Так, при использовании биотеста с инфузориями острое токсическое действие проявляется при концентрациях, составляющих для никеля - 5 ПДК, хрома и кадмия - 10 - 20 ПДК, хлороформа - 50 ПДК, бензола - 100 ПДК, фенола - 500 ПДК. Исключение составляет ртуть, для которой острый токсический эффект фиксируется при содержании 1 - 2 ПДК.
Однако все это относится только к случаям загрязнения воды индивидуальными токсикантами, а основное преимущество методов биотестирования проявляется в фиксации совокупного действия присутствующих в воде токсикантов, когда может иметь место суммирование воздействующих факторов, существенно снижающих уровень обнаружения отдельных токсикантов. При этом возможность экспресс-контроля при применении методов биотестирования с соответствующим приборным оснащением позволяет своевременно выявить возникновение чрезвычайных ситуаций, когда внезапно возникающие высокие уровни загрязнения воды опасными токсикантами могут нанести ущерб здоровью населения в короткие сроки при потреблении небольших количеств воды.
Сводные данные об организациях-разработчиках методов биотестирования, указанных в таблицах 1 и 2, и основных публикациях по этим вопросам, приведены в табл. 3.
|
№ № методик по табл. 1 и тест-объекты |
Организации-разработчики и консультанты |
Литературные источники |
|
1 Клеточный тест-объект (гранулированная сперма быка) |
Всероссийский научно- исследовательский и испытательный институт медицинской техники (ВНИИИИМТ), г. Москва; АО «БМК-ИНВЕСТ» г. Москва |
Количественный экспресс-метод оценки токсичности питьевой воды, природных вод и промышленных стоков с применением клеточного тест-объекта. Методические рекомендации, «Геоцентр-Москва», М., 1993 А.П. Еськов, Р.И. Каюмов, Ю.С. Ротенберг Биотестирование с помощью суспензии сперматозоидов «Гигиена труда и профессиональные заболевания» № 8, 1989 г |
|
2 Инфузории парамеции |
АО «Квант» г. Санкт- Петербург |
Методика определения токсичности проб воды экспресс-методом на приборе «Биотестер» НИИ Гигиены и профпаталогии МЗ СССР, Л-д 1991 А.В. Пожаров, Ю.А. Рахманин, С.А. Шелемотов. Прикладные аспекты аппаратурного биотестирования воды. «Гигиена и санитария» 1994 г. |
|
3 Инфузории тетрахимена периформис |
НИИ экологии человека и гигиены окружающей среды им. А.Н. Сысина (НИИЭЧиГОС), г. Москва |
Методы биотестирования вод, Черноголовка, 1988 |
|
4 Штам бактерий E-колли (фермент дегидрогеназа) |
Московский научно- исследовательский институт гигиены им. Ф.Ф. Эрисмана (МНИИГ), г. Москва |
Предельно допустимые концентрации вредных веществ в воздухе и воде. Справочное пособие, ГИПХ, Л-д, 1972 |
|
5 Ракообразные (дафнии, цериодафнии) |
ВНИИВОДГЕО, г. Москва; Гидрохимический институт г. Ростов; Институт биологии внутренних вод РАН (ИБВВ), г. Дубна; ГУАК, Минприроды России, г. Москва |
Методическое руководство по биотестированию воды РД 118-02-09 Госкомприрода СССР, М., 1991 МС ИСО 6341:1989 «Качество воды. Определение подавления подвижности дафний» |
|
6 Водоросли (сценедесмус, хлорелла) |
МГУ, г. Москва |
Методическое руководство по биотестированию воды РД 118-02-90 Госкомприроды СССР, М., 1991 МС ИСО 6341:1989 «Качество вода. Тест замедления роста пресноводных водорослей» |
|
7 Рыбы (гуппи, данио) |
Научно-исследовательский институт морского рыбного хозяйства (ВНИРО), г. Ростов; МГУ, г. Москва |
Методическое руководство по биотестированию воды РД 118-02-09 Госкомприроды СССР, М., 1991 М.Н. Ильин. Аквариумное рыбоводство, М., изд. МГУ, 1997 |
|
8 Сальмонелла (биологические тест системы для определения мутагенной активности) |
НИИЭЧиГОС им. А.Н. Сысина, г. Москва |
В.В. Соколовский, В.С. Жуков, Ю.А. Рахманин, И.Н. Рыжова. Методические указания по экспериментальной оценке суммарной мутагенной активности загрязнений воздуха и воды, Минздрав СССР, М., 1990; А.М. Фонштейн, С.К. Абилев и др. Методы первичного выявления генетической активности загрязнителей среды с помощью бактериальных тест систем; Методические указания, М. 1985 |
ПРИЛОЖЕНИЕ 1: БИОТЕСТИРОВАНИЕ С ИСПОЛЬЗОВАНИЕМ КЛЕТОЧНОГО ТЕСТ-ОБЪЕКТА (гранулированная сперма быка)
Принцип метода основан на анализе зависимости показателя подвижности суспензии сперматозоидов от времени и определении подавления их подвижности (сокращения среднего времени подвижности) под воздействием содержащихся в контролируемой воде токсикантов.
Сперматозоиды могут существовать вне организма в средах простого состава до нескольких часов без изменений своих функциональных свойств.
Основное назначение половых клеток как носителей наследственной информации - оплодотворение яйцеклетки. Выполнение этой функции определяется их возможностью продвижения к месту оплодотворения, вследствие чего именно подвижность является основным показателем физиологического, биохимического и морфологического статуса сперматозоидов, который оказывается весьма чувствительным к воздействию широкого круга токсикантов.
Реализация метода осуществляется с применением автоматической аналитической системы (комплекса приборов), обеспечивающей сравнительную оценку показателя подвижности суспензии сперматозоидов в опытных (испытуемых) пробах воды и в контрольных средах, определение процедур расчетов и выдачу результатов в виде соответствующих индексов токсичности оцениваемых проб воды.
Оцениваемый системой показатель подвижности (m) определяется как функция концентрации подвижных клеток Сn и среднего модуля их скорости V
|
m = a⋅Cn⋅V, |
где а - коэффициент, связанный с конструкцией измерительной системы.
Оценка показателя подвижности осуществляется путем автоматического подсчета числа флуктуаций интенсивности рассеянного излучения, вызванного прохождением клеток через оптический зонд.
2. Тест-объект
В качестве тест-объекта используются сперматозоиды быка. Сперму получают на станциях искусственного осеменения в виде гранул, замороженных в жидком азоте. В замороженном виде в сосуде Дьюара с жидким азотом сперму можно хранить неограниченно долго.
Долив азота (4 - 5 литров) производят каждые 4 - 5 дней.
Коэффициент вариации концентрации сперматозоидов в гранулах спермы не превышает 10 %, что обеспечивает достаточную стабильность и воспроизводимость в экспериментах по оценке их подвижности в контролируемых водных средах.
3. Аналитическая система
Аналитическая система включает комплекс приборов, в состав которого входит анализатор токсичности, блок подготовки образцов и компьютер с принтером, обеспечивающие автоматическое проведение оценки контролируемой тест-реакции, обработку результатов сравнительной оценки подвижности и выдачу итоговых данных в виде соответствующих распечаток.
Технические характеристики системы:
-длина волны лазерного излучения - 0,63 мкм;
- мощность лазерного излучения - не менее 1 мВт,
- время одного анализа - от 10 до 300 с с шагом 10 с;
- время перемещения кюветы (капилляра) с образцом - не более 2 с;
- время обратного хода каретки - не более 15 с;
-температура проб и рабочих образцов - 35 - 45 °С;
- допустимые пределы отклонения от установленной температуры - ±1,5 °С;
- объем кюветы (капилляра) с контролируемым образцом - 25 мкл;
- компьютер типа IBM PC АТ (и последующие модели).
Блок-схема системы приведена на рис. 1
Конструктивное исполнение системы обеспечивает возможность визуального наблюдения за клеточными тест-объектами в суспензии.
Блок-схема комплекса
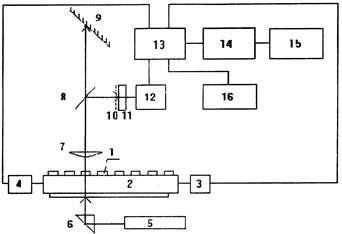
1 - капилляр, 2 - каретка, 3 - привод, 4 - блок
термостатирования капилляров,
5 - лазер, 6 - светоделительная пластина, 7 - микрообъектив, 8 -
светоделительная пластина,
9 - экран, 10 - маска, 11 - фотодиод, 12 - усилитель, 13 - контроллер, 14 -
компьютер,
15 - принтер, 16 - блок подготовки проб и рабочих образцов
4. Вспомогательное оборудование, материалы, реактивы Вспомогательное оборудование, материалы и реактивы включают:
- комплект кювет (капилляров) для помещения контролируемых образцов в аналитическую систему;
- пробирки с притертыми пробками по ГОСТ 1770-74 объемом 3 - 5 мл - 40 шт.;
- пипеточные дозаторы объемом 0,2 мл и 0,5 мл;
- колбы мерные с притертыми пробками объемом 1000 мл - 2 шт.;
- колбы конические с притертыми пробками объемом 50 мл и 100 мл - по 10 шт., объемом 500 мл и 1000 мл - по 2 шт.;
- весы торсионные типа ВТ-500;
- пинцет анатомический;
- сосуд Дьюара емкостью 26,5 л марки СДП-25 - 2 шт.;
- сосуд Дьюара емкостью 5 л марки СДС-5 - 1 шт.;
- шкаф сушильный;
- холодильник бытовой;
- сперма быка в гранулах, замороженная при температуре жидкого азота;
- азот жидкий;
- цитрат натрия кристаллический, хч;
- глюкоза кристаллическая;
- спирт этиловый;
- вода дистиллированная;
- бидистиллят.
5. Условия и процедура биотестирования
5.1. Температура рабочих сред при проведении биотестирования должна поддерживаться в пределах 40 ± 1,5 °С. Это достигается автоматическим термостатирующим устройством.
5.2. Проведение испытаний
5.2.1. Включают аналитическую систему нажатием тумблера «Сеть» за 30 мин до начала испытаний. С помощью компьютера задают условия проведения испытаний: температуру, время одного анализа, количество кювет (капилляров) с образцами. Информация о достижении необходимой температуры и готовности системы к работе выдается на дисплей.
5.2.2. Готовят опытные и контрольные растворы. В качестве контрольного раствора применяют глюкозо-цитратную среду состава: глюкоза - 4 г, цитрат натрия - 1 г, вода дистиллированная - 100 мл. Контрольная среда одновременно является разбавителем для оттаивания замороженной спермы. Изотонию опытного (испытываемого) раствора (проб воды) достигают путем добавления сухих реактивов: 4 г глюкозы и 1 г цитрата натрия на 100 мл воды. Вместо дистиллированной воды может быть использована «фоновая» проба воды из источника с известными показателями химического состава, отвечающими требованиям безопасности
5.2.3. Дозируют по 1 мл контрольного и испытываемого раствора в пробирки и помещают в водный термостат для термостатирования при температуре 40 ± 1,5 °С.
5.2.4. Для оттаивания замороженной спермы отмеривают в пробирки по 0,5 мл разбавителя (по п. 5.2.2) и термостатируют их при температуре 40 ± 1,5 °С. Охлажденным анатомическим пинцетом извлекают из сосуда Дьюара гранулу спермы и быстро опускают в нагретый раствор. Каждую гранулу размораживают в отдельной пробирке. Сразу после размораживания спермы содержимое пробирок сливают в одну пробирку и тщательно перемешивают. Смесь термостатируют при 40 ± 1,5 °С.
5.2.5. Рабочие образцы для биотестирования в аналитической системе готовят путем внесения в каждую пробирку с контрольным и испытываемым растворами по 0,2 мл суспензии сперматозоидов (по п. 5.2.4).
5.2.6. Для проведения анализов рабочие образцы из пробирок с контрольным и испытываемым растворами (по п. 5.2.5) переносят в капилляры, выполняющие функции кювет, и герметизируют их путем поочередного окунания концов капилляров в ванну с парафином.
Капилляры с рабочими образцами помещают на каретку и устанавливают в привод аналитической системы.
С помощью компьютера проводят идентификацию капилляров и запускают процесс накопления экспериментальных данных. Процесс продолжают до достижения нулевых значений показателя подвижности во всех капиллярах, после чего проводят математическую обработку результатов по алгоритмам, реализуемым программой компьютера согласно изложенным ниже методическим положениям.
6. Обработка и оценка результатов
6.1. В результате эксперимента в системе для каждого образца биотестируемых растворов (испытываемых и контрольных проб воды) регистрируется зависимость:
|
m = f(t), |
где m - показатель подвижности (по п. 1),
t - время
7.6.2. Для каждой из указанных зависимостей вычисляется средневзвешенное значение времени подвижности tcp,
|
|
где m1 - i-ое значение показателя подвижности,
i - текущий номер оценки показателя подвижности.
6.3. Для контрольной и опытной выборок образцов вычисляют среднее арифметическое значение и среднее квадратическое отклонение, по которым в свою очередь рассчитывают для каждой выборки коэффициент вариации С, по формуле:
|
|
где δ - среднее квадратическое отклонение,
![]() - среднее арифметическое значение
- среднее арифметическое значение
В случае получения коэффициента вариации более 15 % хотя бы для одной из выборок, повторяют эксперимент. Если значение коэффициента вариации для каждой из выборок меньше или равно 15 %, то результаты контроля считают достоверными.
6.4. Вычисление индекса токсичности It, проводится по формуле:
|
|
где ![]() и
и ![]() средние арифметические значения
средневзвешенного времени подвижности, соответственно, для опытной и
контрольной выборок образцов.
средние арифметические значения
средневзвешенного времени подвижности, соответственно, для опытной и
контрольной выборок образцов.
6.5. Критерием отсутствия токсического воздействия является нахождение величин It в интервале значений от 70 до 130 %.
ПРИЛОЖЕНИЕ 2: БИОТЕСТИРОВАНИЕ С ИСПОЛЬЗОВАНИЕМ ИНФУЗОРИЙ PARAMECIUM
1. Принцип метода
Методика биотестового анализа водных проб основана на способности Paramecium caudatum - инфузории туфельки (далее - инфузории) избегать неблагоприятных и опасных для жизнедеятельности зон и активно перемещаться по градиентам концентраций химических веществ в зоны благоприятные (реакция хемотаксиса). Методика позволяет оперативно определять острую токсичность водных проб.
2. Характеристика тест-объекта, выращивание и подготовка культуры к анализу
2.1. В качестве тест-объекта используется Paramecium caudatum - инфузория туфелька. Относится к подцарству простейших (одноклеточных животных) - Protozoa, типу - Ciliophora. Инфузория широко распространена в пресных водоемах. Форма клетки эллипсоидная, размеры - 200×40 мкм. Основную пищу инфузории составляют бактерии, дрожжи и т.п. Размножение инфузории происходит путем поперечного деления клетки. В зависимости от условий выращивания время генерации может составлять от нескольких часов до нескольких суток.
По сравнению с другими группами простейших инфузории имеют наиболее сложное строение и отличаются разнообразием функций. Инфузория находится в непрерывном движении. Скорость ее при комнатной температуре - 2,0 - 2,5 мм/с. Траектория движения сложная: она движется вперед, вращаясь вдоль продольной оси тела, с помощью ресничек, количество которых достигает 10 - 15 тысяч. Изменение внешних условий (температура, химический состав среды, электромагнитные колебания и другие факторы) воспринимаются клеткой, и первая ответная реакция - изменение характера движения: уменьшение или увеличение скорости, частоты остановок и разворотов, разнообразные таксисы, например, гео-, магнито-, аэро-, хемотаксис.
2.2. Исходный материал для выращивания культуры инфузории передается при поставке прибора «БИОТЕСТЕР-2». Культуру можно также получить из коллекций культуры простейших, имеющихся в различных научных организациях (например, в БиНИИ СПб ГУ: 198904, Старый Петергоф, Ораниенбаумское шоссе, 2). Можно выделить свою культуру из местных водоемов или приобрести у аквариумистов, но необходимо при этом учитывать, что видовую принадлежность может определить специалист-протозоолог, т.к. существуют другие представители рода Paramecium caudatum.
2.3.1. В данной методике может быть использована культура инфузории, выращенная по различным методикам, которые обеспечивают получение тест-объекта, во-первых, в достаточном для анализов количестве, во-вторых, чувствительного к модельному токсиканту в пределах концентраций, установленных в п. 2.3.
Выращивание культуры проводят в любых удобных сосудах, например, в стеклянных колбах, стаканах, чашках Петри и других. В качестве корма используют бактерии, дрожжи и их смесь, выращенные стерильно на твердых средах. При отсутствии условий для выращивания стерильного корма, можно использовать воздушносухие пекарские дрожжи.
К общим положениям по выращиванию культуры относится обязательное требование идентичности среды выращивания и среды, которая будет использована для процедур отмывания культуры от продуктов метаболизма, получения рабочей взвеси, разведения водных проб и прочих процедур с культурой.
Метод культивирования инфузории приведен ниже в качестве примера.
2.3.2. Метод культивирования инфузории
В широкогорлую коническую колбу на 200 мл вносят суспензию инфузорий в среде Лозина-Лозинского в количестве 100 мл с плотностью 1000 ± 200 клеток/мл. В качестве корма добавляют воздушносухие дрожжи из расчета 1 мг на 1 мл среды. Выращивание ведут при температуре 18 - 26 °С.
Для биотестового анализа используют культуру в начале стационарной фазы роста. Для контроля за развитием популяции отбирают ежесуточно пробу, в которой определяют количество клеток по п. 2.3.4.1. Отсутствие прироста клеток в популяции свидетельствует о наступлении стационарной фазы роста, ежесуточный контроль позволяет определить ее начало. Обычно при заданных в начале данного раздела условиях стационарная фаза роста наступает на 2 - 3 сутки, при этом плотность культуры будет составлять 4000 ± 1000 клеток/мл.
2.3.3. Поддержание и хранение культуры
При перерывах в проведении биотестовых анализов культуру достаточно поддерживать только как посевной материал. Один из способов поддержания на зернах риса. В чашку Петри помещают 2 - 3 сырых зернышка риса, добавляют среду около 30 - 40 мл и помещают клетки инфузории туфельки в количестве 50 - 100 клеток/мл. Раз в 2 недели меняют среду и зерна риса.
Удобно содержать резервную культуру в пробирках. Один раз за 7 - 10 суток концентрат клеток из верхней части пробирки (без перемешивания) переливают в другую пробирку, добавляют среду Л-Л до прежнего объема и по 0,5 мг дрожжей на 1 мл жидкости.
Другой способ консервации культуры - хранение в холодильнике при низких положительных температурах. Скорость деления при этом может составлять одно деление в 10 - 20 суток. Культуру отмывают от продуктов метаболизма и старого корма, доводят концентрацию взвеси до 200 ± 100 клеток/мл, добавляют сухие дрожжи 0,2 мг/мл и помещают в холодильник. Так культура сохраняется до месяца. При использовании культуры, сохранявшейся в холодильнике, необходимо дождаться выравнивания ее температуры с температурой остальных растворов и только после этого производить необходимые процедуры.
Особое внимание следует обратить на то, что инфузория не выдерживает резких перепадов температуры (!).
2.3.4. Определение концентрации взвеси инфузории
Концентрацию клеток необходимо определять в процессе выращивания культуры, при подготовке рабочей взвеси клеток и для определения величины тест-реакции. Определение концентрации клеток инфузорий без затруднений выполняется с помощью отградуированного прибора серии «Биотестер».
2.3.4.1. В общем случае концентрацию клеток инфузории определяют подсчетом клеток под микроскопом по общепринятым в микробиологической практике методикам: с помощью измерительных сеток, счетных камер и т.п. Подсчитанное количество клеток пересчитывают на единицу объема среды и выражают как концентрацию (клеток/мл). Ниже приводится пример способа подсчета клеток инфузорий. Исходную взвесь инфузорий взболтать, отобрать с помощью пипетки 0,5 мл взвеси. К этому объему добавить 9,5 мл 1 % раствора NaCl. Таким путем достигается обездвиживание инфузорий. Не дожидаясь полного обездвиживания инфузорий (примерно через 2 - 5 мин) из разбавленной взвеси отбирают 0,5 мл и распределяют этот объем в виде 6 - 10 крупных капель на сухом стекле (например, в чашке Петри). С помощью микроскопа (лупы) подсчитывают инфузории во всех каплях. Полученный результат пересчитывают на 1 мл исходной взвеси.
Например: 0,5 мл взвеси обездвиженных инфузорий распределены в 6 каплях, в которых было сосчитано 29, 38, 32, 31, 28, 35 клеток - всего 193. В 1 мл разбавленной взвеси содержится 386 клеток, а в 1 мл исходной взвеси, следовательно, будет содержаться 3860 клеток инфузорий.
2.3.4.2. Специализированным средством для определения количества подвижных клеток инфузории является прибор серии «Биотестер». Определение концентрации подвижных клеток проводят по предварительно построенной градировочной кривой.
Для построения градировочной кривой берут взвесь клеток инфузории в среде Л-Л по п. 2.3.2. Из взвеси готовят ряд разведений, каждое из которых по концентрации меньше предыдущего в 2 раза, объем взвеси каждого разведения не менее 5 мл. Последнее разведение может содержать 5 - 10 клеток/мл. Исходную концентрацию клеток определяют подсчетом числа клеток под микроскопом (см. п. 2.3.4.1). Концентрации клеток в серии разведений определяют соответствующим расчетом. При этом последовательно определяют концентрацию подвижных клеток инфузорий, находящихся в исходной рабочей взвеси и во всех разведениях, снимая показания на приборе. Для этого заполняют кювету контролируемой взвесью клеток до верха (инфузории не обездвиживать!), помещают в кюветный модуль прибора и снимают ряд показаний.
Процедуру, подсчета клеток в исходной взвеси, приготовление разведений, измерение на приборе исходной взвеси и разведений повторяют не менее 3 раз и результаты усредняют. По полученным данным строят градировочную кривую как зависимость показаний прибора от логарифма концентрации клеток. Построенная кривая может быть использована продолжительное время с одним и тем же измерительным прибором.
2.4. Подготовка инфузорий в анализу
2.4.1. Выращенную по п. 2.3 культуру инфузории отмывают от продуктов метаболизма и корма, доводят концентрацию до рабочего значения, проводят проверку готовности культуры к анализу по ее чувствительности к модельному токсиканту и по ее способности выходить в чистую пробу.
2.4.2. Отмывание культуры
При отмывании используют нормальную физиологическую реакцию инфузорий собираться в верхних слоях жидкости. Использование сосудов с узким длинным горлом позволяет сконцентрировать инфузории в верхней зоне и слить в другой сосуд с минимальным количеством загрязненной культуральной среды. Концентрат разбавляют чистой средой Л-Л, опять собирают клетки в верхней зоне и сливают. В результате отмывания инфузорий степень разбавления культуральной жидкости чистой средой должна быть не менее 1:200.
Пример. Культура выращена на среде Л-Л. Отмывочная среда - Л-Л. К 50 мл культуры добавляют 50 мл среды Л-Л, тщательно переливают в мерную колбу на 100 мл, обязательно заполняя горлышко. Через 5 - 15 минут инфузории собираются в верхней зоне. Сливают верхнюю часть жидкости из колбы. Получают взвесь клеток с разбавлением культуральной жидкости в два раза и объемом, например, 20 мл. Процедуру по отмыванию повторяют еще 2 раза, добавляя к 20 мл взвеси 80 мл среды Л-Л и получают взвесь клеток, например, в объеме 10 мл с разбавлением исходной взвеси инфузорий в 50 раз. Доводят объем полученной взвеси (10 мл) и получают разведение в 250 раз. Определяют концентрацию клеток в полученной взвеси по п. 2.3.4 и доводят ее до значения 1000 ± 200 кл/мл. Полученную рабочую взвесь клеток инфузорий после предварительной проверки используют в течение 1,5 часов.
2.4.3. Проверка готовности взвеси инфузорий к анализу
Проверку проводят по двум параметрам одновременно:
- по степени выхода инфузорий в контрольную чистую пробу;
- по чувствительности к модельному токсиканту.
2.4.3.1. Для проверки выхода инфузорий в контрольную пробу заполняют по п. 4.1 три кюветы взвесью клеток, наслаивают среду Л-Л или заведомо нетоксичную воду (но не дистиллят). Через 30 минут измеряют концентрацию клеток в верхних зонах кювет по п. 4.2. Усредняют результат по 3 кюветам и определяют готовность тест-культуры к биотестовому анализу по условию: выход должен быть не менее 70 % от концентрации рабочей взвеси.
2.4.3.2. Для проверки чувствительности к модельному токсиканту в три кюветы наслаивают раствор сульфата меди с концентрацией 0,1 мг/л, приготовленный по п. 3.4. Через 30 минут измеряют концентрацию в верхних зонах кювет по п. 4.2 и рассчитывают индекс токсичности к раствору сульфата меди.
При 0,2 < Т < 0,7 культуру используют в биотестовом анализе.
3. Средства измерений, вспомогательные устройства, материалы, растворы.
3.1. Средства измерений:
- микроскоп бинокулярный с увеличением порядка 10 - 50;
- прибор серии БИОТЕСТЕР, например, БИОТЕСТЕР-2 - специализированный импульсный фотометр по ТУ 401-51-005-91 с набором фотометрических кювет;
- весы лабораторные общего назначения (ГОСТ 8.520-84).
3.2. Вспомогательные устройства:
- сосуды для культивирования из химически инертного материала, например, химические стаканы, конические широкогорлые колбы, чашки Петри (ГОСТ 25336-82);
- пипетки, мерные колбы, пробирки (ГОСТ 20292-74, 1770-74).
3.3. Материалы:
- соли марки ч.д.а. или х.ч.: натрий хлористый, калий хлористый, кальций хлористый, магний сернокислый, натрий углекислый кислый, медь сернокислая пятиводная;
- поливиниловый спирт ПВС - марка 11/2, высший сорт (ГОСТ 10779-78);
- дрожжи хлебопекарные воздушносухие - используются в качестве корма для инфузорий.
- взвесь клеток инфузорий, полученная путем выращивания тест-объекта в определенных условиях (см. п. 2.3), отмытая от продуктов метаболизма и корма (см. п. 2.4) и доведенная до рабочей концентрации (плотности) 1000 ± 200 клеток/мл;
- среда для культивирования и разбавления: готовится на дистиллированной воде (среда Лозина-Лозинского, в дальнейшем Л-Л). Возможно использование водопроводной воды, которая должна быть соответствующим образом обработана (дехлорировать и отстоять в течении 5 - 10 суток).
Для приготовления концентрата среды Л-Л в 1 л воды растворяют следующие соли (марки ч.д.а. или х.ч.): NaCl - 1,0 г, KCl - 0,1 г, MgSO4 - 0,1 г, СаСl2×2Н2O - 0,1 г, NaНСО3 - 0,2 г. Такой раствор можно хранить в холодильнике до 7 суток. Для работы используется среда Л-Л, полученная десятикратным разбавлением исходного концентрата. Разбавляющая среда и среда для культивирования должны быть идентичны и обеспечивать выживаемость инфузории в течение 5 суток;
- модельный токсикант на основе сульфата меди. Маточный раствор сульфата меди (10 мг/л) в дистиллированной воде хранят не более недели. Рабочие концентрации сульфата меди готовят перед самым определением. Растворы соли с концентрациями до 1 мг/л готовят в дистиллированной воде, а с концентрациями 0,1 мг/л и меньше - в среде Л-Л;
- раствор ПВС в среде Л-Л: 5 % раствор используют в качестве нейтрального загустителя. Для приготовления раствора ПВС 0,5 г порошка ПВС смешивают с 9,5 мл среды Л-Л. Смесь нагревают на водяной бане до растворения порошка. Используют раствор в течение суток.
4. Метод определения
4.1. Метод определения токсичности жидких сред основан на способности тест-объектов реагировать на появление в водной среде веществ, представляющих опасность для их жизнедеятельности, и направлено перемещаться по градиенту концентраций этих веществ (хемотаксическая реакция), избегая их вредного воздействия.
Хемотаксическая реакция реализуется при условии наличия стабильного и воспроизводимого градиента концентраций химических веществ. Подобный градиент создается путем наслоения в вертикальной кювете (пробирке) на взвесь инфузорий в загустителе испытуемой водной пробы. При этом в измерительной кювете образуется стабильная граница, сохраняемая в течение всего времени биотестирования. Эта граница раздела не препятствует свободному перемещению инфузорий в предпочтительном для них направлении и при этом предотвращает перемешивание жидкостей из нижней и верхней зон.
После создания в кювете двух зон в течение 30 минут происходит перераспределение инфузорий по зонам. Важная особенность поведенческой реакции инфузорий - массовое перемещение клеток в верхние слои жидкости. В случае, если исследуемая проба не содержит токсических веществ, в кювете будет наблюдаться концентрирование клеток инфузорий в верхней зоне. Наличие в исследуемой пробе токсических веществ приводит к иному характеру перераспределения инфузорий в кювете, а именно, чем выше токсичность пробы, тем меньшая доля инфузорий перемещается в верхнюю зону (исследуемую пробу).
4.2. Критерием токсического действия является значимое различие в числе клеток инфузорий, наблюдаемых в верхней зоне кюветы в пробе, не содержащей токсических веществ (контроль), по сравнению с этим показателем, наблюдаемым в исследуемой пробе (опыт).
4.3. Количественная оценка параметра тест-реакции, характеризующего токсическое действие, производится путем расчета соотношения числа клеток инфузорий, наблюдаемых в контрольной и исследуемой пробе (согласно п. 8.1), и выражается в виде безразмерной величины - индекса токсичности (Т).
5. Условия определения
5.1 .Определение токсичности по настоящей методике выполняется оператором с квалификацией лаборанта.
5.2. На методику распространяются общие правила техники безопасности при работе с химическими реактивами общего применения и лабораторной аппаратурой (указаны в паспорте на прибор).
5.3. Инфузории работают в интервале Температур 10 - 30 °С при соответствии их свойств требованиям п. 2.3.
6. Подготовка к выполнению определения
6.1. Отбор и хранение проб
Общие процедуры отбора проб определены в следующих документах: ИСО 5667/2. Качество воды. Отбор проб. ч, 2; ГОСТ 24481-80. Вода питьевая. Отбор проб.
6.2. Биотестирование проб воды проводят не позднее 6 часов после их отбора. При невозможности проведения анализа в указанный срок пробы воды охлаждают (+4 °С). Не допускается консервирование проб с помощью химических консервантов.
6.3. Необходимый для выполнения анализа (в трех повторностях) объем водной пробы составляет около 10 мл. Для однократного определения достаточно 2 мл.
6.4. При проведении биотестирования температура исследуемой пробы должна соответствовать температуре взвеси тест-объекта. Инфузории не переносят резких перепадов температуры (!).
6.5. При наличии в пробе крупнодисперсных включений, соизмеримых по величине с клеткой инфузории или больших по размеру, необходима фильтрация пробы.
7. Проведение анализов
В кювету вносят 2,0 мл взвеси инфузорий в рабочей концентрации, предварительно проверенной по двум параметрам: по чувствительности к модельному токсиканту (см. п. 2.4.3.2) и по выходу в разбавляющую среду (см. п. 2.4.3.1). К взвеси добавляют 0,35 мл 5 % раствора ПВС, все тщательно перемешивают, непременно увлажнив стенки кюветы, и наслаивают (например, пипеткой) 1,8 мл анализируемой водной пробы, не допуская перемешивания с нижним слоем. Через 30 минут (продолжительность тест-реакции) последовательно производят определение концентрации инфузорий в верхней зоне кюветы в контрольных (lk) и опытных (loп) пробах. Контрольные и опытные пробы готовят одновременно.
7.2. Измерение концентрации инфузорий на приборе «БИОТЕСТЕР-2»
Подготовленные по п. 7.1 кюветы последовательно помещают в кюветный модуль и снимают показания прибора. В приборе «БИОТЕСТЕР-2» предусмотрено три режима работы:
- измерение и индикация результата через каждые 22 с;
- измерение и индикация среднего значения результатов 5 отсчетов (через каждые 110 с);
- измерение и индикация среднего значения результатов 10 отсчетов (через каждые 220 с).
Работа с прибором:
а) установить режим усреднения «1» ( горит светодиод над кнопкой, соседние светодиоды погашены);
б) вставить кювету в кюветную нишу, закрыть крышку, нажать кнопку «ПУСК»;
в) индикация гаснет, на 12 с (время автоподстройки) загорается светодиод «ОТСЧЕТ», и еще через 22 с на индикационном табло появляется первое значение концентрации в условных единицах. Выдача отсчета сопровождается световым и звуковым сигналом продолжительностью 2 с;
г) в течение 22 с значение предыдущего отсчета сохраняется, этого времени достаточно для регистрации результата.
Если концентрация токсикантов настолько велика, что инфузории практически не выходят в пробу (показания прибора в условных единицах находятся в пределах 000 - 008), то начинает мигать светодиод «ТРЕВОГА». Это означает, что испытуемую пробу необходимо разбавить до получения на приборе значимых величин. (Не забудьте скорректировать оценку токсичности в соответствии со степенью разбавления исходной пробы).
Последовательность операций при использовании других режимов измерений идентична вышеописанной. Обычно работают в режиме усреднения по 5 показаниям. Контрольные и испытуемые пробы делают в трех повторностях. Значения повторностей усредняют и рассчитывают индекс токсичности по п. 8.1.
8. Обработка и оформление результатов
8.1. Оценку токсичности водной пробы производят по относительной разнице количества клеток в верхних зонах кювет с контрольными и анализируемыми пробами.
Индекс токсичности определяется как:
|
|
Icp.k, Icp.оп средние показания прибора для контрольных и анализируемых проб соответственно.
Индекс токсичности (Т) - величина безразмерная и может принимать значения от 0 до 1 в соответствии со степенью токсичности анализируемой пробы.
По величине индекса токсичности анализируемые водные пробы классифицируются по степени их загрязнения на 4 группы:
I. Допустимая степень загрязнения (0,00 < Т < 0,25);
II. Умеренная степень загрязнения (0,26 < Т < 0,70);
III. Высокая степень загрязнения (Т > 0,71 ,а также значимые значения Т, полученные при 2-х, 4-х, 6-кратном разбавлении анализируемой пробы);
IV. Чрезвычайно высокая степень загрязнения (значимые значения Т, полученные при 8-кратном и свыше разбавлении анализируемой пробы).
8.2. Пример записи результатов измерений
|
Номер пробы |
Повторности |
Показания прибора ly.e. |
Ср. знач. по 5 измерениям icp, у.е. |
Ср. знач. по 3 повторностям 4 ср., у.е. |
Индекс токсичности Т, у.е. |
||||
|
Контроль среда Л-Л |
1 |
126 |
120 |
106 |
136 |
116 |
121 122 98 |
144 |
|
|
2 |
136 |
130 |
112 |
120 |
106 |
||||
|
3 |
106 |
73 |
128 |
82 |
100 |
||||
|
Проба 1 |
1 |
86 |
90 |
80 |
116 |
60 |
86 78 80 |
81 |
|
|
2 |
82 |
66 |
78 |
88 |
70 |
||||
|
3 |
74 |
86 |
62 |
98 |
80 |
||||
|
Проба 2 |
1 |
0 |
0 |
0 |
0 |
0 |
0 0 0 |
0 |
|
|
2 |
0 |
0 |
0 |
0 |
0 |
||||
|
3 |
0 |
0 |
0 |
0 |
0 |
||||
|
Проба 2 с 10-кратным разбавлением |
1 |
2 |
4 |
8 |
6 |
5 |
5 5 6 |
6 |
|
|
2 |
4 |
6 |
4 |
2 |
8 |
||||
|
3 |
10 |
8 |
2 |
8 |
4 |
||||
9. Нормы погрешности
9.1. Качество оценки токсичности воды определяется погрешностью прибора серии «Биотестер» и свойствами тест-культуры инфузории.
9.2. Погрешность прибора нормирована и определяется при первичной и периодических проверках по методике, утвержденной Госстандартом России.
9.3. В качестве свойств тест-культуры нормируются следующие показатели:
- порог чувствительности к модельному токсиканту (CuSO4×5H2O) - 0,01 мг/л;
- диапазон реагирования на модельный токсикант находится в пределах 0,01 - 1,0 мг/л.
10. Контроль погрешности
10.1. Контроль метрологических характеристик прибора осуществляется при каждом определении токсичности в режиме ТЕСТ.
10.2. Контроль свойств культуры инфузорий на соответствие требованиям раздела 2 производится при ее подготовке к измерениям (п. 2.4).
ПРИЛОЖЕНИЕ 3: БИОТЕСТИРОВАНИЕ С ИСПОЛЬЗОВАНИЕМ КУЛЬТУРЫ ИНФУЗОРИЙ ТЕТРАХИМЕНА ПЕРИФОРМИС
1. Принцип метода
Метод основан на определении выживаемости и изменения интенсивности размножения инфузорий под воздействием токсических веществ.
Оценка степени токсичности производится по результатам острого и хронического токсического действия тестируемой воды на инфузорий.
В качестве тест-объекта используют инфузории Тетрахимена периформис - Tetrahymena pyriformis (Ehrenberg) Schewiaroff.
Практическое использование инфузорий Тетрахимена периформис при тестировании питьевой воды объясняется высокой чувствительностью инфузорий к неблагоприятным факторам внешней среды, химическим веществам и соединениям, имеющим санитарное и экологическое значение - тяжелым металлам, канцерогенам, гербицидам, инсектицидам, токсинам бактерий и плесени, фармпрепаратам и т.д.
Преимуществом использования инфузорий Тетрахимена периформис по сравнению с другими простейшими является высокая интенсивность обмена веществ, быстрый рост Тетрахимен, возможность работы со стерильной культурой и стандартным штаммом.
2. Характеристика тест-объекта
2.1. Тип инфузории - Ciliophora;
Класс Oligohymenophora;
Надотряд Hymenostomatida;
Отряд Tetrahymenina,
Род Tetrahymena;
Вид Tetrahymena pyriformis (Ehrenberg Sohewiakoff).
2.2. Место обитания
Тетрахимена распространена в пресных водах с высоким содержанием органических веществ. Встречается в сооружениях биологической очистки в активном иле.
2.3. Морфология, развитие, питание, дыхание, роль в круговороте веществ
Тело тетрахимены имеет грушевидную форму, длина его 38 - 60 мкм, покрыто оболочкой (пелликулой). Реснички равномерной длины покрывают его рядами, расположенными меридиально от переднего (суженного) к заднему (расширенному) концу тела. Число рядов ресничек менее двадцати. Питание осуществляется через рот (цистосом), расположенный в верхней части тела на дне околоротовой впадины (вестибулум). От вестибулума вниз отходят два ряда ресничек, а вверх -пересекающий верхнюю часть тела эктоплазматический шов. Пищеварение осуществляется с помощью пищеварительных вакуолей, число которых непостоянно и зависит от пищи. Кроме пищеварительных у тетрахимены имеется сократительная (пульсирующая) вакуоль, функция которой заключается в регулировании водного баланса. Она расположена в задней части тела. Ядерный аппарат состоит из двух типов ядер: макро- и микронуклеуса. Макронуклеус имеет яйцевидную форму, он управляет жизненными процессами в теле инфузорий. Микронуклеус участвует в половом процессе, передавая наследственную информацию.
Бесполое размножение инфузорий осуществляется поперечным делением надвое. Длительность общего цикла жизнедеятельности составляет 4 - 6 ч. Половой процесс носит характер конъюгации - временного соединения двух особей для взаимного обмена частями ядерного аппарата.
По отношению к содержанию растворенного в воде кислорода Tetrahymena pyriformis является эвриксибионтом, т е. может существовать в широком диапазоне его концентраций от 0 до 100 % насыщения. Температурный оптимум: 25 - 26 °С.
2.4. Содержание культуры
2.4.1. Подготовка питательных сред
а) Питательная среда пептонно-дрожжевая
На 100 мл дистиллированной воды внести 0,5 г глюкозы, 2 г пептона бактериологического, 0,1 г дрожжевого экстракта, 0,1 г морской соли. Довести pH до 7,1. Профильтровать питательную среду через бумажный фильтр, разлить в пробирки высотой 20 мм, закрыть ватно-марлевыми тампонами, стерилизовать автоклавированием 30 мин, охладить до комнатной температуры, хранить питательную среду в холодильнике.
б) Питательная среда УСД (углеводно-солевая дрожжевая)
На 100 мл дистиллированной воды внести 1,5 г глюкозы, 0,1 г морской соли, 0,1 г дрожжевого экстракта. Довести pH до 7 - 7,5. Профильтровать питательную среду через бумажный фильтр. Разлить питательную среду в пробирки высотой (20 - 1)мм, закрыть ватно-марлевыми тампонами и стерилизовать автоклавированием 30 мин.
После стерилизации пробирки со средой УСД охладить при комнатной температуре и хранить в холодильнике
в) Печеночная питательная среда
Кусочек печени (крысиной или куриной) весом 20 г отварить в 100 мл водопроводной воды, прокипятить 30 мин. Остудить, профильтровать через бумажный фильтр, разлить по пробиркам (по 5 мл), в некоторые пробирки положить кусочки печени по 5 г. Стерилизовать в автоклаве 30 мин или дробным кипячением на водяной бане в течение трех суток по 30 мин.
2.4.2. Культивирование инфузорий
Для выращивания инфузорий в лабораторных условиях используют пептонно-дрожжевую питательную среду. Культуру инфузорий поддерживают на пептонно-дрожжевой среде путем ее пересева бактериологической петлей на свежую среду через каждые 7 суток.
Поскольку инфузория Тетрахимена периформис является стерильной культурой, то ее пересевы необходимо осуществлять в условиях микробиологического бокса. При его отсутствии можно осуществлять пересев и в обычном рабочем помещении с использованием спиртовки.
Температура в рабочем помещении 25 ± 5 °С.
При отсутствии возможности частого пересева для длительной сохранности культуры можно использовать питательную среду УСД. УСД среду разлить в пробирки по 5 мл. Стерильной пипеткой над пламенем спиртовки внести по 1 - 2 капле трехсуточной культуры инфузорий, выращенных на пептонно-дрожжевой питательной среде и хранить при комнатной температуре.
Инфузории остаются жизнеспособными в течение 1,5 - 2 месяцев.
Примечание: для большей гарантии сохранения культуры рекомендуется делать посевы в 2 - 3 колбы. Хранят в затемненном месте, не допуская попадания прямых солнечных лучей.
В случае необходимости хранения сроком до 6 месяцев инфузорий Tetrahymеnа pyriformis можно культивировать на печеночной питательной среде.
Оборудование и посуду, используемые для работы с инфузорией, не следует использовать для других целей.
Для проверки культуры на чистоту необходимо регулярно делать посевы на скошенный агар. Визуальный осмотр среды, а также микроскопирование позволяют контролировать ее чистоту от посторонней микрофлоры.
Методы очистки культуры Тетрахимена пириформис от посторонней микрофлоры:
а) ежедневный пересев инфузорий на свежую питательную среду (до 4 - 5 раз);
б) взятие инокулята при пересеве с верхнего слоя среды, выдерживание культуры при относительно низкой температуре (11 - 15 °С);
в) в случае, если очистка культуры по методам 1 и 2 не дает результата, то следует использовать антибиотики, которые добавляют к среде в следующих количествах:
пенициллин -1000 мкг/мл, стрептомицин - 400 мкг/мл, тетрациклин - 50 мкг/мл.
Пересев на среду, содержащую антибиотики, можно делать несколько раз (через 3 - 4 дня).
2.4.3. Подготовка культуры Tetrahymena pyriformis к анализу Разлить пептонно-дрожжевую питательную среду в конические колбы с таким расчетом, чтобы толщина слоя среды не превышала 2 см. Колбы закрыть ватномарлевыми пробками и стерилизовать в автоклаве в течение 30 мин при 1 атм. После остывания засеять в колбы 3-5 суточный инокулят инфузорий (из бактериологической пробирки) в количестве 0,2 мл на 10 мл пептонно-дрожжевой среды.
Примечание: объем засеваемой среды определяется планируемым количеством анализов (расход среды на 1 анализ - 2,2 мл).
Засеянные колбы содержать при комнатной температуре в затемненном месте в течение 2 - 4 суток до достижения необходимой плотности культуры (150 - 250 тыс. клеток/мл).
Определение плотности культуры Tetrahymena pyriformis провести с помощью счетной камеры Фукса-Розенталя или камеры Горяева.
Содержание пробирки тщательно перемешать для получения однородной взвеси (провести несколько вращательных движений); отобрать из пробирки пипеткой суспензию клеток и нанести каплю в счетную камеру Фукса-Розенталя (или камеру Горяева). Клетки в капле фиксировать 5 %-ным спиртовым раствором йода, опуская в каплю кончик стеклянной палочки, смоченной раствором йода, быстро накрыть в камере покровным стеклом и протереть стекло. Под микроскопом посчитать в определенном числе квадратов количество клеток (не менее 50), найти количество клеток в 1 мл суспензии.
Расчет произвести по формуле:
|
|
N - численность клеток в 1 см3;
X - количество просчитанных клеток;
n - количество просчитанных маленьких квадратов камеры;
V - объем части камеры, имеющей площадь маленького квадрата;
103 - приведение к 1 мл.
Примечание: на пластине каждой камеры указаны площадь маленького квадрата и глубина камеры.
3. Оборудование, материалы, реактивы
- микроскоп биологический стереоскопический МБС, ТУ;
- баня водяная;
- автоклав;
- спиртовка;
- термошкаф ОСТ 16.0.801.397-87;
- шкаф сушильный ОСТ 16.0.801.397-87;
- весы аналитические с НПВ 0,1 г ГОСТ 24104-82;
- счетная камера Фукса-Розенталя или счетная камера Горяева;
- штативы для пробирок:
- пипетки Пастеровские;
- колбы мерные 2 - 50; 2 - 100; 2 - 1000 ГОСТ 1770-74;
- колбы плоскодонные П-1-500-29/32 ТС П-11-1000-29/32;
- дистиллированная вода ГОСТ 6709-92;
- глюкоза, хч;
- морская соль;
- дрожжевой экстракт;
- бумага фильтровальная ГОСТ 12026-77;
- пептон бактериологический;
- петля бактериологическая;
- пинцет;
- культура инфузории Tetrahymena pyriformis.
4. Условия процедуры биотестирования
4.1. Тестирование проводят при комнатной температуре в защищенном от прямого солнечного света месте. Биотестирование проводят 3 - 5-ти суточной культурой инфузорий, выращенной на пептонно-дрожжевой среде с начальной концентрацией 100 - 200 кл/мл.
4.2. Процедура биотестирования
4.2.1. Исследуемые пробы воды разлить в пробирки в объеме приблизительно 5 мл в 3-х повторностях.
Контролем служит отстоянная питьевая водопроводная вода, соответствующая гигиеническим требованиям по показателям солевого состава, содержанию органических веществ, тяжелых металлов, микроэлементов. Контрольная вода должна обеспечивать выживание инфузорий в течение 48 ч.
4.2.2. Внести в пробирки с водой микропипеткой культуру инфузорий по 0,05 мл в каждую.
Примечание: перед микроскопированием пробы воды перемешать встряхиванием.
4.2.3. Поместить на предметное стекло микроскопа из каждой пробирки по 0,01 мл исследуемой пробы воды.
4.2.4. Подсчитать под микроскопом количество клеток.
5. Обработка и оценка результатов и их выражение
Для экспресс-оценки токсичности пробы воды численность живых клеток контролировать через 15 мин и 1 час.
В хроническом опыте численность живых клеток контролировать еще через 6, 24 и 48 часов.
За острое токсическое действие принимается действие тестируемой питьевой воды на инфузорий в период до 1 часа. Показателем токсичности является гибель инфузорий в тестируемой воде по сравнению с контролем. Обездвиженные клетки считаются погибшими.
Результаты острого опыта подтверждаются в хроническом опыте: в случае, если через 6 часов наблюдается 100 %-ная гибель инфузорий, то исследуемая вода характеризуется как токсичная.
За хроническое принимается действие тестируемой воды в период до 48 часов. Показателем токсичности является снижение интенсивности размножения инфузорий, проявляющееся в уменьшении количества клеток в тестируемой воде по сравнению с контролем. Стимуляция размножения инфузорий по сравнению с контролем также является показателем токсичности тестируемой воды.
Показателем токсичности в хроническом опыте принимается коэффициент токсичности (Кт), который определяется по формуле:
|
|
Вн - среднее количество инфузорий в поле видимости окуляра в начальный момент измерения (получается усреднением по всем каплям);
Вк - среднее количество инфузорий в поле видимости окуляра в конечный момент измерения;
![]() - среднее количество инфузорий в поле
видимости окуляра в начальный момент измерения в контроле;
- среднее количество инфузорий в поле
видимости окуляра в начальный момент измерения в контроле;
![]() - среднее количество инфузорий в поле
видимости окуляра в конечный момент измерения в контроле.
- среднее количество инфузорий в поле
видимости окуляра в конечный момент измерения в контроле.
Пробу следует считать токсичной при значении К < 5 и К > 1.
Достоверность отклонения показателей определяется по критерию Стьюдента (см. приложение 5).
ПРИЛОЖЕНИЕ 4: БИОТЕСТИРОВАНИЕ С ИСПОЛЬЗОВАНИЕМ ФЕРМЕНТА ДЕГИДРОГЕНАЗА ШТАММА БАКТЕРИЙ E.COLI
1. Принцип метода
Метод основан на подавлении окислительной активности фермента дегидрогеназа микроорганизмов E.coli под воздействием содержащихся в воде токсикантов и оценке степени указанного воздействия путем сравнения времени обесцвечивания метиленового синего под воздействием фермента в испытываемой и контрольной пробах воды.
Дегидрогеназы относят к группе ферментов класса оксидоредуктаз, катализирующих отщепление водорода от органических веществ. Они встречаются во всех живых клетках, участвуя в реакциях углеводного и жирового обмена, а также биологического окисления.
Дегидрогеназы весьма чувствительны к действию биологических ядов, что дает основание по степени подавления их активности судить о биологической токсичности исследуемых растворов и, в частности, проб воды.
2. Характеристика тест-объекта
Штамм E.coli с основными стандартными свойствами, присущими организмам данного вида, доступен, удобен в культивировании и применении, в том числе для оценки активности дегидрогеназы, содержащейся в клетках микроорганизмов (музей E.coli имеется в каждой бактериологической лаборатории ЦСЭН РФ).
3. Оборудование, средства измерения, материалы, реактивы используемые при биотестировании:
- термостат;
- секундомер;
- пробирки с притертыми пробками с рабочим объемом 23 мл.;
- раствор метиленового синего 0,01 %;
- раствор пептона свежеприготовленный 1 %;
- раствор хлористого натрия 0,9 % (физиологический раствор);
т суточная культура сапрофитных микроорганизмов E.coli.
4. Условия и процедура биотестирования
4.1. Пробу исследуемой воды доводят до pH 7 ± 0,2 и вносят в три пробирки по 20 мл в каждую.
В другие три пробирки вносят по 20 мл физиологического раствора (0,9 % хлористый натрий) с pH 7 ± 0,2.
4.2. В каждую пробирку добавляют по 1 мл растворов пептона (конц. 1%), метиленового синего (конц. 0,01 %) и 1 мл суточной культуры E.coli (из расчета получения в смеси плотности клеток ~ 1012).
4.3. Если предполагается, что в исследуемой воде могут содержаться вещества, обладающие способностью к химическому или биохимическому окислению, что может проявляться в замедлении процесса обесцвечивания метиленового синего, дополнительно готовят контрольную группу из трех пробирок, в каждую из которых вносят по 20 мл исследуемой воды и по 1 мл растворов пептона и метиленового синего (по п. 4.2), но не вносят культуру E.coli.
4.4. Жидкость во всех пробирках по мере внесения препаратов аккуратно перемешивают, после чего закрывают пробками, вытесняя небольшой избыток жидкости, чтобы избежать образования воздушной прослойки над жидкостью.
4.5. Сразу после заполнения и герметизации все пробирки с растворами помещают в термостат с t = 37 °C и осуществляют наблюдение через стекло в дверце за процессом обесцвечивания метиленового синего в результате процесса окисления. Для улучшения условий наблюдения позади пробирок устанавливают экран белого цвета (лист белой бумаги).
4.6. Начало отсчета времени обесцвечивания жидкости в пробирках фиксируют с момента помещения их в термостат. В течение первых 20 - 25 минут наблюдения ведут периодически, начиная с 25 минут - непрерывно, отмечая время исчезания окраски в каждой пробирке. В среднем время обесцвечивания для контрольных проб с физиологическим раствором и для проб воды, не содержащих токсикантов и окисляющихся компонентов, составляет 30 - 40 минут.
При наличии в воде токсикантов, подавляющих активность дегидрогеназы, время обесцвечивания может существенно увеличиваться.
В этом случае при отсутствии обесцвечивания жидкости в пробирках с испытываемой пробой воды опыт прекращают по истечении времени, на 30 - 40 % превышающего время обесцвечивания смеси с контрольным физиологическим раствором.
5. Обработка и оценка результатов испытаний
Расчет относительного изменения активности фермента дегидрогеназы ΔА под воздействием химических компонентов, содержащихся в испытываемой пробе, производят по формуле.
|
|
Топ - среднее время обесцвечивания в пробирках с опытной (испытываемой) пробой воды;
Тк - среднее время обесцвечивания в пробирках с контрольным физиологическим раствором.
При значениях ΔА < 15 % исследуемая проба воды считается нетоксичной (не вызывающей нарушения биохимических процессов при длительном воздействии).
При значениях ΔА ≥ 15 % отмечается проявление токсического действия содержащихся в испытываемой воде компонентов на сапрофитные микроорганизмы (подавление активности гидрогеназы), что может свидетельствовать, в частности, о наличии в воде повышенных концентраций тяжелых металлов (свинец, ртуть, кадмий и др.).
В случаях, когда Топ превышает время обесцвечивания раствора в контрольных пробирках, не содержащих сапрофитных микроорганизмов, (см. п. 4.3) более чем на 15 %, делают заключение о наличии в испытываемой пробе веществ-восстановителей (химически или биологически окисляющихся), что требует проведения дополнительных химических анализов воды.
ПРИЛОЖЕНИЕ 5: БИОТЕСТИРОВАНИЕ С ИСПОЛЬЗОВАНИЕМ РАКООБРАЗНЫХ
1. Биотестирование с использованием дафний
Метод основан на определении изменений выживаемости и плодовитости дафний при воздействии токсических веществ, содержащихся в тестируемой воде, по сравнению с контролем.
Кратковременное биотестирование (до 96 час) позволяет определить острое токсическое действие воды на дафний по их выживаемости.
Показателем выживаемости служит среднее количество тест-объектов, выживших в тестируемой воде или в контроле за определенное время.
Критерием токсичности является гибель 50 и более процентов дафний за период времени до 96 ч в тестируемой воде по сравнению с контролем. Длительное биотестирование (20 и более суток) позволяет определить хроническое токсическое действие воды на дафний по снижению их выживаемости и плодовитости. Показателем выживаемости служит среднее количество исходных самок дафний, выживших в течение биотестирования, показателем плодовитости - среднее количество молоди, выметанной в течение биотестирования, в пересчете на одну выжившую исходную самку.
Критерием токсичности является достоверное отличие от контроля показателя выживаемости или плодовитости дафний.
В качестве тест-объекта используют Daphnis magha Straus.
1.2. Характеристика тест-объекта
Тип Arthropodа
Класс Crustacea
Отряд Cladocera
Семейство Daphniidae
Род Daphnia
Вид Daphnia magna Straus
1.2.1. Местообитание
Дафнии обитают в стоячих и слабопроточных водоемах. На территории России дафнии широко распространены. Являются типичными мезосапробами, переносят осолонение до 6 %.
1.2.2. Рост, развитие и размножение
Рост дафний в течение всей жизни неравномерный, с возрастом замедляется и связан с периодическими линьками: первые три (ювенильные) следуют через 20, 24 и 36 часов, четвертая (созревание яиц в яичнике) и пятая (откладывание яиц в выводковую камеру) следуют с интервалом 2 - 3 суток. Начиная с шестой, каждая линька сопровождается откладыванием яиц. Растет дафния наиболее интенсивно в первые дни после рождения. При хорошем питании размеры молодых дафний после каждой линьки удваиваются. После наступления половой зрелости рост замедляется. Выметанная молодь имеет 0,7 - 0,9 мм в длину, к моменту половозрелости самки достигают 2,2 - 2,4 мм, самцы - 2,0 - 2,1 мм. Максимальная длина тела самок может достигать 6,0 мм при сыром весе 7 - 10 мг.
В природе в летнее время, а в лаборатории при благоприятных условиях круглый год дафнии размножаются без оплодотворения (партеногенетически), причем рождаются в основном самки. При резком изменении условий существования (недостаток пищи, перенаселенность, понижение температуры и т.д.) в популяции дафний появляются самцы, и дафнии переходят к половому размножению, откладывая после оплодотворения «зимние» яйца (1 - 2 шт.), которые размещаются в специальном седлышке (эфиппиуме), образованном из части створок панциря самки. Это седлышко при очередной линьке отделяется вместе с яйцами и падает на дно водоема, где проходит стадию покоя.
Весной из яиц появляются самки, которые в дальнейшем дают партеногенетические поколения дафний. Период созревания рачков при оптимальной температуре (20 ± 2 °С) и хорошем питании 5 - 8 сут.
Наступление половой зрелости отмечают по моменту выхода яйцеклеток в выводковую камеру. Длительность эмбрионального развития обычно 3 - 4 суток, а при повышении температуры до 25 °С - 46 часов. По истечении этого времени происходит вымет молоди. Партеногенетические поколения следуют одно за другим каждые 3 - 4 суток. Вначале число яиц в кладке дафний 10 - 15, затем возрастает до 30 - 40 и более, потом снижается до 3 - 8. Кладка яиц прекращается за 2 - 3 суток до смерти. В природе дафнии живут в среднем 20 - 25 суток, а в лаборатории при оптимальном режиме 3 - 4 месяца и более. При высоких температурах (свыше +25 °С) продолжительность жизни дафний может сокращаться до 25 суток.
1.2.3. Питание
Источником питания дафний в природных водоемах являются бактерии, одноклеточные водоросли, детрит, растворенные органические вещества. Интенсивность потребления корма зависит от его характера, концентрации в среде, температуры, возраста рачков и т.д.
Процесс питания дафний непосредственно связан с движением грудных ножек, направляющих ток воды внутрь панциря. Пищевые частицы, отфильтрованные на «сите», поступают в продольный желоб (между основанием ног) и передаются ко рту рачка. Скопление пищи в желобе свидетельствует о неблагополучии в питании дафний, как и в случае, когда «сито» забито взвесью. Чрезмерно высокое содержание кормовых частиц снижает активность питания дафний, и они могут погибнуть вследствие засорения пищевого аппарата.
Интенсивный водно-солевой обмен (более 80 % воды рачок заменяет менее чем за 2 мин) способствует поддержанию постоянного осмотического давления внутри панциря и сохранению формы тела. Поэтому при ухудшении состояния дафний тело часто деформируется, что можно считать признаком нарушения водно-солевого обмена.
1.2.4. Отношение к содержанию кислорода
Оптимальное содержание растворенного кислорода для роста и размножения дафний 6 - 7 мг/л. Они устойчивы к ухудшению кислородного режима - выживают при уменьшении концентрации растворенного в воде кислорода до 2 мг/л, что связано с их способностью синтезировать гемоглобин. Повышение содержания гемоглобина в крови дафний отмечено при понижении концентрации растворенного кислорода. В этом случае рачки приобретают красноватый цвет вместо розовато-желтого при благоприятных условиях.
1.3. Содержание культуры дафний в лабораторных условиях
1.3.1. Получение исходного материала для культуры дафний
Исходный материал для лабораторной культуры дафний можно получить в учреждениях-разработчиках настоящих МР1.
________
1НИИЭЧиГОС им. Сысина, ИБВВ РАН, МГУ им. Ломоносова
Если этот вид встречается в местных водоемах, можно самостоятельно вырастить культуру дафний. Для этого из водоема с помощью гидробиологического сачка из планктонового газа №№ 20 - 26 отлавливают дафний и помещают в стеклянные емкости, удобные для транспортировки, которые заполняют под пробку водой из этого водоема. Одновременно отбирают 5 - 10 л воды для последующей пересадки дафний. В лаборатории специалист определяет вид рачков под микроскопом. Доставленных в лабораторию дафний вместе с водой переводят в кристаллизаторы. Отобранную природную воду фильтруют через бумажный фильтр для предупреждения попадания в культуру других организмов - конкурентов дафний по способу питания.
Заранее подготовленные стеклянные сосуды емкостью 3 - 5 л заполняют на 1/3 объема отфильтрованной природой водой и в них переносят дафний с помощью стеклянной трубки (внутренний диаметр 0,5 - 0,7 см) с оплавленным или опиленным надфилем концом, чтобы не травмировать рачков. Такую трубку используют и в дальнейшем при пересадке дафний.
Начальная плотность посадки - 6 - 10 особей на 1 л воды. Спустя 5 - 7 суток, в течение которых дафнии привыкают к лабораторным условиям существования и начинают размножаться, в сосуды доливают воду для дальнейшего культивирования.
1.3.2. Содержание культуры и кормление
Культуру дафний выращивают в климатостате, люминостате, боксе или помещении, не содержащем токсических паров или газов. Оптимальная температура для культивирования дафний и биотестирования составляет 20 + 2 °С, освещенность 400 - 600 лк при продолжительности светового дня 12 - 14 ч.
Не допускают освещения дафний прямыми солнечными лучами. Стеклянную посуду для содержания дафний моют питьевой водой, хромовой смесью или соляной кислотой. Нельзя использовать для мытья синтетические моющие средства и органические растворители. В помещении, где находятся дафнии, не проводят обработку инсектицидами, не хранят летучие вещества и не работают с ними. Для культивирования дафний используют водопроводную воду, которую отстаивают и насыщают кислородом с помощью микрокомпрессоров не менее 7 суток. Используют также природную воду из незагрязненных водоемов. Вода для культивирования должна удовлетворять следующим требованиям: pH 7,0 - 3,2; жесткость общая 3 - 4 мг экв/л; концентрация растворенного кислорода не менее 6,0 мг/л.
Оптимальная плотность культуры - 25 половозрелых самок в 1 л воды. Раз в 7 - 10 суток половину объема воды в сосуде с культурой дафний заменяют на свежую, удаляют сифоном скопившийся на дне осадок и при большой плотности культуры ее прореживают. Не рекомендуется аэрировать воду в сосудах с дафниями.
Кормом для дафний служат зеленые водоросли (хлорелла или сценедесмус) и хлебопекарные дрожжи. Культуру зеленых водорослей выращивают на одной из искусственных питательных сред (табл. 1).
Состав питательных сред для культивирования водорослей
|
Реактивы |
Содержание в среде, г/л |
||
|
Тамия |
Успенского № 1 |
Прага |
|
|
KNO3 |
5,00 |
0,025 |
0,100 |
|
K2НРО4 |
- |
- |
0,010 |
|
KН2РО4 |
1,25 |
0,025 |
- |
|
K2СО3 |
- |
0,0345 |
- |
|
MgSO4×7H2O |
2,50 |
0,025 |
0,010 |
|
Ca(NO3)2 |
- |
0,100 |
- |
|
FeSO4×7H2O |
0,003 |
- |
- |
|
FeCl3×6H2O |
- |
- |
0,001 |
|
Раствор микроэлементов1 |
1 мл |
1 мл |
1 мл |
________
1Н3ВО3 - 2,86; MnCl2, 4H2O - 1,81; ZnSO4-7H2O - 0,222, МоO3 - 17,64; NH4VO - 22,96 г/л.
Питательные среды готовят на дистилированной воде. Навеску каждого вещества растворяют в небольшом количестве воды, а зачем растворы сливают вместе в порядке расположения реактивов в табл. 1 (что бы избежать осадка) и доливают воду до соответствующего объема.
Раствор микроэлементов готовят отдельно. Перед посевом водорослей в 1 л питательной среды вносят 1 мл раствора микроэлементов. Среду Тамия перед посевом водорослей разбавляют дистиллированной водой в 3 - 5 раз.
Посев водорослей производят альгологически чистой культурой, которую выращивают в стерильных условиях (п. 4). Культуру водорослей вносят в питательную среду в количестве, дающем светло-зеленое окрашивание. Исходная концентрация около 2 тыс. кл/мл.
Культивируют водоросли в стеклянных кюветах, батарейных стаканах или плоскодонных колбах при круглосуточном освещении лампами дневного света 3000 лк и при постоянном продувании культуры воздухом с помощью микрокомпрессоров. Через 7 - 10 суток, когда окраска культуры водорослей становится интенсивно зеленой, их отделяют от питательной среды путем центрифугирования или отстаивания в холодильнике в течение 2 - 3 суток. Осадок разбавляют в два раза дистиллированной водой.
Суспензии хранят в холодильнике не более 14 суток. Водоросли вносят в культуру дафний из расчета 1 мл суспензии (600 - 1000 млн. кл/мл) на 1 л воды.
1 - 2 раза в неделю дафний кормят хлебопекарными дрожжами. Для приготовления дрожжевого корма 1 г свежих или 0,3 г воздушносухих дрожжей заливают 100 мл дистиллированной воды. После набухания дрожжи тщательно перемешивают. Образовавшуюся суспензию отстаивают в течение 30 мин. Надосадочную жидкость добавляют в сосуды с дафниями в количестве 3 мл на 1 л воды.
1.3.3. Адаптация дафний к среде с повышенной минерализацией
При необходимости биотестирования воды с общим содержанием солей свыше 3 г/л выращивают культуру, адаптированную к повышенной минерализации среды. Для этого в воду, в которой культивируют дафний и минерализация которой известна, постепенно порциями добавляют хлористый натрий. Вначале его вносят из расчета 500 мг/л. Через неделю минерализацию воды повышают еще на 250 мг/л. Через неделю минерализацию воды повышают еще на 250 мг/л. Эту операцию повторяют каждую неделю до тех пор, пока содержание солей в среде не достигнет нужного уровня (но не выше 6 г/л с учетом начальной минерализации). В дальнейшем достигнутый уровень минерализации среды поддерживают постоянно.
Эта же среда служит контролем при биотестировании и в качестве разбавляющей. Адаптированных к повышенному содержанию солей дафний нельзя использовать для тестирования вод с более низким содержанием солей.
1.4. Условия и процедура биотестирования
1.4.1. Подготовка дафний к биотестированию
Чтобы получить исходный материал для биотестирования, 30 - 40 самок дафний с выводковыми камерами, полными яиц или зародышей, за 1 - 3 суток до биотестирования пересаживают в 0,5 - 1 л емкости (стаканы, кристаллизаторы) с водой для культивирования, в которую перед посадкой дафний вносят корм. После появления молоди (каждая самка может выметать от 10 до 40 молодых дафний) взрослых особей удаляют. Односуточных дафний используют при кратковременном биотестировании, а двухсуточных самок при длительном биотестировании.
1.4.2. Условия биотестирования
Перед началом биотестирования в пробе воды определяют концентрацию растворенного кислорода, которая должна быть не менее 6,0 мг/л. Если она ниже 6,0 мг/л, то перед биотестированием воду аэрируют с помощью микрокомпрессора.
В процессе биотестирования аэрировать воду не рекомендуется.
Биотестирование проводят в климатостате, люминостате, боксе или помещении, в котором отсутствуют токсические пары или газы, при оптимальных температурном и световом режимах (п. 1.3.2.).
Результаты биотестирования считают правильными, если гибель дафний в контроле не превышает 10 % за весь период наблюдений и концентрация растворенного в тестируемой воде кислорода в конце биотестирования составляет не менее 2 мг/л.
1.4.3. Процедура биотестирования
Для определения наличия острого токсического действия контролируемой воды воду тестируют без разбавления.
Объем пробы воды для биотестирования - 500 мл.
Посадку дафний в сосуды для биотестирования проводят следующими способами (возможны и другие).
Стеклянной трубкой диаметром 0,5 - 0,7 см отлавливают дафний из культуры, помещают в сачок из планктонного газа, погрузив его в тестируемую воду, переводят в нее дафний, посадку ведут от разбавлений тестируемой воды с большей кратностью к меньшей;
стеклянной трубкой отлавливают дафний и вместе с водой, попавшей в трубку, переносят в пустой сосуд для биотестирования. Затем пастеровской пипеткой отсасывают жидкость и осторожно, чтобы не повредить дафний, приливают отмеренный объем тестируемой воды.
В сосуды наливают по 100 мл контрольной и тестируемой воды или ее разбавлений. Повторность трехкратная. В каждый сосуд помещают по 10 односуточных дафний и экспонируют при оптимальных условиях (п. 1.4.2) в течение времени до 96 часов. При кратковременном биотестировании дафний не кормят. Учет выживших дафний проводят через 1, 6, 24, 48, 72 и 96 часов. Особей считают выжившими, если они свободно передвигаются в толще воды или всплывают со дна сосуда не позднее 15 с после его легкого Покачивания. Если в любой учитываемый период времени в тестируемой воде гибнет 50 и более процентов дафний, биотестирование прекращают.
Для определения наличия хронического токсического действия воды в контрольном и других створах водного объекта воду тестируют без разбавления. Если требуется сравнить степень токсичности разных проб воды или использовать результаты биотестирования при установлении величин ПДС, готовят серию разбавлений. Определяют минимальную кратность разбавления, при которой хроническое токсическое действие не проявляется.
Объем пробы воды для биотестирования без разбавления - 1 л, с учетом разбавлений - 2 л.
В сосуды наливают по 300 мл контрольной и тестируемой воды или ее разбавлений. Повторность трехкратная. В каждый сосуд вносят одинаковое количество корма, помещают по 10 двухсуточных самок дафний и экспонируют при оптимальных условиях (п. 1.4.2). Дафний кормят ежесуточно. Три раза в неделю в сосудах производят смену контрольной и тестируемой воды на свежеотобранную. При смене воды дафний кормят за 3 часа до смены. С момента появления молоди, в те сутки, когда меняют воду, производят учет выживших исходных самок и выметанной молоди.
Для этого самок с помощью стеклянной трубки пересаживают в заранее подготовленные сосуды с контрольной и тестируемой водой (соответственно) и подсчитывают их количество в каждом сосуде. Оставшуюся воду процеживают через сито из планктонового газа. При этом на сите остается выметанная молодь, которую подсчитывают и удаляют.
После того, как в контроле все исходные самки дадут по четыре помета, биотестирование заканчивают. Время биотестирования сокращается, если при промежуточном подсчете устанавливают достоверное отличие от контроля показателя выживаемости или плодовитости дафний.
1.5. Обработка и оценка результатов при кратковременном биотестировании
При биотестировании воды для определения возможного наличия острого токсического действия рассчитывают процент погибших дафний (А) в тестируемой воде по сравнению с контролем.
|
|
Хк - среднее арифметическое количество дафний, выживших в контроле;
Хт - среднее арифметическое количество дафний, выживших в тестируемой воде.
Если А ≥ 50 %, тестируемая вода оказывает острое токсическое действие; если А < 50 %, тестируемая вода не оказывает острого токсического действия на дафний.
Степень острого токсического действия тестируемой воды рассчитывают графическим методом.
ЛКР50 - 96 ч - кратность разбавления тестируемой воды, при которой гибнет 50 % дафний за 96 часов;
ЛКP0 - 96 ч - минимальная кратность разбавления, при которой дафнии не гибнут за 96 часов.
На оси абсцисс (рис.1) откладывают логарифмы величин кратности разбавлений тестируемой воды, а на оси ординат - средние арифметические величины выживаемости дафний в процентах к контролю. Полученные точки соединяют прямой. От точек на оси ординат, соответствующих 50 и 100 % выживаемости, проводят линии, параллельные оси абсцисс. Из точек пересечения этих линий с экспериментальной прямой опускают перпендикуляры на ось абсцисс и находят логарифмы величин кратности разбавлений, которые будут соответствовать искомым величинам ЛКР50 и ЛКР0. Чем больше величины ЛКР50 и ЛКР0, тем токсичнее тестируемая вода.
Рис.1. Пример расчета средних разбавлений тестируемой воды, в которых выживают 50 (ЛКР50) и 100 % (ЛКР0) тест-объектов за установленный период: времени
Степень токсичности можно также установить, рассчитав ЛТ50 - среднее время гибели 50 % дафний в тестируемой воде. Для этого строят график (На оси абсцисс откладывают время наблюдения, на оси ординат - выживаемость в процентах к контролю. Чем меньше ЛТ50, тем токсичнее тестируемая вода.
Результаты биотестирования записывают по форме, указанной в таблице 2.
1.6. Обработка и оценка результатов при длительном биотестировании
При биотестировании воды из контрольного или других створов родного объекта вывод о наличии хронического токсического действия делают на основании установления достоверности различия между показателем выживаемости или плодовитости дафний в контроле и в тестируемой воде.
Для этого рассчитывают:
- среднее арифметическое показателей выживаемости и плодовитости в контрольной и тестируемой воде
|
|
n - количество повторностей;
Хi - количество выживших исходных самок или количество молоди в пересчете на одну исходную самку (Хi), последнее определяют по формуле:
|
|
Mi - количество молоди в каждом помете;
Vi - количество живых исходных самок, выметавших молодь;
- среднее квадратическое отклонение показателей выживаемости и плодовитости
|
|
- ошибку среднего арифметического показателей выживаемости и плодовитости
|
|
- критерий достоверности разности двух сравниваемых величин
|
|
![]() ,
, ![]() - средние арифметические показателя
выживаемости или плодовитости контроле и тестируемой воде;
- средние арифметические показателя
выживаемости или плодовитости контроле и тестируемой воде;
![]() ,
, ![]() - квадраты
ошибок средних арифметических.
- квадраты
ошибок средних арифметических.
Рассчитанные величины tα сравнивают со значениями критерия Стьюдента (tst) для уровня значимости Р = 0,05 и степени свободы nк+nк - 2. Если рассчитанная величина tα больше или равна значению критерия Стьюдента (tα ≥ tst), то различие между величинами показателя в контрольной и тестируемой воде достоверно.
В этом случае считают, что тестируемая вода оказывает хроническое токсическое действие на дафний.
Если рассчитанная величина tα меньше tst то различие между сравниваемыми величинами недостоверно. Тестируемая вода не оказывает хронического токсического действия на дафний, если отличия от контроля показателей выживаемости и плодовитости недостоверны.
Результаты биотестирования разбавлений тестируемой воды с целью их использования при установлении величин ПДС или определения степени хронического токсического действия тестируемой воды обрабатывают с помощью выше описанных приемов. Определяют минимальную кратность разбавления тестируемой воды, при которой различия между величинами показателей выживаемости и плодовитости дафний в контроле и соответствующем разбавлении будут недостоверными.
Если получают две разные величины минимальной кратности разбавления тестируемой воды (одну, при которой недостоверным будет отличие от контроля показателя выживаемости, и другую, при которой недостоверным окажется отличие от контроля показателя плодовитости), вывод об отсутствии хронического токсического действия на дафний делают на основании большей величины.
Результаты биотестирования записывают по форме, указанной в табл. 3.
Значения критерия Стьюдента
Число степеней свободы
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
12,71 |
4,30 |
3,18 |
2,78 |
2,57 |
2,45 |
2,37 |
2,31 |
2,26 |
2,23 |
1.7. Оборудование, материалы, реактивы
Используют обычное лабораторное оборудование, приборы, посуду, материалы и реактивы, в том числе:
- Климатостат, люминостат или бокс, обеспечивающий регулируемый режим освещенности и температуры;
- микроскоп бинокулярный стереоскопический (МБС-9 или -10);
- микрокомпрессоры АЭН по ТУ 16-064, 011-84;
- оксиметр-1 или кислородомер КЛ-115;
- газ планктоновый №№ 26 - 38;
- сачок из планктоного газа1;
- сито из планктонового газа2;
- дрожжи хлебопекарные по ГОСТ 171-81; ГОСТ 28483-90;
- культура зеленых водорослей (сценедесмус или хлорелла).
________
1Сачок для посадки дафний в сосуды для биотестирования изготавливают из планктоного газа №№ 26 - 35. Раму для сачка делают из стальной нержавеющей проволоки диаметром 1 мм. Диаметр сачка 2,5 - 3,0 см.
К раме крепят круг из планктоного газа диаметром 3,5 - 4,0 см, который вырезают из полотнища с помощью нагретого скальпеля. Оплавленный край газа облегчает его крепление к раме. Крепление производят с помощью хлопчатобумажных ниток № 80. Газ по периметру сачка распределяют равномерно, он не должен иметь складок, мешающих подсчету дафний в сачке и посадке в сосуды для биотестирования
2Бортики сита изготавливают из органического стекла толщиной 1,0 - 1,5 мм., дно из плонтоного газа №№ 31 - 35. все детали скрепляют органическим растворителем (дихлорэтаном) и подгоняют друг к другу так, чтобы между ними не оставалось щели, травмирующие дафний. Для облегчения подсчета рачков на дне сито с наружной стороны наносят сетку квадрата 5,0 мм.
2. Биотестирование с использованием цериодафний
2.1. Принцип методики
Принцип методики биотестирования с использованием цериодафний тот же, что в методике с использованием дафний (п. 1.1). Основным отличием является время биотестирования: до 48 ч при кратковременном и до 7 суток при длительном биотестировании.
Кратковременное биотестирование позволяет определить острое токсическое действие воды на цериодафний по их выживаемости. Критерием токсичности является гибель 50 и более процентов цериодафний за период времени до 48 ч в тестируемой воде по сравнению с контролем.
Длительное биотестирование позволяет определить хроническое токсическое действие воды на цериодафний по снижению их выживаемости и плодовитости. Показателем выживаемости служит количество выживших исходных особей в контроле и тестируемой воде, показателем плодовитости - среднее количество молоди, выметанной в течение биотестирования, в пересчете на одну выжившую исходную самку. Критерием токсичности является гибель 20 и более процентов цериодафний или достоверное снижение их плодовитости в тестируемой воде по сравнению с контролем за период времени до 7 суток.
Данный метод разработан американскими специалистами Д.И. Маунтом и Т.Дж. Норбергом и адаптирован к условиям биотестирования на территории России в Институте биологии внутренних вод АН и Центральной специализированной инспекции Минкомприроды.
В качестве тест-объекта служит Ceriodaphnia affinis Lilljeborg.
2.2. Характеристика тест-объекта
2.2.1. Систематическое положение, местообитание
Тип Arthropada
Класс Crustacea
Отряд Cladocera
Семейство Daphnudae
Род Ceriodaphnia
Вид Ceriodaphnia affinis Lilljeborg.
Этот вид распространен по всему земному шару. На территории России повсеместно: населяет преимущественно небольшие неглубокие озера, пруды, реки с замедленным течением.
2.3. Содержание культуры цериодафний в лабораторных условиях
Исходный материал для лабораторной культуры цериодафний можно получить в учреждениях-разработчиках настоящего РД1.
________
1Институт биологии внутренних вод РАН
Культуру цериодафний выращивают в климатостате, люминостате, боксе или помещении, в котором отсутствуют токсические пары или газы.
Оптимальные условия для содержания цериодафний: температура 25 + 2 °С, освещенность 400 - 600 лк. Для культивирования цериодафний используют дехлорированную, отстоянную водопроводную воду, которая должна удовлетворять следующим требованиям: pH 7,0 - 8,2, общая жесткость 1,3 - 2,0 мг экв/л, содержание растворенного кислорода - не менее 5,0 мг/л.
Рекомендуется содержать культуру цериодафний в кристаллизаторах объемом 2 - 3 л, которые заполняют водой наполовину. Используют и другие стеклянные сосуды указанного объема. Требования к чистоте посуды такие же, как и для дафний (п. 1.3.2).
Каждые 7 - 20 суток культуру цериодафний обновляют. Для этого отбирают 20 половозрелых самок и помещают в сосуды для культивирования, заполненные водой из расчета 50 - 100 мл на одну особь. При оптимальных условиях содержания цериодафнии выметывают молодь ежесуточно или раз в двое суток. Пометы молодых самок состоят из 2 - 6 особей.
Максимальное количество молоди получают от 7 - 20 дневных самок.
2.3.2. Кормление
Раз в сутки цериодафний кормят суспензией хлебопекарных дрожжей, раз в неделю - суспензией зеленых водорослей. Для приготовления дрожжевой суспензии 1 г свежих или 0,5 г сухих хлебопекарных дрожжей заливают 100 мл дистиллированной воды. После набухания суспензию тщательно перемешивают, а затем отстаивают в течение 30 мин. Надосадочную жидкость добавляют в сосуды с цериодафниями из расчета 5 мл суспензии на 1 л воды. Допускается хранить дрожжевую суспензию в холодильнике не более суток.
В качестве водорослевого корма для цериодафний рекомендуется использовать хлореллу, культуру которой выращивают на среде Тамия (п. 1.3.2.). Для кормления цериодафний водоросли отделяют от питательной среды центрифугированием или отстаиванием в холодильнике в течение 2 - 3 суток. Надосадочную жидкость сливают, а осадок разбавляют в два раза дистиллированной водой. Водорослевый корм добавляют в культуру цериодафний из расчета 0,5 мл суспензии (600 - 1000 млн. кл/мл) на 1 л воды. Кроме хлореллы, в качестве корма можно использовать культуру сценедесмус.
2.4. Условия и процедура биотестирования
2.4.1. Подготовка цериодафний к биотестированию
Для биотестирования используют молодых особей через 0 - 2 ч после рождения. Допустимо использовать 6 - 8 часовых особей, но разница в возрасте рачков не должна превышать 4 ч.
Чтобы получить одновозрастных цериодафний, из основной культуры отлавливают 10 - 20 половозрелых самок и помещают по одной в стеклянные сосуды, содержащие по 15 мл воды для культивирования. Раз в сутки цериодафний кормят, добавляя в сосуды по 0,05 мл суспензии хлебопекарных дрожжей.
Выметанную самками одновозрастную молодь изымают из сосудов, часть используют для биотестирования, а оставшуюся удаляют. В начале и конце рабочего дня удаляют молодь и тогда, когда биотестирование не проводят, иначе перенаселение окажет влияние на скорость размножения самок и количество молоди в помете.
По мере старения отсаженных самок и сокращения количества молоди в пометах их заменяют более молодыми.
2.4.2. Условия биотестирования
Объем пробы для биотестирования - 0,5 л.
Вначале в воде определяют концентрацию растворенного кислорода. Если она менее 5,0 мг/л., то воду насыщают кислородом до этого уровня с помощью микрокомпрессора. В процессе биотестирования не рекомендуется аэрировать тестируемую воду.
Биотестирование проводят в климатостате, люминостате, боксе или помещении, в котором обеспечивается оптимальная освещенность (400 - 600 лк) и температура (25 ± 5 °С). Для контроля и приготовления разбавлений используют воду, отвечающую требованиям, описанным в п. 2.3.1.
Результаты биотестирования считают правильными, если гибель цериодафний в контроле за весь период наблюдений не превышает 10 % и концентрация растворенного кислорода в тестируемой воде к концу биотестирования составляет не менее 2,0 мг/л.
2.4.3. Процедура биотестирования
Для определения наличия острого токсического действия тестируемой воды воду тестируют без разбавления Если требуется сравнить степень токсичности воды, отобранной из разных мест или в разное время, готовят серию разбавлений (не менее трех).
При биотестировании используют по 1 сосудов для контрольной, тестируемой воды и ее разбавлений. В каждый сосуд соответственно наливают по 15 мл контрольной, тестируемой воды или ее разбавлений и помещают по одной молодой цериодафнии. Цериодафний отлавливают пипеткой с диаметром отверстия 2,0 мм, переносят в сачок из планктонного газа и, погрузив сачок в воду, переводят в нее рачков.
Вначале сажают цериодафний в контрольную, а затем в тестируемую воду. При тестировании серии разбавлений подсадку ведут от большего разбавления к меньшему.
Учет выживших цериодафний проводят через 1, 6, 24 и 48 ч от начала биотестирования. Особи считают выжившими, если они свободно передвигаются в толще воды или всплывают со дна сосуда не позднее 15 с после его легкого покачивания. Если в любой учитываемый период в тестируемой воде гибнет 50 и более процентов тест-объектов, биотестирование прекращают. В течение 48 ч цериодафний не кормят.
Для определения наличия хронического токсического действия воды в контрольном и других створах водного объекта воду тестируют без разбавления. Если требуется сравнить степень токсичности разных проб воды или использовать результаты биотестирования при установлении величин НДС, готовят серию разбавлений. Определяют минимальную кратность разбавления, при которой хроническое токсическое действие не проявляется.
При длительном биотестировании так же, как и при кратковременном, используют по 10 сосудов для контрольной, тестируемой воды и ее разбавлений, в которые наливают по 15 мл каждой воды соответственно. Затем во все сосуды помещают по одной молодой цериодафнии. Раз в сутки рачков кормят суспензией дрожжей, которую вносят в каждый сосуд в количестве 0,05 мл.
Ежесуточно производят смену контрольной и тестируемой воды на свежеотобранную. При смене воды подсчитывают количество выживших исходных цериодафний и выметанной молоди. Исходных цериодафний пересаживают в сосуды, в которых произведена смена воды, а молодь после подсчета удаляют.
После того как в контроле все исходные самки дадут по три последовательных помета, биотестирование заканчивают.
Время биотестирования сокращается, если при промежуточном подсчете устанавливают гибель 20 и более процентов исходных цериодафний по сравнению с контролем или достоверное отличие от контроля показателя плодовитости.
2.5. Обработка и оценка результатов при кратковременном биотестировании
При биотестировании для определения возможного острого токсического действия воды рассчитывают по формуле (см. п. 1.5) процент погибших цериодафний в тестируемой воде по сравнению с контролем. Если гибель цериодафний составляет 50 и более процентов, то тестируемая вода оказывает острое токсическое действие. Если гибель составляет менее 50 %, тестируемая вода не оказывает острого токсического действия на цериодафний.
Для определения степени острого токсического действия тестируемой воды рассчитывают графическим методом (см. рис. 1):
ЛКР50-48 - кратность разбавления тестируемой воды, при которой гибнет 50 % цериодафний за 48 ч;
ЛКР0-48 - минимальную кратность разбавления, при которой цериодафнии не гибнут за 48 ч.
Чем больше величины ЛКР050-48, и ЛКР0-48, тем токсичнее тестируемая вода.
Степень токсичности можно также установить, рассчитав ЛТ50 - время гибели 50 % цериодафний в тестируемой воде. Для этого строят график (на оси абсцисс откладывают время наблюдений, на оси ординат выживаемость в процентах к контролю). Чем меньше ЛТ50, тем токсичнее тестируемая вода. Результаты биотестирования записывают по форме, указанной в табл. 2.
2.6. Обработка и оценка результатов при длительном биотестировании
При биотестировании воды из контрольного и других створов водного объекта вывод о наличии хронического токсического действия делают на основании расчетов процента гибели цериодафний по сравнению с контролем и достоверности отличия от контроля показателя плодовитости цериодафний.
По формуле (см. п. 1.5) рассчитывают процент погибших цериодафний в тестируемой воде. Если гибель за период времени до 7 суток составляет 20 и более процентов по сравнению с контролем, то тестируемая вода оказывает хроническое токсическое действие на цериодафний по показателю выживаемости. Достоверность отличия от контроля показателя плодовитости цериодафний в тестируемой воде рассчитывают с помощью приемов, описанных в п. 1.6. По формуле рассчитывают критерий достоверности разности показателей плодовитости в контрольной и тестируемой воде (td) и сравнивают его с критерием Стьюдента (tst) для уровня значимости Р = 0,05 и степеней свободы (nк - 1) + (nт - 1), где nк, nт - количество повторностей в контроле и тестируемой воде (табл. 3).
Если рассчитанная величина td больше или равна значению критерия Стьюдента (td ≥ tst), то различие между величинами показателя плодовитости в контрольной и тестируемой воде достоверно. В этом случае считают, что тестируемая вода оказывает хроническое токсическое действие на цериодафний по показателю плодовитости.
Тестируемая вода не оказывает хронического токсического действия на цериодафний, если их гибель составляет менее 20 процентов по сравнению с контролем и отличие от контроля показателя плодовитости недостоверно (td < tst).
Для определения степени хронического токсического действия природной воды на цериодафний и при использовании результатов биотестирования для установления величин ПДС находят минимальную кратность разбавления тестируемой воды, при которой хроническое токсическое действие не проявляется по показателям выживаемости и плодовитости. С этой целью графическим методом (рис. 2) рассчитывают величину ЛКP0 (минимальную кратность разбавления тестируемой воды, при которой цериодафнии не гибнут за 7 суток) и определяют величину минимальной кратности разбавления, при которой отличие от контроля показателя плодовитости недостоверно. Из двух найденных величин минимальной кратности разбавления на основании большей делают вывод об отсутствии хронического токсического действия тестируемой воды на цериодафний.
Результаты биотестирования записывают по форме, указанной в табл. 3
2.7. Оборудование, материалы, реактивы
Используют обычное лабораторное оборудование, приборы, посуду, материалы, в том числе указанные в п. 1.7, а также:
- лупу бинокулярную;
- стекла часовые;
- пипетки диаметром 2 мм;
- грушу резиновую;
- сачок для отлова цериодафний.
Таблица 2
|
Дата отбора пробы |
Место отбора пробы |
Время от начала тестирования |
Количество выживших дафний, экз. |
Процент к контролю |
Кол-во выживших дафний, экз. |
Процент к контролю |
Оценка тестируемой воды |
|||||||||||||
|
контрольная вода |
тестируемая вода без разбавления |
тестируемая вода, разбавленная в раз. |
оказывает (не оказывает) острое токсическое действие |
ЛТ50 |
ЛКР50-96 |
ЛКР0-96 |
||||||||||||||
|
повторность |
среднее арифметическое |
повторность |
среднее арифметическое |
повторность |
среднее арифметическое |
|||||||||||||||
|
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
и |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
Примечание. Графы 19 - 21 заполняют в том случае, если определяют степень токсичности тестируемой воды.
Форма записи результатов биотестирования при определении хронического токсического действия воды на дафний
|
Дата отбора пробы |
Место отбора пробы |
Время от начала тестирования |
Контрольная вода |
Тестируемая вода |
Критерий достоверности различия показателей в контроле и тестируемой воде |
Оценка тестируемой воды |
||||||||||||||||||
|
кол-во выживших исходных самок, экз. |
Кол-во выметанной молоди, экз. |
Кол-во молоди в пересчете на одну выжившую исходную самку |
кол-во выживших исходных самок, экз. |
Кол-во выметанной молоди, экз. |
Кол-во молоди в пересчете на одну выжившую исходную самку |
выживаемости |
плодовитости |
оказывает (не оказывает) хроническое (токсичес) |
минимал. кратнос. разбавления когда токсич. действие не проявляется |
|||||||||||||||
|
Повторность |
Повторность |
|||||||||||||||||||||||
|
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
Примечание. Графу 25 заполняют в том случае, если определяют степень токсичности тестируемой воды.
ПРИЛОЖЕНИЕ 6: БИОТЕСТИРОВАНИЕ С ИСПОЛЬЗОВАНИЕМ ВОДОРОСЛЕЙ
1. Принцип метода
Метод основан на определении изменения интенсивности размножения водорослей при воздействии токсических веществ, содержащихся в тестируемой воде, по сравнению с контролем. Показателем интенсивности размножения является коэффициент прироста численности клеток водорослей.
Кратковременное биотестирование - 96 ч позволяет определить наличие острого токсического действия тестируемой воды на водоросли, а длительное - 14 суток - хронического токсического действия.
Критерием токсичности является достоверное снижение коэффициента прироста численности клеток в тестируемой воде по сравнению с контролем.
В качестве тест-объекта служит культура водорослей Scenedesmus-guadricauda (Тurр) Breb или Chlorella vulgaris Beijer.
2. Характеристика тест-объектов
2.1. Сценедесмус как тест-объект Систематическое положение:
Отдел Chlorophyta
Класс Euchlorophyceae
Порядок Chlorococcales
Семейство Scenedesmaceae
Подсемейство Scenedesmoideae
Род Scenedesmus Meyen
Вид Scenedesmus quadricauda (Turp.) Berb
Данный вид относится к ценобиальным организмам. Ценобии 2-, 4-, реже 8-, 16-клеточные, в виде плоских пластинок. Клетки удлиненно-овальные, с закругленными концами. Краевые клетки имеют два отогнутых наружу рога. Оболочка гладкая. Размеры клеток 7 - 43×2,5 - 16 мкм. Размножение автоспорами. Автоспоры в материнской оболочке располагаются пучком, после освобождения разворачиваются в виде пластинки. Иногда (особенно в условиях культуры) вместо ценобиев образуются отдельные клетки. Вид широко распространен в разнообразных биотопах, главным образом в планктоне пресных водоемов.
2.2. Хлорелла как тест-объект Систематическое положение:
Отдел Chlorophyta
Класс Euchlorophyceaе
Порядок Chlorococcales
Семейство Chlorellaceae
Подсемейство Chlorelloideae
Род Chlorella Beijer
Вид Clorella vulgaris Beijer
Хлорелла относится к одноклеточным водорослям. Клетки шаровидные с тонкой оболочкой, без слизи. Хроматофор чашевидный, с пиреноидом. Размножение автоспорами, образующимися по 4 - 8, реже 16 и освобождающимися через разрыв материнской оболочки. Диаметр клеток 4,2 - 10,5 мкм.
Широко распространенный вид.
Водоросли выращивают на искусственной питательной среде Успенского № 1 (табл. 1).
|
Реактивы |
Содержание. г/л |
|
|
в среде для культивирования |
в растворах солей для биотестирования |
|
|
KNO3 |
0,025 |
50,0 |
|
MgSО4⋅7H2О |
0,025 |
50,0 |
|
KН2РО4 |
0,025 |
50,0 |
|
K2СО3 |
0,0345 |
69,0 |
|
Са(NO3)2 |
0,1 |
200.0 |
|
Раствор микроэлементов1 |
1 мл |
- |
________
1Н3ВО3 - 2,86; MnCl2 - 74H2O - 1,81;.ZnSO4⋅7H2O - 0,222 г/л; МоO3 - 17,64; NH4VO3 - 22,96 мг/л
Раствор микроэлементов вносят в среду после стерилизации, перед посевом.
Питательную среду для культивирования водорослей готовят согласно процедуре подготовки корма для дафний (п. 1.3.2 Приложения 5).
Для биотестирования готовят отдельно по 100 мл раствора каждой соли (табл. 1). Питательную среду, растворы отдельных солей и микроэлементов стерилизуют в автоклаве в течение 45 - 60 мин при 1 атм. Колбы для культивирования водорослей стерилизуют сухим жаром в течение 1 ч при 180 °С.
Культуру водорослей вносят в стерильную колбу с питательной средой в количестве, дающем светло-зеленое окрашивание. После посева колбу закрывают стерильной ватно-марлевой пробкой и колпачком из пергаментной бумаги. Культивируют водоросли при круглосуточном освещении лампами дневного света, размещенными на расстоянии 30 - 40 см от поверхности культуры, освещенность 2000 - 3000 лк. Водоросли можно выращивать на окне при естественном освещении, защищая их от прямых солнечных лучей.
Культуру водорослей периодически перемешивают, встряхивая 1 - 2 раза в сутки. Оптимальная температура для выращивания водорослей 18 - 20 °С.
4. Условия биотестирования
Для посева используют 5 - 7-суточную культуру водорослей, находящуюся в стадии экспоненциального роста. Перед биотестированием ее сгущают фильтрованием через мембранный фильтр № 4 или фильтровальную бумагу (синяя лента) с помощью аппарата Зейтца. Клетки можно также сконцентрировать отстаиванием культуры и последующим отсасыванием среды из колбы.
С фильтра водоросли переносят в колбы с 30 - 50 мл контрольной воды. Проверяют численность суспензии клеток, которую используют для посева. Численность клеток в суспензии должна составлять 5 - 10 млн.
Для подсчета численности клеток используют счетную камеру Горяева или Фукс-Розенталя. Камеру и относящееся к ней покровное стекло обезжиривают, покровным стеклом накрывают камеру и притирают его до образования радужных колец интерференции. Из каждой колбы пипеткой наносят по одной капле тщательно перемешанной суспензии на верхний и нижний края покровного стекла. Камеру заполняют так, чтобы не образовывались пузырьки воздуха, избыток суспензии вытесняется по канавкам. Просматривают 16 квадратов по диагонали или все поле камеры в случае малой численности водорослей (при одном заполнении камеры просчитывают не менее 50 клеток). Из каждой колбы просматривают не менее трех проб. Вычисляют по формуле количество клеток водорослей М в 1 мл суспензии
|
|
m - количество подсчитанных клеток;
n - количество просчитанных маленьких квадратов камеры;
V - объем части камеры, имеющей площадь маленького квадрата.
Биотестирование проводят при оптимальных температуре и освещении (п. 3).
5. Процедура биотестирования
Объем пробы тестируемой воды 0,5 л. При кратковременном биотестировании воды в колбы емкостью 250 мл наливают по 100 мл контрольной или тестируемой воды. Повторность двухкратная. В каждую колбу пипеткой добавляют по 0,5 мл сгущенной культуры водорослей, по 0,1 мл каждого солевого раствора и раствора микроэлементов (табл. 1).
Колбы закрывают ватно-марлевыми пробками, их содержимое тщательно перемешивают и в каждой колбе определяют исходную численность клеток, которая должна составлять 25 - 50 тыс. кл/мл. Колбы помещают в люминостат или в хорошо освещенное место, защищенное от прямых солнечных лучей.
Через 96 часов биотестирование заканчивают. В каждой колбе учитывают численность клеток для определения наличия острого токсического действия тестируемой воды.
При длительном биотестировании воды из контрольного или других створов водного объекта проводят те же операции, что и при кратковременном биотестировании. Первый учет численности клеток водорослей производят через 96 ч от начала биотестирования, чтобы определить наличие острого токсического действия тестируемой воды.
При отсутствии острого токсического действия биотестирование продолжают. На седьмые сутки от начала биотестирования производят смену контрольной и тестируемой воды на свежеотобранную. Для этого в новую партию колб емкостью 250 мл наливают по 75 мл контрольной или тестируемой воды из свежеотобранной пробы, в каждую колбу добавляют вышеуказанное количество растворов солей и микроэлементов.
Тщательно перемешивают содержимое колб, в которых проводили биотестирование в течение первых 7 суток.
Пипеткой с резиновой грушей из содержимого каждой колбы по 25 мл, переносят в свежеприготовленный раствор и перемешивают. Затем в каждой колбе определяют численность клеток и продолжают биотестирование еще в течение 7 суток. Через 14 суток устанавливают, оказывает ли тестируемая вода хроническое токсическое действие на водоросли.
6. Обработка и оценка результатов
Для определения наличия острого или хронического действия тестируемой воды на водоросли рассчитывают коэффициент прироста численности клеток водорослей К в контроле и тестируемой воде
|
|
Nt - численность клеток водорослей в контроле или тестируемой воде через учитываемый промежуток времени t, кл/мл;
N0 - исходная численность клеток, кл/мл.
При длительном биотестировании N0 в контрольной и тестируемой воде определяют на седьмые сутки, после того, как была произведена смена воды. Используемые приемы статистической обработки, описанные в приложении 5, устанавливают достоверность различия коэффициента прироста численности клеток в контроле и тестируемой воде. Достоверное снижение коэффициента прироста численности клеток в тестируемой воде по сравнению с контролем свидетельствуют о наличии острого или хронического токсического действия.
Результаты биотестирования записывают по форме, указанной в табл. 2.
7. Оборудование, материалы, реактивы
Используется обычное лабораторное оборудование, приборы, посуда и реактивы, в том числе:
- автоклав по ГОСТ 9586-75;
- аппарат Зейтца или другой фильтровальный аппарат;
- дозаторы пипеточные на 0,1 и 0,5 мл П1 по ТУ 64-1-3329-81;
- камера счетная Горяева или Фукс-Розенталя по ТУ 64-1-816-77;
- люминостат;
- микроскоп биологический «Виолам»;
- фильтры мембранные № 4.
|
Дата отбора пробы |
Место отбора пробы |
Тестируемая вода |
Время от начала биотестирования (сут.) |
Численность водорослей тыс. кл/мл повторность |
Коэффициент прироста численности |
Оценка тестируемой воды, оказывает (не оказывает) острое или хроническое токсическое действие |
||||
|
повторность |
среднее арифметическое |
критерий достоверности |
||||||||
|
1 |
2 |
1 |
2 |
|
|
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
Контрольная |
0 |
|
4 |
|
|
7 |
|
|
14 |
|
|
Оцениваемая природная (из источника водоснабжения) |
0 |
|
4 |
|
|
7 |
|
|
14 |
Примечание. В начале биотестирования и на седьмые сутки подсчитывают исходную численность клеток N0.
ПРИЛОЖЕНИЕ 7: БИОТЕСТИРОВАНИЕ С ИСПОЛЬЗОВАНИЕМ РЫБ
1. Принцип метода
Метод основан на сравнении выживаемости рыб в тестируемой воде и контроле.
Кратковременное биотестирование - до 96 ч - позволяет определить острое токсическое действие воды на рыб по их выживаемости. Показателем выживаемости служит среднее количество тест-объект» ь, выживших в тестируемой воде или контроле за определенное время.
Критерием токсичности является гибель 50 и более процентов рыб за период времени до 96 ч в тестируемой воде по сравнению с контролем.
Длительное биотестирование - до 30 суток - позволяет определить хроническое токсическое действие тестируемой воды на рыб по их выживаемости.
Критерием токсичности является достоверное снижение выживаемости рыб в тестируемой воде по сравнению с контролем.
В качестве тест-объектов используют рыб, широко применяемых в международных и национальных стандартах по биотестированию воды - гуппи (Роесiliа reticulata Peters) или данио (Brachudanio rerio Hamilton-Buchanan).
2. Характеристика тест-объектов,
условия их содержания и разведения
2.1. Гуппи как тест-объект
Систематическое положение:
|
Тип |
Chordata |
|
Класс |
Piscet |
|
Отряд |
Cuprinodontiformes |
|
Семейство |
Poecilidae |
|
Род |
Роесiliа |
|
Вид |
Роесiliа reticulatus Peters |
Гуппи - один из распространенных видов аквариумных рыб. В природе они обитают в тропических водоемах, где играют важную экологическую роль, уничтожая личинок москитов и комаров.
Гуппи - мелкие рыбы с ярко выраженным половым деморфизмом. Самцы обычно мельче самок (3 - 4 см) и окрашены в более яркие цвета. В их окраске преобладают серовато-коричневые тона с очень яркими красными, голубыми, зелеными и черными вкраплениями и точками. Самки достигают 6 см в длину, обычно желтовато-зеленые.
Для содержания гуппи используют термостатируемые аквариумы, обеспечивающие плотность посадки тест-объектов из расчета 1 - 2 л воды на 1 экз., производителей - 4 л на 1 экз. Аквариумы размещают в помещении, не содержащем токсических паров или газов, и заполняют водопроводной водой, предварительно отстоянной в течение 3 суток. Вода для содержания гуппий должна отвечать следующим требованиям: Жесткость 2,8 - 4,0 мг, экв /л, pH 7,0 - 8,0, температура 24 - 27 °С. Воду в аквариумах аэрируют с помощью микрокомпрессоров. Еженедельно 1/5 объема воды в аквариуме меняют на свежую, температура которой не должна отличаться от таковой в аквариуме. Первоначальный объем воды в аквариумах поддерживают, доливая дистиллированную воду вместо испарившейся. Со дна аквариумов регулярно убирают сифоном ил.
Перед размещением рыб аквариумы засаживают мелколистными и плавающими растениями. Аквариумы освещают ярким верхним светом не менее 8 ч в сутки. Для этого используют электролампы накаливания или люминесцентные.
Кормят тест-объекты 1 - 2 раза в сутки, производителей 3 - 5 раз сухим (дафнии, циклопы) или живым кормом (мотыль, трубочник, дафнии, циклопы). По возможности следует избегать сухого корма. Наряду с эти кормом необходимо дополнительное питание растительной пищей (водорослями, салатом, листьями аквариумных растений и т.п.).
Корм вносят в таком количестве, чтобы рыбы съедали его без остатка в течение 3 - 5 минут, так как его излишки приводят к-ухудшению качества воды в аквариуме.
Для получения молоди отбирают производителей без признаков заболеваний не старше 2 лет (продолжительность жизни гуппий 3 - 3,5 года).
Самку, готовую к вымету, помещают в отдельную термостатируемую нерестовую емкость объемом не менее 4 л, заполненную водопроводной водой с температурой 25 ± 1 °С и с небольшим количеством мелколистных растений. Готовность самки к вымету мальков определяют по наличию хорошо заметного темного пятна перед анальным плавником. При этом форма брюшка приближается к прямоугольной и оно становится намного шире спины.
После окончания вымета самок изолируют, так как они поедают потомство.
Мальки рождаются совершенно сформированными. Лучшим кормом для них является «пыль», состоящая из инфузорий, коловраток, молоди ветвистоусых рачков и науплиусов веслоногих рачков. При отсутствии «пыли» молодь гуппи кормят перетертыми сухими дафниями или любым другим измельченным сухим кормом. На 100 рыб вносят не более 1 г. По мере роста в рацион рыб вводят измельченный трубочник, мотыль, коретру и другой живой корм. Одно-двухнедельных мальков кормят до 5 раз в сутки, более взрослых - 2 - 3 раза. Вносимые порции корма должны быть небольшими и поедаться рыбами в течение 3 - 5 минут.
Мальков сортируют по размерам и постепенно переводят из нерестовых аквариумов в вырастные (вначале объемом 50 л, а затем 200 л).
Мальки становятся половозрелыми в 4 - 6 месяцев.
2.2. Данио как тест-объект
Систематическое положение:
|
Тип |
Chordata |
|
Класс |
Piscet |
|
Отряд |
Cypriniformes |
|
Семейство |
Cyprinidae |
|
Род |
Brachydanio |
|
Вид |
Brachydanio rerio (Hamilton-Buchanan) |
Данио - широко распространенная аквариумная рыба. В природе она обитает в медленно текущих водоемах Юго-Восточной Азии. Длина тела взрослых рыб около 4,5 см тело имеет цилиндрическую форму, серебристое с 7 - 9 темно-синими горизонтальными полосами. Эти полосы идут к хвостовому и анальному плавникам. Спина оливково-зеленая.
Данио исключительно подвижны, ведут стайный образ жизни. Поэтому в лабораториях их содержат в просторных, удлиненных аквариумах, негусто засаженных растениями. Аквариумы заполняют отстоянной в течение 3 суток водопроводной водой температурой 23 ± 1 °С и pH 7,7 - 8,2.
Воду в аквариумах аэрируют с помощью микрокомпрессоров. Освещение обычное с естественной сменой дня и ночи. Плотность посадки рыб не более 30 шт. на 70 л воды. Кормят взрослых данио 1 - 2 раза в сутки живым (белые черви, мотыль, дафнии, артемии), а также сухим кормом. Корм в аквариумы вносят в таком количестве, чтобы рыбы съедали его в течение часа без остатка. Еженедельно со дна аквариума убирают сифоном ил и доливают дистиллированную или свежую отстоянную водопроводную воду до первоначального объема.
Для получения молоди самок и самцов отделяют друг от друга и кормят живым кормом. Плотность посадки на этот период такая же, как и при содержании.
В конце второй недели самцы приобретают густой золотистый блеск, а самки значительно увеличиваются за счет икры.
Аквариум, предназначенный для нереста, наполняют свежей отстоянной водопроводной водой с жесткостью не более 4,0 мг, экв/л, температурой 27 °С, pH 6,8 - 6,9. В аквариум помещают сетку с ячейкой 3 мм. Сетка предназначена для охраны икры и мальков, так как взрослые рыбы нередко интенсивно их поедают. При размещении сетки следят, чтобы оставалось пространство объемом не менее 1 л для плавания рыб
Утром в нерестовый аквариум помещают самок и кормят сухим кормом. Вечером в этот же аквариум помещают 9 самцов и рыб еще раз кормят1. Затем выключают свет. Для стимулирования нереста утром включают свет. После того, как самки отнерестились, взрослых рыб отсаживают, а икринки оставляют развиваться. Через 24 - 36 ч из них выводятся личинки, которые прилипают к стенкам аквариума, а через 4 - 5 суток начинают свободно плавать. С этого момента их начинают кормить: вначале инфузориями, коловратками или личинками низших ракообразных, а затем более крупным кормом. Через месяц молодь данио помещают в 200 л аквариумы и кормят смесью живого и другого подходящего корма. Рыб кормят часто и обильно. Через 3 месяца рыбы становятся половозрелыми, их длина достигает 3,5 см.
_______
1подробно см. Ильин М.Н. Аквариумное рыбоводство, М. изд. МГУ, 1977
3. Условия биотестирования
Для биотестирования используют гуппи в возрасте 1 - 3 недель или половозрелых данио.
Биотестирование проводят при освещении рассеянным светом с естественной сменой дня и ночи, концентрации кислорода в воде не менее 4 мг/л и температуре воды для гуппи 25 ± 1 °С, для данио 23 ± 1 °С. Гибель рыб в контроле не должна превышать 10 %.
Объем воды для биотестирования 20 л.
В аквариум наливают по 10 л контрольной или тестируемой воды. Повторность двухкратная. В каждый аквариум помещают по 10 рыб. Воду в контрольных и опытных аквариумах аэрируют с помощью микрокомпрессоров. Смену воды в контрольных и опытных аквариумах на свежеотобранную производят через 2 суток. При этом рыб быстро переносят с помощью сачка из одного аквариума в другой.
Ежесуточно в каждом аквариуме подсчитывают количество выживших рыб и удаляют погибших. Погибшими считают рыб, не подающих признаков движения или дыхания в течение 5 минут после прикосновения к ним стеклянной палочкой.
Для определения наличия острого токсического действия воды биотестирование проводят в течение 96 ч. Если в любой учитываемый период времени гибнет 50 и более процентов рыб, биотестирование прекращают. При кратковременном биотестировании рыб не кормят.
Для определения наличия хронического токсического действия воды биотестирование проводят в течение 30 суток. Если при промежуточном подсчете устанавливают достоверное отличие от контроля показателя выживаемости рыб в тестируемой воде, время биотестирования сокращается.
5. Обработка и оценка результатов
Результаты биотестирования обрабатывают, используя приемы, описанные в пп. 1.5 и 1.6 Приложения 5.
Если при биотестировании длительностью до 96 ч процент погибших рыб в тестируемой воде по сравнению с контролем равен или больше 50, тестируемая вода оказывает острое токсическое действие, если меньше, тестируемая вода не оказывает острого токсического действия на рыб.
Вывод о наличии хронического токсического действия воды делают на основании определения достоверности различия выживаемости рыб в контроле и тестируемой воде. Достоверное снижение выживаемости рыб в тестируемой воде по сравнению с контролем свидетельствует о наличии хронического токсического действия тестируемой воды на рыб.
Результаты биотестирования записывают по формам, указанным в табл. 1 и 2.
6. Оборудование и материалы
Используют обычное лабораторное оборудование, приборы, посуду, материалы и реактивы, в том числе:
- аквариумы объемом 200, 50 и 10 л;
- микрокомпрессоры АЭН по ТУ 16-064.011-84;
- оксиметр-1 или кислородомер КП-115;
- сачки;
- корм для рыб.
Форма записи результатов биотестирования при определении острого токсического действия на гуппи (данио)
|
Дата отбора пробы |
Место отбора проб |
Время от начала биотестирования |
Контрольная вода |
Тестируемая вода |
Процент погибших рыб по сравнению с контролем |
Оценка тестируемой воды: оказывает (не оказывает) острое токсическое действие |
||||
|
количество выживших рыб, экз. |
количество выживших рыб. экз. |
|||||||||
|
повторность |
среднее арифметическое |
повторность |
среднее арифметическое |
|||||||
|
1 |
2 |
1 |
2 |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
Форма записи результатов биотестирования при определении хронического токсического действия на гуппи (данио)
|
Дата отбора пробы |
Место отбора проб |
Время от начала биотестирования |
Контрольная вода |
Тестируемая вода |
Критерий достоверности |
Отличие от контроля (достоверное или недостоверное) |
Оценка тестируемой воды: оказывает (не оказывает) хроническое токсическое действие |
||||
|
количество выживших рыб, экз. |
количество выживших рыб, экз. |
||||||||||
|
повторность |
среднее арифметическое |
повторность |
среднее арифметическое |
||||||||
|
1 |
2 |
1 |
2 |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |