Государственное санитарно-эпидемиологическое нормирование
Российской Федерации
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы выявления и идентификации
патогенных бактерий-возбудителей
инфекционных заболеваний с пищевым
путём передачи в продуктах питания
на основе ПЦР с гибридизационно-
флуоресцентной детекцией
Методические указания
МУК 4.2.2872-11
Москва 2011
1. Разработаны: Научно-исследовательским институтом питания РАМН (В.А. Тутельян, С.А. Шевелева, Н.Р. Ефимочкина, С.Ю. Батищева, И.Б. Быкова, А.В. Булахов, А.В. Ананьева); ФГУН «ЦНИИ эпидемиологии» Роспотребнадзора (В.И. Покровский, Г.А. Шипулин, А.Т. Подколзин, Т.А. Николаева).
2. Рекомендованы государственной Комиссией по санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (от 2.06.2011 протокол 1).
3. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 15 июня 2011 г.
4. Введены в действие с момента утверждения.
5. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель Федеральной службы Г.Г. Онищенко 15 июня 2011 г. Дата введения: с момента утверждения |
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы выявления и идентификации
патогенных
бактерий-возбудителей инфекционных заболеваний
с пищевым путём передачи в продуктах питания
на основе ПЦР с гибридизационно-флуоресцентной
детекцией
Методические
указания
МУК 4.2.2872-11
1. Область применения
1.1. Настоящие методические указания устанавливают метод ускоренного выявления (посредством ПЦР с гибридизационно-флуоресцентной детекцией) в продуктах питания патогенных бактерий - возбудителей острых и хронических инфекционных заболеваний с пищевым путём передачи (родов Salmonella, Shigella (в комплексе с энтероинвазивными E.coli), вида Enterobacter (Cronobacter) sakazakii, энтерогеморрагических веротоксигенных Escherichia coli, термофильных Campylobacter spp. видов C.jejuni, C.coli, C.lari, а также Listeria monocytogenes).
1.2. Методические указания предназначены для специалистов лабораторий Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, а также иных организаций и учреждений, занимающихся вопросами оценки качества и безопасности пищевых продуктов, аккредитованных (лицензированных) на проведение соответствующих исследований в установленном порядке.
2. Определения, обозначения, сокращения
ПЦР - полимеразная цепная реакция
ДНК - дезоксирибонуклеиновая кислота
РНК - рибонуклеиновая кислота
FEP - детекция по «конечной точке»
FRT - детекция в режиме «реального времени»
ВКО - внутренний контрольный образец
ОКИ - острые кишечные инфекции
ТСБДЭ - триптон-соевый бульон с дрожжевым экстрактом
ТСАДЭ - триптон-соевый агар с дрожжевым экстрактом
ФБР - фосфатный буферный раствор
ЗПВ - забуференная пептонная вода
ЗФР - забуференный физиологический раствор
3. Общие положения
3.1. Лабораторный контроль загрязнённости пищевых продуктов патогенными бактериями с использованием традиционных культуральных методов анализа сопряжён с трудоемкостью, длительностью. Даже в случае отрицательного результата требуется от 3-х до 7-ми дней для выдачи ответа. Этот срок увеличивается при идентификации изолятов биохимическими и серологическими методами, что обусловливает проблемы при расследовании вспышек ОКИ и других заболеваний с пищевым путём передачи. Так, при вспышках шигеллёза, занимающих ведущее место в структуре ОКИ пищевого происхождения в РФ, из-за низкой эффективности выделения возбудителя в чистой культуре из инкриминированных продуктов возникают значительные трудности при верификации инцидентов.
Наряду с этим, среди микробных контаминантов пищи получают всё большее распространение возбудители новых и вновь возникших заболеваний с изменёнными свойствами, дополнительными факторами патогенности (по терминологии ФАО-ВОЗ «эмерджентные» патогены), такие как энтерогеморрагические E.coli (0157:H7 и другие серотипы), Campylobacter jejuni, Enterobacter (Cronobacter) sakazakii, Listeria monocytogenes. Культуральные методы зачастую не позволяют провести их чёткую дифференциацию от родственных непатогенных штаммов, имеющих одинаковые фенотипические свойства. Это снижает достоверность результатов, осложняет оценку распространенности патогенов в пищевых продуктах, а также не гарантирует от необоснованных браковок продукции.
3.2. Существенно оптимизировать процедуры определения, сократить время исследований и повысить специфичность позволяют новые технологии геномного анализа. Наиболее надёжным в последние годы признаётся анализ микробных нуклеиновых кислот и выявление специфичных участков ДНК путём ПЦР с гибридизационно-флуоресцентной детекцией.
3.3. Представленный в настоящих указаниях метод является альтернативным классическому бактериологическому посеву и предусматривает ускоренное определение наличия или отсутствия ДНК, и соответственно, бактерий родов Salmonella, Shigella, вида Enterobacter (Cronobacter) sakazakii, энтерогеморрагических Escherichia coli, термофильных Campylobacter spp. видов C.jejuni, C.coli, C.lari, Listeria monocytogenes в определенной массе (объеме) пищевого продукта, подвергнутого инкубации в жидких селективных питательных средах (при необходимости дополнительно прединкубации в неселективных средах).
______________
* При наличии эпидемиологических данных о возможности массивного заражения пищевого продукта искомыми возбудителями и только в ходе расследования вспышек пищевых отравлений и инфекций допускается исследовать инкриминированные образцы нативных пищевых продуктов с целью получения предварительных данных о причинном агенте вспышки. При этом положительные результаты ПЦР-анализа нативных пищевых продуктов должны подтверждаться выделением возбудителя в культуре, а отрицательные результаты не должны интерпретироваться и не могут служить основанием для прекращения поиска возбудителя с предварительной инкубацией в питательных средах.
3.5. ПЦР с гибридизационно-флуоресцентной детекцией также подлежит включению в комплексное тестирование подозрительных культур патогенных микроорганизмов, выделенных из пищевых продуктов бактериологическими методами (согласно утвержденным в установленном порядке методам определения), с целью подтверждения их принадлежности к родам Salmonella, Shigella, Campylobacter (видов C.jejuni, C.coli, C.lari), Listeria (вида L. monocytogenes), энтерогеморрагическим E.coli и E.(Cr.) sakazakii в качестве дополнительных к биохимическим и серологическим методам идентификации, в т. ч. в обязательном порядке при:
· затруднениях идентификации Salmonella spp. - взамен расширенного набора биохимических тестов в случаях отсутствия агглютинации культуры с поливалентной диагностической сальмонеллезной 0-сывороткой (А, В, С, D, Е) и со смесью 0-сывороток редких групп при положительном результате стандартного набора биохимических тестов; при предположительном результате в случае наличия агглютинации с сыворотками редких групп; при положительных результатах серологического исследования и нетипичных результатах биохимических тестов (отклонения по 2 и более признакам),
· идентификации энтерогеморрагических E.coli (0157:H7 и другие серотипы) - взамен расширенного набора биохимических тестов одновременно с подтверждением серологической принадлежности к серогруппе 0157,
· идентификации L.monocytogenes - взамен расширенного набора биохимических тестов одновременно с определением наличия лецитиназной и β-гемолитической активности,
· идентификации других вышеперечисленных микроорганизмов при нетипичных результатах биохимических тестов (отклонения по 2 и более признакам).
3.6. Метод применяется для исследования пищевых продуктов при осуществлении государственного санитарно-эпидемиологического надзора (контроля), скрининговых исследований для целей гигиенического мониторинга, санитарно-эпидемиологических экспертиз и оценок, санитарно-эпидемиологических расследований вспышек пищевых отравлений и инфекций с пищевым путем передачи, а также может быть использован для проведения производственного контроля продовольственного сырья и пищевых продуктов.
4. Сущность метода
4.1. Принципом метода является выявление путём ПЦР с гибридизационно-флуоресцентной детекцией последовательностей (фрагментов) ДНК, строго специфических для геномов бактерий родов Salmonella, Shigella, вида Enterobacter (Cronobacter) sakazakii, веротоксигенных Escherichia coli, Listeria monocytogenes, термофильных Campylobacter spp. В основе ПЦР лежит многократное увеличение числа копий (амплификация) нуклеотидных фрагментов-мишеней ДНК, ферментом Taq-полимеразой в присутствии синтетических олигонуклеотидных праймеров и дезоксирибонуклеозидтрифосфатов. Гибридизация флуоресцентно-меченых олигонуклеотидных зондов, присутствующих в составе реакционной смеси, с комплементарным участком амплифицируемой ДНК-мишени сопровождается нарастанием флуоресценции. Измерение интенсивности флуоресцентного сигнала позволяет регистрировать накопление специфического продукта амплификации.
4.2. Метод ускоренного выявления предусматривает высев определенных количеств исследуемых образцов пищевых продуктов в соответствующие неселективные и селективные питательные среды, инкубирование посевов для накопления микроорганизмов, экстракцию (выделение) ДНК из культуральной жидкости*, амплификацию участка ДНК целевых бактерий со специфичными праймерами и гибридизационно-флуоресцентную детекцию ампликонов, осуществляемую в одном из двух вариантов: в режиме реального времени в ходе ПЦР (вариант FRT) либо после завершения амплификации (вариант FEP).
______________
* В случае исследования образцов нативных пищевых продуктов или бактериальных культур, выделенных из пищевых продуктов, - экстракция ДНК осуществляется из соответствующим образом подготовленных проб этих продуктов или чистых культур, выращенных на пластинчатых средах по п. 8.5.1.
При использовании варианта FEP детекция флуоресцентного сигнала осуществляется после окончания ПЦР с помощью флуоресцентного ПЦР-детектора (по «конечной точке»), а при использовании варианта FRT - непосредственно в ходе ПЦР с помощью амплификатора с системой детекции флуоресцентного сигнала в режиме «реального времени».
Выделение ДНК из каждого исследуемого образца проводится в присутствии внутреннего контрольного образца (ВКО), используемого на всех этапах исследования, начиная с этапа экстракции ДНК.
Детекция амплифицированной ДНК целевого микроорганизма и ВКО проводится по самостоятельным раздельным каналам.
4.3. При положительных результатах обнаружения патогена жизнеспособность присутствующих в исследуемом продукте искомых микроорганизмов должна быть подтверждена бактериологическим посевом с соответствующим биохимическим и серологическим типированием или ПЦР-анализом парных проб (прошедшей и не прошедшей культуральное обогащение) в режиме FRT.
4.4. Анализ осуществляется с применением коммерчески доступных комплектов реагентов, обеспечивающих амплификацию и детекцию ампликонов в одной пробирке, прошедших регистрацию в РФ в установленном порядке после стандартизации относительно официально утвержденных методов анализа.
5. Требования к выполнению анализов
5.1. Работа по выявлению бактериальных патогенов в пищевых продуктах должна проводиться в лаборатории, выполняющей микробиологические и молекулярно-биологические (ПЦР) исследования и лицензированной на деятельность, связанную с использованием возбудителей инфекционных заболеваний III - IV групп патогенности, с соблюдением СП 1.3.2322-08 «Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней», а также дополнениями и изменениями к ним СП 1.3.2518-09 - «Дополнения и изменения 1 к СП 1.3.2322-08 «Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней» (приложение), ГОСТ Р ИСО 7218-2008 «Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям» и методических указаний МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности».
Исследуемые образцы пищевых продуктов следует рассматривать как инфекционно-опасные и организовывать их хранение в соответствии с СП 1.3.2322-08 «Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней».
5.2. Исследование осуществляется с применением описанных в настоящих указаниях методов культурального бактериологического анализа и коммерчески доступных ПЦР тест-систем с гибридизационно-флуоресцентной детекцией продуктов амплификации, предназначенных для применения в данной области и разрешенных к применению на территории РФ в установленном порядке. Для экстракции ДНК и ее детекции методом ПЦР должны применяться наборы реагентов, предусматривающие возможность использования внутреннего контрольного образца, проходящего все этапы исследования и служащего для выявления возможных ошибок при его проведении.
5.3. Условия безопасного проведения работ.
Процесс амплификации приводит к накоплению миллионов копий фрагментов ДНК, специфичных для целевых организмов. При вскрытии ПЦР-пробирок, прошедших этап амплификации в «чистых» зонах ПЦР-лаборатории или в микробиологической лаборатории, продукты амплификации могут распространяться по лаборатории и обуславливать появление ложно-положительных результатов исследований.
Для снижения риска распространения ампликонов и предотвращения контаминации необходимо соблюдать ниже перечисленные правила работы в соответствии с МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности»:
1) не открывать ПЦР-пробирки после амплификации, удалять отходы с продуктами ПЦР только в закрытом виде;
2) перед входом в рабочую зону снимать уже использованные перчатки. Заранее готовить новые перчатки, перед тем как покинуть рабочую зону;
3) сбрасывать наконечники с пипеток в пластиковый пакет и выносить его после каждого использования из рабочей зоны;
4) промывать рабочую зону после каждого использования дезсредством*;
5) для биологической зашиты рабочей зоны использовать ультрафиолетовые облучатели до и после работы в течение 15 - 30 мин;
6) деконтаминировать пипетки еженедельно согласно рекомендациям производителя (121 °С в течение 30 мин);
7) обрабатывать охлаждающие блоки в следующей последовательности: обработка дезсредством*, ополаскивание водой и протирка сухой салфеткой перед размещением в холодильнике;
8) убирать и дезинфицировать разлитые образцы или реактивы, используя дезсредства*;
9) утилизировать неиспользованные образцы и реактивы.
В случае обнаружения контаминации (положительный результат в ПЦР с гибридизационно-флуоресцентной детекцией для отрицательного контрольного образца), вся рабочая зона должна быть подвергнута тщательной санитарной обработке. Для этого необходимо следовать перечисленным указаниям:
10) санитарную обработку проводить в перчатках;
11) протереть наружные поверхности раствором дезсредства*. Оставить жидкость на поверхности примерно на 10 мин, затем вытереть насухо одноразовыми салфетками. Затем протереть поверхности 70 % этиловым спиртом. Облучить поверхности ультрафиолетом в течение ночи;
______________
* Дезинфицирующие средства в соответствии СП 1.3.2322-08 «Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней».
12) утилизировать все расходные материалы (наконечники для пипеток, растворы реагентов и т.д.), которые были извлечены из упаковок и частично израсходованы, путем автоклавирования при 121 °С в течение 30 мин;
13) очистить наружные поверхности всех используемых приборов и инструментов (амплификатор, пипетки и т.д.) с применением дезсредства и спирта;
14) простерилизовать пипетки и все использованные инструменты и приспособления, стойкие к автоклавированию, при 121 °С в течение 30 мин или в соответствии с рекомендациями производителей.
При выполнении анализов также необходимо соблюдать требования техники безопасности по ГОСТ 12.0.004-90, в т.ч. при работе с химическими реактивами - по ГОСТ 12.1.007-76, требования пожарной безопасности - ГОСТ 12.1.004-91 и электробезопасности - по ГОСТ 12.1.019-79, а также требования, изложенные в технической документации на амплификатор, сушильный шкаф, центрифуги, в инструкциях по применению наборов реагентов (тест-системы) для экстракции ДНК и для выявления ДНК методом ПЦР с гибридизационно-флуоресцентной детекцией.
Необходимо избегать контакта компонентов наборов с кожей, глазами и слизистыми оболочками носа и рта; при попадании немедленно промыть пораженное место водой и обратиться за медицинской помощью.
5.4. Требования к подготовке персонала.
Выполнение измерений могут проводить только специально обученные специалисты, способные после освоения техники ПЦР - анализа и приемов по эксплуатации аппаратуры получать результаты в пределах нормативов оперативного контроля погрешности.
Персонал должен допускаться к работе в одноразовой лабораторной одежде (халат, шапочка, резиновые или пластиковые перчатки, маска, бахилы).
5.5. Условия выполнения измерений (детекции).
Измерения проводятся в нормальных лабораторных условиях при:
1) температуре окружающего воздуха (20 ± 5) °С,
2) атмосферном давлении (97 ± 10) кПа,
3) относительной влажности (65 ± 15) %.
Наборы реагентов (тест-системы) для экстракции ДНК и для выявления ДНК методом ПЦР с гибридизационно-флуоресцентной детекцией должны применяться строго по назначению, согласно прилагаемых инструкций, и не использоваться по истечении срока годности.
6. Аппаратура, материалы, лабораторная посуда, реактивы и питательные среды
6.1. Аппаратура и инструменты
Общего назначения
|
Анализатор потенциометрический, погрешность измерений рН ± 0,01 |
|
|
Шкаф сушильно-стерилизационный, позволяющий поддерживать температуру в диапазоне от 50 до 200 °С с погрешностью ±2 °С Термостат суховоздушный с рабочей температурой 37 °С, рабочий диапазон от 20 до 60 °С, точность поддержания температуры ±1 °С Термостат суховоздушный с рабочей температурой 42 °С, рабочий диапазон от 20 до 60 °С, точность поддержания температуры ±1 °С Анаэробный инкубатор или настольная система для анаэробного инкубирования Баня водяная с подогревом, позволяющая поддерживать температуру (37 ± 1) °С Баня водяная с терморегулятором, позволяющая поддерживать температуру от 0 до 100 °С |
|
|
Весы лабораторные общего назначения, 2 и 4 класса точности, с наибольшим пределом взвешивания 200 г |
|
|
Микроскоп биологический бинокулярный с увеличением 900× - 1000× |
|
|
Стерилизаторы паровые медицинские |
|
|
Дистиллятор, обеспечивающий качество дистиллированной воды по ГОСТ 6709-72 Гомогенизатор бактериологический перистальтического типа «Микс-2», «Стомайкер», «Максикатор» Бокс абактериальной воздушной среды (ПЦР-бокс) или ламинарный шкаф класса биологической безопасности II тип А Автоматическая станция для экстракции ДНК типа экстрактора NucliSENS® easyMAG® в комплекте |
|
|
Компьютер, совместимый с программным обеспечением амплификатора/детектора, в комплекте с монитором, клавиатурой, мышью, кабелем, компакт-дисками с информацией по эксплуатации и инструкциями по настройке прибора Аппарат для встряхивания типа «Вортекс», скорость вращения 250 - 3000 мин-1 Микроцентрифуга настольная типа «Эппендорф» (частота вращения не менее 13000 мин-1) Термостат типа «ТЕРМО 24-15» для пробирок типа «Эппендорф» вместимостью 1,5 см3, диапазон температур от 15 до 120 °С - 2 шт. Автоматические дозаторы с переменным объемом дозирования (от 5 до 20 мм3 с шагом 0,01 мм3, с точностью ±0,8 % и от 20 до 200 мм3 с шагом 0,1 мм3, с точностью ±0,6 %) Диспенсер Распределительная емкость, объем 1 - 2,5 дм3 Вакуумный отсасыватель медицинский с колбой-ловушкой для удаления надосадочной жидкости Насос вакуумный (водоструйный) Холодильник от 2 до 8 °С с морозильной камерой не выше -16 °С для хранения выделенных проб |
|
|
ДНК |
|
|
Облучатель бактерицидный настенный ОБН-150 или других видов Денситометр для бактериальных суспензий |
|
|
Пинцет медицинский |
|
|
Ножницы медицинские |
ГОСТ 21239-89 |
|
Скальпель хирургический, 15 см Ложки столовые стальные |
|
|
Часы механические сигнальные |
|
|
Электроплитка Центрифуга, обеспечивающая 20000×g Аппарат универсальный для встряхивания жидкости в колбах и пробирках (или другая аппаратура для встряхивания) При детекции FEP - «по конечной точке»: |
|
|
- программируемый амплификатор типа «Терцик» («ДНК-Технология», Россия), «Gradient Palm Cyclen» («Corbett Research», Австралия), «MAXYGENE» («Axygen», США), «GeneAmp PCR System 2700» («Applied Bio-systems») или аналогичные по техническим характеристикам - флуоресцентный ПЦР-детектор типа «АЛА-1/4» («Bio-San», Латвия), «Джин» («ДНК-Технология», Россия) или аналогичные по техническим характеристикам - одноразовые полипропиленовые пробирки для ПЦР (плоская крышка, нестрипованные): а) объемом 0,2 см3 (для амплификаторов, адаптированных для ПЦР-пробирок 0,2 см3); б) объемом 0,5 см3 (для амплификаторов, адаптированных для ПЦР-пробирок 0,5 см3) При детекции FRT - в режиме «реального времени»: - программируемый амплификатор с системой детекции флуоресцентного сигнала в режиме «реального времени» типа «Rotor-Gene» 3000/6000 («Corbett Research», Австралия), «Rotor-Gene Q» («Qiagen», Германия), «iQ5» («Bio-Rad», США), «М×3000Р» («Stratagene», США), «ДТ-96» («ДНК-Технология», Россия) или аналогичные по техническим характеристикам - одноразовые полипропиленовые пробирки для ПЦР в «реальном времени»: а) на 0,2 см3 (плоская крышка, нестрипованные, для постановки в ротор на 36 пробирок) - для приборов с детекцией через дно пробирки; б) на 0,2 см3 (куполообразная крышка, для приборов с детекцией через крышку) |
6.2. Лабораторная посуда и материалы
|
Бумага пергаментная |
|
|
Бумага фильтровальная лабораторная |
|
|
Вата медицинская гигроскопическая |
|
|
Марля медицинская |
ГОСТ 9412-77 |
|
Колбы плоскодонные конические или круглые различной вместимости |
|
|
Воронки стеклянные |
|
|
Колбы стеклянные мерные плоскодонные, вместимостью 25, 50, 100, 200, 1000 см3 |
|
|
Цилиндры стеклянные мерные лабораторные, вместимостью 25, 100, 1000 см3 |
|
|
Пробирки микроцентрифужные типа «Эппендорф», вместимостью 0,2, 0,5, и 1,5 см3 Пробирки стрипованные для автоматического экстрактора ДНК Микропипетки на 100 - 1000 мм3 с шагом 5,0 мм3, с точностью ±0,5 % Наконечники одноразовые с фильтром для дозаторов с переменным объёмом дозирования от 5 до 20; от 20 до 200; от 200 до 1 000 мм3; до 10 см3 Штативы для микропробирок объемом 0,2, 0,5 см3 и 1,5 см3 (или в соответствии с используемыми комплектами реагентов) Оптически прозрачные крышки для ПЦР-пробирок |
|
|
Пипетки вместимостью 1, 2, 5 и 10 см3 |
|
|
Пробирки типов П1, П2 |
|
|
Стекла предметные для микропрепаратов |
|
|
Чашки биологические (Петри) стеклянные или одноразовые из полимерных материалов Банки стеклянные широкогорлые на 250 и 500 см3 с пробками (корковыми, ватно-марлевыми) или завинчивающимися крышками Контейнеры стерильные из полимерных материалов с крышками для отбора образцов |
|
|
Спиртовки лабораторные стеклянные |
|
|
Термометр ртутный с диапазоном измерения от 0 до 100 °С (цена деления шкалы 1 °С) Пакеты стерильные одноразовые для гомогенизаторов перистальтического типа Пакеты газогенераторные для микроаэробного инкубирования Набор отраслевых стандартных образцов для визуальной оценки мутности микробных взвесей ОСО 42-28-85-04П, ГИСК им. Л.А. Тарасевича Фильтры мембранные микроцеллюлозные № 3 |
|
|
Система (аппарат) для мембранной фильтрации Стандарты МакФарланда № 1, 2, 3 Контейнер для сброса наконечников Петля бактериологическая, калиброванная на 1 мм3 Одноразовые халаты, шапочки, маски, обувь или бахилы, одноразовые перчатки резиновые или латексные неопудренные |
6.3. Реактивы, питательные среды, дезсредства
|
Реагенты для проведения ПЦР |
|
|
Комплект реагентов (набор) для выделения ДНК из исследуемого материала или аналогичный по техническим характеристикам |
ТУ 9398-003-01897593-2009 |
|
Комплект реагентов (набор) для выделения ДНК/РНК из исследуемого материала или аналогичный по техническим характеристикам |
ТУ 9398-071-01897593-2008 |
|
Комплекты реагентов (наборы) для проведения ПЦР с гибридизационно-флуоресцентной детекцией, обеспечивающие аналитическую чувствительность на уровне 1×103 ГЭ/см3 в отношении выявляемых фрагментов ДНК патогенных бактерий Cronobacter sakazakii, вероцитотоксигенных E.coli, Shigella spp., Salmonella spp., Campylobacter spp. (видов C.jejuni, C.coli, C.lari) и Listeria monocytogenes, содержащие: - смеси олигонуклеотидных праймеров на участки ДНК бактерий и флуоресцентно-меченых олигонуклеотидных зондов, комплементарных участкам амплифицируемых ДНК-мишеней; - полимеразу (TaqF); - смесь буфера и нуклеозидтрифосфатов; - ДНК-буфер; - положительные контрольные образцы этапа ПЦР со специфическими фрагментами ДНК искомых микроорганизмов и внутренним контрольным образцом; - отрицательный контрольный образец и внутренний неконкурентный контрольный образец этапа выделения; - минеральное масло для ПЦР. |
|
|
силика магнитная в растворе для автоматизированной экстракции ДНК, NucliSens easyMAG Magnetic Silica, BioMerieux, Франция буфер лизирующий для автоматизированной экстракции ДНК, NucliSens easyMAG Lysis Buffer, BioMerieux, Франция буфер для экстракции 1 для автоматизированной экстракции ДНК, NucliSens easyMAG Extraction Buffer 1, BioMerieux, Франция буфер для экстракции 2 для автоматизированной экстракции ДНК, NucliSens easyMAG Extraction Buffer 2, BioMerieux, Франция буфер для экстракции 3 для автоматизированной экстракции ДНК, NucliSens easyMAG Extraction Buffer 3, BioMerieux, Франция |
|
|
Питательные среды для обогащения микроорганизмов, приготовления бактериальных взвесей и их компоненты: |
|
|
стерильный фосфатный буфер с рН 7,2 ± 0,1 для предварительного неселективного обогащения бактерий Е.(Cr.) sakazakii |
ГОСТ Р 52814-07, МУК 4.2.2428-08, ГОСТ 26669-85, ГОСТ 29184-91 |
|
стерильный изотонический 0,85 %-й водный раствор хлорида натрия для предварительного неселективного обогащения бактерий Е.(Cr.) sakazakii среда Кесслер с глюкозой бульон Мак-Конки с глюкозой глюкозный бульон с бриллиантовым зеленым и желчью |
|
|
среда Кесслер с лактозой лактозный бульон с бриллиантовым зеленым и желчью грам-негативный обогащающий бульон (GN-бульон) по Хайну |
|
|
селенитовая среда жидкая в модификации Лейфсона (селенитовый бульон) |
ГОСТ 29184-91, Инструкции о порядке расследования и проведения лабораторных исследований в учреждениях санитарно-эпидемиологической службы при пищевых отравлениях. М., 1975 |
|
маннитный селенитовый бульон мясо-пептонный бульон или МПА с 1 % глюкозы, МПБ с 1 % глюкозы забуференная пептонная вода для предварительного неселективного обогащения бактерий рода Salmonella |
ГОСТ Р 52814-07, МУ «Лабораторная диагностика сальмонеллезов человека и животных, обнаружение сальмонелл в кормах, продуктах питания и объектах внешней среды». М, 1990 |
|
молоко сухое обезжиренное среда Раппапорта-Вассилиадиса с соей (RVS-бульон) питательная среда для накопления сальмонелл сухая (селенитовый бульон) |
|
|
Мюллер-Кауфман тетратионатный бульон (МКТ-бульон) основа селективного бульона (Престона) для накопления кампилобактерий основа селективного бульона (Дойла) для накопления кампилобактерий кровь баранья дефибринированная стерильная аэротолерантная добавка на основе натрия пировиноградно-кислого, железа (II) серно-кислого, натрия метабисульфита добавка антибиотиков для кампилобактерий-I (по Блэйзер-Вонг) добавка антибиотиков модифицированная III (по Дойлу) добавка антибиотиков для кампилобактерий-IV (по Престону) модифицированная |
|
|
Питательный бульон для выделения и культивирования листерий (ПБЛ) |
Опытно-промышленное производство «Питательные среды» ГНЦ ПМБ Роспотребнадзора, Оболенск |
|
бульон Фрейзера для вторичного обогащения листерий бульон Фрейзера для обогащения листерий эскулин железа аммонийного цитрат литий хлористый, х.ч. или ч.д.а. налидиксовая кислота акрифлавина гидрохлорид (трипафлавин) натрия гидроксид, х.ч. гуанидина гидрохлорид, Sigma, США тритон Х-100 |
|
|
ЭДТА (этилендиаминтетрауксусная кислота), х.ч. трис-HCl, Sigma, США суспензия двуокиси кремния силикагель (SiO2) ацетон, х.ч. |
ТУ 6-09-11-1721-83 |
|
хлороформ водонасыщенный |
ТУ 6-09-4263-76 |
|
2-меркаптоэтанол, х.ч. смесь газов 5 % O2, 15 % СO2 и 80 % N2, х.ч. в баллонах ацетон, х.ч. |
ТУ 6-09-08-1024-81 |
|
Вода деионизированная |
ОСТ 11.029.003-80 |
|
Дезинфицирующие средства |
|
|
спирт этиловый ректификованный дезинфицирующие средства (0,2 %-й раствор ДП-2Т, Дезолон и др.) |
Примечание. Допускается использование других реактивов, питательных сред и диагностических тест-систем, не хуже указанных выше, с аналогичными составом и техническими характеристиками.
Питательные среды и препараты отечественного производства должны вырабатываться по нормативной документации, утвержденной в установленном порядке; зарубежного производства - должны быть зарегистрированы в РФ и иметь международный сертификат качества ИСО 9001:2008.
Использование диагностических тест-систем допускается после их регистрации в РФ в установленном порядке, после процедуры стандартизации относительно официально утвержденных методов анализа.
6.4. Тест-штаммы микроорганизмов
|
Listeria monocytogenes, типичный по культуральным, морфологическим и биохимическим свойствам |
паспортизированные и депонированные в установленном порядке в ГИСК им. Л.А. Тарасевича |
|
Enterobacter (Cronobacter) sakazakii, типичный по культуральным, морфологическим и биохимическим свойствам |
паспортизированные и депонированные в установленном порядке в ГИСК им. Л.А. Тарасевича |
|
Campylobacter jejuni, Campylobacter coli, Campylobacter lari, типичные по культуральным, морфологическим и биохимическим свойствам |
паспортизированные и депонированные в установленном порядке в ФГУН ГНЦ ПМБ (Оболенск) |
|
Salmonella typhimurium & enteritidis, типичные по культуральным, морфологическим и биохимическим свойствам |
паспортизированные и депонированные в установленном порядке в ГИСК им. Л.А. Тарасевича |
|
Shigella sonnei, типичные по культуральным, морфологическим и биохимическим свойствам |
паспортизированные и депонированные в установленном порядке в ГИСК им. Л.А. Тарасевича |
Примечание: Штаммы необходимо сохранять в лиофильно высушенном виде. При регулярном использовании допускается сохранять в полужидком агаре для бруцелл в пробирках с плотно притертыми пробками, в защищенном от света месте, при температуре (5 ± 1) °С с еженедельным пересевом.
7. Подготовка к проведению испытаний
7.1. Приготовление растворов и реактивов
7.1.1. Растворы и реактивы общего назначения
7.1.1.1. Изотонический 0,85 %-й водный раствор хлорида натрия готовят в соответствии с ГОСТ 10444.1-84 «Консервы. Приготовление растворов, красок, индикаторов, питательных сред, применяемых в микробиологическом анализе».
7.1.1.2. Растворы и реактивы для окраски микроскопических препаратов по Граму, растворы красителей (кристаллического фиолетового, генцианвиолета, метилвиолета, бриллиантового зелёного, бромкрезолового пурпурного и др.), растворы гидроокиси натрия и соляной кислоты для нейтрализации высококислотных продуктов готовят в соответствии с ГОСТ 10444.1-84 или по прописям, указанным на этикетках соответствующих препаратов промышленного производства.
7.1.1.3. Фосфатный буферный раствор (ФБР) с рН (7,2 ± 0,1) готовят в соответствии с нижеследующей прописью:
7.1.1.3.1. ФБР:
однозамещенный фосфорно-кислый калий безводный, КН2РО4 - 0,45 г, двухзамещенный фосфорно-кислый натрий безводный, Na2HPO4 - 5,34 г, дистиллированная вода 1000 см3.
Растворяют ингредиенты в дистиллированной воде в мерной колбе, доводят объём до метки, устанавливают рН таким образом, чтобы после стерилизации он составлял (7,2 ± 0,1) при температуре 25 °С. Раствор разливают в широкогорлые колбы подходящей вместимости с учётом засеваемой навески продукта (например, 900 см3 при посеве 100 г образца). Стерилизуют при температуре (121 ± 1,0) °С в течение 15 мин.
7.1.1.3.2. При добавлении к 1 дм3 ФБР хлористого натрия в количестве 9 г до стерилизации получают фосфатный буферный 0,9 % раствор NaCl.
7.1.1.4. Забуференную пептонную воду (ЗПВ) готовят в соответствии с нижеследующей прописью:
пептон - 10 г,
хлористый натрий - 5 г,
двухзамещенный фосфорно-кислый натрий 12-водный, Na2HPO4 ∙ 12 Н2O - 9 г,
однозамещенный фосфорно-кислый калий, КН2РO4 - 1,5 г,
вода - 1000 см3.
Растворяют ингредиенты в воде при нагревании, доводят объём до метки, устанавливают рН таким образом, чтобы после стерилизации он составлял (7,0 ± 0,2) при температуре 25 °С. Разливают в широкогорлые колбы и флаконы подходящей вместимости с учётом засеваемой навески продукта (например, 225 см3 при посеве 25 г, 450 см3 при посеве 50 г образца и т.п.). Стерилизуют при температуре (121 ± 1,0) °С в течение 15 мин.
7.1.2. Растворы и реактивы, предназначенные для выявления определенных групп патогенов
7.1.2.1. ЗПВ с обезжиренным молочным порошком для неселективного обогащения при исследовании какао и какаосодержащих продуктов на содержание бактерий рода Salmonella готовят в соответствии с нижеследующей прописью: перед стерилизацией в 1000 см3 ЗПВ добавляют 100 г обезжиренного молочного порошка.
7.1.2.2. Аэротолерантную добавку для селективных бульонов Престона и Дойла готовят в соответствии с нижеследующей прописью:
натрий пировиноградно-кислый - 6,25 г,
железо (II) серно-кислое - 6,25 г,
натрий метабисульфит - 6,25 г,
стерильная дистиллированная вода - 100 см3.
Растворить натрий пировиноградно-кислый в 10 - 20 см3 стерильной дистиллированной воды, после растворения довести объем воды до 100 см3. Добавить железо (II) серно-кислое и натрия метабисульфит. Разлить в пробирки по 4 см3. Хранить в защищенном от света месте при температуре минус 20 °С не более 1 месяца. Раствор чрезвычайно чувствителен к воздействию света, после его добавления к питательным средам их необходимо сохранять в защищенном от света месте.
7.2. Приготовление питательных сред
7.2.1. Среды сухие промышленного изготовления, аналогичные поименованным в п. 6.3, готовят согласно прописям, указанным на этикетках.
Допускается применение сред лабораторного приготовления из отдельных компонентов в соответствии с нижеследующими пунктами:
7.2.2. Питательный агар с 1 % глюкозы и питательный бульон с 1 % глюкозы (МПА с 1 % глюкозы, МПБ с 1 % глюкозы) готовят в соответствии с ГОСТ 10444.1-84 «Консервы. Приготовление растворов, красок, индикаторов, питательных сред, применяемых в микробиологическом анализе».
ферментативный гидролизат казеина - 17,0; пептон соевый - 3,0; натрий хлористый - 5,0; фосфат калия однозамещенный - 2,5; глюкоза - 2,5; дрожжевой экстракт - 6,0; агар микробиологический (для ТСАДЭ) - 15,0.
Компоненты растворяют в 1000 см3 дистиллированной воды, тщательно перемешивают, устанавливают рН (7,3 ± 0,2) и автоклавируют при 121 °С в течение 15 мин. Готовые среды разливают в стерильные колбы или пробирки и хранят в защищенных от света условиях при температуре не выше 8 °С.
7.2.4. Среду Кесслер с глюкозой готовят в соответствии с нижеследующей прописью:
пептон - 10 г,
глюкоза - 2,5 г,
желчь крупного рогатого скота сухая - 5 г (натуральная 50 см3),
1 %-й водный раствор кристаллического фиолетового (генцианвиолета, метилвиолета) - 2 см3,
дистиллированная вода - 1000 см3.
Компоненты растворяют в 1000 см3 дистиллированной воды, нагревают на слабом огне до кипения, кипятят 1 - 2 мин, доводят объём до 1 дм3, фильтруют через ватно-марлевый фильтр, охлаждают до 45 - 55 °С. Устанавливают рН таким образом, чтобы после стерилизации он составлял (7,3 ± 0,2) при температуре 25 °С. Разливают в пробирки с поплавками по 10 см3, автоклавируют при (114 ± 1,0) °С в течение 20 мин.
7.2.5. Глюкозный бульон с бриллиантовым зеленым и желчью готовят в соответствии с нижеследующей прописью:
пептон - 10 г,
глюкоза - 5 г,
двухзамещенный фосфорно-кислый натрий безводный, Na2НPO4 - 6,45 г,
однозамещенный фосфорно-кислый калий безводный, КН2РО4 - 2 г,
желчь крупного рогатого скота сухая - 20 г (натуральная 200 см3),
0,5 %-ный водный раствор бриллиантового зеленого - 3 см3,
дистиллированная вода - до 1000 см3.
Компоненты растворяют в 1000 см3 дистиллированной воды, нагревают на слабом огне до кипения, кипятят 1 - 2 мин, доводят объём до 1 дм3, фильтруют через ватно-марлевый фильтр, охлаждают до 45 - 55 °С. Устанавливают рН таким образом, чтобы он составлял (7,2 ± 0,1) при температуре 25 °С, после чего повторно доводят до кипения. Разливают в стерильные пробирки с поплавками по 10 см3.
7.2.6. Бульон Мак-Конки с глюкозой готовят в соответствии с нижеследующей прописью:
пептон - 20 г,
глюкоза - 10 г,
хлористый натрий - 5 г,
желчь крупного рогатого скота сухая - 5 г (натуральная 50 см3),
1,0 %-й щелочной (в растворе гидроокиси натрия с концентрацией 0,02 моль/дм3) раствор бромкрезолового пурпурного - 1 см3,
дистиллированная вода - до 1000 см3.
Компоненты растворяют в 1000 см3 дистиллированной воды, нагревают на слабом огне до кипения, кипятят 1 - 2 мин, доводят объём до 1 дм3, фильтруют через ватно-марлевый фильтр, охлаждают до 45 - 55 °С. Устанавливают рН таким образом, чтобы после стерилизации он составлял (7,2 ± 0,1) при температуре 25 °С. Разливают в пробирки с поплавками по 10 см3, автоклавируют при (121 ± 1,0) °С в течение 15 мин.
7.2.7. Среду Кесслер с лактозой готовят в соответствии с нижеследующей прописью:
пептон - 10 г,
лактоза - 2,5 г,
желчь крупного рогатого скота сухая - 5 г (натуральная 50 см3),
1 %-й водный раствор кристаллического фиолетового (генцианвиолета, метилвиолета) - 2 см3,
дистиллированная вода - до 1000 см3.
Компоненты растворяют в 1000 см3 дистиллированной воды, нагревают на слабом огне до кипения, кипятят 1 - 2 мин, фильтруют через ватно-марлевый фильтр, доводят объём до 1 дм3, охлаждают до 45 - 55 °С. Устанавливают рН таким образом, чтобы после стерилизации он составлял (7,2 ± 0,1) при температуре 25 °С. Разливают в пробирки с поплавками по 10 см3 или в колбы (флаконы) по 225 см3, автоклавируют при (115 ± 1,0) °С в течение 20 мин.
ферментативный перевар казеина - 10 г,
лактоза - 10 г,
желчь крупного рогатого скота сухая - 20 г (натуральная 200 см3),
0,5 %-й водный раствор бриллиантового зелёного - 2,66 см3,
дистиллированная вода - до 1000 см3.
При нагревании растворяют компоненты в воде. Устанавливают рН таким образом, чтобы после стерилизации он составлял (7,2 ± 0,2) при температуре 25 °С. Разливают в пробирки с поплавками по 10 см3 или в колбы (флаконы) по 225 см3, автоклавируют при (121 ± 1,0) °С в течение 15 мин.
7.2.9. Грам-негативный обогащающий бульон (GN-бульон) по Хайну готовят по прописи, указанной на этикетке из сухой среды промышленного производства «GN Enrichment Broth ace.to HAJNA», Cat. № 10756, фирма «MERCK», Германия или Cat № M 242, фирма «Hi-Media», Индия.
7.2.10. Селенитовый бульон в модификации Лейфсона готовят в соответствии с нижеследующей прописью:
кислый селенисто-кислый натрий (NaHSeO3) - 4 г,
пептон - 5 г,
натрий фосфорно-кислый однозамещённый безводный - 3 г,
натрий фосфорно-кислый двухзамещённый безводный - 7 г,
лактоза - 4 г,
вода дистиллированная - до 1000 см3.
Среду готовят из 2 растворов. Раствор 1: смешивают компоненты и при нагревании растворяют в воде. Путём изменения количественных соотношений фосфатов устанавливают рН (7,0 ± 0,1). Разливают во флаконы или колбы по 100 см3, стерилизуют при (112 ± 1) °С 30 мин. Раствор можно хранить в холодильнике 1 - 2 мес. Раствор 2: 10 %-й раствор кислого селенисто-кислого натрия готовят ex tempore на стерильной дистиллированной воде.
Перед началом посева в каждый флакон с 100 см3 раствора 1 добавляют по 4 см3 раствора 2.
Готовую среду асептически разливают в стерильные пробирки по 10 см3 или в колбы (флаконы) по 225 см3 и плотно закрывают пробками. Дальнейшей стерилизации не требуется.
7.2.11. Маннитный селенитовый бульон готовят в соответствии с нижеследующей прописью:
пептон - 5 г,
маннит - 4 г,
натрия фосфат - 10 г,
кислый селенисто-кислый натрий - 4 г,
вода дистиллированная - 1000 см3.
В 1000 см3 дистиллированной воды добавить 4 г натрия селенисто-кислого кислого. После перемешивания добавляют остальные ингредиенты, вновь перемешивают при подогревании до полного растворения солей, разливают в колбы (флаконы) по 225 см3. Стерилизуют текучим паром в течение 10 мин.
7.2.12. Среду Раппапорта-Вассилиадиса с соей (RVS-бульон) готовят в соответствии с нижеследующей прописью.
Раствор 1:
ферментативный гидролизат сои - 5 г,
хлористый натрий - 8 г,
двухзамещенный фосфорно-кислый калий безводный, K2НPO4 - 0,2 г,
однозамещенный фосфорно-кислый калий безводный, KН2РO4 - 1,4 г,
дистиллированная вода - 1000 см3.
Компоненты растворяют в воде при нагревании до температуры 70 °С. Раствор готовят за день до приготовления среды.
Раствор 2:
хлористый магний 6-водный (MgCl2 ∙ 6Н2O) - 400 г,
вода дистиллированная - 1000 см3.
Растворяют хлористый магний в воде, переносят в бутыль из темного стекла с притёртой пробкой и хранят при комнатной температуре. Ввиду гигроскопичности хлористого магния раствор следует готовить, используя вновь вскрытую упаковку реактива.
Раствор 3:
малахитовый зелёный оксалат - 0,4 г,
вода дистиллированная - 100 см3.
Готовят раствор, растирая малахитовый зелёный оксалат в ступке. Переливают в мерную колбу, доводят водой до метки. Хранят в бутылке из тёмного стекла не более 8 мес.
Среду готовят, прибавляя к 1000 см3 раствора 1 100 см3 раствора 2 и 10 см3 раствора 3. Устанавливают рН таким образом, чтобы после стерилизации он составлял (5,2 ± 0,2) при температуре 25 °С. Разливают в пробирки по 10 см3, автоклавируют при (115 ± 1,0) °С в течение 15 мин.
7.2.13. Мюллер-Кауфман тетратионатный бульон (МКТ-бульон) готовят в соответствии с прописью, указанной в ГОСТ Р 52814-2007 (ИСО 6579-2002) «Продукты пищевые. Метод выявления бактерий рода Salmonella», приложение В, п. 4.
Основа среды:
пептон - 10 г,
мясной экстракт - 10 г,
натрия хлорид - 5 г,
вода - 920 см3.
Растворяют основные компоненты в дистиллированной воде. При необходимости подогревают до кипения для полного растворения частиц. Устанавливают рН (7,5 ± 0,2) с помощью 0,1 М HCl или 0,1 М NaOH. Стерилизуют автоклавированием при температуре 121 °С в течение 15 мин. Остужают до 45 - 50 °С.
Готовая среда: перед использованием в 920 см3 бульона асептически добавляют: 70 см3 стерильной дефибринированной крови барана; растворенное в 50 %-м растворе ацетона содержимое двух флакончиков с добавкой антибиотиков для кампилобактерий IV (по Престону) и растворенное в стерильной дистиллированной воде содержимое двух флакончиков ростовой добавки для кампилобактерий или 4 см3 аэротолерантной добавки по п. 7.1.4, тщательно перемешивают и разливают среду в соответствующие емкости в количествах, необходимых для проведения исследования.
7.2.15. Селективный бульон Дойла для накопления кампилобактерий готовят в соответствии с нижеследующей прописью.
Основа среды:
гидролизат казеина - 10 г,
пептический перевар животной ткани - 10 г,
дрожжевой экстракт - 2 г,
глюкоза - 1 г,
натрия хлорид - 5 г,
натрия бисульфит - 0,1,
натрия сукцинат - 3 г,
L-цистеина гидрохлорид - 0,1 г,
дистиллированная вода - 920 см3.
Растворяют сухую основу порошка в дистиллированной воде (при использовании готовой основы указанного состава промышленного изготовления количество согласно прописи на этикетке). При необходимости подогревают до кипения для полного растворения частиц. Устанавливают рН (7,0 ± 0,2) при 25 °С. Стерилизуют автоклавированием при температуре 121 °С в течение 15 мин. Остужают до температуры 45 °С.
Готовая среда: перед использованием в 460 см3 основы асептически добавляют 35 см3 стерильной дефибринированной крови барана, а также растворенное в 5 мл 50 %-го раствора этанола содержимое 1 флакончика с добавкой антибиотиков модифицированной III (по Дойлу). Тщательно перемешивают и разливают в соответствующие емкости в количествах, необходимых для проведения исследования.
7.2.16. Бульоны Фрейзера для предварительного селективного (первичного) обогащения и селективного (вторичного) обогащения листерий готовят в соответствии с нижеследующей прописью.
Основа среды*:
______________
* Допускается готовить основу среды без добавления эскулина и цитрата железа аммонийного.
ферментативный гидролизат казеина - 5,0 г,
пептон - 5,0 г,
мясной экстракт - 5,0 г,
дрожжевой экстракт - 5,0 г, натрий хлористый - 20,0 г,
калий фосфорно-кислый однозамещённый безводный - 1,35 г,
натрий фосфорно-кислый двухзамещённый безводный - 12 г,
эскулин - 1,0 г,
литий хлористый - 3,0 г,
железо аммонийное цитрат - 0,25 г.
Растворяют компоненты в 1000 см3 дистиллированной воды, тщательно перемешивают, устанавливают рН (7,2 ± 0,2) и автоклавируют при 121 °С 15 мин.
Готовые среды: в зависимости от предназначения среды перед употреблением к 1 дм3 основы бульона Фрейзера асептически добавляют селективные компоненты, предварительно растворённые в 10 см3 стерильного раствора гидроокиси натрия с концентрацией 0,2 г/дм3, в количестве:
|
налидиксовая кислота - 10 мг, акрифлавина гидрохлорид - 12,5 мг. |
|
|
налидиксовая кислота - 20 мг, акрифлавина гидрохлорид - 25 мг. |
Готовые среды разливают в стерильные колбы: бульон Фрейзера для предварительного селективного обогащения - в объёмах, в 9 раз превышающих массу (объём) навески засеваемого продукта; бульон Фрейзера для селективного обогащения - по 90 см3, и хранят в защищенных от света условиях при температуре не выше 6 °С не более 3 недель.
8. Отбор и подготовка образцов к анализу
8.1. Общие положения
8.1.1. Отбор образцов пищевых продуктов для исследований проводят в установленном порядке согласно методам отбора проб по ГОСТ 26668-85 «Методы отбора проб для микробиологических анализов», ГОСТ Р ИСО 7218-2008 «Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям», МУК 4.2.577-96 «Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов», «Инструкции о порядке расследования и проведения лабораторных исследований в учреждениях санитарно-эпидемиологической службы при пищевых отравлениях» (М., 1975), а также в соответствии с требованиями нормативных и технических документов на конкретные виды продуктов.
8.1.2. От продукции в потребительской таре в мелкой фасовке пробы отбирают в количестве одной или нескольких единиц в зависимости от массы или объема потребительской тары. От продукции в транспортной или потребительской таре больших размеров или неупакованной отбирают точечные пробы с помощью стерильных инструментов из разных мест с различной глубины, включая поверхность, небольшими порциями (около 50 г), в которых должны быть представлены все компоненты продукта. Пробы жидких и полужидких продуктов отбирают после тщательного перемешивания. Точечные пробы соединяют в объединённую пробу и перемешивают.
8.1.3. Общая масса или объем отбираемых проб должны быть достаточными для проведения исследования (200 ± 50) г (см3). Допускается раздельное упаковывание и последующее исследование точечных проб.
Пробы сыпучих продуктов допускается отбирать в стерильные пакеты из нескольких слоев плотной бумаги; суточные пробы блюд - непосредственно в той посуде, в которой они хранились в холодильнике.
Для анализа на наличие микроаэрофильных бактерий рода Campylobacter пробы твердых продуктов отбирают по МУК 4.2.2321-08 в стерильные газонепроницаемые пакеты, пробы жидких продуктов - в герметично закрывающуюся стерильную стеклянную посуду или иные ёмкости и приспособления, ограничивающие доступ кислорода.
8.1.5. Отобранные образцы пломбируют или опечатывают, маркируют в установленном порядке.
8.1.6. Доставку образцов скоропортящихся продуктов в лабораторию осуществляют в термоконтейнерах при температуре не выше 6 °С; замороженных продуктов - при температуре, указанной в нормативной или технической документации на продукт. Анализ доставленных образцов проводят по возможности в кратчайшие сроки, но не более чем через 4 ч от момента отбора.
8.2. Первичная обработка образцов пищевых продуктов и подготовка их к посеву в среды обогащения
8.2.1. Для предотвращения ингибиции или утраты жизнеспособности патогенной флоры все манипуляции с пробами пищевых продуктов необходимо осуществлять с учётом биологических особенностей и чувствительности искомых патогенных бактерий к изменениям температуры, рН и редокс-потенциала, воздействию УФ, нагреванию, длительному хранению.
8.2.2. До проведения анализа пробы сохраняют в сухом защищенном от света месте, в т.ч. образцы скоропортящихся продуктов - при температуре (5 ± 1) °С, охлаждённых сырых мясных и рыбных продуктов - при температуре (2 ± 2) °С. После вскрытия упаковки пробы подвергают исследованию немедленно.
8.2.3. Подготовку проб проводят по ГОСТ 26669-85 «Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов», ГОСТ Р ИСО 7218-2008 «Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям», а также в соответствии с действующими нормативно-методическими документами на конкретные виды продуктов:
· пробы мяса, включая мясо птицы, субпродуктов, мясных полуфабрикатов, колбасных изделий и других мясных продуктов - по ГОСТ Р 51448-99 (ИСО 31002-88) «Мясо и мясные продукты. Методы подготовки проб для микробиологических исследований», ГОСТ 21237-75 «Мясо. Методы бактериологического анализа», ГОСТ Р 52675-2006 «Полуфабрикаты мясные и мясосодержащие. Общие технические условия», ГОСТ 9958-81 «Изделия колбасные и продукты из мяса», ГОСТ 9792-73 «Колбасные изделия и продукты из свинины, баранины, говядины и мяса других видов убойных животных и птиц», ГОСТ 7702.2.0-95 «Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы отбора проб и подготовка к микробиологическим испытаниям»;
· пробы молока, молочных и молокосодержащих продуктов - по ГОСТ 3622-68 «Молоко и молочные продукты. Отбор и подготовка их к испытанию», ГОСТ Р 53430-2009 «Молоко и продукты переработки молока. Методы микробиологического анализа», ГОСТ 26809-86 «Молоко и молочные продукты. Правила приёмки. Методы отбора и подготовки проб к анализу»;
· пробы рыбы, рыбных и морепродуктов - по ГОСТ 31339-2006 «Рыба, нерыбные объекты и продукция из них. Правила приемки и методы отбора проб»;
· пробы плодоовощной продукции - по ГОСТ 26313-84 «Продукты переработки плодов и овощей. Правила приемки, методы отбора проб»; быстрозамороженных и поверхностно-контаминированных плодоовощных продуктов - по «Инструкции по микробиологическому контролю быстрозамороженной плодоовощной продукции» (МЗ СССР, 29.09.89);
· пробы детского и диетического питания - по МУК 4.2.577-96 «Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов»;
· пробы кремово-кондитерских изделий - по МУК 4.2.762-99 «Методы микробиологического контроля готовых изделий с кремом»;
· жировых продуктов - по ГОСТ Р 52179-2003 «Маргарины, жиры для кулинарии, кондитерской, хлебопекарной и молочной промышленности. Правила приемки и методы контроля» и ГОСТ 30004.2-93 «Майонезы. Правила приёмки и методы испытаний»; ГОСТ Р 52969-2008 «Масло сливочное. Технические условия»; ГОСТ Р 52971-2008 «Масло топленое и жир молочный. Технические условия»;
· напитков - по ГОСТ 6687.0-86 «Продукция безалкогольной промышленности. Правила приемки и методы отбора проб»; ГОСТ 30712-2001 «Продукты безалкогольной промышленности. Методы микробиологического анализа»;
· продуктов и блюд общественного питания - по ГОСТ Р 50763-2007 «Услуги общественного питания. Продукция общественного питания, реализуемая населению. Общие технические условия».
8.2.4. Замороженные продукты предварительно размораживают в защищенном от света месте при температуре (2 ± 2) °С в течение не более 18 ч или в течение 1 ч в термостате при температуре (19 ± 1) °С.
Пробы жировых продуктов (топленое масло, молочный жир, спрэды, маргарины, кремы) расплавляют при температуре 40 - 45 °С на водяной бане, перемешивают до получения однородной эмульсии; масло сливочное и мороженое - до сметанообразной консистенции.
При исследовании на наличие микроаэрофильных бактерий рода Campylobacter продукт измельчают только в перистальтическом гомогенизаторе или в фарфоровой ступке, избегая активного перемешивания; жидкие продукты перемешивают круговыми движениями.
8.2.6. Из суспензии или гомогената готовят навеску необходимой массы в стерильной чашке Петри, в стерильном контейнере с крышкой или бюксе, на куске стерильного пергамента*. Если нормативной документацией не предусмотрено иное, для пищевых продуктов и блюд массового потребления масса навески (объём) для анализа на патогены должна составлять (25 ± 0,1) г (см3), не менее. Величина навески для продуктов детского и диетического питания находится в диапазоне от (25 ± 0,1) - (300 ± 1) г (см3) и должна определяться установленными гигиеническими нормативами.
______________
* При отмеривании навески плотных продуктов должно учитываться количество добавленной при гомогенизации жидкости (среды для обогащения).
8.2.7. От подготовленной пробы жировых продуктов отбирают навеску не менее 50 г, которую центрифугируют при 10000 - 20000×g (12000 - 16000 об./мин) в течение 1 мин при охлаждении (допускается проводить центрифугирование при температуре не выше 15 °С). Удаляют асептически супернатант и слой жира, исследованию подвергают седимент (осадок).
8.2.8. В кислых или кислотосодержащих (с рН < 6,0) пищевых продуктах жидких для предотвращения снижения рН питательных сред на 0,5 и более рН при посеве доводят рН аналитической навески до (7,0 ± 0,2) стерильными растворами гидроокиси натрия и соляной кислоты перед посевом; в высококислотных продуктах твёрдых - рН доводят до (7,0 ± 0,2) после посева непосредственно в посевной жидкости. Измерения рН проводят в условиях асептики.
8.2.9. Приготовление объединенной пробы, навесок продукта и посев осуществляют в максимально короткие сроки.
8.3. Посев в среды обогащения
8.3.1. Для подращивания находящихся в пищевых продуктах патогенных бактерий и накопления их биомассы подготовленные по п. 8.2. образцы засевают в жидкие питательные среды и инкубируют в соответствии с процедурами обогащения, предусмотренными утверждёнными в установленном порядке методами исследований для конкретных микроорганизмов.
Материалом для дальнейшего исследования в ПЦР служат пробы культуральной жидкости, представляющей собой биомассу искомых микроорганизмов с совокупностью образованных ими продуктов метаболизма в питательных средах для селективного обогащения, полученную при оптимальных для данных микроорганизмов режимах инкубации.
8.3.2. Первичный посев пищевых продуктов для накопления бактерий рода Salmonella проводят в неселективную жидкую среду [5, 8] - ЗПВ (п. 7.1.5), подогретую до (37 ± 1) °С, при соотношении навески продукта и среды 1:9, не менее. Например, навеску массой 25 г засевают в 225 см3 ЗПВ, 50 г - в 450 см3 ЗПВ и т.п. Инкубируют при этой температуре (18 ± 2) ч. При исследовании какао и какаосодержащих продуктов используют ЗПВ с обезжиренным молочным порошком (п. 7.1.6), в которую после 2 ч инкубации добавляют 0,5 % водный раствор бриллиантового зелёного из расчёта 3,6 см3 на 1 дм3 инокулята.
По истечении инкубации в ЗПВ проводят вторичное обогащение параллельно в двух жидких селективных средах: по п. 7.2.12 (Раппапорта-Вассилиадиса с соей) и одной из двух сред по п. 7.2.10 (селенитовом бульоне) или п. 7.2.13 (Мюллер-Кауфман тетратионатном бульоне), для чего по 1 см3 инокулята в ЗПВ пересевают в 10 см3 каждой из указанных сред. Посевы в среде Раппапорта-Вассилиадиса с соей инкубируют при (41,5 ± 1) °С 24 ч, в селенитовом бульоне и Мюллер-Кауфман тетратионатном бульоне при (37 ± 1) °С - 24 ч.
Допускается высевать образцы свежих пищевых продуктов, не содержащих сублетально повреждённых бактерий рода Salmonella в результате сушки, замораживания, непосредственно в селективные среды, минуя этап неселективного обогащения, при соотношении продукта и среды 1:9, не менее, при тех же режимах инкубации.
Для исследований в ПЦР используют культуральную жидкость среды Раппапорта-Вассилиадиса с соей и одной из двух сред - селенитового бульона или Мюллер-Кауфман тетратионатного бульона.
8.3.3. Посев пищевых продуктов для накопления бактерий рода Shigella проводят непосредственно в среды селективного обогащения - селенитовый бульон в модификации Лейфсона (п. 7.2.10) и маннитный селенитовый бульон (п. 7.2.11), используя соотношение 9:1 (среда:материал) по [6, 15]. Посевы инкубируют в термостате при температуре 37 °С в течение 18 ч, не более. Дальнейшая инкубация может привести к ингибиции роста бактерий рода Shigella, чувствительных к накоплению кислых продуктов метаболизма.
Для исследований в ПЦР используют культуральную жидкость обеих вышеуказанных селективных сред.
8.3.4. Первичный посев пищевых продуктов для неселективного накопления энтерогеморрагических веротоксигенных Е.coli, в т.ч. серотипа 0157:Н7, проводят аналогично посеву на бактерии рода Salmonella, при соотношении навески продукта и среды 1:9, засевая но 25 г пробы в 225 см3 неселективной жидкой среды ЗПВ по п. 7.1.5, подогретой до (37 ± 1) °С по [3, 14]. Инкубируют при этой температуре (18 ± 2) ч.
По истечении инкубации в ЗПВ проводят вторичное обогащение, для чего по 1 см3 инокулята пересевают параллельно в пробирки с 10 см3 жидкой селективной среды с лактозой: Кесслер с лактозой по п. 7.2.7, лактозный бульон с бриллиантовым зеленым и желчью по п. 7.2.8, грам-негативный обогащающий бульон (GN-бульон) по Хайну по п. 7.2.9.
Молочные продукты подлежат посеву только в среду Кесслер с лактозой по п. 7.2.7.
Посевы термостатируют при (37 ± 1) °С в течение 18 - 24 ч.
Допускается высевать образцы свежих пищевых продуктов (мясопродукты сырые, молоко-сырьё, цельномолочные продукты, в том числе творог, сыр, плодоовощные продукты), не содержащих сублетально повреждённых веротоксигенных E.coli в результате сушки, замораживания, непосредственно в селективные среды, минуя этап неселективного обогащения, при соотношении продукта и среды 1:9, не менее, при тех же режимах инкубации.
Для исследований в ПЦР используют культуральную жидкость любой из вышеуказанных селективных сред.
При необходимости подтверждения отсутствия веротоксигенных штаммов в массе продукта, в которой нормируется отсутствие E.coli (продукты и блюда общественного питания, колбасы и мясопродукты ферментированные), посев производят по [3]. При этом подготовленные по п. 8.2 навески продуктов нормируемой массы или их соответствующие децимальные разведения в ЗПВ засевают непосредственно в пробирки с селективными средами с лактозой по п.п. 7.2.7 или 7.2.8. Посевы просматривают через 18 - 24 ч инкубации при (37 ± 1) °С, отмечая образование кислоты и газа из лактозы (при отсутствии признаков роста инкубируют посевы ещё 24 ч), после чего используют для исследования в ПЦР.
8.3.5. Первичный посев пищевых продуктов для детей раннего возраста (молочные смеси и продукты прикорма сухие, а также специализированные продукты для лечебного и профилактического питания детей I года жизни, подлежащие контролю на наличие Е.(Cr.) sakazakii согласно [13]) проводят в неселективные жидкие среды: ФБР (п. 7.1.3.1) или ЗПВ (п. 7.1.5), исходя из соотношения навески продукта и среды 1:10.
К навеске массой (300 ± 1) г добавляют 2,7 дм3 неселективной среды, подогретой до (37 ± 1) °С, термостатируют при температуре (37 ± 1) °С в течение 18 - 24 ч.
По истечении инкубации в ФБР или ЗПВ проводят вторичное обогащение, для чего по 10 см3 суспензии пересевают в 90 см3 жидких селективных сред для выделения бактерий семейства Enterobacteriaceae - среду Кесслер с глюкозой (п. 7.2.4) или глюкозный бульон с бриллиантовым зеленым и желчью (п. 7.2.5) или бульон Мак-Конки (п. 7.2.6). Посевы термостатируют при температуре (37 ± 1) °С в течение (22 ± 2) ч.
Для исследований в ПЦР используют культуральную жидкость не менее чем из 2 указанных выше питательных сред для селективного обогащения.
8.3.6. Посев пищевых продуктов для накопления бактерий рода Campylobacter проводят непосредственно в среду селективного обогащения.
К необходимому количеству подготовленной по п.п. 8.1.4 и 8.2.5 пробы добавляют 9-кратный объем селективного бульона Престона (п. 7.2.14) или селективного бульона Дойла (п. 7.2.15). При исследовании жировых молочных продуктов седимент, приготовленный согласно п. 8.2.7, предварительно растворяют в 10 см3 обогащающего бульона и добавляют к остальному объёму среды. Полученную взвесь инкубируют в течение 4 ч при 37 °С (а в случае посевов замороженных продуктов или продуктов, которые хранились более 10 дней, - в течение 3 ч при температуре 32 °С и 2 ч при 37 °С). Далее температуру инкубации изменяют, и все посевы продолжают инкубировать в течение 18 - 24 ч при (42 ± 1) °С.
Инкубация на всех этапах осуществляется в микроаэрофильных условиях в соответствии с [12].
Для исследований в ПЦР используют культуральную жидкость любой из вышеуказанных селективных сред.
8.3.7. Первичный посев пищевых продуктов для накопления бактерий L.monocytogenes проводят в бульон Фрейзера для предварительного селективного обогащения (п. 7.2.16.1). Подготовленную навеску массой 25 г (см3) вносят непосредственно в 225 см3 среды, предварительно прогретой в течение 15 мин при температуре 45 °С. Содержимое в колбе встряхивают круговыми движениями руки в радиусе 30 см. При необходимости анализа других масс (объёмов) продукта их посев проводят в среду также в соотношении 1:9 по объему [4, 9].
Посевы термостатируют при (37 ± 1) °С в течение (24 ± 2) ч. В среде предобогащения, содержащей эскулин и цитрат железа аммонийного, отмечают почернение, как признак возможного присутствия бактерий рода Listeria, способных к гидролизу гликозида эскулина до глюкозы и эскулетина. Эскулетин реагирует с ионами железа, образуя комплекс черного или оливкового цвета. На среде без эскулина почернения не наблюдается.
После инкубации продукта в среде для первичного обогащения независимо от наличия или отсутствия признаков роста, в т.ч. почернения, пересевают 1,0 см3 суспензии в 10 см3 бульона Фрейзера для вторичного селективного обогащения листерий по п. 7.2.16.2, предварительно нагретого до температуры 41 °С. Посевы термостатируют при температуре (37 ± 1) °С в течение (24 ± 2) ч.
Для исследований в ПЦР используют культуральную жидкость среды (бульона Фрейзера) для вторичного селективного обогащения листерий.
Допускается использовать культуральную жидкость среды (бульона Фрейзера) для первичного селективного обогащения листерий при наличии в нём признаков роста (почернение, помутнение) без проведения этапа вторичного обогащения.
8.4. Подготовка образцов на средах для первичного обогащения к ПЦР-анализу
8.4.1. Подготовленные по п.п. 8.3.2 - 8.3.7 образцы используют для ПЦР-анализа сразу после окончания инкубации. Для подтверждения жизнеспособности допускается однократное замораживание (сразу после инокуляции в среду обогащения) и хранение образцов культуральной жидкости при температуре минус 20 °С на время инкубации парного образца.
8.4.2. При подтверждении жизнеспособности выявляемых патогенных микроорганизмов путём ПЦР-анализа в режиме реального времени (п. 9.2.2), параллельно с пробами, обогащаемыми в питательных средах, готовят контрольные образцы пищевых продуктов, не подвергающиеся инкубации.
Эти образцы после инокуляции подвергают замораживанию и сохраняют до момента исследования в ПЦР при температуре минус 20 °С, исследуя впоследствии одновременно с образцами, прошедшими подращивание. Инокуляты образцов, подлежащие подращиванию, направляют на инкубацию, как описано в п.п. 8.3.2 - 8.3.7.
8.4.2.1. Пробы жидких продуктов тщательно перемешивают и инокулируют их равные объёмы в среды неселективного или селективного обогащения в соответствии с требованиями п.п. 8.3.2 - 8.3.7.
8.4.2.2. К пробам продуктов плотной консистенции на этапе гомогенизации по п. 8.2.5 добавляют определённое количество соответствующей среды для конкретных искомых микроорганизмов, тщательно перемешивают. Из гомогената отбирают навеску необходимой массы, которую в условиях асептики разделяют на две равные части и засевают в соответствующие требованиям п.п. 8.3.2 - 8.3.7 объёмы питательных сред с учётом количества, добавленного при гомогенизации.
8.4.2.3. Образцы, подлежащие использованию для подтверждения жизнеспособности, непосредственно после инокуляции подвергают замораживанию и сохраняют до момента исследования в ПЦР при температуре минус 20 °С. Инокуляты образцов, подлежащие подращиванию, направляют на инкубацию, как описано в п.п. 8.3.2 - 8.3.7.
8.4.2.4. Для исследований в ПЦР в режиме реального времени для подтверждения жизнеспособности одновременно используют инокуляты пищевых продуктов в питательных средах для селективного обогащения, подвергавшиеся и не подвергавшиеся инкубации в термостате.
8.4.3. Стерильные образцы соответствующих сред для первичного обогащения должны сохраняться для использования в качестве отрицательных контрольных образцов исследования методом ПЦР.
8.5. Подготовка штаммов бактериальных культур к ПНР-анализу
8.5.1. При идентификации культур, выделенных из пищевых продуктов согласно утверждённым в установленном порядке методам исследований [3, 4, 5, 6, 8, 9, 12, 13, 14, 15], используют изолированные колонии, характерные для патогенных микроорганизмов, указанных в п. 1.1, полученные на чашках с селективными агаризованными средами после соответствующего обогащения, в т.ч. для бактерий*:
______________
* Характерные признаки колоний на селективных средах учитывают в соответствии с описаниями в утверждённых методических документах [3, 4, 5, 6, 8, 9, 12, 13, 14, 15].
· рода Salmonella - с ксилоза-лизин-дезоксихолатным агаром, висмут-сульфитным агаром, средой Плоскирева, Эндо, Левина, бриллиантовым зелёным агаром;
· рода Shigella - средой Плоскирева, дезоксихолат-цитратным агаром с лактозой и сахарозой, сальмонелла-шигелла (SS) агаром;
· вида E.(Cr.) sakazakii - фиолетово-красным желчным агаром с глюкозой (VRBG agar), средой Эндо;
· серотипа Е.coli 0157:Н7 - сорбитол E.coli 0157:Н7 агаром, флуорокульт Е.coli 0157:H7 агаром, сорбитол Мак-Конки агаром (SMAC), средой Эндо;
· рода Campylobacter - селективным агаром Престона, угольным селективным агаром для кампилобактерий, колумбийским агаром;
· вида L.monocytogenes - ПАЛКАМ-агаром (полимиксин-акрифлавин-лития хлорид-цефтазидим-эскулин-маннитол агаром), оксфордским агаром, ПАЛ-агаром.
8.5.2. Не менее 3 характерных колоний для бактерий родов Salmonella, Shigella, серотипа Е.coli 0157:H7, вида L.monocytogenes отбирают с одной или нескольких указанных в п. 8.4.1 селективных сред, производят посев штрихом на поверхность плотных питательных сред МПА или ТСАДЭ п. 7.2.3 в отдельных чашках Петри, или в пробирки с жидкими средами (МПБ или триптон-соевый бульон с дрожжевым экстрактом) и инкубируют в течение 18 - 24 ч при (37 ± 1) °С.
Изоляты, предположительно относящиеся к роду Campylobacter, засевают на поверхность кровяного колумбийского агара или в бульон для бруцелл и инкубируют при (42 ± 1) °С в течение 24 - 48 ч в микроаэрофильной атмосфере.
Изоляты, предположительно относящиеся к E.(Cr.) sakazakii, пересевают на поверхность триптон-соевого агара с дрожжевым экстрактом и термостатируют при температуре 25 °С в течение 72 ч.
8.5.3. При необходимости культуры могут быть представлены на исследование в пробирках на агаризованной среде в соответствии с СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности». В указанном случае производят проверку штамма на чистоту путём микроскопирования, пересевают в пробирки с жидкими средами (ТСБДЭ) или другими средами, предназначенными для обогащения данного патогена, и инкубируют в течение 24 ч при (37 ± 1) °С.
8.5.5. Суточные культуры, полученные по п. 8.4.2 на плотных питательных средах, смывают с поверхности агара небольшим количеством стерильного физиологического раствора (или снимают петлёй) и переносят в стандартную пробирку. Концентрацию бактериальных клеток в суспензии проверяют по оптическому стандарту МакФарланда, либо денситометрически на приборах, откалиброванных также по шкале МакФарланда (плотность суспензии должна составлять не менее 1,5 - 2,0 ед. по шкале МакФарланда). При использовании отраслевого стандарта для визуальной оценки мутности ГИСК им. Л.А. Тарасевича расчетная концентрация клеток в пробе должна составлять не менее 107 кл./см3.
Аналогичным образом устанавливают плотность культур на жидких средах. Содержимое пробирки тщательно перемешивают на гомогенизаторе типа «Вортекс» для получения гомогенной суспензии.
Для исследований в ПЦР используют подготовленные указанным образом взвеси микроорганизмов или бульонные культуры, содержащие не менее 107 кл./см3, которые подвергают дальнейшим манипуляциям для выделения ДНК. Подготовленные образцы используют для анализа в тот же день.
8.6. Подготовка проб нашивных пищевых продуктов к ПЦР-анализу
8.6.1. Образцы пищевых продуктов, предназначенные к исследованию в нативном виде при расследовании вспышек пищевых бактериальных отравлений и инфекций с пищевым путём передачи (в соответствии с п. 3.4), подлежат первичной обработке в зависимости от консистенции: путём концентрирования (для жидких продуктов) или перевода в жидкую фазу с последующим концентрированием (для сухих или твёрдых продуктов) по [15, 11].
8.6.2. Концентрирование образцов жидкой консистенции объёмом до 50 см3 путём центрифугирования проводят в условиях асептики по одному из двух режимов:
а) одномоментно при 6 000 об./мин в течение (18 ± 2) мин,
б) дробно при 1000 об./мин в течение 5 мин для осаждения крупных частиц и при 6000 об./мин в течение 15 мин.
По окончании центрифугирования надосадочную жидкость сливают, к осадку добавляют 5 см3 фосфатного буферного 0,9 % раствора NaCl (п. 7.1.3.2), ресуспендируют.
Для проведения экстракции ДНК отбирают 1 см3 взвеси в отдельную пробирку; оставшаяся часть подготовленной пробы используется для посева на питательные среды.
8.6.3. Концентрирование образцов жидкой консистенции объёмом до 50 см3 фильтрацией проводят в 2 этапа:
1) для освобождения от крупных частиц во избежание засорения мембранных фильтров - с использованием стерилизованных ватно-марлевых или бумажных фильтров;
2) через мембранные фильтры № 3 с величиной пор 600 - 800 нм.
Для фильтрования через мембранные фильтры используют предварительно простерилизованные фильтровальные аппараты, подключенные к вакуумному насосу, или фильтрующие устройства шприцевого типа соответствующей ёмкости.
Перед началом фильтрования мембранные фильтры проверяют на отсутствие дефектов, и в случае необходимости двукратно кипятят в дистиллированной воде по 10 - 15 мин. С соблюдением правил асептики фильтры закрепляют в аппарате матовой стороной вверх. Фильтрование проводят дробно, пропуская через каждый фильтр не более 25 см3 жидкости, подвергнутой на 1 этапе фильтрации через ватно-марлевый или бумажный фильтр.
После окончания фильтрации, фильтрат удаляют, а все использованные фильтры переносят в стерильную чашку Петри, бюкс, измельчают стерильными ножницами и заливают 5 - 6 см3 стерильного изотонического раствора натрия хлористого для десорбции бактерий.
Из полученного смыва отбирают 1 см3 в отдельную пробирку для экстракции ДНК; оставшаяся часть подготовленной пробы используется для посева на питательные среды.
8.6.4. Пробы пищевых продуктов твёрдой консистенции и сухих переводят во взвешенное состояние в жидкости для суспендирования содержащихся в них микроорганизмов. Для этого образцы массой 25 - 50 г в условиях асептики предварительно измельчают ножницами, растирают в фарфоровой ступке или в гомогенизаторе при добавлении ФБР (п. 7.1.3.1) или стерильной деионизированной воды в соотношении 1:10 или 1:5 для получения 10 - 20 % концентрации продукта. Доводят до гомогенного состояния.
Полученную суспензию отстаивают 3 - 10 мин для осаждения грубых частиц, жидкую фазу центрифугируют при 1000 об./мин в течение 5 мин.
Если полученный осадок вязкий, из него отбирают 1 см3 для экстракции ДНК в отдельную пробирку и не менее 2 см3 - для посева на питательные среды; если плотный - предварительно ресуспендируют в 0,2 - 0,5 см3 стерильной деионизированной воды.
8.6.5. Подготовленные по п.п. 8.5.2 - 8.5.4 образцы хранению не подлежат и используются для экстракции ДНК сразу после окончания пробоподготовки.
9. Проведение анализа
Алгоритмы проведения исследований пищевых продуктов для обнаружения патогенных бактерий методом ПЦР с гибридизационно-флуоресцентной детекцией приведены в прилож. 1.
9.1. Экстракция ДНК из исследуемых образцов
9.1.1. При работе в зоне подготовки и выделения нуклеиновых кислот из проб, содержащих патогенные биологические агенты, необходимо строго соблюдать правила техники безопасности, производственной санитарии, противоэпидемического режима и личной гигиены: работают только в боксированием помещении или в боксе биологической безопасности II класса, используют одноразовые перчатки, используют и меняют при каждой операции одноразовые наконечники для дозаторов с аэрозольным барьером. Одноразовую пластиковую посуду (пробирки, наконечники) обеззараживают в специальном контейнере с дезинфицирующим 0,2 % раствором ДП-2Т.
9.1.2. Экстракция ДНК из каждого исследуемого образца проводится в присутствии неконкурентного внутреннего контрольного образца (ВКО) на основе рекомбинантной ДНК для контроля правильности (точности) этапов выделения и амплификации ДНК.
9.1.3. В качестве отрицательного контроля (ОК) этапа экстракции ДНК из культуральной жидкости, используют стерильный образец питательной среды для обогащения исследуемого продукта, предварительно протестированный на отсутствие ДНК искомых патогенных бактерий; из проб нативных продуктов - стерильный изотонический раствор натрия хлористого или ФБР для десорбции бактерий. При наличии спорных или невалидных результатов ПЦР используют ОК этапа выделения из набора реагентов.
9.1.4. Экстракцию ДНК из культуральной жидкости, взвесей микроорганизмов и бульонных культур, подготовленных по п.п. 8.3 и 8.5, проводят без дополнительной обработки, применительно к используемым наборам реагентов и в соответствии с утверждёнными в установленном порядке инструкциями [1, 2].
9.1.4.1. Для экстракции ДНК применяются коммерчески доступные комплекты реагентов на основе методов сорбции ДНК на силикагеле или преципитации ДНК в соответствии с инструкцией производителя при возможности их сочетания с комплектами реагентов для амплификационного этапа исследований.
Использование автоматических экстракторов нуклеиновых кислот допускается при наличии указаний в инструкции к прилагаемым комплектам реагентов на возможность их применения при анализе данного вида образцов.
Не допускается применение упрощенных методик экстракции ДНК на основе термокоагуляции.
9.1.5. Допускается проводить экстракцию ДНК из проб нативных пищевых продуктов по п. 9.1.4.1 настоящих МУК или по п. 6.2 МУК 4.2.2304-07 [10]. При повышенном содержании жиров перед экстракцией ДНК проводят дополнительную обработку пробы суспензией неполярных растворителей с водой для перевода содержащейся в пищевом продукте ДНК в водную фазу, в которой и производится дальнейшая очистка.
9.2. Постановка контроля на жизнеспособность патогенных бактерий в исследуемых пищевых продуктах
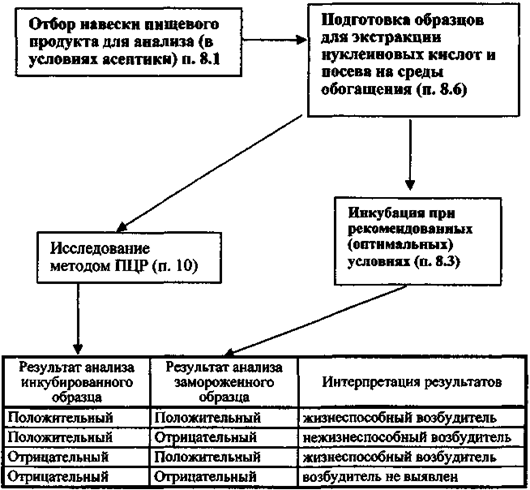
9.2.1. При положительных результатах ПЦР-анализа образцов исследуемых нативных пищевых продуктов и культуральной жидкости от посева пищевых продуктов в среды обогащения (обнаружение ДНК искомых патогенных бактерий) должна подтверждаться жизнеспособность выявленных микроорганизмов. Оценка жизнеспособности микроорганизмов проводится параллельно с основным исследованием в обоих предусмотренных вариантах ПЦР с гибридизационно-флуоресцентной детекцией (FEP и FRT):
9.2.1.1) для образцов обогащенных пищевых продуктов: одновременно с отбором проинкубированной культуральной жидкости на экстракцию ДНК проводят её прямой посев в количестве 0,1 см3 на поверхность соответствующих пластинчатых селективно-дифференциальных сред, используемых для выделения патогенных бактерий, указанных в п. 8.4.1, используют не менее 2-х видов сред из числа рекомендуемых;
9.2.1.2) для образцов нашивных пищевых продуктов, исследуемых только при расследовании вспышек: одновременно с отбором исследуемой взвеси на экстракцию ДНК проводят её посевы:
а) на поверхность соответствующих пластинчатых селективно-дифференциальных сред, так же как указано в п. 9.2.1.1,
б) в жидкую среду для селективного обогащения по п.п. 8.3.2 - 8.3.7 по 0,1 - 1,0 см3 в 10 см3 соответствующих питательных сред. После инкубирования сред при соответствующих для данных микроорганизмов режимах инкубации производят пересев на поверхность соответствующих пластинчатых селективно-дифференциальных сред.
9.2.2. Посевы на плотных средах начинают просматривать через 16 - 18 ч, затем через 24 и 48 ч. При обнаружении роста характерных колоний (или газона культуры) их обрабатывают по п. 8.4.5 и анализируют путём постановки ПЦР по п. 10 или с использованием любых коммерчески доступных зарегистрированных в РФ тест-систем на принадлежность к родам, видам, серотипам искомых патогенных бактерий. Допускается подтверждать принадлежность выделенных культур методами традиционного биохимического и серологического типирования в соответствии с утверждёнными методами определения патогенных микроорганизмов в пищевых продуктах.
9.2.3. Оценку жизнеспособности патогенных бактерий при осуществлении варианта ПЦР в режиме «реального времени» (FRT) допускается проводить путём одновременного исследования двух образцов культуральной жидкости, подготовленных по п. 8.3.9. Интерпретация и оценка результатов проводится по п. 10.4.
9.2.4. При исследовании штаммов чистых культур по п. 8.4 подтверждение жизнеспособности не требуется.
10. Проведение ПЦР
10.1. ПЦР для выявления ДНК патогенных бактерий (родов Salmonella, Shigella, вида Enterobacter (Cronobacter) sakazakii, энтерогеморрагических веротоксигенных Escherichia coli, термофильных Campylobacter spp., Listeria monocytogenes) осуществляется с использованием наборов реагентов (п. 6.3), обеспечивающих постановку любого из двух вариантов гибридизационно-флуоресцентной детекции продуктов амплификации - по конечной точке (вариант FEP) и в режиме реального времени (вариант FRT).
10.2. Постановка ПЦР для выявления ДНК бактерий родов Salmonella, Shigella, вида Enterobacter (Cronobacter) sakazakii, энтероге-моррагических веротоксигенных Escherichia coli, термофильных Campylobacter spp. осуществляется по схемам и алгоритмам, рекомендованным производителем комплектов реагентов с обязательным применением внутренних контрольных образцов с этапа экстракции ДНК.
10.3. Для оценки жизнеспособности микроорганизмов может применяться ПЦР только в формате детекции продуктов амплификации в режиме реального времени (FRT).
10.5. При оценке жизнеспособности целевого микроорганизма в пищевых продуктах сопоставляют результаты тестирования образцов, подвергавшихся и не подвергавшихся инкубации после посева на этапе пробоподготовки при оптимальной температуре для роста искомых патогенов (по п. 8.3.9). Отставание сигнала по каналу JOE/HEX на 3 и более пороговых цикла (Ct) для образца, не подвергавшегося инкубации (Ctне инк. - Ctинк ≥ 3), свидетельствует о наличии в продукте жизнеспособного микроорганизма.
11. Выдача результатов
11.1. Результаты оценивают по каждой исследованной пробе отдельно.
11.2. Заключение о присутствии искомых патогенных бактерий в исследованной массе (объёме) продукта выдают при получении положительного результата ПЦР (выявлении ДНК указанных микроорганизмов в пробе) и подтверждении их жизнеспособности.
11.3. Заключение об отсутствии искомых патогенных бактерий в исследованной массе (объёме) продукта выдают при получении отрицательного результата ПЦР (невыявлении ДНК искомых микроорганизмов) при исследовании образцов пищевых продуктов, подвергнутых инкубации в питательных средах, или положительного результата ПЦР (выявлении ДНК искомых микроорганизмов в пробе), но отрицательного результата по подтверждению жизнеспособности.
11.4. Заключение об отсутствии искомых патогенных бактерий в исследованном нативном продукте, исследуемом при расследовании вспышек, при получении отрицательного результата ПЦР (невыявлении ДНК искомых микроорганизмов), не выдаётся.
11.5. Заключение о принадлежности исследованных бактериальных чистых культур к искомым патогенным бактериям выдают при получении положительного результата ПЦР (выявлении ДНК указанных микроорганизмов в пробе).
Библиографические ссылки
3. ГОСТ 30726-2001 «Продукты пищевые. Методы выявления и определения количества бактерий вида Escherichia coli».
4. ГОСТ Р 51921-2002 «Продукты пищевые. Методы выявления и определения бактерий Listeria monocytogenes».
5. ГОСТ Р 52814-07 «Продукты пищевые. Метод выявления бактерий рода Salmonella».
6. Инструкция о порядке расследования и проведения лабораторных исследований в учреждениях санитарно-эпидемиологической службы при пищевых отравлениях. М., 1975.
7. МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности».
9. МУК 4.2.1122-02 «Организация контроля и методы выявления бактерий Listeria monocytogenes в пищевых продуктах».
10. МУК 4.2.2304-07 «Методы идентификации и количественного определения генно-инженерно-модифицированных организмов растительного происхождения».
12. МУК 4.2.2321-08 «Методы определения бактерий рода Campylobacter в пищевых продуктах».
13. МУК 4.2.2428-08 «Метод определения бактерий Enterobacter sakazakii в продуктах для питания детей раннего возраста».
14. МУК 4.2.992-00 «Методы выделения и идентификации энтерогеморрагической кишечной палочки Е.coli 0157:Н7».
Приложение
Схема 1
Алгоритм проведения исследований с предварительным обогащением
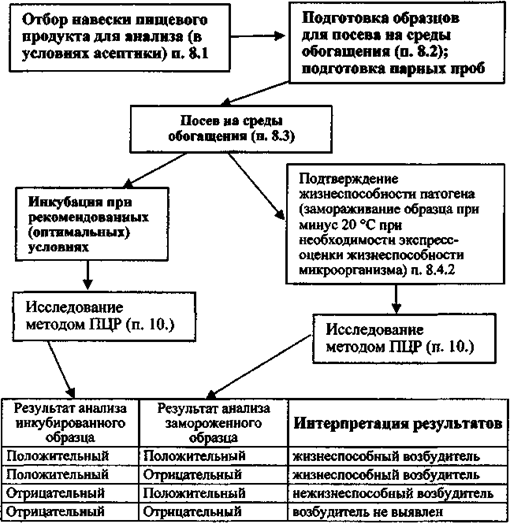
При получении данных о наличии в образце жизнеспособных патогенов, проводится их выделение в чистой культуре. При необходимости ускоренной идентификации чистой культуры патогена возможно применение ПЦР-исследований (п. 8.3.9).
Схема 2
Алгоритм проведения исследований без предварительного обогащения