|
Р 52.24.566-94 |
РЕКОМЕНДАЦИИ
Методы
токсикологической оценки
загрязнения
пресноводных экосистем
Федеральная служба
России по гидрометеорологии
и мониторингу окружающей среды
Москва
1994
ПРЕДИСЛОВИЕ
|
1. Утвержден ГУЭМЗ 21.07.94 г. наименование утверждающего органа, дата 2. Разработчики А.В. Жулидов, канд. биол. наук; инициалы и фамилии руководителя Т.А. Хоружая, д-р биол. наук, с.н.с.; разработки (темы) и остальных разработчиков, ученые степени, Л.М. Предеина, канд. хим. наук; звания Е.Н. Бакаева, канд. биол. наук; Е.В. Морозова, канд. биол. наук. 3. Одобрено на заседании секции по методам химического и радиоактивного мониторинга наименование центральной комиссии; дата 4. Зарегистрирован ГУЭМЗ сокращенное наименование организации за № 1 от 21.07.94 г. дата 5. Введен впервые |
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
Необходимость ввести в практику мониторинга качества поверхностных вод методы оценки токсикологического состояния водных объектов связана с резким ухудшением экологической обстановки в ряде регионов страны. Активно проявляется влияние ранее совершенно не рассматривавшихся факторов загрязнения природных вод токсическими веществами. Объем сточных вод, сбрасываемых в водоемы и водотоки, в настоящее время достаточно велик, тогда как химический контроль за сбросом токсичных компонентов недостаточен. Последнее обусловлено постоянным увеличением числа загрязняющих веществ, трудностями аналитического определения и нормирования, принципиальной невозможностью учета суммарных эффектов и процессов преобразования, загрязняющих веществ. Наиболее приемлемым выходом из создавшейся ситуации является внедрение в практику мониторинга поверхностных вод методов биотестирования токсичности.
Биотестирование в настоящее время - обязательный элемент системы охраны поверхностных вод. Введены нормативы качества воды по данным биотестирования1. Требования к режимным наблюдениям за загрязнением поверхностных вод суши сети Государственной службы наблюдений (ГСН) Росгидромета предусматривают оценку токсикологического состояния водных объектов с использованием биотестирования2.
___________
1 Нормативы приведены в следующих документах: 1) Правила охраны поверхностных вод (типовые положения); 2) РД 118-02-90 Методическое руководство по биотестированию воды (см. п. 2).
2 РД 52.24.309-92. Организация и проведение режимных наблюдений за загрязнением поверхностных вод суши на сети Роскомгидромета.
Настоящие рекомендации содержат следующие разделы:
1) биотестирование в режимных наблюдениях ГСН Росгидромета,
2) биотесты для оперативных работ по оценке качества поверхностных вод.
ПРОЕКТ РЕКОМЕНДАЦИЙ
|
Методы токсикологической |
Дата введения 1994-07-21
1. ОБЛАСТЬ ПРИМЕНЕНИЯ
Настоящие методические рекомендации предназначены оперативно-производственным подразделениям Росгидромета, наблюдающим за загрязнением поверхностных вод суши в рамках ГСН, и являются методическим пособием для проведения наблюдений по токсикологическим показателям.
2. НОРМАТИВНЫЕ ССЫЛКИ
1. ГОСТ 17.1.1.01-77. Использование и охрана вод. Основные термины и определения. Введ. с 01.07.78. - М.: Изд-во стандартов, 1984. - 18 с.
2. ГОСТ 17.1.3.07-82. Гидросфера. Правила контроля качества воды водоемов и водотоков. Введ. с 01.01.83 до 01.01.90. - М.: Изд-во стандартов, 1986. - 12 с.
3. ГОСТ 17.1.5.01-80. Гидросфера. Общие требования к отбору проб донных отложений водных объектов для анализа на загрязненность. Введ. с 01.01.82 до 01.01.89. - М.: Изд-во стандартов, 1980. - 5 с.
4. ГОСТ 17.1.5.05-85. Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков. Введ. с 01.07.86. - М.: Изд-во стандартов, 1985. - 15 с.
5. ГОСТ 19179-73. Гидрология суши. Термины и определения. Введ. с 01.01.75 до 01.01.80. - М.: Изд-во стандартов, 1978. - 34 с.
6. ГОСТ 27065-86 (СТ СЭВ 5184-85). Качество вод. Термины и определения. Введ. с 01.01.87. - М.: Изд-во стандартов, 1987. - 9 с.
7. Закон Российской Федерации «Об охране окружающей природной среды». Статья 58. - М.: Республика, 1992. - С. 43.
8. Закон Российской Федерации «Об охране окружающей природной среды». Статья 59. - М.: Республика, 1992. - С. 43 - 44.
9. Методические рекомендации по установлению предельно допустимых концентраций загрязняющих веществ для воды рыбо-хозяйственных водоемов. - М.: Изд. ВНИРО, 1985 - 88 с.
10. Методические указания по использованию биотестов для определения предзаморного состояния в карповых прудах. - Л.: Изд. ГосНИОРХ, 1989. - 10 с.
11. Методические указания. Экспресс-метод биологической оценки уровня загрязнения водной среды, донных осадков, почвы и живых объектов. - Ростов-на-Дону, 1990. - 22 с.
12. МС ИСО 6341-82. Качество воды. Определение угнетения подвижности Daphnia magna St (Cladocera, Crustacea). - M.: Изд- во стандартов. 1987. - 13 с.
13. Павленко В.В., Зимина Т.А., Трубачеева Л.Я. Техническая документация по применению способа оценки сточных вод и химических соединений по токсико-генетическим показателям (Методические указания). - Иркутск: Изд. НИИ биологии при Иркутс. ун-те, 1984. - 24 с.
14. Правила охраны поверхностных вод (типовые положения). - М.: Изд. Госкомприроды СССР, 1991.
15. РД 118-02-90. Методическое руководство по биотестированию воды. - Введ. 06.08.90. - М.: Госкомприрода, 1991. - 47 с.
16. РД 52.24.309-92. Организация и проведение режимных наблюдений за загрязнением поверхностных вод суши на сети Роскомгидромета. - Введ. 01.01.93. - С.-Петербург.: Изд. Роскомгидромета, 1992. - 67 с.
17. Руководство по химическому анализу поверхностных вод суши/ Под ред. А.Д. Семенова. - Л.: Гидрометеоиздат, 1977. - 540 с.
18. ISO 8692. Water quality - Fresh water algal growth inhibition test with Scenedesmus subspicatus and Selenastrum capricornutum. - ISO, 1989.
3 ОПРЕДЕЛЕНИЯ
Здесь и далее все термины даны применительно к воде, водным организмам и водным экосистемам.
Биологическое тестирование (биотестирование) - оценка качества воды по ответным реакциям водных организмов, являющихся тест-объектами (по ГОСТ 27065-86).
Биотест - совокупность приемов получения информации о токсичности воды (донных отложений) для гидробионтов на основе регистрации реакций тест-объекта.
Взвешенные вещества в природных водах - частицы минерального и органического происхождения, которые по размеру больше, чем коллоидные частицы и находящиеся в воде во взвешенном состоянии. Происхождение их различно: терригенное (продукты размыва почв, горных пород), биогенное (фрагменты тел и экскременты организмов), вулканогенное (обломочный материал вулканических извержений), хемогенное (продукты химических реакций), космогенное (космическая пыль), антропогенное (поступающие со сточными водами). Являются исходным материалом при образовании донных отложений. Их содержание в воде колеблется в широких пределах. От содержания взвешенных веществ зависит прозрачность и цвет природных вод [7] (приложение Ю).
Водный объект - сосредоточение природных вод на поверхности суши, либо в горных породах, имеющее характерные формы распространения и черты режима (по ГОСТ 19179-73).
Водоем - водный объект в углублении суши, характеризующийся замедленным движением воды или полным его отсутствием. Различают естественные водоемы, представляющие собой скопления воды во впадинах, и искусственные - специально созданные скопления воды в искусственных или естественных углублениях земной поверхности (по ГОСТ 19179-73).
Водоток - водный объект, характеризующийся движением воды в направлении уклона в углублении земной поверхности (по ГОСТ 19179-73).
Зона влияния источника загрязнения - часть водоема или водотока, в которой повышены фоновые значения показателя качества воды, но нарушения норм качества не наблюдается (по ГОСТ 17.1.3.07-82).
Качество воды - характеристика состава и свойств воды, определяющая пригодность ее для конкретных видов водопользования (по ГОСТ 17.1.1.01-77).
Контроль качества воды - проверка соответствия показателей качества воды установленным нормам и требованиям (по ГОСТ 17.1.1.01-77).
Критерий токсичности - признак (показатель), на основании которого оценивают токсичность [10].
Мониторинг - постоянное длительное наблюдение за какими- либо объектами, процессами, явлениями. В области охраны природы под этим термином понимают систему наблюдений, оценки и прогноза загрязненности окружающей среды, испытывающей антропогенное воздействие.
Нормы качества воды - установленные значения показателей качества воды для конкретных видов водопользования (по ГОСТ 27065-86).
Острое токсическое действие (острая токсичность) - воздействие, вызывающее быструю ответную реакцию тест-объекта. Острое токсическое действие чаще всего измеряют по тест-реакции «выживаемость» за относительно короткое время (чаще всего за 48 - 96 ч) при кратковременном биотестировании.
Показатели токсичности - показатели, на основании которых делают выводы о вредном действии вещества на жизненные процессы водного организма. По отражению тех или иных сторон жизнедеятельности показатели токсичности делят на биологические, физиологические, биохимические, биофизические и физико-химические [10].
Поверхностные воды - воды, находящиеся на поверхности суши в виде различных водных объектов (по ГОСТ 19179/79).
Природные воды - воды Земли с содержащимися в них твердыми, жидкими и газообразными веществами (по ГОСТ 19179-73).
Проба воды - количество воды, предназначенное для исследования.
Пункт контроля качества поверхностных вод - место на водоеме или водотоке, где проводят комплекс работ для получения данных о качестве воды, предназначенных для последующего обобщения во времени и в пространстве и представления обобщенной систематической информации заинтересованным организациям (по РД 52.24.309-92).
Створ пункта контроля качества поверхностных вод - условное поперечное сечение водоема или водотока, в котором проводят комплекс работ для получения данных о показателях качества воды (по РД 52.24.309-92).
Тест-объект - организм, который используют при биотестировании (водоросли, дафнии и т.д.).
Тест-реакция - реакция тест-объекта, используемая для определения токсичности водной среды.
Токсикологический эксперимент - эксперимент, в ходе которого оценивают влияние на тест-объект испытываемой воды или химического соединения. Состоит из двух серий: опыт (с воздействием воды или химического соединения) и контроль (без воздействия, но в тех же условиях).
Токсичность воды - свойство воды вызывать развитие патологического процесса или гибель тест-объектов.
Условно чистый участок водного объекта - обычно это фоновый створ.
Фоновый створ - створ, расположенный на расстоянии не менее 1 км выше источника загрязнения [7].
Хроническое токсическое действие (хроническая токсичность) - воздействие, вызывающее ответную реакцию тест-объекта, проявляющуюся в течение относительно длительного периода времени. Хроническое токсическое действие измеряют по тест-реакциям «выживаемость», «плодовитость», «изменение роста» и другим реакциям при длительном биотестировании.
Чрезвычайная экологическая ситуация (экологический кризис) - экологическое неблагополучие, характеризующееся устойчивыми отрицательными изменениями окружающей среды и представляющее угрозу для здоровья населения.
Чувствительность организма к яду - скорость и степень реагирования на воздействие яда (токсиканта). Определяется временем начала проявления реакции или содержанием яда, при котором возникает реакция. Чувствительные организмы быстрее реагируют на меньшее содержание яда по сравнению с малочувствительными [10].
ЭВЗ (экстремально высокое загрязнение водоема или водотока) - явление, характеризующееся увеличением содержания загрязняющих веществ в воде водоема или водотока до концентраций, в 100 раз и более превышающих ПДК; увеличением БПК5 свыше 60 мг/л O2, снижением концентрации растворенного в воде кислорода ниже 2 мг/л; покрытием не менее 1/3 поверхности водоема и береговой полосы нефтяной или масляной пленкой; гибелью рыбы и растений; появлением гнилостного запаха, не свойственного воде водоема или водотока ранее (по РД 52.24.309-92).
Экологическое бедствие - экологическое неблагополучие, характеризующееся глубокими необратимыми изменениями окружающей среды и существенным ухудшением здоровья населения (по статье 59 Закона РФ «Об охране окружающей природной среды»).
Экологическое благополучие водного объекта - нормальное воспроизведение основных звеньев экологической системы водного объекта (по ГОСТ 17.1.1.01-77).
Экспозиция - время воздействия испытываемой воды на тест-объект.
Эталонный токсикант - токсическое вещество, используемое для калибровки биотеста или тест-объекта.
4 ОБЩИЕ ПОЛОЖЕНИЯ
В режимных наблюдениях ГСН Росгидромета биотестирование проводят для оценки токсикологического состояния водных объектов или их участков на основе систематических данных биотестирования отдельных проб воды. При биотестировании проверяют соответствие качества воды установленным нормам.
При решении оперативных задач ГСН биотестирование проводят для проверки соответствия качества воды отдельных проб установленным нормам, а также для выявления чрезвычайных экологических ситуаций и зон экологического бедствия.
Согласно действующим нормативам1, вода контрольного створа (природная вода) не должна оказывать токсического действия (хронического и, тем более, острого) на тест-объекты, используемые для биотестирования. Таким образом, задача биотестирования природной воды - установить наличие токсичности (острого или хронического токсического действия) испытываемой пробы воды.
________
1 Правила охраны поверхностных вод (типовые положения). - М.: Изд. Госкомприроды СССР, 1991.
Биотестированию подлежат пробы природной воды, отобранные на определенных участках водного объекта (пунктах, створах).
В задачу биотестирования природной воды не входят идентификация загрязняющих веществ и аналитическое определение их содержания, обусловливающего токсичность испытываемой воды. Биотестирование является интегральной оценкой качества воды, т.е. оценкой свойства воды оказывать токсическое действие на гидробионтов, обусловленное присутствием комплекса загрязняющих веществ и метаболитов.
Результаты биотестирования природной воды указывают на наличие или отсутствие ее токсичности для гидробионтов.
Биотестирование природных вод основано на определении изменения тест-реакций (показателей токсичности) у гидробионтов при экспозиции их в воде, отобранной в зоне влияния источника загрязнения (испытуемая вода) по сравнению с тест-реакциями гидробионтов при экспозиции в воде, отобранной на условно чистом участке водного объекта (контроль).
Для биотестирования используют лабораторные культуры гидробионтов и природные популяции. Биотестирование на лабораторных культурах позволяет проводить токсикологические работы в любое время года, в том числе и зимой, что является определенным преимуществом перед традиционными гидробиологическими подходами, которые более жестко приурочены к вегетационному периоду жизни водных экосистем.
Биотестирование на природных популяциях технически более трудоемко, но оно открывает перспективу прогноза влияния токсического загрязнения на биоту конкретного водного объекта.
Чтобы получить надежную токсикологическую оценку, биотестирование следует проводить с помощью набора биотестов. Это связано с различной чувствительностью тест-объектов к загрязняющим веществам, фазностью реагирования и характером реакций. При использовании набора биотестов пробу воды считают токсичной, если токсическое действие на гидробионтов обнаружено хотя бы в одном биотесте.
Биотестирование природной воды желательно проводить на нефильтрованной и фильтрованной (отстоявшейся) воде. Это связано с наличием в природной воде взвешенных веществ, в состав которых могут входить токсичные загрязняющие вещества (например, хлорорганические пестициды).
Биотестирование природной воды требует достаточно жесткой стандартизации условий и процедуры биотестирования. Это обусловлено относительно малым содержанием загрязняющих веществ, влиянием естественных физико-химических характеристик природной воды (например, жесткости) на ее токсичность, которые скрывают антропогенное влияние.
Методы биотестирования, включенные в настоящие рекомендации, основаны на ряде общих принципов с методами биотестирования сточных вод, описанными в РД 118-02-90, хотя и имеют существенные особенности. Одной их них является также преимущественное использование метода непрерывного биотестирования - без постановки отдельных экспериментов по установлению острого и хронического токсического действия. В ходе такого эксперимента при кратковременном тестировании устанавливают, оказывает ли испытываемая вода острое токсическое действие; если такого действия нет, то продолжают экспозицию в испытываемой воде, чтобы выявить хроническое токсическое действие (длительное биотестирование). При обнаружении острого токсического действия проводят дополнительные токсикологические опыты, чтобы определить кратность разбавления, при котором токсическое действие устраняется.
Особенностью биотестирования природных вод является постановка двух контрольных серий: на отстоявшейся (дехлорированной) водопроводной воде («контроль-1») и на воде, отобранной из фонового («условно чистого») створа («контроль-2»).
«Контроль-1» (на водопроводной воде) обычно используют как показатель, характеризующий состояние тест-объектов. Их выживаемость в этой серии должна быть не менее 90 %. Кроме того, вода фонового створа («контроль-2») может оказаться токсичной, и тогда данные биотестирования опытной пробы сравнивают с контролем на водопроводной воде.
Важной особенностью методологии биотестирования природных вод является следующее. Приступая к опытам, специалист должен знать параметры гидрохимического режима водного объекта, в частности, концентрацию растворенного кислорода, рН, жесткость, соотношение Ca/Mg и т.д.
Результаты биотестирования надежны только при соблюдении оптимальных условий жизнедеятельности используемых гидробионтов (тест-объектов). Изменять гидрохимические параметры природной воды, подгоняя их под эти условия, нежелательно. Это может привести к искажению истинной картины токсичности природной воды. При несоответствии параметров (например, по жесткости) целесообразно проводить биотестирование на природных популяциях, которые адаптированы к гидрохимическим параметрам воды данного водного объекта.
При биотестировании на разных тест-объектах проявляются особенности их жизнедеятельности. Так, при биотестировании на водорослях часто проявляется стимулирующий их размножение аффект загрязненной воды, что приводит к трудностям в интерпретации результатов при сравнении с контролем. Эти трудности показаны на ряде примеров.
При разработке методических рекомендаций использованы данные научных исследований и апробации биотестов на природных водах, проведенных в ГХИ, МГУ и других учреждениях. В частности, использованы данные исследований на следующих природных объектах:
1) дафниях, цириодафниях и рыбах (по РД 118-02-90);
2) водорослях (по РД 118-02-90 и по Методическим указаниям по использованию биотестов для определения предзаморного состояния в карповых прудах);
3) инфузориях (по работам [1, 5] и по Методическим рекомендациям по установлению предельно допустимых концентраций загрязняющих веществ для воды рыбохозяйственных водоемов);
4) коловратках (по работе [6]) и по Методическим указаниям: экспресс-метод биологической оценки уровня загрязнения водной среды, донных осадков, почвы и живых объектов).
Использованы также различные нормативно-методические документы и стандарты (см. п. 2).
5 ОТБОР, ХРАНЕНИЕ И ПОДГОТОВКА ПРОВ ДЛЯ БИОТЕСТИРОВАНИЯ
Пробы природной воды отбирают, руководствуясь ГОСТ 17.1.5.05. Сосуды для отбора и доставки проб в лабораторию должны быть из нетоксичного материала. Целесообразно использовать полиэтиленовые емкости для пищевых продуктов, стеклянные баллоны или бутыли.
Сосуды необходимо маркировать.
Перед заполнением сосудов воду фильтруют через планктонный газ № 70 (для удаления природного планктона) и несколько раз ополаскивают сосуд. Сосуды следует заполнять водой полностью, чтобы в них не оставалось воздуха.
Определение токсичности следует проводить как можно быстрее, не позднее 6 ч после отбора проб. Если указанный срок соблюсти невозможно, то пробы следует охладить до плюс 4 °С или заморозить до минус 20 °С на месте отбора по МС ИСО 6341-82 (см. п. 2).
При замораживании не следует заполнять сосуды полностью, чтобы замерзающая вода не разорвала их, увеличивая свой объем.
Нельзя консервировать пробы с помощью химических консервантов!
Объемы воды, необходимые для постановки биотестов, указаны в соответствующих разделах проекта рекомендаций. После доставки проб в лабораторию их хранят в холодильнике (ГОСТ 17.1.5.05 и ГОСТ 17.1.5.01). Перед биотестированием пробу делят на две части для постановки биотеста на отстоявшейся и неотстоявшейся воде. Вместо отстаивания можно профильтровать воду через бумажный фильтр, чтобы удалить взвешенные вещества. Температуру воды уравнивают с комнатной.
Измеряют концентрацию кислорода, которая должна быть не менее 6,0 мг/л, чтобы обеспечить оптимальные условия жизнедеятельности гидробионтов.
Если перечисленные условия не соблюдены (сосуды неточно маркированы, сроки и условия хранения нарушены и т.п.), проводить биотестирование не следует, так как его результаты будут ненадежными.
6 БИОТЕСТИРОВАНИЕ В РЕЖИМНЫХ НАБЛЮДЕНИЯХ ГСН РОСГИДРОМЕТА
Режимные наблюдения по токсикологическим показателям проводят по программам работ, в которых управлениями определены водные объекты, пункты и створы наблюдений, периодичность и перечень токсикологических показателей.
Научно-методическое руководство работами по наблюдениям за загрязнением поверхности вод в рамках ГСН по токсикологическим показателям осуществляет Гидрохимический институт Росгидромета (РД 52.24.309-92).
Данные биотестирования, полученные в ходе режимных наблюдений за загрязнением поверхностных вод, используют для оценки токсикологического состояния водного объекта или его участка.
Биотестирование природных вод проводят с помощью системы биотестов - нескольких методов, достаточных для получения более или менее надежного результата. Надежными считают данные биотестов, проведенных не менее, чем на трех группах гидробионтов, например, на ракообразных, водорослях и рыбах. При использовании меньшего числа биотестов степень надежности снижается.
Для режимных наблюдений рекомендуется использовать биотесты на лабораторных культурах ракообразных, водорослей, инфузорий, коловраток и рыб.
6.1 Биотест на дафниях
6.1.1 Принцип метода
Метод основан на оценке влияния испытываемой воды, отобранной из водоемов и водотоков, на лабораторную культуру дафний. Влияние испытываемой воды оценивают по изменению в сравнении с контролем показателей выживаемости и плодовитости дафний при экспозиции в испытуемой воде.
Острое, подострое и хроническое токсическое действие испытываемой воды на дафний устанавливают в ходе одного опыта (непрерывное биотестирование) в зависимости от времени проявления этого действия. Острое и подострое токсическое действие испытываемой воды устанавливают по изменению показателей выживаемости при кратковременном биотестировании (длительностью до 96 ч). Хроническое токсическое действие испытываемой воды устанавливают по изменению показателей выживаемости и плодовитости при длительном биотестировании (длительностью примерно 30 сут).
Показателем выживаемости служит среднее число дафний, выживающих в воде в течение опыта. Показателем плодовитости служит среднее число молоди, выметанной в течение экспозиции в испытываемой воде, в расчете на одну выжившую (исходную) самку. Критерием острого токсического действия при кратковременном биотестировании является снижение выживаемости на 50 % и более в испытываемой воде по сравнению с контролем; критерием подострого токсического действия - достоверные отличия показателей выживаемости от контроля. Критерием хронического токсического действия при длительном биотестировании является достоверное отличие показателей выживаемости и плодовитости от контроля.
Для приблизительной оценки токсичности воды используют критерий отличий от контроля, превышающий 25 %.
6.1.2 Необходимые материалы, оборудование, реактивы
1. Культура дафний Daphnia magna. Источники получения культуры, описание основных характеристик вида, условий культивирования и содержания даны в Приложениях А и Б.
2. Микроскоп МБС или МБИ по ГОСТ 8074.
3. Лупа по ГОСТ 25706.
4. Гидробиологический сачок для отлова дафний.
5. Стеклянные трубки для переноса дафний в сосуд, для тестирования с внутренним диаметром 0,5 - 0,7 см.
6. Планктонный газ № 70 для фильтрования проб и № 55 для изготовления сачков.
7. Стеклянные емкости вместимостью 1 - 3 л для транспортирования дафний.
8. Аквариумы вместимостью 10 - 30 л для культивирования дафний.
9. Цилиндры мерные вместимостью 0,5 - 2,0 л по ГОСТ 1770.
10. Пипетки мерные вместимостью 1, 2, 10 мл по ГОСТ 20292.
11. Колбы стеклянные плоскодонные вместимостью 1 - 2 л для выращивания водорослей по ГОСТ 1770.
12. Стаканы химические вместимостью 50, 400 - 600 мл для биотестирования по ГОСТ 25336.
13. рН-метр по ТУ 25-05-1689.
14. Прибор для измерения концентраций растворенного кислорода в воде типа БПК-тестер по ЕХ 2.841.004.ТО.
15. Канистры полиэтиленовые для транспортировки проб воды.
16. Термостат лабораторный по ТУ 64-1-1411-76Е.
17. Калий двухромовокислый х.ч. по ГОСТ 4220.
6.1.3 Подготовка к биотестированию
В биотесте
рекомендуется использовать дафний из синхронизированной культуры, в частности,
третье поколение, полученное путем ациклического партеногенеза в определенных
условиях разведения (приложение А). Допускается использовать
несинхронизированную культуру, если дафнии одновозрастные. Рекомендуется
использовать дафний и возрасте 1 сут. Чувствительность культуры дафний должна
быть следующей: ![]() при экспонировании в растворе
двухромовокислого калия должна находиться в интервале концентраций 0,9 - 2,0
мг/л K2Cr2O7. Периодически (1 раз в
течение 1 - 2 месяцев) следует проводить «калибровку» дафний по
двухромовокислому калию («эталонный» токсикант) для установления
при экспонировании в растворе
двухромовокислого калия должна находиться в интервале концентраций 0,9 - 2,0
мг/л K2Cr2O7. Периодически (1 раз в
течение 1 - 2 месяцев) следует проводить «калибровку» дафний по
двухромовокислому калию («эталонный» токсикант) для установления ![]() .
.
Все процедуры, описанные далее, следует проводить в условиях, оптимальных для жизнедеятельности дафний (приложение Б).
6.1.4 Проведение биотеста
Общий объем воды для биотестирования одной пробы 0,6 л, с учетом 3-кратной смены воды в случае длительного биотестирования - 2,0 л. Если биотестирование проводят на отстоявшейся и неотстоявшейся воде, то для длительного биотестирования необходимо 4,0 л.
Дафний отлавливают из аквариума с помощью стеклянной трубки и переносят в пустой сосуд для биотестирования. Затем пипеткой с грушей отсасывают излишек жидкости и сразу же осторожно (чтобы не травмировать дафний!) приливают испытываемую воду. В каждый сосуд наливают по 0,2 л испытываемой или контрольной воды и помещают по 10 особей односуточной молоди дафний.
В качестве контроля используют воду, отобранную на условно чистом (фоновом) створе водного объекта (первый контроль). Одновременно ставят второй контроль - на отстоянной водопроводной воде. Для каждой пробы ставят три повторности (всего 30 дафний на одну пробу воды). Через 3 сут от начала опыта меняют воду в сосудах с дафниями на свежеотобранную или на воду из той же пробы, хранящейся в холодильнике при соблюдении условий хранения (см. п. 5). Чтобы сменить воду, дафний отлавливают и переносят в другой сосуд.
В течение первых 2 сут дафний не кормят, с третьих суток начинают кормить ежедневно. Количество корма, вносимое в сосуды для биотестирования, должно быть одинаковым. При смене воды дафний кормят за 3 ч до смены.
6.1.5. Регистрация показателей выживаемости и плодовитости дафний
Наблюдения за дафниями ведут в первый час непрерывно, затем в течение 6 - 8 ч - каждый час, в дальнейшем 2 раза в день ежедневно. Регистрируют показатели выживаемости и плодовитости. Кроме того, учитывают поведение рачков, изменение окраски тела и другие показатели жизнедеятельности. Факт гибели дафний устанавливают по неподвижности (иммобилизации). Иммобилизованными считают дафний, которые лежат на дне сосуда и не делают плавательных движений после покачивания сосуда в течение 15 с (даже если их антенны колеблются). Погибших дафний учитывают визуально, не вынимая их из сосуда. При необходимости используют бинокуляр или лупу. По мере появления молоди ее изымают из сосудов, просчитывают и удаляют.
Данные о числе выживших дафний и выметанной молоди за каждые сутки наблюдений записывают в таблицу В.1 (приложение В).
Острое и хроническое токсическое действие устанавливают в одном и том же опыте в зависимости от времени проявления этого действия. Опыт продолжают до тех пор, пока исходные самки дадут по три помета молоди.
Опыт прекращают раньше, если вода проявит токсическое действие, которое оценивают согласно п. 6.1.6.
6.1.6. Обработка результатов, расчеты и оценка токсичности воды
Острое токсическое действие испытываемой воды на дафний устанавливают по критерию токсичности - снижению выживаемости на 50 % и более по сравнению с контролем (кратковременное биотестирование).
Если вода оказывает острое токсическое действие, устанавливают кратность разбавления, при которой оно устраняется. Для этого проводят биотестирование на серии разбавлений. Воду разбавляют в 2, 10, 50 и 100 раз. По полученным результатам биотестирования оценивают токсикологическое состояние водного объекта (см. п. 8).
Если снижение выживаемости в течение 96 ч не превышает 50 %, то рассчитывают достоверность различий выживаемости в испытываемой воде и контроле с помощью статистических методов (см. п. 8). Если различия достоверны, считают, что вода оказывает подострое токсическое действие.
Хроническое токсическое действие испытываемой воды на дафний устанавливают по статистически достоверным отличиям показателей выживаемости и плодовитости дафний в испытываемой воде от контрольных при экспозиции более 96 ч.
Для приблизительной оценки токсичности используют критерии отличий от контроля 25 % по работе [11].
Показатели выживаемости дафний в испытываемой воде и в контроле рассчитывают по формуле
![]() (6.1)
(6.1)
где ![]() -
выживаемость дафний в опыте из i-го числа повторностей, % исходной
численности;
-
выживаемость дафний в опыте из i-го числа повторностей, % исходной
численности;
Xi - численность выживших дафний в каждой повторности, экз.;
N - суммарное число дафний, взятое для опыта (исходная численность дафний).
Снижение выживаемости дафний в испытываемой воде по сравнению с контролем рассчитывают по формуле
![]()
![]() (6.2)
(6.2)
где А - снижение выживаемости дафний по сравнению с контролем, %;
![]() - среднее
арифметическое число дафний, выживших в контроле;
- среднее
арифметическое число дафний, выживших в контроле;
![]() - среднее
арифметическое число дафний, выживших в опыте.
- среднее
арифметическое число дафний, выживших в опыте.
Плодовитость дафний в испытываемой воде и в контроле рассчитывают по формуле
![]() (6.3)
(6.3)
где Mi - численность молоди в каждом вымете, экз.;
Vi - число исходных самок, выметавших молодь и выживших к моменту учета данных по плодовитости.
Патологические отклонения (абортированные яйца, уродливую, мертворожденную молодь) суммируют с реальной плодовитостью (потенциальная плодовитость).
Достоверность различий показателей в испытываемой воде и в контроле находят, используя критерий Стьюдента, как описано в разделе 8.
При оценке хронического токсического действия вывод о наличии токсичности делают в том случае, если выявлены различия хотя бы по одному показателю (выживаемости или плодовитости).
Результаты биотестирования записывают в таблицы по форме приложения В.
6.1.7 Пример биотестирования на дафниях
Проведено биотестирование воды пробы № 1, отобранной ниже и выше города Р. на реке Д. При кратковременном биотестировании на дафниях за 96 ч установлено следующее:
1) в контроле 1 (К-1, отстоявшаяся водопроводная вода) из 30 дафний (три повторности, по 10 особей в каждой) выжили 29;
2) в контроле 2 (К-2, вода реки Д., отобранная выше города) выжили все 30 особей;
3) в опыте (вода, отобранная ниже города) из 30 дафний выжило 20, т.е. 67 % исходного числа.
Из этих данных следует, что вода не оказала острого токсического действия на дафний (не зарегистрировано 50 %-е снижение выживаемости дафний за 96 ч наблюдений). Однако смертность достаточно высока по отношению к контролю (к К-1 - 31 %, к К-2 - 33 %) и превышает принятый критерий отличий, равный 25 %. Таким образом, по приблизительной оценке, вода из пробы оказывает подострое токсическое действие.
Таблица 6.1 - Статистическая обработка данных биотестирования пробы воды № 1
|
Xi |
|
|
|
σ |
S |
|
|
Контроль К-1 |
10 |
9,67 |
0,33 |
0,1089 |
0,58 |
0,34 |
|
10 |
0,33 |
0,1089 |
||||
|
9 |
0,67 |
0,4489 |
||||
|
Σ 0,6667 |
||||||
|
Контроль К-2 |
10 |
10 |
0 |
0 |
- |
- |
|
10 |
0 |
0 |
||||
|
10 |
0 |
0 |
||||
|
Опыт О |
8 |
6,67 |
1,33 |
1,7689 |
1,15 |
0,65 |
|
6 |
0,67 |
0,4489 |
||||
|
6 |
0,67 |
0,4489 |
||||
|
Σ 2,6667 |
Для уточнения результата проведем статистическую обработку (см. п. 8). Для удобства запишем данные в таблицу 6.1.
Рассчитаем t-критерий.
t = (9,67 - 6,67)/(0,342 + 0,652) = 4,11
Число степеней свободы равно
3 + 3 - 2 = 4
Для этого числа степеней свободы tSt = 2,78.
Таким образом, условие достоверности отличий tα > tSt соблюдено, и, следовательно, в опыте выживаемость достоверно ниже, чем в контроле. Отсюда следует, что испытываемая вода действительно оказывает подострое токсическое действие на дафний.
Опыт прекращен, так как токсическое действие воды установлено уже при кратковременном биотестировании. Результаты представлены в таблице 6.2 (см. приложение В, таблица В.2).
Таблица 6.2 - Результаты кратковременного биотестировавня воды реки Д. на дафниях
|
Водный объект, дата отбора |
Серия |
Выживаемость, % исходного числа особей |
Снижение выживаемости по отношению к контролю |
Оценка токсичности воды |
||
|
К-1 |
К-2 |
|||||
|
1 |
Река Д. 12.08.91 |
Контроль К-1 |
96 |
- |
Оказывает подострое токсическое действие |
|
|
Контроль К-2 |
100 |
- |
||||
|
Опыт О |
67 |
69 |
||||
Результаты биотестирования указывают на несоответствие качества воды по токсикологическим показателям установленным нормам.
6.2 Биотест на цериодафниях
6.2.1. Принцип метода
Метод основан на оценке влияния испытываемой воды, отобранной из водоемов и водотоков, на лабораторную культуру цериодафний. Влияние испытываемой воды оценивают по изменению показателей выживаемости и плодовитости цериодафний при экспозиции в испытываемой воде по сравнению с контролем.
Острое и хроническое токсическое действие испытываемой воды на цериодафний устанавливают в двух различных опытах - остром (кратковременное биотестирование длительностью до 48 ч) и хроническом (длительное биотестирование, примерно 7 сут).
Показатели выживаемости и плодовитости, критерий токсичности и контрольные серии те же, что и в биотесте на дафниях (п. 6.1).
6.2.2. Необходимые материалы, оборудование, реактивы
1. Лабораторная культура цериодафний. Описание основных характеристик вида, условия культивирования, содержание и источники получения культуры приведены в приложениях Г и Д.
2. Стеклянные капилляры с диаметром 0,2 см.
3. Микроскопы, лупы и другое оборудование согласно п. 6.1.2.
6.2.3. Подготовка к биотестированию
Для биотестирования используют молодых особей через 0 - 2 ч после их рождения. Допустимо использовать особей возрастом 6 - 8 ч, но разница в возрасте рачков не должна превышать 4 ч.
Чтобы получить одновозрастных цериодафний, из основной культуры отлавливают 10 - 20 половозрелых самок и помещают по одной в стеклянные сосуды, содержащие по 15 мл воды, для культивирования. Раз в сутки цериодафний кормят, добавляя в сосуды по 0,05 мл суспензии хлебопекарных дрожжей.
Выметанную самками одновозрастную молодь изымают из сосудов, часть используют для биотестирования, а оставшуюся удаляют.
Чувствительность
культуры цериодафний должна быть следующей: ![]() = 1,2 ... 1,9 мг/л K2Cr2O7.
= 1,2 ... 1,9 мг/л K2Cr2O7.
Общий объем воды для биотестирования одной пробы (с учетом смены воды) - 0,5 л.
Вначале в воде определяют концентрацию растворенного кислорода. Если она менее 5,0 мг/л, то воду насыщают кислородом до этого уровня с помощью микрокомпрессора. В процессе биотестирования не рекомендуется аэрировать тестируемую воду.
Биотестирование проводят в климатостате, люминостате, боксе или помещении, в котором обеспечены оптимальная освещенность (400 - 600 лк) и температура (25 ± 1 °С).
Результаты биотестирования считают правильными, если гибель цериодафний в контроле за весь период наблюдений не превышает 10 % и концентрация растворенного кислорода в тестируемой воде к концу биотестирования составляет не менее 2,0 мг/л.
Биотестирование проводят в двух вариантах: острое и подострое токсическое действие определяют при кратковременном биотестировании, а хроническое токсическое действие - при длительном биотестировании.
В обоих вариантах в 10 сосудов наливают по 15 мл испытываемой воды и помещают в каждый сосуд по одной особи молоди цериодафний. Для этого цериодафний отлавливают пипеткой с диаметром отверстия 2,0 мм, переносят в сачок из планктонного газа и, погрузив сачок в воду, выпускают в нее рачков.
Вначале сажают цериодафний в контрольную, а затем в испытываемую воду.
6.2.5. Регистрация показателей выживаемости и плодовитости
При кратковременном биотестировании выживших цериодафний учитывают через 1, 6, 12, 24 и 48 ч. Особей считают живыми, если они свободно передвигаются в толще воды или всплывают со дна сосуда не позднее 15 с после его покачивания.
В течение 48 ч цериодафний не кормят. При длительном биотестировании 1 раз в сутки цериодафний кормят суспензией дрожжей, которую вносят в каждый сосуд в количестве 0,05 мл.
Воду меняют ежесуточно. При этом подсчитывают выживших исходных цериодафний и выметанную молодь. Исходных цериодафний пересаживают в другие сосуды, куда уже налита свежая порция воды. Молодь после подсчета удаляют.
Длительное биотестирование проводят до тех пор, пока все исходные самки дадут по три последовательных вымета.
Опыт прекращают раньше, если вода проявит токсическое действие, которое оценивают согласно п. 6.1.6.
6.2.6 Обработка результатов, расчеты и оценка токсичности воды
Острое и подострое токсическое действие определяют при кратковременном биотестировании (длительностью до 48 ч), хроническое токсическое действие определяют при длительном биотестировании. Оценку токсичности проводят как описано в п. 6.1,6. Данные представляют в виде таблицы, так же, как и при биотестировании на дафниях. Пример оценки токсичности приведен в п. 6.1.7.
6.3 Биотест на водорослях
6.3.1 Принцип метода
Методика основана на определении изменений интенсивности размножения лабораторной культуры зеленых протококковых водорослей под влиянием испытываемой воды по сравнению с контролем. Показателем интенсивности размножения культуры является коэффициент прироста численности клеток водорослей.
Критерием токсичности является достоверное снижение коэффициента прироста численности клеток в испытываемой воде по сравнению с контролем1.
________
1 ISO 8692. Water quality - Fresh water algal growth inhibition test with Scenedesmus subspicatus and Selenastrum capricornutum. - ISO, 1989.
Возможно также увеличение коэффициента прироста численности водорослей, что свидетельствует о наличии в испытываемой воде загрязняющих веществ, стимулирующих рост водорослей.
Острое токсическое действие устанавливают при кратковременном биотестировании - в течение 96 ч, хроническое токсическое действие - при длительном биотестировании в течение 14 сут.
Источники получения культуры, описание основных характеристик вида, условия культивирования и содержания даны в приложениях Е и Ж.
6.3.2. Необходимые материалы, оборудование, реактивы
1. Культура водорослей Scenedesmus quadricauda (Turp.) Breb. или Chlorella vulgaris Beijer.
2. Автоклав по ГОСТ 9586.
3. Аппарат Зейтца или другой фильтровальный аппарат.
4. Колба Бунзена по ТУ 25-1173.
5. Дозаторы пипеточные на 0,1 и 0,5 мл П1 по ТУ 64-1-3329.
6. Камера счетная Горяева или Фукс-Розенталя по ТУ 64-1-816.
7. Люминостат.
8. Микроскоп биологический «Биолам».
9. Фильтры мембранные по ТУ 6-05-1903 с диаметром пор 0,85 - 2,5 мкм (№ 4).
10. Колбы конические по ГОСТ 10394 вместимостью 1000 мл и 250 мл.
11. Колбы мерные по ГОСТ 1770, в исполнении 2, вместимостью 100 мл.
12. Цилиндры мерные по ГОСТ 1770, в исполнении 3, вместимостью 250 мл.
13. Вата.
14. Марля по ГОСТ 9412.
15. Калий азотнокислый по ГОСТ 4217 изм. № 1.
16. Магний сернокислый по ГОСТ 4523.
17. Калий фосфорнокислый однозамещенный по ГОСТ 4198.
18. Калий углекислый по ГОСТ 4221.
19. Кальций азотнокислый по ТУ 6-09-1013.
20. Борная кислота по ГОСТ 9656.
21. Магний хлористый четырехводный по ГОСТ 4209.
22. Цинк сернокислый по ГОСТ 4174.
23. Оксид молибдена по ТУ 6-09-4471.
24. Аммоний ванадиевокислый по ГОСТ 9336 изм. № 1.
6.3.3. Подготовка к биотестированию
Для посева используют 5 - 7-суточную культуру водорослей, находящуюся в стадии экспоненциального роста. Перед биотестированием ее сгущают, фильтруя через мембранный фильтр № 4 или фильтровальную бумагу (синяя лента) с помощью аппарата Зейтца. С фильтра водоросли смывают в стаканчик 30 - 50 мл профильтрованной культуральной среды. Клетки водорослей можно также сконцентрировать путем отстаивания культуры водорослей. Численность клеток в суспензии, которую используют для посева, должна составлять 5 - 10 млн. кл./мл.
Биотестирование проводят при оптимальной температуре и освещении.
Для биотестирования используют культуру водорослей, для которой концентрация K2Cr2O7, вызывающая 50 %-е снижение численности водорослей через 4 сут, находится в интервале 0,4 - 0,9 мг/л.
6.3.4 Проведение биотестирования
Для биотестирования необходимо 0,5 л воды.
Биотест ставят в трех сериях: одной опытной и двух контрольных. Для контрольных серий используют воду, отобранную из «условно чистого» (фонового) створа, и отстоявшуюся водопроводную воду. При отсутствии фонового створа допустимо использовать один контроль - на водопроводной воде.
В колбы вместимостью 250 мл наливают по 100 мл контрольной или испытываемой воды.
Повторность двукратная. В каждую колбу пипеткой вносят по 0,1 мл каждого солевого раствора (см. приложение Ж) и по 0,5 мл сгущенной культуры водорослей.
Колбы закрывают ватно-марлевыми пробками, содержимое тщательно перемешивают и в каждой колбе определяют исходную численность клеток, которая должна быть 25 - 50 тыс. кл./мл. Колбы помещают в люминостат или в хорошо освещенное место, защищенное от прямых солнечных лучей. Через 96 ч в каждой колбе подсчитывают численность клеток для установления острого токсического действия испытываемой воды (кратковременное биотестирование). При установлении острого токсического действия (см. п. 6.3.6) биотестирование прекращают. При отсутствии острого токсического действия опыт продолжают, чтобы установить возможное хроническое действие (длительное биотестирование). В этом случае через 7 сут от начала биотестирования меняют контрольную и испытываемую воду на свежеотобранную. Для этого в новую партию колб вместимостью 250 мл наливают по 75 мл контрольной или испытываемой воды (из свежеотобранной пробы), в каждую колбу добавляют указанное количество растворов солей.
Тщательно перемешивают содержимое колб, в которых проводили биотестирование в течение первых 7 сут. Пипеткой с резиновой грушей отбирают из содержимого каждой колбы по 25 мл, переносят соответственно в свежеприготовленные растворы и перемешивают. Затем в каждой колбе определяют численность клеток и продолжают биотестирование еще в течение 7 сут. Через 14 сут устанавливают, оказывает ли испытываемая вода хроническое токсическое действие на водоросли.
6.3.5. Регистрация численности клеток водорослей
Численность клеток подсчитывают под микроскопом, используя камеру Горяева или Фукс-Розенталя. Камеру и покровное стекло обезжиривают, накрывают камеру покровным стеклом и притирают его до образования радужных колец интерференции. Из каждой колбы пипеткой наносят по одной капле тщательно перемешанной суспензии на верхний и нижний края покровного стекла. Камеру заполняют так, чтобы не образовывались пузырьки воздуха, избыток суспензии вытесняется по канавкам. Просматривают 16 квадратов по диагонали или все поле камеры, если численность водорослей мала (при одном заполнении камеры просчитывают не менее 50 клеток). Вычисляют численность клеток водорослей в 1 мл суспензии по формуле
М = [m/(nV)] ∙ 103, (6.4)
где М - численность клеток водорослей, тыс. кл./мл;
m - число подсчитанных клеток;
n - число просчитанных маленьких квадратов камеры;
V - объем части камеры, соответствующей площади маленького квадрата, мл.
Необходимо обратить внимание на то, что численность клеток водорослей у каждой колбе определяют не менее, чем из трех проб, что требуется для статистической обработки результатов биотестирования.
6.3.6. Обработка результатов, расчеты и оценка токсичности воды
Для определения острого или хронического токсического действия испытываемой воды на водоросли рассчитывают коэффициент прироста численности клеток водорослей в контрольных и опытной сериях, используя формулу
K = Nt/N0, (6.5)
где K - коэффициент прироста численности клеток водорослей;
Nt - численность клеток водорослей в контроле или испытываемой воде через учитываемый промежуток времени, тыс. кл./мл;
N0 - исходная численность клеток, тыс. кл./мл.
Поскольку в каждой колбе подсчитывают численность клеток водорослей в трех пробах, то для каждой повторности в опытной и контрольных сериях рассчитывают три коэффициента прироста численности (K1, K2, K3):
![]()
![]()
![]()
где N0 макс, N0 мин, N0 пр - соответственно наибольшая, наименьшая и промежуточная исходная численность клеток водорослей, тыс. кл./мл;
Nt макс, Nt мин, Nt пр - соответственно наибольшая, наименьшая и промежуточная численность клеток водорослей через учитываемый период времени t, тыс. кл/мл.
Таким образом, для опытной и контрольных серий получаем шесть коэффициентов прироста численности (по три для каждой повторности). При длительном биотестировании N0 в контрольной и испытуемой воде определяют через 7 сут после смены воды.
Используют приемы статистической обработки, описанные в п. 6. Вначале устанавливают достоверность различия между коэффициентами прироста численности клеток в двух контрольных сериях. При отсутствии достоверных различий между ними сравнивают коэффициенты прироста численности клеток в испытываемой воде и в контроле, поставленном на «условно чистой» природной воде из фонового створа. Если различия между коэффициентами прироста численности водорослей в двух контрольных сериях достоверны, то сравнивают показатели интенсивности размножения водорослей в испытываемой воде с тем или иным контрольным значением в зависимости от поставленной задачи. В работах по режимному мониторингу при оценке влияния источника загрязнения на качество воды устанавливают достоверность различий между коэффициентами прироста численности клеток водорослей в испытываемой и контрольной воде, отобранной на фоновом створе водного объекта.
Для проб воды, отобранных вне зоны влияния источника загрязнения, сравнивают коэффициенты прироста численности клеток водорослей для испытываемой воды и для контроля, поставленного на отстоявшейся водопроводной воде.
Достоверное снижение коэффициента прироста численности клеток в опытной серии по сравнению с контролем свидетельствует о наличии острого или хронического токсического действия испытываемой воды на водоросли, достоверное увеличение - о присутствии в испытываемой воде загрязняющих веществ, стимулирующих рост водорослей.
Результаты биотестирования записывают по форме, приведенной в приложении И.
6.3.7 Примеры биотестирования на водорослях
Пример 1. При биотестировании воды, отобранной ниже города А. и на реке Б., на культуре сценедесмус получены данные по численности клеток водорослей, представленные в таблице 6.3. По формуле (6.4) рассчитаем коэффициенты прироста численности водорослей за 96 ч (4 сут).
В контроле К-1, поставленном на отстоявшейся водопроводной воде, коэффициенты прироста для первой повторности имели следующие значения:
![]()
![]()
![]()
Для второй повторности коэффициенты прироста равны:
K1 = 238/38 = 6,26, K2 = 200/49 = 4,08, K3 = 205/42 = 4,88.
Таблица 6.3 - Результаты биотестирования с использованием показателя интенсивности размножения водорослей сценедесмус
|
Водный объект, пункт, створ, дата отбора |
Серия |
Время от начала биотестирования, сут |
Численность водорослей, тыс. кл./мл |
Коэффициент прироста численности водорослей |
Оценка токсичности воды |
|||||
|
Повторность |
Повторность |
Среднее арифметическое |
Критерий достоверности t |
|||||||
|
1 |
2 |
1 |
2 |
|||||||
|
1 |
Река Б. выше города А, 25.06.92 |
Контроль К-1 |
0 |
35, 39, 42, 156, 168, 181 |
38, 42, 49, 200, 205, 238 |
5,17 |
6,26 |
4,74 |
||
|
4 |
3,71 |
4,08 |
||||||||
|
4,31 |
4,88 |
|||||||||
|
2 |
То же |
Контроль К-2 |
0 |
38, 42, 47, 163, 179, 190 |
35, 38, 43, 171, 195, 208 |
5,00 |
5,94 |
4,63 |
tK-1, K-2 = 0,21 |
|
|
4 |
3,47 |
3,98 |
||||||||
|
4,26 |
5,13 |
|||||||||
|
3 |
Река Б. ниже города А, 25.05.92 |
Опыт О |
0 |
36, 39, 44, 125, 138, 142 |
42, 48, 49, 133, 145, 152 |
2,84 |
2,71 |
3,28 |
tO, K-2 = 3,29 |
Оказывает острое токсическое действие |
|
4 |
3,94 |
3,62 |
||||||||
|
3,54 |
3,02 |
|||||||||
При расчете коэффициентов прироста численности клеток водорослей в контроле К-2 на природной воде из фонового створа и в опытной серии с испытываемой водой получены следующие результаты:
|
Коэффициент |
K1 |
K2 |
K3 |
|
Контроль К-2 |
|||
|
Повторность 1 Повторность 2 |
5,0 5,94 |
3,47 3,98 |
4,26 5,13 |
|
Опыт О |
|||
|
Повторность 1 Повторность 2 |
2,84 2,71 |
3,94 3,62 |
3,54 3,02 |
Чтобы
оценить достоверность различий коэффициентов прироста численности клеток
водорослей в испытываемой воде (опытная серии) и в контроле, рассчитаем их
средние арифметические ![]() ,
,
![]() и
и ![]() по формуле (8.1), а
затем суммы квадратов отклонений каждого коэффициента прироста численности
водорослей от среднего арифметического
по формуле (8.1), а
затем суммы квадратов отклонений каждого коэффициента прироста численности
водорослей от среднего арифметического ![]() для расчета средних
квадратических отклонений σ (таблица 6.4).
для расчета средних
квадратических отклонений σ (таблица 6.4).
Далее рассчитаем для коэффициентов прироста численности клеток в контрольных и опытных сериях среднее квадратическое отклонение σК-1, σК-2, σO, по формуле 8.2 и ошибку среднего арифметического SК-1, SК-2, SO по формуле 8.3:
![]()
![]()
![]()
![]()
![]()
![]()
По формуле (8.4) рассчитаем критерий Стъюдента t для контроля К-1 и контроля К-2:
![]()
Таблица 6.4 - Расчет суммы квадратов отклонений коэффициентов прироста численности водорослей от средней арифметической
|
Контроль К-2 |
Опыт |
||||||||||
|
Xi |
|
|
Xi |
|
|
Xi |
|
|
|||
|
5,17 |
0,43 |
0,1849 |
5,00 |
0,37 |
0,1369 |
2,84 |
0,44 |
0,1936 |
|||
|
8,71 |
1,03 |
1,0609 |
3,47 |
1,16 |
1,3456 |
3,94 |
0,66 |
0,4356 |
|||
|
4,81 |
0,43 |
0,1849 |
4,26 |
0,37 |
0,1369 |
3,54 |
0,26 |
0,076 |
|||
|
6,26 |
1,52 |
2,3104 |
5,94 |
1,31 |
1,7161 |
2,71 |
0,57 |
0,3249 |
|||
|
4,08 |
0,66 |
0,4356 |
3,98 |
0,65 |
0.4225 |
3,62 |
0,34 |
0,1156 |
|||
|
4,88 |
0,14 |
0,0196 |
5,13 |
0,50 |
0,2500 |
3,02 |
0,26 |
0,0676 |
|||
|
|
|
|
|
|
|
||||||
Сравним рассчитанное значение t с его критическим значением tSt для числа степеней свободы k = 6 + 6 - 2 = 10 при уровне значимости 0,05, пользуясь таблицей (8.1). Согласно таблице, tSt = 2,23. Таким образом, условие t ≥ tSt не выполняется (0,21 < 2,23), что свидетельствует о недостоверности различий коэффициентов прироста численности клеток водорослей в обоих контролях. Отсюда следует вывод об отсутствии острой токсичности в фоновом створе. В этом случае для установления токсичности в опыте коэффициенты прироста численности водорослей в испытываемой воде сравним с контролем К-2, поставленном на природной воде из фонового створа. Рассчитаем критерий Стьюдента t для этих серий:
![]()
В данном случае условие t ≥ tSt выполняется (3,29 > 2,23) при выбранном уровне значимости и, следовательно, коэффициенты прироста численности водорослей в испытываемой воде и в контроле К-2 достоверно различаются. Полученные результаты позволяют сделать вывод об угнетающем влиянии испытываемой воды на водоросли и констатировать наличие острого токсического действия.
Таким образом, качество испытываемой воды не соответствует действующей норме по токсикологическим показателям.
Наличие второго контроля на природной воде из фонового створа позволило не только выявить токсичность испытуемой воды, но и установить, что токсические свойства она приобретает в результате влияния городских сточных вод.
Пример 2. Необходимо провести биотестирование пробы воды, отобранной на реке Д. ниже города Е. Для этого ставим три серии эксперимента: две контрольные (на отстоявшейся водопроводной воде и природной воде из фонового створа) и одну опытную. Данные по численности водорослей и рассчитанные коэффициенты прироста численности клеток водорослей в трех сериях эксперимента представлены в таблице 6.5.
Чтобы выявить достоверность различий коэффициентов прироста численности клеток водорослей в опыте и контроле, рассчитаем статистические параметры в двух контрольных и опытной сериях, как показано в примере 1. Средние квадратические отклонения соответственно в контроле К-1, контроле К-2 и опыте О составили σК-1 = 0,92, σК-2 = 0,67 и σO = 0,49, а ошибка среднего арифметического SК-1 = 0,38, SК-2 = 0,27 и SO = 0,20.
Таблица 6.5 - Результаты биотестирования с использованием показателя интенсивности размножения водорослей сценедесмус
|
Водный объект, пункт, створ, дата отбора |
Серия |
Время от начала биотестирования, сут |
Численность водорослей, тыс. кл./мл |
Коэффициент прироста численности водорослей |
Оценка токсичности воды |
|||||
|
Повторность |
Повторность |
Среднее арифметическое |
Критерий достоверности t |
|||||||
|
1 |
2 |
1 |
2 |
|||||||
|
1 |
- |
Контроль К-1 |
0 |
35, 39, 42, |
38, 42, 49, |
5,17 |
6,26 |
4,74 |
||
|
4 |
156, 168, |
200, 205, |
3,71 |
4,08 |
||||||
|
181 |
288 |
4,31 |
4,88 |
|||||||
|
2 |
Река Д. выше города Е., 24.06.92 |
Контроль К-2 |
0 |
42, 48, 55, |
34, 39, 45, |
4,17 |
4,64 |
3,69 |
tК-1, К-2 = 0,28 |
Оказывает острое токсическое действие |
|
4 |
153, 168, |
145, 149, |
2,78 |
3,22 |
||||||
|
175 |
158 |
3,50 |
3,82 |
|||||||
|
3 |
Река Д. ниже города Е., 24.06.92 |
Опыт О |
0 |
36, 39, 44, |
42, 48, 49, |
2,84 |
2,11 |
3,28 |
tО, К-2 = 3,40 |
То же |
|
4 |
125, 138, |
133, 145, |
3,94 |
3,62 |
||||||
|
142 |
152 |
3,54 |
3,02 |
|||||||
Вычисляем критерий Стьюдента t для контроля К-1 и контроля К-2:
![]()
Рассчитанное значение t соответствует критическому значению tSt для уровня значимости 0,05 и числа степеней свободы k = 10. Таким образом, установлено достоверное снижение коэффициента прироста численности клеток водорослей в контроле К-2 по сравнению с контролем К-1. Это свидетельствует о том, что вода, отобранная в фоновом створе, оказывает острое токсическое действие на водоросли. В этом случае сравним прирост численности клеток водорослей в фоновом створе и в контроле К-1, поставленном на отстоянной водопроводной воде. Определим критерий Стьюдента
![]()
Результаты свидетельствуют о достоверном снижении коэффициентов прироста численности клеток водорослей в опытной серии эксперимента по сравнению с контролем К-1. Это позволяет установить наличие острого токсического действия испытываемой воды на водоросли.
В данном случае качество воды в фоновом створе и в створе, расположенном ниже города, не соответствует установленной норме по токсикологическим показателям.
Пример 3. Необходимо произвести биотестирование проб воды, отобранных на реке В. у города Г. ниже сбросов завода Д. и ниже сбросов завода Е. Для этого ставим четыре серии эксперимента: две контрольные и две опытные. Данные по численности водорослей и коэффициенты прироста численности клеток водорослей всех серий приведены в таблице 6.6.
Статистические параметры (ход расчета приведен в примере 1) в контроле с отстоявшейся водопроводной водой (К-1), в контроле с природной водой из фонового створа (К-2), в опыте с водой, отобранной ниже сбросов завода Д. (O-1) и ниже сбросов завода Е. (O-2) соответственно равны:
σК-1 = 0,93; σК-2 = 0,88; σO-1 = 1,01; σO-2 = 0,87;
SК-1 = 0,38; SК-2 = 0,36; SO-1 = 0,41; SO-2 = 0,36.
Таблица 6.6 - Результаты биотестирования с использованием показателя интенсивности размножения водорослей сценедесмус
|
Водный объект, пункт, створ, дата отбора |
Серия |
Время от начала биотестирования, сут |
Численность водорослей, тыс. кл./мл |
Коэффициент прироста численности водорослей |
Оценка токсичности воды |
|||||
|
Повторность |
Повторность |
Среднее |
Критерий |
|||||||
|
1 |
2 |
1 |
2 |
арифметическое |
достоверности t |
|||||
|
1 |
Контроль К-1 |
0 |
35, 39, 42, 156, 168, 181 |
38, 42, 49, 200, 205, 238 |
5,17 |
6,26 |
4,74 |
|||
|
4 |
3,71 |
4,08 |
||||||||
|
4,31 |
4,88 |
|||||||||
|
2 |
Река В. выше города Г. |
Контроль К-2 |
0 |
28, 33, 36, 192, 206, 211 |
31, 35, 40, 203, 209, 218 |
7,54 |
7,03 |
6,29 |
tК-1, К-2 = 2,98 |
В воде присутствуют загрязняющие вещества, стимулирующие рост водорослей |
|
4 |
5,85 |
5,08 |
||||||||
|
6,24 |
5,97 |
|||||||||
|
3 |
Река В. ниже сбросов города Г. |
Опыт O-1 |
0 |
34, 39, 40, 262, 280, 286 |
25, 28, 32, 215, 222, 228 |
8,41 |
9,12 |
tO-1, К-1 = 5,20 tO-1, К-2 = 2,47 |
То же |
|
|
4 |
6,55 |
6,72 |
||||||||
|
7,18 |
7,93 |
|||||||||
|
4 |
Река В., город Г., ниже сбросов завода Е. |
Опыт О-2 |
0 |
24, 29, |
28, 33, |
5,83 |
6,14 |
tO-2, К-1 = 0,42 tO-2, К-1 = 2,61 |
Однозначную оценку дать нельзя, необходимо провести биотестирование с использованием других тест-объектов |
|
|
4 |
32, 128, |
36, 152, |
4,00 |
4,22 |
||||||
|
132, 140 |
167, 172 |
4,55 |
5,06 |
|||||||
Рассчитаем достоверность различий коэффициентов прироста численности клеток водорослей в контроле К-1 и контроле К-2 по критерию Стьюдента t:
![]()
Рассчитанное значение критерия t превышает его критическое значение для уровня значимости 0,05 и числа степеней свободы k = 10 (2,98 > 2,23), что свидетельствует о достоверности увеличения коэффициентов прироста численности клеток водорослей в контроле К-2 по сравнению к контролем К-1. Таким образом, в воде фонового участка реки присутствуют загрязняющие вещества, стимулирующие рост водорослей.
В опытной серии O-1, поставленной на воде, отобранной ниже сбросов завода Д., также обнаружено достоверное увеличение коэффициентов прироста численности клеток водорослей по сравнению с данными обоих контролей (tO-1, К-1 = 5,20; tO-1, К-2 = 2,47). Следовательно, в испытываемой воде O-1 также присутствуют загрязняющие вещества, стимулирующие рост водорослей. В опытной серии O-2, поставленной на воде, отобранной ниже сбросов завода Е., и в контроле К-1 на отстоявшейся водопроводной воде коэффициенты прироста численности клеток водорослей достоверно не различались (tO-2, К-1 = 0,42). В то же время по сравнению с контролем К-2 на природной воде из фонового створа обнаружено достоверное снижение коэффициентов прироста численности водорослей (tO-2, К-2 = 2,61). Таким образрм, сравнение с контролем К-1 как будто бы дает основание, чтобы сделать вывод об отсутствии острого токсического действия испытываемой воды О-2 на водоросли. Однако сравнение с контролем К-2 не позволяет делать однозначные выводы, поскольку коэффициенты прироста могут снизиться в двух случаях: 1) в результате естественного самоочищения воды и при условии, что со стоками не поступают токсичные вещества, и 2) в результате сброса токсичных веществ, которые, угнетая рост водорослей, снимают эффект стимуляции, вызываемой присутствующими в воде другими загрязняющими веществами. В данной ситуации нельзя дать однозначную оценку токсичности воды. Необходимо провести биотестирование на других тест-объектах (дафниях, инфузориях, коловратках, рыбах и т.д.) и сопоставить результаты.
6.4 Биотест на парамециях
6.4.1. Принцип метода
Метод основан на оценке влияния испытываемой воды, отобранной из водоемов и водотоков, на индивидуальные линии лабораторной культуры парамеций. Влияние испытываемой воды оценивают по изменению показателей выживаемости и размножения парамеций при экспозиции в испытываемой воде по сравнению с контролем.
Острое, подострое и хроническое токсическое действие испытываемой воды на парамеций устанавливают в ходе одного опыта (непрерывное биотестирование) в зависимости от времени проявления токсического действия. Острое токсическое действие устанавливают за время экспозиции до 24 ч, подострое - до 48 ч, хроническое - до 72 ч.
Показателем выживаемости служит среднее число парамеций, выживших в испытываемой воде за время опыта. Показателем размножения служит средний прирост численности парамеций за время опыта.
Критерием токсичности является снижение выживаемости на 25 % и более и изменение плодовитости на 30 % и более по сравнению с контролем.
6.4.2. Необходимые материалы, оборудование, реактивы
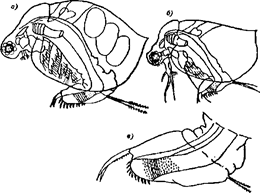
1. Культура Paramecium caudatum Ehreberg 1838, п/т Ciliata. Источники получения культуры, описание основных характеристик вида и условий культивирования даны в приложениях Л и М.
2. Микроскоп стереоскопический (МБС-9) по ГОСТ 8074.
3. Фильтры бумажные с размером пор 3 - 5 мкм.
4. Фильтровальная бумага.
5. Дрожжи пекарские.
6. Пипетки капиллярные (пастеровские, укороченные с двух сторон или глазные с оттянутым носиком).
7. Планшеты из плексиглаза для иммунологических исследований или конволюты из-под лекарств, или обрезанные флаконы из-под антибиотиков, вместимостью примерно 2 мл.
8. Чашки Петри по ГОСТ 109-73.
6.4.3 Подготовка к биотестированию
Исходный материал для биотестирования получают за 1 - 3 сут до опыта. Для этого парамеций пересаживают в чистые чашки Петри с дехлорированной водопроводной водой, в которую предварительно вносят корм (один - два кусочка сухих пекарских дрожжей размером 1 мм3 на одну чашку Петри).
Биотестирование проводят при комнатной температуре без смены воды в нестерильных условиях в защищенном от прямого солнечного света месте.
Непрерывное биотестирование проводят в луночных микроаквариумах вместимостью 0,4 - 0,6 мл. Для этого обычно используют планшеты для иммунологических работ с крышками. Луночные микроаквариумы расположены в планшете из оргстекла размером 12×8 см в восемь рядов по 12 лунок (диаметр 0,6 см, глубина 1,2 см). Шесть рядов микроаквариумов используют для образцов испытуемой воды, а последние два - для контроля.
При отсутствии планшетов используют конволюты из-под лекарств или обрезанные флаконы из-под антибиотиков, помещая их в чашку Петри для предотвращения испарения.
6.4.4 Проведение биотестирования
Общий объем воды для биотестирования одной пробы воды 10 мл.
Для проведения токсикологического эксперимента в каждый луночный микроаквариум планшета с помощью капиллярной пипетки под микроскопом отсаживают по одной особи. Попавшую с парамециями воду убирают с помощью фильтровальной бумаги и приливают по 0,4 - 0,5 мл испытываемой или контрольной воды. В одной серии биотеста используют по 10 особей, каждую пробу воды ставят в двух повторностях, т.е. используют 20 луночных микроаквариумов. Одновременно с опытной ставят две контрольные серии: с водопроводной дехлорированной водой и природной водой из фонового створа водного объекта. Контроль на водопроводной воде служит для оценки состояния популяции парамеций, используемой при биотестировании, и для оценки возможной токсичности воды фонового створа водного объекта.
Через сутки от начала биотестирования парамеций кормят раствором пекарских дрожжей (см. приложение М, п. 2).
6.4.5 Регистрация показателей выживаемости и размножения
Регистрация показателей выживаемости и размножения основана на учете числа парамеций в каждом луночном микроаквариуме. Для оценки выживаемости учитывают число мертвых особей, для оценки размножения - число народившихся особей. Число народившихся особей (прирост численности) является показателем размножения, поскольку используемая методика индивидуальных линий позволяет наблюдать число парамеций, народившихся от одной особи.
Учет парамеций ведут под микроскопом (увеличение 4×12,4) через 1, 3, 5, 24, 48 и 72 ч. Во время наблюдений под микроскопом содержимое луночных микроаквариумов осторожно барботируют пузырьками воздуха из капиллярной пипетки для того, чтобы отличить возможную иммобилизацию особей от их гибели. Показателем гибели парамеций служит деформация тела, разрыв пелликулы (оболочки), лизис клетки, а также сохранение неподвижности после барботирования водной среды. В ходе наблюдений вновь народившихся и мертвых особей удаляют из луночных микроаквариумов.
Численность парамеций в контроле и опыте (исходную - Nисх и в каждые последующие строки наблюдения), число живых (Nж) и мертвых (Nм) особей записывают в журнал по форме, приведенной в приложении М.
6.4.6 Обработка результатов, расчеты и оценка токсичности воды
Результаты биотестирования оценивают по показателям выживаемости и размножения (приросту численности) за 24, 48 и 72 ч.
Показатель выживаемости для испытываемой воды (опыт) и контроля рассчитывают по формуле
где X - выживаемость, %;
ΣNисх - общее число исходных особей, взятых в опыт;
ΣNм - общее число мертвых особей за время экспозиции.
Снижение выживаемости парамеций в испытываемой воде по сравнению с контролем рассчитывают по формуле
где А - снижение выживаемости парамеций в испытываемой воде, %;
Хк и Хо - выживаемость парамеций в испытываемой воде (опытная серия) и в контроле соответственно, %.
При обработке результатов биотестирования вначале сравнивают показатели выживаемости парамеций в контрольных сериях на водопроводной воде (К-1) и на природной воде из фонового створа (К-2) при условии, что выживаемость в К-1 не ниже 90 %. Если в К-2 снижение выживаемости парамеций по сравнению с К-1 не превышает 25 % (вода контроля К-2 не токсична), то результаты в опытной серии сравнивают с контролем на воде из фонового створа. Если в К-2 снижение выживаемости парамеций по сравнению с контролем К-1 составляет 25 % и более, то воду фонового створа оценивают как токсичную и результаты опытной серии сравнивают с контролем на водопроводной воде, рассчитывая снижение выживаемости инфузорий в испытываемой воде по формуле (6.6). При снижении выживаемости парамеций в опытной серии на 25 % и более по сравнению с контролем испытываемую воду считают токсичной.
Если снижение выживаемости парамеций в опыте менее 25 %, то рассчитывают показатель размножения парамеций на основе прироста их численности на каждый рассматриваемый промежуток времени по формуле
g = (ΣNt - ΣNисх)/ΣNисх, (6.8)
где g - показатель размножения парамеций (число особей, рожденных одной парамецией);
ΣNисх - общее исходное число парамеций;
ΣNt - общее число парамеций на момент времени t.
____________
1 Если выживаемость парамеций в контроле на дехлорированной водопроводной воде в любой учитываемый промежуток времени ниже 90 %, то опыт повторяют на другой популяции парамеций.
Токсичность испытываемой воды оценивают по отклонению показателя размножения:
n = [(go - gк)/gк]100, (6.9)
где n - отклонение показателя размножения парамеций от контроля, %;
gк и go - показатели размножения парамеций в контроле и в опыте соответственно.
Отклонения показателя размножения в опыте от показателя в контроле могут быть положительными и отрицательными. Положительные отклонения свидетельствуют об увеличении плодовитости по сравнению с контролем. Увеличение интенсивности размножения парамеций и угнетение размножения по сравнению с контролем являются проявлением токсичности испытываемой воды. Наличие токсичности действия испытываемой воды устанавливают при отклонении показателя размножения парамеций от контроля на 30 % и более.
Таблица 6.7 - Оценка токсичности воды по данным биотестирования по парамециям
|
Снижение выживаемости, % контроля |
Отклонение показателя размножения от контроля, % |
Оценка токсичности воды |
|
|
1 - 24 |
< 25 |
< 30 |
Не оказывает острого токсического действия |
|
≥ 30 |
Оказывает острое токсическое действие |
||
|
≥ 25* |
< 30 |
||
|
≥ 30 |
|||
|
48 |
< 25 |
< 30 |
Не оказывает подострого токсического действия |
|
≥ 30 |
Оказывает подострое токсическое действие |
||
|
≥ 25* |
< 30 |
||
|
≥ 30 |
|||
|
72 |
< 25 |
< 30 |
Не оказывает хронического токсического действия |
|
≥ 30 |
Оказывает хроническое токсическое действие |
||
|
≥ 25* |
< 30 |
||
|
≥ 30 |
|||
|
* Если снижение выживаемости составляет 25 % и более, воду считают токсичной и показатель размножения не рассчитывают. |
|||
Характер токсического действия (острое, подострое и хроническое) определяют по двум показателям в зависимости от времени выявления:
1) острое токсическое действие - за 24 ч экспозиции,
2) подострое токсическое действие - за 48 ч экспозиции,
3) хроническое токсическое действие - за 72 ч экспозиции.
Критерии токсичности испытываемой воды с использованием показателей выживаемости и размножения парамеций приведены в таблице 6.7.
Результаты биотестирования записывают по форме таблицы 2 приложения Н.
6.4.7 Пример биотестирования на парамециях
В лабораторию доставлена проба воды из водоема А., пункт г. С., в соответствии с программой режимных наблюдений. Пробы отобраны на фоновом створе водоема (условно чистом) и створе ниже города.
Емкости с водой оставим в лаборатории для уравнивания температуры воды проб и температуры среды с парамециями. Для определения токсического действия проведем биотестирование на индивидуальных линиях парамеций. Для этого под микроскопом капиллярной пипеткой отберем парамеций и поместим по одной в луночные микроаквариумы. Остаток воды уберем с помощью фильтровальной бумаги. Ставим две повторности: на каждую по 10 особей (всего 20 особей, по одной в каждом из луночных микроаквариумов). К отсаженным особям в опытной серии добавим испытываемую воду, в одну контрольную серию - отстоянную водопроводную (дехлорированную) воду, в другую контрольную серию - воду из условно чистого створа.
Через 1, 3, 5, 24, 48 и 72 ч под микроскопом подсчитаем число парамеций. В каждом луночном микроаквариуме осторожно барботируем воду воздухом из капиллярной пипетки. Данные об исходном числе парамеций, взятых в опыт, и числе живых (Nж) и мертвых (Nм) особей в ходе наблюдений запишем по форме таблицы 6.8.
Способ обработки данных наблюдений и оценки результатов биотестирования покажем на примере расчета данных за 72 ч наблюдений.
Рассчитаем суммарное число живых парамеций в каждой повторности и сумму из повторностей в опытных и контрольных сериях.
Таблица 6.8 - Данные непрерывного биотестирования памераций
|
Серия |
№ микроаквариума |
Исходная численность в каждой повторности, экз. |
Живые особи, экз. |
Мертвые особи, экз. |
|||||||||||||||||
|
Время экспозиции, ч |
|||||||||||||||||||||
|
24 |
48 |
72 |
24 |
48 |
72 |
||||||||||||||||
|
Повторность |
Сумма |
Повторность |
Сумма |
Повторность |
Сумма |
Повторность |
Сумма |
Повторность |
Сумма |
Повторность |
Сумма |
||||||||||
|
1 |
2 |
1 |
2 |
1 |
2 |
1 |
2 |
1 |
2 |
1 |
2 |
||||||||||
|
1 |
Контроль К-l |
1 |
1 |
1 |
1 |
3 |
2 |
3 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||
|
2 |
1 |
2 |
1 |
2 |
2 |
2 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
3 |
1 |
1 |
2 |
2 |
1 |
3 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
4 |
1 |
1 |
3 |
3 |
1 |
2 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
5 |
1 |
2 |
2 |
2 |
3 |
3 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
6 |
1 |
3 |
2 |
2 |
2 |
2 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
7 |
1 |
2 |
2 |
2 |
3 |
3 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
8 |
1 |
1 |
3 |
2 |
2 |
3 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
9 |
1 |
2 |
1 |
3 |
2 |
3 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
10 |
1 |
2 |
2 |
2 |
3 |
3 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
Сумма |
10 |
17 |
19 |
36 |
23 |
21 |
44 |
27 |
29 |
56 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
||
|
2 |
Контроль К-2 |
1 |
1 |
1 |
2 |
2 |
2 |
4 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||
|
2 |
1 |
1 |
1 |
2 |
2 |
3 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
3 |
1 |
1 |
3 |
3 |
3 |
3 |
8 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
4 |
1 |
2 |
2 |
2 |
2 |
3 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
5 |
1 |
1 |
2 |
2 |
3 |
3 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
6 |
1 |
1 |
1 |
2 |
2 |
3 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
7 |
1 |
2 |
2 |
2 |
3 |
3 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
8 |
1 |
2 |
1 |
2 |
2 |
3 |
22 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
9 |
1 |
3 |
1 |
8 |
2 |
3 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
10 |
1 |
2 |
8 |
2 |
8 |
2 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
Сумма |
10 |
16 |
18 |
34 |
22 |
24 |
46 |
30 |
26 |
56 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
||
|
3 |
Опыт |
1 |
1 |
1 |
2 |
2 |
3 |
4 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||
|
2 |
1 |
1 |
8 |
2 |
4 |
3 |
4 |
0 |
0 |
0 |
0 |
0 |
|||||||||
|
8 |
1 |
2 |
1 |
2 |
2 |
3 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
4 |
1 |
1 |
1 |
2 |
2 |
2 |
4 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
5 |
1 |
2 |
1 |
3 |
3 |
5 |
3 |
0 |
0 |
0 |
о |
0 |
0 |
||||||||
|
6 |
1 |
2 |
2 |
3 |
3 |
4 |
4 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
7 |
1 |
2 |
1 |
3 |
2 |
3 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
8 |
1 |
3 |
2 |
3 |
3 |
4 |
4 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
9 |
1 |
1 |
2 |
2 |
3 |
3 |
4 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
10 |
1 |
1 |
2 |
2 |
3 |
2 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
||||||||
|
Сумма |
10 |
17 |
17 |
34 |
24 |
28 |
52 |
33 |
35 |
68 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
||
В первой повторности контроля К-2 оно равно
4 + 3 + 3 + 3 + 3 + 3 + 3 + 3 + 3 + 2 = 30 экз.
Во второй повторности К-2 оно равно
2 + 3 + 3 + 2 + 3 + 2 + 3 + 2 + 3 + 3 = 26 экз.
Сумма из двух повторностей равна 30 + 26 = 56 экз. В К-1 сумма для первой и второй повторностей ровна соответственно 27 и 29 экз. Сумма для обеих повторностей 56 экз. В опыте эти суммы равны соответственно 33, 35 и 68 экз. Полученные донные запишем в ту же таблицу 6.8.
Рассчитаем суммарное число мертвых особей в каждой повторности в опытной и контрольных сериях. За период экспозиции 72 ч в К-2 погибла одна особь из 20, в К-1 мертвых особей не обнаружено, в опыте погибли две особи из 20. Полученные данные запишем в ту же таблицу 6.8.
Далее используем полученные суммы для расчета показателей за период экспозиции 72 ч.
Рассчитаем показатель выживаемости X по формуле (6.6).
В К-1 мертвых особей не отмечено - выживаемость 100 %.
В К-2 показатель выживаемости равен
X = [(20 - 1)/20]100 = 90 %.
В опыте показатель выживаемости составил
X = [(20 - 2)/20]100 = 90 %.
Запишем полученные данные в таблицу 6.9.
Оценим контрольные серии. В К-1 гибели не отмечено, следовательно, данные, полученные на этой популяции парамеций, должны быть правильными. В К-2 отмечена гибель, выживаемость составила 95 %.
Сравним выживаемость в контрольных сериях К-1 и К-2 по формуле (6.7):
А = [(100 - 95)/100]100 = 5 %.
Снижение выживаемости в К-1 по сравнению с К-2 менее 25 %, следовательно, вода в фоновом створе реки не оказывает токсического действия на парамеций.
Таким образом, в дальнейших расчетах используем данные контроля К-2.
Рассчитаем снижение выживаемости в опыте по сравнению с К-2 по формуле (6.7):
А = [(100 - 90)/100]100 = 10 %.
Таблица 6.9 - Результаты биотестирования природной воды на парамециях
|
Водный объект, пункт, створ, дата отбора |
Серия |
Время экспозиции, ч |
Выживаемость, % исходного количества |
Снижение выживаемости, % контроля |
Показатель размножения |
Отклонение показателя размножения от контроля, % |
Оценка токсичности воды |
|
|
1 |
- |
Контроль К-1 |
72 |
100 |
- |
1,8 |
- |
- |
|
2 |
Река А. выше города С., 24.06.92 |
Контроль К-2 |
72 |
98 |
5 |
1,8 |
0 |
Не оказывает хронического токсического действия |
|
3 |
река А. ниже города С., 24.06.92 |
Опыт |
72 |
90 |
10 |
2,4 |
33,3 |
Оказывает хроническое токсическое действие |
Запишем полученные данные в таблицу результатов.
Снижение выживаемости в опыте по сравнению с контролем составило 10 %, что менее 25 %. Согласно критериям таблицы 6.7, в этом случае для оценки токсичности воды необходимо рассчитать второй показатель - показатель размножения.
Рассчитаем показатель размножения парамеций g на основе прироста численности (см. таблицу 6.8) по формуле (6.8):
1) в К-1: g = ((56 - 20)/20] = 1,8;
2) в К-2: g = [(56 - 20)/20] = 1,8;
3) в опыте: g = [(68 - 20)/20] = 2,4.
Рассчитанные значения запишем в таблицу результатов по форме таблицы Н.2 приложения Н.
Сравним показатели размножения, полученные в опыте, с контролем по формуле (6.9):
n = [(2,3 - 1,8)/2,8]100 = 33,3 %.
Запишем данные в таблицу результатов.
Оценим токсичность испытываемой воды по двум полученным показателям: по снижению выживаемости, равному 10 %, и по отклонению плодовитости по сравнению с контролем, равному 33,3 %.
В таблице 6.7 выберем нужное время экспозиции - 72 ч. В нашем случае снижение выживаемости составило 10 %, а отклонение показателя плодовитости 33,3 %. Этим данным соответствует следующая оценка токсичности: испытываемая вода оказывает хроническое токсическое действие. Таким образом, испытываемая вода токсична для парамеций и не соответствует установленным нормам.
6.5 Биотест на коловратках
6.5.1 Принцип метода
Метод основан на оценке влияния испытываемой воды, отобранной из водоемов и водотоков, на лабораторную культуру коловраток. Влияние испытываемой воды оценивают по изменению показателей выживаемости и плодовитости коловраток при экспозиции в испытываемой воде по сравнению с контролем.
Острое, подострое и хроническое токсическое действие испытываемой воды устанавливают в ходе одного опыта. Острое токсическое действие определяют за время экспозиции 24 ч, подострое - за 48 - 72 ч, хроническое - за 96 ч.
Показателем выживаемости служит число коловраток, выживших в испытываемой воде; показателем плодовитости - число молоди, рожденное одной особью за время экспозиции.
Критерием токсичности является снижение выживаемости и изменение плодовитости коловраток на 25 % и более по сравнению с контролем.
6.5.2. Необходимые материалы, оборудование, реактивы
1 Культура коловраток Brachionus calyciflorue. Источники получения культуры, описание основных характеристик вида и условий культивирования даны в приложениях Р и С.
2 Культура одноклеточных протококковых водорослей родов Scenedesmus или Chlorella. Источники получения и условия содержания культуры даны в приложении С.
3 Микроскоп стереоскопический МБС-9 по ГОСТ 8074.
4 Емкости вместимостью 0,2 - 0,5 л.
5 Чашки Петри по ГОСТ 10973.
6 Пипетки капиллярные (обрезанные с обеих сторон пастеровские пипетки) или глазные пипетки с оттянутым носиком.
7 Микроаквариумы (обрезанные флаконы из-под антибиотиков объемом 2 мл) или конволюты из-под лекарств.
6.5.3. Подготовка к биотестированию
Для биотестирования по показателю плодовитости желательно использовать синхонизированную (одновозрастную) культуру коловраток. Синхронизированную культуру можно получить двумя способами: 1) из покоящихся яиц и 2) из вегетирующей культуры коловраток.
Покоящиеся яйца помещают в микроаквариумы, заливают небольшим количеством дехлорированной (отстоявшейся) водопроводной воды и ставят под источник освещения (лампы дневного света ЛДЦ-40 или лампы накаливания). Оптимальные условия культивирования: рН = 6,5...7,5, температура воды 22 ± 2 °С. Через 2 - 3 сут происходит массовый выклев молоди. Полученных одновозрастных коловраток используют для опыта. Из вегетирующей культуры коловраток под микроскопом капиллярной пипеткой отбирают самок с амиктическими яйцами и помещают в чашку Петри. Через 1 - 2 ч отбирают пипеткой выклюнувшуюся молодь и используют ее для опыта.
Вегетирующую культуру, из которой получают молодь, готовят следующим образом. За 7 сут до эксперимента пересевают культуру коловраток на свежую среду и в дальнейшем культивируют ее в условиях оптимума (рН = 6,5...7,5, температура 22 ± 2 °С, естественное освещение без попадания прямых солнечных лучей). Пересев проводят под микроскопом. С помощью капиллярной пипетки отсаживают 10 - 20 особей в чашки Петри или стеклянные емкости вместимостью 0,2 - 0,5 л и добавляют суспензию зеленых микроводорослей.
Чтобы упростить отбор и процедуру отсаживания, коловраток концентрируют в поверхностном слое среды, освещая их культуру лампой в течение 15 мин.
6.5.4. Проведение биотестирования
Объем воды для биотестирования 50 - 100 мл.
Для биотестирования капиллярной пипеткой под микроскопом отсаживают по 10 экземпляров коловраток в микроаквариумы. Излишек попавшей с коловратками воды убирают с помощью фильтровальной бумаги. В опытные микроаквариумы добавляют 1 - 2 мл исследуемой воды, в контрольные добавляют дехлорированную водопроводную воду (К-1) и природную воду из чистого створа водоема (К-2). Каждую серию (опытную и контрольные) ставят в трех повторностях.
Микроаквариумы помещают в чашки Петри и оставляют в помещении при естественном освещении, избегая прямых солнечных лучей. Опыт ведут в нестерильных условиях. На 2-е сутки коловраток кормят, добавляя по капле суспензии протококковых водорослей.
6.5.5. Регистрация показателей выживаемости и плодовитости
Выживших особей и родившуюся молодь коловраток учитывают через 24, 48, 72 и 96 ч с помощью микроскопа при увеличении 2×12,5.
Наблюдения за выживаемостью проводят через 1, 3, 5 и 24 ч, а в последующие сутки - 2 - 3 раза в день. Показателем гибели коловраток является сохранение неподвижности после барботирования среды пузырьками воздуха с помощью капиллярной пипетки. Наблюдения за размножением коловраток проводят через 24, 48, 72 и 96 ч дважды в сутки. При наблюдении за размножением коловраток учитывают время наступления половозрелости (момент появления первого яйца), общую численность родившейся жизнеспособной молоди за время экспозиции и численность молоди в расчете на одну самку. Родившуюся молодь из микроаквариумов удаляют. Патология размножения проявляется в виде абортирования яиц, уродливой, мертворожденной и нежизнеспособной молоди. Данные о всех этих отклонениях суммируют с данными о фактической плодовитости (потенциальная плодовитость). Плодовитость определяет сохранность вида, в связи, с чем ей отводят решающую роль при оценке токсичности воды.
Данные наблюдений о выживаемости особей и родившейся молоди записывают в журнале по форме таблицы Т.1 из приложения Т.
6.5.6 Обработка результатов, расчеты и оценка токсичности воды
Оценку результатов биотестирования проводят по двум показателям: выживаемости и плодовитости.
Показатель выживаемости для испытываемой воды (опыта) и контроля рассчитывают по формуле
где X - выживаемость, %;
Nж - коловратки, выжившие в серии, экз.;
Nиcx - исходное число коловраток в серии.
Снижение выживаемости коловраток в опытной серии по сравнению с контролем рассчитывают по формуле
где А - снижение выживаемости коловраток, %;
Хк и Хо - выживаемость коловраток в контроле и в опыте соответственно, %.
Снижение выживаемости коловраток в опытной серии по сравнению с контролем на 25 % и более свидетельствует о наличии токсического действия испытуемой воды. Если снижение выживаемости в опытной серии меньше 25 %, то токсичность испытываемой воды оценивают с использованием показателя плодовитости коловраток по таблице 6.10.
Показатель плодовитости рассчитывают по формуле
где E - показатель плодовитости;
Nj - молодь, родившаяся за время экспозиции, экз.;
Nисх - исходное число коловраток.
Таблица 6.10 - Оценка токсичности воды при непрерывном биотестировании на коловратках
|
Снижение выживаемости, % контроля |
Отклонение плодовитости от контроля, % |
Оценка токсичности воды |
|
|
24 |
< 25 |
< 25 |
Не оказывает острое токсическое действие |
|
≥ 25 |
Оказывает острое токсическое действие |
||
|
≥ 25* |
< 25 ≥ 25 |
||
|
48 - 72 |
< 25 |
< 25 |
Не оказывает подострое токсическое действие |
|
≥ 25 |
Оказывает подострое токсическое действие |
||
|
≥ 25* |
< 25 ≥ 25 |
||
|
96 |
< 25 |
< 25 |
Не оказывает хроническое токсическое действие |
|
≥ 25 |
Оказывает хроническое токсическое действие |
||
|
≥ 25* |
< 25 ≥ 25 |
||
|
* Если снижение выживаемости составляет 25 % и более, то воду считают токсичной и показатель плодовитости не рассчитывают. |
|||
Отклонение показателя плодовитости рассчитывают по формуле
 (6.13)
(6.13)
где n - отклонение показателя плодовитости, %;
![]() и
и ![]() - суммарная
численность молоди в контрольной и опытной сериях соответственно, экз.;
- суммарная
численность молоди в контрольной и опытной сериях соответственно, экз.;
![]() и
и ![]() - суммарная
исходная численность коловраток в контрольной и опытной сериях соответственно,
экз.
- суммарная
исходная численность коловраток в контрольной и опытной сериях соответственно,
экз.
Поскольку исходное число особей во всех сериях одинаково, можно использовать упрощенную формулу
Отклонения показателя плодовитости могут быть положительными или отрицательными, поскольку токсическое действие может проявиться как в угнетении, так и в усилении функции размножения. Наличие токсического действия испытываемой воды устанавливают, если отклонение плодовитости в ту или иную сторону от контроля составляет 25 % и более.
Характер токсического действия (острое, подострое и хроническое) определяют по показателям выживаемости и плодовитости в зависимости от времени экспозиции.
Если вода оказывает острое токсическое действие, то устанавливают кратность разбавления, при которой устраняется острое токсическое действие. Для этого проводят биотестирование на серии разбавлений. Готовят следующие разбавления: в 2, 10, 50 и 100 раз.
Результаты биотестирования записывают по форме, приведенной в таблице Т.2 приложения Т.
6.5.7 Пример биотестирования на коловратках
Пробы воды отобраны в реке А. у города С. 25.09.92. Пробы воды оставим в лаборатории для выравнивания температуры в пробе и в среде с коловратками.
Для исследования одной пробы воды требуется девять микроаквариумов: три для опытной серии, три - для серии с контролем К-1 (природная вода из фонового участка водоема), три - для серии с контролем К-2 (водопроводная дехлорированная вода). На примере ведения одной серии опишем действия исполнителя.
Капиллярной пипеткой под микроскопом отсадим по 10 одновозрастных коловраток в три микроаквариума. С помощью фильтровальной бумаги уберем воду, попавшую вместе с коловратками. Затем в них внесем по 2 мл испытываемой воды. Микроаквариумы поместим в чашки Петри для предотвращения испарения воды.
Через 1, 3, 5, 24, 48, 82 и 96 ч подсчитаем число выживших коловраток и родившуюся молодь. Молодь сразу удалим. Данные наблюдения запишем по форме таблицы 6.11. Численность молоди в каждые последующие сроки наблюдений состоит из суммы родившихся в предыдущий срок наблюдений (удаленных) особей и особей, родившихся на данный момент наблюдений. Так, например, для экспозиции в 24 ч суммарная численность молоди в К-1 составила 18 экз. Эту молодь удалим. Для экспозиции в 48 ч, суммарная численность молоди равна 18 + 12 = 30 экз. (18 экз. родились за 24 ч и были удалены, 12 экз. родились за период между первым и вторым наблюдением).
Таблица 6.11 - Данные биотестирования природной воды на коловратках
|
Серия |
№ повторности |
Выжившие особи, экз. |
Молодь, экз. |
|||||||
|
Время экспозиции, ч |
||||||||||
|
24 |
48 |
72 |
96 |
24 |
48 |
72 |
96 |
|||
|
1 |
Контроль К-1 |
1 |
10 |
10 |
10 |
10 |
3 |
5 |
11 |
15 |
|
2 |
10 |
10 |
10 |
10 |
22 |
8 |
13 |
19 |
||
|
3 |
10 |
10 |
10 |
10 |
1 |
8 |
12 |
17 |
||
|
Сумма |
30 |
30 |
30 |
30 |
26 |
21 |
36 |
51 |
||
|
2 |
Контроль К-2 |
1 |
10 |
10 |
10 |
10 |
4 |
8 |
12 |
16 |
|
2 |
10 |
10 |
10 |
10 |
2 |
6 |
8 |
14 |
||
|
3 |
10 |
10 |
10 |
10 |
0 |
4 |
10 |
15 |
||
|
Сумма |
30 |
30 |
30 |
30 |
6 |
18 |
30 |
45 |
||
|
3 |
Опыт |
1 |
10 |
10 |
10 |
8 |
1 |
7 |
9 |
8 |
|
2 |
10 |
10 |
8 |
9 |
3 |
6 |
9 |
11 |
||
|
3 |
10 |
10 |
9 |
7 |
2 |
8 |
11 |
11 |
||
|
Сумма |
30 |
30 |
27 |
24 |
6 |
21 |
29 |
30 |
||
|
Примечание. Численность молоди в каждые последующие сроки наблюдения определяют, суммируя особей, родившихся в предыдущий срок наблюдений (отсаженных) и родившихся на момент наблюдений. |
||||||||||
Кормим коловраток со вторых суток, добавляя в каждый микроаквариум по капле суспензии микроводорослей.
Способ обработки данных наблюдений и оценки результатов биотестирования покажем на примере расчета данных за 96 ч наблюдений.
Рассчитаем показатель выживаемости в обоих контролях и в опыте по формуле 6.10. Для опыта выживаемость составила
х = (24/30)100 = 80 %.
В К-1 и К-2 выживаемость 100 %.
Данные запишем по форме таблицы 6.12.
Таблица 6.12 - Результаты биотестирования природной воды на коловратках
|
Водный объект, пункт, створ, дата отбора |
Серия |
Время экспозиции, ч |
Выживаемость, % исходного числа |
Снижение выживаемости, % контроля |
Плодовитость |
Отклонение показателя плодовитости от контроля, % |
Оценка токсичности воды |
|
|
1 |
- |
Контроль К-1 |
72 |
100 |
- |
1,7 |
- |
- |
|
2 |
Река А. выше города С., 18.07.92 (фоновый створ) |
Контроль К-2 |
72 |
100 |
0 |
1,6 |
-11,2 |
Не оказывает хронического токсического действия |
|
3 |
Река А. ниже города С., 18.07.92 |
Опыт |
72 |
80 |
20 |
1,0 |
-70 |
Оказывает хроническое токсическое действие |
Сравним показатели выживаемости в контролях. В обоих контролях коловратки не гибли, выживаемость составила 100 %. Следовательно, опытную серию можно сравнивать с любым контролем.
Рассчитаем снижение выживаемости в опытной серии по сравнению с контролем по формуле (6.11)
А = [(30 - 24)/30]100 = 20 %.
Данные запишем в таблицу результатов (см. таблицу 6.12). Снижение выживаемости коловраток в опытной серии менее 25 %, следовательно, по этому показателю испытываемая вода не оказывает токсического действия.
Для окончательной оценки характера токсического действия рассчитаем показатель плодовитости. Для этого рассчитаем суммарную из повторностей численность молоди, родившейся за время экспозиции. Для контроля К-1 численность молоди за 96 ч экспозиции составила 16 + 13 + 16 = 45 экз. Для К-2 она составила 51 экз., для опыта - 30 экз. Данные запишем по форме таблицы 6.11.
Рассчитаем плодовитость в опытной серии и в контроле по формуле (6.12).
Для контроля К-1 плодовитость равна
Е = 45/30 = 1,5,
Для К-2 значение Е = 1,7, для опыта Е = 1,0. Данные запишем по форме таблицы 6.12.
Сравним отклонение показателя плодовитости двух контролей по формуле (6.14). Для К-1 отклонение равно
n = [(45 - 51)/51]100 = -11,2 %.
Следовательно, по совокупности отклонений показателей выживаемости и плодовитости за 96 ч экспозиции, согласно критериям таблицы 6.10, вода фонового створа не оказывает хронического токсического действия.
Сравним отклонение показателя плодовитости опытной серии с контролем по формуле (6.14):
n = [(30 - 51)/30]100 = -70 %.
Запишем результат по форме таблицы 6.12.
Оценим токсичность испытываемой воды по полученным показателям снижения выживаемости, равного 20 %, и отклонения плодовитости, равного 70 %.
Используя таблицу 6.10, по времени экспозиции 96 ч и по показателям снижения выживаемости (20 % < 25 %) и отклонения плодовитости (70 % > 25 %) оценим токсичность испытываемой воды. В нашем случае вода оказывает хроническое токсическое действие. Таким образом, испытываемая вода токсична для коловраток и не соответствует установленным нормам качества вод.
6.6 Биотест на рыбах
6.6.1. Принцип метода
Метод основан на оценке влияния испытываемой воды, отобранной из водоемов и водотоков, на аквариумных рыб гуппи или данио. Влияние испытываемой воды оценивают по изменению показателей выживаемости рыб по сравнению с контролем.
Острое и хроническое токсическое действие испытываемой воды устанавливают в ходе одного опыта (непрерывное биотестирование) в зависимости от времени, в течение которого проявляется токсическое действие. Острое токсическое действие испытываемой воды устанавливают при кратковременном биотестировании (до 96 ч), хроническое - при длительном биотестировании (до 30 сут).
Показателем выживаемости служит среднее число рыб, выживших в течение определенного промежутка времени при биотестировании воды. Критерием токсичности испытываемой воды при кратковременном и длительном биотестировании является снижение выживаемости на 50 % и более по сравнению с контролем при условии, что в контроле выживаемость не менее 90 %.
6.6.2. Необходимые материалы, оборудование, реактивы
1. Аквариумные рыбы гуппи Poecilia reticulata Peters или данио Brachydanio rerio Hamilton-Buchanan. Источники получения, описание основных характеристик вида и условий содержания даны в приложениях Ф и X.
2. Аквариумы вместимостью 200, 50 и 10 л.
3. Микрокомпрессоры АЭН по ТУ 16-064.011.
4. Прибор для измерения содержания растворенного кислорода в воде типа БПК-тестер по ЕХ 2.841.004.ТО.
5. Сачки.
6. Корм для рыб.
6.6.3 Подготовка и проведение биотестирования
Для биотестирования необходим объем воды 20 л.
Для биотестирования используют гуппи в возрасте 1 - 3 недель или половозрелых данио (по РД 118-02-90).
Биотест ставят в трех сериях: одной опытной и двух контрольных. Для контрольных серий используют природную воды, отобранную из условно чистого (фонового) створа и отстоявшуюся водопроводную воду. При отсутствии фонового створа на данном водном объекте ставят только одну контрольную серию - на водопроводной воде.
Контроль на отстоявшейся водопроводной воде позволяет оценить качество тест-объекта, а контроль на природной условно чистой воде из фонового створа позволяет выявить источник токсического загрязнения испытываемой воды.
В аквариумы наливают по 10 л контрольной или испытываемой воды. Повторность двухкратная. В каждый аквариум помещают по 10 рыб.
Биотестирование проводят при освещении рассеянным светом с естественной сменой дня и ночи, концентрации кислорода в воде не менее 4 мг/л и температуре воды для гуппи 25 ± 1 °С, для данио 23 ± 1 °С. Воду в контрольных и опытных аквариумах меняют на свежеотобранную через 2 сут. При этом рыб быстро переносят с помощью сачка из одного аквариума в другой.
Через 1 ч от начала эксперимента, а затем ежесуточно в каждом аквариуме подсчитывают выживших рыб и удаляют погибших, измеряют содержание кислорода в воде. Погибшими считают рыб, не имеющих признаков движения или дыхания в течение 5 мин после прикосновения к ним стеклянной палочкой.
Для определения острого токсического действия воды биотестирование проводят в течение 96 ч. Если в любой учитываемый период времени снижение выживаемости рыб по сравнению с контролем составляет 50 % и более, биотестирование прекращают. В течение 96 ч рыб не кормят.
При отсутствии острого токсического действия испытываемой воды на рыб биотестирование продолжают до 30 сут для определения наличия хронического токсического действия воды. Выживших рыб подсчитывают ежесуточно. Если в любой учитываемый период времени в опытной серии снижение выживаемости рыб по сравнению с контролем составляет 50 % и более, биотестирование прекращают. В хроническом эксперименте рыб кормят ежедневно.
6.6.4 Обработка результатов, расчеты и оценка токсичности воды
При биотестировании в каждый учитываемый период времени регистрируют выживших рыб в каждом аквариуме. Затем рассчитывают среднее арифметическое для выживших рыб в контроле и опыте и далее снижение выживаемости рыб в опыте по сравнению с контролем по формуле
где А - снижение выживаемости рыб по сравнению с контролем, %;
![]() - среднее
арифметическое для рыб, выживших в контроле, экз.;
- среднее
арифметическое для рыб, выживших в контроле, экз.;
![]() - среднее
арифметическое для рыб, выживших в опыте, экз.
- среднее
арифметическое для рыб, выживших в опыте, экз.
Если при биотестировании длительностью до 96 ч снижение выживаемости рыб по сравнению с контролем равно или больше 50 %, то считают, что испытываемая вода оказывает токсическое действие. Если этот показатель меньше 50 %, то считают, что испытываемая вода не оказывает острого токсического действия на рыб. Во втором случае биотестирование продолжают для определения хронического токсического действия.
Если обнаружено острое токсическое действие испытываемой воды, то устанавливают кратность разбавления, при котором оно устраняется. Для этого испытываемую воду разбавляют в 2, 10, 50 и 100 раз и проводят биотестирование на данной серии разбавлений. Полученные результаты используют для оценки токсикологического состояния водных экосистем (см. п. 10).
Вывод о наличии хронического токсического действия испытываемой воды на рыб делают, если в любой период времени от 5 до 30 сут снижение выживаемости рыб по сравнению с контролем равно или больше 50 %. В противном случае делают заключение об отсутствии хронического токсического действия испытываемой воды.
Результаты биотестирования учитывают при условии, что в контроле выживаемость рыб не меньше 90 % и концентрация кислорода в воде не ниже 4 мг/л.
Результаты биотестирования записывают по форме, приведенной в приложении Ц.
6.6.5 Пример биотестирования на рыбах
Для установления токсического действия воды, отобранной на реке Б. ниже города А., с использованием показателей выживаемости рыб гуппи, ставим три серии биотеста - две контрольные и одну опытную. Каждую серию ставим в двух повторностях. В качестве контроля К-1 используем отстоявшуюся водопроводную воду, в качестве контроля К-2 - условно чистую природную воду из фонового створа реки.
Перед помещением рыб в аквариумы в каждой серии измеряем концентрацию кислорода. Если она меньше 4 мг/л, то воду аэрируем.
Через 1, 24, 48, 72 и 96 ч подсчитаем выживших рыб в каждом аквариуме и измеряем содержание кислорода. Полученные данные запишем по форме таблицы 6.13.
Далее за каждый учитываемый промежуток времени в каждой серии эксперимента рассчитаем среднее арифметическое для выживших рыб, выживаемость по сравнению с исходным числом рыб и снижение выживаемости по сравнению с контролем по формулам (6.10), (6.15) и (8.1).
Например, через 72 ч в контроле К-2 в одной из повторностей выжило 10 рыб, в другой - 9, среднее арифметическое равно (10 + 9)/2 = 9,5, а выживаемость - 100(9,5/10) = 95 %. В этот же период времени в опыте выжило в среднем (6 + 7)/2 = 6,5 рыб, выживаемость по отношению к исходному числу рыб составила (6,5/10)100 = 65 %. Снижение выживаемости рыб по сравнению с контролем К-2 равно
А = 100[(9,5 - 6,5)/9,5] = 32 %.
Полученное снижение выживаемости меньше 50 %. Следовательно, биотестирование следует продолжать.
Через 96 ч в опытной серии выживаемость рыб по отношению к исходному числу составила 55 %. В контроле К-1 она составила 100 %, в контроле К-2 95 %.
Таблица 6.13 - Результаты биотестирования с использованием показателя выживаемости рыб гуппи
|
Водный объект, пункт, створ, дата отбора |
Серия |
Время от начала биотестирования, ч |
Выжившие рыбы, экз. |
Выживаемость рыб, % |
Снижение выживаемости, % контроля |
Коцентрация кислорода, мг/л |
Оценка токсичности воды |
|||
|
Повторность |
Среднее арифметическое |
|||||||||
|
1 |
2 |
|||||||||
|
1 |
- |
Контроль К-1 |
1 |
10 |
10 |
10 |
0 |
8,2 |
||
|
24 |
10 |
10 |
10 |
0 |
8,1 |
|||||
|
48 |
10 |
10 |
10 |
0 |
8,4 |
|||||
|
72 |
10 |
10 |
10 |
0 |
8,1 |
|||||
|
96 |
10 |
10 |
10 |
0 |
8,3 |
|||||
|
2 |
Река Б. выше города А., 18.07.92 |
Контроль К-2 |
1 |
10 |
10 |
10 |
0 |
6,4 |
||
|
24 |
10 |
10 |
10 |
0 |
6,6 |
|||||
|
48 |
10 |
10 |
10 |
0 |
6,5 |
|||||
|
72 |
9 |
10 |
9,5 |
5 |
6,4 |
|||||
|
96 |
9 |
10 |
9,5 |
5 |
6,6 |
|||||
|
3 |
Река Б. ниже города А., 18.07.92 |
Опыт |
1 |
10 |
10 |
10 |
0 |
0 |
5,8 |
Оказывает острое токсическое действие |
|
24 |
9 |
10 |
9,5 |
5 |
5 |
5,9 |
||||
|
48 |
7 |
8 |
7,6 |
75 |
25 |
5,3 |
||||
|
72 |
6 |
7 |
6,5 |
65 |
32 |
5,4 |
||||
|
96 |
5 |
4 |
4,5 |
45 |
53 |
5,6 |
||||
Рассчитаем снижение выживаемости рыб в опытной серии по сравнению с контролем. В качестве контроля для сравнения в данном случае используем природную воду из фонового створа К-2:
А = [(9,5 - 4,5)/9,5]100 = 53 %.
Снижение выживаемости рыб в опыте по сравнению с контролем превышает 50 %, при этом выживаемость рыб в контроле К-2 равна 95 %, концентрация кислорода в опытной серии выше 4 мг/л, поэтому делаем вывод о том, что испытываемая вода оказывает острое токсическое действие на рыб гуппи. Таким образом, качество испытываемой воды не соответствует установленной норме по токсикологическим показателям.
Учитывая, что в контрольной серии, поставленной на природной воде из фонового створа, выживаемость гуппи выше 90 %, можно заключить, что острую токсичность испытываемая вода приобретает в результате влияния городских сточных вод.
Поскольку обнаружена острая токсичность испытываемой воды, необходимо найти кратность разбавления, при которой острая токсичность устраняется. Для этого испытываемую воду разбавляем водой из фонового створа в 2, 10, 50 и 100 раз и ставим заново биотесты на этой серии разбавлений. В качестве контроля используем природную воду из фонового створа.
Данные биотестирования показали, что уже при разбавлении испытываемой воды в 2 раза острая токсичность устраняется. Используя критерии качества из раздела 10, заключаем, что токсикологическое состояние экосистемы не данном участке реки крайне неблагополучное.
7 БИОТЕСТИРОВАНИЕ В ОПЕРАТИВНЫХ РАБОТАХ ПО ОЦЕНКЕ КАЧЕСТВА ПОВЕРХНОСТНЫХ ВОД
Биотестирование при решении оперативных задач (при авариях, залповых сбросах, случаях ЭВЗ) проводят, чтобы установить острое токсическое действие, а также выявить чрезвычайные экологические ситуации и зоны экологического бедствия1.
_____________
1 Степень экологического неблагополучия, соответствующая чрезвычайным экологическим ситуациям и экологическому бедствию, определена статьями 68 и 69 Закона об охране окружающей среды РФ.
Для оперативных работ рекомендуются методы экспрессного биотестирования на ракообразных, инфузориях, коловратках, A-Z-Ph-тест на водорослях, а также биотесты на природных популяциях гидробионтов. Эти методы ориентированы главным образом на выявление острого токсического действия, обусловленного высоким уровнем загрязненности или присутствием опасных токсических химических соединений.
При обнаружении острого токсического действия воды на гидробионтов биотестирование проводят, чтобы определить кратность разбавления, при котором острое токсическое действие не проявляется.
При загрязнении химическими соединениями с мутагенным эффектом можно использовать биотесты, позволяющие оценить токсико-генетическое действие, например, Методические указания, приведенные в п. 2 (авторы В.В. Павленко, Т.А. Зимина, Л.Я. Трубачеева).
7.1 Биотесты на ракообразных
Биотестирование проводят на дафниях и цериодафниях. Предпочтение следует отдать кратковременному биотестированию на цериодафниях, так как этот биотест проводят в течение 48 ч.
Методический подход к установлению токсичности такой же, как в режимных наблюдениях (см. п. 6) проверка соответствия качества воды установленным нормам.
Степень токсичности воды для дафний можно оценить не только по показателю выживаемости, но и по различным показателям физического состояния, пользуясь 5-балльной шкалой Л.А. Лесникова, опубликованной в Методических указаниях по использованию биотестов для определения предзаморного состояния в карповых прудах (см. п. 2). Согласно этому подходу, учитывают в основном поведение рачков, степень наполнения кишечника, структуру и окраску его содержимого, окраску тела и количество жира, состояние покровов тела. Оценку в баллах дают, исходя из следующих критериев:
1 балл - хорошее состояние рачков (рачки активны, окраска тела желтая, капель жира много, кишечник наполнен полностью или слабо в передней части, окраска содержимого зеленовато- оливковая или зеленовато-охристая);
2 балла - слабые изменения (рачки активны, окраска тела желтоватая, капли жира мелкие, кишечник заполнен, содержимое его частично может быть рыхлым). Это - реакция дафний, связанная с легкими повреждениями, не угрожающими гибелью;
3 балла - средние изменения (окраска бледно-желтая или диффузно-розовая, капель жира мало и они мелкие, кишечник заполнен менее чем наполовину или все содержимое просвечивает). Это - реакция дафний, связанная с повреждениями или нарушениями средней тяжести;
4 балла - сильные изменения (окраска тела бледная, «стеклянная» или мутная, капель жира нет, содержимое кишечника прозрачное, кишечник наполнен очень слабо и только в задней части). Это - реакция рачков, связанная с повреждениями, угрожающими жизни;
5 баллов - гибель рачков (симптомы, свидетельствующие о скорой гибели: засорен фильтрующий аппарат, хлопья или обрастания на антеннах и каудальной игле, судорожное дрожание антенн, замедление движения грудных ножек, обездвиживание, паралич).
Суммарную оценку состояния дафний делают путем расчета коэффициента т по формуле
τ = Σ[jni/(ΣtN)], (7.1)
где N - общее число организмов, участвующих в опыте;
j - номер (балл) выявленной оценки;
Σt - время проявления реакций;
ni - число организмов, у которых отмечена реакция, соответствующая выявленной оценке.
Чем хуже состояние дафний, тем выше балл и тем больше τ. Если при экспозиции 72 ч значение τ > 1, то это свидетельствует об ухудшении качества воды водного объекта и вероятности возникновения заморной ситуации. При τ < 1 качество воды считают удовлетворительным.
7.2 A-Z-Ph-тест на водорослях
7.2.1 Принцип методики
Методика основана на определении кислородно-скляночным методом изменений интенсивности фотосинтеза и продукционно-деструкционных процессов лабораторной культуры зеленых протококковых водорослей под влиянием испытываемой воды по сравнению с контролем.
Анализируют два показателя: интенсивность фотосинтеза и отношение валовой продукции к деструкции.
Критерием токсичности является снижение интенсивности фотосинтеза лабораторной культуры в испытываемой воде по сравнению с контролем. Возможно увеличение интенсивности фотосинтеза под влиянием испытываемой воды, что указывает на присутствие в ней загрязняющих веществ, оказывающих стимулирующее воздействие на водоросли.
Показатель отношения валовой продукции к деструкции используют для характеристики экологического состояния водного объекта, связанного с уровнем органического загрязнения воды.
Продолжительность биотеста - 1 сут.
7.2.2. Необходимые материалы, оборудование, реактивы
1 Культура Scenedesmus quadricauda (Turp) Breb. или Chlorella vulgaris Beijer. Источники получения культуры, описание основных характеристик вида и условий культивирования даны в приложениях Е и Ж.
2 Весы аналитические типа ВЛР-200 по ТУ 25-06-1131 или весы другого типа, равноценные по точности.
3 Батометр ГР-15М по ТУ 25-04-1750.
4 Люминостат с освещенностью до 3 - 5 тыс. л (лампа дневного света ДС-30 или ДС-40).
5 БПК-тестер для измерения содержания растворенного кислорода по ЕХ 2.841.004.ТО.
6 Колбы конические вместимостью 0,5 - 1,0 л по ГОСТ 10394.
7 Емкость для отстаивания воды.
8 Воронки конические по ГОСТ 8613 диаметром 6 см.
9 Кислородные склянки с притертыми пробками, объемом 100 - 150 мл.
10 Резиновые трубки со стеклянными наконечниками (сифоны).
11 Пипетки вместимостью 10 мл по ГОСТ 20292.
12 Набор оборудования и реактивов для определения содержания растворенного кислорода методом Винклера по Руководству по химическому анализу поверхностных вод суши (см. п. 2).
13 Набор реактивов для культивирования водорослей (приложение Ж).
14 Мельничный газ № 70.
7.2.3 Подготовка к биотестированию
Для биотестирования необходимо 1,5 - 2,0 л воды.
Для биотестирования берут 5 - 7-суточную культуру водорослей. Плотность посевного материала 1 - 3 млн. кл/мл (культура должна быть темно-зеленого цвета). Чувствительность подорослей определяют по п. 6.3.3.
7.2.4 Проведение биотестирования и регистрация показателей
Воду для испытаний наливают в четыре серии кислородных склянок (в двух повторностях каждая, т.е. всего восемь склянок) при помощи сифона. В три серии склянок вносят 1 - 2 мл культуры водорослей, в четвертую серию культуру водорослей не вносят. Все склянки плотно закрывают притертыми пробками.
Для испытываемой воды (опыт) и воды условно чистого участка (контроль) ставят по четыре серии склянок.
Первую серию склянок без культуры водорослей ставят в люминостат (светлые склянки - серия Ос).
Вторую серию склянок с добавленной культурой водорослей также ставят в люминостат (светлые склянки с водорослями - Ос.в).
Третью серию склянок с добавленной культурой водорослей ставят в темное место (темные склянки с водорослями - От.в).
Четвертую серию склянок сразу фиксируют и определяют в них исходное содержание растворенного кислорода - (серия Он.в).
Все серии должны находиться в одинаковых температурных условиях.
Аналогичным способом анализируют контроль - воду из условного чистого участка (фонового створа).
Первую серию
склянок (без водорослей) ставят в люминостат - ![]()
Вторую серию
склянок (с водорослями) ставят в люминостат - ![]()
Третью серию
(с водорослями) ставят в темное место ![]()
Четвертую
серию сразу фиксируют и определяют исходное содержание растворенного кислорода ![]()
При отсутствии люминостата склянки «н.в» с испытываемой и контрольной водой можно оставлять на сутки при естественном освещении.
Время экспозиции 24 ч.
Через 24 ч во всех склянках определяют содержание растворенного кислорода методом Винклера или электрохимическим методом, используя Руководство по химическому анализу поверхностных вод суши (см. п. 2).
7.2.5 Обработка результатов, расчеты и оценка токсичности воды
После определения содержания кислорода в опытных и контрольных склянках рассчитывают следующие показатели: интенсивность фотосинтеза, валовую первичную продукцию и деструкцию органического вещества, отношение валовой продукции к деструкции.
Изменение интенсивности фотосинтеза водорослей после экспозиции в течение 24 ч на свету рассчитывают по формуле
где ΔИФ - изменение интенсивности фотосинтеза в испытываемой воде по сравнению с контролем, %;
Ос.в - концентрация молекулярного кислорода в склянках с испытываемой водой с водорослями, мг/л;
Ос - концентрация молекулярного кислорода в склянках с испытываемой водой без водорослей, мг/л;
![]() -
концентрация молекулярного кислорода в склянках с контрольной водой без
водорослей, мг/л;
-
концентрация молекулярного кислорода в склянках с контрольной водой без
водорослей, мг/л;
![]() -
концентрация молекулярного кислорода в склянках с контрольной водой с
водорослями, мг/л.
-
концентрация молекулярного кислорода в склянках с контрольной водой с
водорослями, мг/л.
Валовую первичную продукцию и деструкцию органического вещества рассчитывают по формулам:
где Ф - валовая первичная продукция, мг/л молекулярного кислорода;
Д - деструкция, мг/л молекулярного кислорода;
Ос.в - концентрация кислорода в склянках с водорослями после 24-часовой экспозиции на свету, мг/л;
От.в - концентрация кислорода в склянках с водорослями после 24-часовой экспозиции в темноте, мг/л;
Он.в - исходная концентрация кислорода в склянках с водорослями, мг/л.
О токсичности воды судят по показателям интенсивности фотосинтеза (ΔИФ). Значимой считают величину ΔИФ, превышающую 25 %. Отрицательные значения ΔИФ указывают на токсичность воды для водорослей. Положительные значения ΔИФ свидетельствуют о стимулирующем эффекте воды по отношению к водорослям. Этот эффект чаще всего обусловлен наличием в воде соединений биогенных элементов.
По соотношению первичной продукции и деструкции в тесте можно приблизительно судить об интенсивности продукционно-деструкционных процессов в экосистеме водного объекта. Если Ф/Д > 1, то это указывает на преобладание продукционных процессов. Если Ф/Д < 1, то это указывает на преобладание деструкционных процессов (экологическое неблагополучие).
По данным Методических указаний по использованию биотестов для определения предзаморного состояния в карповых прудах, если Ф/Д < 1, то концентрация органических веществ в воде по показателю ХПК больше 70 мг/л молекулярного кислорода. Таким образом, показатель Ф/Д можно использовать для косвенной оценки содержания органических веществ в воде.
Результаты биотестирования записывают по форме, приведенной в приложении К.
7.2.6 Примеры биотестирования на водорослях с помощью A-Z-Ph-теста
Пример 1. При биотестировании воды, отобранной выше и ниже города А. на реке С.Д., получены данные по A-Z-Ph-тесту (таблица 7.1). Вода, отобранная выше города А., является условно чистой и служит контролем по отношению к пробам воды, отобранным ниже города А.
Пробы воды из различных участков реки С.Д. фильтруем и разливаем в восемь склянок (четыре серии): восемь склянок для проб воды, отобранных выше города А., и восемь склянок для проб, отобранных ниже города А.
Для каждой пробы воды в одной из серии склянок изменим исходное содержание кислорода. Во всех других сериях содержание кислорода измерим через 24 ч. После этого найдем разницу между содержанием кислорода в светлых склянках с водорослями и без них для проб воды, отобранных выше и ниже города А. Для пробы воды, отобранной выше города А., эта разница равна 5,8 мг/л.
Таблица 7.1 - Результаты биотестирования на водорослях с помощью A-Z-Ph-тест
|
Водный объект, пункт, створ, дата отбора |
Серия |
Концентрация кислорода, мг/л |
Ф мг/л О2 |
Д мг/л О2 |
Ф/Д |
Оценка токсичности воды |
||||||
|
Он.в* |
Ос.в |
От.в |
Ос |
Ос.в - Ос |
ΔИФ % |
|||||||
|
1 |
Река С.Д. выше города А. |
Контроль |
9,5 |
16,0 |
7,6 |
10,2 |
5,8 |
8,5 |
2 |
4,2 |
||
|
2 |
Река С.Д. ниже города А. |
Опыт |
9,2 |
17,6 |
7,4 |
11,3 |
6,3 |
8,6 |
10,2 |
1,8 |
5,7 |
Не оказывает токсического действия |
|
3 |
Река С.Д. выше города Б. |
Контроль |
8,0 |
16,4 |
7,0 |
11,1 |
5,3 |
9,4 |
1 |
9,4 |
||
|
4 |
Река С.Д. ниже города Б. |
Опыт |
7,8 |
15,1 |
7,2 |
12,4 |
2,7 |
-49 |
7,9 |
0,6 |
13 |
Оказывает токсическое действие |
По формуле (7.2) рассчитаем изменение интенсивности фотосинтеза для пробы воды, отобранной ниже города А.:
ΔИФ = [(6,3 - 5,8)/5,8]100 = 8,6 %.
Рассчитаем по формуле валовую продукцию в пробе воды, отобранной ниже города А.:
Ф = 17,6 - 7,4 = 10,2 мг/л О2.
По формуле (7.2) рассчитаем деструкцию
Д = 9,2 - 7,4 = 1,8 мг/л О2.
Отношение валовой продукции к деструкции составило
Ф/Д = 10,2/1,8 = 5,7.
Для пробы, отобранной выше города А., валовая продукция, деструкция и отношение продукции к деструкции равны:
Ф = 8,5 мг/л О2,
Д = 2,0 мг/л О2,
Ф/Д = 4,3.
Изменение интенсивности фотосинтеза в пробе воды, отобранной ниже города А., незначительно. Оно составило 8,6 %, это меньше 25 %, поэтому следует сделать вывод о том, что вода не оказывает токсического действия на водоросли. В пробах воды, отобранных выше и ниже города А., значение Ф/Д > 1. Это свидетельствует о том, что продукционные процессы преобладают над деструкционными, т.е. экологическое состояние данного участка реки является благополучным.
Пример 2. При биотестировании воды, отобранной выше и ниже города Б. на реке С.Д., получены данные по A-Z-Ph-тесту (см. таблицу 7.1). Вода, отобранная выше города Б., является условно чистой и служит контролем по отношению к пробам воды, отобранным ниже города Б.
Аналогично тому, как указано в примере 1, обработаем пробы, отобранные выше и ниже города Б.
Рассчитаем разницу между содержанием кислорода в светлых склянках с водорослями и без них. Для пробы воды, отобранной ниже города Б., эта разница равна 2,7 мг/л, а для пробы воды, отобранной выше города Б., она равна 5,3 мг/л.
По формуле (7.2) рассчитаем изменение интенсивности фотосинтеза для пробы, отобранной ниже города Б.:
ΔИФ = [(2,7 - 5,3)/5,3]100 = -49 %.
Рассчитаем по формуле (7.3) валовую продукцию для пробы воды, отобранной ниже города Б.:
Ф = 15,1 - 7,2 = 7,9 мг/л О2.
По формуле (7.4) рассчитаем деструкцию
Д = 7,8 - 7,2 = 0,6 мг/л О2.
Отношение продукции к деструкции
Ф/Д = 7,8/0,6 = 13.
Показатель ΔИФ = -49 %, указывает на то, что испытываемая вода токсична для водорослей. Это свидетельствует о крайне неблагоприятных условиях для существования гидробионтов на участке реки ниже города Б. По методическим указаниям по использованию биотестов для определения предзаморного состояния в карповых прудах, при такой ситуации существует опасность возникновения заморных явлений в рыборазводных прудах в ближайшее время. Значение Ф/Д > 1 свидетельствует о преобладании продукционных процессов над деструкционными.
7.3 Экспресс-биотест на парамециях
7.3.1 Принцип метода
Метод основан на оценке влияния испытываемой воды, отобранной из водоемов и водотоков, на выживаемость массовой культуры парамеций. Влияние испытываемой воды (острое токсическое действие) оценивают по изменению показателя выживаемости при экспозиции в испытываемой воде. Показателем выживаемости служит среднее число парамеций, выживших в испытываемой воде за время опыта.
Критерием токсичности является снижение выживаемости парамеций на 50 % и более в испытываемой воде по сравнению с контролем. Выживаемость в контроле при этом должна быть не менее 90 % .Продолжительность биотестирования 5 ч.
7.3.2 Необходимые материалы, оборудование, реактивы
Список аналогичен списку, приведенному в п. 6.4.2. Дополнительно требуются часовые стекла или микроаквариумы. В качестве последних используют обрезанные флаконы из-под антибиотиков вместимостью примерно 2 мл для проведения биотестирования.
7.3.3 Подготовка к биотестированию
Подготовку к биотестированию проводят согласно п. 6.4.3.
7.3.4 Проведение биотестирования
Объем воды для биотестирования 20 мл.
Парамеций помещают в микроаквариумы для биотестирования следующим образом. Капиллярной пипеткой берут из исходной культуры парамеций (приложение Л) 1 - 2 капли взвеси и помещают в пустые микроаквариумы. Воду, попавшую вместе с парамециями, убирают с помощью фильтровальной бумаги. Затем доливают 0,5 мл испытываемой воды.
Микроаквариумы помещают в чашки Петри для предотвращения испарения. Отсаженных особей экспонируют в оптимальных условиях (приложение М). Каждую серию ставят в трех повторностях. В каждом микроаквариуме подсчитывают парамеций. Общее число парамеций должно быть не менее 100.
В течение опыта парамеций не кормят.
7.3.5 Регистрация показателя выживаемости
Учитывают выживших особей в массовой культуре с помощью микроскопа (увеличение 2×14) через 1, 3 и 5 ч.
На гибель указывает деформация тела парамеций, разрыв пелликулы, лизис клетки, а также сохранение неподвижности особей после барботирования среды воздухом из капиллярной пипетки.
Данные биотестирования регистрируют в журнале по форме таблицы П.1 приложения П.
7.3.6 Обработка результатов, расчеты и оценка токсичности воды
Результаты оценивают по снижению выживаемости парамеций в испытываемой воде по сравнению с контролем.
Первоначально рассчитывают показатель выживаемости в опытной и контрольных сериях по формуле
где X - выживаемость парамеций, %;
![]() - живые
особи (средняя из повторностей), оставшиеся в серии через время t, экз.;
- живые
особи (средняя из повторностей), оставшиеся в серии через время t, экз.;
![]() - исходное
число особей в серии (средняя из повторностей).
- исходное
число особей в серии (средняя из повторностей).
Если выживаемость в контроле К-1 менее 50 %, то данные опыта могут быть некорректными, и для тестирования необходимо взять другую культуру парамеций.
Если выживаемость в К-2 менее 50 %, то вода в фоновом створе токсична, и ее нельзя брать для сравнения с данными в испытываемой воде (опыте).
Снижение показателя выживаемости в опыте по сравнению с контролем рассчитывают по формуле:
где А - снижение выживаемости парамеций по сравнению с контролем, %;
![]() и
и ![]() - среднее
число живых особей в контроле и в опыте соответственно.
- среднее
число живых особей в контроле и в опыте соответственно.
При снижении выживаемости парамеций в опыте по сравнению с контролем на 50 % и более за любой промежуток времени (1, 3, 5 ч) считают, что испытываемая вода оказывает острое токсическое действие. Если снижение выживаемости парамеций в испытываемой воде по сравнению с контролем через 5 ч меньше 50 %, то биотест ставят заново согласно п. 7.3.4.
Результаты биотестирования записывают по форме таблицы П.2 приложение П.
7.3.7 Пример экспресс-биотеста на парамециях
В лабораторию доставлены две пробы воды из створов 3 и 5 водоема А. в связи с сообщениями населения о высокой загрязненности воды. Емкости с водой оставим в лаборатории для уравнивания температуры проб воды и среды с парамециями.
Для определения возможного острого токсического действия исследуемой воды проводим экспрессное биотестирование на массовой культуре парамеций.
Для проведения опыта капиллярной пипеткой берем по капле исходной культуры парамеций и помещаем в микроаквариумы. Попавшую с парамециями воду убираем с помощью фильтровальной бумаги. Добавим по 0,5 мл испытываемой воды в опытные микроаквариумы, по 0,5 мл природной воды из фонового участка водоема для контроля К-2 и по 0,5 мл дехлорированной водопроводной воды для контроля К-1. Опытные и контрольные серии ставим в трех повторностях. После добавления воды определим исходную численность парамеций в каждом микроаквариуме и запишем данные по форме таблицы 7.2.
Через 1, 3 и 5 ч просмотрим пробы и запишем число выживших особей за соответствующий промежуток времени по форме таблицы 7.2.
Первоначально рассчитаем среднюю численность парамеций из повторностей для экспозиции в течение 5 ч. Так, например, для К-2 средняя численность равна
(39 + 43 + 41):3 = 41 экз.
Такие расчеты проведем для всех серий. Полученные данные запишем по форме таблицы 7.2.
Таблица 7.2 - Данные экспресс-биотеста на парамециях
|
Серия |
Повторности |
Исходная численность парамеций, экз. |
Число выживших парамеций через |
|||
|
1 ч |
3 ч |
6 ч |
||||
|
1 |
Контроль К-1 |
1 |
43 |
43 |
43 |
43 |
|
2 |
38 |
38 |
38 |
38 |
||
|
3 |
42 |
42 |
42 |
42 |
||
|
Среднее |
41 |
41 |
41 |
41 |
||
|
2 |
Контроль К-2 |
1 |
39 |
39 |
39 |
37 |
|
2 |
43 |
43 |
43 |
41 |
||
|
3 |
41 |
41 |
41 |
39 |
||
|
Среднее |
41 |
41 |
41 |
39 |
||
|
3 |
Опыт (створ 3) |
1 |
40 |
33 |
27 |
19 |
|
2 |
38 |
32 |
24 |
19 |
||
|
3 |
42 |
37 |
33 |
16 |
||
|
Среднее |
40 |
34 |
28 |
18 |
||
|
4 |
Опыт (створ 5) |
1 |
42 |
42 |
42 |
40 |
|
2 |
39 |
39 |
39 |
38 |
||
|
3 |
42 |
42 |
42 |
39 |
||
|
Среднее |
41 |
41 |
41 |
39 |
||
На основании полученного среднего числа выживших парамеций, рассчитаем показатель выживаемости по формуле (7.5) К-2 он составил:
А = (39/41)100 = 95,5 %.
Такие расчеты проведем для каждой серий. Полученные данные запишем по форме таблицы 7.6. В контроле К-1 выживаемость составила 100 %, что говорит об удовлетворительном состоянии популяций парамеций. В контроле К-2 выживаемость составила 95,2 %. Это свидетельствует об отсутствии острого токсического действия воды фонового створа водоема.
Таблица 7.3 - Результаты экспрессного биотестирования природной воды на парамециях
|
№ пробы |
Водный объект, пункт, дата отбора |
Серия |
Время экспозиции, ч |
Выживаемость, % исходного числа |
Снижение выживаемости контролем, % |
Оценка токсичности воды |
|
1 |
Водопроводная вода |
Контроль К-1 |
5 |
- |
- |
- |
|
2 |
Фоновый створ, 11.09.92 |
Контроль К-2 |
5 |
95,1 |
4,9 |
Не оказывает острого токсического действия |
|
3 |
Водный объект А у города С., створ 3, 11.09.92 |
Опыт |
5 |
45,0 |
56,0 |
Оказывает острое токсическое действие |
|
4 |
Водный объект А. у города С., створ 5, 11.09.92 |
Опыт |
5 |
96,1 |
4,9 |
Не оказывает острого токсического действия |
Оценим токсичность воды створов 3 и 5. Для этого рассчитаем снижение показателя выживаемости в опыте по сравнению с контролем по формуле (7.6). В створе 3 снижение выживаемости парамеций составило 56,0 % > 50 %, что свидетельствует об остром токсическом действии воды (не соответствует нормам качества вод).
В створе 5 снижение выживаемости парамеций составило 4,9 % < 50 %. Это свидетельствует об отсутствии острого токсического действия воды створа 5. Для проверки соответствия испытываемой воды из створа 5 установленным нормам по токсичности следует поставить новые серии опыта для определения наличия хронического токсического действия.
7.4 Экспресс-биотест на коловратках
7.4.1 Принцип метода
Метод основан на оценке влияния испытываемой воды, отобранной из водоемов и водотоков, на функцию питания лабораторной культуры коловраток. Влияние испытываемой воды оценивают по изменению показателя скорости осветления среды с микроводорослями из-за действия коловраток при экспозиции в испытываемой воде по сравнению с контролем.
Показатель скорости осветления среды (СОС) - это объем среды, который одна коловратка осветляет, потребляя микроводоросли, в единицу времени. В ходе опыта устанавливают острое токсическое действие испытываемой воды.
Критерием токсичности является отклонение показателя СОС коловратками на 50 % и более по сравнению с контролем.
Длительность биотестирования - 30 мин.
7.4.2 Необходимые материалы, оборудование, реактивы
1 Культура коловраток Brachionus calyc florus Pallas. Источники получения культуры, описание основных характеристик вида, условий культивирования и содержания даны в приложениях С и Р.
2 Культура одноклеточных протококковых водорослей родов Chlorella и Scenedesmus. Источники получения, культивирование и содержание даны в приложениях Е и Ж.
3 Микроскоп стереоскопический МБС-9 по ГОСТ 8074-82.
4 Микроскоп (Виолам, МБИ).
5 Камера Горяева по ТУ 64-1-816-7.
6 Емкости вместимостью 0,2 - 0,5 л.
7 Чашки Петри по ГОСТ 10973-75.
8 Микроаквариумы (обрезанные флаконы из-под антибиотиков объемом 2 мл).
9 Пипетки капиллярные (обрезанные с обеих сторон пастеровские пипетки) или глазные пипетки с оттянутым носиком.
10 Секундомер механический типа СОП пр-203 по ГОСТ 5072.
11 Центрифуга типа ЦЛН-2.
7.4.3 Подготовка и проведение биотестирования
Коловраток готовят к опыту по п. 6.5.3.
Объем пробы воды для биотестирования 50 мл.
Для расчета показателя СОС считают клетки микроводорослей, поглощенных коловратками.
Под микроскопом с помощью капиллярной пипетки отсаживают в микроаквариумы по 10 коловраток. Избыток попавшей с коловратками воды убирают с помощью фильтровальной бумаги. В опытные микроаквариумы добавляют 1,0 мл испытываемой воды. В контроль К-1 добавляют дехлорированную водопроводную воду, в К-2 - природную воду из фонового створа водоема. Каждую серию ставят в двух повторностях.
В каждый микроаквариум вносят 0,5 мл суспензии микроводорослей. Для удобства подсчета микроводорослей их вносят в каждый микроаквариум через период времени порядка 10 мин. Концентрация вносимой хлореллы должна быть не ниже 2 млн.кл./мл. Если плотность микроводорослей низка, то их концентрируют с помощью центрифуги ЦЛН-2.
Микроаквариумы помещают в чашки Петри и накрывают листом темной бумаги, чтобы предотвратить фотосинтез микроводорослей.
7.4.4 Регистрация численности микроводорослей
Для расчета показателя СОС учитывают число клеток микроводорослей непосредственно после внесения их в микроаквариумы с коловратками и по истечении 30 мин.
Микроводоросли учитывают с помощью камеры Горяева, просчитывая 10 больших квадратов (увеличение 20×10). Подсчет ведут в трех пробах из каждого микроаквариума.
Внесение микроводорослей через период времени порядка 10 мин обеспечивает удобство подсчета их в камере Горяева. При определенном навыке разрыв в подсчете повторностей составляет 0,5 - 1,0 мин.
Данные биотестирования (число клеток микроводорослей в начале и в конце опыта, время начала и окончания опыта) регистрируют в журнале по форме таблицы У.2 приложения У.
7.4.5 Обработка результатов, расчеты и оценка токсичности воды
Токсичность испытываемой воды оценивают по изменению величины отклонения скорости осветления среды от контроля. Для этого вначале рассчитывают показатель СОС в каждой серии опыта:
СОС = [(С0 - Сt)/(С0Nt)]V, (7.7)
где СОС - показатель скорости осветления среды, мкл/(экз. ∙ мин);
С0 и Сt - число клеток водорослей в одном большом квадрате камеры Горяева в начале и в конце опыта соответственно;
N - число коловраток в микроаквариуме;
t - время опыта, мин;
V - объем воды в микроаквариуме, мкл.
Поскольку при биотестировании объем среды, в котором находятся коловратки (1500 мкл), число коловраток (10 экз.) и время опыта (30 мин) одинаковы во всех сериях, то для сравнения с контролем можно использовать упрощенную формулу:
СОС = (С0 - Сt)/С0. (7.8)
Число клеток водорослей в одном большом квадрате камеры Горяева получают как среднее арифметическое из 10 больших квадратов камеры. Затем рассчитывают отклонение СОС в опытных вариантах от контроля:
X = [(СОСо - COCк)/COCк]100, (7.9)
где X - отклонение показателя скорости осветления среды от контроля, %;
СОСк и СОСо - показатель скорости осветления среды в контроле и в опыте соответственно, мкл/(экз. ∙ мин).
Отклонения могут быть положительными и отрицательными, так как токсическое действие может проявляться как в стимуляции, так и в угнетении СОС.
Если отклонение достигает 50 % и более, то это указывает на острое токсическое действие испытываемой воды.
Чтобы выбрать контроль для расчета отклонения СОС, сравнивают показатели СОС двух контролей, рассчитывая отклонение СОС. Если отклонение СОС не превышает 25 %, то для оценки токсичности испытываемой пробы используют в качестве контроля природную воду из фонового створа. В противном случае используют данные контроля на водопроводной воде.
Результаты биотестирования записывают по форме таблицы У.2 приложения У.
7.4.6 Пример экспресс-биотеста на коловратках
Привезена проба воды из водоема А. Пробу воды оставим в лаборатории для выравнивания температуры в пробе и среде с коловратками.
Для исследования одной пробы воды требуется шесть микроаквариумов: два для опытной серии, два для серии с контролем К-1 (водопроводная дехлорированная вода), два для серии с контролем К-2 (природная вода из фонового створа). Опишем ведение одной серии.
Капиллярной пипеткой под микроскопом поместим по 10 коловраток в два микроаквариума, с помощью фильтровальной бумаги уберем воду, попавшую вместе с коловратками. Затем внесем 1 мл испытываемой воды и 0,5 мл суспензии микроводорослей. Вносим микроводоросли в каждый микроаквариум через 10 мин для удобства дальнейшего подсчета. Сразу после внесения суспензии перемешаем среду, засечем время и немедленно начнем подсчет исходной численности микроводорослей в микроаквариуме. Следует обязательно регистрировать время внесения микроводорослей, так как процесс осветления среды уже идет. Подсчет ведем 3 раза в камере Горяева, при наличии нескольких камер отбираем пробы одновременно.
В данном случае исходное число клеток микроводорослей в одном большом квадрате камеры Горяева в среднем было следующим при трех подсчетах:
- первая повторность: 10,8, 11,1 и 11,2 клетки;
- вторая повторность: 11,1, 11,1 и 10,9 клетки.
Данные запишем по форме таблицы 7.4.
Следует отметить, что размерность численности (число клеток в большом квадрате камеры Горяева) не переводим в миллионы клеток на 1 л, так как при расчете СОС размерности сокращаются.
После внесения микроводорослей и отбора их для подсчета исходной численности микроаквариумы помещаем в чашки Петри (для предотвращения испарения) и накрываем листом темной бумаги, чтобы исключить фотосинтез микроводорослей. Оставляем на 30 мин. Спустя 30 мин повторно считаем клетки микроводорослей в микроаквариумах. Время окончания опыта (второго учета) запишем в ту же таблицу. В данном случае конечная численность микроводорослей составила в среднем в одном большом квадрате камеры Горяева в первой повторности при трех подсчетах 10,4, 10,7 и 10,8 клеток, во второй повторности 10,8, 10,7 и 10,5 клеток. Данные подсчетов запишем в ту же таблицу.
Таблица 7.4 - Данные экспресс-биотеста на коловратках
|
№ пробы |
Серия |
№ повторности |
№ счета |
Число клеток микроводорослей в одном большом квадрате камеры Горяева |
Число коловраток в микроаквариуме |
Начало опыта |
Конец опыта |
|||
|
в начале опыта |
в конце опыте |
ч |
мин |
ч |
мин |
|||||
|
1 |
Контроль К-1 |
1 |
1 |
11,5 |
11,1 |
10 |
10 |
50 |
11 |
20 |
|
2 |
11,5 |
11,2 |
10 |
10 |
50 |
11 |
20 |
|||
|
3 |
11,2 |
10,6 |
10 |
10 |
50 |
11 |
20 |
|||
|
2 |
1 |
11,3 |
10,7 |
10 |
11 |
00 |
11 |
30 |
||
|
2 |
11,6 |
11,0 |
10 |
11 |
00 |
11 |
30 |
|||
|
3 |
11,4 |
10,8 |
10 |
11 |
00 |
11 |
30 |
|||
|
Среднее |
11,4 |
10,9 |
10 |
- |
- |
|||||
|
2 |
Контроль К-2 |
1 |
1 |
11,2 |
10,7 |
10 |
10 |
00 |
10 |
30 |
|
2 |
11,6 |
11,2 |
10 |
10 |
00 |
10 |
30 |
|||
|
3 |
11,2 |
10,8 |
10 |
10 |
00 |
10 |
30 |
|||
|
2 |
1 |
11,4 |
10,9 |
10 |
10 |
10 |
10 |
40 |
||
|
2 |
11,5 |
11,1 |
10 |
10 |
10 |
10 |
40 |
|||
|
3 |
11,1 |
10,7 |
10 |
10 |
10 |
10 |
40 |
|||
|
Среднее |
11,8 |
10,9 |
10 |
- |
- |
|||||
|
3 |
Опыт |
1 |
1 |
10,8 |
10,4 |
10 |
11 |
40 |
12 |
10 |
|
2 |
11,1 |
10,7 |
10 |
11 |
40 |
12 |
10 |
|||
|
3 |
11,2 |
10,8 |
10 |
11 |
40 |
12 |
10 |
|||
|
2 |
1 |
11,1 |
10,8 |
10 |
12 |
20 |
12 |
50 |
||
|
2 |
11,1 |
10,7 |
10 |
12 |
20 |
12 |
50 |
|||
|
3 |
10,9 |
10,5 |
10 |
12 |
20 |
12 |
50 |
|||
|
Среднее |
11,0 |
10,7 |
10 |
- |
- |
|||||
Аналогичные действия проводим в контрольных сериях.
Для оценки токсического действия испытываемой воды используем средние данные о СОС.
Для этого на основании полученных результатов рассчитаем среднюю численность водорослей в опыте и контроле. Так, для опытной серии исходная численность водорослей в среднем составила (10,8 + 11,1 + 11,2 + 11,1 + 11,1 + 10,9):6 = 11,0 клеток в одном большом квадрате, а в конце опыта она составила 10,7 клеток в одном большом квадрате.
Аналогично рассчитаем численность водорослей в начале и в конце эксперимента для К-1 и К-2. Данные запишем в ту же таблицу. Далее используем полученные средние значения.
Рассчитаем СОС для опыта по формуле (7.7):
СОС = (11,0 - 10,7) ∙ 2500/(11,0 ∙ 10 ∙ 30) = 0,20 мкл/(экз. ∙ мин).
Для К-1 СОС = 0,25, для К-2 СОС = 0,30 мкл/(экз. ∙ мин).
Полученные данные запишем по форме таблицы 7.5.
Таблица 7.5 - Результаты экспресс-биотеста на коловратках
|
Водный объект, пункт, створ, дата отбора |
Серия |
СОС мкл/(экз. ∙ мин) |
Отклонение СОС от контроля, % |
Оценка токсичности воды |
|
|
1 |
Контроль К-1 |
0,25 |
- |
||
|
2 |
Река А. выше города Б., 23.07.92 |
Контроль К-2 |
0,30 |
-16,7 |
Не оказывает острого токсического действия |
|
3 |
Река А. ниже города В., 23.07.92 |
Опыт |
0,20 |
-33,8 |
То же |
Сравним значения СОС в К-1 и К-2 и рассчитаем отклонения по формуле (7.9):
X = [(0,25 - 0,30)/0,30]100 = -16,7.
Отклонение составило 16,7 %, что свидетельствует об отсутствии острой токсичности в фоновом участке водоема. Следовательно, сравним опытную серию с контрольной К-2 на природной воде из фонового створа на основании расчета отклонения по формуле (7.9):
X = [(0,20 - 0,30)/0,30]100 = -33,3 %.
Отклонение от контроля составило -33,3 %, что меньше 50 %. Это свидетельствует об отсутствии острого токсического действия испытываемой воды.
Результат представляют по форме таблицы 7.5.
7.5 Биотестирование на природных популяциях гидробионтов
7.5.1 Общие положения
Биотестирование на природных популяциях имеет определенные преимущества. Отловив водных животных на относительно незагрязненных участках водного объекта и поместив их в воду, отобранную на загрязненном участке, можно проследить влияние загрязнения. При этом, благодаря естественной адаптации к воде данного водного объекта, можно избежать реакцию гидробионтов из природной среды на физико-химические особенности воды, которая имеет место у лабораторных культур гидробионтов.
Преимуществом биотестирования на природных популяциях является возможность прогнозирования судьбы конкретных организмов и популяций в данном водоеме в связи с антропогенным воздействием. В то же время, помехой при биотестировании на природных популяциях может быть их адаптация к слабому антропогенному воздействию на незагрязненном участке, если оно имеет идентичную природу с воздействием на загрязненном участке.
Одной из трудностей является то, что заранее нельзя предвидеть, какие именно организмы можно будет отловить, чтобы запланировать перечень показателей, необходимых для регистрации тест-реакций.
Недостаточно разработаны вопросы, касающиеся техники биотестирования: сроков адаптации конкретных видов к условиям лаборатории, сроков проведения биотеста и т.п.
Тем не менее, в экспедиционных условиях, при расследовании случаев ЭВЗ, биотесты на природных популяциях являются предпочтительными из-за возможности прогноза. Оптимальным вариантом, несомненно, является параллельное биотестирование на лабораторных культурах с известными характеристиками и известной (градуированной по эталонному токсиканту) чувствительностью к загрязняющим веществам.
Принципы биотестирования на природных популяциях в основном те же, что и на лабораторных культурах. Чаще всего для биотестирования используют ракообразных, поэтому при постановке биотеста можно использовать п. 6.1.
В результате биотестирования выявляют острое или хроническое токсическое действие воды, что целесообразно определять в ходе одного токсикологического эксперимента (непрерывное биотестирование) в зависимости от времени выявления ответа.
При проведении биотестирования следует обеспечить оптимальные условия для жизнедеятельности тест-объектов (температура воды, кислородный режим, освещенность и т.д.).
7.5.2 Получение тест-объектов
При постановке биотестов в полевых экспедиционных условиях живой материал можно отловить непосредственно из водного объекта. В принципе, можно использовать любые гидробионты, встречающиеся в массовых количествах.
Чаще всего используют организмы зоопланктона и зообентоса. Это могут быть рачки симоцефалюс, моины, скафалоберис, личинки поденок, моллюски.
Организмы отлавливают на участке водного объекта, не подверженном влиянию источников загрязнения, или на участке, где это влияние наименьшее. Желательно, чтобы это был фоновый (контрольный) створ того же водного объекта, откуда отбирают пробы для биотестирования. Это позволяет свести к минимуму помехи от влияния воды данного объекта, обусловленного ее природными особенностями.
Лучше всего отловить организмы на мелководье в зарослях водной растительности, так как на этих участках наиболее интенсивно происходят процессы самоочищения воды. Для отлова можно использовать кружку для отбора проб. Воду из кружки фильтруют через сачок из планктонного газа. Последний затем выворачивают и осторожно смывают в любой сосуд из нетоксичного материала (стеклянные банки или молочные бутылки). Сосуды заполняют этой же природной водой полностью (под крышку), чтобы при транспортировке не травмировать организмы.
В лаборатории организмы осторожно переносят в кристаллизаторы, которые заполнены этой же водой.
Кристаллизаторы устанавливают в достаточно освещенное место, защищенное от прямых солнечных лучей и перегрева. Животных выдерживают в кристаллизаторах 1 сут. для адаптации к условиям искусственного содержания в лаборатории. Кормление не производят, так как корм содержится в природной воде.
Специалист-гидробиолог должен установить видовую принадлежность отловленных организмов, предназначенных для токсикологических опытов. После таксономического определения отбирают особей для биотестирования. При отборе руководствуются следующим: особи должны быть одного размера и по возможности относиться к одной популяции. Рачков отбирают преимущественно крупных, с яйцами и эмбрионами в выводковой камере. Личинок поденок также выбирают, предпочитал личинок старшего возраста с зачатками крыльев.
7.5.3 Проведение биотестирования
При использовании рачков в сосуды для биотестирования (см. п. 6.1.4) помещают по 10 особей (например, симоцефалюс) и наливают по 50 мл испытываемой воды (опыт).
При использовании личинок поденок, бокоплавов, олигохет или мелких моллюсков их помещают по 10 особей в чашки Петри.
Для контроля используют воду того участка, где отловлены тест-объекты.
Все серии (опыт и контроль) ставят в нескольких повторностях (не менее трех). Общее число организмов в серии должно быть не менее 20.
7.5.4 Регистрация показателей и оценка токсичности воды
В качестве показателей токсичности используют выживаемость и плодовитость тест-объектов. Можно использовать и другие показатели, например, такие, как поведенческие реакции, но их регистрация требует хорошего знания видовых особенностей гидробионтов.
Показатели регистрируют в первые сутки через каждые 1 - 3 ч, затем 1 раз ежесуточно в одно и то же время. Данные записывают по форме таблицы приложения В, указывая вид тест-объекта.
Критерием токсичности служит отклонение показателей токсичности от контроля при расчете по средним значениям.
Острое токсическое действие воды на гидробионтов устанавливают при кратковременном биотестировании по снижению выживаемости тест-объекта на 50 % и более.
Хроническое токсическое действие воды на гидробионтов устанавливают при длительном биотестировании по снижению выживаемости и/или изменению плодовитости тест-объектов по сравнению с контролем. О наличии изменений судят по статистически достоверным отличиям от контроля. Для приблизительной оценки токсичности воды можно использовать критерий 25 %-ных отличий от контроля.
Выживаемость животных в контроле должна быть не ниже 90 %. В противном случае опыт необходимо повторить. Опыт прекращают, как только по перечисленным критериям будет установлена токсичность воды. В противном случае опыт заканчивают после получения третьего помета от исходных особей.
8 СТАТИСТИЧЕСКАЯ ОБРАБОТКА РЕЗУЛЬТАТОВ БИОТЕСТИРОВАНИЯ
Наличие токсического действия тестируемой воды в биотестах устанавливают на основании достоверности различий используемых показателей токсичности (выживаемость, плодовитость дафний, коэффициенты прироста численности клеток водорослей и т.д.).
Достоверность
различий определяют, применяя критерий Стьюдента t. При этом для
контрольной и испытываемой воды рассчитывают среднее арифметическое значение
показателей токсичности ![]() , среднее квадратическое отклонение
(σ), ошибку среднего арифметического (S), критерий достоверности
отличий (t). Используют следующие формулы:
, среднее квадратическое отклонение
(σ), ошибку среднего арифметического (S), критерий достоверности
отличий (t). Используют следующие формулы:
где ![]() - среднее
арифметическое;
- среднее
арифметическое;
n - число повторностей,
Хi - значение i-го регистрируемого показателя токсичности воды;
где ![]() и
и ![]() - среднее
арифметическое значение используемых показателей токсичности соответственно в
контрольной и испытываемой воде;
- среднее
арифметическое значение используемых показателей токсичности соответственно в
контрольной и испытываемой воде;
Sк и So - ошибка среднего арифметического значения показателей токсичности в контрольной и испытываемой воде.
Рассчитанные значения критерия достоверности t сравнивают с его критическими (стандартными) значениями tSt для уровня значимости 0,05 и степени свободы k = nк + nO - 2 (таблица 8.1).
Таблица 8.1 - Критические значения критерия Стьюдента tSt при уровне значимости 0,05
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
tSt |
12,71 |
4,30 |
3,18 |
2,78 |
2,57 |
2,45 |
2,37 |
2,31 |
2,26 |
2,23 |
Если рассчитанное значение t ≥ tSt, то различие между выборочными средними показателей токсичности достоверно. В этом случае есть основания утверждать, что испытываемая вода оказывает токсическое действие на тест-объект.
9 ОЦЕНКА ТОКСИЧНОСТИ ВОДЫ ПО ДАННЫМ БИОТЕСТИРОВАНИЯ С ИСПОЛЬЗОВАНИЕМ НАБОРА БИОТЕСТОВ
Для надежной оценки токсичности пробы воды необходимо использовать набор биотестов, состоящий не менее чем из трех методов биотестирования. Рекомендуется использовать набор, в который входят биотесты на ракообразных (дафнии или цериодафнии), на водорослях (сценедесмус или хлорелла), на рыбах (гуппи или данио). Любой из этих биотестов можно заменить биотестом на инфузориях (парамеции) или на коловратках (брахионусы).
Необходимость использования набора биотестов определяется тем, что состав и загрязненность природной воды заранее неизвестны, и нельзя подобрать заранее тест-объекты, наиболее чувствительные к присутствующим в данной пробе загрязняющим веществам. Использование набора биотестов увеличивает вероятность обнаружения токсичности. Поэтому обнаружение токсичности даже при одном из биотестов (наиболее чувствительном) указывает на наличие токсичности испытываемой воды.
Кроме того, с другой стороны, при использовании в биотестировании только одного тест-объекта нельзя исключить неправильный результат, что связано с биологическими особенностями гидробионтов. Так, дафнии могут погибать в воде, содержащей большое количество взвешенных веществ (забивается жаберный аппарат, что можно установить при микроскопическом анализе); а у водорослей при некоторых видах загрязнения стимулируется рост, и т.п.
Таким образом, итоговая оценка токсичности является экспертной и неформальной. Специалист должен знать и учитывать особенности жизнедеятельности тест-объектов и соблюдать условия проведения токсикологического эксперимента, чтобы иметь уверенность в том, что регистрируемые реакции обусловлены присутствием в природной воде токсичных соединений, а не какими-то другими причинами.
Большинство рекомендуемых тест-объектов чувствительны к широкому спектру химических соединений, присутствующих в природных водах. Хотя количественные характеристики их реакций существенно различаются, использование гидробионтов позволяет получить достаточно надежную оценку токсичности - интегрального показателя токсического загрязнения воды.
10 ОЦЕНКА ТОКСИКОЛОГИЧЕСКОГО СОСТОЯНИЯ ВОДНОГО ОБЪЕКТА ИЛИ ЕГО УЧАСТКА
Для оценки токсикологического состояния водного объекта или его участка с точки зрения благополучия водной экосистемы рекомендуется использовать таблицу 10.1.
Как видно из таблицы, первые три позиции (от благополучного до крайне неблагополучного состояния водной экосистемы) выделены на основе частоты выявления нарушений установленных норм качества воды, согласно которым природная вода не должна оказывать хронического токсического действия на тест-объекты. Оценка по этим позициям возможна при проведении систематических (режимных) наблюдений и основана на анализе данных биотестирования воды, отобранной в одном и том же створе в течение определенного промежутка времени (согласно программе работ управлений ГСН Росгидромета). Такая оценка основана на вариациях токсичности природной воды, связанной с влиянием естественных факторов и антропогенных воздействий.
Таблица 10.1 - Оценка токсикологического состояния водного объекта (участка)
|
Оценка токсикологических параметров по данным биотестирования |
|
|
Благополучное |
Хроническое токсическое действие не обнаружено ни в одной из съемок* в течение режимных наблюдений* |
|
Неблагополучное |
Хроническое токсическое действие обнаружено в одной из съемок* в течение режимных наблюдений* |
|
Крайне неблагополучное |
Хроническое токсическое действие обнаружено а двух и более съемках* в течение режимных наблюдений*, или в одной съемке обнаружено острое токсическое действие, которое устраняется при кратности разбавления в 2 раза |
|
Чрезвычайная экологическая ситуация** |
Обнаружено острое токсическое действие воды, которое устраняется при кратности ее разбавления от 50 до 100 раз (одна съемка) |
|
Экологическое бедствие |
Обнаружено острое токсическое действие воды, которое устраняется при кратности разбавления в 100 раз и более (одна съемка) |
|
_______________ * Число съемок (проб воды, отобранных в одном и том же створе) определено программой работ по токсикологическим показателям для каждого управления сети ГСН Росгидромета. ** Критерии оценки даны по работе [8]. |
|
Четвертая и пятая позиции, характеризующие кризисное и катастрофическое состояние водной экосистемы (чрезвычайная экологическая ситуация и экологическое бедствие), не требуют систематических наблюдений. Оценку по этим позициям можно сделать по результатам биотестирования одной пробы воды, если они указывают на острое токсическое действие воды, которое проявляется даже при разбавлении воды в 50 раз и более.
Данные об остром или хроническом токсическом действии природной воды можно получить как в режимных наблюдениях, так и в ходе оперативных работ. В системе режимных наблюдений можно использовать все пять позиций предлагаемой таблицы.
В оперативных работах токсикологическое состояние оценивают на определенный момент времени. В этом случае устанавливают, оказывает ли вода токсическое действие, является ли это действие хроническим или острым и при обнаружении последнего находят кратность разбавления испытываемой воды, при которой токсичность не проявляется.
Если вода оказывает хроническое токсическое действие, делают заключение о том, что качество воды в данный момент времени не соответствует установленным нормам. Если вода оказывает острое токсическое действие, делают заключение о неблагополучном экологическом состоянии водного объекта или его участка. Затем определяют кратность разбавления, при которой токсическое действие устраняется, и дают оценку состояния водной экосистемы, исходя из последних двух позиций таблицы 10.1.
11 ПРЕДСТАВЛЕНИЕ РЕЗУЛЬТАТОВ БИОТЕСТИРОВАНИЯ ПРИРОДНОЙ ВОДЫ
Результаты биотестирования природной воды представляют в виде следующих материалов:
1) характеристика пробы природной воды и условия отбора согласно приложению Ш;
2) результаты биотестирования природной воды по каждому использованному биотесту согласно приложениям В, И, К, Н, П, Т, У, Ц;
3) результаты биотестирования пробы природной воды согласно приложению Щ;
4) заключение о токсикологическом состоянии водных экосистем согласно приложению Э.
12 ТРЕБОВАНИЯ К ТЕХНИКЕ БЕЗОПАСНОСТИ
При выполнении работ следует соблюдать общие требования к технике безопасности работ на водных объектах и в химических лабораториях.
13 ТРЕБОВАНИЯ К КВАЛИФИКАЦИИ ОПЕРАТОРА
К выполнению биотестов допускаются лица с высшим биологическим образованием, освоившие методики биотестирования.
ПРИЛОЖЕНИЕ А
(информационное)
Характеристика тест-объекта рачка Daphnia magna S.
Систематическое положение:
|
Тип......................................................... |
Ariropoda |
|
Класс.................................................... |
Crustacea |
|
Отряд ................................................... |
Cladocera |
|
Семейство............................................ |
Daphnidae |
|
Род......................................................... |
Daphnia |
|
Вид........................................................ |
Daphnia magna Straus, 1826 (в дальнейшем дафнии) |
Местообитание. Дафнии обитают в сточных и слабо проточных водоемах, особенно много их во временно пересыхающих лужах. На территории СНГ дафнии широко распространены, являются типичными β-мезасапробами, переносят осолонение до 6 ‰.
Морфология, биология. Тело дафний овальной формы, сжато с боков, заключено в хитиновую прозрачную раковину (рисунок А.1). Тело неясно сегментировано на головной, грудной и брюшной отделы. Голова покрыта головным щитом, передний крест которого клювообразно вытянут, образуя рострум. Под рострумом впереди прикреплены две антеннулы, вооруженные щетинками, которые более развиты у самцов. В основании головы по бокам расположены две задние сильно развитые антенны, служащие для скакообразного передвижения в толще воды. В грудном отделе дафний расположено пять пар грудных ножек. Функции последних связаны с процессами фильтрации, питания и дыхания. Брюшной отдел лишен конечностей, изогнут и снабжен парой крупных придатков - каудальных когтей. Заканчивается брюшной отдел постабдоменом с характерной выемкой, наличие которой является видовым признаком. На спинной стороне грудного отдела находится сердце.
Дафнии раздельнополы. Половая система представлена парными гонадами (яичниками у самок и семенниками у самцов), расположенными по обеим сторонам кишечника. Между спинной частью туловища и панцирем расположена выводковая камера, в нее откладываются яйца и в ней развиваются эмбрионы рачков. Размножаются в природе в летнее время, а в лаборатории при благоприятных условиях круглый год, партеногенетически. Партеногенетические поколения следуют одно за другим каждые 8 - 4 сут.
Рисунок A.1 - Строение Daphnia magna S.
a - самка, в - самец, в - внешний вид эфиппиума;
1 - антеннула, 2 - сложный глаз, 3 - антенна, 4 - печеночные выросты, 5 - кишечник, 6 - сердце, 7 - выводковая камера, 8 - хвостовые щетинки, 9 - постабдомен, 10 - каудельные когти, 11 - створки раковины, 12 - яичник, 13 - грудные ножки.
При резком изменении условий существования (недостаточно пищи, понижение температуры и т.д.) появляются самцы, и дафнии переходят к двуполому размножению, откладывая после оплодотворения «зимние» яйца.
В природе дафнии живут в среднем 20 - 25 сут, в лабораторных условиях при оптимальном режиме - 3 - 4 месяца и более. Длительность эмбрионального развития обычно 3 - 4 сут. Период созревания рачков при оптимальной температуре (20 ± 2 °С) и хорошем питании 5 - 8 сут.
ПРИЛОЖЕНИЕ Б
(справочное)
Содержание культуры дафний в лабораторных условиях
Получение исходного материала для культуры дафний. Исходный материал для лабораторной культуры дафний можно получить в ГХИ. Культуры D. magna имеются в научно- исследовательских Лабораториях ряда учреждений: ОВП Карельского филиала АН России, Государственных университетов Москвы, Санкт-Петербурга, Иркутска, Нижнего Новгорода и др.
Можно самостоятельно вырастить культуру D. magna, если этот вид встречается в местных водоемах и водотоках. Из водоема с помощью гидробиологического сачка из планктонного газа № 20 - 26 отлавливают дафний и помещают в стеклянные емкости, удобные для транспортировки, которые заполняют под пробку водой из этого водоема. Одновременно отбирают 5 - 10 л воды для последующей пересадки дафний. В лаборатории специалист определяет вид рачков под микроскопом. Доставленных в лабораторию дафний вместе с водой переводят в кристаллизаторы. Отобранную природную воду фильтруют через планктонный газ, чтобы предупредить попадание в культуру других организмов - конкурентов дафний по способу питания. Заранее подготовленные стеклянные сосуды вместимостью 3 - 5 л заполняют на 1/3 объема отфильтрованной природной водой и в них переносят дафний с помощью стеклянной трубки с внутренним диаметром 0,5 - 0,7 см, конец которой оплавлен или спилен надфилем, чтобы не травмировать рачков. Такую трубку используют и в дальнейшем при пересадке дафний. Начальная плотность размещения - 6 - 10 особей на 1 л воды. Спустя 5 - 7 сут, в течение которых дафний привыкают к лабораторным условиям существования и начинают размножаться, в сосуды доливают воду для дальнейшего культивирования. Можно использовать дафний других видов, отловленных в природных водоемах и культивируемых в лаборатории. В этом случае чувствительность вида, установленная при градуировке по бихромату калия согласно п. 6.1.3, должна быть не ниже, чем у D. magna.
Содержание культуры и кормление. Для успешного культивирования дафний в лаборатории необходимо соблюдать следующие условия: содержать в чистоте посуду и помещение, обеспечить рачкам стандартное освещение, регулярное кормление и подготовленную определенным образом воду для культивирования.
Можно использовать разнообразные способы разведения, если они позволяют достичь удовлетворительного размножения путем партеногенеза и если популяции обладают достаточной чувствительностью к бихромату калия.
Для разведения используют стеклянную посуду: аквариум вместимостью 5 л. Посуду следует мыть с помощью питьевой соды и механических средств. Нельзя использовать синтетические моющие средства и органические растворители. Перед употреблением посуду ополаскивают исследуемой водой.
Используют дехлорированную водопроводную воду, отстаивая ее 7 - 10 сут и проводя аэрацию с помощью микрокомпрессора. Можно использовать деионизированную воду, пропустив ее через установку «Родничок» или через слой гранулированного активированного угля. Можно использовать природную воду из заведомо чистого источника. Воду меняют наполовину каждые 7 - 10 сут.
Оптимальная температура для разведения и содержания дафний 20 ± 2 °С, продолжительность светового дня 10 - 12 ч. Можно использовать люминостат или дополнительное освещение лампой дневного света.
Плотность размещения - 20 - 30 особей на 1 л воды для маточной культуры.
Кормление проводят ежедневно 1 раз в сутки, внося в аквариумы протококковые водоросли (хлореллу или сценедесмус). 1 - 2 раза в неделю рекомендуется вносить несколько капель суспензии пекарских или кормовых дрожжей. Подготовка культуры водорослей для кормления описана ниже.
В помещении, где находятся дафнии, нельзя хранить летучие вещества и работать с ними, проводить обработку помещения ядохимикатами, натирать полы мастикой и лакировать их.
Подготовка корма дафний (выращивание водорослей и подготовка их для кормления дафний).
Исходную культуру зеленых протококковых водорослей (хлорелла, сценедесмус) можно получить в тех же учреждениях, где и культуру дафний. Водоросли выращивают на одной из искусственных питательных сред, состав которых приведен в таблице Б.1.
Водоросли культивируют в стеклянных кюветах или плоскодонных колбах при круглосуточном освещении лампами дневного света мощностью 240 Вт/м2, размещенными на расстоянии 30 - 40 см от поверхности культуры, и при продувании культуры воздухом с помощью микрокомпрессора. Питательные среды готовят на дистиллированной воде или кипяченой водопроводной воде. Навеску каждого вещества растворяют в небольшом количестве воды, а затем растворы сливают вместе и доводят их объем до 1 л.
Таблица Б.1 - Концентрация веществ в питательных средах для водорослей, г/л
|
Среда |
||||||
|
Тамия |
Мейерса |
Успенского |
Прата |
|||
|
KNO3 |
5,00 |
1,213 |
0,025 |
0,100 |
||
|
MgSO4 ∙ 7H2O |
2,50 |
1,204 |
0,025 |
0,010 |
||
|
KH2PO4 |
1,25 |
1,224 |
0,025 |
0,010 |
||
|
FeSO4 ∙ 7H2O |
0,003 |
|||||
|
Fe2(SO4)3 |
0,0747 |
|||||
|
K2CO3 |
0,0345 |
|||||
|
Ca(NO3)2 |
0,1 |
|||||
|
FeCl3 ∙ 6H2O |
0,001 |
|||||
|
Раствор микроэлементов, добавляемых в среду |
||||||
|
1 мл раствора |
||||||
|
Соединение |
Н3ВО3 |
MnCl2 ∙ 4H2O |
ZnSO4 ∙ 7Н2О |
МoО3 |
NH4VO3 |
|
|
Концентрация, г/л |
2,86 |
1,81 |
0,222 |
0,017 |
0,023 |
|
|
0,2 - 0,5 мл раствора |
||||||
|
Соединение |
ZnSO4 |
Н3ВО3 |
MnSO4 |
CuSO4 ∙ 5Н2О |
||
|
Концентрация, мг/л |
100,0 |
100,0 |
150,0 |
3,0 |
||
Среды Мейерса и Тамия перед внесением водорослей разбавляют в 3 - 5 раз.
Культуру водорослей вносят в среду до тех пор, пока среда не приобретет видимую светло-зеленую окраску. Колбу закрывают ватно-марлевой пробкой.
Водоросли хорошо растут при температуре 18 - 23 °С и периодическом перемешивании.
Пересевать их можно через 1 месяц или 2 - 3 недели.
Через 7 - 10 сут после посева, когда окраска станет интенсивно-зеленой, водоросли уплотняют путем отстаивания или центрифугирования. Надосадочный слой сливают с помощью сифона, а уплотненную суспензию используют для кормления. При хранении в холодильнике суспензия пригодна для корма в течение 14 сут.
Суспензию вносят в сосуды с дафниями из расчета 1 мл корма (концентрация клеток 600 - 700 тыс./мл) на 1 л воды.
ПРИЛОЖЕНИЕ В
(обязательное)
Форма записи результатов биотестирования природной воды на дафниях (цериодафниях)
Таблица В.1 - Данные биотестирования на дафниях (цериодафниях) пробы № (водный объект, пункт, створ)
Дата отбора проб
|
Выжившие дафнии, экз. |
Выметанная молодь, экз. |
|||||||||||||||||
|
Контроль К-1 |
Контроль К-2 |
Испытываемая вода |
Контроль К-1 |
Контроль К-2 |
Испытываемая вода |
|||||||||||||
|
Повторность |
Повторность |
Повторность |
Повторность |
Повторность |
Повторность |
|||||||||||||
|
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
|
Таблица В.2 - Результаты кратковременного биотестирования природной воды на дафниях (цериодафниях)
|
Водный объект, пункт, створ, дата отбора |
Серия |
Выживаемость, % исходного числа особей |
Критерий Стьюдента t |
Снижение выживаемости, % контроля |
Оценка токсичности воды |
||
|
К-1 |
К-2 |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Примечание: В графе «Оценка токсичности воды» пишут: «Оказывает (не оказывает) токсическое действие». |
|||||||
Таблица В.3 - Результаты длительного биотестирования природной воды на дафниях (цериодафниях)
|
№ пробы |
Водный объект, пункт, створ, дата отбора |
Серия |
Выживаемость, % исходного числа особей |
Критерий Стьюдента t |
Снижение выживаемости, % контроля |
Плодовитость |
Критерий Стьюдента t |
Оценка токсичности воды |
|
|
К-1 |
К-2 |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Примечание: В графе «Оценка токсичности воды» пишут: Оказывает (не оказывает) токсическое действие». Воду считают токсичной, если отличия выявлены хотя бы по одному показателю (выживаемости или плодовитости) |
|||||||||
ПРИЛОЖЕНИЕ Г
(информационное)
Характеристика тест-объекта рачка Ceriodaphnia affinis
Систематическое положение:
|
Тип................................................. |
Artropoda |
|
Класс............................................. |
Crustacea |
|
Отряд............................................. |
Cladocera |
|
Семейство.................................... |
Daphnidae |
|
Род ................................................ |
Ceriodaphnia |
|
Вид................................................. |
Ceriodaphnia affinis Lillgeborg, 1862 (в дальнейшем - цериодафнии) |
Местообитание. Этот вид распространен по всему земному шару, на территории бывшего СССР повсеместно, кроме южных районов азиатского региона. С. affinis населяет преимущественно небольшие неглубокие озера, пруды, реки с замедленным течением. Встречается реже, чем другие виды цериодафний, в основном в литоральном планктоне - на открытых местах или между зарослями тростника и погруженными растениями над заиленным дном. Обнаружен в каменистых лужах побережий полярных морей.
Морфология, биология. Тело цериодафний (рисунок Г.1) заключено в прозрачный хитиновый панцирь, створки которого на брюшной стороне не соединены и образуют щель. Тело нечетко сегментировано на головной и брюшной (абдоминальный) отделы. Впереди под головным отделом находятся две антеннулы, вооруженные осязательными щетинками, которые более развиты у самцов. По бокам головы расположены две задние, хорошо развитые антенны, служащие для скачкообразного передвижения рачков в толще воды. В грудном отделе имеются пять пар грудных ножек, функции которых связаны с фильтрацией воды, питанием и дыханием. Сердце находится на спинной стороне грудного отдела. Половая система представлена парными гонадами: яичниками у самок и семенниками у самцов, которые расположены по обе стороны кишечника. Брюшной отдел самки (см. рисунок Г.1,г) имеет хорошо развитые абдоминальные выросты, один из которых, сильно выступающий, конусовидный (1), является специфическим признаком вида С. affinis. На вогнутой стороне каудального коготка имеются щетинки (2).
Рисунок Г.1 - Строение Ceriodaphnia affinis.
а - самка, б - самец, в и г - постабдомен самца и самки соответственно.
1 - абдоминальные выросты, 2 - щетинки на каудальном коготке.
Этот вид цериодафний моно- или дицикличен. Максимум полового периода приходится на август - октябрь. Эфиппиум с одним покоящимся яйцом. В лабораторных условиях самцы появляются при недостаточном освещении, при снижении температуры и содержания растворенного кислорода и при голодании.
ПРИЛОЖЕНИЕ Д
(справочное)
Содержание культуры цериодафний в лабораторных условиях
Получение культуры. Исходный материал для лабораторной культуры цериодафний можно получить в учреждениях - разработчиках настоящего РД.
Культуру цериодафний выращивают в климатостате, люминостате, боксе или помещении, в котором отсутствуют токсические пары или газы. Оптимальные условия для содержания цериодафний: температура 25 ± 2 °С, освещенность 400 - 600 лк.
Для культивирования цериодафний используют дехлорированную, отстоявшуюся водопроводную воду, которая должна удовлетворять следующим требованиям: рН = 7,0...8,2, общая жесткость 1,3 - 2,0 ммоль/л, содержание растворенного кислорода - не менее 5,0 мг/л.
Рекомендуется содержать культуру цериодафний в кристаллизаторах вместимостью 2 - 3 л, которые заполняют водой наполовину. Используют и другие стеклянные сосуды указанной вместимости. Требования к чистоте посуды такие же, как и для дафний (приложение Б).
Каждые 7 - 20 сут культуру цериодафний обновляют. Для этого отбирают 20 половозрелых самок и помещают в сосуды для культивирования, заполненные водой из расчета 50 - 100 мл на одну особь. При оптимальных условиях содержания цериодафний выметывают молодь ежесуточно или раз в 2 сут. Пометы молодых самок состоят из 2 - 6 особей. Максимальное число молоди получают от 7 - 20-суточных самок.
Кормление. Раз в сутки цериодафний кормят суспензией пекарских дрожжей, раз в неделю - суспензией зеленых водорослей.
Для приготовления дрожжевой суспензии 1 г свежих или 0,5 г сухих пекарских дрожжей заливают 100 мл дистиллированной воды. После набухания суспензию тщательно перемешивают, а затем отстаивают в течение 30 мин. Надосадочную жидкость добавляют в сосуды с цериодафниями из расчета 5 мл суспензии на 1 л воды. Хранить дрожжевую суспензию в холодильнике можно не более 1 сут.
В качестве водорослевого корма для цериодафний рекомендуется использовать хлореллу, культуру которой выращивают на среде Тамия. Для кормления цериодафний водоросли отделяют от питательной среды при помощи центрифугирования или отстаивания в холодильнике в течение 2 - 3 сут. Надосадочную жидкость сливают, а осадок разбавляют в 2 раза дистиллированной водой. Водорослевый корм добавляют в культуру цериодафний из расчета 0,5 мл суспензии (600 - 1000 млн. кл./мл) на 1 л воды. Кроме хлореллы в качестве корма можно использовать культуру сценедесмус.
ПРИЛОЖЕНИЕ Е
(информационное)
Характеристика водорослевых тест-объектов1
_________________
1 Дана по РД 118-02-90.
Е.1. Характеристика тест-объекта Scenedesmus quadricauda (Turp.) Breb.
Систематическое положение:
|
Отдел............................................. |
Chlorophyta |
|
Класс............................................. |
Euchlorophyceae |
|
Порядок........................................ |
Clorococcales |
|
Семейство.................................... |
Scenedesmaceae |
|
Подсемейство.............................. |
Scenedesmoldeae |
|
Род ................................................. |
Scenedesmus Mayen |
|
Вид................................................. |
Scenedesmus quadricauda (Turp.) Bred. |
Местообитание. S. quadricauda - широко распространенный в пресных поверхностных водах вид зеленых водорослей. Встречается главным образом в планктоне.
Морфология, биология. Данный вид относится к ценобиальным организмам. Ценобии - организмы, имеющие вид плоских пластинок и состоящие из 2, 4, реже 8 и 16 клеток. Клетки удлиненно-овальные, с закругленными концами. Краевые клетки имеют два отогнутых наружу рога. Оболочка гладкая. Размеры клеток 7 - 43×2,5 - 16 мкм. Размножается автоспорами. Автоспоры в материнской оболочке располагаются пучком, после освобождения разворачиваются в виде пластинки. Иногда (особенно в условиях культуры) вместо ценобиев образуются отдельные клетки.
Е.2. Характеристика тест-объекта Chlorella vulgaris Beijer
Систематическое положение:
|
Отдел......................................................... |
Chlorophyta |
|
Класс......................................................... |
Euchlorophyceae |
|
Порядок.................................................... |
Chlorococcales |
|
Семейство................................................ |
Chlorellaceae |
|
Подсемейство.......................................... |
Chlorelloideae |
|
Род.............................................................. |
Chlorella Beijer |
|
Вид............................................................. |
Chlorella vulgaris Beijer (в дальнейшем хлорелла) |
Местообитание. Ch. vulgaris - широко распространенный вид зеленых водорослей, обитающих в различных биотопах пресноводных экосистем.
Морфология, биология. Хлорелла относится к одноклеточным водорослям. Клетки шаровидные, с тонкой оболочкой, без слизи. Хроматофор чашевидный, с пиреноидом. Размножается автоспорами, которые образуются по 4 - 8, реже по 16 штук, и освобождаются через разрыв в материнской оболочке. Диаметр клеток 4,2 - 10,5 мкм.
ПРИЛОЖЕНИЕ Ж
(справочное)
Содержание культуры водорослей в лабораторных условиях
Исходный материал для лабораторной культуры водорослей можно получить в ГХИ. Культуры сценедесмуса и хлореллы имеются в научно-исследовательских лабораториях ряда учреждений: ОВП Карельского филиала АН России, Государственных университетов Москвы, Санкт-Петербурга и др.
Водоросли выращивают на искусственной питательной среде Успенского № 1 (таблица Ж.1)
Таблица Ж.1 - Состав питательной среды
|
Содержание, г/л |
|||||
|
в среде для культивирования |
в растворах солей для биотестирования |
||||
|
KNO3 |
0,025 |
50,0 |
|||
|
MgSO4 ∙ 7Н2О |
0,025 |
50,0 |
|||
|
KH2PO4 |
0,025 |
50,0 |
|||
|
К2СО3 |
0,0345 |
69,0 |
|||
|
Ca(NO3)2 |
0,100 |
200,0 |
|||
|
Раствор микроэлементов объемом 1 мл |
|||||
|
Соединение |
Н3ВО3 |
MnCl2 ∙ 4Н2О |
ZnSO4 ∙ 7Н2О |
МоО3 |
NH4VO3 |
|
Концентрация, г/л |
2,86 |
1,81 |
0,222 |
0,017 |
0,023 |
Раствор микроэлементов вносят в среду после стерилизации, перед посевом.
Питательную среду для культивирования водорослей готовят так же, как при подготовке корма для дафний (приложение Б).
Для биотестирования готовят отдельно по 100 мл раствора каждой соли (см. таблицу Ж.1)
Желательно питательную среду, растворы отдельных солей и микроэлементов стерилизовать в автоклаве в течение 45 - 60 мин при давлении 1,013 ∙ 105 Па (1 атм.). Колбы для культивирования водорослей также желательно стерилизовать сухим паром в течение 1 ч при 180 °С.
Культуру водорослей вносят для посева в стеклянную колбу с питательной средой в количестве, дающем светло-зеленое окрашивание. Колбу закрывают стерильной ватно-марлевой пробкой и колпачком из пергаментной бумаги.
Водоросли культивируют при круглосуточном освещении лампами дневного света, размещенными на расстоянии 80 - 40 см от поверхности культуры, освещенность 2000 - 3000 лк. Водоросли можно выращивать на окне при естественном освещении, защищая от прямых солнечных лучей. Культуру водорослей периодически перемешивают, встряхивая 1 - 2 раза в сутки. Оптимальная температура для выращивания водорослей 18 - 20 °С.
ПРИЛОЖЕНИЕ
И
(обязательное)
Форма записи результатов биотестирования природной воды на водорослях
Таблица И.1 - Результаты биотестирования природной воды на водорослях
|
№ пробы |
Водный объект, пункт, створ, отбора |
Серия |
Время от начала биотестирования. сут |
Численность водорослей, тыс. кл./мл |
Коэффициент прироста численности водорослей |
Оценка токсичности воды |
||||
|
Повторность |
Повторность |
Среднее арифметическое |
Критерий достоверности Стьюдента |
|||||||
|
1 |
2 |
1 |
2 |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
Примечание: 1. В начале биотестирования и на седьмые сутки до пересева подсчитывают исходную численность клеток. 2. В графе «Оценка токсичности воды» пишут: «Оказывает (не оказывает) острое или хроническое токсическое действие». |
||||||||||
ПРИЛОЖЕНИЕ К
(обязательное)
Форма записи результатов биотестирования природной воды на водорослях с использованием A-Z-Ph-теста
Таблица К.1 - Данные биотестирования природной воды на водорослях с использованием A-Z-Ph-теста
|
№ пробы |
Водный объект, пункт, створ, дата отбора |
Серия |
Концентрация кислорода, мг/л |
|||||||||||
|
Он.в |
Ос.в |
Oт.в |
Ос |
|||||||||||
|
Повторность |
Среднее |
Повторность |
Среднее |
Повторность |
Среднее |
Повторность |
Среднее |
|||||||
|
1 |
2 |
1 |
2 |
1 |
2 |
1 |
2 |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
Примечание: Условные обозначения см. п. 7.2.5. |
||||||||||||||
Таблица К.2 - Результаты биотестирования природной воды на водорослях с использованием A-Z-Ph-теста
|
№ пробы |
Водный объект, пункт, створ, дата отбора |
Серия |
Ос.в - Ос, мг/л О2 |
Δ УФ % |
Ф, мг/л O2 |
Д, мг/л О2 |
Ф/Д |
Оценка токсичности воды |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
Примечания: 1. Условные обозначения см. п. 7.2.5. 2. В графе «Оценка токсичности воды» пишут: «Оказывает (не оказывает) острое токсическое действие». |
||||||||
ПРИЛОЖЕНИЕ Л
(информационное)
Характеристика тест-объекта инфузории Paramecium caudatum
Систематическое положение:
|
Тип..................................................... |
Ciliophora |
|
Подтип.............................................. |
Ciliata |
|
Класс................................................. |
Otigohymenophora |
|
Отряд ................................................ |
Hymenostomatida |
|
Подотряд.......................................... |
Peniculina |
|
Род...................................................... |
Paramecium |
|
Вид..................................................... |
Paramecium caudatum Ehrenberg., 1838 (в дальнейшем парамеция) |
Местообитание. P. caudatum - свободноживущая широко распространенная ресничная инфузория. Предпочитает α-мезосапробные условия, близкие к нейтральному значения рН = 6,5...7,5, температурный оптимум в пределах 24 - 28 °С. Обитает в пресных водоемах.
Морфология, биология. Парамеции - наиболее сложно организованные простейшие, очень чувствительные к изменению химического состава среды. Парамеции, представляющие собой одноклеточные организмы, имеют сигарообразное или веретенообразно вытянутое в поперечном сечении округлое тело. Клетка парамеций содержит два типа ядер: вегетативное и генеративное. Размножаются парамеции либо поперечным делением клеток (бесполое размножение), либо половым путей, носящим характер конъюгации. Клетки делятся 1 - 2 раза в сутки. Перистом расположен косо от переднего конца тела к вестибулуму. Пульсирующих вакуолей большей частью две со звездчато расположенными приводящими каналами. Ресничный покров густой, равномерный, сзади чуть удлиненный. Длина тела 180 - 300 мкм [3, 13].
ПРИЛОЖЕНИЕ М
(справочное)
Содержание культуры парамеций в лабораторных условиях
Получение исходного материала для культуры парамеций. Получить исходный материал для культуры парамеций можно в институтах и учреждениях, занимающихся биотестированием с использованием парамеций (в том числе в ГХИ). Обычно этот вид встречается в местных водоемах, поэтому можно самостоятельно вырастить культуру парамеций.
Выделяют парамеции из природных вод методом концентрирования [1]. Для этого из водоема отбирают пробу воды объемом 5 л. Затем путем ее фильтрации через мембранный фильтр с размером пор 3 - 5 мкм получают концентрированную пробу объемом 40 мл. Полученный концентрат пробы сливают в стакан. Затем осадок с фильтра смывают полученным концентратом в чашки Петри. Высота слоя воды в чашке составляет 0,5 - 0,8 см. В чашки Петри добавляют корм - сухие пекарские дрожжи (один - два кусочка размером 1 мм3). Полученные пробы оставляют на 1 - 3 сут. Часто уже через сутки начинается массовое развитие разных видов микрозоопланктона. В лаборатории специалист определяет нужный вид инфузорий под микроскопом. Заранее подготовленные чашки Петри наполняют дехлорированной водопроводной водой и в них переносят инфузорий с помощью капиллярной пипетки. Такую пипетку используют в дальнейшем при пересадке инфузорий. Начальная плотность размещения - 5 - 10 особей на одну чашку Петри. В течение 1 - 3 сут инфузорий адаптируют к лабораторным условиям и используют полученную культуру как исходную.
Содержание культуры, кормление. Культуру инфузорий выращивают в климатостате, боксе или в любом помещении, не содержащем токсических паров или газов. Оптимальная температура для культивирования и биотестирования 22 ± 2 °С. Дополнительного освещения не требуется, не допускается освещать инфузории прямыми солнечными лучами. Стеклянную посуду для содержания инфузорий моют водопроводной водой. Нельзя использовать для мытья синтетические моющие средства и органические растворители. В помещении, где находится культура парамеций, не хранят летучие вещества и не работают с ними.
Для культивирования инфузорий используют водопроводную дехлорированную воду или природную воду из незагрязненного водоема. Вода для культивирования должна удовлетворять следующим требованиям: рН = 6,5...7,5, жесткость общая 3 - 4 ммоль/л, концентрация растворенного кислорода не менее 6,0 мг/л.
Оптимальная плотность культуры 10 - 20 особей на 1 мл воды. Один раз в 7 - 10 сут культуру пересевают, чтобы обеспечить стандартные условия культивирования, поддерживающие культуру парамеций в стационарной фазе роста.
В качестве корма для парамеций используют сухие пекарские дрожжи. Для содержания парамеций в одной чашке Петри достаточно одного - двух кусочков сухих дрожжей размером 1 мм. Дрожжевой корм для опытов с индивидуальными линиями парамеций готовят следующим образом: 0,5 г свежих или 0,1 г воздушно-сухих дрожжей заливают 100 мл дехлорированной водопроводной воды. После набухания дрожжи тщательно перемешивают, дают отстояться 30 мин. Для корма используют надосадочную жидкость, для чего сначала обмакивают пипетку в дрожжевой раствор, затем - в луночный микроаквариум.
Транспортировка культуры. Культуру парамеций транспортируют в пробирках, не допуская перегрева и переохлаждения. Хранить ее без пересева можно в холодильнике при температуре 8 - 10 °С в течение 2 - 3 недель. Период адаптации к лабораторным условиям составляет 24 ч.
ПРИЛОЖЕНИЕ H
(обязательное)
Форма записи результатов биотестирования природной воды на парамециях
Таблица Н.1 - Данные биотестирования природной воды на парамециях
|
№ пробы |
Серия |
№ микроаквариума |
Исходная численность в каждой повторности, экз. |
Живые особи, экз. |
||||||||
|
Время экспозиции, ч |
||||||||||||
|
24 |
48 |
72 |
||||||||||
|
Повторность |
Сумма |
Повторность |
Сумма |
Повторность |
Сумма |
|||||||
|
1 |
2 |
1 |
2 |
1 |
2 |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
1 |
Контроль К-1 |
1 |
||||||||||
|
2 |
||||||||||||
|
. |
||||||||||||
|
. |
||||||||||||
|
. |
||||||||||||
|
10 |
||||||||||||
|
Сумма |
||||||||||||
|
2 |
Опыт |
1 |
||||||||||
|
2 |
||||||||||||
|
. |
||||||||||||
|
. |
||||||||||||
|
. |
||||||||||||
|
10 |
||||||||||||
|
Сумма |
||||||||||||
Продолжение таблицы Н.1
|
№ пробы |
Серия |
№ микроаквариума |
Исходная численность в каждой повторности, экз. |
Мертвые особи, экз. |
||||||||
|
Время экспозиции, ч |
||||||||||||
|
24 |
48 |
72 |
||||||||||
|
Повторность |
Сумма |
Повторность |
Сумма |
Повторность |
Сумма |
|||||||
|
1 |
2 |
1 |
2 |
1 |
2 |
|||||||
|
1 |
2 |
3 |
4 |
14 |
16 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
|
1 |
Контроль К-1 |
1 |
||||||||||
|
2 |
||||||||||||
|
. |
||||||||||||
|
. |
||||||||||||
|
. |
||||||||||||
|
10 |
||||||||||||
|
Сумма |
||||||||||||
|
2 |
Опыт |
1 |
||||||||||
|
2 |
||||||||||||
|
. |
||||||||||||
|
. |
||||||||||||
|
. |
||||||||||||
|
10 |
||||||||||||
|
Сумма |
||||||||||||
Таблица Н.2 - Результаты биотестирования природной воды на парамециях
|
№ пробы |
Водный объект, пункт, створ, дата отбора |
Серия |
Время экспозиции, ч |
Выживаемость, % исходного числа |
Снижение выживаемости, % контроля |
Показатель размножения |
Отклонение показателя размножения от контроля, % |
Оценка токсичности воды |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
Примечание. В графе «Оценка токсичности воды» пишут: «Оказывает (не оказывает) острое, подострое, хроническое токсическое действие». |
||||||||
ПРИЛОЖЕНИЕ П
(обязательное)
Форма записи результатов экспресс-биотеста природной воды на парамециях
Таблица П.1 - Данные экспреес-биотеста на парамециях
|
Серия |
Повторность |
Исходная численность, экз. |
Число выживших парамеций через |
|||
|
1 ч |
3 ч |
5 ч |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Таблица П.2 - Результаты экспресс-биотеста природной воды на парамециях
|
Водный объект, пункт, створ, дата отбора |
Серия |
Время экспозиции, ч |
Выживаемость, % исходного числа |
Снижение выживаемости, % контроля |
Оценка токсичности воды |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Примечание. В графе «Оценка токсичности воды» пишут: «Оказывает (не оказывает) острое токсическое действие». |
||||||
ПРИЛОЖЕНИЕ Р
(информационное)
Характеристика тест-объекта коловратки Brachionus calyciflorus Pallas
Систематическое положение:
|
Тип............................................. |
Nemathelminies |
|
Класс........................................ |
Rotatoria (Rotifera) |
|
Отряд ....................................... |
Ploimidae |
|
Семейство................................ |
Brachionidae |
|
Род............................................. |
Brachionus |
|
Вид............................................ |
Brachionus calyciflorus Pallas, 1766 (в дальнейшем - брахионус, коловратка) |
Местообитание. В. calyciflorus - пелагический, широко распространенный вид. Встречается в различных по трофике и гидрологическому типу водоемах, в том числе в солоноватых. Предпочитает щелочную среду (рН = 7...9) и евтрофные воды. Эвритермный вид, температурный оптимум лежит в пределах 24 - 28 °С.
Морфология, биология. Коловратки легко распознаются по специфическим для них органам: коловращательному аппарату, или короне, как правило, выполняющему одновременно функции движения и питания, и по мастаксу, или глотке, содержащей внутри челюстной аппарат.
Характерной чертой коловраток является то, что тело их состоит из небольшого, вполне определенного и постоянного числа клеток.
Тело брахионуса состоит из головы, туловища и ноги, легко втягивающейся внутрь. Туловище покрыто панцирем, составленным из более выпуклой спинной и брюшной пластинок, сросшихся краями. Панцирь довольно мягкий, тонкий, прозрачный, гладкий, со спины сильно вздутый. По переднему спинному краю четыре шипа, брюшной шип имеет срединную выемку. Задний край округлый, без шипов, с треугольным или подковообразным отверстием для ноги. Длина панциря 180 - 600, ширина 124 - 300 мкм.
Брахионус обладает маллеатным типом челюстного аппарата и коловращательным аппаратом типа Euchlanis. Брахионидам присущ специфический способ питания, связанный с принципом плавания, в результате которого происходит осветление среды. Потребляет брахионус микроводоросли и бактериопланктон. Кровеносная и дыхательная системы у коловраток отсутствуют. Выделительная система протонефридиального типа. Нервная система проста - состоит из одного надглоточного ганглия и отходящих от него нервов.
Рисунок P.1 - Различные категории самок Brachionus calyciflorus.
а - амиктическая самка с яйцами «на самку», б - амиктическая самка с яйцами «на самца», в - миктическая самка с оплодотворенными покоящимися яйцами.
Брахионусы раздельнополы. Самцы карликовые с редуцированной пищеварительной и выделительной системами. После оплодотворения самок самцы погибают. Для брахионид характерна гетерогония: чередование двуполого и однополого размножения. Процесс размножения осуществляется самками двух категорий (амиктическими и миктическими). В сложном процессе размножения коловраток формируются три основных типа яиц: миктические неоплодотворенные «на самца», миктические оплодотворенные (покоящиеся или латентные) и амиктические «на самок» (рисунок Р.1). Наличие того или иного типа яиц у самок является критерием для суждения о состоянии культуры. При хорошем состоянии культуры преобладают самки с амиктическими яйцами.
Продолжительность жизни самок составляет в среднем 6 - 8, максимум 19 сут. Самки откладывают яйца ежедневно. Яйца прикрепляются к основанию ноги самки с помощью стебелька, образуемого слизистыми выделениями желез (см. рисунок Р.1). Развитие зародыша длится дольше, чем формирование яйца, поэтому яиц у самок может быть одновременно 2 - 3 и более. Эмбриональное развитие зародыша длится 8 - 13 ч. Большинство коловраток достигает половозрелости и откладывает яйца приблизительно через сутки после выхода из яйца [9].
ПРИЛОЖЕНИЕ С
(справочное)
Содержание культуры коловраток в лабораторных условиях
Получение исходного материала для культуры коловраток. Получить исходный материал для культуры коловраток можно в институтах и учреждениях, занимающихся биотестированием с использованием коловраток (в том числе в ГХИ).
Можно самостоятельно получить культуру коловраток, выделяя их либо из зоопланктона естественных водоемов, в которых обнаружен нужный вид, либо из покоящихся яиц коловраток, собранных в водоеме.
Для получения культуры коловраток из зоопланктона водоемов отбирают пробу воды объемом 0,5 - 1,0 л, добавляют четыре - пять кусочков сухих пекарских дрожжей (размером 1 мм3). Через 5 - 6 сут происходит массовое развитие различных представителей зоопланктона. Затем под микроскопом специалист определяет нужный вид. Капиллярной пипеткой отлавливают несколько самок брахионуса с партеногенетическими яйцами (см. рисунок Р.1) и рассаживают их в микроаквариумы или чашки Петри, добавляя корм. Корм (суспензию протококковых водорослей) добавляют до тех пор, пока среда не приобретет светло-зеленую окраску. Можно кормить коловраток дрожжами: один - два кусочка сухих пекарских дрожжей размером 1 мм3 добавляют в среду.
При наличии покоящихся яиц у коловраток можно получить культуру коловраток и непрерывно культивировать их в лаборатории в течение нескольких лет. Можно сохранять покоящиеся яйца и по мере необходимости получать из них культуру коловраток. Для получения вегетирующей культуры коловраток из покоящихся яиц последние помещают в микроемкости вместимостью 2 - 5 мл, заливают небольшим количеством дехлорированной водопроводной воды и помещают под лампы дневного света ЛДЦ-40 или лампы накаливания. Часто уже через сутки начинается выклев коловраток из покоящихся яиц. После выклева коловраток добавляют корм и поддерживают культуру как описано далее.
Содержание культуры коловраток, кормление. Общие требования к содержанию культуры аналогичны таковым для содержания культуры инфузорий.
Содержат культуру в стеклянных емкостях вместимостью 0,2 - 0,5 л.
Оптимальная плотность культуры 10 - 20 экз. на 1 мл воды. Раз в 10 - 14 сут культуру пересевают, чтобы обеспечить стандартные условия культивирования, поддерживающие культуру коловраток в стационарной фазе роста. Оптимальными условиями содержания являются температура 22 ± 2 °С, рН = 6,5...7,5, естественное освещение без прямого солнечного света.
Корм - одноклеточные протококковые микроводоросли (хлорелла или сценедесмус), которые можно получить способом, описанным в приложении Б. Кормление проводят через 2 - 3 сут, добавляя в небольшом количестве концентрированную культуру водорослей. По мере заполнения емкости 1/4 часть культуры коловраток переливают в новую емкость и продолжают культивирование. При отсутствии микроводорослей коловраток можно подкармливать пекарскими дрожжами - один - два кусочка сухих дрожжей размером 1 мм3 на 50 мл среды. Однако при применении дрожжей следует чаще пересевать культуру (через 5 сут), поскольку культура коловраток очень быстро заражается вселенцами-простейшими. Культуру коловраток транспортируют в пробирках, не допуская перегрева и переохлаждения. Хранить ее без пересева можно в холодильнике при температуре 8 - 10 °С в течение 2 - 3 недель. Период адаптации к лабораторным условиям 3 сут и более.
Для удобства хранения и быстрого получения культуры для экспериментов заготавливают покоящиеся яйца коловраток. Последние либо собирают в водоемах (мелких прудах, лужах), либо получают в лаборатории по следующему способу [2]: коловраток обильно кормят водорослевой пастой в течение 3 - 5 сут, затем кормление прекращают, среду с коловратками отцеживают через сито (газ № 76) и переносят коловраток в чистую воду. Спустя 3 - 4 сут происходит массовый сброс покоящихся яиц, которые высушивают и хранят в бумажных пакетах в холодильнике.
ПРИЛОЖЕНИЕ Т
(обязательное)
Форма записи результатов биотестирования природной воды на коловратках
Таблица Т.1 - Данные биотестирования на коловратках
|
Серия |
№ повторности |
Живые особи, экз. |
Молодь, экз. |
|||||||
|
Время экспозиции, ч |
||||||||||
|
24 |
48 |
72 |
96 |
24 |
48 |
72 |
96 |
|||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
Таблица Т.2 - Результаты биотестирования природной воды на коловратки
|
Водный объект, пункт, место отбора, дата отбора |
Серия |
Снижение выживаемости, % контроля |
Отклонение плодовитости от контроля, % |
Оценка токсичности воды |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Примечание. В графе «Оценка токсичности воды» пишут: «Оказывает (не оказывает) острое, подострое, хроническое токсическое действие». |
|||||
ПРИЛОЖЕНИЕ У
(обязательное)
Форма записи результатов экспресс-биотеста на коловратках
Таблица У.1 - Данные экспресс-биотеста на коловратках
|
№ пробы |
Серия |
№ повторности |
№ счета |
Число клеток микроводорослей в одном большом квадрате камеры Горяева |
Число коловраток в микроаквариуме |
Начало опыта |
Конец опыта |
|||
|
В начале опыта |
В конце опыта |
ч |
мин |
ч |
мин |
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
Таблица У.2 - Результаты экспресс-биотеста природной воды на коловратках
|
Водный объект, пункт, дата отбора |
Серия |
Скорость осветления среды, мкл/(экз. ∙ мин) |
Отклонение скорости осветления среды от контроля, % |
Оценка токсичности воды |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Примечание. В графе «Оценка токсичности воды» пишут: «Оказывает (не оказывает) острое токсическое действие». |
|||||
ПРИЛОЖЕНИЕ
Ф
(информационное)
Характеристика рыб как тест-объектов1
______________
1 Дана по РД 118-02-90.
Ф.1. Характеристика Poecilia reticulata
Систематическое положение:
|
Тип........................................................ |
Chordata |
|
Класс................................................... |
Pisces |
|
Отряд .................................................. |
Cyprinodontiformes |
|
Семейство........................................... |
Poecilidae |
|
Род........................................................ |
Poecilis |
|
Вид....................................................... |
Poecilia reticulata Peters (в дальнейшем гуппи) |
Местообитание. Гуппи - один из распространенных видов аквариумных рыб. В природе они обитают в тропических водоемах, где играют важную экологическую роль, уничтожая москитов и комаров.
Морфология. Гуппи - мелкие рыбы с ярко выраженным половым диморфизмом. Самцы длиной 3 - 4 см обычно мельче самок и окрашены в более яркие цвета. В их окраске преобладают серовато-коричневые тона с очень яркими красными, голубыми, зелеными, черными вкраплениями и точками. Самки достигают 6 см в длину, обычно желтовато-зеленые.
Ф.2. Характеристика Brachydanio rerio
Систематическое положение:
|
Тип......................................................... |
Chordata |
|
Класс..................................................... |
Pisces |
|
Отряд..................................................... |
Cyriniformes |
|
Семейство............................................ |
Cyprinidae |
|
Род.......................................................... |
Brachydanio |
|
Вид......................................................... |
Brachydanio rerio (Hamilton-Buchanan) (в дальнейшем данио) |
Местообитание. Данио - широко распространенная аквариумная рыба. В природе она обитает в медленно текущих водоемах Юго-Восточной Азии.
Морфология, биология. Взрослые особи достигают в длину 4 - 5 см. Тело имеет цилиндрическую форму, серебристое, с семью - девятью темно-синими горизонтальными полосами. Эти полосы идут к хвостовому и анальному плавникам. Спина оливково-зеленая.
Данио исключительно подвижны, ведут стайный образ жизни.
ПРИЛОЖЕНИЕ X
(справочное)
Содержание рыб в лабораторных условиях
Гуппи. Для содержания гуппи используют термостатируемые аквариумы, обеспечивающие плотность размещения тест-объектов из расчета 1 - 2 л воды на 1 экз., для производителей - 4 л на 1 экз. Аквариум размещают в помещении, не содержащем токсических паров или газов, и заполняют водопроводной водой, предварительно отстоянной в течение 3 сут. Вода для содержания гуппи должна отвечать следующим требованиям: жесткость 2,8 - 4,0 ммоль/л, рН = 7,0...8,0, температура 24 - 27 °С. Воду в аквариумах аэрируют с помощью микрокомпрессора. Еженедельно 1/5 объема воды в аквариуме меняют на свежую, температура которой не должна отличаться от температуры воды в аквариуме. Первоначальный объем воды в аквариумах поддерживают, доливая дистиллированную воду вместо испарившейся. Со дна аквариумов регулярно убирают ил с помощью сифона.
Перед размещением рыб в аквариумы сажают мелколистные и плавающие растения. Аквариумы освещают ярким верхним светом не менее 8 ч в сутки. Для этого используют электролампы накаливания или люминесцентные лампы.
Кормят рыб 1 - 2 раза в сутки, производителей кормят 3 - 5 раз в сутки сухим (дафнии, циклопы) или живым кормом (мотыль, трубочник, дафнии, циклопы). По возможности следует избегать сухого корма. Наряду с этим кормом для рыб необходимо дополнительное питание растительной пищей (водорослями, салатом, листьями аквариумных растений и т.п.). Корм вносят в таком количестве, чтобы рыбы съедали его без остатка в течение 3 - 5 мин, так как его излишки приводят к ухудшению качества воды в аквариуме.
Для получения молоди отбирают производителей без признаков заболеваний не старше 2 лет (продолжительность жизни гуппи 3,0 - 3,5 года). Самку, готовую к вымету, помещают в отдельную термостатируемую нерестовую емкость вместимостью не менее 4 л, заполненную водопроводной водой с температурой 25 ± 1 °С и большим количеством мелколистных растений. Готовность самки к вымету мальков определяют по наличию хорошо заметного темного пятна перед анальным плавником. При этом форма брюшка приближается к прямоугольной, и оно становится намного шире спины.
После окончания вымета самок изолируют, так как они поедают потомство.
Мальки рождаются совершенно сформированными. Лучшим кормом для них является «пыль», состоящая из инфузорий, коловраток, молоди ветвистоусых рачков и науплиусов веслоногих рачков. При отсутствии «пыли» молодь кормят перетертыми сухими дафниями или любым другим измельченным сухим кормом. На 100 рыб вносят не более 1 г корма. По мере роста рыб в рацион вводят измельченных трубочников, мотыль, коретру и другой живой корм. Мальков в возрасте 1 - 2 недели кормят до 5 раз в сутки, более взрослых - 2 - 3 раза в сутки. Вносимые порции корма должны быть небольшими и поедаться рыбами в течение 3 - 5 мин.
Мальков сортируют по размерам и постепенно переводят из нерестовых аквариумов в вырастные (вначале вместимостью 50 л, а затем - 200 л). Мальки становятся половозрелыми в 4 - 6 месяцев.
Данио. Рыб содержат в просторных, удлиненных аквариумах, негусто засаженных растениями. Аквариумы заполняют отстоявшейся в течение 3 сут водопроводной водой с температурой 28 ± 1 °С и рН = 7,7...8,2. Воду в аквариумах аэрируют с помощью микрокомпрессоров. Освещение обычное, с естественной сменой дня и ночи. Плотность размещения не более 30 экз. на 70 л воды. Кормят взрослых данио 1 - 2 раза в сутки живым (белые черви, мотыль, дафнии, артемии), а также сухим кормом. Корм в аквариумы вносят в таком количестве, чтобы рыбы съедали его в течение часа без остатка. Еженедельно со дна аквариумов убирают с помощью сифона ил и доливают дистиллированную или свежую отстоявшуюся водопроводную воду до первоначального объема.
Чтобы получить молодь, самок и самцов отделяют друг от друга и кормят живым кормом. Плотность размещения рыб в этот период такая же, как и при содержании. В конце второй недели самцы приобретают густой золотистый блеск, а самки значительно увеличиваются за счет икры.
Аквариум, предназначенный для нереста, наполняют свежей отстоявшейся водопроводной водой с жесткостью не более 4,0 ммоль/л, температурой 27 °С, рН = 6,8...6,9. В аквариум помещают сетку с размером ячеек 3 мм. Сетка предназначена для охраны икры и мальков, так как взрослые рыбы нередко интенсивно их поедают. При размещении сетки следят, чтобы оставалось пространство объемом не менее 1 л для плавания рыб. Утром в нерестовый аквариум помещают самок и кормят сухим кормом. Вечером в этот же аквариум помещают девять самцов, и рыб еще раз кормят. Затем выключают свет. Для стимулирования нереста утром включают свет. После того, как самки отнерестились, взрослых рыб отсаживают, а икринки оставляют развиваться. Через 24 - 36 ч из них выводятся личинки, которые прилипают к стенкам аквариума, а через 4 - 5 сут начинают свободно плавать. С этого момента их начинают кормить: вначале инфузориями, коловратками или личинками низших ракообразных, а затем более крупным кормом. Через месяц молодь данио помещают в 200-литровые аквариумы и кормят смесью живого и другого подходящего корма. Рыб кормят часто и обильно. Через 8 месяца рыбы становятся половозрелыми, их длина достигает 3,5 см.
ПРИЛОЖЕНИЕ
Ц
(обязательное)
Форма записи результатов биотестирования природной воды на рыбах
Таблица Ц.1 - Результаты биотестирования природной воды на рыбах
|
№ пробы |
Водный объект, пункт, створ, дата отбора |
Серия |
Время от начала биотестирования, ч |
Выжившие рыбы, экз. |
Выживаемость рыб, % исходного числа |
Снижение выживаемости, % контроля |
Концентрация кислорода, мг/л |
Оценка токсичности воды |
||
|
Повторность |
Среднее арифметическое |
|||||||||
|
1 |
2 |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
Примечание. В графе «Оценка токсичности воды» пишут: «Оказывает (не оказывает) хроническое токсическое действие». |
||||||||||
ПРИЛОЖЕНИЕ Ш
(обязательное)
Характеристика пробы природной воды и условий отбора
1 Номер пробы.
2 Место отбора пробы воды:
водный объект,
пункт,
створ, горизонт, вертикаль.
3 Дата отбора, время суток.
4 Температура воды, воздуха.
5 Погодные условия.
6 Визуальная характеристика воды:
- органолептические признаки,
- прозрачность,
- характер взвесей (минеральные частицы; частицы глины, песка; ил; растительный детрит; дрифт водорослей; бактериальная слизь и т.д.),
- загрязненность (детрит; обрывки водной растительности,
- пятна нефтепродуктов, пена, хозяйственно-бытовой и другой мусор, отходы производства и т.д.).
7 Санитарное состояние прилегающей к водоему территории.
8 Предварительное заключение о загрязненности водного объекта, пункта, створа (по пунктам).
ПРИЛОЖЕНИЕ Щ
(обязательное)
Результаты биотестирования пробы природной воды
|
1. Проба номер ___________________________________________________________ 2. Биотестирование проведено на ____________________________________________ (дафниях, цериодафниях, водорослях, A-Z-Ph-тесте на водорослях, инфузориях, коловратках, рыбах). 3. Параллельно с биотестированием проведены другие работы: ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ (гидробиологические по фитопланктону, зоопланктону, перифитону, макрозообентосу и т.д.; гидрохимические по показателям, гидрологические) 4. Для контрольной серии при биотестировании использована ___________________________________________________________________________ (отстоявшаяся водопроводная вода, вода из условно чистого створа, указать точно). 5. Обнаружено: острое, подострое токсическое действие в биотесте на __________________________ ___________________________________________________________________________ (наименование биотеста) хроническое токсическое действие в биотесте на ______________________________ ___________________________________________________________________________ (наименование биотеста) Не обнаружено токсического действия ни в одном из биотестов. 6. Общее заключение о токсичности: - вода оказывает/не оказывает острого токсического действия, - вода оказывает/не оказывает подострого токсического действия, - вода оказывает/не оказывает хронического токсического действия. |
ПРИЛОЖЕНИЕ Э
(обязательное)
Форма заключения о токсикологическом состоянии водных экосистем
Таблица Э.1 - Заключение о токсикологическом состоянии водных экосистем
|
№ пробы |
Водный объект, пункт, створ |
Токсикологические параметры по данным биотестирования (по критериям таблицы 8.1) |
Токсикологическое состояние водной экосистемы (по критериям таблицы 8.1) |
|
1 |
2 |
3 |
4 |
|
|
|
|
|
|
|
|
|
|
ПРИЛОЖЕНИЕ Ю
(справочное)
1 Айвазова Л.E., Гроздов А.О., Соколова С.А., Новосадова Т.Г. и др. Метод биотестирования водной среды с использованием инфузорий // Методы биотестирования вод. - Черноголовка: Изд. ин-та хим. физики АН СССР, 1988. - С. 37 - 42.
3 Банина Н.Н. Тип «инфузории» // Фауна аэротенков. Атлас. - Л., 1984. - С. 136 - 186.
4 Богословский А.С. Материалы к изучению покоящихся яиц коловраток (сообщение 1) // МОИП. Отд. биол. - 1963. - Т. 65, № 6. - С. 50 - 67.
7 Зенин А.А., Белоусова Н.В. Гидрохимический словарь. - Л.: Гидрометеоиздат, 1988. - 238 с.
9 Кутикова Л.А. Класс коловратки // Фауна аэротенков. Атлас. - Л., 1984. - С. 187 - 241.
12 Сущеня Л.М. Количественные закономерности питания ракообразных. - Минск, 1975. - 346 с.
13 Corliss J.О. The ciliated protozoa: characterisation, classification and guide to the literature. - NY, London, 1979. - 455 p.
ЛИСТ РЕГИСТРАЦИИ ИЗМЕНЕНИЙ
|
Номер изменения |
Номер страницы |
Номер документа |
Подпись |
Дата внесения изменения |
Дата введения изменения |
|||
|
измененной |
замененной |
новой |
аннулированной |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 (7.2)
(7.2)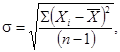 (8.2)
(8.2)