ФЕДЕРАЛЬНАЯ СЛУЖБА ПО ГИДРОМЕТЕОРОЛОГИИ
И МОНИТОРИНГУ ОКРУЖАЮЩЕЙ СРЕДЫ
(РОСГИДРОМЕТ)
РЕКОМЕНДАЦИИ |
РД |
ОЦЕНКА ТОКСИЧЕСКОГО ЗАГРЯЗНЕНИЯ
ПРИРОДНЫХ ВОД И ДОННЫХ ОТЛОЖЕНИЙ
ПРЕСНОВОДНЫХ ЭКОСИСТЕМ
МЕТОДАМИ
БИОТЕСТИРОВАНИЯ
С ИСПОЛЬЗОВАНИЕМ КОЛОВРАТОК
Москва
МЕТЕОАГЕНТСТВО РОСГИДРОМЕТА
2006
Предисловие
|
1 РАЗРАБОТАН |
Гидрохимическим институтом (ГХИ) Федеральной службы по гидрометеорологии и мониторингу окружающей среды (Росгидромет) |
|
2 РАЗРАБОТЧИКИ |
A.M. Никаноров, чл.-кор. РАН, руководитель разработки; Е.Н. Бакаева, д-р. биол. наук; Н.А. Игнатова; Л.М. Ходурская |
|
3 УТВЕРЖДЕН |
Зам. Руководителя Росгидромета Ю.С. Цатуров 28.10.2004 г. |
|
наименование должности лица, утвердившего документ личной подписью дата |
|
|
4 ЗАРЕГИСТРИРОВАН |
ГУ ЦКБ ГМП за номером Р 52.24.622-2004 от 23.11.2004 г. |
|
5 ВВЕДЕН ВПЕРВЫЕ |
СОДЕРЖАНИЕ
Введение
В настоящее время общепризнана необходимость введения нового вида контроля качества вод - биотестирование на токсичность, - интегральный показатель, отражающий реальную картину токсического загрязнения водных объектов.
В ряде научно-исследовательских учреждений проведены исследования по разработке методов оценки качества вод. Сложнее обстоит дело с оценкой качества донных отложений.
Донные отложения являются наиболее загрязненным компонентом водных экосистем, именно они кумулируют все виды загрязняющих веществ, поступающих с речным стоком, атмосферными осадками, отмершими растительными и животными организмами, а также с техногенными материалами хозяйственной деятельности человека. Наряду с этим биодоступность связанных с донными отложениями токсических веществ для представителей бентоса, в которых происходит накопление ксенбиотиков, приводит, как минимум к снижению их продуктивности. Взмучивание в результате ветровой и волновой деятельности, а также турбулентного перемешивания вод, является источником вторичного загрязнения толщи воды. Это приводит к ухудшению качества обеих составляющих водной экосистемы - водной и донной, к снижению биологического разнообразия за счет выпадения из состава экосистем наиболее чувствительных к токсическому загрязнению видов, в том числе ценных промысловых рыб. В конечном итоге наблюдаются процессы деградации водных экосистем, приводящие к потере хозяйственного значения водных ресурсов.
Оценка токсического загрязнения донных отложений основана на трех подходах. На химическом (анализе концентрации токсических веществ в донных отложениях) и двух биологических - биоиндикации и биотестировании. Оценка токсичности донных отложений с помощью биотестирования широко применяется за рубежом, но не нашла должного применения в системе государственного мониторинга поверхностных вод суши (ПВС) Росгидромета. В организациях других ведомств используются различные методические подходы и приемы биотестирования. Для проведения токсикологической оценки загрязнения водной экосистемы в системе мониторинга ПВС Росгидромета Гидрохимическим институтом разработана методическая база и подготовлены рекомендации Р 52.24.566-94, для оценки донной составляющей - РД 52.24.635-2002, включающий один биотест на хирономидах.
Целью настоящих рекомендаций является совершенствование методической базы мониторинга токсического загрязнения природных вод и донных отложений, осуществляемого в рамках мониторинга ПВС Росгидрометом, путем биотестирования с использованием коловраток (с учетом эколого-биологических особенностей их жизнедеятельности).
Совершенствование методической базы биотестирования подразумевает расширение круга тест-объектов, отвечающих основным критериям видов-индикаторов, учет специфики оценки качества природных вод и донных отложений и обеспечение качества биологической информации. Эти направления требуют поиска новых представительных тест-объектов и глубокое знание их эколого-биологических особенностей. Имеющиеся сведения о значимости коловраток (кл. Rotatoria) как гетеротрофного звена в планктоценозах, результаты спонтанных попыток применения их для оценки воздействия токсических веществ позволяют считать представителей класса коловраток перспективными для биотестирования. Представители кл. Rotatoria имеют ряд преимуществ перед тест-объектом Daphnia magna. Преимущества методов биотестирования с использованием коловратки Brachionus calyciflorus состоят в следующем:
- они более экспрессны (определение острой токсичности возможно за 2 - 24 ч, хронической токсичности - за 5 - 7 сут; с использованием дафний - за 96 ч и более 30 сут);
- они компактны (могут использоваться в полевых условиях);
- возможно проведение анализов микрообъемов воды (от 2 - 5 мл, для дафний требуется 1 - 1,5 л воды для анализа одной пробы);
- возможно проведение непрерывных анализов (нет необходимости в постановке отдельных экспериментов по установлению острой, подострой и хронической токсичности воды).
Использование рекомендаций позволит проводить оценку токсичности проб природных вод и донных отложений, выделять участки токсического загрязнения и накопления токсичных загрязняющих веществ в донных отложениях, оценивать уровень токсического загрязнения водной и донной составляющих экосистемы, а также состояние экосистемы водного объекта в целом, на основе гарантированной биологической информации.
Рекомендации разработаны на основе собственных исследований, а также опубликованных данных. При разработке рекомендаций учтены нормативно-методические документы и стандарты, связанные с изучаемой проблемой.
РЕКОМЕНДАЦИИ
|
ОЦЕНКА ТОКСИЧЕСКОГО ЗАГРЯЗНЕНИЯ |
Дата введения 2006-01-01
1 Область применения
В настоящих рекомендациях приводятся методики и порядок проведения оценки токсического загрязнения природных вод и донных отложений пресноводных экосистем в системе мониторинга поверхностных вод суши на основе биотестирования с использованием в качестве тест-объекта коловраток (кл. Rotatoria).
Рекомендации предназначены для оперативно-производственных подразделений территориальных управлений по гидрометеорологии и мониторингу окружающей среды (УГМС) Росгидромета, осуществляющих организацию и проведение наблюдений за состоянием поверхностных вод суши в рамках Государственной службы наблюдений (ГСН) России.
Рекомендации могут быть использованы в природоохранных учреждениях, осуществляющих наблюдения за загрязнением природной среды, в качестве методического пособия специалистами и практическими работниками, а также для оценки токсичности природных вод и донных отложений при дноуглубительных работах и техногенно загрязненных почв.
2 Нормативные ссылки
2.1 В настоящих рекомендациях использованы ссылки на следующие нормативные документы
ГОСТ 17.1.1.01-77 Использование и охрана вод. Основные термины и определения
ГОСТ 17.1.1.07-77 Охрана природы. Гидросфера. Использование и охрана вод. Основные термины и определения
ГОСТ 17.1.3.07-82 Охрана природы. Гидросфера. Правила контроля качества воды водоемов и водотоков
ГОСТ 17.1.5.04-81 Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ 19179-73 Гидрология суши. Термины и определения
ГОСТ 27065-86 Качество вод. Термины и определения
РД 52.18.595-96 Федеральный перечень методик выполнения измерений, допущенных к применению при выполнении работ в области мониторинга загрязнения окружающей природной среды
РД 52.24.309-92 Методические указания. Охрана природы. Гидросфера. Организация и проведение режимных наблюдений за загрязнением поверхностных вод суши на сети Роскомгидромета
Р 52.24.566-94 Методы токсикологической оценки загрязнения пресноводных экосистем
РД 52.24.635-2002 Методические указания. Проведение наблюдений за токсическим загрязнением донных отложений в пресноводных экосистемах на основе биотестирования
РД 52.24.609-99 Методические указания. Охрана природы. Гидросфера. Организация и проведение наблюдений за содержанием загрязняющих веществ в донных отложениях
РД 118-02-90 Методическое руководство по биотестированию воды
2.2 Ссылки на остальные стандарты (технические условия) приведены в подразделах 10.2, 11.2, 12.2.
3 Термины и определения, обозначения
В настоящих рекомендациях использованы следующие термины и определения:
3.1 Анализ проб воды - определение физических, физико-химических, химических, биологических, токсических свойств и состава воды [1].
3.2 Биотестирование (биологическое тестирование) - оценка качества объектов окружающей среды (воды и др.) по ответным реакциям живых организмов, являющихся тест-объектами (РД 52.24.635).
3.3 Биотест - совокупность приемов получения информации о токсичности воды (донных отложений) для гидробионтов на основе регистрации реакций тест-объекта (Р 52.24.566).
3.4 Водный объект - сосредоточение вод на поверхности суши в формах ее рельефа, либо в недрах, имеющее границы, объем и черты водного режима [2].
3.5 Диапазон реагирования - интервал значений концентраций эталонного токсического вещества, в пределах которого результат биотестирования является надежным.
3.6 Донные отложения - донные наносы и твердые частицы, образовавшиеся и осевшие на дно в результате внутриводоемных процессов, в которых участвуют вещества как естественного, так и антропогенного происхождения [1].
3.7 Загрязнение воды водоемов и водотоков - процесс изменения состава и свойств воды водоемов и водотоков под влиянием поступающих в воду загрязняющих веществ, микроорганизмов, тепла, приводящих к ухудшению качества воды (РД 52.24.309).
3.8 Загрязнение токсическое - загрязнение воды водоемов и водотоков токсичными веществами.
3.9 Качество воды - характеристика состава и свойств воды, определяющая пригодность ее для конкретных видов водопользования (ГОСТ 17.1.1.07).
3.10 Контроль качества воды - проверка соответствия показателей качества воды установленным нормам и требованиям (ГОСТ 27065).
3.11 Критерий токсичности - значение показателя токсичности, на основании которого судят о наличии токсического действия (РД 118-02).
3.12 Метрологическая характеристика метода - характеристика чувствительности метода, определяемая для тест-объекта по LC50 при воздействии эталонного токсиканта (медь (II) сернокислая, калий двухромовокислый).
3.13 «Нативная» проба донных отложений - проба донных отложений без какой-либо дополнительной предварительной обработки.
3.14 Нормы качества воды - установленные значения показателей качества воды для конкретных видов водопользования (ГОСТ 27065).
3.15 Острое токсическое воздействие (острая токсичность) - воздействие, вызывающее быструю ответную реакцию тест-объекта. Острое токсическое действие чаще всего определяют по тест-реакции «гибель» или «выживаемость» в условиях кратковременного биотестирования. При использовании коловраток и других организмов микрозоопланктона длительность воздействия составляет 6 - 24 ч.
3.16 Показатель токсичности - признак тест-объекта, используемый для оценки токсичности воды (РД 118-02).
3.17 Поверхностные воды - воды, находящиеся на поверхности суши в виде различных водных объектов (ГОСТ 19179).
3.18 Природные воды - воды Земли с содержащимися в них твердыми, жидкими и газообразными веществами (ГОСТ 19179).
3.19 Проба воды - количество воды, предназначенное для исследования.
3.20 Пункт наблюдений за загрязнением поверхностных вод суши Государственной сети наблюдений Росгидромета - место на водоеме или водотоке, где проводят комплекс работ для получения данных о качестве воды или донных отложений (РД 52.24.635).
3.21 Результат биотестирования - конечный вывод о токсичности водной среды, сделанный в ходе биотестирования.
3.22 Состояние водного объекта - характеристика водного объекта по совокупности его количественных и качественных показателей применительно к видам водопользования (ГОСТ 17.1.1.01).
3.23 Створ пункта наблюдений за загрязнением поверхностных вод суши ГСН Росгидромета - условное поперечное сечение водоема или водотока, в котором производят комплекс работ для получения данных о показателях состава и свойств воды (РД 52.24.635).
3.24 Тест-объект - организм, который используют при биотестировании (инфузории, дафнии и т.д.) (Р 52.24.566).
3.25 Токсикология водная - наука о токсичности водной среды, в том числе природной или сточной воды, для гидробионтов [3].
3.26 Токсичность воды (донных отложений) - свойство воды (донных отложений) вызывать патологические изменения в организмах или гибель, обусловленные присутствием в ней токсичных веществ (РД 118-02).
3.27 Токсикологический эксперимент - эксперимент, в ходе которого оценивают влияние на тест-объект испытываемой воды или химического соединения. Состоит из двух серий: опыт (с воздействием воды или химического соединения) и контроль (без воздействия, но в тех же условиях) (Р 52.24.566).
3.28 Точка отбора проб - точно зафиксированное местоположение отбора пробы воды или донных отложений (РД 52.24.635).
3.29 Условно чистый участок водного объекта - обычно это фоновый створ.
3.30 Фоновый створ - створ, расположенный на расстоянии не менее 1 км выше источника загрязнения (Р 52.24.566).
3.31 Хроническое токсическое воздействие (хроническая токсичность) - воздействие, вызывающее ответную реакцию тест-объекта, проявляющуюся в течение относительно длительного периода времени. Хроническое токсическое воздействие измеряют по тест-показателям «выживаемость», «плодовитость», «изменение роста» и другим реакциям при длительном биотестировании (Р 52.24.566).
3.32 Чувствительность тест-объекта - нижняя граница диапазона действия эталонного токсического вещества, при которой обнаруживают параметры его токсичности на тест-объект.
3.33 Экологическое благополучие водного объекта - нормальное воспроизведение основных звеньев экологической системы водного объекта (Р 52.24.566).
3.34 Экспозиция - период времени, в течение которого организм находится под воздействием исследуемого фактора, в частности под воздействием химического вещества. В зависимости от экспозиции различают острое или хроническое токсическое воздействие (РД 52.24.635).
3.35 Эталонное токсическое вещество - токсическое вещество, используемое для проверки чувствительности биотеста или тест-объекта (РД 52.24.566).
3.36 LC50 - концентрация токсиканта, приводящая к гибели 50 % взятой для эксперимента выборки.
4 Общие положения
4.1 В данных рекомендациях сделан первый шаг по созданию универсального метода биотестирования, основанного на использовании особенностей жизнедеятельности коловраток (кл. Rotatoria) - микроскопических червей с коротким жизненным циклом развития и высокой скоростью оборачиваемости популяции. Обоснование использования представителей класса коловраток в токсикологических исследованиях и критерии выбора видов-индикаторов изложены в приложении А.
4.2 Универсальность метода биотестирования на коловратках заключается в том, что он основан на использовании покоящихся яиц [4]. Покоящиеся яйца - это стадия жизненного цикла коловраток (см. приложения Б, В). Методической базой получения покоящихся яиц конкретного вида - Brachionus calyciflorus - могут служить работы по аквакультуре коловраток [5 - 8].
4.3 Биотестирование природных вод и донных отложений используют при проведении режимных наблюдений и для решения оперативных задач с целью проверки соответствия качества вод и донных отложений отдельных проб установленным нормам. В режимных наблюдениях на основе систематических данных биотестирования оценивают токсическое загрязнение водных объектов или их участков. В ходе решения оперативных задач оценивают токсичность отдельных проб воды с целью выяснения чрезвычайных экологических ситуаций.
4.4 В принятом на сегодняшний день перечне нормирования показателей качества вод указано, что вода контрольного створа (природная вода) не должна оказывать токсического - хронического и тем более острого действия на тест-объекты, используемые для биотестирования [9].
4.5 В ходе биотестирования воды и донных отложений устанавливают отсутствие или наличие токсического (острого, подострого, хронического) действия испытываемой пробы для биологических объектов, без идентификации загрязняющих веществ и их количественных характеристик [9].
4.6 Биотестирование природных вод и донных отложений основано на определении показателей токсичности опытной пробы воды и донных отложений, взятой в зоне влияния источника загрязнения, и их отличий от контрольной пробы, отобранной на условно чистом участке водного объекта.
4.7 Биотестирование токсичности природных вод и донных отложений направлено на решение задач различного уровня. Биотестовые исследования дают возможность определить:
- токсичность пробы воды и донных отложений;
- участки накопления токсичных загрязняющих веществ в донных отложениях;
- влияние источников загрязнения на состояние водной и донной составляющих водного объекта;
- отдельно уровень токсического загрязнения водной среды и донных отложений экосистемы водного объекта;
- в целом уровень токсического загрязнения экосистемы водного объекта;
- эколого-токсикологическое состояние водного объекта в комплексе с методами биоиндикационными и физико-химическими исследованиями;
- токсичность донных отложений при дампинговых работах в водных объектах;
- оценить токсичность проб техногенно загрязненных почво-грунтов.
4.8 Объективную оценку токсического загрязнения получают:
- с помощью набора биотестов (методик) с различными тест-объектами, желательно, представителями разного трофического и систематического уровня (например, микроводоросли, дафнии, рыбы, инфузории, коловратки и т.д.);
- с помощью набора биотестов на основе различных тест-реакций одного тест-объекта, (например, пищевая активность, гибель, плодовитость коловраток или фотосинтез, концентрация хлорофилла, интенсивность прироста микроводорослей);
- получают наиболее точную оценку по комплексу показателей гибели и плодовитости тест-объекта в сочетании с экспозицией (см. раздел 12).
5 Основные принципы биотестирования природных вод
Методы биотестирования природных вод имеют ряд общих принципов с методами биотестирования сточных вод, но имеют и существенные особенности:
- необходимость четких стандартных условий и процедуры биотестирования в связи с относительно низкими концентрациями загрязняющих веществ и влиянием естественных физико-химических параметров водной среды;
- использование двух контрольных серий (на дехлорированной водопроводной воде исследуемого региона и на воде фонового створа);
- обязательное наличие данных о параметрах гидрохимического режима водного объекта и использование исследуемой воды с теми же параметрами;
- биотестирование проводят на нефильтрованной воде, при наличии взвешенных частиц - на нефильтрованной и фильтрованной;
- возможность проведения непрерывного биотестирования (без постановки отдельных экспериментов по установлению острого и хронического токсического воздействия, т.е. при отсутствии острого токсического воздействия в кратковременном опыте можно продолжить этот опыт без замены среды и популяций тест-объектов в длительном эксперименте по определению хронического токсического действия).
6 Основные принципы биотестирования донных отложений
Методы биотестирования донных отложений имеют ряд общих принципов с методами биотестирования природных вод, но имеют и свою специфику:
а) в зависимости от поставленных задач и имеющихся в наличии тест-объектов биотестирование проводят:
- на нативной пробе донных отложений, для анализа такой пробы желательно использовать в качестве тест-объектов представителей бентоса, т.е. организмы, для которых естественной средой обитания являются донные отложения (например, хирономиды, моллюски);
- на водной вытяжке (экстракте) донных отложений, для анализа такой пробы можно использовать любые тест-объекты;
б) использование в контрольной серии донных отложений с фонового участка, имеющих идентичный тип грунта (ил, песок), гранулометрический состав и, желательно, уровень органического загрязнения;
в) получение вытяжек донных отложения в зависимости от их типа (песок, ил, ракушечник) имеет особенности.
7 Сеть пунктов и программы наблюдений
В системе мониторинга поверхностных вод суши режимные наблюдения за состоянием водных объектов по показателям токсичности с использованием методов биотестирования проводят по программам работ территориальных УГМС в соответствии с требованиями РД 52.24.309 - для поверхностных вод суши и РД 52.24.609, РД 52.24.635 - для донных отложений.
8 Отбор, хранение и подготовка проб природной воды для биотестирования
8.1 Пробы природной воды отбирают с учетом требований ГОСТ 17.1.5.05 и Р 52.24.566.
8.2 Объем пробы должны быть не менее 50,0 мл.
8.3 Сосуды должны быть из материала, не содержащего токсичных примесей (полиэтиленовые емкости для пищевых продуктов, стеклянные баллоны и бутыли).
8.4 Сосуды необходимо маркировать.
8.5 Перед заполнением сосудов воду фильтруют через газ № 70 - 76 (для удаления природного планктона) и несколько раз ополаскивают сосуд. Сосуд заполняют водой полностью.
8.6 Анализ проб по определению токсичности воды проводят не позднее 6 ч после их отбора.
8.7 В случае невозможности проведения исследований за указанный в п. 8.6 срок пробы охлаждают до +4 °С или замораживают, согласно РД 52.24.309, и хранят до 30 сут.
8.8 Консервирование проб химическими веществами не допускается.
8.9 Перед биотестированием измеряют концентрацию кислорода и значения рН (с целью дифференциации токсического воздействия каких-либо загрязняющих веществ и измеренных значений рН и кислорода, если эти параметры не обеспечивают нормальной жизнедеятельности гидробионтов).
8.10 Пробу делят на две части: для проведения биотеста на фильтрованной воде (пропущенной через бумажный фильтр для удаления из нее взвешенных веществ) и на нефильтрованной.
9 Отбор, хранение и подготовка проб донных отложений для биотестирования
9.1 Отбор проб донных отложений проводят согласно РД 52.24.635, РД 52.24.609, используя способы и устройства, предусмотренные РД 52.24.609.
9.1.1 Помимо проб донных отложений, для токсикологического анализа обязательно отбирают воду на этом же участке, желательно из придонного слоя согласно ГОСТ 17.1.5.04, ГОСТ 17.1.5.05 для подготовки пробы донных отложений, получения вытяжек, разбавления и т.д.
9.1.2 Отобранные пробы донных отложений помещают в чистые пластиковые мешки или пластиковые (стеклянные) банки с широким горлом, в которых доставляют их в лабораторию.
9.1.3 Пробы не консервируют.
9.2 Хранят пробы во влажном состоянии не более 1 сут при температуре не выше 2 - 4 °С. Сразу после отбора пробы помещают в холодильник или в прохладное место на борту экспедиционного судна.
9.2.1 Биотестирование проводят не позднее, чем через 1 сут.
9.2.2 Допустимо замораживание проб. В замороженном состоянии пробы можно хранить в течение 60 сут при температуре минус 15 - 20 °С.
9.3 Подготовку опытной пробы и контрольной, отобранной на фоновом створе, проводят одновременно с помощью одних и тех же процедур.
9.4 Каждая опытная проба должна сопровождаться отбором контрольной пробы с идентичным типом и характеристиками донных отложений. Если тип донных отложений в опытных пробах различен, то к каждой опытной пробе необходимо ставить свой контроль.
9.5 Подготовка проб для разных вариантов биотестирования (нативная проба и водная вытяжка) основана на следующем.
9.5.1 Биотестирование проводят на пробах с естественной влажностью (без высушивания).
9.5.2 Для биотестирования нативной пробы ее во влажном состоянии просеивают через сито с порами от 0,5 до 1,5 мм для удаления обломков раковин, камней, водорослей и отмерших организмов, используя природную воду, отобранную одновременно с донными отложениями. Количество используемой для этой процедуры воды должно быть минимальным. Дают воде и полученному осадку отстояться в течение 6 ч. Сливают с помощью сифона большую часть воды в сосуд и сохраняют ее. Осадок перемешивают с оставшейся водой и используют для анализа.
Осадок можно хранить во влажных условиях при температуре от 2 до 4 °С не более 1 суток. Допускается замораживание осадка при температуре от минус 15 до минус 20 °С и хранение его в течение 60 сут (по РД 52.24.635), если невозможно провести биотестирование в течение указанного времени.
Наиболее объективную оценку токсического загрязнения донных отложений получают при проведении биотестирования непосредственно после отбора проб.
9.5.3 Для биотестирования водной вытяжки полученный осадок (по 9.5.2) помещают в чашки Петри и оставляют на воздухе при температуре (20 ± 5)°С для получения воздушно-сухой пробы. К навеске массой 100 г добавляют природную воду (отобранную с фонового участка, или отстоявшуюся водопроводную воду), в соотношении 1:4, согласно РД 52.24.635, или 1:5. Водный экстракт можно получить либо центрифугированием в течение 15 мин при 3000 об./мин, согласно РД 52.24.635, либо встряхиванием на шейкере в течение 1 ч с частотой 150 раз в минуту, или вручную в течение 1 ч.
Одну часть (1/2) водной вытяжки используют без фильтрования для анализа токсичности, обусловленной взвешенными веществами. Другую часть (1/2) фильтруют через бумажный фильтр до получения прозрачного фильтрата для оценки токсичности, обусловленной присутствием растворенных в воде загрязняющих веществ.
9.6 Биотестирование водной вытяжки донных отложений проводят с использованием любых тест-объектов, в том числе коловраток.
9.7 Биотестирование нативной необработанной пробы донных отложений проводят с использованием хирономид по РД 52.24.635.
10 Биотест по пищевой активности коловраток
10.1 Принцип метода
Метод основан на оценке влияния исследуемой воды и фильтрованной водной вытяжки донных отложений, отобранных из водоемов и водотоков, на функцию питания лабораторной культуры коловраток. Влияние исследуемой воды оценивают по изменению показателя скорости осветления среды с микроводорослями коловратками по сравнению с контрольной пробой.
Показатель скорости осветления среды (СОС) - это объем среды, который осветляет одна коловратка в единицу времени, потребляя микроводоросли.
В ходе опыта устанавливают острое токсическое действие. Длительность биотестирования составляет 30 мин.
Критерием токсичности является отклонение показателя СОС коловратками на 50 % и более по сравнению с контролем.
Метод удобно использовать при оперативных наблюдениях для получения экспресс-информации о токсическом загрязнении проб воды и донных отложений.
10.2 Материалы, оборудование, реактивы
1 Культура коловраток Brachionus calyciflorus Pallas. Основные характеристики вида, источники получения культуры, условия культивирования и содержания даны в приложениях Б, В и Г.
2 Культура одноклеточных протококковых водорослей родов Chlorella и Scenedesmus. Источники получения, культивирование и содержание изложено в Р 52.24.566.
3 Микроскоп по ГОСТ 8074-82.
4 Камера Горяева по ТУ 64-1-816-77.
5 Емкости вместимостью 0,2 - 0,5 л по ГОСТ 23932-90.
6 Чашки Петри по ГОСТ 25336-82.
7 Микроаквариумы (обрезанные флаконы из-под антибиотиков объемом 2 мл).
8 Пипетки капиллярные (обрезанные с обеих сторон пастеровские пипетки) или глазные пипетки с оттянутым носиком по ГОСТ 29230-91.
9 Секундомер механический «Слава» СО СПР-6А-1-000 по ТУ 25-1819.0021-90.
10 Центрифуга ЦЛН-2.
11 Вата медицинская гигроскопическая по ГОСТ 5556-81.
12 Марля медицинская по ГОСТ 9412-93.
13 Стекла предметные для микропрепаратов по ГОСТ 9284-75.
14 Стекла покровные для микропрепаратов по ГОСТ 6672-75.
10.3 Подготовка и проведение биотестирования
Перед проведением биотестирования проводят проверку чувствительности культуры коловраток согласно приложению Д.
Объем пробы воды для биотестирования составляет 50,0 мл.
Для расчета показателя СОС считают количество клеток микроводорослей в начале и в конце эксперимента.
Под микроскопом с помощью капиллярной пипетки отсаживают в микроаквариумы по 10 коловраток. Избыток попавшей с коловратками воды убирают с помощью фильтровальной бумаги. В опытные микроаквариумы добавляют 1,0 мл испытываемой воды. В контрольную пробу К1 добавляют дехлорированную водопроводную воду, в К2 - природную воду из фонового створа водоема. Каждую серию ставят в двух повторностях.
В каждый микроаквариум вносят 0,5 мл суспензии микроводорослей. Для удобства подсчета микроводорослей их вносят в каждый микроаквариум с интервалом времени порядка 10 мин. Концентрация вносимой хлореллы должна быть не ниже 2 млн.кл./мл. Если плотность микроводорослей низка, то их концентрируют с помощью центрифуги ЦЛН-2.
Микроаквариумы помещают в чашки Петри и накрывают листом темной бумаги, чтобы предотвратить фотосинтез микроводорослей.
10.4 Регистрация численности микроводорослей
Для определения показателя СОС подсчитывают количество клеток микроводорослей сразу после внесения их в микроаквариумы с коловратками и по истечении 30 мин.
Количество клеток микроводорослей определяют с помощью камеры Горяева, по 10 большим квадратам (увеличение 10×20). Подсчет ведут в трех пробах из каждого микроаквариума.
Внесение микроводорослей с интервалом времени порядка 10 минут удобно при подсчете их в камере Горяева. При определенном навыке интервал в подсчете повторностей составляет 0,5 - 1,0 мин.
Данные биотестирования (число клеток микроводорослей в начале и в конце опыта, а также время начала и окончания опыта) регистрируют.
10.5 Обработка результатов, расчеты и оценка токсического загрязнения
Токсическое загрязнение воды испытываемой пробы или фильтрованной водной вытяжки донных отложений оценивают по изменению отклонения скорости осветления среды от контрольной пробы. Для этого вначале рассчитывают показатель СОС мкл/(экз.×мин) в каждой серии опыта по формуле
СОС = [(C0 - Ct)/(C0 - N · t)] · V, (10.1)
где С0 и Ct - количество клеток микроводорослей в одном большом квадрате камеры Горяева в начале и в конце опыта соответственно;
N - количество коловраток в микроаквариуме, экз.;
t - время опыта, мин;
V - объем воды в микроаквариуме, мкл.
Поскольку при биотестировании объем среды, в котором находятся коловратки (1500 мкл), число коловраток (10 экз.) и время опыта (30 мин) одинаковы во всех сериях, то для определения СОС можно использовать упрощенную формулу:
СОС = (С0 - Сt)/С0. (10.2)
Количество клеток водорослей в одном большом квадрате камеры Горяева получают как среднее арифметическое из количества клеток в 10 больших квадратах камеры. Затем рассчитывают отклонение СОС (X %) в опытных вариантах от контрольного варианта по формуле
X = [(СОС0 - СОСК)/СОСК] · 100, (10.3)
где СОС0 и СОСК - значение СОС в опытном в контрольном варианте соответственно.
Отклонения могут быть положительными или отрицательными, так как токсическое действие может проявляться как в увеличении, так и в уменьшении СОС.
Если отклонение достигает ± 50 % и более, то это указывает на острое токсическое воздействие испытываемой воды.
Чтобы выбрать контроль для расчета отклонения показателя СОС в опыте, сравнивают показатели СОС двух контролей, рассчитывая отклонение СОС. Если отклонение СОС не превышает 25 %, то для оценки токсичности проб в качестве контроля используют природную воду из фонового створа. В противном случае используют данные контроля на водопроводной воде.
11 Биотест с использованием покоящихся яиц коловратки Brachionus calyciflorus
11.1 Принцип метода
Метод основан на оценке влияния испытываемой воды и водной вытяжки донных отложений, отобранных из водоемов и водотоков, на покоящиеся яйца коловраток. Влияние испытываемой пробы оценивают по изменению - по сравнению с контрольной - выклева коловраток из покоящихся яиц при экспозиции последних в испытываемой пробе.
Острое и хроническое токсическое воздействие испытываемой пробы устанавливают в ходе одного опыта. Острое токсическое воздействие определяют за время экспозиции 24 ч, хроническое - за 72 ч.
Критерием токсичности является отклонение выклева коловраток из покоящихся яиц на 25 % и более по сравнению с контролем.
Метод удобно использовать для получения экспресс-информации о токсическом загрязнении проб воды и донных отложений, а также в режимных наблюдениях.
11.2 Материалы, оборудование, реактивы
11.2.1 Покоящиеся яйца коловраток Brachionus calyciflorus Pallas. Описание основных характеристик вида, жизненного цикла коловраток (брахионид), определитель состава популяции данного вида, источники получения покоящихся яиц и способы их хранения даны в приложениях Б, В, Ж, И.
11.2.2 Сухие пекарские дрожжи.
11.2.3 Микроскоп по ГОСТ 8074-82.
11.2.4 Микроаквариумы (обрезанные флаконы из-под антибиотиков вместимостью 2 мл) или конволюты из-под лекарств.
11.2.5 Весы лабораторные по ГОСТ 24104-2001.
11.2.6 Лампы люминесцентные по ГОСТ 6825-91.
11.3 Подготовка к биотестированию
11.3.1 Получение культуры покоящихся яиц
Для биотестирования используют покоящиеся яйца коловратки Brachionus calyciflorus. Лучше использовать покоящиеся яйца, полученные искусственным путем, поскольку точно известны условия их культивирования. Способ получения покоящихся яиц в лабораторных условиях изложен в приложении Ж.
Можно использовать покоящиеся яйца, собранные в естественных водоемах (прудах, на мелководьях рек). Гидробиолог легко определит покоящиеся яйца данного вида коловраток согласно определителю, приведенному в приложении И.
11.3.2 Проверка пригодности покоящихся яиц коловраток для биотестирования
Первоначально под микроскопом визуально проверяют целостность покрова покоящихся яиц (см. рисунки И.1 - И.4 приложения И). Для опыта берут яйца без поврежденной оболочки. Отбирают по 50 - 100 штук, помещают их в микроаквариумы с отстоявшейся водопроводной водой, затем под люминесцентные лампы или под лампы накаливания. Через сутки подсчитывают количество выклюнувшейся молоди. Если количество молоди составляет более 50 %, то покоящиеся яйца можно использовать для биотестирования.
11.3.3 Чувствительность популяции
В случае более 50 %-го выклева молоди из покоящихся яиц их можно использовать для экспериментов. Дальнейшей проверки чувствительности к какому-либо эталонному токсическому веществу не требуется. Односуточные особи наиболее чувствительны к действию испытываемых водных сред.
11.4 Проведение биотестирования
Для биотестирования либо отсчитывают по 50 - 100 штук покоящихся яиц, используя бинокулярную лупу. Либо берут навеску покоящихся яиц массой 0,1 - 0,2 мг, и помещают их в микроаквариум. В опытные микроаквариумы добавляют по 2 мл испытываемой воды, в контрольные микроаквариумы - отстоявшуюся водопроводную воду (контроль К1) и природную воду из фонового створа (контроль К2). Каждую пробу воды делают не менее чем в двух таких повторностях.
Все взятые в эксперимент микроаквариумы помещают под люминесцентные лампы или под лампы накаливания.
11.5 Регистрация показателя количества выклева коловраток
Подсчет количества выклюнувшихся из покоящихся яиц коловраток (показатель выклева) проводят через 24, 48 и 72 ч с помощью микроскопа при увеличении 2×14. Выклюнувшаяся молодь подвижна и легко регистрируется визуально (см. приложение И). Молодь следует отсаживать.
11.6 Обработка результатов, расчеты и оценка токсического загрязнения
Оценку токсического загрязнения с использованием покоящихся яиц коловраток проводят по показателю количества выклева коловраток в сравнении с контрольным значением. Расчет отклонения количества (X %) выклюнувшейся молоди в опыте от контрольного значения проводят по формуле:
![]() 11.1
11.1
где N0 и Nk - количество выклюнувшейся молоди (экз.) в опыте и контроле соответственно.
Как уменьшение, так и увеличение выклева коловраток из покоящихся яиц в опыте свидетельствует о наличии токсического действия испытываемой пробы. Стимуляция выклева может происходить за счет воздействия на оболочку покоящихся яиц некоторых химических веществ, а также интенсивного биологического воздействия микроорганизмов. Поэтому важно проверять выживаемость выклюнувшейся молоди коловраток.
При обработке результатов биотестирования вначале сравнивают показатели выклева молоди из покоящихся яиц в контрольных сериях К1 и К2. Если отклонение показателя выклева молоди коловраток в опытной серии составляет 25 % и более, то воду оценивают как токсичную. Если через 24 ч экспозиции отклонение составляет 25 % и более, то считается, что вода оказывает острое токсическое воздействие, через 48 и 72 ч - хроническое токсическое воздействие. Более детальное определение токсического действия проводят уже на вегетирующей популяции коловраток с использованием комплекса показателей (плодовитости и гибели), (см. раздел 12).
12 Биотест по выживаемости и плодовитости коловраток
12.1 Принцип метода
Метод основан на оценке влияния испытываемой природной воды или водной вытяжки донных отложений, отобранных из водоемов и водотоков, на индивидуальные линии лабораторной культуры коловраток. Влияние испытываемой пробы воды оценивают по изменению показателей гибели и плодовитости коловраток по сравнению с контролем при экспозиции в этой пробе.
Острое, подострое и хроническое токсическое воздействие испытываемой пробы воды устанавливают в ходе одного опыта. Острое токсическое действие определяют за время экспозиции 24 ч, подострое - 48 - 72 ч; хроническое - 96 ч.
Показателем гибели является количество коловраток, погибших в испытываемой воде; показателем плодовитости - количество молоди, рожденное одной особью за время экспозиции.
Критерием токсичности является увеличение гибели и изменение плодовитости коловраток на 25 % и более по сравнению с контролем.
Оценку токсического воздействия испытываемой пробы воды проводят по двум показателям в зависимости от экспозиции. Такая комплексная оценка позволяет с помощью настоящего метода получать наиболее объективную информацию о токсическом загрязнении водного объекта.
12.2 Материалы, оборудование, реактивы
12.2.1 Культура коловраток Brachionus calyciflorus Pallas. Описание основных характеристик вида, источники получения культуры и условия культивирования даны в приложениях Б, В и Г.
12.2.2 Культура одноклеточных протококковых водорослей родов Scenedesmus или Chlorella, получение которой описано во всех методических рекомендациях по биотестированию с использованием в качестве тест-объекта Daphnia magna, например в Р 52.24.566, РД 118-02.
12.2.3 Микроскоп по ГОСТ 8074-82.
12.2.4 Емкости вместимостью 0,2 - 0,5 л по ГОСТ 25336-82.
12.2.5 Чашки Петри по ГОСТ 25336-82.
12.2.6 Пипетки капиллярные (обрезанные с обеих сторон пастеровские пипетки) или глазные пипетки с оттянутым носиком по ГОСТ 29230-91.
12.2.7 Микроаквариумы (обрезанные флаконы из-под антибиотиков вместимостью 2 мл) или конволюты из-под лекарств.
12.2.8 Медь (II) сернокислая, химически чистая по ГОСТ 4165.
12.2.9 Калий двухромовокислый по ГОСТ 4220-75.
12.3 Подготовка к биотестированию
12.3.1 Получение культуры коловраток
Для биотестирования используют культуру коловраток в начале стационарной фазы роста. Получают такую культуру за 5 - 7 дней до опыта. Для этого в емкости вместимостью 50 - 100 мл отсаживают 2 - 3 десятка коловраток и культивируют их в оптимальных условиях (температура 25 °С, рН 7,4 - 7,8 без принудительного освещения) при кормлении суспензией протококковых водорослей. Развитие коловраток в замкнутом объеме происходит по общим для микроорганизмов закономерностям, в своем развитии коловратки проходят те же стадии роста: лаг-фазу, фазу логарифмического роста, стационарную фазу и фазу гибели. Фазу роста популяции коловраток определяют, ежедневно подсчитывая количество особей в единице объема. Отсутствие прироста коловраток в популяции свидетельствует о наступлении стационарной фазы роста.
12.3.2 Проверка пригодности культуры для биотестирования
Первоначально визуально, под микроскопом проверяют состав популяции коловраток, в соответствии с приложением И. Обязательным условием пригодности культуры для биотестирования является отсутствие в ней самцов. Наличие самцов приводит к смене способов размножения и переходу популяции в период покоя (см. приложения Б, В).
Проверяют чувствительность полученной популяции коловраток под действием эталонного токсического вещества. В качестве эталонного токсического вещества используют медь (II) сернокислую или калий двухромовокислый.
Критерием пригодности популяции к биотестированию является величина LC50 в диапазоне концентраций 0,009 - 0,029 мг/л в растворе меди (II) сернокислой или 0,075 - 0,250 мг/л калия двухромовокислого за 24 ч экспозиции, т.е. в пределах таких диапазонов концентраций эталонных токсических веществ происходит гибель 50 % тест-объектов за 24 ч экспозиции.
Порядок проверки чувствительности популяции тест-объекта описан в приложении Д.
12.4 Проведение биотестирования
Для биотестирования капиллярной пипеткой при увеличении 2×12 отсаживают коловраток по одной в микроаквариумы. Делают четыре таких повторности, т.е. по 40 коловраток в 40 микроаквариумах на каждую серию (опытную и контрольную). Излишек попавшей с коловратками воды удаляют фильтровальной бумагой. В опытные микроаквариумы добавляют 1 - 2 мл испытываемой воды, в контрольные - дехлорированную водопроводную воду (К1) и природную воду из чистого створа водоема (К2).
Микроаквариумы помещают в чашки Петри и оставляют в помещении при естественном освещении (избегая прямых солнечных лучей). Опыт проводят в нестерильных условиях. На вторые сутки коловраток кормят, добавляя по капле суспензии протококковых водорослей.
12.5 Регистрация показателей гибели и плодовитости коловраток
Учет погибших особей и родившейся молоди коловраток проводят в течение 4 сут с помощью микроскопа при увеличении 2×14. Наблюдения за гибелью в первые сутки проводят через 1, 3, 5, 25 ч, а в последующие сутки - 2 раза в день. Сохранение неподвижности после барботирования среды пузырьками воздуха из капиллярной пипетки, свидетельствует о гибели коловраток.
Наблюдения за размножением коловраток проводят через 24, 48, 72 и 96 ч дважды в сутки. При наблюдении за размножением коловраток учитывают время наступления половозрелости (момент появления первого яйца), общее количество родившейся за время экспозиции жизнеспособной молоди и количество молоди в расчете на одну самку. Родившуюся молодь из микроаквариума удаляют. Патология размножения проявляется в виде абортирования яиц, уродливой, мертворожденной и нежизнеспособной молоди. Плодовитость определяет сохранность вида, в связи с чем ей отводят решающую роль при оценке токсичности воды.
12.6 Обработка результатов, расчеты и оценка токсического загрязнения
Оценку токсического загрязнения пробы воды или водной вытяжки донных отложений проводят по показателям гибели и плодовитости. Показатели гибели (Х %) в опытной и контрольной пробе воды рассчитывают по формуле:
![]() 12.1
12.1
где NМ - количество коловраток, погибших в серии, экз.;
NИСХ - исходное количество коловраток в серии, экз.
Увеличение количества погибших коловраток (А %) в опытной серии по сравнению с контрольной рассчитывают по формуле:
А = Х0 - Хk, 12.2
где Хk - количество коловраток, погибших в контрольной серии, %;
Х0 - количество коловраток, погибших в опытной серии, %.
Увеличение гибели коловраток в опытной серии по сравнению с контрольной на 25 % и более свидетельствует о наличии токсического воздействия испытываемой воды. При обработке результатов биотестирования вначале сравнивают показатели гибели тест-объектов в контрольных сериях - К1 и К2 (см. приложение К). Если показатель гибели в опытной серии меньше 25 %, оценку токсичности испытываемой пробы проводят с использованием тест-показателя плодовитости коловраток согласно таблице 1.
Показатель плодовитость рассчитывают по формуле
![]() 12.3
12.3
где NJ - количество молоди, родившейся за время экспозиции, экз.;
NИСХ - исходное количество коловраток, экз.
Затем рассчитывают отклонение показателя плодовитости коловраток (n %) в опытной пробе от контрольной. Поскольку исходное число особей во всех сериях одинаково, отклонения показателя плодовитости рассчитывают по формуле
![]() 12.4
12.4
где ![]()
![]() - суммарное количество молоди (экз.) в
опытной и контрольной сериях соответственно.
- суммарное количество молоди (экз.) в
опытной и контрольной сериях соответственно.
Значения отклонения значений плодовитости могут иметь знак «+» или «-» поскольку токсическое воздействие может проявляться как в угнетении, так и в усилении функции размножения. При отклонении показателя плодовитости в ту или иную сторону от контрольных значений на 25 % и более, считается, что исследуемая вода оказывает токсическое воздействие.
Характер токсического воздействия (острое, подострое, хроническое) определяют по показателям гибели и плодовитости в зависимости от экспозиции согласно таблице 1. Для более детальной оценки можно провести статистическую обработку результатов биотестирования в соответствии с Р 52.24.566.
Если вода в пробе оказывает острое токсическое воздействие, устанавливают кратность разбавления, при которой оно устраняется. Для этого проводят биотестирование на серии разбавлений: в 2, 10, 50 и 100 раз.
Таблица 1 - Оценка токсического загрязнения испытываемой пробы воды или водной вытяжки донных отложений при биотестировании на коловратках
|
Увеличение показателя гибели в сравнении с контрольным, % |
Отклонение показателя плодовитости от контрольного, % |
Токсическое загрязнение |
|
|
24 |
Менее 25 |
Менее 25 |
Не оказывает острого токсического действия (ОТД) |
|
Более 25 |
Оказывает ОТД |
||
|
Более 25 |
Менее 25 Более 25 |
||
|
48 - 72 |
Менее 25 |
Менее 25 |
Не оказывает подострого токсического действия (П/ОТД) |
|
Более 25 |
Оказывает П/ОТД |
||
|
Более 25 |
Менее 25 Более 25 |
||
|
96 |
Менее 25 |
Менее 25 |
Не оказывает хронического токсического действия (ХТД) |
|
Более 25 |
Оказывает ХТД |
||
|
Более 25* |
Менее 25 Более 25 |
||
|
Примечание. * Если гибель составляет 25 % и более, пробу считают токсичной и показатель плодовитости не рассчитывают |
|||
12.7 Метрологическая характеристика метода
В результате исследований установлены следующие метрологические характеристики:
а) при воздействии меди (II) сернокислой за 24 ч экспозиции диапазон реагирования Brachionus calyciflorus составляет от 0,009 до 0,029 мг/л, внутрилабораторная прецизионность - 25 %;
б) при воздействии калия двухромовокислого за 24 ч экспозиции диапазон реагирования Brachionus calyciflorus составляет от 0,075 до 0,250 мг/л, внутрилабораторная прецизионность - 25 %.
13 Биотест на природной популяции коловраток
13.1 Биотесты на природных популяциях, согласно Р 52.24.566, более предпочтительны в экспедиционных условиях и при исследовании случаев экстремально высоких загрязнений (ЭВЗ). Использование в качестве тест-объектов коловраток из водных объектов имеет ряд преимуществ:
- широкое распространение коловраток как класса в целом позволяет практически всегда выделить их из планктонных ценозов любого водного объекта для целей биотестирования;
- естественная адаптация тест-объектов, взятых из природных популяций, снижает возможную ошибку результатов биотестирования, т.к. тест-объекты из лабораторных культур реагируют на новые для них физико-химические характеристики исследуемой воды;
- возможен прогноз существования конкретных видов в исследуемом водном объекте.
13.2 Коловраток для целей биотестирования отбирают в фоновых (чистых) участках водных объектов.
13.3 Биотестирование на природных популяциях коловраток проводят по показателям пищевой активности, гибели, плодовитости (см. разделы 10, 12).
13.4 В ходе биотестирования выявляют острое, подострое и хроническое токсическое действие.
13.5 Оценку токсического загрязнения пробы проводят так же, как в разделах 10.5, 12.6, оценку токсического загрязнения природных вод и донных отложений - так же, как в разделе 14, водного объекта - так же, как в разделе 15.
14 Оценка токсического загрязнения проб воды и донных отложений по комплексу биотестов с использованием коловраток
14.1 Оценка токсического загрязнения проб по набору биотестов является экспертной. Оценка основана на принципе принятом в водной токсикологии: при наличии в одном из использованных биотестов токсического действия всю пробу считают токсичной.
14.2 Для получения экспресс-информации вначале проводят биотест по пищевой активности коловраток. В случае отсутствия токсического действия или обнаружения хронического токсического действия биотестирование проводят по выживаемости и плодовитости (см. раздел 12).
14.3 Биотест по выживаемости и плодовитости используют и как самостоятельный токсикологический эксперимент.
14.4 Биотест с использованием покоящихся яиц коловраток используют при любом исследовании, особенно удобно проводить этот тест в полевых условиях, когда не удается выделить природную популяцию коловраток или, когда нет лабораторной культуры.
14.5 В случае отсутствия токсического действия или обнаружения хронического токсического действия по показателям пищевой активности и выклева коловраток из покоящихся яиц для получения более детальной информации наблюдения продолжают по показателям выживаемости и плодовитости (см. раздел 12). Если по показателю выживаемости обнаружено острое токсическое действие, то показатель плодовитости не рассчитывают.
14.6 Использование одновременно всего указанного набора биотестов с использованием коловраток позволяет дать прогноз развития популяции.
15 Оценка токсического состояния исследованного водного объекта или его участка
15.1 Оценка токсического загрязнения водного объекта или участка по результатам биотестирования является экспертной согласно РД 52.24.635 и Р 52.24.566.
15.2 Оценка токсического загрязнения водного объекта основана на сопоставлении результатов биотестирования (острого, подострого и хронического токсического действия), полученных при оценке токсичности водной и донной составляющих экосистемы. При этом в токсикологическом эксперименте используют одни и те же биотесты.
15.3 Результаты биотестов водной и донной составляющих экосистем могут не совпадать. В этом случае для общей оценки токсичности исходят из принятого в водной токсикологии принципа: при наличии даже в одном из биотестов токсического действия всю пробу считают токсичной.
15.4 Характер токсического действия донных отложений (ОТД, ХТД) отражает результат длительного процесса накопления загрязняющих веществ, поэтому обнаружение хронического токсического действия даже в одной из съемок режимных наблюдений является основанием для оценки состояния исследуемого участка водного объекта как неблагополучного.
15.5 Оценку уровня токсического загрязнения донных отложений водного объекта рекомендуют проводить по таблице 2 согласно РД 52.24.635.
15.6 Состояние экосистемы водного объекта или его участка оценивают по токсическому загрязнению водной и донной составляющих, полученному в результате биотестирования, согласно таблице 3.
Таблица 2 - Оценка уровня токсического загрязнения донных отложений водного объекта
|
Участки водного объекта, где в пробах обнаружено загрязнение |
Уровень токсического загрязнения |
|
|
Ил преимущественно мелкодетритный |
На отдельных участках водного объекта |
Умеренно загрязненный |
|
Ил мелко- и крупнодетритный |
На значительной части участков |
Загрязненный |
|
Ил всех типов, илистый песок |
На всех участках |
Грязный |
|
Донные отложения всех типов, поверхность камней, гравия, гальки |
На всех участках |
Очень грязный |
Таблица 3 - Оценка состояния экосистем водного объекта или его участка по результатам биотестирования
|
Состояние экосистемы водного объекта** |
||
|
водная составляющая |
донная составляющая |
|
|
(ХТД) не обнаружено ни в одном из биотестов |
ХТД не обнаружено ни в одном из биотестов или ни на одном из участков водного объекта |
Благополучное |
|
ХТД обнаружено в одном из биотестов |
ХТД не обнаружено ни на одном участке ХТД обнаружено на одном участке |
Неблагополучное |
|
ХТД обнаружено в двух и более биотестах |
ХТД обнаружено на одном и более участках ОТД обнаружено на одном участке |
Крайне неблагополучное |
|
(ОТД) обнаружено в одном из биотестов, которое устраняется при кратности разбавления в 2 раза |
ХТД обнаружено на одном и более участках ОТД обнаружено на одном участке |
|
|
ОТД обнаружено в одном из биотестов, которое устраняется при кратности разбавления в 50 - 100 раз |
ХТД обнаружено на одном и более участках ОТД обнаружено на одном участке |
Чрезвычайная экологическая ситуация |
|
ОТД обнаружено в одном из биотестов, которое устраняется при кратности разбавления в 100 раз |
ХТД обнаружено на одном и более участках ОТД обнаружено на одном и более участках |
Экологическое бедствие |
|
* Выбор пунктов и программ наблюдений за токсическим загрязнением природных вод и донных отложений осуществляют УГМС и согласуют с ГХИ в порядке, установленном РД 52.24.309, РД 52.24.609. ** Состояние экосистемы дано по Р 52.24.566. |
||
16 Представление результатов биотестирования
Результаты биотестирования природной воды и донных отложений записывают в соответствии с таблицами Е.1 - Е.3 (см. Приложения Е).
17 Требования безопасности, охраны окружающей среды
При выполнении работ следует соблюдать правила техники безопасности работ на водных объектах и в химических лабораториях.
Особых требований по экологической безопасности не предъявляется.
18 Требования к квалификации оператора
К выполнению экспериментальных работ методам биотестирования допускаются лица, имеющие биологическое, экологическое образование, знакомые с основами водной токсикологии и методами полевых и лабораторных гидробиологических исследований.
Оценка результатов биотестирования является экспертной. Получить надежную биологическую информацию позволят знания специалиста-гидробиолога, способного поддерживать культуру тест-объекта в лаборатории или получать ее из природных водных объектов, корректно провести токсикологический эксперимент, проанализировать данные и сопоставить результаты биотестирования с результатами гидробиологического и гидрохимического исследований.
Приложение А
(справочное)
Критерии выбора видов-индикаторов и использование коловраток в токсикологических исследованиях
Несмотря на довольно обширную базу данных по биологии, экологии коловраток, полученную в основном для аквакультуры, существуют единичные попытки отдельных авторов использовать коловраток в качестве тест-объектов. Имеющаяся на данный момент информация о коловратках позволяет заключить, что представители этой группы животных соответствуют большинству критериев, по которым выбираются виды биоиндикаторы [6], так как
- способны накапливать загрязняющее вещество и не погибают под действием встречающихся в природе концентраций;
- имеется много видов коловраток, легко доступных в природе;
- имеют приемлемые размеры;
- легко культивируются в лабораторных условиях;
- ряд видов устойчив к солоноватой воде;
- достаточно легко определяются с точностью до вида (кроме отряда бделлоид);
- образ жизни ряда видов хорошо изучен;
- имеют короткий жизненный цикл развития.
Несомненный интерес представляет одна из стадий жизненного цикла гетерогенных коловраток - период покоя, заканчивающийся откладкой покоящихся яиц. Гетерогония - чередование обоеполого и партеногенетического поколений у беспозвоночных животных. Такая особенность коловраток позволяет постоянно иметь культуру животных, а также дает возможность получать синхронную культуру коловраток [6].
Коловратки отвечают также требованиям к индикационным видам беспозвоночных животных, используемых в биологическом мониторинге водной среды:
- по своей экологии заметно подвергаются воздействию тех веществ среды, на которые ориентирован мониторинг. В отдельных работах показано, что коловратки проявляют чувствительность к загрязняющим веществам различной химической природы: тяжелым металлам, пестицидам, полимерным материалам, фенолам и полихлордифинилам;
- занимают функционально значимое место в экосистемах всех регионов;
- широко распространены во всех областях, в том числе и в континентальной;
- заметно реагируют на изменение среды колебаниями численности.
Поэтому в дополнение к их важной роли в экологии водных сообществ, коловратки представляют собой подходящие организмы для токсикологических исследований.
Одна из стадий жизненного цикла коловраток - период покоя в виде покоящихся яиц, переживаемый коловратками, обладающими гетерогонией, представляет несомненный интерес. Использование покоящихся яиц коловраток позволяет унифицировать процесс биотестировани и его воспроизводимость. Сопоставимость результатов биотестирования - одно из условий методов токсикологической оценки качества воды с помощью живых организмов, которое выполнимо лишь при использовании синхронных культур в экспериментах по токсичности. Это культуры, полученные в одинаковых условиях и находящиеся в одинаковом физиологическом состоянии одновозрастные особи (тест-объекты). Для получения синхронной культуры в качестве альтернативного варианта чистым культурам беспозвоночных можно использовать покоящиеся яйца. Так, воспроизводимость в экспериментах при использовании тест-культур из покоящихся яиц коловраток оказалась в три раза выше, чем при использовании дафнии. Однако использование в широком масштабе покоящихся яиц коловраток как в аквакультуре, так и в биотестировании в настоящее время неосуществимо, так как еще не в полной мере изучен сложный цикл размножения коловраток, не разработаны способы получения, хранения, обеспечивающие стабильный выклев молоди из покоящихся яиц.
Изложенное выше свидетельствует, что коловратки как класс представляют интерес и являются перспективными объектами для разработки системы биотестирования природных вод.
Приложение Б
(справочное)
Характеристика тест-объекта коловратки Brachionus calyciflorus Pallas
Б.1 Систематическое положение, местообитание
Тип - Nemathelmintes
Класс - Rotatoria (Rotifera)
Отряд - Ploimidae
Семейство - Brachionidae
Род - Brachionus
Вид - Brachionus calyciflorus Pallas, 1766
(в дальнейшем - брахионус, коловратка)
Brachionus calyciflorus - пелагический, широко распространенный вид. Встречается в различных по трофическому и гидрологическому типу водоемах, в том числе в солоноватых [7, 10]. Предпочитает щелочную среду (рН = 7 - 9) и эвтрофные воды. Эритемный вид, температурный оптимум находится в пределах 24 - 28 °С.
Б.2 Морфология, биология
Коловратки легко распознаются по специфическим для них органам: коловращательному аппарату, или короне, как правило, выполняющему одновременно функции движения и питания, и по мастаксу, или глотке, содержащей внутри челюстной аппарат.
Характерная особенность коловраток заключается в том, что их тело состоит из небольшого, вполне определенного и постоянного числа клеток.
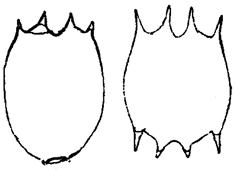
Тело брахионуса состоит из головы, туловища и ноги, легко втягивающейся внутрь. Туловище покрыто панцирем, состоящим из более выпуклой спинной и брюшной пластинок, сросшихся краями. Панцирь довольно мягкий, тонкий, прозрачный, гладкий, со спины сильно вздутый. По переднему краю расположены 4 шипа; брюшной - со срединной выемкой; задний край округлый, без шипов, с треугольным или подковообразным отверстием для ноги. Длина панциря 180 - 600 мкм, ширина 124 - 300 мкм.
Брахионус обладает маллеатным типом челюстного аппарата и коловращательным аппаратом типа «Euchlanis». Брахионидам присущ специфический способ питания, связанный с принципом плавания, в результате которого происходит осветление среды.
Потребляет брахионус микроводоросли и бактериопланктон. Кровеносная и дыхательная системы у коловраток отсутствуют. Выделительная система протонефридиального типа. Нервная система проста - состоит из одного надглоточного ганглия и отходящих от него нервов.
Брахионусы раздельнополы. Самцы карликовые, с редуцированной пищеварительной и выделительной системами. После оплодотворения самок самцы погибают. Для брахионид характерна гетерогония: чередование двуполого и однополого размножения. Процесс размножения осуществляется самками двух категорий: амиктическими и мистическими. В процессе размножения коловраток формируется три основных типа яиц: миктические неоплодотворенные - «на самца», миктические оплодотворенные (покоящиеся или латентные) и амиктические «на самок». Наличие того или иного типа яиц у самок является критерием для суждения о состоянии культуры. При хорошем состоянии культуры преобладают самки с амиктическими яйцами. Живут самки максимум 19 дней. Самки откладывают яйца ежедневно. Яйца прикрепляются к основанию ноги самки с помощью стебелька, образуемого слизистыми выделениями желез. Развитие зародыша длится дольше, чем формирование яйца, поэтому у самок можно обнаружить одновременно 2 - 3 и более яиц. Эмбриональное развитие зародыша длится 8 - 19 ч. Большинство коловраток достигает половозрелости и откладывает яйца приблизительно через сутки после их выхода из яйца.
Приложение В
(справочное)
Жизненный цикл коловратки Brachionus calyciflorus
Для коловраток семейства Brachionidae характерна гетергония: чередование однополого и двуполого размножения [5, 6].
Жизненный цикл брахионид протекает по схеме, характерной для моногононтных коловраток, и состоит из трех периодов: однополого размножения, двуполого размножения и покоя. Эти периоды могут протекать параллельно в одной культуре. Период однополого размножения начинается с вылупления амиктических (партеногенетических) самок из покоящихся яиц. Амиктические самки не способны к оплодотворению и производят диплоидные (2N) амиктические яйца, из которых вылупляются либо амиктические самки, либо (в зависимости от условий) миктические самки, способные к однополому или двуполому размножению. В первом случае самки вынашивают гаплоидные (N) миктические яйца, из которых развиваются самцы. В случае оплодотворения миктической самки откладываются диплоидные покоящиеся яйца, из которых после латентного периода вылупляются амиктические самки. Миктические и амиктические самки, присутствующие в культуре, различаются по наличию определенного типа яиц.
При смешанном размножении в популяции коловраток имеются самцы и самки всех категорий: ювенильные, амиктические, миктические оплодотворенные с покоящимися яйцами и неоплодотворенные, а также самки в пострепродуктивном периоде - сенильные. Самцы имеют значительно меньшие размеры, чем самки, обладают большей скоростью и другим направлением движения.
У самцов отсутствует пищеварительная система, имеются сильно редуцированные органы, кроме половой системы. Живут самцы несколько часов, поэтому вид определяют только по самкам. Наличие разных стадий жизненного цикла и их численное соотношение характеризуют состояние культуры коловраток. Для дифференцирования выше указанных категорий самок используют определитель (см. приложение И).
Приложение Г
(справочное)
Содержание культуры коловраток Brachionus caiyciflorus в лабораторных условиях
Г.1 Получение исходного материала в лабораторных условиях
Получить исходный материал для культуры коловраток можно в институтах и учреждениях, занимающихся биотестированием с использованием коловраток (в том числе в ГХИ).
Можно самостоятельно получить культуру коловраток, выделяя коловраток из зоопланктона естественных водоемов, в которых обнаружен нужный вид, либо из покоящихся яиц коловраток, собранных в водоеме.
Для получения культуры коловраток из зоопланктона водоемов отбирают пробу воды объемом 0,5 - 1,0 л, добавляют 4 - 5 кусочков сухих пекарских дрожжей (размером 1 мм3). Через 5 - 6 суток происходит массовое развитие различных представителей зоопланктона. Затем под микроскопом специалист определяет нужный вид. Капиллярной пипеткой отлавливают несколько самок брахионуса с партеногенетическими яйцами и рассаживают их в микроаквариумы или чашки Петри, добавляя корм. Корм (суспензию протококковых водорослей) добавляют до светло-зеленого окрашивания среды. Можно кормить коловраток дрожжами: 1 - 2 кусочка сухих пекарских дрожжей размером 1 мм3 добавляют в среду.
При наличии покоящихся яиц у коловраток можно получить культуру коловраток и непрерывно культивировать их в лаборатории в течение нескольких лет. Можно сохранять покоящиеся яйца и по мере необходимости получать из них культуру коловраток. Для получения вегетирующей культуры коловраток из покоящихся яиц последние помещают в микроемкости вместимостью 2 - 5 мл, заливают небольшим количеством дехлорированной водопроводной воды и помещают под люминесцентные лампы или лампы накаливания. Часто уже через 17 ч начинается выклев коловраток из покоящихся яиц. После выклева коловраток добавляют корм и поддерживают культуру как описано выше.
Г.2 Содержание культуры коловраток, кормление
Содержат культуру в стеклянных емкостях вместимостью 0,2 - 0,5 л. Оптимальная плотность культуры 10 - 20 экземпляров на 1 мл воды.
Один раз в 7 - 10 суток проводят пересев культуры для обеспечения стандартных условий культивирования, поддерживающих культуру коловраток в стационарной фазе роста. Оптимальными условиями содержания являются температура 25 °С, рН = 7,4 и естественное освещение без прямого солнечного света.
Корм - одноклеточные протококковые микроводоросли (хлорелла или сценедесмус). Кормление проводят через 2 - 3 суток, добавляя в небольшом количестве концентрированную культуру водорослей. По мере заполнения емкости 1/4 часть культуры коловраток переливают в новую емкость и продолжают культивирование. При отсутствии микроводорослей коловраток можно подкармливать пекарскими дрожжами - 1 - 2 кусочка сухих пекарских дрожжей размером 1 мм3 на 50 мл среды. Однако, при применении дрожжей следует чаще пересевать культуру (через 5 суток), т.к. происходит очень быстрое заражение культуры коловраток вселенцами - простейшими.
Культуру коловраток транспортируют в пробирках, не допуская перегрева и переохлаждения. Хранить ее без пересева можно в холодильнике при температуре 8 - 10 °C в течение 2 - 3 недель. Период акклиматизации к лабораторным условиям от 3 суток и более.
Приложение Д
(справочное)
Проверка чувствительности популяции тест-объекта. Brachionus calyciflorus
Чувствительность популяции тест-объекта проверяют по интенсивности реагирования на эталонное токсическое вещество (медь (II) сернокислая или калий двухромовокислый). Показателем чувствительности служит LC50 за 24 ч экспозиции, т.е. концентрация эталонного токсического вещества, в которой гибнет 50 % популяции взятой в опыт.
В практике токсикологических исследований показано, что LC50 проявляется в диапазоне концентраций.
Для тест-объекта Brachionus calyciflorus диапазон составляет 0,009 - 0,029 мг/л меди (II) сернокислой и 0,075 - 0,250 мг/л калия двухромовокислого.
LC50 определяют графическим методом. В ходе эксперимента учитывают количество погибших особей. Значение гибели выражают в процентах. Процентные значения переводят в пробитные значения согласно таблице Д.1. Если гибель особей в какой-либо из концентраций погибло 0 или 100 % особей, то пробитные значения определяют по таблице Д.2, учитывая при этом количество особей в группе, взятых в эксперимент. Например, если количество особей в группе равно 10, то пробитное значение для эффекта 0 %-ной гибели будет равняться 3,04, для 100 %-ной гибели - 6,96.
Соответствующие концентрации эталонного токсического вещества выражают логарифмическими значениями.
По пробитным значениям и концентрациям эталонного токсического вещества, выраженным в значениях десятичных логарифмов, строят график в виде прямой линии. На графике на оси ординат находят точку пробитного значения 5,0 и от нее параллельно оси абсцисс проводят линию до пересечения с линией графика, построенного по результатам эксперимента с различными концентрациями эталонного токсического вещества. Получают точку А (рисунок Д.1). Точка пересечения опущенного перпендикуляра и оси абсцисс дает значение LC50, соответствующее концентрации эталонного токсического вещества, при которой гибнет 50 % взятой в опыт популяции.
Таблица Д.1 - Пробитные значения в зависимости от процента гибели подопытных животных
|
0,0 |
1,0 |
2,0 |
3,0 |
4,0 |
5,0 |
6,0 |
7,0 |
8,0 |
9,0 |
|
|
0 |
- |
2,67 |
2,95 |
3,12 |
3,25 |
3,35 |
3,44 |
3,52 |
3,59 |
3,66 |
|
10 |
3,72 |
3.77 |
3,85 |
3,87 |
3,92 |
3,96 |
4,01 |
4,05 |
4,08 |
4,12 |
|
20 |
4,16 |
4,19 |
4,22 |
4,26 |
4,29 |
4,33 |
4,36 |
4,39 |
4,42 |
4,45 |
|
30 |
4,48 |
4,50 |
4,53 |
4,56 |
4,59 |
4,61 |
4,64 |
4,67 |
4,69 |
4,72 |
|
40 |
4,75 |
4,77 |
4,81 |
4,82 |
4.84 |
4,87 |
4,90 |
4,92 |
4,95 |
4,97 |
|
50 |
5,00 |
5,03 |
5,05 |
5,08 |
5,10 |
5,13 |
5,15 |
5,18 |
5,20 |
5,23 |
|
60 |
5,25 |
5,28 |
5,30 |
5,33 |
5,36 |
5,38 |
5,41 |
5,44 |
5,47 |
5,50 |
|
70 |
5,52 |
5,55 |
5,58 |
5,61 |
5,64 |
5,67 |
5,71 |
5,74 |
5,77 |
5.81 |
|
80 |
5,84 |
5,88 |
5,92 |
5,95 |
5,99 |
6,04 |
6,08 |
6,13 |
6,18 |
6,23 |
|
90 |
6,28 |
6,34 |
6,41 |
6,48 |
6,55 |
6,64 |
6,75 |
6,88 |
7,05 |
7,32 |
Таблица Д.2 - Пробитные значения для результатов, равных 0 и 100 %
|
Пробитные значения для результатов 0 % |
Пробитные значения для результатов 100 % |
|
|
4 |
3,47 |
6,53 |
|
5 |
3,36 |
6,64 |
|
6 |
3,27 |
6,73 |
|
7 |
3,20 |
6,80 |
|
8 |
3,13 |
6,87 |
|
9 |
3,09 |
6,91 |
|
10 |
3,04 |
6,96 |
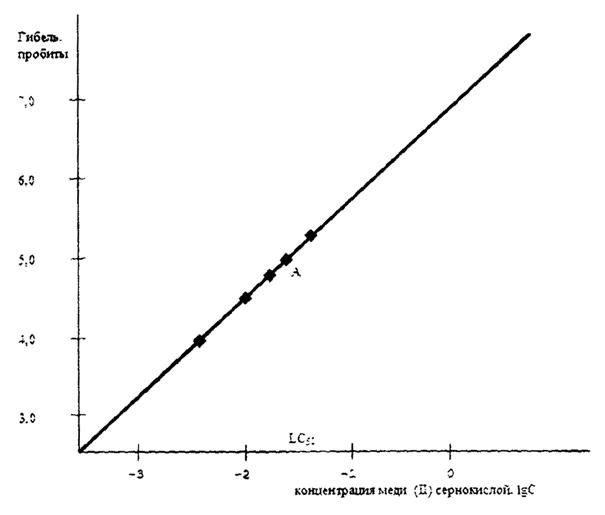
Рисунок Д.1 - Графический расчет LC50
Если полученное по графику значение концентрации эталонного токсического вещества (LC50) выходит за пределы указанных выше диапазонов, то для биотестирования следует взять другую популяцию. В противном случае результаты биотестирования будут не корректными.
Например, для нахождения LC50 для популяции брахионуса проводят эксперимент по исследованию нескольких концентраций меди (II) сернокислой: 0,005; 0,010; 0,015; 0,030 мг/л. По результатам опыта составляют таблицу (таблица Д.3).
По значениям таблицы Д.3 строят график (рисунок Д.1). Точка пересечения опущенного из точки А перпендикуляра и оси абсцисс определяет значение LC50. В данном случае значение LC50 составляет - 1,7 lgC, что соответствует 0,020 мг/л концентрации меди (II) сернокислой. Полученная по графику концентрация меди (II) сернокислой LC50 укладывается в границы указанного выше диапазона (0,009 - 0,029 мг/л). Следовательно, популяцию брахионуса можно использовать для проведения токсикологического анализа.
Таблица Д.3 - Результаты эксперимента по определению LC50 популяции брахионуса
|
Гибель |
|||
|
С, мг/л |
lgC |
% |
пробиты |
|
0,005 |
-2,3 |
10 |
3,72 |
|
0,010 |
-2,0 |
30 |
4,48 |
|
0,015 |
-1,8 |
45 |
4,87 |
|
0,030 |
-1,5 |
60 |
5,25 |
Приложение Е
(обязательное)
Формы представления результатов биотестирования
Таблица Е.1 - Результаты биотестирования проб воды или водной вытяжки донных отложений по пищевой активности (показатель СОС) коловратки Brachionus calyciflorus
|
Водный объект, пункт, дата отбора |
Показатель СОС, мл/экз. · мин |
Отклонение показателя СОС от контроля, % |
Оценка токсического действия пробы |
|
|
1 |
2 |
3 |
4 |
5 |
|
Примечание - в графе «Оценка токсического действия пробы» пишут: «Оказывает» или «Не оказывает острое токсическое действие». |
||||
Таблица Е.2 - Результаты биотестирования проб воды или водной вытяжки донных отложений с использованием покоящихся яиц коловратки Brachionus calyciflorus
|
Номер пробы |
Водный объект, пункт, дата отбора пробы |
Выклев молоди, % |
Отклонение выклева молоди, % от контроля |
Оценка токсического действия пробы |
|
1 |
2 |
3 |
4 |
5 |
|
Примечание - в графе «Оценка токсического действия пробы» пишут: «Оказывает» или «Не оказывает острое токсическое действие». |
||||
Таблица Е.3 - Результаты биотестирования пробы воды или донных отложений с использованием тест-объекта В. calyciflorus
|
Водный объект, пункт, дата отбора пробы |
Дата проведения биотеста |
Чувствительность тест-объекта LC50 по эталонному токсическому веществу |
Отклонение показателя гибели от контроля, % |
Отклонение показателя плодовитости от контроля, % |
Оценка токсического действия пробы |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Примечание - в графе «Оценка токсического действия пробы» пишут: «Оказывает» или «Не оказывает острое, подострое, хроническое токсическое действие». |
||||||
Приложение Ж
(справочное)
Получение и хранение покоящихся яиц коловратки Brachionus calyciflorus
Покоящиеся яйца коловраток можно собрать в природных водоемах (прудах, озерах, на мелководьях рек). Гидробиолог легко определит покоящиеся яйца именно этого вида по определителю (см. приложение И).
Нетрудно получить покоящиеся яйца в лабораторных условиях. Для этого вегетирующую культуру коловраток культивируют в оптимальных условиях при температуре 26 - 28 °C, рН на уровне 7 и кормлении суспензией зеленых одноклеточных водорослей. Корм необходимо вносить коловраткам в количестве 5-ти или 10-ти кратной массы коловраток. Через 5 - 7 суток в культуральной среде появится большое количество покоящихся яиц, которые сосредотачиваются в поверхностной пленке воды и на дне культуральной емкости. Полученные покоящиеся яйца собирают сифоном и высушивают на воздухе. Хранят в плотных бумажных пакетах в холодильнике при температуре 4 °С. При таком хранении покоящиеся яйца сохраняют всхожесть порядка 80 % в течение года [10, 11].
Приложение И
(справочное)
Определитель состава популяции коловратки Brachionus calyciflorus
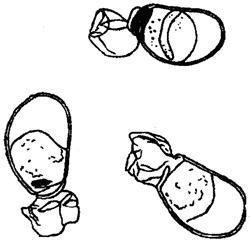
Определение желательно проводить на живых коловратках под микроскопом с увеличением 8×40 [8, 10, 11]. Категории самок, яиц и самцы представлены на рисунках И.1 - И.9 [10, 11].
1 (6) Коловратка с яйцами.
2 (5) Яйца крупные длиной от 110 до 135 мкм, ширина от 85 до 100 мкм (рисунок И.1).
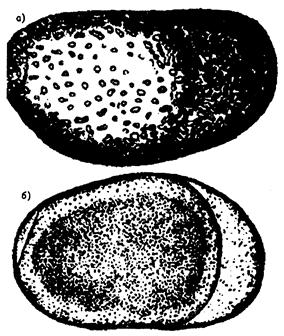
3 (4) Яйца с темно-коричневым содержимым, прилегающим к оболочке, или с оранжевым содержимым, на одном из полюсов отстоящим от оболочки. Количество таких яиц не более 3 ……… Самка с миктическими покоящимися яйцами (рисунки И.1 - И.4).
4 (3) Мелкие яйца с полупрозрачным содержимым, находящиеся на разных стадиях эмбриогенеза (можно видеть все стадии - от еще не дробящегося яйца до окончательного формирования коловратки в яйце), ……. Самка с амиктическими яйцами (рисунок И.5). Интенсивно размножающаяся культура состоит преимущественно из таких самок. Длина панциря половозрелых самок при достаточном количестве корма составляет до 600 мкм.
5 (2) Яйца мелкие длиной от 65 до 75 мкм, шириной от 50 до 55 мкм, с полупрозрачным содержимым в количестве от 1 до 10:
а) яиц обычно несколько …….. Самка с миктическими яйцами на «самца» (рисунок И.6). В интенсивной культуре встречаются редко. Увеличение численности таких особей является признаком перехода культуры на двуполое размножение и последующий переход культуры в период покоя в виде покоящихся яиц.
б) яйцо одно …. Самка с мелким амиктическим яйцом. Встречаются при недостатке корма. Могут быть также старыми самками с последним амиктическим яйцом.
6 (1) Коловратка без яиц.
7 (10) Размеры коловратки крупные, длина панциря более 200 мкм.
8 (9) Коловратка с темным плотным содержимым, обычно колбовидно раздутая в задней трети длины …. Сенильная самка.
9 (8) Коловратка прозрачная:
а) в яичнике фолликулы отсутствуют. Обычно хорошо различимы мастакс, желудок и кишечник значительно уменьшены. Панцирь может быть слегка раздут в задней половине ……….. Сенильная самка (рисунок И.7а).
Сенильные самки в культуре бывают в очень небольшом количестве.
б) В яичнике видны фолликулы, один из которых обычно крупнее других …….. Ювенильная самка (рисунки И.7б, И.8).
10 (7) Размеры коловратки мелкие, длина менее 100 мкм.
11 (12) Очень подвижны, никогда не прикрепляются ногой к стенкам сосуда, на заднем конце тела имеется зернистое скопление.
Пищеварительная система и мастакс недоразвиты ……. Самец (рисунок И.7в)
12 (11) Движутся плавно, часто прикрепляются ногой к стенкам сосуда или поверхностной пленке воды. Внутри виден работающий мастакс и, как правило, наполненные водорослями желудок и кишечник ….. Новорожденная самка (рисунки И.7в - И.8).
а) покоящееся оранжевое яйцо;
б) покоящееся серое яйцо
Рисунок И.1. - покоящиеся яйца Brachionus calyciflorus

Рисунок И.2 - Мистическая самка Brachionus calyciflorus с оплодотворенными покоящимися «яйцами на самку»

Рисунок И.3 - Покоящиеся яйца Brachionus calyciflorus, скорлупа которых нарушена
Рисунок И.4 - Оболочки покоящихся яиц Brachionus calyciflorus после выклева коловраток из яиц
Рисунок И.5 - Амиктическая самка Brachionus calyciflorus с партеногенетическими яйцами «на самку»
Рисунок И.6 - Миктическая самка Brachionus calyciflorus с партеногенетическими яйцами на «самца»
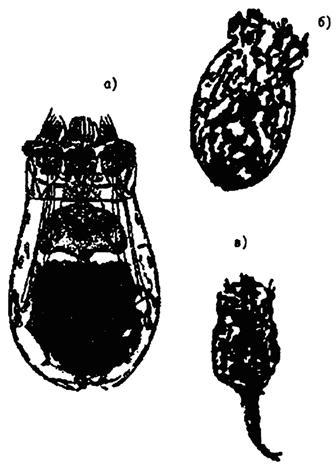
а) сенильная самка;
б) ювенильная самка;
в) самец
Рисунок И.7 - Возрастной и половой состав коловраток Brachionus calyciflorus
Рисунок И.8 - Только что вылупившиеся из покоящихся яиц молодые самки Brachionus calyciflorus
Приложение К
(справочное)
Порядок сравнения контрольных серий
Особенностью биотестирования природных вод является использование двух контрольных серий. Для расчета токсичности испытываемой воды необходимо определить контроль для сравнения. Поэтому при обработке результатов биотестирования вначале сравнивают показатели гибели тест-объектов в двух контрольных сериях: на водопроводной дехлорированной воде К1 и на природной воде условно чистого (фонового) створа К2 при условии, что гибель в К1 не более 10 %. В случае гибели тест-объектов в контроле на дехлорированной водопроводной воде в любой учитываемый промежуток времени более 10 %, опыт повторяют на другой популяции тест-объектов.
Если в К2 гибель тест-объектов по сравнению с К1 не превышает 25 % (вода в К2 не оказывает токсического действия), то результат опытной серии сравнивают с контролем на воде из фонового створа. Если в К2 гибель тест-объектов по сравнению с К1 составляет 25 % и более, то воду фонового створа оценивают как токсичную и результаты опытной серии сравнивают с контролем на водопроводной воде. Гибель и увеличение гибели тест-объектов в испытываемой воде от контроля рассчитывают по формулам (К.1) и (К.2).
где X - гибель, %;
NМ - количество погибших коловраток, экз.;
NИСХ - исходное количество коловраток, экз.
Увеличение гибели коловраток в опытной серии по сравнению с контролем рассчитывают по формуле
где А - увеличение гибели коловраток, %;
Хк - гибель коловраток в контроле, %;
Х0 - гибель коловраток в опыте, %.
Библиография
1 Зенин А.А., Белоусова Н.В. Гидрохимический словарь. - Л.: Гидрометеоиздат, 1988. - 238 с.
2 Водный кодекс Российской Федерации. В ред. Федерального закона от 23.12.2003, № 186-ФЗ.
9 Правила охраны поверхностных вод (типовые положения). - М.: Госкомприрода СССР, 1991.
10 Кутикова Л.А. Класс коловратки //Фауна аэротенков. Атлас. Л.: Наука, 1984. - С. 187 - 241.
11 Богословский А.С. Материалы к изучению покоящихся яиц коловраток // Бюллетень Моск. о-ва исп. природы, отд. Биологии. Т.LXYIII (6), 1963. - С. 50 - 65.