Федеральнаяслужба
по надзору в сфере защиты прав потребителей
и благополучия человека
4.2. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика сальмонеллезов,
обнаружение сальмонелл в пищевых продуктах
и объектах окружающей среды
Методические
указания
МУ 4.2.2723-10
1. Методические указания разработаны ФГУН «ЦНИИ эпидемиологии» Роспотребнадзора (С.Ш. Рожнова, А.Т. Подколзин).
2. Рекомендованы к утверждению Комиссией по санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека.
3. Утверждены и введены в действие Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 13.08.2010.
4. Введены в действие с 2.09.2010.
3. Введены впервые взамен МУ «Лабораторная диагностика сальмонеллезов человека и животных, обнаружение сальмонелл в кормах, продуктах питания и объектах внешней среды», 1990.
СОДЕРЖАНИЕ
|
|
УТВЕРЖДАЮ Руководитель
Федеральной службы Г.Г. Онищенко 13.08.2010 Дата введения: 02.09.2010 |
4.2. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика сальмонеллезов,
обнаружение сальмонелл в пищевых продуктах
и объектах окружающей среды
Методические указания
МУ 4.2.2723-10
1. Область применения
1.1. Настоящие методические указания предназначены для специалистов органов и учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, а также могут быть использованы специалистами организаций здравоохранения и других заинтересованных организаций.
1.2. В настоящих методических указаниях определен порядок проведения лабораторных исследований в целях обнаружения сальмонелл в клиническом материале, пищевых продуктах и объектах окружающей среды.
1.3. Настоящие методические указания распространяются только на лаборатории, имеющие право на работу с микроорганизмами III - IV групп патогенности (опасности) и удовлетворяющие требованиям к помещениям и оборудованию в соответствии с СанПиН 1.3.2322-08.
2. Термины и сокращения
ДНК - дезоксирибонуклеиновая кислота
ПЦР - полимеразная цепная реакция
Н-антиген - жгутиковый антиген, представляющий собой термолабильный белок
О-антиген - соматический антиген, представляющий собой липополисахарид клеточных мембран
Смесь О-сывороток - диагностические адсорбированные сыворотки сальмонеллезные
R-форма - шероховатая форма
RAPD - амплификация с произвольными (случайными) праймерами
ISO-6579 - международная организация стандартизации
MLST - мультилокусное секвенирование-типирование
PFGE - электрофорез в пульсирующем поле
VNTR - амплификация тандемных повторов с переменной копийностью
S-форма - гладкая форма
SS-агар - сальмонелла-шигелла агар
РПГА - реакция пассивной гемагглютинации
AFLP - оценка полиморфизма длины фрагментов амплификации
3. Нормативные ссылки
МУ по микробиологической диагностике заболеваний, вызываемых энтеробактериями - 1984 г.
МУ "Лабораторная диагностика сальмонеллезов человека и животных, обнаружение сальмонелл в кормах, продуктах питания и объектах внешней среды" - 1990 г.
ГОСТ Р 52814-2007 (ИСО 6579:2002) Продукты пищевые. Метод выявления бактерий рода Salmonella.
ГОСТ 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологического анализа.
ГОСТ 26669-85. Продукты пищевые и вкусовые. Подготовка проб для микробиологического анализа.
ГОСТ Р 50455-92 Мясо и мясные продукты. Обнаружение сальмонелл (арбитражный метод).
ГОСТ Р 51448-99 (ИСО 3100-2-88) Мясо и мясные продукты. Методы подготовки проб для микробиологических исследований.
ГОСТ 9792-73 "Колбасные изделия и продукты из свинины, баранины говядины и мяса других видов убойных животных и птиц. Правила приемки и методы отбора проб".
ГОСТ 7702.2.0-95 "Субпродукты и полуфабрикаты птичьи. Методы отбора проб".
ГОСТ Р 52833-2007 (ИСО 22174-2005). Микробиология пищевой продукции и кормов для животных. Метод полимеразной цепной реакции (ПЦР) для определения патогенных микроорганизмов. Общие требования и определения.
ГОСТ 30705-2000 "Продукты молочные для детского питания. Методы микробиологического анализа".
МУ 4.2.1884-04 Санитарно-микробиологический и санитарно-паразитологический анализ воды поверхностных водных объектов.
МУК 4.2.577-96 "Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов".
МУ 1.3.1888-04 "Организация работы при исследованиях методом ПЦР материала, инфицированного патогенными биологическими агентами III - IV групп патогенности".
Информационное письмо МЗ РСФСР № 10/11-3223 от 28.08.1987 г.
"Методы контроля бактериологических питательных сред". Методические указания. МУК 4.2.2316-08.
"Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней". Санитарно-эпидемиологические правила СП 1.3.2322-08.
"Методы контроля. Бактериологические и микробиологические факторы. Техника сбора и транспортировки биоматериала в микробиологические лаборатории" МУ 4.2.2039-05.
Инструкция по применению набора реагентов "Диагностикум эритроцитарный сальмонеллезный О-антигенный жидкий" от 22.08.2008 № 6854-Пр/08.
"Гигиенические требования безопасности и пищевой ценности пищевых продуктов" СанПиН 2.3.2.1078-01.
"Правила сбора, хранения и удаления отходов лечебно-профилактических учреждений" СП 2.1.7.728-99.
Приказ № 535 от 22 апреля 1985 г. "Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений".
Laboratory Protocol "Isolation of Salmonella spp. From Food and Animal Faeces" 5th Ed June 2010. WHO Global Foodborhe Infections Network.
Antigenic formulae of the Salmonella serovars, 2007, 9th edition WHO Collaborating Centre for Reference and Research on Salmonellа.
4. Аппаратура, материалы, лабораторная посуда, реактивы
4.1. Аппаратура и инструментарий
|
Анализатор потенциометрический, погрешность измерений рН ± 0,01 |
|
|
Шкаф сушильный стерилизационный ШСС-80П или других марок, позволяющий поддерживать температуру (160 ± 5) °С |
ТУ 64-1-28-70-76 |
|
Термостат, позволяющий поддерживать рабочую температуру 37 °С с отклонением от заданной ±1 °С |
ТУ 64-1-1382-83 |
|
Термостат, позволяющий поддерживать рабочую температуру 41,5 °С с отклонением от заданной ±1 °С |
ТУ 64-1-1382-83 |
|
Весы лабораторные общего назначения, 2 и 4 класса точности, с наибольшим пределом взвешивания 200 г |
|
|
Микроскоп биологический МБИ-1, МБИ-2, МБИ-3, МБР-1, МБР-3, МБС |
ГОСТ 8284-78 |
|
Стерилизаторы паровые медицинские или аналогичные |
|
|
Дистиллятор, обеспечивающий качество дистиллированной воды в соответствии с |
|
|
Гомогенизатор перистальтического типа "Микс-2", "Стомайкер", или других наименований |
AES Lab., Cat.N AESAP 1066 |
|
Гомогенизатор типа "вортекс" |
|
|
Микропипетки на 200 - 1000 мкл |
BIOHIT, Cat.N 720040 или "Ленпипет" |
|
Облучатель бактерицидный настенный ОБН-150 или других видов |
ТУ-16-535-84 |
|
Холодильник бытовой электрический |
|
|
Пинцет медицинский |
|
|
Ножницы медицинские |
ГОСТ 21239-89 |
|
Скальпель хирургический, 15 см |
|
|
Часы механические сигнальные |
|
|
Электроплитка |
|
|
Аппарат универсальный для встряхивания жидкости в колбах и пробирках (или другая аппаратура для встряхивания) |
ТУ 64-1-2451-78 |
4.2. Лабораторная посуда и материалы
|
Бумага фильтровальная лабораторная |
|
|
Марля медицинская |
ГОСТ 9412-77 |
|
Колбы плоскодонные конические или круглые разной вместимости |
|
|
Воронки стеклянные |
|
|
Вата медицинская гигроскопическая |
|
|
Пипетки вместимостью 1, 2, 5 и 10 см3 |
|
|
Пробирки типов П1, П2 |
|
|
Стекла предметные для микропрепаратов |
|
|
Спиртовки лабораторные стеклянные |
|
|
Термометр ртутный с диапазоном измерения от 0 до 100 °С (цена деления шкалы 1 °С) |
|
|
Чашки биологические (Петри) или одноразовые из полимерных материалов |
|
|
Пакеты стерильные для гомогенизатора |
AES Lab., Cat.N AES400/50G |
|
Отраслевой стандарт для визуальной оценки мутности № 10 |
ГИСК им. Л.А. Тарасевича, МЗ РФ |
|
Стандарт Макфарланда №№ 1, 2, 3 |
ф. "BioMerieux" |
|
Петля бактериологическая |
|
4.3. Реактивы и питательные среды
|
Агар микробиологический |
ГОСТ 17206-84 |
|
Вода дистиллированная |
|
|
D-глюкоза, ч. |
|
|
D-лактоза, 1-водная |
ТУ 6-09-22-98-79 |
|
Маннит |
|
|
D-сорбит |
|
|
Рамноза |
|
|
Калия гидроокись |
|
|
Калий фосфорнокислый однозамещенный, ч. |
|
|
Калий фосфорнокислый двузамещенный 3-водный |
|
|
Кислота соляная, х.ч. |
|
|
Литий хлористый, ч. или х.ч., или ч.д.а. |
|
|
Масло иммерсионное для микроскопии |
|
|
Набор реактивов для окраски по Граму |
|
|
Натрий-аммоний фосфорнокислый двузамещенный, 4-водный, ч. или х.ч. |
|
|
Натрия гидроокись, ч.д.а. |
|
|
Натрий лимоннокислый, 5,5-водный, ч.д.а. |
ГОСТ 22280-75 |
|
Натрий хлористый, ч. или х.ч., или ч.д.а. |
|
|
Пара-диметиламидобензальдегид, ч. |
ТУ 6-09-3272-77 |
|
Пептон сухой ферментативный для бактериологических целей |
|
|
Спирт этиловый ректификованный технический |
|
|
Спирт этиловый ректификованный |
|
|
Феноловый красный |
ГОСТ 5853-51 |
|
Фенолфталеин |
ГОСТ 5850-72 |
|
Фуксин основной |
ТУ 6-09-4119-75 |
|
Уксусная кислота |
|
|
Сульфаниловая кислота |
|
|
α-нафтол |
|
|
Цинк порошкообразный |
|
|
Экстракт дрожжевой сухой |
|
|
Пептонная вода забуференная - (сухая) |
|
|
Питательный бульон и питательный агар |
ТУ 10-02-02-789-176-94 |
|
Среды Гисса с глюкозой, лактозой, маннитом, рамнозой, дульцитом, адонитом, сахарозой, сорбитом |
ФС (ЦНИИВС им. И.И. Мечникова, НИИ питательных сред) |
|
Среда Эндо |
ТУ 9229-072-00419785 |
|
Среда Кесслер с глюкозой |
|
|
Тест-системы биохимические для видовой идентификации API 20Е, Rapid 20E, ID 32E для идентификации Enterobacteriaceae и других грамотрицательных палочек |
BioMerieux |
|
Набор реактивов для окраски по Граму |
|
5. Средства измерений, вспомогательное оборудование, посуда, реактивы
5.1. Средства измерений и вспомогательное оборудование
|
Центрифуга лабораторная |
|
|
Шкаф сушильный любого типа, обеспечивающий постоянство температуры (130 ± 5) °С по НД |
|
|
Шкаф холодильный любого типа, обеспечивающий постоянство температуры по НД |
|
|
Весы лабораторные аналитические общего назначения и образцовые по с наибольшим пределом взвешивания 200 г, не ниже 2 -го класса точности |
|
|
Дозаторы пипеточные с диапазоном объема доз 20 - 200 мкл, 200 - 1000 мкл и дискретности установки доз 5 мкл |
ТУ 64-16-55-90 |
|
Дистиллятор тип ДЭ-4-2 по НД |
|
|
рН-метр по НД |
|
|
Гомогенизатор ножевой или перистальтический типа "Стомайкер" |
|
|
Ступки фарфоровые с пестиками |
|
5.2. Лабораторная посуда и инструменты
|
Посуда мерная лабораторная; цилиндры исполнения 2 вместимостью 1000 см3, цилиндры исполнения 3 вместимостью 25 см3 и 100 см3, пробирки исполнения 1 вместимостью 10 см3, колбы исполнения 2 вместимостью 100 см3, 500 см3 и 1000 см3 |
|
|
Пипетки 2-1-50 или 2-2-50 |
|
|
Посуда лабораторная стеклянная; колбы конические вместимостью 50 - 1000 см3 |
|
|
Пинцеты, скальпели, ножницы |
|
|
Автоматические пипетки на 50, 100 мкл и 1 мл, с наконечниками |
|
5.3. Перечень рекомендуемого оборудования для проведения ПЦР-исследований*
_________________
* Представленный перечень оборудования может корректироваться с учетом рекомендаций производителей диагностических тест-систем и не включает оборудования, для проведения работ по типированию штаммов в связи с разнообразием используемых для этого методов.
5.3.1. Ламинарный бокс (например, "БАВп-01-"Ламинар-С"-1,2", "Ламинарные системы", Россия, класс биологической безопасности II тип А).
5.3.2. Программируемый амплификатор (например, "Терцик" ("ДНК-Технология", Россия), "Gradient Palm Cycler" ("Corbett Research", Австралия), "MAXYGENE" ("Axygen", США), "GeneAmp PCR System 2700" ("Applied Biosystems") или аналогичные).
5.3.3. Программируемый амплификатор с системой детекции флуоресцентного сигнала в режиме "реального времени" - при работе с "ПЦР-комплект" вариант FRT (например, "Rotor-Gene" 3000/6000 ("Corbett Research", Австралия), "Rotor-Gene Q" ("Qiagen", Германия), "iQ5" ("Bio-Rad", США), "Mx3000P" ("Stratagene", США), "ДТ-96" ("ДНК-Технология", Россия) или аналогичные).
5.3.4. Флуоресцентный ПЦР-детектор (например, "AЛА-1/4" ("BioSan", Латвия), "Джин" ("ДНК-Технология", Россия) или аналогичные).
5.3.5. Термостат для пробирок типа "Эппендорф" от 25 до 100 °С (например, "ТЕРМО 24-15", "Биоком", Россия).
5.3.6. Микроцентрифуга для пробирок типа "Эппендорф" до 16 тыс об/мин (например, "MiniSpin", "Eppendorf", Германия).
5.3.7. Вортекс (например, "ТЭТА-2", "Биоком", Россия).
5.3.8. Вакуумный отсасыватель медицинский с колбой-ловушкой для удаления надосадочной жидкости (например, "ОМ-1", г. Ульяновск, Россия).
5.3.9. Набор электронных или механических дозаторов переменного объема (например, "Ленпипет", Россия).
5.3.10. Одноразовые полипропиленовые завинчивающиеся или плотно закрывающиеся микропробирки на 1,5 мл (например, "Axygen", США).
5.3.11. Штативы для наконечников (например, "Axygen", США) и микропробирок на 1,5 мл (например, "ИнтерЛабСервис", Россия).
5.3.12. Одноразовые наконечники для дозаторов переменного объема до 200 мкл (например, "Axygen", США).
5.3.13. Одноразовые наконечники для дозаторов переменного объема с аэрозольным барьером до 200 мкл и до 1000 мкл (например, "Axygen", США).
5.3.14. Холодильник от 2 до 8 °С с морозильной камерой не выше минус 16 °С.
5.3.15. Отдельный халат и одноразовые перчатки.
5.3.16. Емкость с дезинфицирующим раствором.
5.3.17. Камера для горизонтального электрофореза объёмом не более 400 мл (например, "SE-2", "Хеликон", Россия).
5.3.18. Источник постоянного тока с напряжением 150 - 460 В (например, "Эльф-4", "ДНК-Технология", Россия).
5.3.19. Ультрафиолетовый трансиллюминатор с кабинетом для просмотра гелей (например, "Биоком", Россия).
5.3.20. Видеосистема с цифровой камерой для регистрации результатов и передачи изображения (например, "Биотест-1", ФГУН ЦНИИЭ Роспотребнадзора, Россия; "BioRad", США).
5.3.21. Аквадистиллятор. (например ДЭ-4-2Э, Завод медицинского оборудования, г. Саранск.)
5.3.22. Микроволновая печь для плавления агарозы.
5.3.23. Колба коническая из термостойкого стекла (ГОСТ 21400-75) для плавления агарозы на 250 мл.
5.3.24. Мерный цилиндр на 1 л (ГОСТ 1770-74).
5.3.25. Пластиковая ёмкость на 5 л для дезактивации буфера и гелей, содержащих бромид этидия.
6. Общие положения
Сальмонеллезы - инфекционные болезни, возбудителями которых являются представители рода Salmonella. Они характеризуются значительным полиморфизмом клинического течения с преимущественным поражением желудочно-кишечного тракта, возможной генерализацией и различной степенью выраженности симптомов общей интоксикации и обезвоживания.
Лабораторным критерием диагноза является выделение возбудителя (сальмонеллы) из испражнений, мочи, крови, рвотных масс и промывных вод больных, а при необходимости и наличии специальных показаний и из желчи, дуоденального содержимого, спинномозговой жидкости и секционного материала.
В особых случаях (вспышки сальмонеллезов) диагноз может быть поставлен на основе клинико-эпидемиологических данных с дополнительными позитивными результатами серологических и молекулярно-генетических исследований.
Таксономия и культурально-ферментативные свойства сальмонелл.
Род Salmonellа входит в семейство Enterobacteriaceae и состоит из микроорганизмов, родственных по фенотипическим и генотипическим свойствам. Ферментативные свойства сальмонелл положены в основу их подразделения на подвиды. Согласно последним данным род Salmonellа представлен двумя видами - S.enterica и S.bongori.
Сальмонеллы вида S.enterica делятся на несколько подвидов и обозначаются следующими символами:
Подвид I - или название серовара для сероваров вида S.enterica подвида enterica.
Для представителей других подвидов вида S.enterica введены следующие обозначения:
Подвид II - для сероваров S.enterica subsp. salamae
Подвид IIIa - для сероваров S.enterica subsp. arizonae
Подвид IIIb - для сероваров S.enterica subsp. diarizonae
Подвид IV - для сероваров S.enterica subsp. houtenae
Подвид VI - для сероваров S.enterica subsp. indica
V - Вид S.bongori - для серовара S.bongori subsp. bongori. Все серовары вида S.bongori имеют символ V.
Деление на подвиды имеет определенное эпидемиологическое значение так как основным, естественным резервуаром сальмонелл подвидов 1 и 2 служат теплокровные животные, а для представителей остальных подвидов (IIIa, IIIb, IV, VI и вида S.bongori (V) - хладнокровные животные и окружающая среда. Определение и название подвидов не является обязательными в клинической микробиологической практике. Необходимым для идентификации является только название серовара подвида enterica. В клинической практике возможно использование двух вариантов названий:
1. Salmonellа ser Typhimurium
2. Salmonellа Typhimurium
Серовары других подвидов вида S.enterica и вида S.bongori обозначаются номером подвида и их антигенной формулой:
II - O 1, 6, 14 Н, e, n, x, z15.
Это значит, что штамм с такой антигенной характеристикой относится к виду enterica subsp. salamae.
При написании серовара сальмонелл используется начальная заглавная буква, а при обозначении вида или подвида - прописная (лабораторный протокол ВОЗ, 2010 г.).
Сальмонеллы каждого подвида разделяются на серологические варианты по О- и Н- антигенной характеристике.
Современная схема Кауфмана-Уайта насчитывает 2579 серологических вариантов (2007 г., девятое издание).
Число сероваров сальмонелл, входящих в каждый подвид:
|
S.enterica |
2557 |
|
S.enterica subsp.еnterica |
1531 |
|
S.enterica subsp.salamae |
505 |
|
S.enterica subsp.arizonae |
99 |
|
S.enterica subsp.diarizonae |
336 |
|
S.enterica subsp.houtenae |
73 |
|
S.enterica subsp.indica |
13 |
|
S.bongori subsp.bongori |
22 |
|
Всего |
2579 |
Сальмонеллы - лактозонегативные грамотрицательные палочки. Подвижные, имеют перитрихиальные (по всей поверхности клетки) жгутики, за исключением S.Gallinarum. D-глюкозу ферментируют с образованием кислоты и газа. (S.Typhi газа не образуют) Ферментируют рамнозу, ксилозу, арабинозу, мальтозу, дульцит, сорбит, трегалозу, маннит. Сальмонеллы - оксидазонегативные, каталазопозитивные, индол и Фогес-Проскауэр (VP) негативные, метиловый красный и цитрат позитивные, продуцируют сероводород и не расщепляют мочевину.
Они являются факультативными анаэробами, хорошо растут на обычных питательных средах, за исключением нескольких сероваров (S.Paratyphi A, S.Choleraesuis, S.Typhisuis, S.Sendai, S.Gallinarum и некоторых других). Оптимальной температурой роста является 37 °С, реакция среды слабощелочная (рН 7,2 - 7,4).
При более низкой температуре (20 °С) или более высокой (42 °С) и при более кислой или более щелочной реакции среды (рН от 4,1 до 9,0) они способны размножаться, но значительно медленнее, чем при оптимальных условиях. При температуре ниже 5 °С их рост полностью прекращается.
Сальмонеллы обладают сравнительно высокой степенью устойчивости к воздействию различных факторов внешней среды. В жидкой среде при прогревании до 70 °С они погибают через 5 - 10 минут, а при кипячении моментально.
В то же время они хорошо сохраняются в различных пищевых продуктах (молоке, мясе, на поверхности и внутри яиц и др.). Соление и копчение оказывают на сальмонеллы относительно слабое действие.
Факторами передачи возбудителей инфекции при сальмонеллезах являются, как правило, продукты животного происхождения, в том числе молоко и молочные продукты. В настоящее время чаще всего заболевания возникают при употреблении в пищу инфицированных яиц или продуктов, в состав которых входят яйца, в том числе кремово-кондитерских изделий. Ряд заболеваний связан с инфицированным сальмонеллами мясом и мясопродуктами. Чаще всего это мясо домашних птиц (куры, утки, гуси, индейки), а также крупного рогатого скота и свинина, которые нередко являются причиной заболевания людей сальмонеллезом.
Известны вспышки сальмонеллеза, связанные с употреблением рыбы и рыбных продуктов, в том числе рыбы горячего копчения и сельди пряного посола, хотя доля их в общем числе вспышек сальмонеллезной этиологии невелика.
Инфицированными могут быть и продукты растительного происхождения (овощи, фрукты, ягоды), а также дрожжи, кондитерские красители и даже наркотические средства (марихуана).
Наибольшую опасность как возможные факторы передачи возбудителя инфекции представляют такие продукты и блюда, которые после приготовления не подвергаются термической обработке и могут храниться длительное время, в том числе и при комнатной температуре.
Необходимо учитывать, что в качестве факторов передачи возбудителя инфекции при сальмонеллезах могут оказываться продукты питания, инфицированные небольшими дозами сальмонелл.
Так, известны отдельные случаи заболевания сальмонеллезами и даже вспышки, когда заражающая доза не превышала несколько десятков микроорганизмов.
Следует учитывать и то, что даже при интенсивном размножении сальмонелл в пищевых продуктах они не изменяют ни вкуса, ни запаха, ни их внешнего вида.
Основными критериями эпидемиологической значимости определенных продуктов питания является обнаружение сальмонелл в пищевых продуктах или других объектах внешней среды.
Следует подчеркнуть, что в последние 20 лет во всем мире и в нашей стране широко распространилась Salmonella Enteritidis. Представители этого серовара вызывают пищевые вспышки сальмонеллеза при низкой дозе указанных микроорганизмов в продукте, а заболевания отличаются, как правило, более манифестным клиническим течением.
В настоящее время известны ряд схем, используемых в различных странах для выделения сальмонелл. В идеале для этого должны быть выбраны высокочувствительные и специфичные методы. В то же время эти методы должны быть простыми, быстрыми и недорогими.
Сложности с выделением сальмонелл связаны с наличием в кишечной флоре 1011 конкурентных микроорганизмов 300 - 400 видов, травмированием клеток при их транспортировке, перемежающимся выделением с испражнениями. Для преодоления этого при выделении сальмонелл обязательно используются среды обогащения.
Рекомендуемые в настоящее время стандартные приемы выделения сальмонелл должны соответствовать ISO-6579, однако не исключается возможность использования и некоторых других методов.
Так, рекомендовано кроме указанных в ISO-6579 сред обогащения использовать селенитовую среду, или селенит-цистин-бульон, а в качестве дифференциально-диагностических сред кроме широко используемых в России среды Эндо, Плоскирева, висмут-сульфит агара, применять ксилозо- лизин-деоксихолат агар, бриллиант-грюн агар, SS-агар, Мак-Конки агар в случае их соответствия требованиям реализации на отечественном рынке.
7. Показания к исследованию
Исследование на сальмонеллез проводят с целью диагностики заболеваний, выявления сальмонеллоносительства, определения соответствия гигиеническим требованиям безопасности пищевых продуктов, выявления обсемененности объектов внешней среды, а также при расследовании вспышек сальмонеллезов с целью установления источников и факторов передачи возбудителей инфекции.
8. Исследование клинического материала
8.1. Взятие и транспортировка
8.1.1. Для исследования на наличие сальмонелл отбирают испражнения, рвотные массы и промывные воды желудка, кровь, мочу, а при наличии специальных показаний - желчь, дуоденальное содержимое, спинномозговую жидкость и секционный материал.
8.1.2. Патологический материал следует доставлять в лабораторию в возможно короткий срок, но не позднее 12 ч после отбора, испражнения (фекалии) - не позднее 3 - 4 ч; кровь высевают у постели больного.
В случае невозможности доставки в установленные сроки материал посылают в консерванте или в транспортной среде. Такой материал до исследования хранят при 4 - 6 °С не более 24 ч.
При отборе проб необходимо исключить возможность контаминации их за счет смежных областей кожи, других органов, внешней среды и т.п.
8.1.3. Испражнения собирают сразу после дефекации с помощью стерильной стеклянной палочки или деревянного шпателя. При наличии патологических примесей (слизь, кровь, гной и т.п.) их включают в отбираемую пробу. В случае невозможности получения испражнений после дефекации материал берут непосредственно из прямой кишки с помощью "зонд тампона", вводя его в кишку на 8 - 10 см. Тампон помещают в пробирку с консервантом.
8.1.4. При профилактических обследованиях здоровых лиц на сальмонеллоносительство накануне взятия испражнений для исследования можно применить солевое слабительное (25 - 30 г магнезии сульфата - MgSO4), растворенное в теплой воде. Не принимается для исследования на сальмонеллоносительство материал, взятый на дому в отсутствии медицинского работника.
8.1.5. Кровь для исследования берут в начале заболевания, а также повторно в период лихорадки или в разгар рецидивов стерильным шприцем из локтевой вены в объеме 2 - 10 мл (в зависимости от возраста пациента); в более поздние сроки или при слабовыраженной клинической картине - 15 - 20 мл. Взятую кровь высевают у постели больного.
У детей до одного года кровь берут в доступных количествах из пальца, пятки или мочки уха.
8.1.6. Рвотные массы и промывные воды желудка отбирают при заболевании, сопровождающемся соответствующей симптоматикой, в объеме до 100 мл. Для исследования используют первые порции промывных вод, полученные без применения бактерицидных средств.
В случае кислой реакции (рН < 4,5) рвотных масс их перед посевом нейтрализуют 10 %-ным раствором бикарбоната натрия, промывные воды центрифугируют 15 мин. при 3000 об/мин и в дальнейшем используют осадок. В случае невозможности центрифугирования допускается высев нативного материала.
8.1.7. Желчь (дуоденальное содержимое) собирают в стерильные пробирки. При этом отдельно собирают дуоденальное содержимое, пузырную желчь и желчь из желчных протоков (порции А, В и С соответственно).
Кислая реакция, белесоватый оттенок, наличие хлопьев свидетельствуют о примеси желудочного сока и делают материал непригодным для бактериологического исследования.
8.1.8. Мочу для исследования собирают после тщательного туалета. Первую порцию мочи не берут для анализа, остальную в количестве 20 - 30 мл собирают в стерильную посуду и доставляют в лабораторию. Мочу центрифугируют 15 мин при 3000 об/мин Для исследования используют осадок. Допускается высев нативного материала.
8.1.9. Спинномозговая жидкость подлежит исследованию при наличии менингеального или менингоэнцефалитического синдромов.
Пробу (3 - 5 мл) помещают в стерильную пробирку и доставляют в лабораторию, предохраняя материал от замораживания (можно использовать термос).
8.1.10. Операционный и секционный материал для исследования отбирают в случае необходимости при оперативных вмешательствах или на месте вскрытия. Масса пробы должна быть не менее 20 г.
В сопроводительном документе необходимо указать, какое учреждение направляет материал, фамилию, имя, отчество и возраст обследуемого, место работы (для детей - название детского учреждения или школы), дату заболевания, предполагаемый диагноз или показания к обследованию, дату и час взятия пробы материала, фамилию и должность лица, посылающего материал.
8.2. Подготовка к исследованию клинического материала
8.2.1. Доставленные в лабораторию образцы клинического материала подготавливают к посеву в среды обогащения и на дифференциально-диагностические среды.
8.2.2. Операционный и секционный материал массой не менее 20 г растирают в ступках.
8.2.3. Рвотные массы, промывные воды желудка и мочу центрифугируют. При кислой реакции (рН < 4,5) рвотные массы перед центрифугированием нейтрализуют 10 % раствором питьевой соды (рН 7,0 - 7,4).
8.3. Методы выделения
Эффективность проводимого исследования, направленного на выделение сальмонелл из разных материалов, в первую очередь зависит от применения соответствующих сред обогащения и адекватных дифференциально-диагностических сред.
В настоящее время освоен коммерческий выпуск большинства питательных сред рядом производителей, имеющих регистрационные удостоверения и сертификаты производства. В тех случаях, когда рекомендуемые среды отсутствуют, их готовят в лабораторных условиях в соответствии с ГОСТ Р 52814-2007 или МУ по микробиологической диагностике заболеваний, вызываемых энтеробактериями, 1984 г. Контроль питательных сред осуществляют в соответствии с МУК 4.2.2316-08.
Рекомендуемые среды обогащения делятся на неселективные первичные (забуференная пептонная вода) и среды селективного обогащения (магниевая, селенитовая, Мюллер-Кауфмана, Раппапорт-Вассилиадис, селенит-цистиновая).
Дифференциально-диагностические среды в свою очередь делятся на слабо селективные и высоко селективные. К первым относятся Эндо агар, Мак-Конки агар, бриллиант-грюн агар. Ко вторым - Плоскирева агар, SS-агар, ксилозо-лизин деоксихолат агар, висмут-сульфит агар.
Характер роста сальмонелл на указанных средах приведен в табл. 1
Таблица 1
Характер роста сальмонелл на различных дифференциально-диагностических средах
|
Название среды |
Вид колоний сальмонелл |
|
1. Бриллиант-грюн агар |
Розовые |
|
2. Мак-Конки агар |
Бесцветные |
|
3.Ксилозо-лизин - деоксихолат агар) |
Черные с бесцветным ободком за исключением S.Typhi, которые растут в виде светлых колоний |
|
4. Сальмонелла шигелла агар (SS) |
С черным центром |
|
5. Висмут сульфит агар |
Черные, среда под колонией прокрашивается. Некоторые серовары сальмонелл (S.Para A, S.Gallinarum могут быть слегка зеленоватыми) |
|
6. Агар Эндо |
Бесцветные, слегка розовые |
|
7. Агар Плоскирева |
Бесцветные, слегка розовые, иногда с черным центром |
8.3.1. После подготовки материала от больных к исследованию производят его посев на среду обогащения. При этом можно использовать как среды отечественного производства, так и импортные, разрешенные к реализации в России. При необходимости допускается приготовление некоторых сред в лабораторных условиях (магниевая среда, селенитовая среда, Мюллер-Кауфман среда, среда Раппапорт-Вассилиадис).
Непосредственный высев материала из среды обогащения до ее инкубирования в термостате может заменить прямой высев на дифференциально-диагностические среды.
8.3.2. Испражнения, доставленные в фосфатно-буферном растворе, высевают в среду обогащения двойной концентрации в соотношении 1:1. Фекалии, доставленные в глицериновом консерванте или транспортной среде, помещают в обычную среду обогащения в соотношении 1:10. Испражнения, доставленные без консерванта, суспендируют в среде обогащения в соотношении 1:5. Из указанных суспензий делают высев на дифференциально-диагностические среды, оставшуюся часть инкубируют в термостате.
8.3.3. Кровь, взятую из вены, высевают в двойную среду. В случае крайней необходимости в 10 - 20 %-ный желчный бульон. После 16 - 20 ч. инкубирования делают высев на одну из дифференциально-диагностических сред. При отрицательном результате делают повторные посевы на 3-и, 5-е, 8-e сутки.
8.3.4. Рвотные массы, промывные воды желудка и мочу после центрифугирования высевают в среды обогащения. В случае исследования материала без центрифугирования посев проводят в среду обогащения двойной концентрации в соотношении 1:1 и после 18 - 24 ч. инкубирования делают высев на дифференциально-диагностические среды.
8.3.5. Каждую фракцию желчи (дуоденального содержимого) высевают во флаконы со слабощелочным питательным бульоном в соотношении 1:10 и на дифференциально-диагностические среды. Через 18 - 24 ч. из флаконов осуществляют повторный высев на дифференциально-диагностические среды. В случае получения отрицательных результатов высев повторяют на 3 и, 5-, 7-е сутки, используя среды слабой селективности.
8.3.6. Спинномозговую жидкость высевают на шоколадный агар.
8.3.7. Операционный и секционный материал высевают в одну из сред обогащения в отношении 1:10. Допускается одновременный высев суспензии материала в среду обогащения и на дифференциально-диагностические среды.
8.3.8. При наличии другого клинического материала его высевают на две-три дифференциально-диагностические среды (комбинируя высоко- и низко селективные среды и в емкости со средой обогащения одновременно).
При посеве на плотные среды исследуемый материал наносят с помощью бактериологической петли (материал от больных), пипетки, стеклянной палочки или тампона (пробы продуктов и смывы) с последующим втиранием материала шпателем по всей поверхности среды. На высоко селективные среды посевной материал вносят в большом объеме (в 3 - 5 раз), чем на слабо селективные.
Пластинчатые среды подсушивают, на их поверхности не должна оставаться конденсационная жидкость, что обеспечивает рост изолированных колоний.
8.3.9. После инкубирования посевов на средах обогащения делается повторный высев на дифференциально-диагностические среды с последующим отбором подозрительных колоний (прилож. 2, 5.)
Необходимо учитывать, что при исследовании различных материалов на инфицированность сальмонеллами отличаются только начальные этапы анализа (правила взятия материала, его обработка, выбор адекватных питательных сред). Начиная с отбора колоний на дифференциально-диагностических средах, последующие этапы бактериологического исследования идентичны.
9. Исследование пищевых продуктов
9.1. Взятие проб и их транспортировка.
9.1.1. Объектами исследования могут являться продукты, указанные в СанПиН 2.3.2.1078-01, а также остатки пищи, употребленной заболевшими, а также исходные продукты и полуфабрикаты, которые использовали при ее приготовлении, суточные пробы готовой пищи и др. подозреваемые в качестве фактора передачи возбудителя инфекции.
9.1.2. Пробы для исследования отбирают по ГОСТ 26668-85 "Продукты пищевые и вкусовые. Методы отбора проб для микробиологического анализа", по ГОСТ 9792-73, "Колбасные изделия и продукты из свинины, баранины, говядины и мяса других видов убойных животных и птиц. Правила приемки и методы отбора проб", а также "Мясо птицы" (ГОСТ 7702.20-95). "Субпродукты и полуфабрикаты птичьи. Методы отбора проб".
9.1.3. Остатки консервов направляют в лабораторию непосредственно в той банке, из которой их использовали в пищу. При отсутствии остатков консервов исследованию подлежит содержимое 2 - 5 невскрытых банок с аналогичной маркировкой.
9.1.4. Мелкую рыбу отбирают в количестве 2 - 3 шт., у крупной вырезают 3 - 4 куска из спинки, ближе к голове, и из участков около анального отверстия общей массой не менее 200 г.
9.1.5. Солонину и соленые продукты, находящиеся в бочечной таре, берут сверху, из середины и со дна бочки. Общая масса пробы должна быть не менее 200 г. В отдельную посуду набирают 100 - 200 мл рассола.
9.1.6. Пробы жидких и полужидких продуктов и кормов (супы, соусы, заменитель цельного молока - ЗЦМ) отбирают после тщательного перемешивания в количестве около 200 г.
9.1.7. Молочные продукты заводского приготовления доставляют в лабораторию в оригинальной упаковке, прочие - в объеме до 200 мл.
9.1.8. Суточные пробы направляют для исследования непосредственно в той посуде, в которой они хранились в холодильнике. Остатки фактически употребленной пищи отбирают в той посуде, в которой их обнаружили.
9.1.9. Яйца отбирают по 5 шт. из шести разных мест обследуемой партии; в первую очередь берут яйца, хранившиеся более 7 дней.
9.1.10. Материал, подлежащий исследованию, помещают в стерильную посуду (банки, пробирки, флаконы), новые полиэтиленовые пакеты, стерильную пергаментную бумагу, тщательно укупоривают и упаковывают.
Пробы можно брать в стерильные одноразовые емкости, стаканы или банки, прокипяченные 15 мин. Обработка посуды дезинфицирующими средствами не допускается.
Каждую пробу снабжают этикеткой с наименованием материала и источника его получения.
При направлении проб продуктов дополнительно указывают, какой из продуктов подозревается в качестве фактора риска.
9.2. Подготовка к исследованию
9.2.1. При исследовании пищевых продуктов делают навеску. Величина навески определяется видом продукта, масса которого должна соответствовать величине норматива на отсутствие в нем бактерий рода сальмонелла. Чаще всего масса навески составляет 25 г.
9.2.2. Продукты плотной консистенции гомогенизируют или растирают в ступках.
9.2.3. Пищевые продукты, бактериологическое исследование которых проводят в соответствии с требованиями МУК 4.2.577-96 "Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов" и ГОСТ 30705-2000 "Продукты молочные для детского питания. Методы микробиологического анализа", берут для исследования в количестве, предусмотренном в указанных документах.
9.2.4. Крем, сливочное масло, мороженое и т.п. перед посевом расплавляют в водяной бане.
9.2.5. Жидкие продукты, имеющие кислую реакцию (рН меньше 4,5), перед посевом нейтрализуют 10 %-ным стерильным раствором бикарбоната натрия до слабощелочной реакции (рН 7,0 - 7,4).
9.2.6. При исследовании яиц скорлупу обрабатывают спиртом и обжигают, после чего яйца разбивают и отделяют желток и белок в стерильную посуду, объединяя отдельно по пять желтков и белков в одной пробе. Желтки и белки гомогенизируют и используют для посева.
9.3. Методы выделения
9.3.1.Подготовленные пробы продуктов питания высевают в неселективную среду обогащения в соотношении 1:10.
Одновременно делают посев материала из указанной среды до ее инкубирования на дифференциально-диагностические среды. Предпочтительно использовать одну чашку с низко селективной средой и одну с высоко селективной. Инкубируют посевы при 37 °С в течение 18 - 24 часов (чашки с висмут-сульфит агаром - 48 часов).
После инкубирования посевов на неселективной среде обогащения проводится посев материала в две среды селективного обогащения. При этом должно соблюдаться следующее соотношение посевной дозы и объема среды обогащения. Для всех указанных сред обогащения оно составляет 1 мл надосадочной жидкости на 10 мл среды и инкубировании 18 - 20 час при 37 °С. Для среды Мюллер-Кауфмана 1 мл надосадочной жидкости на 10 мл среды инкубирование 18 - 20 час при 41,5 - 42 °С (прилож. 3, 4).
При использовании среды Раппапорт-Василиадис вносить 0,1 мл из неселективной среды обогащения (забуференной пептонной воды) в 10 мл указанной среды и инкубировать при 42 °С в течение 18 - 24 час.
Материал, прошедший инкубацию на средах селективного обогащения, высевается на чашки Петри с двумя-тремя дифференциально-диагностическими средами (прилож. 2, 5).
10. Исследование объектов окружающей среды
Основными объектами окружающей среды, подлежащими исследованию на наличие сальмонелл, являются смывы с различных предметов на эпидемиологически значимых объектах и в лечебно-профилактических учреждениях, а также вода (питьевая, открытых водоисточников, сточная), воздух и почва.
10.1. Взятие проб и их транспортировка
10.1.1. Отбор проб смывов осуществляют стерильными ватными или ватно-марлевыми тампонами. Тампоны монтируют на деревянной палочке или проволоке, пропущенной через пробку, помещают в пробирку и стерилизуют 30 мин при температуре 120 °С. Затем в каждую пробирку наливают 2 мл предварительной среды обогащения - забуференной пептонной воды рН 7,0. Непосредственно перед взятием смыва тампон увлажняют, наклоняя пробирку, излишек влаги отжимают о стенку пробирки.
Смывы берут с площади не менее 100 см2, если нет специальных указаний для данного объекта.
При взятии смывов с яичной скорлупы один тампон используют для исследования 10 яиц.
10.1.2. Для отбора проб воды используют стерильные флаконы вместимостью 0,5 л с притертой, каучуковой или корковой пробкой.
Пробы воды (питьевой) отбирают при соблюдении правил стерильности, после предварительной стерилизации кранов обжиганием пламенем горящего тампона, смоченного спиртом, и последующего спуска воды в течение 10 - 15 мин при полностью открытом кране. Пробы должны быть исследованы не позже чем через 2 ч после их отбора.
При невозможности выполнения этих условий анализ допускается проводить не позже чем через 6 ч после отбора проб, сохраняя их при температуре 4 ± 2 °С.
Пробы воды открытых водоемов или сточных вод отбирают в соответствии с МУК 4.2.1884-04.
10.1.3. Анализ почвы на наличие сальмонелл проводят по эпидпоказаниям. Навеску в 50 г помещают в среду неселективного обогащения в соотношении 1:10 и дальнейшее исследование выполняют аналогично пищевым продуктам.
10.1.4. Отбор проб воздуха
Определение наличия сальмонелл в воздухе проводится по эпидпоказаниям.
Пробы воздуха отбирают аспирационным методом с помощью аппаратов и устройств, разрешенных к применению в установленном порядке.
Количество пропущенного воздуха должно составлять 250 дм3 на одну чашку с дифференциально-диагностической средой. В качестве таких сред используют 2 чашки с агаром эндо и две чашки с висмут-сульфит агаром. Таким образом, объем пропущенного через аппарат воздуха составляет 1000 дм3.
10.2. Подготовка к исследованию
10.2.1. Подготовка к исследованию воды необходима при использовании метода мембранной фильтрации при определении наличия в ней сальмонелл. Для этого берутся 2 объема воды по 500 мл каждый. Каждый объем фильтруют через один или несколько мембранных фильтров.
10.3. Методы выделения
10.3.1. При исследовании смывов после высева на среду Кесслера смывную жидкость заливают 5 мл одной из рекомендуемых для выделения сальмонелл сред обогащения (магниевая, селенитовая или среда Раппапорт-Вассилиадис) и помещают в термостат при 37 °С на 18 - 20 ч. После инкубации делают высев на среду Эндо и висмут сульфит агар с последующим отбором подозрительных колоний и их идентификацией.
10.3.2. При исследовании воды питьевой, поверхностных водных объектов и сточных вод берутся 2 пробы по 500 мл каждая и вносятся в равный объем селективной среды обогащения двойной концентрации. При использовании мембранной фильтрации для исследования полученные фильтры помещают в 50 мл в каждой из двух сред накопления, например магниевую и селенитовую, или среду Раппапорт-Василиадис и селенитовую.
Посевы инкубируют при 37 °С 18 - 20 ч. Затем делают высев на дифференциально-диагностические среды. Дальнейший анализ ведут также как и при выделении сальмонелл из других объектов исследования.
10.3.3. При исследовании воздуха
Чаши с агаром эндо помещают в термостат при 37 °С на 18 - 20 ч, а чашки с висмут-сульфит агаром инкубируют при той же температуре 48 ч.
Колонии подозрительные на сальмонеллы идентифицируют по той же схеме, что и изолированные из других объектов.
11. Идентификация сальмонелл
После 18 - 20 часового инкубирования чашек с дифференциально-диагностическими средами (висмут-сульфит агар 48 ч) производится учет характера роста с отбором 3 - 5 подозрительных колоний на одну из сред для первичной идентификации (Клиглера, Ресселя, Олькеницкого) и на скошенный питательный агар. В случае чрезвычайной эпидемической ситуации культуру, выросшую на указанных средах, используют для последующей постановки реакции агглютинации. Результаты этой реакции ориентировочны и требуют подтверждения на этапе завершения биохимической идентификации.
11.1. Определение ферментативных свойств выделенных микроорганизмов
Если культуры не ферментируют лактозу, не расщепляют мочевину, но ферментируют глюкозу и образуют сероводород, то они подозрительны на принадлежность к роду сальмонелла и подвергаются дальнейшему изучению.
О ферментации лактозы (и сахарозы) в среде Олькеницкого и ферментации лактозы в среде Клиглера и Ресселя судят по появлению желтой окраски в скошенной части агара, а о ферментации глюкозы - по такому же окрашиванию в столбике. Газообразование устанавливают по наличию пузырьков газа и разрыву агара, а образование сероводорода - по почернению среды. В среде Олькеницкого при росте культуры, гидролизирующей мочевину, среда приобретет диффузный яркий красно-малиновый цвет.
В случае если в результате прямого посева испражнений не выросло ни одной колонии или выросли единичные колонии, необходимо произвести повторный высев, увеличив порцию засеваемого материала. При повторном отсутствии роста следует получить материал для исследования еще раз.
У подозрительных культур изучают их ферментативные характеристики, позволяющие определить родовую принадлежность выделенных бактерий. Для этих целей используют тесты, позволяющие определить способность к образованию индола, наличие роста на средах с цитратами, разложение салицина и малоната натрия, наличие лизин-декарбоксилазы, фенилаланиндезаминазы, способность к разложению мочевины, образованию ацетил-метил-карбинола в реакции Фогес-Проскауэра. Ставится также проба с метиловым красным и определяется подвижность.
Сальмонеллы индола не образуют, способны расти на средах с цитратами, декарбоксилировать лизин (за исключением некоторых штаммов S.Typhimurium, S.Enteritidis), не имеют фенилаланиндезаминазы, не разлагают мочевину, отрицательны в реакции Фогес-Проскауэра, положительны в пробе с метил-рот, подвижны (за исключением S.Gallinarum). Подавляющее большинство сальмонелл не ферментируют салицин.
Для определения родовой принадлежности культур можно использовать системы для идентификации энтеробактерий, в т.ч. пластины биохимические, дифференцирующие энтеробактерий (ПБДЭ), Аpi20Е, Бак трак, Vidas, mini-Vidas и другие приборы, прошедшие соответствующие испытания и рекомендованные к применению в лабораториях системы Роспотребнадзора РФ.
При необходимости получения срочного, предварительного ответа, определяется антигенная структура выделенных возбудителей в реакции агглютинации на стекле с О и Н-агглютинирующими диагностическими сальмонеллезными сыворотками.
Серотипирование штаммов сальмонелл включает в себя выявление соматического антигена (О-антигены сальмонелл), являющегося липополисахаридом (ЛПС), и жгутиковых антигенов (Н-антигены), представленных термолабильными белками. Большинство сероваров сальмонелл имеют Н-антигены двух фаз. Такие сальмонеллы называются двуфазными (например - S.Typhimurium. Антигенная формула - О: 1, 4, 5, 12; H:i; 1,2). Известны монофазные (например - S.Enteritidis, антигенная формула - О: 1, 9, 12; Н:gm). Неподвижные (бесфазные) - S. Gallinarum.
Определение сероваров основано на антигенной комбинации отдельных О- и Н- антигенов.
11.2. Определение О-антигенов, выделенных микроорганизмов
Определение О-антигена проводится в реакции агглютинации на стекле. В сыворотке находятся антитела к О-антигенам сальмонелл, которые образуют агглютинат с бактериями, обладающими соответствующими антигенами.
Растворять сухие сальмонеллезные О-сыворотки следует в 1,0 мл изотонического раствора хлорида натрия (или 2,0 мл), согласно прилагаемой инструкции.
На предметное стекло наносится одна капля сыворотки и одна капля изотонического раствора хлорида натрия. С питательного агара берется полная петля культуры, выращенной в течение 18 - 24 ч при 37 °С. Культура наносится на предметное стекло вблизи капли изотонического раствора хлорида натрия и эмульгируется (контроль на отсутствие спонтанной агглютинации). При отсутствии спонтанной агглютинации манипуляцию повторяют в капле О сыворотки, формируя равномерную непрозрачную суспензию. Учет результатов проводят в течение 1 - 2 минут, мягко покачивая стекло. Гомогенная суспензия свидетельствует об отрицательном результате. Образование хлопьев агглютината внутри капли расценивается как положительный результат.
Агглютинация проявляется через несколько секунд (или 1 минуты) в виде хлопьев (зерен) агглютината формирующихся внутри капли на фоне ее просветления. Штаммы, находящиеся в R-форме, обладают самопроизвольной агглютинацией. Их дальнейшее серотипирование не представляется возможным без дополнительных манипуляций. Такие штаммы пересевают на слабощелочной агар для того, чтобы выбрать колонию с ровными краями и вернуть штамм в S (гладкую) форму и повторить агглютинацию. Если агглютинация с поливалентными О-антисыворотками не происходит, маловероятно, что штамм относится к роду Salmonella.
11.3. Определение Н-антигена выделенных микроорганизмов
Для определения Н-антигенов используют ту же культуру, выросшую на питательном агаре. Если культура малоподвижна, можно применять полужидкий (0,7 %) агар, условно называемый агаром для роения, формируя посев в виде небольшого пятна в центре чашки Петри. Посев инкубируют в течение ночи при 37 °С. Сухие сальмонеллезные Н-сыворотки растворяются также как и О-сыворотки, согласно прилагаемой инструкции. На предметное стекло наносят одну каплю Н-сыворотки и одну каплю изотонического раствора хлорида натрия. С периферии указанного агара для роения или из конденсата на косяке берут полную петлю культуры. Наносят ее на предметное стекло вблизи капли изотонического раствора хлорида натрия и эмульгируют (контроль на отсутствие спонтанной агглютинации). При отсутствии спонтанной агглютинации манипуляцию повторить в капле Н-сыворотки, формируя равномерную непрозрачную суспензию. Учет результатов проводят в течение 1 - 2 минут, мягко покачивая стекло. Гомогенная суспензия свидетельствует об отрицательном результате. Образование хлопьев (зерен) агглютината внутри капли расценивается как положительный результат.
Результаты определения О- и Н-антигенов сальмонелл фиксируются в протоколе. В случае отсутствия реакции агглютинации с сыворотками одной из Н-фаз проводят инверсию (подавление) обнаруженной Н-фазы (метод Свена-Гарда).
Для определения невыявленного Н-антигена готовят чашки Петри с полужидким (0,7 %) агаром. После застывания агара в центр чашки добавляют 0,1 мл антисыворотки против выявленного Н-антигена первой или второй фазы. Дают сыворотке впитаться в агар, а затем в центр капли петлей наносят культуру.
Вместо чашки можно также использовать U-образную трубку. Инкубировать посев при 37 °С 18 - 24 ч (чашки не переворачивать!). Соответствующая антисыворотка связывает выявленный Н-антиген, подвижность (роение) штамма будет происходить за счет клеток, содержащих Н-антиген не обнаруживаемой фазы. Неизвестная фаза Н-антигена определяется тем же способом, что и выявленная. При этом культура берется с периферии выросшей макроколонии или с противоположного относительно посеву колена U-образной трубки. Затем после суммирования результатов О и Н - серотипирования определяется серовар штамма, согласно схемы Кауфмана-Уайта.
Серологическую идентификацию сальмонелл начинают с испытания их в реакции агглютинации на стекле с агглютинирующей адсорбированной поливалентной сывороткой к сальмонеллам групп А, В, С, Д, Е), а в случае получения отрицательного результата с агглютинирующей адсорбированной поливалентной сывороткой к сальмонеллам редких групп.
При получении положительных результатов агглютинации со смесью О-сывороток, культуру испытывают с каждой О-сывороткой, входящей в смесь. После установления принадлежности культуры к одной из О-групп, выявляют наличие дополнительных О-антигенов, присущих представителям указанной группы.
После этого проводят реакцию агглютинации с Н-сыворотками. При этом вначале используют Н-сыворотки, соответствующие Н-антигенам 1 фазы, а потом Н-антигенам 2 фазы. Начинать следует с Н-сывороток, соответствующих более распространенным сероварам данной группы.
Для реакции агглютинации с О-сывороткой следует брать культуру с верхней части скошенного агара, для Н-сывороток - конденсат или с нижнего участка роста (наиболее подвижные особи).
Для подтверждения принадлежности культуры к роду Salmonella, в случае затруднений с идентификацией, можно пользоваться пробой с бактериофагом, используя лечебный бактериофаг сальмонеллезный.
Для этого две капли четырех или восемнадцати часовой бульонной культуры испытуемого штамма наносят тонко оттянутой пастеровской пипеткой или петлей на хорошо подсушенный слабощелочной агар в чашке Петри. После подсыхания на одну из капель петлей или пастеровской пипеткой меньшего диаметра, наносят каплю бактериофага, а на другую, в качестве контроля - каплю бульона.
На одной чашке, таким образом, можно испытать одновременно 5 - 6 культур.
Чашки с нанесенными культурами и бактериофагом помещают в термостат на 18 - 24 ч, после чего учитывают результаты по появившейся на месте нанесения фага четко очерченной зоне сливного лизиса или большего или меньшего числа негативных колоний.
При отсутствии лизиса в местах нанесения фага будет сплошной рост культуры, как в контроле.
Атипичные сальмонеллезные культуры в большинстве случаев чувствительны к фагу, в то время как штаммы представителей других родов семейства Enterobacteriaceae как правило не лизируются этим фагом.
11.4. Определение биоваров сальмонелл
В пределах некоторых сероваров сальмонелл наблюдается различная ферментативная активность в отношении отдельных углеводов, органических кислот или многоатомных спиртов. Это позволяет проводить биохимическое типирование штаммов сальмонелл, относящихся к таким сероварам.
Типирование можно осуществлять по любой комбинации тестов, по отношению к которым выявлены вариабельные свойства у штаммов одного серовара.
Наибольшее число биоваров сальмонелл выявлено среди штаммов S. Typhimurium (табл. 2).
В настоящее время типирование среди S.Enteritidis проводят по способности к ферментации бульона Штерна и наличию лизиндекарбоксилазы. S.Enteritidis var. ratin характеризуется отсутствием указанных ферментов, a S.Enteritidis var jena - их наличием.
По способности ферментировать d-тартрат различают S.Java (d-тартрат положительна) и S.Paratyphi В (d-тартрат отрицательна).
Биовары S.Typhimurium
|
Биовар |
Арабиноза |
Ксилоза |
Рамноза |
d-тартрат |
i-тартрат |
Мукат |
Инозит |
|
1-й |
+ |
- |
- |
- |
- |
- |
- |
|
2-й |
+ |
+ |
- |
- |
- |
- |
- |
|
3-й |
+ |
+ |
+ |
- |
- |
- |
- |
|
4-й |
+ |
+ |
+ |
+ |
- |
- |
- |
|
5-й |
+ |
+ |
+ |
+ |
+ |
- |
- |
|
6-й |
+ |
+ |
+ |
+ |
+ |
+ |
- |
|
7-й |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
8-й |
+ |
- |
+ |
+ |
+ |
+ |
+ |
|
9-й |
+ |
+ |
- |
+ |
+ |
+ |
+ |
|
10-й |
+ |
+ |
- |
+ |
+ |
- |
+ |
|
11-й |
- |
+ |
+ |
- |
- |
+ |
+ |
|
12-й |
+ |
+ |
- |
+ |
+ |
+ |
- |
|
13-й |
- |
- |
- |
+ |
+ |
+ |
+ |
|
14-й |
- |
- |
+ |
+ |
+ |
+ |
+ |
|
15-й |
+ |
- |
+ |
+ |
+ |
+ |
- |
|
16-й |
+ |
- |
+ |
- |
- |
+ |
+ |
|
17-й |
+ |
+ |
+ |
- |
- |
+ |
- |
|
18-й |
+ |
+ |
+ |
- |
- |
+ |
+ |
|
19-й |
+ |
+ |
+ |
- |
- |
- |
+ |
|
20-й |
+ |
+ |
+ |
- |
+ |
- |
- |
|
21-й |
+ |
+ |
+ |
+ |
- |
+ |
+ |
|
22-й |
+ |
+ |
+ |
- |
+ |
+ |
- |
|
23-й |
+ |
+ |
+ |
- |
+ |
+ |
+ |
|
24-й |
+ |
+ |
+ |
+ |
- |
+ |
- |
|
25-й |
+ |
+ |
+ |
+ |
+ |
- |
+ |
Необходимо учитывать, что в последнем издании съемы Кауфмана-Уайта (2001 г.) выделяемые ранее как серовары сальмонелл, имеющие одну и ту же антигенную структуру и отличающиеся только по некоторым биохимическим характеристикам объединены в один серовар (S.Isangi объединена с S.Mission, S.Gallinarum с S.Pullorum, S.Paratyphi B с S.Java). Кроме этого, О-группа Е1 объединена с О-группой Е2 и Е3.
12. Использование серологических методов исследования для диагностики сальмонеллезов и выявления различных форм бактерионосительства
В дополнение к микробиологическому методу диагностики в качестве ориентировочных во время вспышек могут быть использованы клинический, эпидемиологический, серологический и молекулярно-генетический методы. Эпидемиологическим подтверждением постановки диагноза является наличие вспышки при условии, что указанный больной подвергался воздействию выявленного фактора риска, а клиническим - обнаружение клинической картины сальмонеллеза.
Использование РПГА для диагностики сальмонеллезов имеет вспомогательное значение, т.к. в крови практически здоровых людей могут присутствовать антитела к антигенам сальмонелл. Вследствие этого понятие "диагностического титра" антител носит весьма условный ориентировочный характер. Следует учитывать и то, что для разных районов страны величина "диагностического титра" будет различной, что связано с территориальными особенностями эпидемической ситуации. Существенно большее диагностическое значение имеет нарастание уровня антител в динамике заболевания, для чего сыворотку нужно брать сразу после выявления больного, а затем в конце первой или в начале второй недели болезни. В более поздние сроки заболевания титр антител снижается, что также может служить диагностическим критерием.
Парные сыворотки должны исследоваться одномоментно (для этого первая сыворотка до исследования должна храниться в замороженном виде).
Условно-диагностическим титром считается титр не ниже 1:320 для взрослых, 1:80 для детей до 6 мес. и 1:110 для детей старше 6 мес.
Положительным нарастанием титра антител считается их 4-х кратное увеличение по отношению к одному и тому же антигену.
При серологической диагностике сальмонеллезов большое диагностическое значение имеют иммуноглобулины, образование которых обусловливает нарастание титра антител в крови лиц, инфицированных сальмонеллами в определенные периоды жизни. При этом наиболее специфичны в диагностическом плане IgG-антитела. Вместе с тем IgM-антитела появляются в крови раньше других. Они могут образовываться и у здоровых лиц в результате "бытовой" иммунизации или вследствие ранее перенесенной инфекции, т.е. IgM-антитела менее специфичны.
IgM-антитела инактивируются при обработке сыворотки крови цистеином, тогда как IgG-антитела резистентны к этому препарату. После обработки сыворотки крови цистеином в РПГА выявляются только IgG-антитела, тем самым повышается специфичность реакции.
Скорость образования антител и их титр зависят от возраста больного, стадии и тяжести течения болезни, состояния преморбидного фона и других факторов, отражаемых в анализе.
Порядок исследования крови человека:
Сыворотку крови взрослых людей исследуют дважды: сразу после поступления больного в стационар и на второй неделе болезни, а при возможности исследование проводят и в период реконвалесценции.
Сыворотку крови детей первых двух лет жизни исследуют в динамике сразу после поступления ребенка в стационар, затем каждые 7 - 10 дней. При невозможности проведения повторных исследований однократное серологическое обследование назначают в следующие сроки в зависимости от возраста ребенка:
• до года при легкой и средне-тяжелой формах - на третьей неделе болезни, при тяжелой форме - на четвертый - шестой;
• в возрасте одного - трех лет - на второй неделе независимо от тяжести болезни;
• старше трех лет независимо от тяжести болезни - на шестой - седьмой день.
В табл. 3 приведен уровень антител в крови детей.
12.1. Постановка РПГА
Сыворотку крови исследуют в РПГА с комплексным антигеном. При высоком (не ниже 1:320) титре или нарастании уровня антител сыворотку исследуют в РПГА со всеми групповыми О-диагностикумами. При этом следует учитывать, что в случае хронического носительства титры суммарных антител могут быть и более низкими. В этом случае при положительном результате бактериологического исследования для выяснения характера носительства необходимо ставить РПГА с цистеином.
12.2. Определение антител в РПГА без цистеина
Для постановки реакции исследуемую сыворотку крови разводят 0,85 %-ным раствором натрия хлорида в соотношении 1:10.
Для титрования готовят раствор 0,85 %-ного натрия хлорида на фосфатном буфере (рН 7,0 - 7,2).
В реакции используют коммерческие эритроцитарные сальмонеллезные О-диагностикумы основных серологических групп (А. В, C1, C2, D и Е) и комплексный (поливалентный) О-диагностикум.
Дальнейшее проведение исследования ведут в соответствии с Инструкцией по применению набора реагентов "Диагностикум эритроцитарный сальмонеллезный О-антигенный жидкий" от 22.08.2008 г. № 6854-Пр/08.
Уровень антител в крови детей
|
Возраст ребенка |
Суммарные О-антитела |
Цистеиноустойчивые О-антитела |
||||
|
титр на первой неделе болезни |
максимальный уровень |
титр на первой неделе болезни |
максимальный уровень |
|||
|
сроки появления, неделя |
титр |
сроки появления неделя |
титр |
|||
|
До 3 мес |
1:20 - 1:40 |
4 - 5-я |
Не более 1:320 |
Отсутствуют |
4 - 5-я |
1:20 - 1:40 |
|
3 - 6 мес |
1:20 - 1:80 |
4 - 5-я |
До 1:320 |
1:20 у 10 % детей |
4 - 5-я |
1:20 - 1:80 |
|
6 - 12 мес |
1:20 - 1:160 |
4 - 5-я |
1:320 и выше |
1:20 у 30 - 40 % детей |
5-я |
До 1:160 |
|
Старше 1 года |
1:80 - 1:320 |
3 - 4-я |
1:320 и выше |
1:80 - 1:320 |
3 - 4-я |
1:320 и выше |
|
Старше 8 лет |
1:80 - 1:320 |
2 - 3-я |
1:320 и выше |
1:80 - 1:320 |
2 - 3-я |
1:320 и выше |
12.3. Определение антител в РПГА с цистеином
Для определения в сыворотке крови удельного содержания IgG-антител готовят раствор цистеина*. Для этого 10 - 15 мг солянокислого L-цистеина или "свободного" цистеина квалификации "ч" растворяют в 1 мл 0,1 н. раствора едкого натра с таким расчетом, чтобы рН готового раствора равнялся 7,0 - 7,2. Готовый раствор хранят не более 1 ч.
Исследуемую сыворотку разводят 0,85 %-ным раствором натрия хлорида в соотношении 1:5 и смешивают с равным объемом раствора цистеина. Пробирку герметизируют (резиновой пробкой, лейкопластырем, парафином) и помещают в термостат на 18 - 20 ч. при температуре 37 °С.
Дальнейшее исследование проводят, как указано в п. 10.1, при этом в раствор для титрования добавляют 1 % нормальной инактивированной сыворотки крови (лошадиной, кроличьей, крупного рогатого скота). Сыворотка должна быть проверена на отсутствие антител к применяемым диагностикумам.
________________
* Вместо цистеиновой пробы можно использовать унитиоловую, в которой цистеин заменен унитиолом. (Информационное письмо МЗ РСФСР № 10/11-3223 от 28.08.1987 г.)
12.4. Учет РПГА и интерпретация результатов
Реакция агглютинации считается положительной, если эритроциты полностью агглютинировались и расположены равномерно по дну лунки или при почти полной агглютинации небольшая часть эритроцитов оседает в центре лунки в виде ровного колечка или пуговки. Иногда при положительной реакции края агглютината в лунках могут слегка сползать, и он принимает вид "зонтика". При отрицательном результате агглютината нет, эритроциты оседают на дне в центре в виде пуговки или ровного колечка.
В случае возникновения вспышки сальмонеллеза серологически обследуют максимальное число лиц, подвергшихся риску заражения или подозреваемых в качестве источника возбудителя инфекции.
При этом обнаружение (обычно в низких титрах) антител в РПГА без цистеина и отсутствие последних при исследовании сыворотки в РПГА с цистеином может расцениваться как транзиторное сальмонеллоносительство.
Достаточно высокий титр в РПГА с цистеином указывает на возможное хроническое сальмонеллоносительство или переболевание сальмонеллезом (даже субклинически) в течение последних 1 - 2 мес.
В случае контроля за бактерионосительством стабильное снижение титра антител (особенно IgG), подтверждаемое отрицательными бактериологическими исследованиями, позволяет сделать заключение об освобождении организма от возбудителя.
13. Молекулярно-генетические методы исследования
Все работы, связанные с применением молекулярно-генетических методов при исследовании материала, содержащего микроорганизмы рода Salmonella, проводятся с соблюдением санитарно-эпидемических правил СП 1.3.2322-08 "Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней", СП 2.1.7.728-99 "Правила сбора, хранения и удаления отходов лечебно-профилактических учреждений" и методических указаний МУ 1.3.1888-04 "Организация работы при исследованиях метолом ПЦР материала, инфицированного патогенными биологическими агентами III - IV групп патогенности".
Молекулярно-генетические методы исследования в отношении микроорганизмов рода Salmonella обладают рядом особенностей, которые необходимо учитывать при определении оптимальной области их применения и правильной интерпретации получаемых результатов:
• объектом детекции является ДНК возбудителя, обнаружение которой не является доказательством жизнеспособности микроорганизма.
• аналитическая чувствительность различных тест-систем на основе метода ПЦР колеблется в пределах 100 - 500 бактериальных клеток/мл, и в ряде случаев может уступать аналитической чувствительности микробиологического исследования с использованием сред селективного обогащения.
• при работе с продуктами питания обнаружение ДНК сальмонелл требует дополнительного микробиологического исследования для выявления культуры возбудителя.
• при работе с клиническим материалом обнаружение ДНК сальмонелл может использоваться в качестве скринингового диагностического теста при групповой заболеваемости сальмонеллезом и у пациентов с антибактериальной терапией, начатой до первичного лабораторного исследования.
• возможность обнаружения нежизнеспособных микроорганизмов дает возможность результативного исследования образцов при неинформативности микробиологического метода (продукты питания после термической обработки, с нарушенными сроками хранения, клинические образцы от пациентов после применения ими антибактериальных препаратов). Спектр специфичности коммерчески доступных тест-систем на основе метода ПЦР позволяет выявлять все микроорганизмы рода сальмонелл, включая и возбудителей тифо-паратифозных заболеваний без серогрупповой дифференцировки между ними.
• различные методы оценки идентичности ДНК микроорганизмов рода Salmonella, выделенных из различных источников, имеют максимальную информативность при их использовании на чистых культурах, выделенных при первичном исследовании образцов.
13.1 Обнаружение ДНК микроорганизмов рода Salmonella в различных видах клинического, биологического материала и продуктах питания
Для выявления ДНК микроорганизмов рода Salmonella в клиническом и биологическом материале используются диагностические тест-системы, разрешенные к применению на территории РФ в установленном порядке. Предпочтение при этом должно отдаваться диагностическим тест-системам, обладающим максимальной степенью контаминационной безопасности (тест-системы с гибридизационно-флуоресцентной детекцией в режиме реального времени или по конечной точке).
Клинический материал для исследования (образцы фекалий, рвотные массы, желчь) следует забирать, исключая его возможную контаминацию ДНК, содержащейся в продезинфицированной посуде (использовать стерильные чашки Петри, одноразовые пластиковые пакеты, подкладываемые в судно перед дефекацией, производить забор фекалий из памперсов или в автоклавированую для разрушения остаточной ДНК многоразовую посуду).
При одновременном проведении молекулярно-генетического и микробиологического исследований возможен унифицированный забор клинического материала и образцов продуктов питания в соответствии с рекомендациями, представленными в соответствующем разделе. При невозможности исследования нативных фекалий возможно их хранение с использованием глицеринового консерванта. Для проведения молекулярно-генетических исследований при длительном хранении допускается замораживание образцов в данном консерванте. Забор материала проводится в объеме 2 - 5 мл.
Условия и сроки хранения и транспортировки клинического материала, а также метода его предварительной обработки определяются инструкцией к используемой диагностической тест-системе.
Выделение ДНК микроорганизмов рода Salmonella из образцов продуктов питания проводят после предварительного обогащения образца в соответствии с рекомендациями, представленными в разделе, описывающем микробиологические исследования. Дальнейшее выявление ДНК сальмонелл в культуральной среде проводят без ее дополнительной обработки в соответствии с инструкцией к тест-системе.
13.2 Оценка идентичности ДНК микроорганизмов рода Salmonella, выделенных из различных источников
Исследования по оценке идентичности штаммов сальмонелл проводятся в соответствующих референс-центрах, региональных центрах по мониторингу за возбудителями инфекционных и паразитарных болезней II - IV групп патогенности (в соответствии с приказом Роспотребнадзора от 17.03.2008 № 88 "О мерах по совершенствованию мониторинга за возбудителями инфекционных и паразитарных болезней") на собственных базах или на базах других организаций, сотрудничающих с ними. При использовании тест-систем для типирования сальмонелл, разрешенных к применению на территории РФ в установленном порядке, допускается их использование на базе лабораторий ФГУЗ "Центров гигиены и эпидемиологии" в субъектах Российской Федерации. Результаты оценки идентичности штаммов должны получать эпидемиологическую интерпретацию только в рамках комплексного эпидемиологического расследования, так как в изолированном виде не могут свидетельствовать о эпидемиологической связи между источниками их выделения, а позволяют лишь исключить наличие такой связи. Для оценки идентичности ДНК микроорганизмов рода Salmonella используются молекулярно-генетических методики, обеспечивающие:
• необходимую для исследований разрешающую способность (способность дифференцировки штаммов микроорганизмов, циркулирующих на данной территории);
• межлабораторную воспроизводимость результатов исследований, отсутствие субъективизма при интерпретации их результатов;
• предпочтение должно отдаваться широко используемым в мире методикам, позволяющим провести сопоставление получаемых результатов с международными данными (мультилокусное секвенирование-типирование - MLST и его варианты, амплификация тандемных повторов с переменной копийностью - VNTR и его варианты, электрофорез в пульсирующем поле - PFGE, оценка полиморфизма длинны фрагментов амплификации - AFLP и др.). Желательно более широкое применение методик, позволяющих провести межлабораторное сравнение получаемых результатов исследования Не рекомендуется применение методик, обладающих низкой внутри- и межлабораторной воспроизводимостью - например, амплификации со случайными праймерами (RAPD).
При оформлении заключения по результатам оценки идентичности изолятов, должна быть представлена следующая информация:
• количество, состояние полученных культур микроорганизмов;
• краткое описание используемой методики с указанием используемого оборудования и программного обеспечения, при использовании метода прямого секвенирования - размеров и расположения анализируемых участков генома; при использовании методик, результаты которых имеют форму паттернов (VNTR, AFLP, PFGE) - графическое представление полученных результатов.
Организации, ответственные за проведение данных разделов работы, сохраняют образцы клинического материала и ООС, культуры микроорганизмов и результаты исследований в виде первичных материалов (файлы, полученные на детектирующих приборах) до оформления окончательного донесения об очаге инфекционного заболевания с групповой заболеваемостью, а при проведении комиссионной судебной экспертизы в рамках уголовного дела - до истечения срока обжалования решения суда.
Приложение № 1
Блок-схема для выделения
сальмонелл
(по материалам международного надзора за сальмонеллезами,
лабораторные протоколы обучающих курсов, 5-е издание 2007 г.)
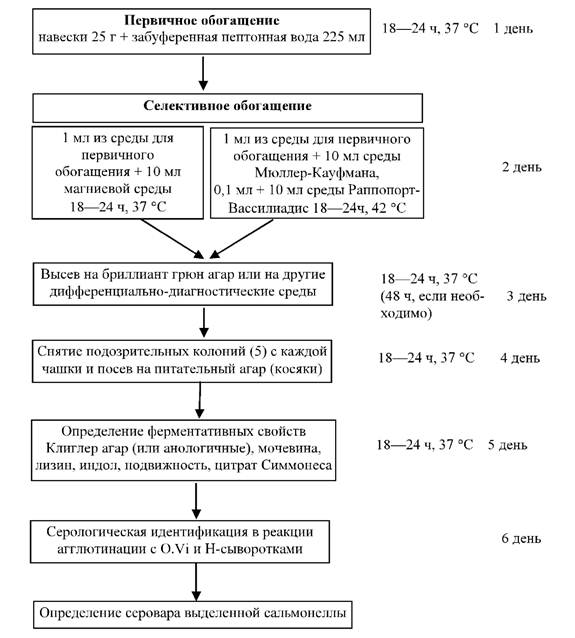
Приложение № 2
Схема выделения сальмонелл из испражнении
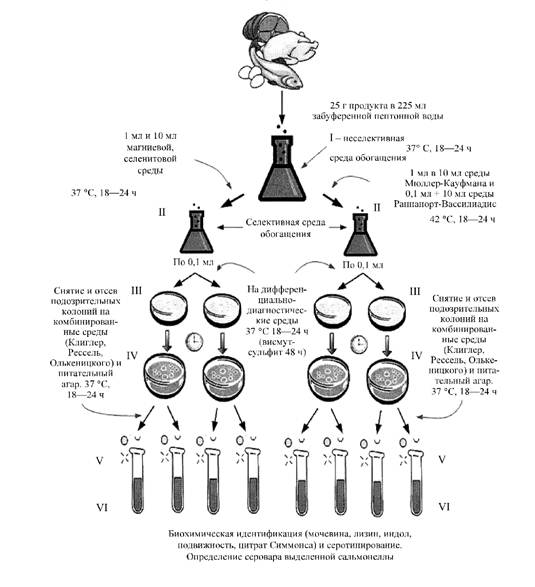
Приложение № 3
Схема выделения сальмонелл из пищевых продуктов
Неселективное обогащение

_________________
* Используется навеска продукта, масса которого соответствует величине норматива на бактерии рода сальмонелла в исследуемом продукте при соотношении навески продукта и среды обогащения 1:9
* Среда Раппапорт-Вассилиадис имеет преимущества перед другими селективными средами при исследовании сырых рыбных продуктов, креветок и высококонтаминированной пищи.
Приложение № 4
Схема выделения сальмонеллы из пищевых продуктов
Приложение № 5
Схема выделения сальмонеллы из испражнений
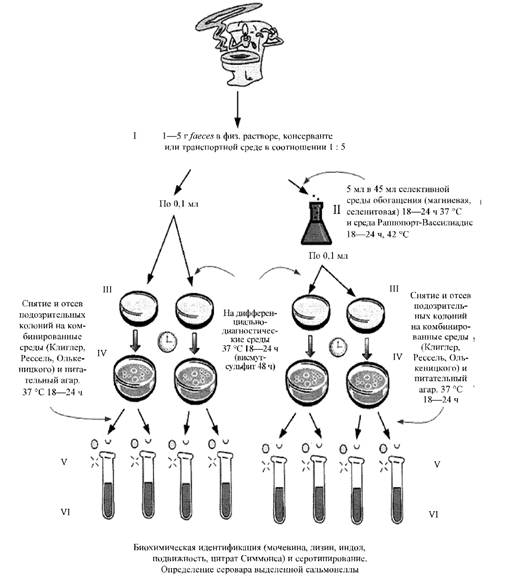
Приложение № 6
Схема Кауфмана-Уайта (Издание № 8, 2001 год)
|
Серовар |
Соматические O антигены |
Жгутиковые H антигены |
|
|
Фаза 1 |
Фаза 2 |
||
|
Группа O:2 (A) |
|||
|
Paratyphi A |
1, 2, 12 |
a |
[1, 5] |
|
Nitra |
2, 12 |
g, m |
- |
|
Kiel |
1, 2, 12 |
g, p |
- |
|
Koessen |
2, 12 |
l, v |
1, 5 |
|
Группа O:4 (B) |
|||
|
Kisangani |
1, 4, [5], 12 |
a |
1, 2 |
|
Hessarek |
4, 12, 27 |
a |
1, 5 |
|
Fulica |
4, [5], 12 |
a |
- |
|
Arechavaleta |
4, [5], 12 |
a |
1, 7 |
|
Bispebjerg |
1, 4, [5], 12 |
a |
e, n, x |
|
Tinda |
1, 4, 12, 27 |
a |
e, n, z15 |
|
II |
1, 4, [5], 12, 27 |
a |
e, n, x |
|
Huettwilen |
1, 4, 12 |
a |
l, w |
|
Nakuru |
1, 4, 12, 27 |
a |
z6 |
|
II |
1, 4, 12, 27 |
a |
z39 |
|
Paratyphi B |
1, 4, [5], 12 |
b |
1, 2 |
|
Limete |
1, 4, 12, 27 |
b |
1, 5 |
|
II |
4, 12 |
b |
1, 5 |
|
Canada |
4, 12, 27 |
b |
1, 6 |
|
Uppsala |
1, 4, 12, 27 |
b |
1, 7 |
|
Abony |
1, 4, [5], 12, 27 |
b |
e, n, x |
|
II |
1, 4, 12, 27 |
b |
[e, n, x] |
|
Wagenia |
1, 4, 12, 27 |
b |
e, n, z15 |
|
Wien |
1, 4, 12, 27 |
b |
l, w |
|
Tripoli |
1, 4, 12, 27 |
b |
z6 |
|
Schleissheim |
4, 12, 27 |
b |
- |
|
Legon |
1, 4, 12, 27 |
c |
1, 5 |
|
Abortusovis |
4, 12 |
c |
1, 6 |
|
Altendorf |
4, 12, 27 |
c |
1, 7 |
|
Bissau |
4, 12 |
c |
e, n, x |
|
Jericho |
1, 4, 12, 27 |
c |
e, n, z15 |
|
Hallfold |
1, 4, 12, 27 |
c |
l, w |
|
Bury |
4, 12, 27 |
c |
z6 |
|
Stanley |
1, 4, [5], 12, 27 |
d |
1, 2 |
|
Eppendorf |
1, 4, 12, 27 |
d |
1, 5 |
|
Brezany |
1, 4, 12, 27 |
d |
1, 6 |
|
Schwarzengrund |
1, 4, 12, 27 |
d |
1, 7 |
|
II |
4, 12 |
d |
e, n, x |
|
Sarajane |
1, 4, [5], 12, 27 |
d |
e, n, x |
|
Duisburg |
1, 4, 12, 27 |
d |
e, n, z15 |
|
Mons |
1, 4, 12, 27 |
d |
1, w |
|
Ayinde |
1, 4, 12, 27 |
d |
z6 |
|
Santpaul |
1, 4, [5], 12 |
e, h |
1, 2 |
|
Reading |
1, 4, [5], 12 |
e, h |
1, 5 |
|
Eko |
4, 12 |
e, h |
1, 6 |
|
Kaapstad |
4, 12 |
e, h |
1, 7 |
|
Chester |
1, 4, [5], 12 |
e, h |
e, n, x |
|
Sandiego |
4, [5], 12 |
e, h |
e, n, z15 |
|
Chartres |
1, 4, 12 |
e, h |
l, w |
|
II |
4, 12 |
e, n, x |
1, 2, 7 |
|
II |
1, 4, 12, 27 |
e, n, x |
1, [5], 7 |
|
Derby |
1, 4, [5], 12 |
f, g |
[1, 2] |
|
Agona |
1, 4, [5], 12 |
f, g, s |
[1, 2] |
|
II |
1, 4, [5], 12 |
f, g, t |
z6:z42 |
|
Essen |
4, 12 |
g, m |
- |
|
Hato |
1, 4, [5], 12 |
g, m, s |
- |
|
II |
1, 4, 12, 27 |
g, [m], [s], t |
e, n, x |
|
II |
1, 4, 12, 27 |
g, [m], t |
[1, 5] |
|
II |
4, 12 |
g, m, t |
z39 |
|
California |
4, 12 |
g, m, t |
z67 |
|
Kingston |
1, 4, [5], 12, 27 |
g, s, t |
[1, 2] |
|
Budapest |
1, 4, 12, 27 |
g, t |
- |
|
Travis |
4, [5], 12 |
g, z51 |
1, 7 |
|
Tennyson |
4, [5], 12 |
g, z51 |
e, n, z15 |
|
II |
4, 12 |
g, z62 |
- |
|
Banana |
1, 4, [5], 12 |
m, t |
[1, 5] |
|
Madras |
4, [5], 12 |
m, t |
e, n, z15 |
|
Typhimurium |
1, 4, [5], 12 |
i |
1, 2 |
|
Lagos |
1, 4, [5], 12 |
i |
1, 5 |
|
Agama |
4, 12 |
i |
1, 6 |
|
Farsta |
4, 12 |
i |
e, n, x |
|
Tsevie |
4, 12 |
i |
e, n, z15 |
|
Gloucester |
1, 4, 12, 27 |
i |
l, w |
|
Tumodi |
1, 4, 12 |
i |
z6 |
|
II |
4, 12, 27 |
i |
z35 |
|
Massenya |
1, 4, 12, 27 |
k |
1, 5 |
|
Neumuenster |
1, 4, 12, 27 |
k |
1, 6 |
|
II |
1, 4, 12, 27 |
k |
1, 6 |
|
Ljubljana |
4, 12, 27 |
k |
e, n, x |
|
Texas |
4, [5], 12 |
k |
e, n, z15 |
|
Fyris |
4, [5], 12 |
l, v |
1, 2 |
|
Azteca |
4, [5], 12, 27 |
l, v |
1, 5 |
|
Clackamas |
4, 12 |
l, v |
1, 6 |
|
Bredeney |
1, 4, 12, 27 |
l, v |
1, 7 |
|
Kimuenza |
1, 4, 12, 27 |
l, v |
e, n, x |
|
II |
1, 4, 12, 27 |
l, v |
e, n, x |
|
Brandenburg |
4, [5], 12 |
l, v |
e, n, z15 |
|
II |
1, 4, 12, 27 |
l, v |
z39 |
|
Mono |
4, 12 |
l, w |
1, 5 |
|
Togo |
4, 12 |
l, w |
1, 6 |
|
II |
4, 12 |
l, w |
e, n, x |
|
Ayton |
1, 4, 12, 27 |
l, w |
z6 |
|
Kunduchi |
1, 4, [5], 12, 27 |
l, [z13], [z28] |
1, 2 |
|
Tyresoe |
1, 4, 12, 27 |
1, [z13], z28 |
1, 5 |
|
Haduna |
4, 12 |
l, z13, [z28] |
1, 6 |
|
Kubacha |
1, 4, 12, 27 |
l, z13, z28 |
1, 7 |
|
Kano |
1, 4, 12, 27 |
l, z13, z28 |
e, n, x |
|
Vom |
1, 4, 12, 27 |
l, z13, z28 |
e, n, z15 |
|
Reinickendorf |
1, 4, 12 |
l, z28 |
e, n, x |
|
II |
1, 4, 12 |
l, z28 |
[e, n, x] |
|
Heidelberg |
1, 4, [5], 12 |
r |
1, 2 |
|
Bradford |
4, 12, 27 |
r |
1, 5 |
|
Winneba |
4, 12 |
r |
1, 6 |
|
Remo |
1, 4, 12, 27 |
r |
1, 7 |
|
Bochum |
4, [5], 12 |
r |
l, w |
|
Southampton |
4, 12, 27 |
r |
z6 |
|
Drogana |
1, 4, 12, 27 |
r, i |
e, n, z15 |
|
Africana |
4, 12 |
r, i |
l, w |
|
Coeln |
1, 4, [5], 12 |
y |
1, 2 |
|
Trachau |
4, 12, 27 |
y |
1, 5 |
|
Finaghy |
4, 12 |
y |
1, 6 |
|
Teddington |
1, 4, 12, 27 |
y |
1, 7 |
|
Ball |
1, 4, 12, 27 |
y |
e, n, x |
|
Jos |
1, 4, 12, 27 |
y |
e, n, z15 |
|
Kamoru |
1, 4, 12, 27 |
y |
z6 |
|
Shubra |
4, [5], 12 |
z |
1, 2 |
|
Kiambu |
1, 4, 12 |
z |
1, 5 |
|
II |
1, 4, 12, 27 |
z |
1, 5 |
|
Loubomo |
4, 12 |
z |
1, 6 |
|
Indiana |
1, 4, 12 |
z |
1, 7 |
|
II |
4, 12 |
z |
1, 7 |
|
Neftenbach |
4, 12 |
z |
e, n, x |
|
II |
1, 4, 12, 27 |
z |
e, n, x |
|
Koenigstuhl |
1, 4, [5], 12 |
z |
e, n, z15 |
|
Preston |
1, 4, 12 |
z |
l, w |
|
Entebbe |
1, 4, 12, 27 |
z |
z6 |
|
II |
4, 12 |
z |
z39 |
|
Stanleyville |
1, 4, [5], 12, 27 |
z4, z23 |
[1, 2] |
|
Vuadens |
4, 12, 27 |
z4, z23 |
z6 |
|
Kalamu |
1, 4, [5], 12 |
z4, z24 |
[1, 5] |
|
Haifa |
1, 4, [5], 12 |
z10 |
1, 2 |
|
Ituri |
1, 4, 12 |
z10 |
1, 5 |
|
Tudu |
4, 12 |
z10 |
1, 6 |
|
Albert |
4, 12 |
z10 |
e, n, x |
|
Tokoin |
4, 12 |
z10 |
e, n, z15 |
|
Mura |
1, 4, 12 |
z10 |
l, w |
|
Fortune |
1, 4, 12, 27 |
z10 |
z6 |
|
Vellore |
1, 4, 12, 27 |
z10 |
z35 |
|
Brancaster |
1, 4, 12, 27 |
z29 |
- |
|
II |
1, 4, 12 |
z29 |
e, n, x |
|
Pasing |
4, 12 |
z35 |
1, 5 |
|
Tafo |
1, 4, 12, 27 |
z35 |
1, 7 |
|
Sloterdijk |
1, 4, 12, 27 |
z35 |
z6 |
|
Yaounde |
1, 4, 12, 27 |
z35 |
e, n, z15 |
|
Tejas |
4, 12 |
z36 |
- |
|
Wilhelmsburg |
1, 4, [5], 12, 27 |
z38 |
[e, n, z15] |
|
II |
1, 4, 12, 27 |
z39 |
1, [5], 7 |
|
Thayngen |
1, 4, 12, 27 |
z41 |
1, (2), 5 |
|
Maska |
1, 4, 12, 27 |
z41 |
e, n, z15 |
|
Abortusequi |
4, 12 |
- |
e, n, x |
|
Группа O:7 (C1) |
|||
|
Sanjuan |
6, 7 |
a |
1, 5 |
|
II |
6, 7, 14 |
a |
1, 5 |
|
Umhlali |
6, 7 |
a |
1, 6 |
|
Austin |
6, 7 |
a |
1, 7 |
|
Oslo |
6, 7, 14 |
a |
e, n, x |
|
Denver |
6, 7 |
a |
e, n, z15 |
|
Coleypark |
6, 7, 14 |
a |
l, w |
|
Damman |
6, 7 |
a |
z6 |
|
II |
6, 7 |
a |
z6 |
|
II |
6, 7 |
a |
z42 |
|
Brazzaville |
6, 7 |
b |
1, 2 |
|
Edinburg |
6, 7, 14 |
b |
1, 5 |
|
Adime |
6, 7 |
b |
1, 6 |
|
Koumra |
6, 7 |
b |
1, 7 |
|
Lockleaze |
6, 7, 14 |
b |
e, n, x |
|
Georgia |
6, 7 |
b |
e, n, z15 |
|
II |
6, 7 |
b |
[e, n, x]:z42 |
|
Ohio |
6, 7, 14 |
b |
l, w |
|
Leopoldville |
6, 7 |
b |
z6 |
|
Kotte |
6, 7 |
b |
z35 |
|
II |
6, 7 |
b |
z39 |
|
Hissar |
6, 7, 14 |
c |
1, 2 |
|
Paratyphi C |
6, 7, [Vi] |
c |
1, 5 |
|
Choleraesuis |
6, 7 |
c |
1, 5 |
|
Typhisuis |
6, 7 |
c |
1, 5 |
|
Birkenhead |
6, 7 |
c |
1, 6 |
|
Schwabach |
6, 7 |
c |
1, 7 |
|
Cotonou |
6, 7 |
c |
z6 |
|
Namibia |
6, 7 |
c |
e, n, x |
|
Kaduna |
6, 7, 14 |
c |
e, n, z15 |
|
Kisii |
6, 7 |
d |
1, 2 |
|
Isangi |
6, 7, 14 |
d |
1, 5 |
|
Kivu |
6, 7 |
d |
1, 6 |
|
Kambole |
6, 7 |
d |
1, [2], 7 |
|
Amersfoort |
6, 7, 14 |
d |
e, n, x |
|
Gombe |
6, 7, 14 |
d |
e, n, z15 |
|
Livingstone |
6, 7, 14 |
d |
l, w |
|
Wil |
6, 7 |
d |
l, z13, z28 |
|
Nieukerk |
6, 7, 14 |
d |
z6 |
|
II |
6, 7 |
d |
z42 |
|
Larochelle |
6, 7 |
e, h |
1, 2 |
|
Lomita |
6, 7 |
e, h |
1, 5 |
|
Norwich |
6, 7 |
e, h |
1, 6 |
|
Nola |
6, 7 |
e, h |
1, 7 |
|
Braenderup |
6, 7, 14 |
e, h |
e, n, z15 |
|
II |
6, 7 |
e, n, x |
l, 6:z42 |
|
Kastrup |
6, 7 |
e, n, z15 |
1, 6 |
|
Rissen |
6, 7, 14 |
f, g |
- |
|
Eingedi |
6, 7 |
f, g, t |
1, 2, 7 |
|
Afula |
6, 7 |
f, g, t |
e, n, x |
|
Montevideo |
6, 7, 14 |
g, m, [p], s |
[1, 2, 7] |
|
II |
6, 7 |
g, m, [s], t |
e, n, x |
|
II |
6, 7 |
(g), m, [s], t |
1, 5 |
|
II |
6, 7 |
g, m, s, t |
z39 |
|
II |
6, 7 |
g, [m], s, t |
[z42] |
|
Othmarschen |
6, 7, 14 |
g, m, [t] |
- |
|
Plumaugat |
6, 7 |
g, s, q |
- |
|
Menston |
6, 7 |
g, s, [t] |
[1, 6] |
|
II |
6, 7 |
g, t |
[e, n, x]: z42 |
|
Riggil |
6, 7 |
g, (t) |
- |
|
Alamo |
6, 7 |
g, z51 |
1, 5 |
|
Larose |
6, 7 |
g, z51 |
e, n, z15 |
|
IV |
6, 7 |
g, z51 |
- |
|
Haelsingborg |
6, 7 |
m, p, t, [u] |
- |
|
Winston |
6, 7 |
m, t |
1, 6 |
|
Oakey |
6, 7 |
m, t |
z64 |
|
II |
6, 7 |
m, t |
- |
|
Oranienburg |
6, 7, 14 |
m, t |
z57 |
|
Augustenborg |
6, 7, 14 |
i |
1, 2 |
|
Oritamerin |
6, 7 |
i |
1, 5 |
|
Garoli |
6, 7 |
i |
1, 6 |
|
Lika |
6, 7 |
i |
1, 7 |
|
Athinai |
6, 7 |
i |
e, n, z15 |
|
Norton |
6, 7 |
i |
l, w |
|
Stuttgart |
6, 7, 14 |
i |
z6 |
|
Galiema |
6, 7, 14 |
k |
1, 2 |
|
Thompson |
6, 7, 14 |
k |
1, 5 |
|
Daytona |
6, 7 |
k |
1, 6 |
|
Baiboukoum |
6, 7 |
k |
1, 7 |
|
Singapore |
6, 7 |
k |
e, n, x |
|
Escanaba |
6, 7 |
k |
e, n, z15 |
|
IIIb |
6, 7 |
(k) |
z:[z55] |
|
II |
6, 7 |
k |
z6 |
|
Concord |
6, 7 |
l, v |
1, 2 |
|
Irumu |
6, 7 |
l, v |
1, 5 |
|
Mkamba |
6, 7 |
l, v |
1, 6 |
|
Kortrijk |
6, 7 |
l, v |
1, 7 |
|
Bonn |
6, 7 |
l, v |
e, n, x |
|
Potsdam |
6, 7, 14 |
l, v |
z15 |
|
Gdansk |
6, 7, 14 |
l, v |
z6 |
|
Coromandel |
6, 7 |
l, v |
z35 |
|
IIIb |
6, 7 |
l, v |
z53 |
|
Gabon |
6, 7 |
l, w |
1, 2 |
|
Colorado |
6, 7 |
l, w |
1, 5 |
|
II |
6, 7 |
l, w |
1, 5, 7 |
|
Langeveld |
6, 7 |
l, w |
e, n, z15 |
|
II |
6, 7 |
l, w |
z42 |
|
Nessziona |
6, 7 |
l, w |
1, 5 |
|
Kenya |
6, 7 |
l, w |
e, n, x |
|
Neukoelln |
6, 7 |
1, z13, [z28] |
e, n, z15 |
|
Makiso |
6, 7 |
l, z13, z28 |
z6 |
|
Strathcona |
6, 7 |
1, z13, z28 |
1, 7 |
|
II |
6, 7 |
l, z28 |
l, 5:[ z42] |
|
II |
6, 7 |
l, z28 |
e, n, x |
|
II |
6, 7 |
1, z28 |
z6 |
|
Virchow |
6, 7, 14 |
r |
1, 2 |
|
Infantis |
6, 7, 14 |
r |
1, 5 |
|
Nigeria |
6, 7 |
r |
1, 6 |
|
Colindale |
6, 7 |
r |
1, 7 |
|
Papuana |
6, 7 |
r |
e, n, z15 |
|
Grampian |
6, 7 |
r |
l, w |
|
Richmond |
6, 7 |
y |
1, 2 |
|
Bareilly |
6, 7, 14 |
y |
1, 5 |
|
Oyonnax |
6, 7 |
y |
1, 6 |
|
Gatow |
6, 7 |
y |
1, 7 |
|
Hartford |
6, 7 |
y |
e, n, x:[z67] |
|
Mikawasima |
6, 7, 14 |
y |
e, n, z15 |
|
Chile |
6, 7 |
z |
1, 2 |
|
Poitiers |
6, 7 |
z |
1, 5 |
|
II |
6, 7 |
z |
1, 5 |
|
Oakland |
6, 7 |
z |
1, 6, [7] |
|
Cayar |
6, 7 |
z |
e, n, x |
|
II |
6, 7 |
z |
e, n, x |
|
Businga |
6, 7 |
z |
e, n, z15 |
|
Bruck |
6, 7 |
z |
l, w |
|
II |
6, 7 |
z |
z6 |
|
II |
6, 7 |
z |
z39 |
|
II |
6, 7 |
z |
z42 |
|
Obogu |
6, 7 |
z4, z23 |
1, 5 |
|
Planckendael |
6, 7 |
z4, z23 |
1, 6 |
|
Aequatoria |
6, 7 |
z4, z23 |
e, n, z15 |
|
Goma |
6, 7 |
z z4, z23 |
z6 |
|
IV |
6, 7 |
z4, z23 |
- |
|
II |
6, 7 |
z4, z24 |
z42 |
|
Somone |
6, 7 |
z4, z24 |
- |
|
IV |
6, 7 |
z4, z24 |
- |
|
II |
6, 7 |
z6 |
1, 7 |
|
Menden |
6, 7 |
z10 |
1, 2 |
|
Inganda |
6, 7 |
z10 |
1, 5 |
|
Eschweiler |
6, 7 |
z10 |
1, 6 |
|
Ngili |
6, 7 |
z10 |
1, 7 |
|
Djugu |
6, 7 |
z10 |
e, n, x |
|
Mbandaka |
6, 7, 14 |
z10 |
e, n, z15 |
|
Jerusalem |
6, 7, 14 |
z10 |
l, w |
|
Redba |
6, 7 |
z10 |
z6 |
|
Omuna |
6, 7 |
z10 |
z35 |
|
Tennessee |
6, 7, 14 |
z29 |
[1, 2, 7] |
|
II |
6, 7 |
z29 |
[z42] |
|
Tienba |
6, 7 |
z35 |
1, 6 |
|
Palime |
6, 7 |
z35 |
e, n, z15 |
|
Tampico |
6, 7 |
z36 |
e, n, z15 |
|
II |
6, 7 |
z36 |
z42 |
|
IV |
6, 7 |
z36 |
- |
|
Rumford |
6, 7 |
z38 |
1, 2 |
|
Lille |
6, 7, 14 |
z38 |
- |
|
IIIb |
6, 7, 14 |
z39 |
1, 2 |
|
II |
6, 7 |
z39 |
1, 5, 7 |
|
VI |
6, 7 |
z41 |
1, 7 |
|
Hillsborough |
6, 7 |
z41 |
l, w |
|
Tamilnadu |
6, 7 |
z41 |
z35 |
|
II |
6, 7 |
z42 |
1, 7 |
|
Bulovka |
6, 7 |
z44 |
- |
|
II |
6, 7 |
- |
1, 6 |
|
Группа O:8 (C2-C3) |
|||
|
Be |
8, 20 |
a |
[z6] |
|
Valdosta |
6, 8 |
a |
1, 2 |
|
Doncaster |
6, 8 |
a |
1, 5 |
|
Curacao |
6, 8 |
a |
1, 6 |
|
Nordufer |
6, 8 |
a |
1, 7 |
|
Narashino |
6, 8 |
a |
e, n, x |
|
II |
6, 8 |
a |
e, n, x |
|
Leith |
6, 8 |
a |
e, n, z15 |
|
II |
6, 8 |
a |
z39 |
|
II |
6, 8 |
a |
z52 |
|
Djelfa |
8 |
b |
1, 2 |
|
Skansen |
6, 8 |
b |
1, 2 |
|
Korbol |
8, 20 |
b |
1, 5 |
|
Nagoya |
6, 8 |
b |
1, 5 |
|
II |
6, 8 |
b |
1, 5 |
|
Stourbridge |
6, 8 |
b |
1, 6 |
|
Sanga |
8 |
b |
1, 7 |
|
Eboko |
6, 8 |
b |
1, 7 |
|
Konstanz |
8 |
b |
e, n, x |
|
Gatuni |
6, 8 |
b |
e, n, x |
|
Shipley |
8, 20 |
b |
e, n, z15 |
|
Presov |
6, 8 |
b |
e, n, z15 |
|
Bukuru |
6, 8 |
b |
l, w |
|
Tounouma |
8, 20 |
b |
z6 |
|
Banalia |
6, 8 |
b |
z6 |
|
Wingrove |
6, 8 |
c |
1, 2 |
|
Gaillac |
8, 20 |
c |
1, 5 |
|
Utah |
6, 8 |
c |
1, 5 |
|
Bronx |
6, 8 |
c |
1, 6 |
|
Belfast |
6, 8 |
c |
1, 7 |
|
Alexanderpolder |
8 |
c |
l, w |
|
Santiago |
8, 20 |
c |
e, n, x |
|
Belem |
6, 8 |
c |
e, n, x |
|
Quiniela |
6, 8 |
c |
e, n, z15 |
|
Tado |
8, 20 |
c |
z6 |
|
Virginia |
8 |
d |
1, 2 |
|
Muenchen |
6, 8 |
d |
l, 2:[z67] |
|
Yovokome |
8, 20 |
d |
1, 5 |
|
Manhattan |
6, 8 |
d |
1, 5 |
|
Portanigra |
8, 20 |
d |
1, 7 |
|
Dunkwa |
6, 8 |
d |
1, 7 |
|
Sterrenbos |
6, 8 |
d |
e, n, x |
|
Herston |
6, 8 |
d |
e, n, z15 |
|
Labadi |
8, 20 |
d |
z6 |
|
II |
6, 8 |
d |
z6 - z42 |
|
Bardo |
8 |
e, h |
1, 2 |
|
Newport |
6, 8, 20 |
e, h |
l, 2:[z67] |
|
Ferruch |
8 |
e, h |
1, 5 |
|
Kottbus |
6, 8 |
e, h |
1, 5 |
|
Cremieu |
6, 8 |
e, h |
1, 6 |
|
Atakpame |
8, 20 |
e, h |
1, 7 |
|
Tshiongwe |
6, 8 |
e, h |
e, n, z15 |
|
Rechovot |
8, 20 |
e, h |
z6 |
|
Sandow |
6, 8 |
f, g |
e, n, z15 |
|
II |
6, 8 |
f, g, m, t |
[e, n, x] |
|
Emek |
8, 20 |
g, m, s |
- |
|
Chincol |
6, 8 |
g, m, [s] |
[e, n, x] |
|
II |
6, 8 |
g, m, t |
1, 7 |
|
Reubeuss |
8, 20 |
g, m, t |
- |
|
Alminko |
8, 20 |
g, s, t |
- |
|
Nanergou |
6, 8 |
g, s, t |
- |
|
Yokoe |
8, 20 |
m, t |
- |
|
II |
6, 8 |
m, t |
1, 5 |
|
II |
6, 8 |
m, t |
e, n, x |
|
Bassa |
6, 8 |
m, t |
- |
|
Lindenburg |
6, 8 |
i |
1, 2 |
|
Bargny |
8, 20 |
i |
1, 5 |
|
Takoradi |
6, 8 |
i |
1, 5 |
|
Warnow |
6, 8 |
i |
1, 6 |
|
Malmoe |
6, 8 |
i |
1, 7 |
|
Bonariensis |
6, 8 |
i |
e, n, x |
|
Aba |
6, 8 |
i |
e, n, z15 |
|
Magherafelt |
8, 20 |
i |
l, w |
|
Cyprus |
6, 8 |
i |
l, w |
|
Kentucky |
8, 20 |
i |
z6 |
|
Kallo |
6, 8 |
k |
1, 2 |
|
Haardt |
8 |
k |
1, 5 |
|
Blockley |
6, 8 |
k |
1, 5 |
|
Schwerin |
6, 8 |
k |
e, n, x |
|
Charlottenburg |
6, 8 |
k |
e, n, z15 |
|
Pakistan |
8 |
l, v |
1, 2 |
|
Litchfield |
6, 8 |
l, v |
1, 2 |
|
Loanda |
6, 8 |
l, v |
1, 5 |
|
Amherstiana |
8 |
l, v |
1, 6 |
|
Manchester |
6, 8 |
l, v |
1, 7 |
|
Holcomb |
6, 8 |
l, v |
e, n, x |
|
II |
6, 8 |
l, v |
e, n, x |
|
Edmonton |
6, 8 |
l, v |
e, n, z15 |
|
Fayed |
6, 8 |
l, w |
1, 2 |
|
II |
6, 8 |
l, w |
z6:z42 |
|
Hiduddify |
6, 8 |
l, z13, z28 |
1, 5 |
|
Breukelen |
6, 8 |
l, z13, [z28] |
e, n, z15 |
|
II |
6, 8 |
l, z28 |
e, n, x |
|
Bsilla |
6, 8 |
r |
1, 2 |
|
Hindmarsh |
8, 20 |
r |
1, 5 |
|
Bovismorbificans |
6, 8, 20 |
r, [i] |
1, 5 |
|
Noya |
8 |
r |
1, 7 |
|
Akanji |
6, 8 |
r |
1, 7 |
|
Cocody |
8, 20 |
r, i |
e, n, z15 |
|
Hidalgo |
6, 8 |
r, [i] |
e, n, z15 |
|
Brikama |
8, 20 |
r, [i] |
l, w |
|
Goldcoast |
6, 8 |
r |
l, w |
|
Altona |
8, 20 |
r, [i] |
z6 |
|
Giza |
8, 20 |
y |
1, 2 |
|
Brunei |
8, 20 |
y |
1, 5 |
|
Tananarive |
6, 8 |
y |
1, 5 |
|
Bulgaria |
6, 8 |
y |
1, 6 |
|
II |
6, 8 |
y |
l, 6:z42 |
|
Alagbon |
8 |
y |
1, 7 |
|
Inchpark |
6, 8 |
y |
1, 7 |
|
Sunnycove |
8 |
y |
e, n, x |
|
Daarle |
6, 8 |
y |
e, n, x |
|
Praha |
6, 8 |
y |
e, n, z15 |
|
Kralingen |
8, 20 |
y |
z6 |
|
Benue |
6, 8 |
y |
l, w |
|
Sindelfingen |
8, 20 |
y |
l, w |
|
Mowanjum |
6, 8 |
z |
1, 5 |
|
II |
6, 8 |
z |
1, 5 |
|
Phaliron |
8 |
z |
e, n, z15 |
|
Kalumburu |
6, 8 |
z |
e, n, z15 |
|
Kuru |
6, 8 |
z |
l, w |
|
Daula |
8, 20 |
z |
z6 |
|
Bellevue |
8 |
z4, z23 |
1, 7 |
|
Lezennes |
6, 8 |
z4, z23 |
1, 7 |
|
Breda |
6, 8 |
z4, z23 |
e, n, x |
|
Chailey |
6, 8 |
z4, z23 |
[e, n, z15] |
|
Dabou |
8, 20 |
z4, z23 |
l, w |
|
Corvallis |
8, 20 |
z4, z23 |
z6 |
|
Albany |
8, 20 |
z4, z24 |
- |
|
Duesseldorf |
6, 8 |
z4, z24 |
- |
|
Tallahassee |
6, 8 |
z4, z32 |
- |
|
Bazenheid |
8, 20 |
z10 |
1, 2 |
|
Zerifin |
6, 8 |
z10 |
1, 2 |
|
Paris |
8, 20 |
z10 |
1, 5 |
|
Mapo |
6, 8 |
z10 |
1, 5 |
|
Cleveland |
6, 8 |
z10 |
1, 7 |
|
Istanbul |
8 |
z10 |
e, n, x |
|
Hadar |
6, 8 |
z10 |
e, n, x |
|
Chomedey |
8, 20 |
z10 |
e, n, z15 |
|
Glostrup |
6, 8 |
z10 |
e, n, z15 |
|
Remiremont |
8, 20 |
z10 |
l, w |
|
Molade |
8, 20 |
z10 |
z6 |
|
Wippra |
6, 8 |
z10 |
z6 |
|
II |
6, 8 |
z29 |
1, 5 |
|
II |
8 |
z29 |
e, n, x: z42 |
|
Tamale |
8, 20 |
z29 |
[e, n, z15] |
|
Uno |
6, 8 |
z29 |
[e, n, z15] |
|
II |
6, 8 |
z29 |
e, n, x |
|
Kolda |
8, 20 |
z35 |
1, 2 |
|
Yarm |
6, 8 |
z35 |
1, 2 |
|
Angers |
8, 20 |
z35 |
z6 |
|
Apeyeme |
8, 20 |
z38 |
- |
|
Diogoye |
8, 20 |
z41 |
z6 |
|
Aesch |
6, 8 |
z60 |
1, 2 |
|
Группа O:9 (D1) |
|||
|
Sendai |
1, 9, 12 |
a |
1, 5 |
|
Miami |
1, 9, 12 |
a |
1, 5 |
|
II |
9, 12 |
a |
1, 5 |
|
Os |
9, 12 |
a |
1, 6 |
|
Saarbruecken |
1, 9, 12 |
a |
1, 7 |
|
Lomalinda |
1, 9, 12 |
a |
e, n, x |
|
II |
1, 9, 12 |
a |
e, n, x |
|
Durban |
9, 12 |
a |
e, n, z15 |
|
II |
9, 12 |
a |
z39 |
|
II |
1, 9, 12 |
a |
z42 |
|
Onarimon |
1, 9, 12 |
b |
1, 2 |
|
Frintrop |
1, 9, 12 |
b |
1, 5 |
|
II |
1, 9, 12 |
b |
e, n, x |
|
Mana |
9, 12 |
b |
e, n, z15 |
|
II |
1, 9, 12 |
b |
z6 |
|
II |
1, 9, 12 |
b |
z39 |
|
Goeteborg |
9, 12 |
c |
1, 5 |
|
Ipeko |
9, 12 |
c |
1, 6 |
|
Elokate |
9, 12 |
c |
1, 7 |
|
Alabama |
9, 12 |
c |
e, n, z15 |
|
Ridge |
9, 12 |
c |
z6 |
|
Ndolo |
1, 9, 12 |
d |
1, 5 |
|
Tarshyne |
9, 12 |
d |
1, 6 |
|
Eschberg |
9, 12 |
d |
1, 7 |
|
II |
9, 12 |
d |
e, n, x |
|
Bangui |
9, 12 |
d |
e, n, z15 |
|
Zega |
9, 12 |
d |
z6 |
|
Jaffna |
1, 9, 12 |
d |
z35 |
|
II |
9, 12 |
d |
z39 |
|
Typhi |
9, 12[Vi] |
d |
- |
|
Bournemouth |
9, 12 |
e, h |
1, 2 |
|
Eastbourne |
1, 9, 12 |
e, h |
1, 5 |
|
Westafrica |
9, 12 |
e, h |
1, 7 |
|
Israel |
9, 12 |
e, h |
e, n, z15 |
|
II |
9, 12 |
e, n, x |
1, [5], 7 |
|
II |
9, 12 |
e, n, x |
1, 6 |
|
Berta |
1, 9, 12 |
[f], g, [t] |
- |
|
Enteritidis |
1, 9, 12 |
g, m |
- |
|
Blegdam |
9, 12 |
g, m, q |
- |
|
II |
1, 9, 12 |
g, m, [s], t |
[l, 5, 7]:[ z42] |
|
II |
1, 9, 12 |
g, m, s, t |
e, n, x |
|
Dublin |
l, 9, 12[Vi] |
g, p |
- |
|
Naestved |
1, 9, 12 |
g, p, s |
- |
|
Rostock |
1, 9, 12 |
g, p, u |
- |
|
Moscow |
9, 12 |
g, q |
- |
|
II |
9, 12 |
g, s, t |
e, n, x |
|
Newmexico |
9, 12 |
g, z51 |
1, 5 |
|
II |
1, 9, 12 |
g, z62 |
[e, n, x] |
|
Antarctica |
9, 12 |
g, z63 |
- |
|
Rosenberg |
9, 12 |
g, z85 |
- |
|
II |
9, 12 |
m, t |
e, n, x |
|
Pensacola |
1, 9, 12 |
m, t |
[1, 2] |
|
II |
1, 9, 12 |
m, t |
1, 5 |
|
II |
1, 9, 12 |
m, t |
z39 |
|
Seremban |
9, 12 |
i |
1, 5 |
|
Claibornei |
1, 9, 12 |
k |
1, 5 |
|
Goverdhan |
9, 12 |
k |
1, 6 |
|
Mendoza |
9, 12 |
l, v |
1, 2 |
|
Panama |
1, 9, 12 |
l, v |
1, 5 |
|
Kapemba |
9, 12 |
l, v |
1, 7 |
|
Zaiman |
9, 12 |
l, v |
e, n, x |
|
II |
9, 12 |
l, v |
e, n, x |
|
Goettingen |
9, 12 |
l, v |
e, n, z15 |
|
II |
9, 12 |
l, v |
z39 |
|
Victoria |
1, 9, 12 |
l, w |
1, 5 |
|
II |
1, 9, 12 |
l, w |
e, n, x |
|
Itami |
9, 12 |
l, z13 |
1, 5 |
|
Miyazaki |
9, 12 |
l, z13 |
1, 7 |
|
Napoli |
1, 9, 12 |
l, z13 |
e, n, x |
|
Javiana |
1, 9, 12 |
l, z28 |
1, 5 |
|
Kotu |
9, 12 |
l, z28 |
1, 6 |
|
II |
9, 12 |
l, z28 |
l, 5:[z42] |
|
II |
9, 12 |
l, z28 |
e, n, x |
|
York |
9, 12 |
l, z28 |
e, n, z15 |
|
Jamaica |
9, 12 |
r |
1, 5 |
|
Camberwell |
9, 12 |
r |
1, 7 |
|
Campinense |
9, 12 |
r |
e, n, z15 |
|
Lome |
9, 12 |
r |
z6 |
|
Powell |
9, 12 |
y |
1, 7 |
|
II |
1, 9, 12 |
y |
z39 |
|
Mulhouse |
1, 9, 12 |
z |
1, 2 |
|
Lawndale |
1, 9, 12 |
z |
1, 5 |
|
Kimpese |
9, 12 |
z |
1, 6 |
|
II |
1, 9, 12 |
z |
1, 7 |
|
II |
1, 9, 12 |
z |
z6 |
|
II |
9, 12 |
z |
z39 |
|
Wangata |
1, 9, 12 |
z4, z23 |
[1, 7] |
|
Natal |
9, 12 |
z4, z24 |
- |
|
Franken |
9, 12 |
z6 |
z_67 |
|
Portland |
9, 12 |
z10 |
1, 5 |
|
Treguier |
9, 12 |
z10 |
z6 |
|
Ruanda |
9, 12 |
z10 |
e, n, z15 |
|
II |
9, 12 |
z29 |
1, 5 |
|
II |
1, 9, 12 |
z29 |
e, n, x |
|
Penarth |
9, 12 |
z35 |
z6 |
|
Elomrane |
1, 9, 12 |
z38 |
- |
|
II |
1, 9, 12 |
z39 |
1, 7 |
|
Ottawa |
1, 9, 12 |
z41 |
1, 5 |
|
II |
1, 9, 12 |
z42 |
1, [5], 7 |
|
Gallinarum |
1, 9, 12 |
- |
- |
|
Группа O:9, 46 (D2) |
|||
|
Baildon |
9, 46 |
a |
e, n, x |
|
Doba |
9, 46 |
a |
e, n, z15 |
|
Montaigu |
9, 46 |
b |
1, 2 |
|
Cheltenham |
9, 46 |
b |
1, 5 |
|
Zadar |
9, 46 |
b |
1, 6 |
|
Worb |
9, 46 |
b |
e, n, x |
|
II |
9, 46 |
b |
e, n, x |
|
Bamboye |
9, 46 |
b |
l, w |
|
Linguere |
9, 46 |
b |
z6 |
|
Kolar |
9, 46 |
b |
z35 |
|
Itutaba |
9, 46 |
c |
z6 |
|
Ontario |
9, 46 |
d |
1, 5 |
|
Quentin |
9, 46 |
d |
1, 6 |
|
Strasbourg |
9, 46 |
d |
1, 7 |
|
Olten |
9, 46 |
d |
e, n, z15 |
|
Plymouth |
9, 46 |
d |
z6 |
|
Bergedorf |
9, 46 |
e, h |
1, 2 |
|
Waedenswil |
9, 46 |
e, h |
1, 5 |
|
Guerin |
9, 46 |
e, h |
z6 |
|
II |
9, 46 |
e, n, x |
1, 5, 7 |
|
Wernigerode |
9, 46 |
f, g |
- |
|
Hillingdon |
9, 46 |
g, m |
- |
|
Macclesfield |
9, 46 |
g, m, s |
1, 2, 7 |
|
II |
9, 46 |
g, [m], [s], t |
[e, n, x] |
|
Gateshead |
9, 46 |
g, s, t |
- |
|
II |
9, 46 |
g, z62 |
- |
|
II |
9, 46 |
m, t |
e, n, x |
|
Sangalkam |
9, 46 |
m, t |
- |
|
Mathura |
9, 46 |
i |
e, n, z15 |
|
Potto |
9, 46 |
i |
z6 |
|
Marylebone |
9, 46 |
k |
1, 2 |
|
Cochin |
9, 46 |
k |
1, 5 |
|
Clontarf |
9, 46 |
k |
1, 6 |
|
Ceyco |
9, 46 |
k |
z35 |
|
India |
9, 46 |
l, v |
1, 5 |
|
Geraldton |
9, 46 |
l, v |
1, 6 |
|
Toronto |
9, 46 |
l, v |
e, n, x |
|
Ackwep |
9, 46 |
l, w |
- |
|
Nordrhein |
9, 46 |
l, z13, z28 |
e, n, z15 |
|
Deckstein |
9, 46 |
r |
1, 7 |
|
Shoreditch |
9, 46 |
r |
e, n, z15 |
|
Sokode |
9, 46 |
r |
z6 |
|
Benin |
9, 46 |
y |
1, 7 |
|
Irchel |
9, 46 |
y |
e, n, x |
|
Nantes |
9, 46 |
y |
l, w |
|
Mayday |
9, 46 |
y |
z6 |
|
II |
9, 46 |
z |
1, 5 |
|
II |
9, 46 |
z |
e, n, x |
|
Bambylor |
9, 46 |
z |
e, n, z15 |
|
Ekotedo |
9, 46 |
z4, z23 |
- |
|
II |
9, 46 |
z4, z24 |
z39- z42 |
|
Ngaparou |
9, 46 |
z4, z24 |
- |
|
Lishabi |
9, 46 |
z10 |
1, 7 |
|
Inglis |
9, 46 |
z10 |
e, n, x |
|
Mahina |
9, 46 |
z10 |
e, n, z15 |
|
Louisiana |
9, 46 |
z10 |
z6 |
|
II |
9, 46 |
z10 |
z6 |
|
II |
9, 46 |
z10 |
z39 |
|
Ouakam |
9, 46 |
z29 |
- |
|
Hillegersberg |
9, 46 |
z35 |
1, 5 |
|
Basingstoke |
9, 46 |
z35 |
e, n, z15 |
|
Trimdon |
9, 46 |
z35 |
z6 |
|
Fresno |
9, 46 |
z38 |
- |
|
II |
9, 46 |
z39 |
1, 7 |
|
Wuppertal |
9, 46 |
z41 |
- |
|
Группа O:9, 46, 27 (D3) |
|||
|
II |
1, 9, 12, 46, 27 |
a |
z6 |
|
II |
1, 9, 12, 46, 27 |
c |
z39 |
|
II |
9, 12, 46, 27 |
g, t |
e, n, x |
|
II |
1, 9, 12, 46, 27 |
l, z13, z28 |
z39 |
|
II |
1, 9, 12, 46, 27 |
y |
z39 |
|
II |
1, 9, 12, 46, 27 |
z4, z24 |
1, 5 |
|
II |
1, 9, 12, 46, 27 |
z10 |
1, 5 |
|
II |
1, 9, 12, 46, 27 |
z10 |
e, n, x |
|
II |
1, 9, 12, 46, 27 |
z10 |
z39 |
|
Группа O:3, 10 (E1) |
|||
|
Aminatu |
3, 10 |
a |
1, 2 |
|
Goelzau |
3, 10 [15] |
a |
1, 5 |
|
Oxford |
3, 10 [15] [15, 34] |
a |
1, 7 |
|
Masembe |
3, 10 |
a |
e, n, x |
|
II |
3, 10 |
a |
e, n, x |
|
Galil |
3, 10 |
a |
e, n, z, |
|
II |
3, 10 |
a |
l, v |
|
II |
3, 10 |
a |
z39 |
|
Kalina |
3, 10 |
b |
1, 2 |
|
Butantan |
3, 10 [15] [15, 34] |
b |
1, 5 |
|
Allerton |
3, 10 |
b |
1, 6 |
|
Huvudsta |
3, 10 |
b |
1, 7 |
|
Benfica |
3, 10 |
b |
e, n, x |
|
II |
3, 10 |
b |
e, n, x |
|
Yaba |
3, 10 [15] |
b |
e, n, z15 |
|
Epicrates |
3, 10 |
b |
l, w |
|
Wilmington |
3, 10 |
b |
z6 |
|
Westminster |
3, 10 [15] |
b |
z35 |
|
II |
3, 10 |
b |
z39 |
|
Asylanta |
3, 10 |
c |
1, 2 |
|
Gbadago |
3, 10 [15] |
c |
1, 5 |
|
Ikayi |
3, 10 [15] |
c |
1, 6 |
|
Pramiso |
3, 10 |
c |
1, 7 |
|
Agege |
3, 10 |
c |
e, n, z15 |
|
Anderlecht |
3, 10 |
c |
l, w |
|
Okefoko |
3, 10 |
c |
z6 |
|
Stormont |
3, 10 |
d |
1, 2 |
|
Shangani |
3, 10 [15] |
d |
1, 5 |
|
Lekke |
3, 10 |
d |
1, 6 |
|
Onireke |
3, 10 |
d |
1, 7 |
|
Souza |
3, 10 [15] |
d |
e, n, x |
|
II |
3, 10 |
d |
e, n, x |
|
Madjorio |
3, 10 |
d |
e, n, z15 |
|
Birmingham |
3, 10 [15] |
d |
l, w |
|
Weybridge |
3, 10 |
d |
z6 |
|
Maron |
3, 10 |
d |
z35 |
|
Vejle |
3, 10 [15] |
e, h |
1, 2 |
|
Muenster |
3, 10 [15] [15, 34] |
e, h |
1, 5 |
|
Anatum |
3, 10 [15] [15, 34] |
e, h |
1, 6 |
|
Nyborg |
3, 10 [15] |
e, h |
1, 7 |
|
Newlands |
3, 10 [15, 34] |
e, h |
e, n, x |
|
Lamberhurst |
3, 10 |
e, h |
e, n, z15 |
|
Meleagridis |
3, 10 [15] [15, 34] |
e, h |
l, w |
|
Sekondi |
3, 10 |
e, h |
z6 |
|
II |
3, 10 |
e, n, x |
1, 7 |
|
Regent |
3, 10 |
f, g, [s] |
[1, 6] |
|
Alfort |
3, 10 |
f, g |
e, n, x |
|
Suberu |
3, 10 |
g, m |
- |
|
Amsterdam |
3, 10 [15] [15, 34] |
g, m, s |
- |
|
II |
3, 10 [15] |
g, m, s, t |
[1, 5] |
|
Westhampton |
3, 10 [15] [15, 34] |
g, s, t |
- |
|
Bloomsbury |
3, 10 |
g, t |
1, 5 |
|
II |
3, 10 |
g, t |
- |
|
II |
3, 10 |
m, t |
1, 5 |
|
Southbank |
3, 10 [15] [15, 34] |
m, t |
[1, 6] |
|
II |
3, 10 |
m, t |
e, n, x |
|
Cuckmere |
3, 10 |
i |
1, 2 |
|
Amounderness |
3, 10 |
i |
1, 5 |
|
Tibati |
3, 10 |
i |
1, 6 |
|
Truro |
3, 10 |
i |
1, 7 |
|
Bessi |
3, 10 |
i |
e, n, x |
|
Falkensee |
3, 10 [15] |
i |
e, n, z15 |
|
Hoboken |
3, 10 |
i |
l, w |
|
Yeerongpilly |
3, 10 |
i |
z6 |
|
Wimborne |
3, 10 |
k |
1, 2 |
|
Zanzibar |
3, 10 [15] |
k |
1, 5 |
|
Serrekunda |
3, 10 |
k |
1, 7 |
|
Yundum |
3, 10 |
k |
e, n, x |
|
Marienthal |
3, 10 |
k |
e, n, z15 |
|
Newrochelle |
3, 10 |
k |
l, w |
|
Nchanga |
3, 10 [15] |
l, v |
1, 2 |
|
Sinstorf |
3, 10 |
l, v |
1, 5 |
|
London |
3, 10 [15] |
l, v |
1, 6 |
|
Give |
3, 10 [15] [15, 34] |
[d], l, v |
1, 7 |
|
II |
3, 10 |
l, v |
e, n, x |
|
Ruzizi |
3, 10 |
l, v |
e, n, z15 |
|
II |
3, 10 |
l, v |
z6 |
|
Sinchew |
3, 10 |
l, v |
z35 |
|
Assinie |
3, 10 |
l, w |
z6 |
|
Freiburg |
3, 10 |
l, z13 |
1, 2 |
|
Uganda |
3, 10 [15] |
l, z13 |
1, 5 |
|
Fallowfield |
3, 10 |
1, z13, z28 |
e, n, z15 |
|
Hoghton |
3, 10 |
1, z13, z28 |
z6 |
|
II |
3, 10 |
1, z28 |
1, 5 |
|
Joal |
3, 10 |
1, z28 |
1, 7 |
|
Lamin |
3, 10 |
1, z28 |
e, n, x |
|
II |
3, 10 |
1, z28 |
e, n, x |
|
II |
3, 10 |
1, z28 |
z39 |
|
Ughelli |
3, 10 |
r |
1, 5 |
|
Elisabethville |
3, 10 [15] |
r |
1, 7 |
|
Simi |
3, 10 |
r |
e, n, z15 |
|
Weltevreden |
3, 10 [15] |
r |
z6 |
|
Seegefeld |
3, 10 |
r, i |
1, 2 |
|
Dumfries |
3, 10 |
r, i |
1, 6 |
|
Amager |
3, 10 [15] |
y |
1, 2 |
|
Orion |
3, 10 [15] [15, 34] |
y |
1, 5 |
|
Mokola |
3, 10 |
y |
1, 7 |
|
Ohlstedt |
3, 10 [15] |
y |
e, n, x |
|
Bolton |
3, 10 |
y |
e, n, z15 |
|
Langensalza |
3, 10 |
y |
l, w |
|
Stockholm |
3, 10 [15] |
y |
z6 |
|
Fufu |
3, 10 |
z |
1, 5 |
|
II |
3, 10 |
z |
1, 5 |
|
Harleystreet |
3, 10 |
z |
1, 6 |
|
Huddinge |
3, 10 |
z |
1, 7 |
|
II |
3, 10 |
z |
e, n, x |
|
Clerkenwell |
3, 10 |
z |
l, w |
|
Landwasser |
3, 10 |
z |
z6 |
|
II |
3, 10 |
z |
z39 |
|
Adabraka |
3, 10 |
z4, z23 |
[1, 7] |
|
Wagadugu |
3, 10 |
z4, z23 |
z6 |
|
Florian |
3, 10 [15] |
z4, z24 |
- |
|
II |
3, 10 |
z4, z24 |
- |
|
Okerara |
3, 10 |
z10 |
1, 2 |
|
Lexington |
3, 10 [15] [15, 34] |
z10 |
1, 5 |
|
Harrisonburg |
3, 10 [15] [15, 34] |
z10 |
1, 6 |
|
Coquilhatville |
3, 10 |
z10 |
1, 7 |
|
Kristianstad |
3, 10 |
z10 |
e, n, z15 |
|
Biafra |
3, 10 |
z10 |
z6 |
|
Everleigh |
3, 10 |
z10 |
e, n, x |
|
II |
3, 10 |
z10 |
[e, n, x] |
|
Jedburgh |
3, 10 [15] |
z10 |
- |
|
Ratchaburi |
3, 10 |
z35 |
1, 6 |
|
Zongo |
3, 10 |
z35 |
1, 7 |
|
II |
3, 10 |
z35 |
e, n, x, z15 |
|
Shannon |
3, 10 |
z35 |
l, w |
|
Cairina |
3, 10 |
z35 |
z6 |
|
Macallen |
3, 10 |
z36 |
- |
|
Albertslund |
3, 10 |
z38 |
1, 6 |
|
Bolombo |
3, 10 |
z38 |
[z6] |
|
II |
3, 10 |
z38 |
z42 |
|
II |
3, 10 |
z39 |
1, [5], 7 |
|
Dortmund |
3, 10 |
z41 |
1, [2], 5 |
|
Pietersburg |
3, 10 [15, 34] |
z69 |
1, 7 |
|
Группа O:1, 3, 19 (E4) |
|||
|
Niumi |
1, 3, 19 |
a |
1, 5 |
|
Juba |
1, 3, 19 |
a |
1, 7 |
|
Gwoza |
1, 3, 19 |
a |
e, n, z15 |
|
Alkmaar |
1, 3, 19 |
a |
l, w |
|
Gnesta |
1, 3, 19 |
b |
1, 5 |
|
Visby |
1, 3, 19 |
b |
1, 6 |
|
Tambacounda |
1, 3, 19 |
b |
e, n, x |
|
Kande |
1, 3, 19 |
b |
e, n, z15 |
|
Broughton |
1, 3, 19 |
b |
l, w |
|
Accra |
1, 3, 19 |
b |
z6 |
|
Eastglam |
1, 3, 19 |
c |
1, 5 |
|
Bida |
1, 3, 19 |
c |
1, 6 |
|
Madiago |
1, 3, 19 |
c |
1, 7 |
|
Ahmadi |
1, 3, 19 |
d |
1, 5 |
|
Liverpool |
1, 3, 19 |
d |
e, n, z15 |
|
Tilburg |
1, 3, 19 |
d |
l, w |
|
Niloese |
1, 3, 19 |
d |
z6 |
|
Vilvoorde |
1, 3, 19 |
e, h |
1, 5 |
|
Hayindogo |
1, 3, 19 |
e, h |
1, 6 |
|
Sanktmarx |
1, 3, 19 |
e, h |
1, 7 |
|
Sao |
1, 3, 19 |
e, h |
e, n, z15 |
|
Calabar |
1, 3, 19 |
e, h |
l, w |
|
Rideau |
1, 3, 19 |
f, g |
- |
|
Petahtikve |
1, 3, 19 |
f, g, t |
1, 7 |
|
Maiduguri |
1, 3, 19 |
f, g, t |
e, n, z15 |
|
Kouka |
1, 3, 19 |
g, m, [t] |
- |
|
Senftenberg |
1, 3, 19 |
g, [s], t |
- |
|
Cannstatt |
1, 3, 19 |
m, t |
- |
|
Stratford |
1, 3, 19 |
i |
1, 2 |
|
Ouagadougou |
1, 3, 19 |
i |
1, 5 |
|
Chichester |
1, 3, 19 |
i |
1, 6 |
|
Machaga |
1, 3, 19 |
i |
e, n, x |
|
Avonmouth |
1, 3, 19 |
i |
e, n, z15 |
|
Zuilen |
1, 3, 19 |
i |
l, w |
|
Taksony |
1, 3, 19 |
i |
z6 |
|
Oesterbro |
1, 3, 19 |
k |
1, 5 |
|
Bethune |
1, 3, 19 |
k |
1, 7 |
|
Ngor |
1, 3, 19 |
l, v |
1, 5 |
|
Parkroyal |
1, 3, 19 |
l, v |
1, 7 |
|
Svedvi |
1, 3, 19 |
l, v |
e, n, z15 |
|
Fulda |
1, 3, 19 |
l, w |
1, 5 |
|
Westerstede |
1, 3, 19 |
1, z13 |
1, 2 |
|
Winterthur |
1, 3, 19 |
1, z13 |
1, 6 |
|
Lokstedt |
1, 3, 19 |
1, z13, z28 |
1, 2 |
|
Stuivenberg |
1, 3, 19 |
l, [z13] z28 |
1, 5 |
|
Bedford |
1, 3, 19 |
1, z13, z28 |
e, n, z15 |
|
Tomelilla |
1, 3, 19 |
l, z28 |
1, 7 |
|
Kindia |
1, 3, 19 |
l, z28 |
e, n, x |
|
Yalding |
1, 3, 19 |
r |
e, n, z15 |
|
Fareham |
1, 3, 19 |
r, i |
l, w |
|
Gatineau |
1, 3, 19 |
y |
1, 5 |
|
Thies |
1, 3, 19 |
y |
1, 7 |
|
Slade |
1, 3, 19 |
y |
e, n, z15 |
|
Kinson |
1, 3, 19 |
y |
e, n, x |
|
Krefeld |
1, 3, 19 |
y |
l, w |
|
Korlebu |
1, 3, 19 |
z |
1, 5 |
|
Kainji |
1, 3, 19 |
z |
1, 6 |
|
Lerum |
1, 3, 19 |
z |
1, 7 |
|
Schoeneberg |
1, 3, 19 |
z |
e, n, z15 |
|
Carno |
1, 3, 19 |
z |
l, w |
|
Hongkong |
1, 3, 19 |
z |
z6 |
|
S ambre |
1, 3, 19 |
z4, z24 |
- |
|
Dallgow |
1, 3, 19 |
z10 |
e, n, z15 |
|
Llandoff |
1, 3, 19 |
z29 |
|
|
Ochiogu |
1, 3, 19 |
z38 |
[e, n, z15] |
|
Chittagong |
1, 3, 10, 19 |
b |
z35 |
|
Bilu |
1, 3, 10, 19 |
f, g, t |
1, (2), 7 |
|
Ilugun |
1, 3, 10, 19 |
z4, z23 |
z6 |
|
Dessau |
1, 3, 15, 19 |
g, s, t |
- |
|
Cannonhill |
1, 3, 10, [15], 19 |
y |
e, n, x |
|
Группа O:11 (F) |
|||
|
II |
11 |
a |
d:e, n, z15 |
|
Gallen |
11 |
a |
1, 2 |
|
Marseille |
11 |
a |
1, 5 |
|
VI |
11 |
a |
1, 5 |
|
Toowong |
11 |
a |
1, 7 |
|
Luciana |
11 |
a |
e, n, z15 |
|
Epinay |
11 |
a |
l, z13, z28 |
|
II |
11 |
a |
z6: z42 |
|
Atento |
11 |
b |
1, 2 |
|
Leeuwarden |
11 |
b |
1, 5 |
|
Wohlen |
11 |
b |
1, 6 |
|
VI |
11 |
b |
1, 7 |
|
VI |
11 |
b |
e, n, x |
|
Pharr |
11 |
b |
e, n, z15 |
|
Chiredzi |
11 |
c |
1, 5 |
|
Brindisi |
11 |
c |
1, 6 |
|
II |
11 |
c |
e, n, z15 |
|
Woodinville |
11 |
c |
e, n, x |
|
Ati |
11 |
d |
1, 2 |
|
Gustavia |
11 |
d |
1, 5 |
|
Chandans |
11 |
d |
[e, n, x]:[r] |
|
Findorff |
11 |
d |
z6 |
|
Chingola |
11 |
e, h |
1, 2 |
|
Adamstua |
11 |
e, h |
1, 6 |
|
Redhill |
11 |
e, h |
l, z13, z28 |
|
Abuja |
11 |
g, m |
1, 5 |
|
Missouri |
11 |
g, s, t |
- |
|
II |
11 |
g, [m], s, t |
z39 |
|
IV |
11 |
g, z51 |
- |
|
Moers |
11 |
m, t |
- |
|
II |
11 |
m, t |
e, n, x |
|
Aberdeen |
11 |
i |
1, 2 |
|
Brijbhumi |
11 |
i |
1, 5 |
|
Heerlen |
11 |
i |
1, 6 |
|
Veneziana |
11 |
i |
e, n, x |
|
Pretoria |
11 |
k |
1, 2 |
|
Abaetetuba |
11 |
k |
1, 5 |
|
Sharon |
11 |
k |
1, 6 |
|
Colobane |
11 |
k |
1, 7 |
|
Kisarawe |
11 |
k |
e, n, x, [z15] |
|
Mannheim |
11 |
k |
l, w |
|
Amba |
11 |
k |
l, z13, z28 |
|
IIIb |
11 |
k |
z53 |
|
Stendal |
11 |
l, v |
1, 2 |
|
Maracaibo |
11 |
l, v |
1, 5 |
|
Fann |
11 |
l, v |
e, n, x |
|
Bullbay |
11 |
l, v |
e, n, z15 |
|
IIIb |
11 |
l, v |
z |
|
IIIb |
11 |
l, v |
z53 |
|
Glidji |
11 |
l, w |
1, 5 |
|
Tours |
11 |
l, z13 |
1, 2 |
|
Connecticut |
11 |
1, z13, z28 |
1, 5 |
|
Osnabrueck |
11 |
l, z13, z28 |
e, n, x |
|
II |
11 |
l, z28 |
e, n, x |
|
Senegal |
11 |
r |
1, 5 |
|
Rubislaw |
11 |
r |
e, n, x |
|
Clanvillian |
11 |
r |
e, n, z15 |
|
Euston |
11 |
r, i |
e, n, x, z15 |
|
Volta |
11 |
r |
l, z13, z28 |
|
Solt |
11 |
y |
1, 5 |
|
Jalisco |
11 |
y |
1, 7 |
|
Herzliya |
11 |
y |
e, n, x |
|
Woumbou |
11 |
y |
e, n, x, z15 |
|
Crewe |
11 |
z |
1, 5 |
|
Maroua |
11 |
z |
1, 7 |
|
II |
11 |
z |
e, n, x |
|
Nyanza |
11 |
z |
z6:[z83] |
|
II |
11 |
z |
z39 |
|
Remete |
11 |
z4, z23 |
1, 6 |
|
Etterbeek |
11 |
z4, z23 |
e, n, z15 |
|
IIIa |
11 |
z4, z23 |
- |
|
IV |
11 |
z4, z23 |
- |
|
Yehuda |
11 |
z4, z24 |
- |
|
IV |
11 |
z4, z32 |
- |
|
Wentworth |
11 |
z10 |
1, 2 |
|
Straengnaes |
11 |
z10 |
1, 5 |
|
Telhashomer |
11 |
z10 |
e, n, x |
|
Lene |
11 |
z38 |
- |
|
Maastricht |
11 |
z41 |
1, 2 |
|
II |
11 |
- |
1, 5 |
|
Группа O:13 (G) |
|||
|
Chagoua |
1, 13, 23 |
a |
1, 5 |
|
II |
1, 13, 23 |
a |
1, 5 |
|
Mim |
13, 22 |
a |
1, 6 |
|
II |
13, 22 |
a |
e, n, x |
|
Wyldegreen |
1, 13, 23 |
a |
l, w |
|
Marshall |
13, 22 |
a |
l, z13, z28 |
|
II |
1, 13, 23 |
a |
z42 |
|
Ibadan |
13, 22 |
b |
1, 5 |
|
Mississippi |
1, 13, 23 |
b |
1, 5 |
|
Oudwijk |
13, 22 |
b |
1, 6 |
|
II |
1, 13, 23 |
b |
[l, 5]:z42 |
|
Bracknell |
13, 23 |
b |
1, 6 |
|
Rottnest |
1, 13, 22 |
b |
1, 7 |
|
Vaertan |
13, 22 |
b |
e, n, x |
|
Ullevi |
1, 13, 23 |
b |
e, n, x |
|
Bahati |
13, 22 |
b |
e, n, z15 |
|
Durham |
13, 23 |
b |
e, n, z15 |
|
Sanktjohann |
13, 23 |
b |
l, w |
|
II |
1, 13, 22 |
b |
z42 |
|
Haouaria |
13, 22 |
c |
e, n, x, z15 |
|
Handen |
1, 13, 23 |
d |
1, 2 |
|
Mishmarhaemek |
1, 13, 23 |
d |
1, 5 |
|
Friedenau |
13, 22 |
d |
1, 6 |
|
Wichita |
1, 13, 23 |
d |
1, 6 |
|
Grumpensis |
1, 13, 23 |
d |
1, 7 |
|
II |
13, 23 |
d |
e, n, x |
|
Diguel |
1, 13, 22 |
d |
e, n, z15 |
|
Telelkebir |
13, 23 |
d |
e, n, z15 |
|
Putten |
13, 23 |
d |
l, w |
|
Isuge |
13, 23 |
d |
z6 |
|
Tschangu |
1, 13, 23 |
e, h |
1, 5 |
|
Willemstad |
1, 13, 22 |
e, h |
1, 6 |
|
Vridi |
1, 13, 23 |
e, h |
l, w |
|
II |
1, 13, 23 |
e, n, x |
1, [5], 7 |
|
Raus |
13, 22 |
f, g |
e, n, x |
|
Havana |
1, 13, 23 |
f, g, [s] |
- |
|
Bron |
13, 22 |
g, m |
[e, n, z15] |
|
Agbeni |
1, 13, 23 |
g, m, [s], [t] |
- |
|
II |
1, 13, 22 |
g, m, t |
[1, 5] |
|
II |
1, 13, 23 |
g, m, s, t |
1, 5 |
|
II |
1, 13, 23 |
g, m, [s], t |
[e, n, x] |
|
II |
1, 13, 23 |
g, m, s, t |
z42 |
|
Newyork |
13, 22 |
g, s, t |
- |
|
Okatie |
13, 23 |
g, [s], t |
- |
|
II |
1, 13, 22 |
g, t |
[1, 5] |
|
II |
13, 22 |
g, t |
z6 |
|
II |
1, 13, 23 |
g, t |
1, 5 |
|
II |
13, 23 |
g, t |
e, n, x |
|
II |
1, 13, 23 |
g, [s], t |
z42 |
|
IIIa |
1, 13, 23 |
g, z51 |
- |
|
Washington |
13, 22 |
m, t |
- |
|
II |
1, 13, 23 |
m, t |
1, 5 |
|
II |
1, 13, 23 |
m, t |
e, n, x |
|
II |
13, 22 |
m, t |
z42 - z39 |
|
II |
1, 13, 23 |
m, t |
z42 |
|
Kintambo |
1, 13, 23 |
m, t |
- |
|
V |
1, 13, 22 |
i |
- |
|
Idikan |
1, 13, 23 |
i |
1, 5 |
|
Jukestown |
13, 23 |
i |
e, n, z15 |
|
Kedougou |
1, 13, 23 |
i |
l, w |
|
II |
13, 22 |
k |
l, 5:z42 |
|
Marburg |
13, 23 |
k |
- |
|
II |
13, 23 |
k |
z41 |
|
Lovelace |
13, 22 |
l, v |
1,5 1, 5, 7 |
|
IIIb |
13, 22 |
l, v |
1, 6 |
|
Borbeck |
13, 22 |
l, v |
|
|
Nanga |
1, 13, 23 |
l, v |
e, n, z15 |
|
II |
13, 23 |
l, w |
e, n, x |
|
Taiping |
13, 22 |
l, z13 |
e, n, z15 |
|
II |
13, 22 |
1, z28 |
1, 5 |
|
II |
13, 23 |
1, z28 |
1, 5 |
|
II |
13, 23 |
1, z28 |
z6 |
|
II |
1, 13, 23 |
1, z28 |
z42 |
|
V |
13, 22 |
r |
- |
|
Adjame |
13, 23 |
r |
1, 6 |
|
Linton |
13, 23 |
r |
e, n, z15 |
|
Tanger |
1, 13, 22 |
y |
1, 6 |
|
Yarrabah |
13, 23 |
y |
1, 7 |
|
Ordonez |
1, 13, 23 |
y |
l, w |
|
Tunis |
1, 13, 23 |
y |
z6 |
|
II |
1, 13, 23 |
z |
1, 5 |
|
IIIb |
13, 23 |
z |
1, 5 |
|
Poona |
1, 13, 22 |
z |
1, 6:[z44] |
|
Farmsen |
13, 23 |
z |
1, 6 |
|
Bristol |
13, 22 |
z |
1, 7 |
|
Tanzania |
1, 13, 22 |
z |
e, n, z15 |
|
Worthington |
1, 13, 23 |
z |
l, w |
|
II |
1, 13, 23 |
z |
z42 |
|
II |
13, 22 |
z |
- |
|
Ried |
1, 13, 22 |
z4, z23 |
[e, n, z15] |
|
IIIa |
13, 22 |
z4, z23 |
- |
|
Ajiobo |
13, 23 |
z4, z23 |
- |
|
IIIa |
13, 23 |
z4, z23, [z32] |
- |
|
Romanby |
1, 13, 23 |
z4, z24 |
- |
|
IIIa |
1, 13, 23 |
z4, z24 |
- |
|
Roodepoort |
1, 13, 22 |
z10 |
1, 5 |
|
II |
1, 13, 22 |
z10 |
z6 |
|
Sapele |
13, 23 |
z10 |
e, n, z15 |
|
Demerara |
13, 23 |
z10 |
l, w |
|
II |
13, 22 |
z29 |
1, 5 |
|
II |
13, 22 |
z29 |
e, n, x |
|
II |
1, 13, 23 |
z29 |
1, 5 |
|
II |
1, 13, 23 |
z29 |
e, n, x |
|
Agoueve |
13, 22 |
z29 |
- |
|
Cubana |
1, 13, 23 |
z29 |
- |
|
Mampong |
13, 22 |
z35 |
1, 6 |
|
Nimes |
13, 22 |
z35 |
e, n, z15 |
|
Anna |
13, 23 |
z35 |
e, n, z15 |
|
Leiden |
13, 22 |
z38 |
- |
|
Fanti |
13, 23 |
z38 |
- |
|
II |
13, 22 |
z39 |
1, 7 |
|
II |
1, 13, 23 |
z39 |
1, 5, 7 |
|
II |
1, 13, 23 |
[z42] |
1, [5], 7 |
|
II |
13, 23 |
- |
1, 6 |
|
Группа O:6, 14 (H) |
|||
|
Garba |
1, 6, 14, 25 |
a |
1, 5 |
|
VI |
[1], 6, 14 |
a |
1, 5 |
|
VI |
1, 6, 14, 25 |
a |
e, n, x |
|
Banjul |
1, 6, 14, 25 |
a |
e, n, z15 |
|
Ndj amena |
1, 6, 14, 25 |
b |
1, 2 |
|
Kuntair |
1, 6, 14, 25 |
b |
1, 5 |
|
Tucson |
[1], 6, 14, [25] |
b |
1, 7 |
|
IIIb |
(6), 14 |
b |
e, n, x |
|
Blijdorp |
1, 6, 14, 25 |
c |
1, 5 |
|
Kassberg |
1, 6, 14, 25 |
c |
1, 6 |
|
Runby |
1, 6, 14, 25 |
c |
e, n, x |
|
Minna |
1, 6, 14, 25 |
c |
l, w |
|
Finkenwerder |
[1], 6, 14, [25] |
d |
1, 5 |
|
Woodhull |
1, 6, 14, 25 |
d |
1, 6 |
|
Midway |
6, 14, 24 |
d |
1, 7 |
|
Florida |
[1], 6, 14, [25] |
d |
1, 7 |
|
Lindern |
6, 14, [24] |
d |
e, n, x |
|
Charity |
[1], 6, 14, [25] |
d |
e, n, x |
|
Teko |
[1], 6, 14, [25] |
d |
e, n, z15 |
|
Encino |
1, 6, 14, 25 |
d |
l, z13, z28 |
|
Albuquerque |
1, 6, 14, 24 |
d |
z6 |
|
Bahrenfeld |
6, 14, [24] |
e, h |
1, 5 |
|
Onderstepoort |
1, 6, 14, [25] |
e, h |
1, 5 |
|
Magumeri |
1, 6, 14, 25 |
e, h |
1, 6 |
|
Beaudesert |
[1], 6, 14, [25] |
e, h |
1, 7 |
|
V |
6, 14 |
e, n, z15 |
- |
|
Warragul |
[1], 6, 14, [25] |
g, m |
- |
|
Caracas |
[1], 6, 14, [25] |
g, m, s |
- |
|
Sylvania |
[1], 6, 14, [25] |
g, p |
- |
|
Catanzaro |
6, 14 |
g, s, t |
- |
|
II |
1, 6, 14 |
m, t |
1, 5 |
|
II |
6, 14 |
m, t |
e, n, x |
|
Kaitaan |
1, 6, 14, 25 |
m, t |
- |
|
Mampeza |
1, 6, 14, 25 |
i |
1, 5 |
|
Buzu |
[1], 6, 14, [25] |
i |
1, 7 |
|
Schalkwijk |
6, 14, [24] |
i |
e, n, z15 |
|
Moussoro |
1, 6, 14, 25 |
i |
e, n, z15 |
|
Harburg |
[1], 6, 14, [25] |
k |
1, 5 |
|
II |
6, 14, [24] |
k |
1, 6 |
|
II |
6, 14 |
k |
e, n, x |
|
IIIb |
(6), 14 |
k |
z |
|
II |
1, 6, 14 |
k |
z6: z42 |
|
IIIb |
(6), 14 |
k |
z53 |
|
Boecker |
[1], 6, 14, [25] |
l, v |
1, 7 |
|
Horsham |
1, 6, 14, [25] |
l, v |
e, n, x |
|
Alpenquai |
6, 14 |
l, v |
e, n, z15 |
|
IIIb |
(6), 14 |
l, v |
z |
|
IIIb |
(6), 14 |
l, v |
z35 |
|
IIIb |
(6), 14 |
l, v |
z53 |
|
VI |
6, 14 |
1, v |
z88 |
|
Aflao |
1, 6, 14, 25 |
l, z28 |
e, n, x |
|
Istoria |
1, 6, 14, 26 |
r, i |
1, 5 |
|
IIIb |
(6), 14 |
r |
z |
|
Surat |
[1], 6, 14, [25] |
r, [i] |
e, n, z15 |
|
Carrau |
6, 14, [24] |
y |
1, 7 |
|
Madelia |
1, 6, 14, 25 |
y |
1, 7 |
|
Fischerkietz |
1, 6, 14, 25 |
y |
e, n, x |
|
Mornington |
1, 6, 14, 25 |
y |
e, n, z15 |
|
Homosassa |
1, 6, 14, 25 |
z |
1, 5 |
|
Kanifing |
1, 6, 14, 25 |
z |
1, 6 |
|
Soahanina |
6, 14, 24 |
z |
e, n, x |
|
Sundsvall |
[1], 6, 14, [25] |
z |
e, n, x |
|
Royan |
1, 6, 14, 25 |
z |
e, n, z15 |
|
Poano |
1, 6, 14, 25 |
z |
1, z13, z28 |
|
Arapahoe |
6, 14 |
z4, z23 |
1, 5 |
|
Bousso |
1, 6, 14, 25 |
z4, z23 |
[e, n, z15] |
|
IV |
6, 14 |
z4, z23 |
- |
|
Chichiri |
6, 14, 24 |
z4, z24 |
- |
|
Uzaramo |
1, 6, 14, 25 |
z4, z24 |
- |
|
Nessa |
1, 6, 14, 25 |
z10 |
1, 2 |
|
VI |
1, 6, 14, 25 |
z10 |
1, (2), 7 |
|
II |
1, 6, 14 |
z10 |
1, 5 |
|
Laredo |
1, 6, 14, 25 |
z10 |
1, 6 |
|
IIIb |
(6), 14 |
z10 |
e, n, x, z15 |
|
IIIb |
(6), 14 |
z10 |
z |
|
II |
1, 6, 14 |
z10 |
z6: z42 |
|
IIIb |
6, 14 |
z10 |
z53 |
|
Potosi |
6, 14 |
z36 |
1, 5 |
|
II |
6, 14 |
z36 |
- |
|
Sara |
1, 6, 14, 25 |
z38 |
[e, n, x] |
|
II |
1, 6, 14 |
z42 |
1, 6 |
|
IIIb |
6, 14 |
z52 |
e, n, x, z15 |
|
IIIb |
1, 6, 14, 25 |
z52 |
z35 |
|
Группа O:16 (I) |
|||
|
Hannover |
16 |
a |
1, 2 |
|
Brazil |
16 |
a |
1, 5 |
|
Amunigun |
16 |
a |
1, 6 |
|
Nyeko |
16 |
a |
1, 7 |
|
Togba |
16 |
a |
e, n, x |
|
Fischerhuette |
16 |
a |
e, n, z15 |
|
Heron |
16 |
a |
z6 |
|
Hull |
16 |
b |
1, 2 |
|
Melaka |
16 |
b |
1, 2, 5 |
|
Wa |
16 |
b |
1, 5 |
|
Glasgow |
16 |
b |
1, 6 |
|
Hvittingfoss |
16 |
b |
e, n, x |
|
II |
16 |
b |
e, n, x |
|
Sangera |
16 |
b |
e, n, z15 |
|
Vegesack |
16 |
b |
l, w |
|
Malstatt |
16 |
b |
z6 |
|
II |
16 |
b |
z39 |
|
II |
16 |
b |
z42 |
|
Vancouver |
16 |
c |
1, 5 |
|
Gafsa |
16 |
c |
1, 6 |
|
Shamba |
16 |
c |
e, n, x |
|
Hithergreen |
16 |
c |
e, n, z15 |
|
Yoruba |
16 |
c |
l, w |
|
Oldenburg |
16 |
d |
1, 2 |
|
Sculcoates |
16 |
d |
1, 5 |
|
II |
16 |
d |
1, 5 |
|
Sherbrooke |
16 |
d |
1, 6 |
|
Gaminara |
16 |
d |
1, 7 |
|
Barranquilla |
16 |
d |
e, n, x |
|
II |
16 |
d |
e, n, x |
|
Nottingham |
16 |
d |
e, n, z15 |
|
Caen |
16 |
d |
l, w |
|
Barmbek |
16 |
d |
z6 |
|
Malakal |
16 |
e, h |
1, 2 |
|
Saboya |
16 |
e, h |
1, 5 |
|
Rhydyfelin |
16 |
e, h |
e, n, x |
|
Weston |
16 |
e, h |
z6 |
|
II |
16 |
e, n, x |
1, (5), 7 |
|
II |
16 |
e, n, x |
l, 6:z42 |
|
Tees |
16 |
f, g |
- |
|
Adeoyo |
16 |
g, m, [t] |
- |
|
Nikolaifleet |
16 |
g, m, s |
- |
|
II |
16 |
g, [m], [s], t |
[l, 5]:[ z42] |
|
II |
16 |
g, [m], [s], t |
[e, n, x] |
|
Cardoner |
16 |
g, s, t |
- |
|
II |
16 |
m, t |
e, n, x |
|
Morbihan |
16 |
m, t |
e, n, z15 |
|
II |
16 |
m, t |
[z42] |
|
Mpouto |
16 |
m, t |
- |
|
Amina |
16 |
i |
1, 5 |
|
Agbara |
16 |
i |
1, 6 |
|
Wisbech |
16 |
i |
1, 7 |
|
Frankfurt |
16 |
i |
e, n, z15 |
|
Pisa |
16 |
i |
l, w |
|
Abobo |
16 |
i |
z6 |
|
IIIb |
16 |
i |
z35 |
|
Szentes |
16 |
k |
1, 2 |
|
Maumee |
16 |
k |
1, 6 |
|
Nuatja |
16 |
k |
e, n, x |
|
Orientalis |
16 |
k |
e, n, z15 |
|
IIIb |
16 |
k |
z |
|
IIIb |
16 |
(k) |
z35 |
|
IIIb |
16 |
k |
z53 |
|
IIIb |
16 |
l, v |
1, 5, 7 |
|
Shanghai |
16 |
l, v |
1, 6 |
|
Welikade |
16 |
l, v |
1, 7 |
|
Salford |
16 |
l, v |
e, n, x |
|
Burgas |
16 |
l, v |
e, n, z15 |
|
IIIb |
16 |
l, v |
z:[z61] |
|
Losangeles |
16 |
l, v |
z6 |
|
IIIb |
16 |
l, v |
z35 |
|
IIIb |
16 |
l, v |
z53 |
|
Zigong |
16 |
l, w |
1, 5 |
|
Westeinde |
16 |
l, w |
1, 6 |
|
Brooklyn |
16 |
l, w |
e, n, x |
|
Lomnava |
16 |
l, w |
e, n, z15 |
|
Essingen |
16 |
l, w |
z6 |
|
II |
16 |
l, w |
z6 |
|
Mandera |
16 |
l, z13 |
e, n, z15 |
|
Enugu |
16 |
l, [z13], z28 |
[1, 5] |
|
Battle |
16 |
l, z13, z28 |
1, 6 |
|
Ablogame |
16 |
l, z13, z28 |
z6 |
|
II |
16 |
l, z28 |
z42 |
|
Rovaniemi |
16 |
r, i |
1, 5 |
|
Ivory |
16 |
r |
1, 6 |
|
Brunflo |
16 |
r |
1, 7 |
|
Annedal |
16 |
r, i |
e, n, x |
|
Zwickau |
16 |
r, i |
e, n, z15 |
|
Saphra |
16 |
y |
1, 5 |
|
Akuafo |
16 |
y |
1, 6 |
|
Kikoma |
16 |
y |
e, n, x |
|
Avignon |
16 |
y |
e, n, z15 |
|
Gerland |
16 |
z |
1, 5 |
|
Fortlamy |
16 |
z |
1, 6 |
|
Lingwala |
16 |
z |
1, 7 |
|
II |
16 |
2 |
e, n, x |
|
Brevik |
16 |
z |
e, n, [x], z15 |
|
Bouake |
16 |
z |
z6 |
|
II |
16 |
z |
z42 |
|
Kibi |
16 |
z4, z23 |
[1, 6] |
|
Axim |
16 |
z4, z23 |
z6 |
|
II |
16 |
z4, z23 |
- |
|
IV |
16 |
z4, z23 |
- |
|
II |
16 |
z4, z24 |
- |
|
IV |
16 |
z4, z24 |
- |
|
IV |
16 |
z4, z32 |
- |
|
II |
16 |
z6 |
1, 6 |
|
Badagry |
16 |
z10 |
1, 5 |
|
IIIb |
16 |
z10 |
1, 5, 7 |
|
Lisboa |
16 |
z10 |
1, 6 |
|
IIIb |
16 |
z10 |
e, n, x, z15 |
|
Redlands |
16 |
z10 |
e, n, z15 |
|
Angouleme |
16 |
z10 |
z6 |
|
Saloniki |
16 |
z29 |
- |
|
II |
16 |
z29 |
1, 5 |
|
II |
16 |
z29 |
e, n, x |
|
Trier |
16 |
z35 |
1, 6 |
|
Dakota |
16 |
z35 |
e, n, z15 |
|
II |
16 |
z35 |
e, n, x |
|
IV |
16 |
z36 |
- |
|
II |
16 |
z36 |
e, n, z15 |
|
Naware |
16 |
z38 |
- |
|
Grancanaria |
16 |
z39 |
[1, 6] |
|
II |
16 |
z42 |
1, (5), 7 |
|
II |
16 |
z42 |
1, 6 |
|
IIIb |
16 |
z52 |
z35 |
|
Группа O:17 (J) |
|||
|
Bonames |
17 |
a |
1, 2 |
|
Jangwani |
17 |
a |
1, 5 |
|
Kinondoni |
17 |
a |
e, n, x |
|
Kirkee |
17 |
b |
1, 2 |
|
Dahra |
17 |
b |
1, 5 |
|
Mattenhof |
17 |
b |
e, n, x |
|
II |
17 |
b |
e, n, x, z15 |
|
Bignona |
17 |
b |
e, n, z15 |
|
II |
17 |
b |
z6 |
|
Luedinghausen |
17 |
c |
1, 5 |
|
Victoriaborg |
17 |
c |
1, 6 |
|
II |
17 |
c |
z39 |
|
Berlin |
17 |
d |
1, 5 |
|
Karlshamn |
17 |
d |
e, n, z15 |
|
Niamey |
17 |
d |
l, w |
|
Jubilee |
17 |
e, h |
1, 2 |
|
II |
17 |
e, n, x, z15 |
1, 6 |
|
II |
17 |
e, n, x, z15 |
1, [5], 7 |
|
II |
17 |
g, m, s, t |
- |
|
Lowestoft |
17 |
g, s, t |
- |
|
II |
17 |
g, t |
[e, n, x, z15] |
|
II |
17 |
g, t |
z39 |
|
Bama |
17 |
m, t |
- |
|
II |
17 |
m, t |
- |
|
Ahanou |
17 |
i |
1, 7 |
|
IIIb |
17 |
i |
z35 |
|
Irenea |
17 |
k |
1, 5 |
|
Warri |
17 |
k |
1, 7 |
|
Matadi |
17 |
k |
e, n, x |
|
Zaria |
17 |
k |
e, n, z15 |
|
IIIb |
17 |
k |
z |
|
II |
17 |
k |
- |
|
Morotai |
17 |
l, v |
1, 2 |
|
Michigan |
17 |
l, v |
1, 5 |
|
Lancaster |
17 |
l, v |
1, 7 |
|
Carmel |
17 |
l, v |
e, n, x |
|
IIIb |
17 |
l, v |
e, n, x, z15 |
|
IIIb |
17 |
l, v |
z, w |
|
Granlo |
17 |
l, z28 |
e, n, x |
|
Lode |
17 |
r |
1, 2 |
|
IIIb |
17 |
r |
z |
|
II |
17 |
y |
- |
|
Tendeba |
17 |
y |
e, n, x |
|
Hadejia |
17 |
y |
e, n, z15 |
|
Lokomo |
17 |
y |
l, w |
|
Gori |
17 |
z |
1, 2 |
|
Warengo |
17 |
z |
1, 5 |
|
II |
17 |
z |
1, 7 |
|
Tchamba |
17 |
z |
e, n, z15 |
|
II |
17 |
z |
l, w:z42 |
|
IIIa |
17 |
z4, z23 |
- |
|
IIIa |
17 |
z4, z23, z32 |
- |
|
IIIa |
17 |
z4, z24 |
- |
|
IIIa |
17 |
z4, z32 |
- |
|
Djibouti |
17 |
z10 |
e, n, x |
|
IIIb |
17 |
z10 |
e, n, x, z15 |
|
IIIb |
17 |
z10 |
z |
|
II |
17 |
z10 |
- |
|
Kandla |
17 |
z29 |
- |
|
IIIa |
17 |
z29 |
- |
|
IV |
17 |
z29 |
- |
|
Aachen |
17 |
z35 |
1, 6 |
|
IIIa |
17 |
z36 |
- |
|
IV |
17 |
z36 |
- |
|
Группа O:18 (K) |
|||
|
Brazos |
6, 14, 18 |
a |
e, n, z15 |
|
Fluntern |
6, 14, 18 |
b |
1, 5 |
|
Cochise |
18 |
b |
1, 7 |
|
Rawash |
6, 14, 18 |
c |
e, n, x |
|
Groenekan |
18 |
d |
1, 5 |
|
Usumbura |
18 |
d |
1, 7 |
|
Pontypridd |
18 |
g, m |
- |
|
IIIa |
18 |
g, z51 |
- |
|
II |
18 |
m, t |
1, 5 |
|
Langenhorn |
18 |
m, t |
- |
|
Memphis |
18 |
k |
1, 5 |
|
IIIb |
18 |
(k) |
z53 |
|
IIIb |
18 |
(k) |
z54 |
|
IIIb |
18 |
l, v |
e, n, x, z15 |
|
Orlando |
18 |
l, v |
e, n, z15 |
|
IIIb |
18 |
l, v |
z |
|
IIIb |
18 |
l, v |
z53 |
|
Toulon |
18 |
l, w |
e, n, z15 |
|
Tennenlohe |
18 |
r |
1, 5 |
|
IIIb |
18 |
r |
z |
|
Troy |
18 |
y |
1, 7 |
|
II |
18 |
y |
e, n, x, z15 |
|
Potengi |
18 |
z |
- |
|
Cerro |
6, 14, 18 |
z4, z23 |
[1, 5] |
|
Aarhus |
18 |
z4, z23 |
z64 |
|
II |
18 |
z4, z23 |
- |
|
IIIa |
18 |
z4, z23 |
- |
|
Blukwa |
6, 14, 18 |
z4, z24 |
- |
|
II |
18 |
z4, z24 |
- |
|
IIIa |
18 |
z4, z32 |
- |
|
IIIb |
18 |
z10 |
e, n, x, z15 |
|
Leer |
18 |
z10 |
1, 5 |
|
Carnac |
18 |
z10 |
z6 |
|
II |
18 |
z10 |
z6 |
|
II |
18 |
z36 |
- |
|
IV |
18 |
z36, z38 |
- |
|
Sinthia |
18 |
z38 |
- |
|
Delmenhorst |
18 |
z71 |
- |
|
Cotia |
18 |
- |
1, 6 |
|
Группа O:21 (L) |
|||
|
Assen |
21 |
a |
[1, 5] |
|
II |
21 |
b |
1, 5 |
|
Ghana |
21 |
b |
1, 6 |
|
Minnesota |
21 |
b |
e, n, x |
|
Hydra |
21 |
c |
1, 6 |
|
Rhone |
21 |
c |
e, n, x |
|
II |
21 |
c |
e, n, x |
|
IIIb |
21 |
c |
e, n, x, z15 |
|
Spartel |
21 |
d |
1, 5 |
|
Magwa |
21 |
d |
e, n, x |
|
Madison |
21 |
d |
z6 |
|
Good |
21 |
f, g |
e, n, x |
|
II |
21 |
g, [m], [s], t |
- |
|
IIIa |
21 |
g, z51 |
- |
|
IV |
21 |
g, z51 |
- |
|
II |
21 |
m, t |
- |
|
Diourbel |
21 |
i |
1, 2 |
|
IIIb |
21 |
i |
1, 5, 7 |
|
IIIb |
21 |
i |
e, n, x, z15 |
|
IIIb |
21 |
k |
e, n, x, z15 |
|
IIIb |
21 |
k |
z |
|
Surrey |
21 |
k |
1, (2), 5 |
|
IIIb |
21 |
l, v |
z |
|
IIIb |
21 |
l, v |
z57 |
|
Keve |
21 |
l, w |
- |
|
Jambur |
21 |
l, z28 |
e, n, z15 |
|
Mountmagnet |
21 |
r |
- |
|
IIIb |
21 |
r |
z |
|
Ibaragi |
21 |
y |
1, 2 |
|
Ruiru |
21 |
y |
e, n, x |
|
II |
21 |
z |
- |
|
Baguida |
21 |
z4, z23 |
- |
|
IIIa |
21 |
z4, z23 |
- |
|
IV |
21 |
z4, z23 |
- |
|
II |
21 |
z4, z24 |
- |
|
IIIa |
21 |
z4, z24 |
- |
|
IV |
21 |
z4, z32 |
- |
|
IIIb |
21 |
z10 |
e, n, x, z15 |
|
IIIb |
21 |
z10 |
z |
|
II |
21 |
z10 |
[z6] |
|
IIIb |
21 |
z10 |
z53 |
|
IIIa |
21 |
z29 |
- |
|
Gambaga |
21 |
z35 |
e, n, z15 |
|
IV |
21 |
z36 |
- |
|
IIIb |
21 |
z65 |
e, n, x, z15 |
|
Группа O:28 (M) |
|||
|
Solna |
28 |
a |
1, 5 |
|
Dakar |
28 |
a |
1, 6 |
|
Bakau |
28 |
a |
1, 7 |
|
Seattle |
28 |
a |
e, n, x |
|
II |
28 |
a |
e, n, x |
|
Honelis |
28 |
a |
e, n, z15 |
|
Dibra |
28 |
a |
z6 |
|
Moero |
28 |
b |
1, 5 |
|
Ashanti |
28 |
b |
1, 6 |
|
Bokanjac |
28 |
b |
1, 7 |
|
Soumbedioune |
28 |
b |
e, n, x |
|
II |
28 |
b |
e, n, x |
|
Langford |
28 |
b |
e, n, z15 |
|
Freefalls |
28 |
b |
l, w |
|
II |
28 |
b |
z6 |
|
Hermannswerder |
28 |
c |
1, 5 |
|
Eberswalde |
28 |
c |
1, 6 |
|
Halle |
28 |
c |
1, 7 |
|
Dresden |
28 |
c |
e, n, x |
|
Wedding |
28 |
c |
e, n, z15 |
|
Techimani |
28 |
c |
z6 |
|
Amoutive |
28 |
d |
1, 5 |
|
Hatfield |
28 |
d |
1, 6 |
|
Mundonobo |
28 |
d |
1, 7 |
|
Mocamedes |
28 |
d |
e, n, x |
|
Patience |
28 |
d |
e, n, z15 |
|
Cullingworth |
28 |
d |
l, w |
|
Kpeme |
28 |
e, h |
1, 7 |
|
Gozo |
28 |
e, h |
e, n, z15 |
|
II |
28 |
e, n, x |
1, 7 |
|
II |
28 |
e, n, z15 |
z87 |
|
Friedrichsfelde |
28 |
f, g |
- |
|
Yardley |
28 |
g, m |
1, 6 |
|
Abadina |
28 |
g, m |
[e, n, z15] |
|
II |
28 |
g, (m), [s], t |
1, 5 |
|
Croft |
28 |
g, m, s |
[e, n, z15] |
|
II |
28 |
g, m, t |
e, n, x |
|
II |
28 |
g, m, t |
z39 |
|
II |
28 |
g, s, t |
e, n, x |
|
Ona |
28 |
g, s, t |
- |
|
II |
28 |
m, t |
[e, n, x] |
|
Vinohrady |
28 |
m, t |
[e, n, z15] |
|
Morillons |
28 |
m, t |
1, 6 |
|
Doorn |
28 |
i |
1, 2 |
|
Cotham |
28 |
i |
1, 5 |
|
Volkmarsdorf |
28 |
i |
1, 6 |
|
Dieuppeul |
28 |
i |
1, 7 |
|
Warnemuende |
28 |
i |
e, n, x |
|
Kuessel |
28 |
i |
e, n, z15 |
|
Douala |
28 |
i |
l, w |
|
Guildford |
28 |
k |
1, 2 |
|
Ilala |
28 |
k |
1, 5 |
|
Adamstown |
28 |
k |
1, 6 |
|
Ikeja |
28 |
k |
1, 7 |
|
IIIb |
28 |
k |
1, 7 |
|
Taunton |
28 |
k |
e, n, x |
|
Ank |
28 |
k |
e, n, z15 |
|
Leoben |
28 |
l, v |
1, 5 |
|
Vitkin |
28 |
l, v |
e, n, x |
|
Nashua |
28 |
l, v |
e, n, z15 |
|
Ramsey |
28 |
l, w |
1, 6 |
|
Catalunia |
28 |
l, z13, z28 |
1, 5 |
|
Penilla |
28 |
l, z13, z28 |
e, n, z15 |
|
II |
28 |
l, z28 |
1, 5 |
|
Fajara |
28 |
l, z28 |
e, n, x |
|
II |
28 |
1, z28 |
e, n, x |
|
Bassadji |
28 |
r |
1, 6 |
|
Kibusi |
28 |
r |
e, n, x |
|
II |
28 |
r |
e, n, z15 |
|
Fairfield |
28 |
r |
l, w |
|
Chicago |
28 |
r, [i] |
1, 5 |
|
Banco |
28 |
r, i |
1, 7 |
|
Sanktgeorg |
28 |
r, [i] |
e, n, z15 |
|
Oskarshamn |
28 |
y |
1, 2 |
|
Nima |
28 |
y |
1, 5 |
|
Pomona |
28 |
y |
1, 7:[z60] |
|
Kitenge |
28 |
y |
e, n, x |
|
Telaviv |
28 |
y |
e, n, z15 |
|
Shomolu |
28 |
y |
l, w |
|
Selby |
28 |
y |
z6 |
|
Vanier |
28 |
z |
1, 5 |
|
II |
28 |
z |
1, 5 |
|
Doel |
28 |
z |
1, 6 |
|
Ezra |
28 |
z |
1, 7 |
|
Brisbane |
28 |
z |
e, n, z15 |
|
II |
28 |
z |
z39 |
|
Cannobio |
28 |
z4, z23 |
1, 5 |
|
Teltow |
28 |
z4, z23 |
1, 6 |
|
Babelsberg |
28 |
z4, z23 |
[e, n, z15] |
|
Rogy |
28 |
z10 |
1, 2 |
|
Farakan |
28 |
z10 |
1, 5 |
|
Libreville |
28 |
z10 |
1, 6 |
|
Malaysia |
28 |
z10 |
1, 7 |
|
Umbilo |
28 |
z10 |
e, n, x |
|
Luckenwalde |
28 |
z10 |
e, n, z15 |
|
Moroto |
28 |
z10 |
l, w |
|
IIIb |
28 |
z10 |
z |
|
Djermaia |
28 |
z29 |
- |
|
II |
28 |
z29 |
1, 5 |
|
II |
28 |
z29 |
e, n, x |
|
Konolfingen |
28 |
z35 |
1, 6 |
|
Babili |
28 |
z35 |
1, 7 |
|
Santander |
28 |
z35 |
e, n, z15 |
|
Aderike |
28 |
z38 |
e, n, z15 |
|
Группа O:30 (N) |
|||
|
Overvecht |
30 |
a |
1, 2 |
|
Zehlendorf |
30 |
a |
1, 5 |
|
Guarapiranga |
30 |
a |
e, n, x |
|
Doulassame |
30 |
a |
e, n, z15 |
|
II |
30 |
a |
z39 |
|
Louga |
30 |
b |
1, 2 |
|
Aschersleben |
30 |
b |
1, 5 |
|
Tempe |
30 |
b |
1, 7 |
|
Urbana |
30 |
b |
e, n, x |
|
Neudorf |
30 |
b |
e, n, z15 |
|
II |
30 |
b |
z6 |
|
Zaire |
30 |
c |
1, 7 |
|
Morningside |
30 |
c |
e, n, z15 |
|
II |
30 |
c |
z39 |
|
Messina |
30 |
d |
1, 5 |
|
Livulu |
30 |
e, h |
1, 2 |
|
Torhout |
30 |
e, h |
1, 5 |
|
Godesberg |
30 |
g, m, [t] |
- |
|
II |
30 |
g, m, s |
e, n, x |
|
Giessen |
30 |
g, m, s |
- |
|
Sternschanze |
30 |
g, s, t |
- |
|
II |
30 |
g, t |
- |
|
Wayne |
30 |
g, z51 |
- |
|
II |
30 |
m, t |
- |
|
Landau |
30 |
i |
1, 2 |
|
Morehead |
30 |
i |
1, 5 |
|
Mjordan |
30 |
i |
e, n, z15 |
|
Soerenga |
30 |
i |
l, w |
|
Hilversum |
30 |
k |
1, 2 |
|
Ramatgan |
30 |
k |
1, 5 |
|
Aqua |
30 |
k |
1, 6 |
|
Angoda |
30 |
k |
e, n, x |
|
Odozi |
30 |
k |
e, n, [x], z15 |
|
II |
30 |
k |
c, n, x, z15 |
|
Scarborough |
30 |
k |
l, z13, z28 |
|
Ligeo |
30 |
l, v |
1, 2 |
|
Donna |
30 |
l, v |
1, 5 |
|
Ockcnheim |
30 |
l, z13, z28 |
1, 6 |
|
Morocco |
30 |
l, z13, z28 |
e, n, z15 |
|
II |
30 |
l, z28 |
z6 |
|
Grandhaven |
30 |
r |
1, 2 |
|
Gege |
30 |
r |
1, 5 |
|
Quincy |
30 |
r |
1, 6 |
|
Matopeni |
30 |
y |
1, 2 |
|
Bictri |
30 |
y |
1, 5 |
|
Stcinplatz |
30 |
y |
1, 6 |
|
Baguirmi |
30 |
y |
e, n, x |
|
Nijmegen |
30 |
y |
e, n, z15 |
|
Sioneferry |
30 |
z4, z23 |
- |
|
Bodjonegoro |
30 |
z4, z24 |
- |
|
II |
30 |
z6 |
1, 6 |
|
Sada |
30 |
z10 |
1, 2 |
|
Scnncvillc |
30 |
z10 |
1, 5 |
|
Kumasi |
30 |
z10 |
e, n, z15 |
|
II |
30 |
z10 |
e, n, x, z15 |
|
Aragua |
30 |
z29 |
- |
|
Kokoli |
30 |
z35 |
1, 6 |
|
Wuiti |
30 |
z35 |
e, n, z15 |
|
Ago |
30 |
z38 |
- |
|
II |
30 |
z39 |
1, 7 |
|
Группа O:35 (O) |
|||
|
Umhlatazana |
35 |
a |
e, n, z15 |
|
Tchad |
35 |
b |
- |
|
Keurmassar |
35 |
c |
1, 2 |
|
Gouloumbo |
35 |
c |
1, 5 |
|
Yolo |
35 |
c |
[e, n, z15] |
|
II |
35 |
d |
1, 5 |
|
Dembe |
35 |
d |
l, w |
|
Gassi |
35 |
e, h |
z6 |
|
Adelaide |
35 |
f, g |
- |
|
Ealing |
35 |
g, m, s |
- |
|
II |
35 |
g, m, s, t |
- |
|
Ebrie |
35 |
g, m, t |
- |
|
Anecho |
35 |
g, s, t |
- |
|
II |
35 |
g, t |
1, 5 |
|
II |
35 |
g, t |
z42 |
|
Agodi |
35 |
g, t |
- |
|
IIIa |
35 |
g, z51 |
- |
|
Monschaui |
35 |
m, t |
- |
|
II |
35 |
m, i |
- |
|
IIIb |
35 |
i |
e, n, x, z15 |
|
Gambia |
35 |
i |
e, n, z15 |
|
Bandia |
35 |
i |
l, w |
|
IIIb |
35 |
i |
z |
|
IIIb |
35 |
i |
z35 |
|
IIIb |
35 |
i |
z53 |
|
IIIb |
35 |
k |
e, n, x, z15 |
|
IIIb |
35 |
k |
z |
|
IIIb |
35 |
(k) |
z35 |
|
IIIb |
35 |
k |
z53 |
|
IIIb |
35 |
l, v |
1, 5, 7 |
|
III |
35 |
l, v |
e, n, x, z15 |
|
IIIb |
35 |
l, v |
z35:[z67] |
|
II |
35 |
1, z28 |
- |
|
IIIb |
35 |
r |
e, n, x, z15 |
|
Massakory |
35 |
r |
l, w |
|
IIIb |
35 |
r |
z |
|
IIIb |
35 |
r |
z35 |
|
IIIb |
35 |
r |
z61 |
|
Alachua |
35 |
z4, z23 |
- |
|
IIIa |
35 |
z4, z23 |
- |
|
Westphalia |
35 |
z4, z24 |
- |
|
IIIa |
35 |
z4, z24 |
- |
|
IIIa |
35 |
z4, z32 |
- |
|
Camberene |
35 |
z10 |
1, 5 |
|
Enschede |
35 |
z10 |
l, w |
|
Ligna |
35 |
z10 |
z6 |
|
IIIb |
35 |
z10 |
z35 |
|
II |
35 |
z29 |
e, n, x |
|
Widemarsh |
35 |
z29 |
- |
|
IIIa |
35 |
z29 |
- |
|
IIIa |
35 |
z36 |
- |
|
Haga |
35 |
z38 |
- |
|
IIIb |
35 |
z52 |
1, 5, 7 |
|
IIIb |
35 |
z52 |
e, n, x, z15 |
|
IIIb |
35 |
z52 |
z |
|
IIIb |
35 |
z52 |
z35 |
|
Группа O:38 (P) |
|||
|
Oran |
38 |
a |
e, n, z15 |
|
II |
38 |
b |
1, 2 |
|
Rittersbach |
38 |
b |
e, n, z15 |
|
Sheffield |
38 |
c |
1, 5 |
|
Kidderminster |
38 |
c |
1, 6 |
|
II |
38 |
d |
[1, 5] |
|
II |
38 |
d |
z39 |
|
Thiaroye |
38 |
e, h |
1, 2 |
|
Kasenyi |
38 |
e, h |
1, 5 |
|
Korovi |
38 |
g, m, [s] |
- |
|
II |
38 |
g, t |
- |
|
IIIa |
38 |
g, z51 |
- |
|
IV |
38 |
g, z51 |
- |
|
Rothenburgsort |
38 |
m, t |
- |
|
Mgulani |
38 |
i |
1, 2 |
|
Lansing |
38 |
i |
1, 5 |
|
IIIb |
38 |
i |
z |
|
IIIb |
38 |
i |
z53 |
|
Echa |
38 |
k |
1, 2 |
|
Mango |
38 |
k |
1, 5 |
|
Inverness |
38 |
k |
1, 6 |
|
Njala |
38 |
k |
e, n, x |
|
IIIb |
38 |
k |
e, n, x, z15 |
|
IIIb |
38 |
k |
z |
|
IIIb |
38 |
k |
z53 |
|
IIIb |
38 |
(k) |
1, 5, 7 |
|
IIIb |
38 |
(k) |
z35 |
|
IIIb |
38 |
(k) |
- |
|
IIIb |
38 |
(k) |
z55 |
|
Alger |
38 |
l, v |
1, 2 |
|
Kimberley |
38 |
l, v |
1, 5 |
|
Taylor |
38 |
l, v |
e, n, z15 |
|
Roan |
38 |
l, v |
e, n, x |
|
IIIb |
38 |
l, v |
z |
|
IIIb |
38 |
l, v |
z35 |
|
IIIb |
38 |
l, v |
z53:[z54] |
|
Lindi |
38 |
r |
1, 5 |
|
IIIb |
38 |
r |
1, 5, 7 |
|
Emmastad |
38 |
r |
1, 6 |
|
IIIb |
38 |
r |
e, n, x, z15 |
|
IIIb |
38 |
r |
z:[z57] |
|
IIIb |
38 |
r |
z35 |
|
Freetown |
38 |
y |
1, 5 |
|
Colombo |
38 |
y |
1, 6 |
|
Perth |
38 |
y |
e, n, x |
|
Stachus |
38 |
z |
- |
|
Yoff |
38 |
z4, z23 |
1, 2 |
|
IIIa |
38 |
z4, z23 |
- |
|
IV |
38 |
z4, z23 |
- |
|
Bangkok |
38 |
z4, z24 |
- |
|
Neunkirchen |
38 |
z10 |
[1, 5] |
|
IIIb |
38 |
z10 |
z |
|
IIIb |
38 |
z10 |
z53 |
|
Klouto |
38 |
z38 |
- |
|
IIIb |
38 |
z52 |
z35 |
|
IIIb |
38 |
z52 |
z53 |
|
IIIb |
38 |
z53 |
- |
|
IIIb |
38 |
z61 |
[z53] |
|
Группа O:39 (Q) |
|||
|
II |
39 |
a |
z39 |
|
Wandsworth |
39 |
b |
1, 2 |
|
Abidjan |
39 |
b |
l, w |
|
II |
39 |
c |
e, n, x |
|
Logone |
39 |
d |
1, 5 |
|
Bruebach |
39 |
e, h |
1, 2 |
|
Mara |
39 |
e, h |
1, 5 |
|
II |
39 |
e, n, x |
1, 7 |
|
II |
39 |
[g], m, t |
[e, n, x] |
|
Hofit |
39 |
i |
1, 5 |
|
Cumberland |
39 |
i |
e, n, x |
|
Alma |
39 |
i |
e, n, z15 |
|
Champaign |
39 |
k |
1, 5 |
|
Newjersey |
39 |
k |
e, n, x |
|
II |
39 |
l, v |
1, 5 |
|
Kokomlemle |
39 |
i, v |
e, n, x |
|
Oerlikon |
39 |
l, v |
e, n, z15 |
|
II |
39 |
l, z28 |
e, n, x |
|
II |
39 |
l, z28 |
z39 |
|
Anfo |
39 |
y |
1, 2 |
|
Windermere |
39 |
y |
1, 5 |
|
Delan |
39 |
y |
e, n, z15 |
|
Hegau |
39 |
z10 |
- |
|
II |
39 |
- |
1, 7 |
|
Группа O:40 (R) |
|||
|
Shikmonah |
40 |
a |
1, 5 |
|
Greiz |
40 |
a |
z6 |
|
II |
40 |
a |
z39 |
|
Riogrande |
40 |
b |
1, 5 |
|
Saugus |
40 |
b |
1, 7 |
|
Johannesburg |
1, 40 |
b |
e, n, x |
|
Duval |
140 |
b |
e, n, z15 |
|
Benguella |
40 |
b |
z6 |
|
II |
40 |
b |
- |
|
II |
1, 40 |
c |
e, n, x, z15 |
|
II |
1, 40 |
c |
z39 |
|
Driffield |
1, 40 |
d |
1, 5 |
|
II |
40 |
d |
- |
|
Tilene |
1, 40 |
e, h |
1, 2 |
|
II |
1, 40 |
e, n, x |
1, [5], 7 |
|
II |
1, 40 |
e, n, x, z15 |
1, 6 |
|
Bijlmer |
1, 40 |
g, m |
- |
|
II |
1, 40 |
g, [m], [s], [t] |
e, n, x |
|
II |
1, 40 |
g, [m], [s], t |
[1, 5] |
|
II |
1, 40 |
g, t |
e, n, x, z15 |
|
II |
40 |
g, t |
z39 |
|
IV |
1, 40 |
g, t |
- |
|
II |
1, 40 |
g, [m], [s], t |
z42 |
|
IIIa |
40 |
g, z51 |
- |
|
IIIb |
40 |
g, z51 |
e, n, x, z15 |
|
IV |
1, 40 |
g, z51 |
- |
|
II |
40 |
m, t |
z39 |
|
II |
1, 40 |
m, t |
z42 |
|
IV |
40 |
m, t |
- |
|
IIIb |
40 |
i |
1, 5, 7 |
|
Goulfey |
1, 40 |
k |
1, 5 |
|
Allandale |
1, 40 |
k |
1, 6 |
|
Hann |
40 |
k |
e, n, x |
|
II |
1, 40 |
k |
e, n, x, z15 |
|
IIIb |
40 |
k |
z:z57 |
|
II |
40 |
k |
z6 |
|
IIIb |
40 |
k |
z53 |
|
Millesi |
1, 40 |
l, v |
1, 2 |
|
Canary |
40 |
l, v |
1, 6 |
|
II |
40 |
l, v |
e, n, x |
|
IIIb |
40 |
l, v |
z |
|
IIIb |
40 |
l, v |
z53 |
|
Overchurch |
1, 40 |
l, w |
[1, 2] |
|
Tiko |
1, 40 |
l, z13, z28 |
1, 2 |
|
Bukavu |
1, 40 |
l, z28 |
1, 5 |
|
II |
1, 40 |
l, z28 |
1, 5, z42 |
|
Santhiaba |
40 |
l, z28 |
1, 6 |
|
II |
1, 40 |
l, z28 |
z39 |
|
IIIb |
40 |
r |
z53 |
|
Odienne |
40 |
y |
1, 5 |
|
II |
1, 40 |
z |
1, 5 |
|
Casamance |
40 |
z |
e, n, x |
|
Nowawes |
40 |
z |
z6 |
|
II |
1, 40 |
z |
z6 |
|
II |
1, 40 |
z |
z39 |
|
II |
40 |
z |
z42 |
|
IIIa |
40 |
z4, z23 |
- |
|
IV |
1, 40 |
z4, z23 |
- |
|
II |
40 |
z4, z24 |
z39 |
|
IIIa |
40 |
z4, z24 |
- |
|
IV |
40 |
z4, z24 |
- |
|
IIIa |
40 |
z4, z32 |
- |
|
IV |
40 |
z4, z32 |
- |
|
II |
1, 40 |
z6 |
1, 5 |
|
Trotha |
40 |
z10 |
z6 |
|
IIIb |
40 |
z10 |
z35 |
|
Omifisan |
1, 40 |
z29 |
- |
|
IIIa |
40 |
z29 |
- |
|
II |
1, 40 |
z35 |
e, n, x, z15 |
|
Yekepa |
1, 40 |
z35 |
e, n, z15 |
|
V |
1, 40 |
z35 |
- |
|
IIIa |
40 |
z36 |
- |
|
II |
1, 40 |
z39 |
1, 5:z42 |
|
II |
1, 40 |
z39 |
1, 6 |
|
IIIb |
40 |
z39 |
1, 6 |
|
II |
40 |
z39 |
1, 7 |
|
Karamoja |
1, 40 |
z41 |
1, 2 |
|
II |
1, 40 |
z42 |
1, 6 |
|
II |
1, 40 |
[z42] |
1, (5), 7 |
|
II |
1, 40 |
z81 |
z6 |
|
V |
1, 40 |
z81 |
- |
|
Группа O:41 (S) |
|||
|
Burundi |
41 |
a |
- |
|
II |
41 |
b |
1, 5 |
|
Vaugirard |
41 |
b |
1, 6 |
|
VI |
41 |
b |
1, 7 |
|
Vietnam |
41 |
b |
z6 |
|
Sica |
41 |
b |
e, n, z15 |
|
IIIb |
41 |
c |
e, n, x, z15 |
|
II |
41 |
c |
z6 |
|
Egusi |
41 |
d |
1, 5 |
|
II |
41 |
d |
z6 |
|
II |
41 |
g, m, s, t |
z6 |
|
II |
41 |
g, t |
- |
|
IIIa |
41 |
g, z51 |
- |
|
Leatherhead |
41 |
m, t |
1, 6 |
|
Samaru |
41 |
i |
1, 5 |
|
Verona |
41 |
i |
1, 6 |
|
Ferlo |
41 |
k |
1, 6 |
|
II |
41 |
k |
1, 6 |
|
II |
41 |
k |
z6 |
|
IIIb |
41 |
(k) |
z35 |
|
II |
41 |
l, z13, z28 |
e, n, x, z15 |
|
Lubumbashi |
41 |
r |
1, 5 |
|
Konongo |
41 |
r |
1, 7 |
|
II |
41 |
z |
1 5 |
|
Bofflens |
41 |
z4, z23 |
1, 7 |
|
Waycross |
41 |
z4, z23 |
[e, n, z15] |
|
IIIa |
41 |
z4, z23 |
- |
|
IV |
41 |
z4, z23 |
- |
|
IIIa |
41 |
z4, z23, z32 |
- |
|
Ipswich |
41 |
z4, z24 |
1, 5 |
|
IIIa |
41 |
z4, z24 |
- |
|
IIIa |
41 |
z4, z32 |
- |
|
II |
41 |
z10 |
1, 2 |
|
Leipzig |
41 |
z10 |
1, 5 |
|
Landala |
41 |
z10 |
1, 6 |
|
Inpraw |
41 |
z10 |
e, n, x |
|
II |
41 |
z10 |
e, n, x, z15 |
|
II |
41 |
z10 |
z6 |
|
Lodz |
41 |
z29 |
- |
|
IIIa |
41 |
z29 |
- |
|
IV |
41 |
z29 |
- |
|
Ahoutoue |
41 |
z35 |
1, 6 |
|
IIIa |
41 |
z36 |
- |
|
IV |
41 |
z36 |
- |
|
Offa |
41 |
z38 |
- |
|
IV |
41 |
z52 |
- |
|
II |
41 |
- |
1, 6 |
|
Группа O:42 (T) |
|||
|
Faji |
1, 42 |
a |
e, n, z15 |
|
II |
42 |
b |
1, 5 |
|
Orbe |
42 |
b |
1, 6 |
|
II |
42 |
b |
e, n, x, z15 |
|
Tomegbe |
1, 42 |
b |
e, n, z15 |
|
Frederiksberg |
1, 42 |
b |
l, w |
|
Egusitoo |
1, 42 |
b |
z6 |
|
II |
42 |
b |
z6 |
|
Antwerpen |
1, 42 |
c |
e, n, z15 |
|
Kampala |
1, 42 |
c |
z6 |
|
II |
42 |
d |
z6 |
|
II |
42 |
e, n, x |
1, 6 |
|
II |
42 |
g, t |
- |
|
Maricopa |
1, 42 |
g, z51 |
1, 5 |
|
IIIa |
42 |
g, z51 |
- |
|
IV |
1, 42 |
g, z51 |
- |
|
II |
42 |
m, t |
[e, n, x, z15] |
|
Waral |
1, 42 |
m, t |
- |
|
Kaneshie |
1, 42 |
i |
l, w |
|
Borromea |
42 |
i |
1, 6 |
|
Middlesbrough |
1, 42 |
i |
z6 |
|
Haferbreite |
42 |
k |
1, 6 |
|
IIIb |
42 |
k |
e, n, x, z15 |
|
IIIb |
42 |
k |
z |
|
Gwale |
1, 42 |
k |
z6 |
|
IIIb |
42 |
(k) |
z35 |
|
IIIb |
42 |
l, v |
1, 5, 7 |
|
II |
42 |
l, v |
e, n, x, z15 |
|
IIIb |
42 |
l, v |
e, n, x, z15 |
|
Coogee |
42 |
l, v |
e, n, z15 |
|
IIIb |
42 |
l, v |
z |
|
IIIb |
42 |
l, v |
z53 |
|
II |
1, 42 |
l, w |
e, n, x |
|
II |
1, 42 |
1, [z13], z28 |
[z6] |
|
Sipane |
1, 42 |
r |
e, n, z15 |
|
Brive |
1, 42 |
r |
l, w |
|
IIIb |
42 |
r |
z |
|
IIIb |
42 |
r |
z53 |
|
II |
42 |
r |
- |
|
IIIa |
42 |
r |
- |
|
Spalentor |
1, 42 |
y |
e, n, z15 |
|
Harvestehude |
1, 42 |
y |
z6 |
|
II |
42 |
z |
1, 5 |
|
Ursenbach |
1, 42 |
z |
1, 6 |
|
II |
42 |
z |
e, n, x, z15 |
|
Melbourne |
42 |
z |
e, n, z15 |
|
II |
42 |
z |
z6 |
|
Gera |
1, 42 |
z4, z23 |
1, 6 |
|
Broc |
42 |
z4, z23 |
e, n, z15 |
|
IIIa |
42 |
z4, z23 |
- |
|
Toricada |
1, 42 |
z4, z24 |
- |
|
IIIa |
42 |
z4, z24 |
- |
|
IV |
1, 42 |
z4, z24 |
- |
|
II |
42 |
z6 |
1, 6 |
|
II |
42 |
z10 |
1, 2 |
|
II |
42 |
z10 |
e, n, x, z15 |
|
IIIb |
42 |
z10 |
e, n, x, z15 |
|
IIIb |
42 |
z10 |
z |
|
Loenga |
1, 42 |
z10 |
z6 |
|
II |
42 |
z10 |
z6 |
|
IIIb |
42 |
z10 |
z35 |
|
IIIb |
42 |
z10 |
z67 |
|
Djama |
1, 42 |
z29 |
[1, 5] |
|
II |
42 |
z29 |
- |
|
Kahla |
1, 42 |
z35 |
1, 6 |
|
Hennekamp |
42 |
z35 |
e, n, z15 |
|
Tema |
1, 42 |
z35 |
z6 |
|
Weslaco |
42 |
z36 |
- |
|
IV |
42 |
z36 |
- |
|
Vogan |
1, 42 |
z38 |
z6 |
|
Taset |
1, 42 |
z41 |
- |
|
IIIb |
42 |
z52 |
z |
|
Группа O:43 (U) |
|||
|
Graz |
43 |
a |
1, 2 |
|
Berkeley |
43 |
a |
1, 5 |
|
II |
43 |
a |
1, 5 |
|
II |
43 |
a |
z6 |
|
Niederoderwitz |
43 |
b |
- |
|
II |
43 |
b |
z42 |
|
Montreal |
43 |
c |
1, 5 |
|
Orleans |
43 |
d |
1, 5 |
|
II |
43 |
d |
e, n, x, z15 |
|
II |
43 |
d |
z39 |
|
II |
43 |
d |
z42 |
|
II |
43 |
e, n, x, z15 |
1, (5), 7 |
|
II |
43 |
e, n, x, z15 |
1, 6 |
|
Milwaukee |
43 |
f, g, [t] |
- |
|
II |
43 |
g, m, [s], t |
[z42] |
|
II |
43 |
g, t |
[1, 5] |
|
IIIa |
43 |
g, z51 |
- |
|
IV |
43 |
g, z51 |
- |
|
II |
43 |
g, z62 |
e, n, x |
|
Mbao |
43 |
i |
1, 2 |
|
Voulte |
43 |
i |
e, n, x |
|
Thetford |
43 |
k |
1, 2 |
|
Ahuza |
43 |
k |
1, 5 |
|
IIIb |
43 |
k |
z |
|
IIIb |
43 |
l, v |
z53 |
|
Sudan |
43 |
l, z13 |
- |
|
II |
43 |
l, z13, z28 |
1, 5 |
|
IIIb |
43 |
r |
e, n, x, z15 |
|
IIIb |
43 |
r |
z |
|
IIIb |
43 |
r |
z53 |
|
Farcha |
43 |
y |
1, 2 |
|
Kingabwa |
43 |
y |
1, 5 |
|
Ogbete |
43 |
z |
1, 5 |
|
II |
43 |
z |
1, 5 |
|
Arusha |
43 |
z |
e, n, z15 |
|
II |
43 |
z4, z23 |
- |
|
IIIa |
43 |
z4, z23 |
- |
|
IV |
43 |
z4, z23 |
- |
|
IIIa |
43 |
z4, z24 |
- |
|
IV |
43 |
z4, z24 |
- |
|
IV |
43 |
z4, z32 |
- |
|
Adana |
43 |
z10 |
1, 5 |
|
II |
43 |
z29 |
e, n, x |
|
II |
43 |
z29 |
z42 |
|
Makiling |
43 |
z29 |
- |
|
IV |
43 |
z29 |
- |
|
Ahepe |
43 |
z35 |
1, 6 |
|
IIIa |
43 |
z36 |
- |
|
IV |
43 |
z36, z38 |
- |
|
Irigny |
43 |
z38 |
- |
|
II |
43 |
z42 |
[1, 5, 7] |
|
IIIb |
43 |
z52 |
z53 |
|
Группа O:44 (V) |
|||
|
IV |
44 |
a |
- |
|
Niakhar |
44 |
a |
1, 5 |
|
Tiergarten |
44 |
a |
e, n, x |
|
Niarembe |
44 |
a |
l, w |
|
Shahalam |
44 |
b |
1, 6 |
|
Sedgwick |
44 |
b |
e, n, z15 |
|
Madigan |
44 |
c |
1, 5 |
|
Quebec |
44 |
c |
e, n, z15 |
|
Bobo |
44 |
d |
1, 5 |
|
Kermel |
44 |
d |
e, n, x |
|
Fischerstrasse |
44 |
d |
e, n, z15 |
|
Palamaner |
1, 44 |
d |
z35 |
|
II |
1, 44 |
e, n, x |
1, 6 |
|
Vleuten |
44 |
f, g |
- |
|
Gamaba |
1, 44 |
g, m, [s] |
- |
|
Splott |
44 |
g, s, t |
- |
|
II |
44 |
g, t |
z42 |
|
IIIb |
1, 44 |
g, t |
l, 5:z42 |
|
Carswell |
44 |
g, z51 |
- |
|
IV |
44 |
g, z51 |
- |
|
Muguga |
44 |
m, t |
- |
|
II |
1, 44 |
m, t |
z42 |
|
Maritzburg |
1, 44 |
i |
e, n, z15 |
|
Lawra |
44 |
k |
e, n, z15 |
|
Malika |
44 |
l, z28 |
1, 5 |
|
Brefet |
44 |
r |
e, n, z15 |
|
V |
44 |
r |
- |
|
Brackenridge |
44 |
z |
1, 5 |
|
Uhlenhorst |
44 |
z |
l, w |
|
Bolama |
44 |
z |
e, n, x |
|
Kua |
44 |
z4, z23 |
- |
|
Ploufragan |
1, 44 |
z4, z23 |
e, n, z15 |
|
II |
44 |
z4, z23 |
- |
|
IIIa |
44 |
z4, z23 |
- |
|
IV |
44 |
z4, z23 |
- |
|
IIIa |
44 |
z4, z23, z32 |
- |
|
Christiansborg |
44 |
z4, z24 |
- |
|
IIIa |
44 |
z4, z24 |
- |
|
IV |
44 |
z4, z24 |
- |
|
IIIa |
44 |
z4, z32 |
- |
|
IV |
44 |
z4, z32 |
- |
|
Guinea |
1, 44 |
z10 |
1, 7 |
|
Llobregat |
1, 44 |
z10 |
e, n, x |
|
II |
44 |
z29 |
z42 |
|
Zinder |
44 |
z29 |
- |
|
IV |
44 |
z29 |
- |
|
IV |
44 |
z36, [z38] |
- |
|
Koketime |
44 |
z38 |
- |
|
II |
1, 44 |
z39 |
e, n, x, z15 |
|
V |
44 |
z39 |
- |
|
Группа O:45 (W) |
|||
|
VI |
45 |
a |
e, n, x |
|
Meekatharra |
45 |
a |
e, n, z15 |
|
II |
45 |
a |
z10 |
|
Riverside |
45 |
b |
1, 5 |
|
Fomeco |
45 |
b |
e, n, z15 |
|
Deversoir |
45 |
c |
e, n, x |
|
Dugbe |
45 |
d |
1, 6 |
|
Karachi |
45 |
d |
e, n, x |
|
Warmsen |
45 |
d |
e, n, z15 |
|
Suelldorf |
45 |
f, g |
- |
|
Tornow |
45 |
g, m, [s], [t] |
- |
|
II |
45 |
g, m, s, t |
1, 5 |
|
II |
45 |
g, m, s, t |
e, n, x |
|
II |
45 |
g, m, t |
e, n, x, z15 |
|
Binningen |
45 |
g, s, t |
- |
|
IIIa |
45 |
g, z51 |
- |
|
IV |
45 |
g, z51 |
- |
|
II |
45 |
m, t |
1, 5 |
|
Apapa |
45 |
m, t |
- |
|
Verviers |
45 |
k |
1, 5 |
|
Casablanca |
45 |
k |
1, 7 |
|
Cairns |
45 |
k |
e, n, z15 |
|
Imo |
45 |
l, v |
[e, n, z15] |
|
Kofandoka |
45 |
r |
e, n, z15 |
|
II |
45 |
z |
1, 5 |
|
Yopougon |
45 |
z |
e, n, z15 |
|
II |
45 |
z |
z39 |
|
IIIa |
45 |
z4, z23 |
- |
|
IV |
45 |
z4, z23 |
- |
|
Transvaal |
45 |
z4, z24 |
- |
|
IIIa |
45 |
z4, z24 |
- |
|
IIIa |
45 |
z4, z32 |
- |
|
Aprad |
45 |
z10 |
- |
|
Jodhpur |
45 |
z29 |
- |
|
II |
45 |
z29 |
1, 5 |
|
II |
45 |
z29 |
e, n, x |
|
II |
45 |
z29 |
z42 |
|
IIIa |
45 |
z29 |
- |
|
Lattenkamp |
45 |
z35 |
1, 5 |
|
Balcones |
45 |
z36 |
- |
|
IV |
45 |
z36, z38 |
- |
|
Группа O:47 (X) |
|||
|
II |
47 |
a |
1, 5 |
|
II |
47 |
a |
e, n, x, z15 |
|
Wenatchee |
47 |
b |
1, 2 |
|
II |
47 |
b |
1, 5 |
|
II |
47 |
b |
e, n, x, z15 |
|
Sya |
47 |
b |
z6 |
|
II |
47 |
b |
z6 |
|
IIIb |
47 |
c |
1, 5, 7 |
|
Kodjovi |
47 |
c |
1, 6 |
|
IIIb |
47 |
c |
e, n, x, z15:[z57] |
|
IIIb |
47 |
c |
z |
|
IIIb |
47 |
c |
z35 |
|
II |
47 |
d |
1, 5 |
|
Stellingen |
47 |
d |
e, n, x |
|
II |
47 |
d |
e, n, x, z15 |
|
II |
47 |
d |
z39 |
|
II |
47 |
e, n, x, z15 |
1, 6 |
|
Sljeme |
1, 47 |
f, g |
- |
|
Luke |
1, 47 |
g, m |
- |
|
II |
47 |
[g, t] |
e, n, x |
|
IIIa |
47 |
g, z51 |
- |
|
Mesbit |
47 |
m, t |
e, n, z15 |
|
IIIb |
47 |
i |
e, n, x, z15 |
|
Bergen |
47 |
i |
e, n, z15 |
|
IIIb |
47 |
i |
z |
|
IIIb |
47 |
i |
z35 |
|
IIIb |
47 |
i |
z53:[z57] |
|
Staoueli |
47 |
k |
1, 2 |
|
Bootle |
47 |
k |
1, 5 |
|
IIIb |
47 |
k |
1, 5, 7 |
|
Dahomey |
47 |
k |
1, 6 |
|
IIIb |
47 |
k |
e, n, x, z15 |
|
Lyon |
47 |
k |
e, n, z15 |
|
IIIb |
47 |
k |
z |
|
IIIb |
47 |
k |
z35 |
|
IIIb |
47 |
k |
z53 |
|
IIIb |
47 |
l, v |
1, [5], 7 |
|
Drac |
47 |
l, v |
e, n, x |
|
IIIb |
47 |
l, v |
e, n, x, z15 |
|
IIIb |
47 |
l, v |
z |
|
IIIb |
47 |
l, v |
z35 |
|
IIIb |
47 |
l, v |
z53 |
|
IIIb |
47 |
l, v |
z57 |
|
IV |
47 |
l, v |
- |
|
Teshie |
1, 47 |
l, z13, z28 |
e, n, z15 |
|
IIIb |
47 |
r |
e, n, x, z15 |
|
Dapango |
47 |
r |
1, 2 |
|
IIIb |
47 |
r |
1, 5, 7 |
|
IIIb |
47 |
r |
z |
|
IIIb |
47 |
r, [i] |
z35 |
|
IIIb |
47 |
r |
z53:[z60] |
|
Moualine |
47 |
y |
1, 6 |
|
Blitta |
47 |
y |
e, n, x |
|
Mountpleasant |
47 |
z |
1, 5 |
|
Kaolack |
47 |
z |
1, 6 |
|
II |
47 |
z |
e, n, x, z15 |
|
II |
47 |
z |
z6 |
|
Tabligbo |
47 |
z4, z23 |
e, n, z15 |
|
Fehrbellin |
47 |
z4, z23 |
1, 6 |
|
Bere |
47 |
z4, z23 |
z6 |
|
Binche |
47 |
z4, z23 |
l, w |
|
IIIa |
47 |
z4, z23 |
- |
|
Tamberma |
47 |
z4, z24 |
- |
|
II |
47 |
z6 |
1, 6 |
|
IIIb |
47 |
z10 |
1, 5, 7 |
|
Namoda |
47 |
z10 |
e, n, z15 |
|
IIIb |
47 |
z10 |
z |
|
IIIb |
47 |
z10 |
z35 |
|
II |
47 |
z29 |
e, n, x, z15 |
|
Ekpoui |
47 |
z29 |
- |
|
IIIa |
47 |
z29 |
- |
|
Bingerville |
47 |
z35 |
e, n, z15 |
|
IV |
47 |
z36 |
- |
|
Alexanderplatz |
47 |
z38 |
- |
|
Quinhon |
47 |
z44 |
- |
|
IIIb |
47 |
z52 |
1, 5, 7 |
|
IIIb |
47 |
z52 |
e, n, x, z15 |
|
IIIb |
47 |
z52 |
z |
|
IIIb |
47 |
z52 |
z35 |
|
Группа O:48 (Y) |
|||
|
Hisingen |
48 |
a |
1, 5, 7 |
|
II |
48 |
a |
z6 |
|
II |
48 |
a |
z39 |
|
II |
48 |
b |
z6 |
|
II |
48 |
b |
e, n, x, z15 |
|
V |
48 |
b |
- |
|
IIIb |
48 |
c |
z |
|
II |
48 |
d |
1, 2 |
|
II |
48 |
d |
z6 |
|
Buckeye |
48 |
d |
- |
|
Fitzroy |
48 |
e, h |
1, 5 |
|
II |
48 |
e, n, x, z15 |
z6 |
|
II |
48 |
g, m, t |
- |
|
IIIa |
48 |
g, z51 |
- |
|
IV |
48 |
g, z51 |
- |
|
IIIb |
48 |
i |
z |
|
IIIb |
48 |
i |
z35:[z57] |
|
IIIb |
48 |
i |
z53 |
|
IIIb |
48 |
i |
z61 |
|
V |
48 |
i |
- |
|
IIIb |
48 |
k |
1, 5, (7) |
|
II |
48 |
k |
e, n, x, z15 |
|
IIIb |
48 |
k |
e, n, x, z15 |
|
Dahlem |
48 |
k |
e, n, z15 |
|
IIIb |
48 |
k |
z |
|
IIIb |
48 |
k |
z35 |
|
II |
48 |
k |
z39 |
|
IIIb |
48 |
k |
z53 |
|
Australia |
48 |
l, v |
1, 5 |
|
IIIb |
48 |
l, v |
1, 5, (7) |
|
IIIb |
48 |
l, v |
z |
|
IIIb |
48 |
r |
e, n, x, z15 |
|
IIIb |
48 |
r |
z |
|
Toucra |
48 |
z |
1, 5 |
|
II |
48 |
z |
1, 5 |
|
IIIb |
48 |
z |
1, 5, 7 |
|
IIIa |
48 |
z4, z23 |
- |
|
IV |
48 |
z4, z23 |
- |
|
IIIa |
48 |
z4, z23, z32 |
- |
|
Djakarta |
48 |
z4, z24 |
- |
|
IIIa |
48 |
z4, z24 |
- |
|
IIIa |
48 |
z4, z32 |
- |
|
IV |
48 |
z4, z32 |
- |
|
II |
48 |
z10 |
[1, 5] |
|
VI |
48 |
z10 |
1, 5 |
|
II |
48 |
z10 |
1, 6 |
|
Isaszeg |
48 |
z10 |
e, n, x |
|
IIIb |
48 |
z10 |
e, n, x, z15 |
|
IIIb |
48 |
z10 |
z |
|
II |
48 |
z29 |
- |
|
IV |
48 |
z29 |
- |
|
IIIb |
48 |
z35 |
z52 |
|
V |
48 |
z35 |
- |
|
IIIa |
48 |
z36 |
- |
|
IV |
48 |
z36, [z38] |
- |
|
V |
48 |
z39 |
- |
|
V |
48 |
z41 |
- |
|
IIIb |
48 |
z52 |
e, n, x, z15 |
|
IIIb |
48 |
z52 |
z |
|
V |
48 |
z65 |
- |
|
V |
48 |
z81 |
- |
|
Группа O:50 (Z) |
|||
|
IV |
50 |
a |
- |
|
Rochdale |
50 |
b |
e, n, x |
|
II |
50 |
b |
z6 |
|
IV |
50 |
b |
- |
|
Hemingford |
50 |
d |
1, 5 |
|
IV |
50 |
d |
- |
|
II |
50 |
e, n, x |
1, 7 |
|
II |
50 |
g, [m], s, t |
[l, 5] |
|
IV |
50 |
g, z51 |
- |
|
II |
50 |
g, z62 |
e, n, x |
|
II |
50 |
m, t |
z6: z42 |
|
IIIb |
50 |
i |
1, 5, 7 |
|
IIIb |
50 |
i |
e, n, x, z15 |
|
IIIb |
50 |
i |
z |
|
IIIb |
50 |
k |
1, 5, 7 |
|
II |
50 |
k |
e, n, x: z42 |
|
IIIb |
50 |
k |
e, n, x, z15 |
|
IIIb |
50 |
k |
z:[z57]:[z68] |
|
II |
50 |
k |
z6 |
|
IIIb |
50 |
k |
z35 |
|
IIIb |
50 |
k |
z53 |
|
Fass |
50 |
l, v |
1, 2 |
|
IIIb |
50 |
l, v |
e, n, x, z15 |
|
IIIb |
50 |
l, v |
z |
|
IIIb |
50 |
l, v |
z35 |
|
IIIb |
50 |
l, v |
z57 |
|
VI |
50 |
l, v |
z67 |
|
II |
50 |
l, w |
e, n, x, z15:z42 |
|
II |
50 |
l, z28 |
z42 |
|
IIIb |
50 |
r |
1, 5, (7) |
|
IIIb |
50 |
r |
e, n, x, z15 |
|
IIIb |
50 |
r |
z:[z67] |
|
IIIb |
50 |
r |
z35 |
|
IIIb |
50 |
r |
z53 |
|
Dougi |
50 |
y |
1, 6 |
|
II |
50 |
z |
e, n, x |
|
IIIb |
50 |
z |
z52 |
|
IIIa |
50 |
z4, z23 |
- |
|
IV |
50 |
z4, z23 |
- |
|
IIIa |
50 |
z4, z23, z32 |
- |
|
IIIa |
50 |
z4, z24 |
- |
|
IV |
50 |
z4, z24 |
- |
|
IIIa |
50 |
z4, z32 |
- |
|
IV |
50 |
z4, z32 |
- |
|
IIIb |
50 |
z10 |
z |
|
II |
50 |
z10 |
z6:z42 |
|
IIIb |
50 |
z10 |
z53 |
|
Ivorycoast |
50 |
z29 |
- |
|
IIIa |
50 |
z29 |
- |
|
IIIa |
50 |
z36 |
- |
|
II |
50 |
z42 |
1, 7 |
|
IIIb |
50 |
z52 |
1, 5, 7 |
|
IIIb |
50 |
z52 |
z35 |
|
IIIb |
50 |
z52 |
z53 |
|
Группа O:51 |
|||
|
IV |
51 |
a |
- |
|
Windsheim |
51 |
a |
1, 2 |
|
Tione |
51 |
a |
e, n, x |
|
Karaya |
51 |
b |
1, 5 |
|
IV |
51 |
b |
- |
|
II |
51 |
c |
- |
|
Gokul |
1, 51 |
d |
1, 5 |
|
Meskin |
51 |
e, h |
1, 2 |
|
II |
51 |
g, s, t |
e, n, x |
|
IIIa |
51 |
g, z51 |
- |
|
Djinten |
51 |
m, t |
- |
|
Kabete |
51 |
i |
1, 5 |
|
Dan |
51 |
k |
e, n, z15 |
|
IIIb |
51 |
k |
z35 |
|
Harcourt |
51 |
l, v |
1, 2 |
|
Overschie |
51 |
l, v |
1, 5 |
|
Dadzie |
51 |
l, v |
e, n, x |
|
IIIb |
51 |
l, v |
z |
|
Moundou |
51 |
l, z28 |
1, 5 |
|
II |
51 |
l, z28 |
z6 |
|
II |
51 |
l, z28 |
z39 |
|
Lutetia |
51 |
r, i |
l, z13, z28 |
|
Antsalova |
51 |
z |
1, 5 |
|
Treforest |
1, 51 |
z |
1, 6 |
|
Lechler |
51 |
z |
e, n, z15 |
|
IIIa |
51 |
z4, z23 |
- |
|
IV |
51 |
z4, z23 |
- |
|
IIIa |
51 |
z4, z24 |
- |
|
IIIa |
51 |
z4, z32 |
- |
|
Bergues |
51 |
z10 |
1, 5 |
|
II |
51 |
z29 |
e, n, x, z15 |
|
II |
51 |
- |
1, 7 |
|
Группа O:52 |
|||
|
Uithof |
52 |
a |
1, 5 |
|
Ord |
52 |
a |
e, n, z15 |
|
Molesey |
52 |
b |
1, 5 |
|
Flottbek |
52 |
b |
e, n, x |
|
II |
52 |
c |
k |
|
Utrecht |
52 |
d |
1, 5 |
|
II |
52 |
d |
e, n, x, z15 |
|
II |
52 |
d |
z39 |
|
Butare |
52 |
e, h |
1, 6 |
|
Derkle |
52 |
e, h |
1, 7 |
|
Saintemarie |
52 |
g, t |
- |
|
II |
52 |
g, t |
- |
|
Bordeaux |
52 |
k |
1, 5 |
|
IIIb |
52 |
k |
z35 |
|
IIIb |
52 |
k |
z53 |
|
IIIb |
52 |
l, v |
z53 |
|
II |
52 |
z |
z39 |
|
IIIb |
52 |
z |
z52 |
|
II |
52 |
z39 |
1, 5, 7 |
|
II |
52 |
z44 |
1, 5, 7 |
|
Группа O:53 |
|||
|
II |
53 |
c |
1, 5 |
|
II |
53 |
d |
1, 5 |
|
II |
1, 53 |
d |
z39 |
|
II |
53 |
d |
z42 |
|
IIIa |
53 |
g, z51 |
- |
|
IV |
1, 53 |
g, z51 |
- |
|
IIIb |
53 |
i |
z |
|
IIIb |
53 |
k |
e, n, x, z15 |
|
IIIb |
53 |
k |
z |
|
IIIb |
53 |
(k) |
z35 |
|
IIIb |
53 |
k |
z53 |
|
IIIb |
53 |
l, v |
e, n, x, z15 |
|
IIIb |
53 |
l, v |
z |
|
IIIb |
53 |
l, v |
z35 |
|
II |
53 |
1, z28 |
e, n, x |
|
II |
53 |
1, z28 |
z6 |
|
II |
53 |
1, z28 |
z39 |
|
IIIb |
53 |
r |
z |
|
IIIb |
53 |
r |
z35 |
|
IIIb |
53 |
r |
z68 |
|
II |
53 |
z |
1, 5 |
|
IIIb |
53 |
z |
1, 5, (7) |
|
II |
53 |
z |
z6 |
|
IIIa |
53 |
z4, z23 |
- |
|
IV |
53 |
z4, z23 |
- |
|
IIIa |
53 |
z4, z23, z32 |
- |
|
II |
53 |
z4, z24 |
- |
|
IIIa |
53 |
z4, z24 |
- |
|
IIIb |
53 |
z10 |
z |
|
IIIb |
53 |
z10 |
z35 |
|
IIIa |
53 |
z29 |
- |
|
IV |
1, 53 |
z36, z38 |
- |
|
IIIb |
53 |
z52 |
z35 |
|
IIIb |
53 |
z52 |
z53 |
|
Leda |
53 |
- |
1, 6 |
|
Группа O:54 |
|||
|
Tonev |
21, 54 |
b |
e, n, x |
|
Winnipeg |
54 |
e, h |
1, 5 |
|
Rossleben |
3, 54 |
e, h |
1, 6 |
|
Borreze |
54 |
f, g, s |
- |
|
Uccle |
3, 54 |
g, s, t |
- |
|
Newholland |
4, 12, 54 |
m, t |
- |
|
Poeseldorf |
8, 20, 54 |
i |
z6 |
|
Ochsenwerder |
6, 7, 54 |
k |
1, 5 |
|
Czernyring |
54 |
r |
1, 5 |
|
Steinwerder |
3, 15, 54 |
y |
1, 5 |
|
Yerba |
54 |
z4, z23 |
- |
|
Canton |
54 |
z10 |
e, n, x |
|
Barry |
54 |
z10 |
e, n, z15 |
|
Mundubbera |
54 |
z29 |
- |
|
Группа O:55 |
|||
|
II |
55 |
k |
z39 |
|
Группа O:56 |
|||
|
II |
56 |
b |
[1, 5] |
|
II |
56 |
d |
- |
|
II |
56 |
e, n, x |
1, 7 |
|
II |
56 |
l, v |
z39 |
|
II |
56 |
l, z28 |
- |
|
II |
56 |
z |
z6 |
|
IIIa |
56 |
z4, z23 |
- |
|
IIIa |
56 |
z4, z23, z32 |
- |
|
II |
56 |
z10 |
e, n, x |
|
IIIa |
56 |
z29 |
- |
|
Группа O:57 |
|||
|
Antonio |
57 |
a |
z6 |
|
II |
57 |
a |
z42 |
|
Maryland |
57 |
b |
1, 7 |
|
Batonrouge |
57 |
b |
e, n, z15 |
|
IIIb |
57 |
c |
e, n, x, z15 |
|
IIIb |
57 |
c |
z:[z60] |
|
II |
57 |
d |
1, 5 |
|
II |
57 |
g, [m], s, t |
z42 |
|
II |
57 |
g, t |
- |
|
IIIb |
57 |
i |
e, n, x, z15 |
|
IIIb |
57 |
i |
z |
|
IIIb |
57 |
k |
e, n, x, z15 |
|
IV |
57 |
z4, z23 |
- |
|
IIIb |
57 |
z10 |
z |
|
II |
57 |
z29 |
z42 |
|
II |
57 |
z39 |
e, n, x, z15 |
|
II |
57 |
z42 |
1, 6:z53 |
|
Группа O:58 |
|||
|
II |
58 |
a |
z6 |
|
II |
58 |
b |
1, 5 |
|
II |
58 |
c |
z6 |
|
II |
58 |
d |
z6 |
|
IIIb |
58 |
i |
z15 |
|
IIIb |
58 |
k |
z |
|
IIIb |
58 |
l, v |
z15 |
|
IIIb |
58 |
l, v |
z35 |
|
II |
58 |
l, z13, z28 |
1, 5 |
|
II |
58 |
l, z13, z28 |
z6 |
|
IIIb |
58 |
r |
e, n, x, z15 |
|
IIIb |
58 |
r |
z |
|
IIIb |
58 |
r |
z53:[z57] |
|
II |
58 |
z6 |
1, 6 |
|
II |
58 |
z10 |
1, 6 |
|
IIIb |
58 |
z10 |
e, n, x z15 |
|
II |
58 |
z10 |
z6 |
|
IIIb |
58 |
z10 |
z53 |
|
II |
58 |
z39 |
e, n, x, z15 |
|
IIIb |
58 |
z52 |
z |
|
IIIb |
58 |
z52 |
z35 |
|
Группа O:59 |
|||
|
IIIb |
59 |
c |
e, n, x, z15 |
|
IIIb |
59 |
i |
e, n, x, z15 |
|
IIIb |
59 |
i |
z |
|
IIIb |
59 |
i |
z35 |
|
IIIb |
59 |
(k) |
e, n, x, z15 |
|
II |
59 |
k |
z65 |
|
IIIb |
59 |
(k) |
z |
|
IIIb |
59 |
(k) |
z35 |
|
IIIb |
59 |
k |
z53 |
|
IIIb |
59 |
l, v |
z |
|
IIIb |
59 |
l, v |
z53 |
|
IIIb |
59 |
r |
z35 |
|
II |
1, 59 |
z |
z6 |
|
IIIa |
59 |
z4, z23 |
- |
|
IIIb |
59 |
z10 |
z53 |
|
IIIb |
59 |
z10 |
z57 |
|
IIIa |
59 |
z29 |
- |
|
IIIa |
59 |
z36 |
- |
|
IIIb |
59 |
z52 |
z53 |
|
Группа O:60 |
|||
|
II |
60 |
b |
- |
|
II |
60 |
g, m, t |
z6 |
|
IIIb |
60 |
i |
e, n, x, z15 |
|
IIIb |
60 |
i |
z |
|
IIIb |
60 |
i |
z35 |
|
IIIb |
60 |
k |
z |
|
IIIb |
60 |
k |
z35 |
|
IIIb |
60 |
(k) |
z53 |
|
IIIb |
60 |
l, v |
z |
|
IIIb |
60 |
r |
e, n, x, z15 |
|
IIIb |
60 |
r |
z |
|
IIIb |
60 |
r |
z35 |
|
IIIb |
60 |
r |
z53 |
|
II |
60 |
z |
e, n, x |
|
IIIb |
60 |
z10 |
z |
|
IIIb |
60 |
z10 |
z35 |
|
IIIb |
60 |
z10 |
z53 |
|
II |
60 |
z29 |
e, n, x |
|
V |
60 |
z41 |
- |
|
IIIb |
60 |
z52 |
1, 5, [7] |
|
IIIb |
60 |
z52 |
z |
|
IIIb |
60 |
z52 |
z35 |
|
IIIb |
60 |
z52 |
z53 |
|
Группа O:61 |
|||
|
IIIb |
61 |
c |
1, 5, (7) |
|
IIIb |
61 |
c |
z35 |
|
IIIb |
61 |
i |
e, n, x, z15 |
|
IIIb |
61 |
i |
z |
|
IIIb |
61 |
i |
z35 |
|
IIIb |
61 |
i |
z53 |
|
IIIb |
61 |
k |
1, 5, (7) |
|
IIIb |
61 |
k |
z35 |
|
IIIb |
61 |
(k) |
z53 |
|
IIIb |
61 |
l, v |
l, 5, 7:[z57] |
|
IIIb |
61 |
l, v |
z |
|
IIIb |
61 |
l, v |
z35 |
|
IIIb |
61 |
r |
1, 5, 7 |
|
IIIb |
61 |
r |
z |
|
IIIb |
61 |
r |
z35 |
|
IIIb |
61 |
r |
z53 |
|
IIIb |
61 |
z10 |
z35 |
|
V |
61 |
z35 |
- |
|
IIIb |
61 |
z52 |
1, 5, 7 |
|
IIIb |
61 |
z52 |
z |
|
IIIb |
61 |
z52 |
z35 |
|
IIIb |
61 |
z52 |
z53 |
|
Группа O:62 |
|||
|
IIIa |
62 |
g, z51 |
- |
|
IIIa |
62 |
z4, z23 |
- |
|
IIIa |
62 |
z4, z32 |
- |
|
IIIa |
62 |
z29 |
- |
|
IIIa |
62 |
z36 |
- |
|
Группа O:63 |
|||
|
IIIa |
63 |
g, z51 |
- |
|
IIIa |
63 |
z4, z23 |
- |
|
IIIa |
63 |
z4, z32 |
- |
|
IIIa |
63 |
z36 |
- |
|
Группа O:65 |
|||
|
IIIb |
65 |
c |
1, 5, 7 |
|
IIIb |
65 |
c |
z |
|
IIIb |
65 |
c |
z53 |
|
II |
65 |
g, t |
- |
|
IIIb |
65 |
i |
e, n, x, z15 |
|
IIIb |
65 |
(k) |
z |
|
IIIb |
65 |
(k) |
z35 |
|
IIIb |
65 |
(k) |
z53 |
|
IIIb |
65 |
l, v |
e, n, x, z15 |
|
IIIb |
65 |
l, v |
z |
|
IIIb |
65 |
l, v |
z35 |
|
IIIb |
65 |
l, v |
z53 |
|
IIIb |
65 |
r |
z35 |
|
IIIb |
65 |
z10 |
e, n, x, z15 |
|
IIIb |
65 |
z10 |
z |
|
IIIb |
65 |
z52 |
e, n, x, z15 |
|
IIIb |
65 |
z52 |
z |
|
IIIb |
65 |
z52 |
z35 |
|
IIIb |
65 |
z52 |
z53 |
|
II |
65 |
- |
1, 6 |
|
Группа O:66 |
|||
|
V |
66 |
z35 |
- |
|
V |
66 |
z39 |
- |
|
V |
66 |
z41 |
- |
|
V |
66 |
z65 |
- |
|
V |
66 |
z81 |
- |
|
Группа O:67 |
|||
|
Crossness |
67 |
r |
1, 2 |
