
 ГОСТ Р 54421-2011
ГОСТ Р 54421-2011
Руководство по аудиту систем менеджмента качества изготовителей медицинских изделий на соответствие регулирующим требованиям. Часть 1. Общие требования
| Обозначение: |  ГОСТ Р 54421-2011 ГОСТ Р 54421-2011 |
| Обозначение англ: |  GOST R 54421-2011 GOST R 54421-2011 |
| Статус: | введен впервые |
| Название рус.: | Руководство по аудиту систем менеджмента качества изготовителей медицинских изделий на соответствие регулирующим требованиям. Часть 1. Общие требования |
| Название англ.: | Guidelines for regulatory auditing of quality management systems of medical device manufacturers. Part 1. General requirements |
| Дата добавления в базу: | 01.09.2013 |
| Дата актуализации: | 01.01.2021 |
| Дата введения: | 01.01.2013 |
| Область применения: | Стандарт является руководством для организаций, проводящих аудиты и ответственных за разработку, планирование, проведение и документирование аудитов систем менеджмента качества изготовителей медицинских изделий. Стандарт охватывает также связанные с аудитом требования по проверке выполнения коррекций, корректирующих и предупреждающих действий, деятельности по улучшению, если это применимо. Кроме того, стандарт устанавливает критерии компетентности, которым должна соответствовать аудиторская группа. |
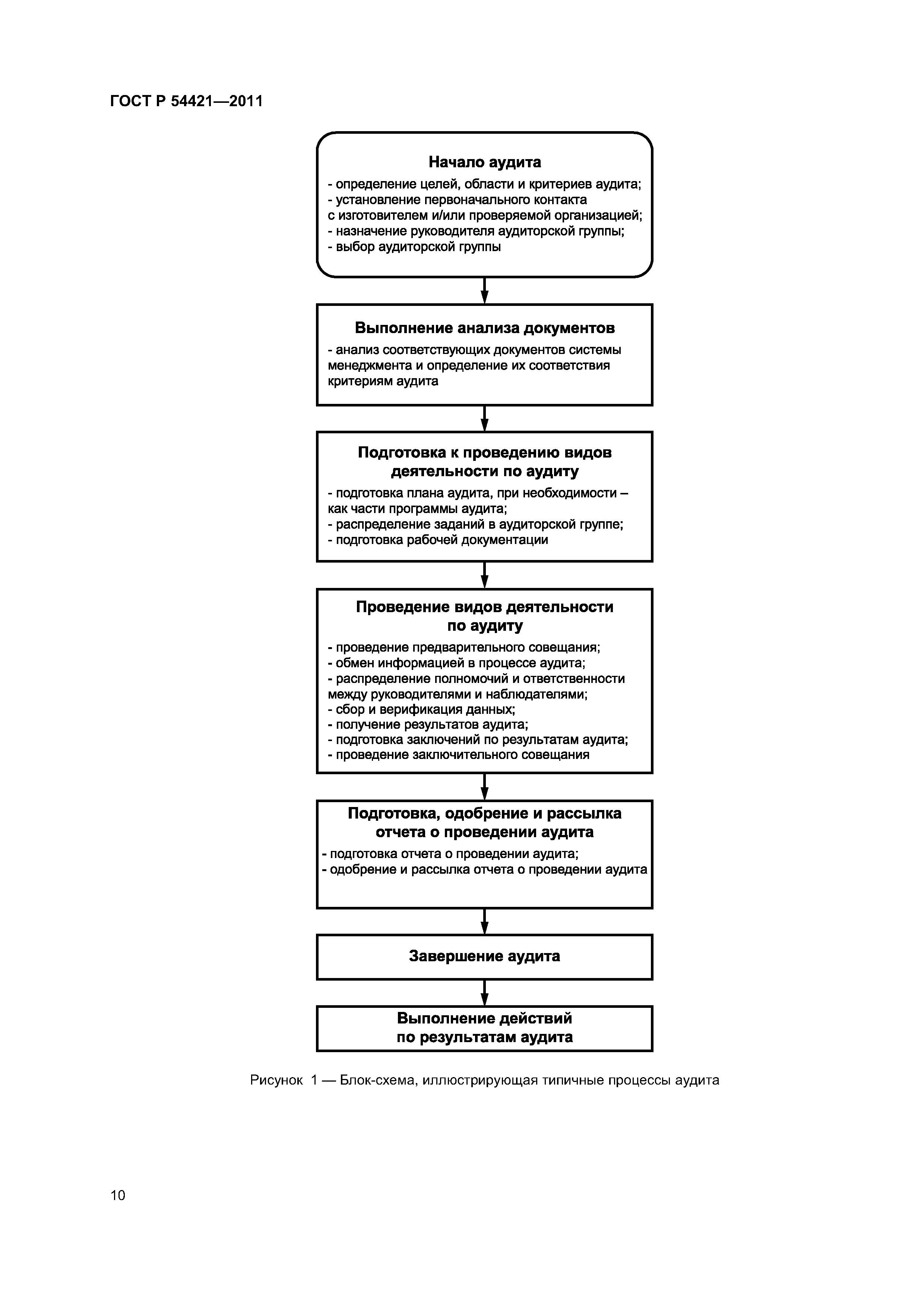
| Оглавление: | 1 Область применения 2 Нормативные ссылки 3 Термины и определения 4 Общие требования к организациям, проводящим аудиты 4.1 Юридическая ответственность 4.2 Независимость и беспристрастность 4.3 Конфиденциальность, обусловленная профессиональными и этическими принципами 4.4 Материальные затраты и финансирование 5 Менеджмент 5.1 Требования к структуре 5.2 Система менеджмента качества 5.3 Последовательность 6 Ресурсы 6.1 Ресурсы 6.2 Компетентность аудиторской группы 6.3 Внешние организации 7 Процесс аудита 7.1 Цели и область аудита 7.2 Виды аудитов 7.3 Блок-схема 7.4 Роли, ответственность и распределение полномочий 7.5 Состав аудиторской группы 7.6 Виды деятельности по аудиту 7.7 Соответствие документации по аудиту 7.8 Последующие виды деятельности Приложение ДА (обязательное) Сравнение структуры настоящего стандарта со структурой документа GHTF/SG4/N28R4:2008 «Руководство по аудиту систем менеджмента качества изготовителей медицинских изделий на соответствие регулирующим требованиям. Часть 1. Общие требования» Приложение ДБ (обязательное) Текст измененных структурных элементов настоящего стандарта и документа GHTF/SG4/N28R4:2008 «Руководство по аудиту систем менеджмента качества изготовителей медицинских изделий на соответствие регулирующим требованиям. Часть 1. Общие требования» Приложение ДВ (справочное) Сведения о соответствии ссылочных национальных стандартов Российской Федерации международным стандартам, использованным в качестве ссылочных в примененном документе |
| Разработан: | ЗАО МЕДИ-ТЕСТ |
| Утверждён: | 28.09.2011 Федеральное агентство по техническому регулированию и метрологии (352-ст) |
| Издан: | Стандартинформ (2012 г. ) |
| Расположен в: | |
| Нормативные ссылки: |
|




























 ГОСТ Р ИСО 19011-2003 «Руководящие указания по аудиту систем менеджмента качества и/или систем экологического менеджмента»
ГОСТ Р ИСО 19011-2003 «Руководящие указания по аудиту систем менеджмента качества и/или систем экологического менеджмента»