
 ГОСТ Р 54882-2011
ГОСТ Р 54882-2011
Руководство по аудиту систем менеджмента качества изготовителей медицинских изделий на соответствие регулирующим требованиям. Часть 2. Стратегия аудита
| Обозначение: |  ГОСТ Р 54882-2011 ГОСТ Р 54882-2011 |
| Обозначение англ: |  GOST R 54882-2011 GOST R 54882-2011 |
| Статус: | введен впервые |
| Название рус.: | Руководство по аудиту систем менеджмента качества изготовителей медицинских изделий на соответствие регулирующим требованиям. Часть 2. Стратегия аудита |
| Название англ.: | Guidelines for regulatory auditing of quality management systems of medical device manufacturers. Part 2. Regulatory auditing strategy |
| Дата добавления в базу: | 01.09.2013 |
| Дата актуализации: | 01.01.2021 |
| Дата введения: | 01.01.2013 |
| Область применения: | Стандарт предназначен для регулирующих органов и организаций, проводящих аудиты систем менеджмента качества изготовителей медицинских изделий на основе процессного подхода к требованиям к системам менеджмента качества (см. ГОСТ Р ИСО 13485). Если деятельность организаций, проводящих аудиты, регламентируется регулирующими требованиями или требованиями к аккредитации, то стратегию аудита, представленную в стандарте, рекомендуется рассматривать как дополнение к регулирующим требованиям или требованиям к аккредитации, если целесообразно. Несмотря на то что аудит изготовителя медицинских изделий может включать в себя аудит на соответствие регулирующим требованиям, не связанным непосредственно с менеджментом качества, область применения стандарта ограничена требованиями к системам менеджмента качества. При наличии дополнительных регулирующих требований, являющихся частью области аудита, аудитор должен рассмотреть, идентифицировать и документировать данные требования, интегрировав их в цели и критерии аудита. Стандарт применим к первоначальным и подтверждающим аудитам, но может также применяться к другим видам аудитов, описанным в ГОСТ Р 54421, включая все дополнения, разработанные GHTF SG4 в качестве руководства для организаций, проводящих аудиты. Цели других аудитов определяются элементами подсистем менеджмента качества, выбранными для проведения аудита. |
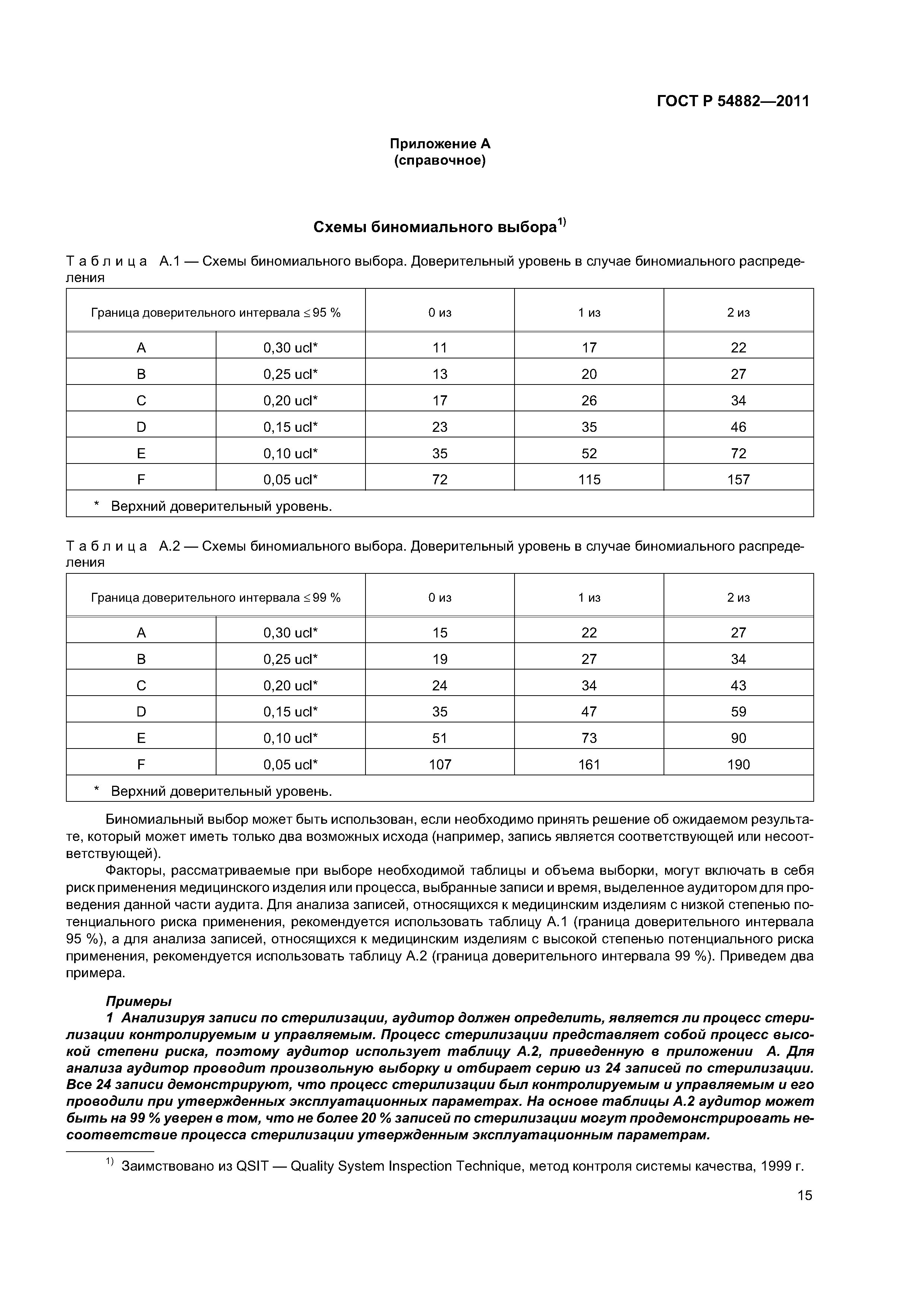
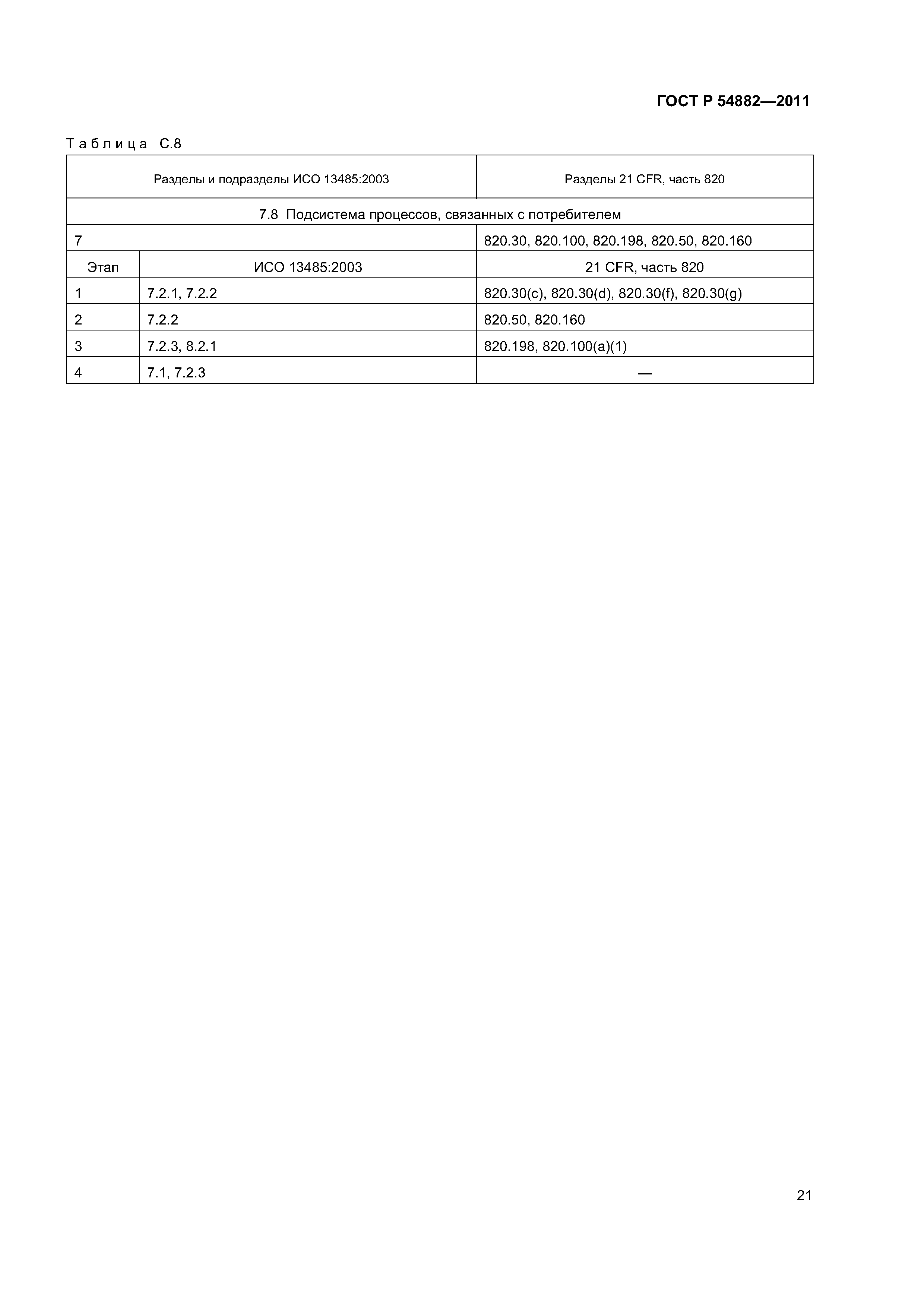
| Оглавление: | 1 Область применения 2 Нормативные ссылки 3 Термины и определения 4 Общие замечания по стратегии аудита на соответствие регулирующим требованиям 4.1 Цели 4.2 Проверяемая система менеджмента качества 4.3 Подходы к аудиту 4.4 Процессный подход к аудиту 4.5 Выборка 4.6 Планирование аудита 4.7 Руководство по материально-техническому обеспечению аудита 4.8 Связи 5 Проверяемые подсистемы 5.1 Подсистема высшего руководства 5.2 Подсистема проектирования и разработки 5.3 Подсистема документации на продукцию 5.4 Подсистема управления продукцией и процессами 5.5 Подсистема корректирующих и предупреждающих действий 5.6 Подсистема управления закупками 5.7 Подсистема документации и записей 5.8 Подсистема процессов, связанных с потребителем Приложение А (справочное) Схемы биномиального выбора Приложение В (справочное) Факторы, применяемые для определения продолжительности аудита Приложение С (справочное) Соответствие структурных элементов ИСО 13485:2003 и 21 CFR, часть 820 Приложение D (справочное) Процессы стерилизации Приложение Е (справочное) Аудит программного обеспечения Приложение ДА (обязательное) Сравнение структуры настоящего стандарта со структурой документа ОНТЕ/8О4/М30I20:2006 «Руководство по аудиту систем менеджмента качества изготовителей медицинских изделий на соответствие регулирующим требованиям. Часть 2. Стратегия аудита» Приложение ДБ (обязательное) Текст измененных структурных элементов настоящего стандарта и документа ОНТЕ/8О4/М30I20:2006 «Руководство по аудиту систем менеджмента качества изготовителей медицинских изделий на соответствие регулирующим требованиям. Часть 2. Стратегия аудита» Приложение DВ (справочное) Сведения о соответствии ссылочных национальных стандартов Российской Федерации международным стандартам, использованным в качестве ссылочных в примененном документе Библиография |
| Разработан: | ЗАО МЕДИ-ТЕСТ |
| Утверждён: | 13.12.2011 Федеральное агентство по техническому регулированию и метрологии (1189-ст) |
| Издан: | Стандартинформ (2012 г. ) |
| Расположен в: | |
| Нормативные ссылки: |
|































 ГОСТ Р ИСО 19011-2003 «Руководящие указания по аудиту систем менеджмента качества и/или систем экологического менеджмента»
ГОСТ Р ИСО 19011-2003 «Руководящие указания по аудиту систем менеджмента качества и/или систем экологического менеджмента»