
 ГОСТ ISO 10993-3-2018
ГОСТ ISO 10993-3-2018
Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 3. Исследования генотоксичности, канцерогенности и токсического действия на репродуктивную функцию
| Обозначение: |  ГОСТ ISO 10993-3-2018 ГОСТ ISO 10993-3-2018 |
| Обозначение англ: |  10993-3-2018 10993-3-2018 |
| Статус: | взамен |
| Название рус.: | Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 3. Исследования генотоксичности, канцерогенности и токсического действия на репродуктивную функцию |
| Название англ.: | Medical devices. Biological evaluation of medical devices. Part 3. Tests for genotoxicity, carcinogenicity and reproductive toxicity |
| Дата добавления в базу: | 01.01.2019 |
| Дата актуализации: | 01.01.2021 |
| Дата введения: | 01.06.2019 |
| Область применения: | Стандарт предназначен для формирования стратегии с целью оценки риска, выбора тестов для определения опасностей и менеджмента риска с точки зрения возможности следующих потенциально необратимых биологических изменений, возникающих в результате воздействия медицинских изделий: - генотоксичности; - канцерогенности; - токсического действия на репродуктивную функцию и развитие. Стандарт применяется для оценки потенциального генотоксического, канцерогенного эффектов или токсического действия на репродуктивную функцию при использовании медицинского изделия. |
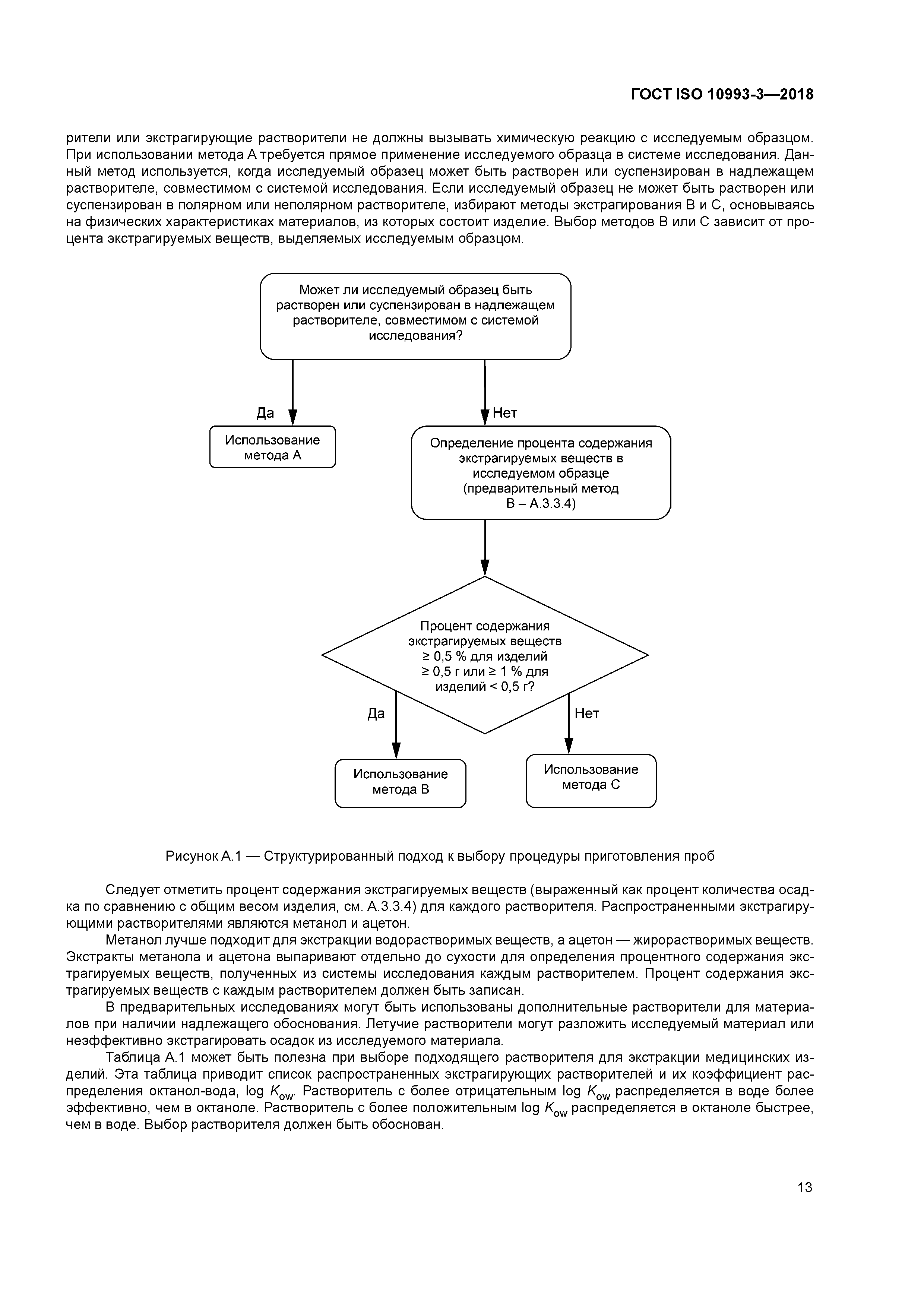
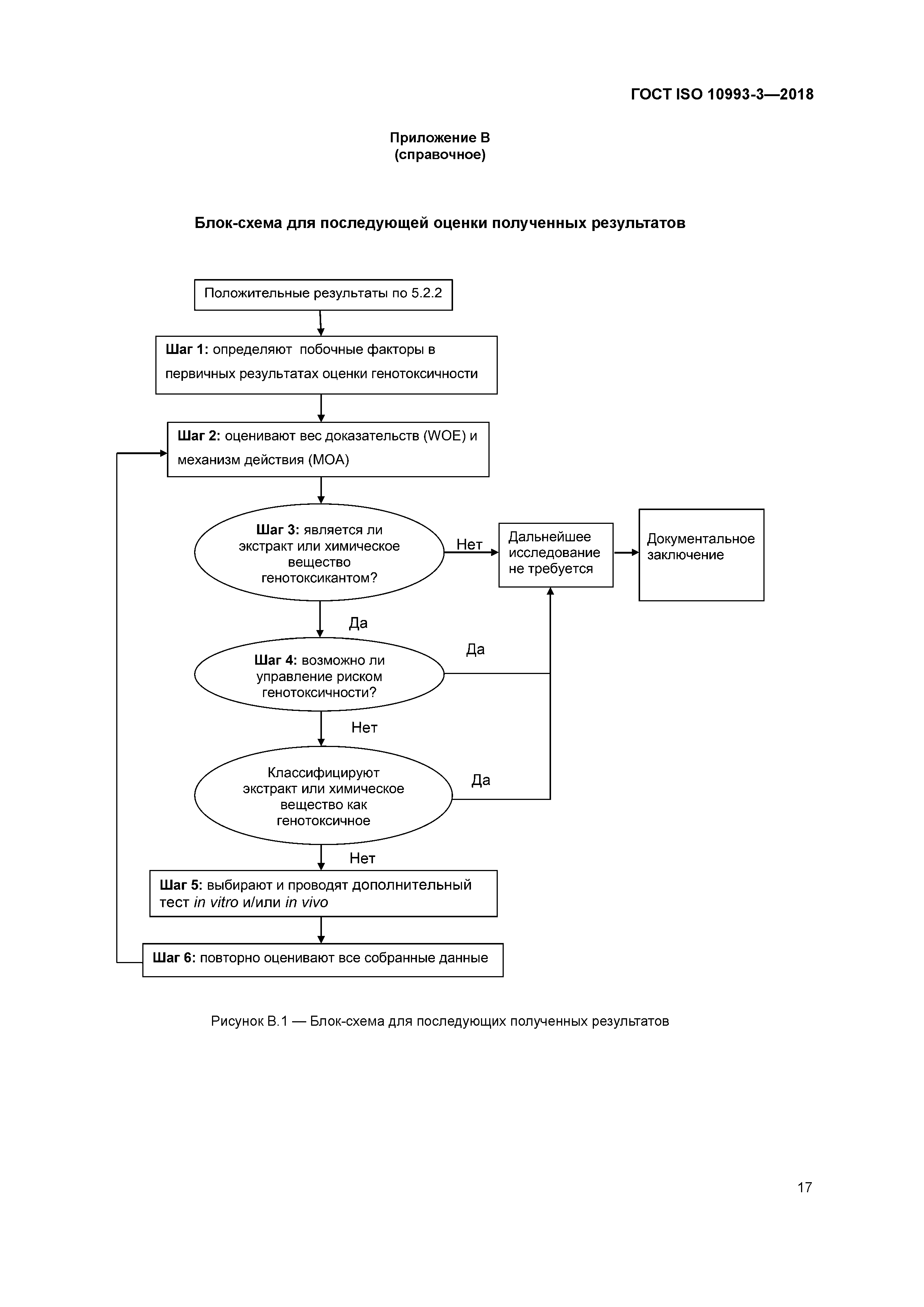
| Оглавление: | 1 Область применения 2 Нормативные ссылки 3 Термины и определения 4 Основные требования 4.1 Общие положения 4.2 Дополнительные требования к тестам для оценки канцерогенности 4.3 Дополнительные требования к тестам для оценки токсического воздействия на репродуктивную функцию 5 Тесты на генотоксичность 5.1 Общие положения 5.2 Стратегия исследования 5.3 Подготовка образцов 6 Тесты на канцерогенность 6.1 Общие положения 6.2 Стратегия исследования 6.3 Подготовка образцов 6.4 Методы исследования 7 Тесты для оценки токсического воздействия на репродуктивную функцию и развитие потомства 7.1 Общие положения 7.2 Стратегия исследования 7.3 Подготовка образцов 7.4 Методы исследования 8 Отчет об исследовании Приложение A (справочное) Руководство по выбору приемлемой процедуры подготовки образцов при исследовании генотоксичности Приложение B (справочное) Блок-схема для последующей оценки полученных результатов Приложение C (справочное) Обоснование тест-системы Приложение D (справочное) Тест-системы для оценки клеточной трансформации Приложение E (обязательное) Исследование канцерогенности с использованием имплантационного теста Приложение F (справочное) Тесты in vitro для оценки эмбриотоксичности Приложение ZA (справочное) Взаимосвязь между настоящим стандартом и основными требованиями Директивы ЕС 93/42 ЕЕС по медицинским изделиям Приложение ZB (справочное) Взаимосвязь между настоящим стандартом и основными требованиями Директивы ЕС 90/385/ЕЕС по активным имплантируемым медицинским изделиям Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов и документов межгосударственным стандартам Библиография |
| Разработан: | АНО ИМБИИТ |
| Утверждён: | 30.08.2018 Межгосударственный Совет по стандартизации, метрологии и сертификации (Inter-Governmental Council on Standardization, Metrology, and Certification 111-П) 03.10.2018 Федеральное агентство по техническому регулированию и метрологии (698-ст) |
| Издан: | Стандартинформ (2018 г. ) |
| Расположен в: | |
| Заменяет собой: | |
| Нормативные ссылки: |
|





































 ГОСТ ISO 10993-3-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 3. Исследования генотоксичности, канцерогенности и токсического действия на репродуктивную функцию»
ГОСТ ISO 10993-3-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 3. Исследования генотоксичности, канцерогенности и токсического действия на репродуктивную функцию»